Összefoglaló közlemények / Reviews
Diagnosis and treatment of primary biliary cholangitis (PBC) – Counsel of current clinical practice guidelines (CPG) of European Association for Study of Liver (EASL)
Summary
Primary biliary cholangitis (PBC) is a chronic cholestatic autoimmune liver disease of unknown origin, which can result in end-stage biliary cirrhosis without proper treatment. Diagnosis is based on elevated cholestatic liver enzymes and the presence of anti-mitochondrial antibody (AMA) and/ or PBC specific anti-nuclear antibody (ANA). Liver biopsy is not necessary to establish the diagnosis with a few exceptions. AMA positivity in itself, without elevated cholestatic liver enzymes, is not enough to establish the diagnosis of PBC. PBC can affect patients’ quality of life with the progression of the liver disease (development liver cirrhosis), and also with the associated symptoms (cholestatic pruritus, sicca complex, fatigue). The clinical presentation and the disease course can vary thus the treatment and disease management should be tailored to the individual needs and should be lifelong. The primary goal of care is to prevent the progression to end-stage liver disease and to alleviate the associated symptoms. Recommended first-line treatment is ursodeoxycholic acid (UDCA). Oral obeticholic acid (OCA) was conditionally approved for the treatment of PBC. It can be prescribed in combination with UDCA for cases where treatment response for the first-line therapy was insufficient, or in monotherapy in case of UDCA-intolerance. In Hungary, OCA is not reimbursed for patients. Preparation for liver transplantation should be initiated when complications of the liver cirrhosis occur, or the markers of disease severity, like constantly elevated bilirubin level or MELD score >15, suggest advanced disease stage or when pruritus is severe or refracotry to treatment. Higher risk for osteoporosis should be kept in mind when treating PBC patients, screening and treatment are essential parts of the care. This review covers the structured, lifelong and individual approach of clinical management for PBC patients, based on the latest EASL guideline, to provide help for the attending hepatologists with the establishment of diagnosis, delivery of effective treatment and patient care.
A primer biliaris cholangitis (PBC) egy krónikus gyulladással járó ismeretlen eredetű autoimmun cholestaticus májbetegség, amely kezeletlen esetben végstádiumú biliaris cirrózis kialakulásához vezet. A diagnózis a cholestaticus májenzimek emelkedett szintjén és ezzel egyidejűleg a szérumban kimutatható anti-mitokondriális (AMA) és/ vagy PBC specifikus antinukleáris antitestek (ANA) jelenlétén alapszik. A májbiopszia elvégzése a diagnózis felállításához ritka esetektől eltekintve nem szükséges. Az AMA-pozitivitás önmagában normál májenzimértékek esetén nem elégséges a PBC diagnózisának felállításához. A PBC a betegekre mind a májbetegség progressziója (májcirrózis kialakulása), mind pedig tünetei révén (cholestaticus viszketés, sicca komplex, fáradtság) hatással van. A betegség klinikai megjelenése és lefolyása különböző lehet, ezért a betegek személyre szabott kezelésének és gondozásának biztosítása fontos élethosszig tartóan. A kezelés és a gondozás célja a végstádiumú májbetegség kialakulásának megelőzése és az ezzel összefüggő tünetek enyhítése. Az elsővonalbeli kezelésre az urzodeoxikólsav (UDCA) javasolt. Az orális obetikólsav- (OCA) kezelést feltételesen jóváhagyták PBC-betegek kezelésére, UDCA-val kombinációban azon esetekre, akik nem megfelelően reagálnak az UDCA-ra, vagy monoterápiaként azon betegekben, akiknél UDCA-intolerancia észlelhető. Magyarországon társadalombiztosítási keretek között nem elérhető. A betegek májtranszplantációs előkészítése szükséges, ha a májcirrózis szövődményei alakulnak ki, vagy ha a betegség progrediál, mint pl. folyamatosan emelkedett bilirubinérték vagy MELD-pontszám >15, vagy súlyos, kezelésre nem reagáló viszketés jelentkezik. Minden PBC-s betegnél figyelembe kell venni, hogy fokozott osteoporosis-kockázat állhat fenn, ezért ennek szűrése és kezelése szükséges. Jelen összefoglaló az EASL klinikai gyakorlati útmutatója nyomán ismerteti a PBC-s betegek ellátásának strukturált, élethosszig tartó és egyéni megközelítését, amely keretet nyújt az ellátó hepatológusnak a diagnózis felállításához, a hatékony kezeléséhez és gondozásához.
Bevezetés
A primer biliaris cholangitis (PBC; korábbi nevén primer biliaris cirrózis) (1) egy ritka, de fontos autoimmun cholestaticus májbetegség, amely világszerte előfordul, és túlnyomórészt nőket érint (2–5). Számos ismertetőjegye van, beleértve a cholestasist (epepangást), a specifikus antitestképződést: antimitokondriális antitestek (AMA) vagy specifikus antinukleáris antitestek (ANA), és a típusos májszövettani képet (krónikus, nem gennyes, granulomatosus, limfocitás, kis epeutakat érintő cholangitis). A betegség krónikus lefolyású és progresszív, idővel végstádiumú májbetegséget és ehhez társuló problémákat eredményezhet (6–8). Gyermekkorban nem fordul elő (9, 10).
A betegség kialakulásához vezető tényezők kevéssé ismertek. A környezeti hatások, az immungenetikai és epigenetikai kockázati tényezőkkel együttesen, valószínűleg jelentős szerepet játszanak a PBC kialakulásában. Ezek krónikus immunmediált epeúti hámsérüléshez és később epepangáshoz, az epeutak mennyiségének csökkenéséhez, és a progresszív biliaris fibrosis kialakulásához vezetnek (11–13). Világszerte kb. 1000 negyven év feletti nőből 1 szenved PBC-ben (14). Az európai populációban a hozzávetőleges incidencia 1-2/100 000 lakos/ év. Általánosságban az említett incidencia 0,3-5,8/100 000, a prevalencia pedig 1,9-40,2/100 000 (15–17). A női dominancia pontos oka továbbra sem ismert (18). Epidemiológiai vizsgálatokkal a PBC kockázati tényezőiként azonosították a nyálkahártya-fertőzéseket (különösképpen a visszatérő húgyúti fertőzéseket) és a dohányzást.
A PBC a betegekre mind a májbetegség progressziója (májcirrózis és végstádiumú májelégtelenség kialakulása, amely májátültetést tesz szükségessé), mind pedig a tünetei révén hatással van, és csökkenti a várható élettartamot. A PBC-vel kapcsolatos tünetek, mint a cholestaticus viszketés, a sicca komplex, a hasi diszkomfort és a fáradtság (19, 20) befolyásolják az életminőséget (QoL, quality of life). Nyugtalanláb-szindrómáról, álmatlanságról, depresszióról és kognitív diszfunkcióról is beszámoltak. Az élethosszig tartó kezelés célja a progresszív májbetegség feltartóztatása, és a kórképpel összefüggő, a beteg életminőségét rontó tünetek enyhítése. A betegség klinikai megjelenése és lefolyása különböző lehet, éppen ezért fontos a progresszió szempontjából a magas és alacsony kockázatú betegségforma megkülönböztetése, amely az urzodeoxikólsavra (UDCA) (elsővonalbeli kezelési lehetőség) adott terápiás válasz értékelésével lehetséges (21).
A jelenlegi nemzetközi regisztertanulmányok szerint az UDCA-val kezelt betegek tíz éves túlélése megközelíti a 80%-ot, ugyanakkor a kezeletlen PBC-ben szenvedő betegek átlagos élettartama ~9-10 év a betegség diagnózisától számítva (22). A tünetmentes betegekben jobb, akár 16 év is lehet a medián túlélés (23), amely mutatja a betegséggel kapcsolatos kockázat heterogenitását.
A PBC-s betegek ellátása során fontos az életre szóló és egyénre szabott megközelítés.
A PBC diagnózisának felállítása
Az epepangás (cholestasis) diagnosztikus megközelítése
1. táblázat: Az intra- és extrahepatikus cholestasis differenciáldiagnózisa felnőttekben
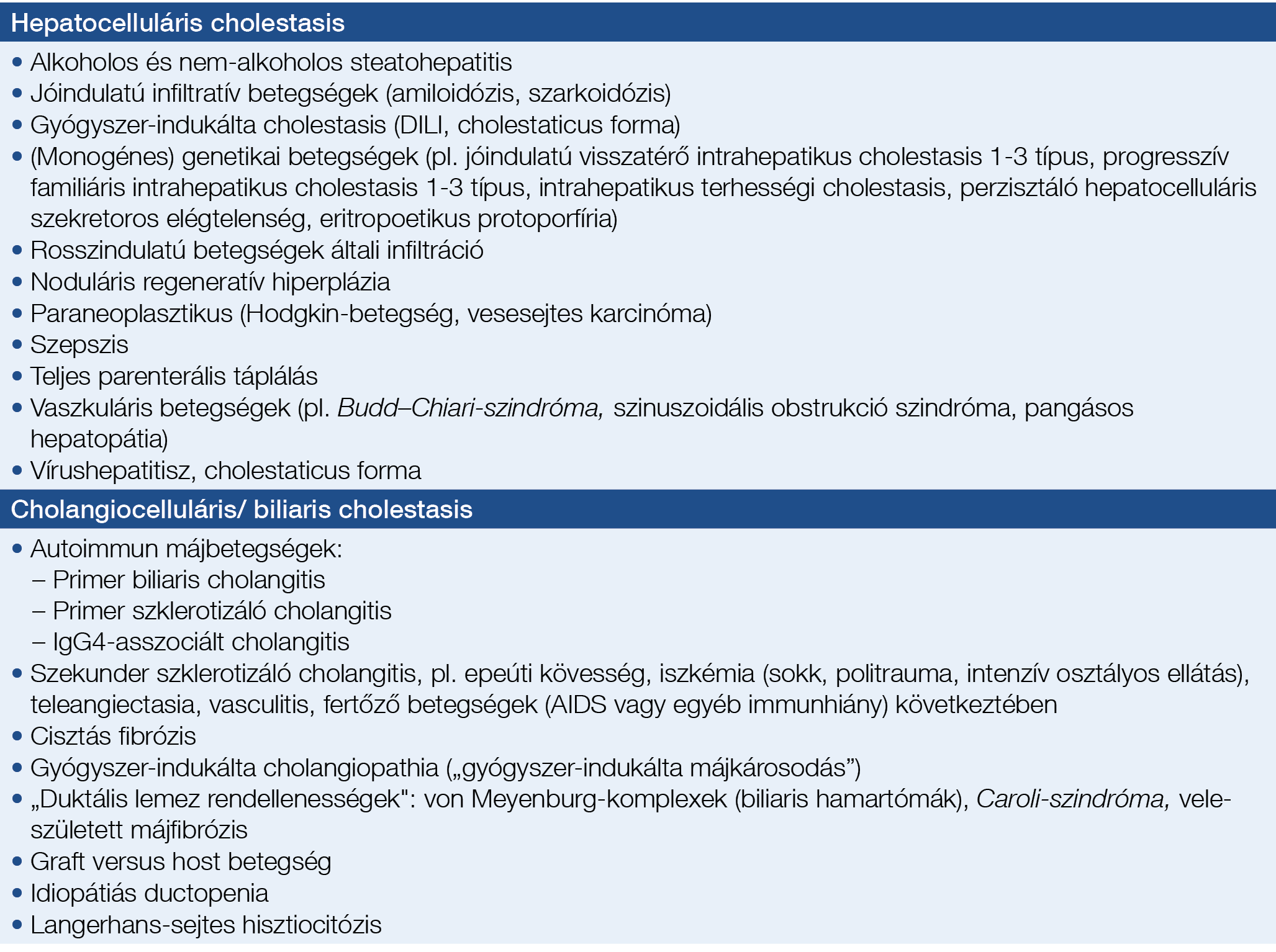
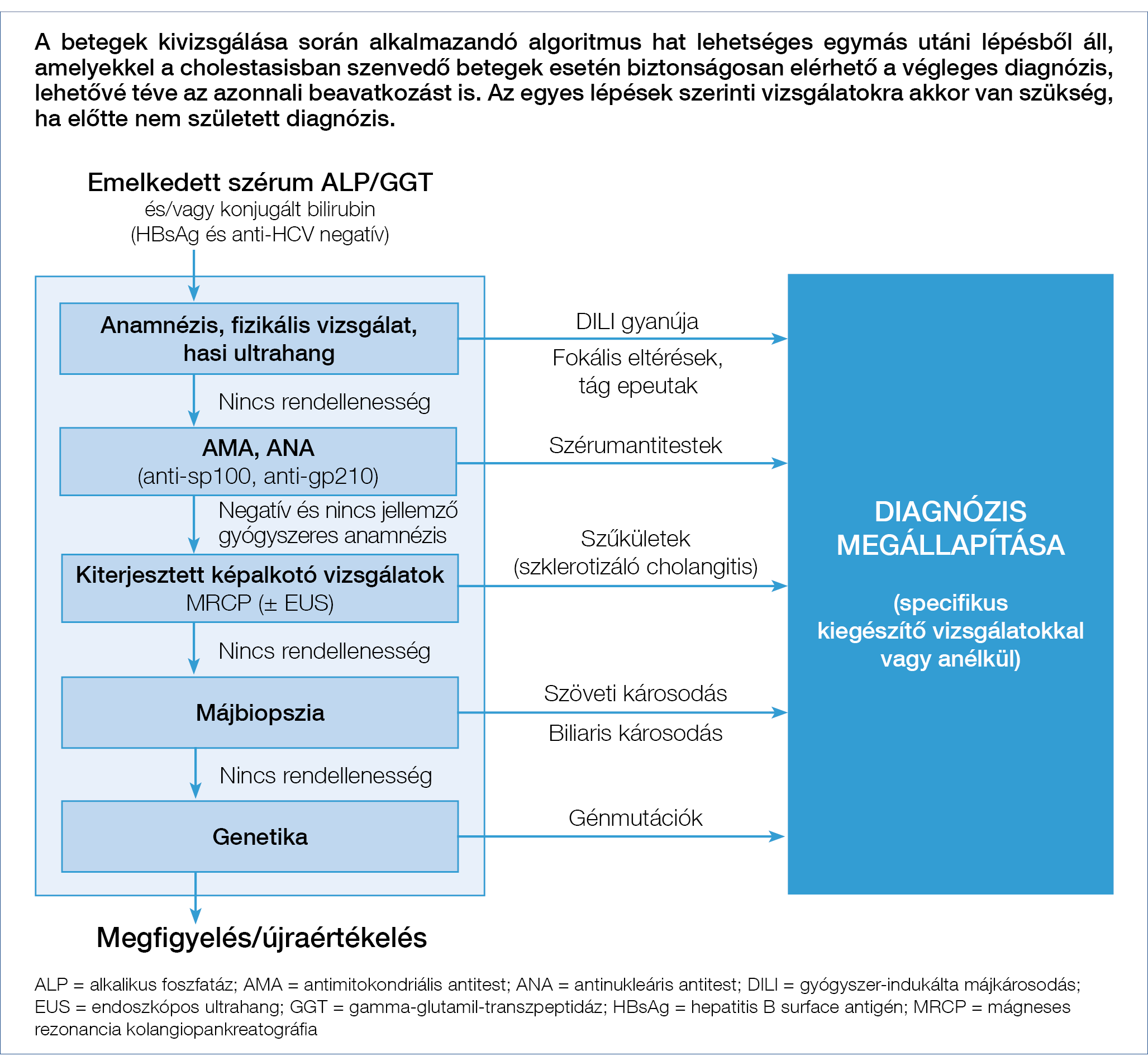
A PBC gyanúját elsőként a laborértékekben észlelt krónikus cholestasis veti fel, ugyanis a betegség akár hónapokon vagy éveken keresztül is tartósan tünetmentes lehet. Az epepangás krónikusnak tekinthető, ha több mint 6 hónapja áll fenn (24). Korai biokémiai markerek közé tartozik az emelkedett szérum alkalikus foszfatáz (ALP) és gamma-glutamil-transzpeptidáz (GGT), amelyet előrehaladottabb stádiumban konjugált hyperbilirubinaemia követ. Ritkán korai jelként csak GGT-emelkedés észlelhető önmagában és az ALP-szint normális. Az ALP és/vagy a GGT-emelkedés mértékének alsó küszöbértékére vonatkozóan az EASL CPG nem fogalmaz meg javaslatot. Ugyanakkor már viszonylag szerény ≥1,5×ULN-emelkedés is utalhat PBC-re (CS-sel folyatott személyes megbeszélés nyomán). A krónikus cholestasist a PBC-n kívül számos egyéb, az epeutakat érintő intrahepatikus vagy extrahepatikus kórkép is okozhatja, illetve a károsodott epeképződés hepatocellularis és cholangiocellularis formái is (1. táblázat). A kivizsgálás során tehát minden esetben egy komplex, klinikai, biokémiai és képalkotó diagnosztikai vizsgálóeljárásokból álló algoritmust célszerű követni (1. ábra). A biokémiai markerekkel kapcsolatosan fontos tudni, hogy a szérum ALP több helyről származhat (mint pl.: máj, béltraktus, csont, vagy placenta). Ebből adódóan, ALP-emelkedést nemcsak a cholestaticus májbetegségek okozhatnak, hanem gyors csontnövekedés gyermekekben, extrahepatikus betegségek (mint pl.: csontbetegségek – Paget-kór, csontáttétek, osteoporosis), D-vitamin-hiány vagy terhesség is. A klinikai gyakorlatban az emelkedett szérum ALP máj eredetét támogatja az egyidejűleg emelkedett GGT (vagy 5’nukleotidáz) és/vagy konjugált bilirubinszint. Lehetséges a különböző eredetű ALP-izoformák differenciálása is elektroforézissel, amennyiben annak forrása nem nyilvánvaló. A gyermekgyógyászati gyakorlatban a szérum GGT-t az epepangás jobb markereknek tartják, mint az ALP-t.
A betegek cholestasis miatti kivizsgálása során alkalmazandó algoritmus hat lehetséges lépésből áll:
- Vírushepatitisek kizárása;
- Kórtörténet, fizikális vizsgálat, hasi ultrahang;
- Immunszerológiai vizsgálatok;
- Kiterjesztett képalkotó vizsgálatok;
- Májbiopszia és
- Genetikai vizsgálatok (1. ábra).
Gondos anamnézisfelvétel szükséges (személyes, szociális, utazási és családi) (24). Fontos a PBC-hez kapcsolódó társbetegségek felismerése, amelyek a következőek lehetnek: autoimmun Hashimoto-thyreoiditis, sicca szindróma (száraz szem, száraz száj), cöliákia, vagy szisztémás szklerózis. Gyulladásos bélbetegséghez a primer szklerotizáló cholangitis (PSC) társul gyakran. A kórtörténetben szereplő intenzív osztályos kezelés és/vagy súlyos politrauma másodlagos szklerotizáló cholangitishez vezethet; immunglobulin (Ig)G4 asszociált cholangitist festékekkel, gázolajjal és más olajtermékekkel vagy ipari gázokkal való hosszú távú érintkezést követően figyeltek meg. A gyógyszeres anamnézisnek nemcsak a jelenleg szedett vagy korábban felírt gyógyszereket kell tartalmaznia, hanem a gyógynövénytartalmú készítményeket, illetve más gyógyászati termékeket és bármely típusú szerhasználatot is (mint pl. anabolikus szteroid, hashajtók), valamint az alkoholfogyasztást és a dohányzást is. Gyógyszer-indukálta májkárosodás (DILI) esetén a betegek kb. 30%-ánál figyelhető meg cholestaticus májenzim-emelkedés (24). Az antibiotikumok, mint az amoxicillin/klavulánsav és a trimethoprim/szulfamethoxazol, az anabolikus szteroidok vagy az azathioprin potenciális károsító tényezők lehetnek (25). Ha ezen gyógyszereket a cholestasis észlelése előtt 5-90 napos periódusban kezdte el szedni a beteg, akkor ezeket el kell hagyni (ha eddig még nem hagyta el), és követni kell a cholestasis mértékének változását. DILI kockázatának becslésében a Roussel Uclaf oksági elemző pontrendszer, illetve a National Institute of Health weboldal (http://livertox.nih.gov) segíthet. Korábbi műtéteket, transzfúziókat szintén tisztázni szükséges. A fizikális vizsgálatnak ki kell terjednie a máj- és lépmegnagyobbodás, valamint az előrehaladott májbetegség extrahepatikus jeleinek azonosítására. A hasi ultrahang az első ajánlott képalkotó vizsgálat minden betegnél a mechanikai epeúti elzáródás, a szövetszaporulat (a májban, vagy azon kívül) és az epehólyag/nagy epeúti eltérések kizárására. Normál hasi ultrahanglelet esetén az intrahepatikus cholestasis diagnózisa a legvalószínűbb.
Akiknél krónikus intrahepatikus cholestasis áll fenn, következő diagnosztikus lépésként szerológiai vizsgálatot szükséges végezni: szérum AMA- és PBC-specifikus ANA [immunfluoreszcens és/vagy specifikus anti-sp100/anti-gp210 antitestek vizsgálata Western-blott vagy enzimhez kötött immunoszorbens assay (ELISA) technikával] (26, 27). Az AMA korlátozott specificitású lehet akut májkárosodás esetén (28), azonban PBC-re jóval szenzitívebb és specifikusabb tisztázatlan eredetű krónikus cholestasis esetén. AMA-pozitivitás cholestasis jelenléte nélkül, egészséges egyénekben is előfordulhat (legfeljebb 1/1000) (29, 30).
1. ábra: A krónikus cholestasis klinikai, biokémiai és képalkotó diagnosztikus vizsgálatainak algoritmusa
Cholestasis esetén a kiterjesztett képalkotó vizsgálatok, mint a mágnesesrezonancia kolangiopankreatográfia (MRCP) biztonságos és pontos képalkotó vizsgálati eljárás az intra- és extrahepatikus epeutak vizsgálatára, amennyiben azt tapasztalt szakember végzi (24). A primer vagy szekunder biliaris cholangitis diagnózisához alapvető az intra- és/vagy extrahepatikus szűkületek és tágulatok észlelése. Különösen a disztális epeutak esetében az endoszkópos ultrahang (EUS) az MRCP-vel klinikailag egyenértékű az epeúti kövek és az extrahepatikus elzáródást okozó eltérések észlelésében.
Májbiopsziát indokolt végezni, ha a fent összefoglalt diagnosztikus lépésekkel nem igazolható a krónikus intrahepatikus cholestasis oka, de nem jelentős aktivitású, nem előrehaladott stádiumú, nem progresszív esetekben mérlegelhető a követés, és a fenti vizsgálatok időszakos ismétlése is (a szerzők véleménye). Májbiopszia esetén a megfelelő minőségű biopsziának legalább 11 portális mezőt kell tartalmaznia. A biopsziás eredmények a következőképpen osztályozhatók:
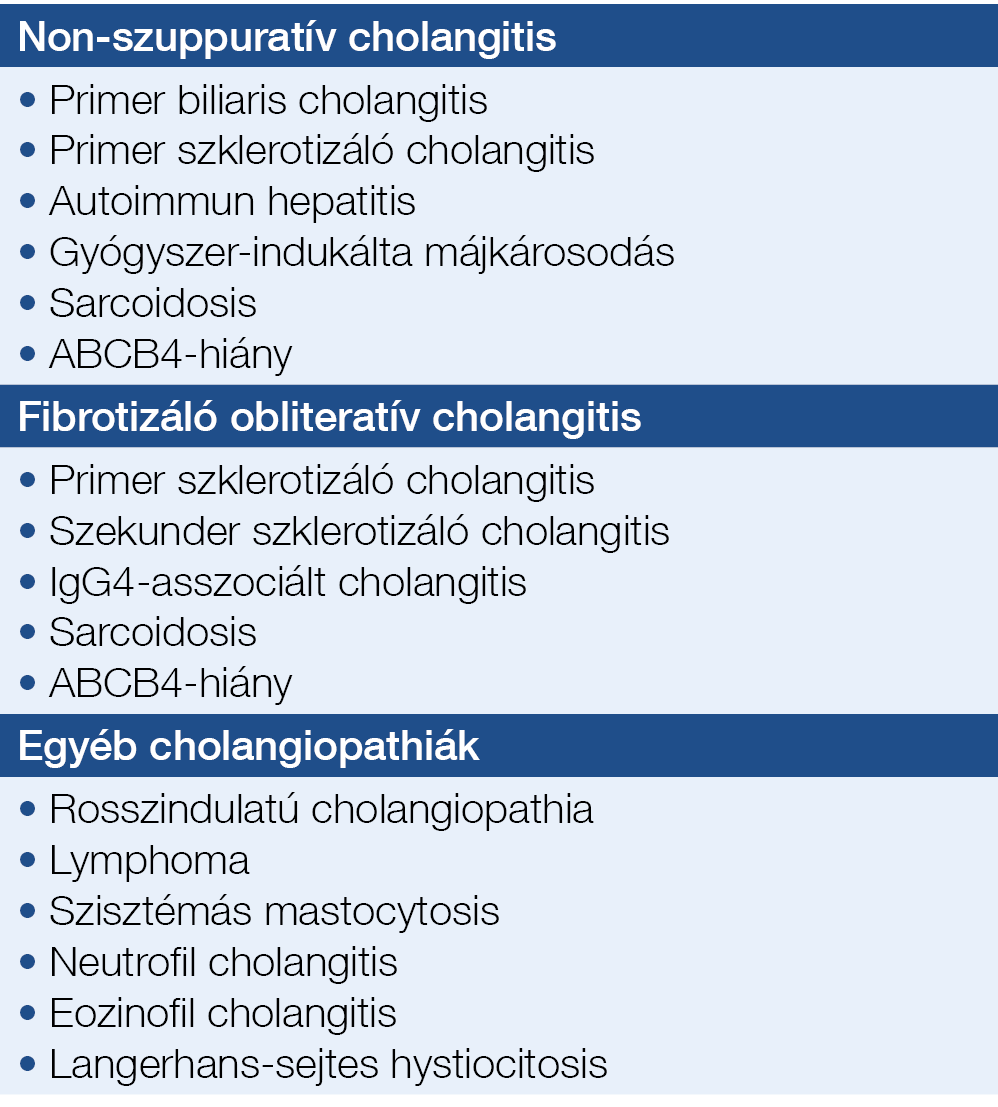
- Rendellenességek, amelyek érintik az epeutakat, mint a krónikus nem-gyulladásos cholangitis vagy fibrotizáló cholangitis, illetve a kevéssé gyakori cholangiopathiák (2. táblázat).
- Rendellenességek, amelyek nem érintik az epeutakat, mint például a különböző tárolási betegségek, az infiltráló vagy gyulladásos májbetegségek, a noduláris regeneratív hiperplázia, a pelyosis hepatis, a sinusoidok kitágulása és a különböző etiológiájú májcirrózisok.
- Hepatocellularis cholestasis minimális szövettani eltérésekkel vagy azok nélkül, ahogyan az a jóindulatú, visszatérő intrahepatikus cholestasisnál (BRIC), az ösztrogén vagy anabolikus szteroidkezelésnél, szepszisben, teljes parenterális táplálás vagy paraneoplasia esetén megfigyelhető.
Legvégül pedig, genetikai vizsgálat végezhető erre specializálódott laboratóriumban, amely akkor jön szóba, ha minden egyéb diagnózis kizárásra került, és a családi anamnézis, a klinikai tünetek, a biokémiai és képalkotó vizsgálatok eredményei azt sugallják, hogy monogénes cholestaticus kórkép áll a háttérben. Számos, epepangással járó genetikai szindróma került leírásra (http://www.ncbi.nlm.nih.gov/omim/?term=cholestasis).
2. táblázat: Az epeútkárosodás differenciál-diagnózisa a májbiopszia szövettani vizsgálata után
A PBC kezdeti diagnosztikája
Klinikai és biokémiai eltérések
Perzisztáló cholestasisra utaló laboreltérések vagy tünetek, mint pl. viszketés vagy gyengeség esetén fel kell vetődnie a PBC esetleges fennállásának. A PBC-s betegekre jellemző a kóros szérum ALP-érték, amely az epeutak számának csökkenésével és a betegség progressziójával hozható összefüggésbe. A PBC másik biokémiai jellemzője az immunglobulin-koncentrációk, különösen az IgM emelkedése (31). PBC-s betegeknél a szérum transzaminázok szintén emelkedettek lehetnek aszpartát-aminotranszferáz (AST/ GOT) és alanin-aminotranszferáz (ALT/ GPT), amelyek a májparenchyma gyulladásának és nekrózisának mértékét tükrözik, különösen, amikor IgG-emelkedéssel társul (32–34). Amennyiben az AST/ALT (GOT/GPT) arány >1, az zajló májfibrózis jele lehet, illetve a GGT-emelkedés már az ALP-emelkedés előtt észlelhető. A PBC progressziója során hyperbilirubinaemia alakul ki, a bilirubinszint jelentős emelkedése az előrehaladott betegség jellemzője. Az ezzel egyidejűleg csökkenő trombocitaszám, albuminkoncentráció és kolinészteráz- (KÉ) szint (ez utóbbi Mo-n rutinvizsgálat), illetve a nemzetközi normalizált ráta (INR) emelkedése a klinikailag szignifikáns májcirrózis kialakulását jelzi. Az epesavszintek meghatározása (bár nem rutinvizsgálat) szintén hasznos (a szerzők véleménye). A cholestasis a vérzsírok szintjét is befolyásolja, a PBC-s betegek szérum koleszterin értéke emelkedett, valamint fokozott a xanthoma és xanthelasma kialakulása. Ennek ellenére PBC-s beteg esetén nem számoltak be jelentősen emelkedett kardiovaszkuláris rizikóról (35, 36, 37).
Immunológiai markerek
A PBC diagnózisában kulcsfontosságú az AMA-pozitivitás, amelynek célpontja a piruvát-dehidrogenáz komplex E2-alegysége (PDC-E2), amely a mitokondrium külső membránrétegében található. Számos AMA-szubtípus került azonosításra (M1-9), amelyek közül az M2, M4, M8 és M9 mutat kapcsolatot a PBC-vel. Manapság ezen epitópokat lefedő kombinált peptideket tudnak előállítani és a szolid fázis tesztekben alkalmazni (38). AMA-pozitivitás a PBC-s betegek több mint 90%-ában megfigyelhető (39) (>1:40 titer az immunfluoreszcens-vizsgálat során). Az AMA-pozitivitás a PBC-re utal kóros, másképpen nem magyarázható májenzim-eltérések esetén, ugyanakkor az AMA-reaktivitás csak akkor elégséges a PBC diagnózisához, ha az kóros cholestaticus májenzim-eltérésekkel társul (17).
Az ANA-pozitivitás a PBC-s betegek megközelítőleg kb. 30%-ában figyelhető meg. Az ANA-mintázatok közül néhány specifikus PBC-re (>95%), de a szenzitivitásuk alacsony. Az immunfluoreszcens festéssel kimutatható magpontozottság (sokpettyes mintázat [több nukleáris pont néven is ismert] anti-sp100 reaktivitásra utal) és a magmembrán-pontozottság (anti-gp210 reaktivitásra utal) a betegek azon 5-10%-ában (a vizsgálati módszertől függően) hasznos segítség a PBC diagnosztikájában, akik egyébként AMA-negatívak (24, 39–42).
Képalkotók
A PBC korai stádiumban nem okoz a májban olyan specifikus morfológiai elváltozást, amelyet képalkotó vizsgálatokkal észlelni lehetne. Viszont a PBC gyanús betegek esetén mindenképp szükséges a hasi ultrahang elvégzése a cholestasis extrahepatikus okainak, illetve a máj daganatainak kizárása céljából. Más, krónikus májbetegségekhez hasonlóan a máj képalkotó vizsgálata hasznos továbbá az előrehaladott betegség jeleinek azonosítására: fokális májléziók, portális hipertónia, lépmegnagyobbodás, ascites. A hilaris nyirokcsomók megnagyobbodása gyakori PBC-s betegekben.
Szövettani vizsgálat
A PBC krónikus, nem szuppuráló gyulladásként jellemezhető, amely körülveszi és károsítja az interlobuláris és szeptális epeutakat, amelyet „florid duktális léziók”-nak neveznek. Ez gyakran már a betegség korai stádiumában azonosítható. A gyulladásos infiltrátum döntően T-limfocitákból áll, kevés B-limfocitával, makrofággal és eozinofil sejttel; epiteloid granuloma szintén megfigyelhető lehet. Az epeutak progresszív károsodása ductopeniához, gyulladáshoz és kollagénlerakódáshoz vezet, ez alapján a PBC négy stádiumát különböztetik meg (1–4) (Ludwig és Scheuer írta le). A 4-es stádium májcirrózis fennállását jelenti (43–45). A közelmúltban PBC esetén egy olyan új stádiumbeosztást javasoltak, amely a krónikus cholangitis és hepatitis aktivitásának felmérésén alapszik (46–48) és sokkal pontosabban jelzi előre a betegség 10 éves kimenetelét, különösen a májcirrózis és komplikációinak kialakulását (48).
Tekintettel a nagy specificitású szerológiai markerekre, májbiopszia elvégzése általában nem szükséges a diagnózis felállításához; azonban továbbra is alapvető vizsgálat PBC-specifikus antitestek hiánya esetén, valamint a differenciáldiagnosztikában, pl. amennyiben AIH vagy nem-alkoholos steatohepatitis (NASH) együttes fennállása gyanítható. A májbiopszia lehet indokolt továbbá egyéb társbetegségek (szisztémás/extrahepatikus) fennállása esetén is. Mindamellett a májbiopszia hasznos lehet olyan betegekben, akiknél az UDCA-kezelésre adott válasz nem megfelelő; a szövettani elváltozások jellemzése és mennyiségi meghatározása segíthet felderíteni a kezeléssel szembeni rezisztencia hátterében álló esetlegesen kezelhető okokat is (49, 50).
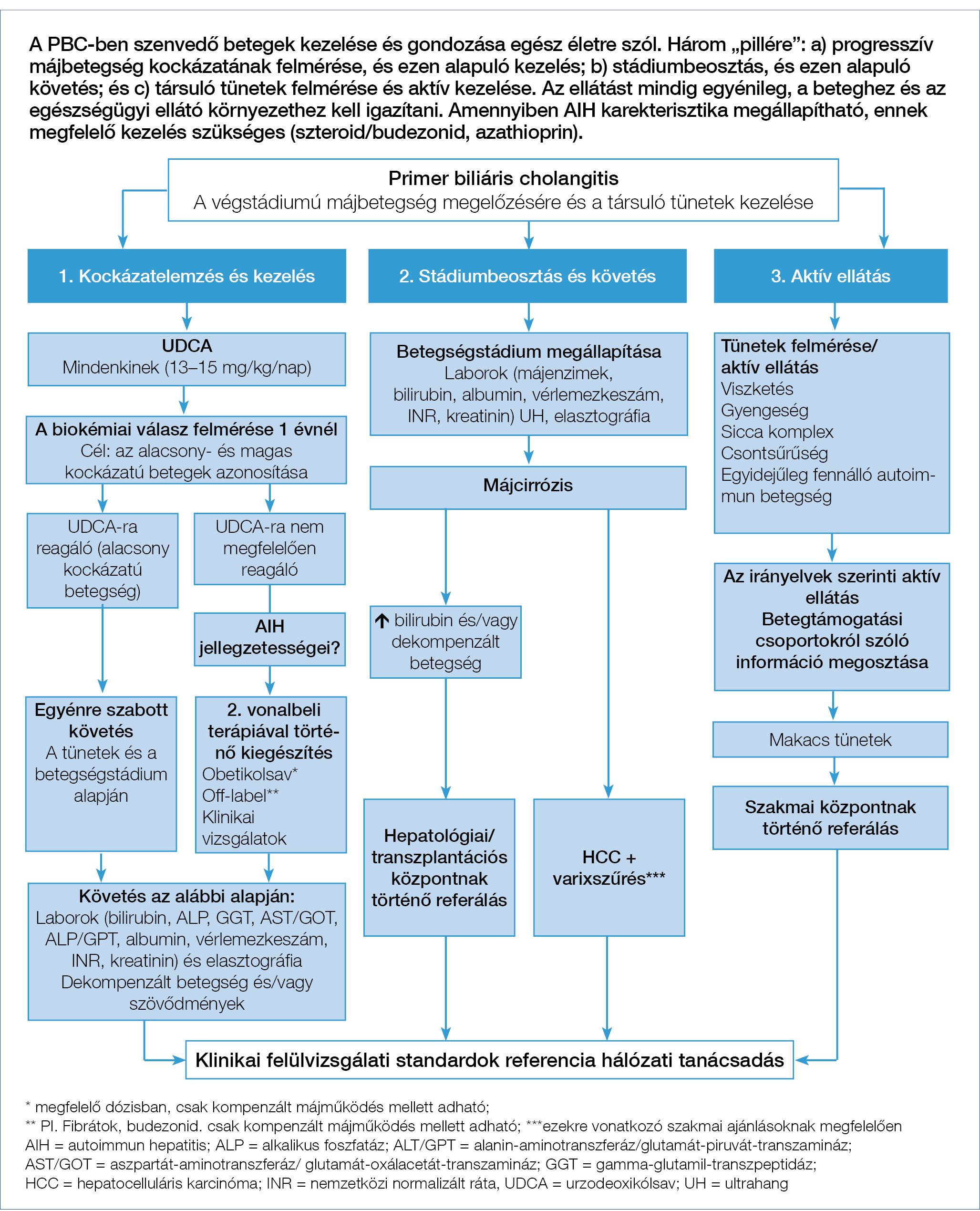
Kockázatbecslés PBC esetén
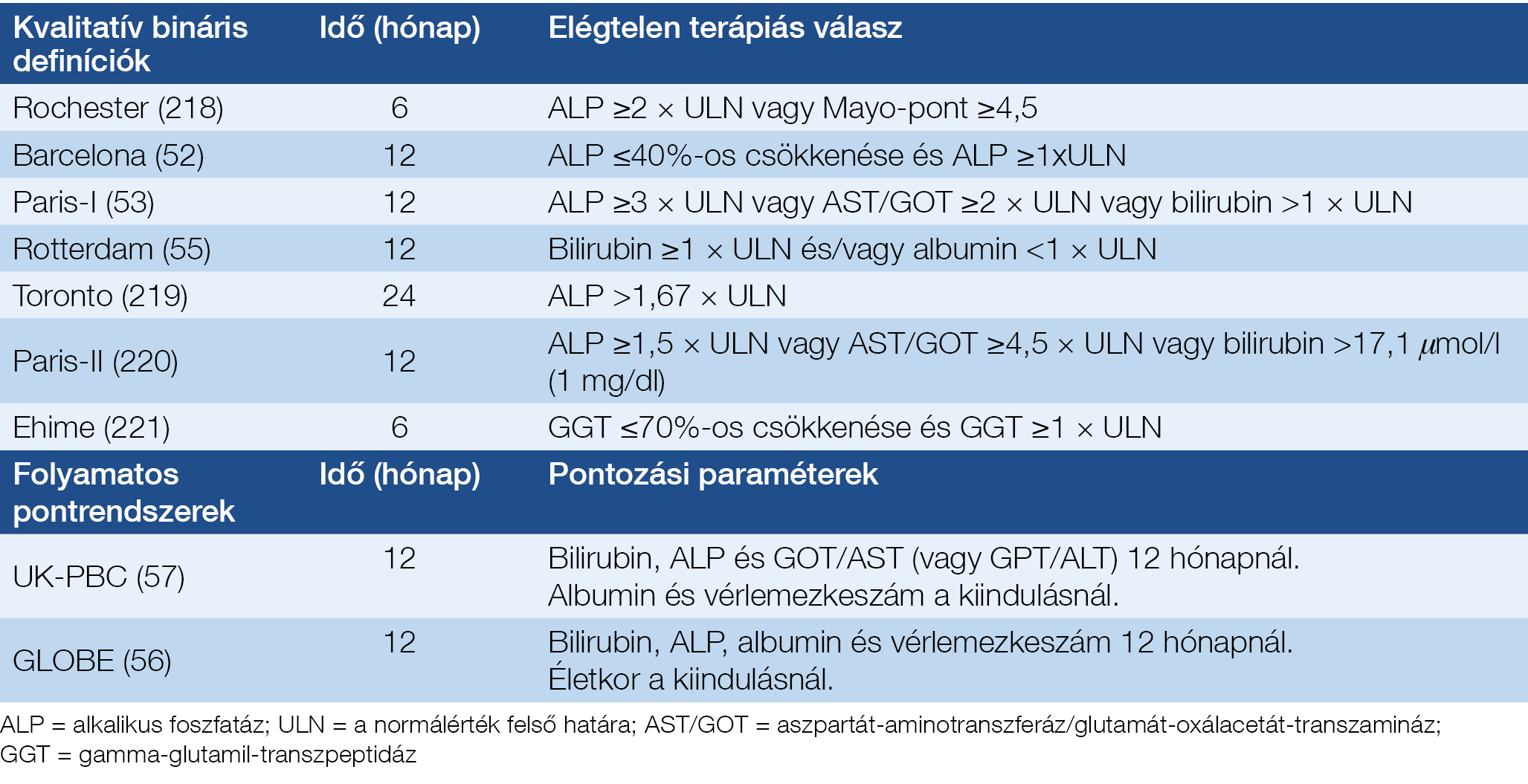
A PBC még UDCA-kezelésben részesülő betegek esetén is progresszivitást mutathat, és a májjal összefüggő szövődmények kialakulását és a halálozás magasabb kockázatát (51–53). Éppen ezért, a diagnózis felállítását követően minden beteg esetében fel kell mérni a progresszív betegséglefolyás kockázatát (2. ábra). A klinikai gyakorlatban ennek az első és legfontosabb alkalmazási területe a másodvonalbeli terápiára szoruló betegek kiválasztása, mind a rutinellátás során, mind pedig az elérhető terápiás kutatások során. A második, hogy a kockázatbecsléssel a klinikai vizsgálatokban lehetőség adódik a beválogatáskor a betegek közötti prognosztikai különbségek kiegyenlítésére. Jelenleg a betegséglefolyás szempontjából a kockázati csoportok kialakításának két megközelítése:
- az UDCA-kezelésre adott biokémiai válasz felmérése;
- a betegség felfedezéskori stádiumának megállapítása (korai vagy előrehaladott).
A kezelés hatékonyságának lemérése az UDCA-kezelés indításától számított 12. hónapnál javasolt, de újabb irodalmi adatok szerint a 6. hónapnál végzett felmérés ugyanolyan hatékonyságú (54). Diszkrét bináris változókon alapuló kvalitatív, vagy folyamatos paraméterekből számolt kvantitatív pontrendszerek használhatók (3. táblázat). A legtöbb vizsgálatban a betegek 25-50%-ában találtak nem megfelelő biokémiai választ UDCA-ra, attól függően, hogy melyik definíciót használták (54, 55). A nemzetközi megegyezés szerint az UDCA-ra adott válasz megítélésére használt két legfontosabb paraméter az ALP és a totálbilirubin (7) (kvalitatív bináris határozókat tartalmazó modellek). A dichotóm kritériumokon alapuló prognosztikai eszközök egyszerűek és a klinikai gyakorlatban könnyen használhatók, mint pl. a Paris-I/II kritérium, amelyek jelentős szétválasztó erővel is bírnak. Az újonnan kifejlesztett folyamatos pontrendszerek azonban egyesítik mind a kezelésre adott választ, mind a betegségsúlyosság paramétereket (56, 57) (a Globális PBC Kutatócsoport [http://www.globalpbc.com/globe] és az Egyesült Királyság-PBC [UK-PBC] konzorcium [www.uk-pbc.com] pontrendszerei), így a halálozás vagy a májtranszplantáció szükségességének a becslésében megbízhatóbbak, mint a Paris-I kritérium, amelynek a bináris modellek közül a legjobb a teljesítőképessége (58). A Paris-I kritériumokhoz képest a GLOBE-pontrendszer a betegek alacsony- és magas kockázatú csoportba sorolásának pontosságát mintegy 10%-kal növeli (56). A GLOBE-pontrendszer alapján, az UDCA-val kezelt betegek mintegy 40%-ánál alacsonyabb a várható transzplantációmentes túlélés az egészséges egyénekhez viszonyítva (56). Hasonló adat az UK-PBC-pontrendszer esetén nem áll rendelkezésre.
A szerzők a klinikai gyakorlatban az UDCA-kezelésre adott válasz értékelésére a diszkrét bináris változókon alapuló kvalitatív pontrendszerek közül a Paris-II kritériumokat használják (57), azaz elégtelen terápiás válasznak tekintik, amennyiben az 1 éves UDCA-kezelést követően az ALP ≥1,5×ULN vagy AST/GOT ≥4,5×ULN vagy bilirubin >17,1 mmol/l (1 mg/dl). Ugyanakkor az UDCA-ra adott válaszhoz tartozó ALP-szintet befolyásolja maga a kiindulási ALP-szint is. Minél nagyobb a csökkenés, annál kedvezőbb a prognózis; a legalább 60%-os csökkenés a kiindulási ALP-értékhez képest azonban mindenképpen kívánatos és már elfogadhatónak tartható (ez utóbbi CS véleménye). A folyamatos pontrendszereknek a mindennapi klinikai gyakorlatban való használata nehézkes, és ritkán használják csak. Leginkább úgy lenne reális az alkalmazásuk, ha az orvosinformatikai rendszerbe beépítésre kerülnének, és az aktuális vizit során automatikusan kalkulálódnának.
A kiindulási betegségstádium vonatkozásában a korai, vagy előrehaladott betegség meghatározása az alábbiak alapján történhet:
- szövettani eredmény (amennyiben a biopszia elérhető) – hiányzó vagy mérsékelt fibrózis szemben a bridging fibrózissal vagy cirrózissal;
- tranziens elasztográfiás vizsgálat eredménye – az LSM ≤9,6 kPa szemben >9,6 kPa;
- szérum bilirubin- és albuminértékek – mindkét paraméter normális, szemben legalább az egyik paraméter kóros értékével.
Diagnosztizált májcirrózis esetén a Child-Pugh (CP) score és/vagy a MELD-score rögzítése minden vizit kapcsán ajánlható (a szerzők javaslata).
A tranziens elasztográfiával (FibroScan) történő májtömöttség-mérés (liver stiffness measurement, LSM) az egyik legmegbízhatóbb módszer PBC-s betegekben a májcirrózis vagy a súlyos fibrózis (azaz bridging fibrózis) észlelésére (59–61). A >9,6 kPa LSM-értékek esetén 5× nagyobb a dekompenzált májbetegség kialakulásának, a májtranszplantáció szükségességének vagy az elhalálozásnak a kockázata 5 éves intervallumban (56). Emellett a romló LSM-érték nagyobb mértékben jelzi a betegség várható kimenetelét, mint az LSM értéke önmagában (56). A tranziens elasztográfiát javasolják a betegségprogresszió ellenőrzésére PBC-ben, azonban több adatra van még szükség az optimális prognosztikai küszöb és az ismételt vizsgálatok közötti időintervallum megállapítására (59). Erre a kérdésre az ERN Rare Liver R-Liver Research Registry a jövőben adhat majd választ. A regiszterbe prospektíven beválasztásra kerülő PBC-betegek esetén tudományos céllal évente történik tranziens elasztográfiás vizsgálat. A szerzők a saját klinikai gyakorlatukban, az erőforrások optimalizálását is figyelembe véve az alábbiak szerint végzik az ellenőrző tranziens elasztográfiát a betegség követése folyamán: az F0-2 kiindulási stádiumok esetén amennyiben az első 1-2 évben az LSM kPa-értékben nincs szignifikáns változás és a beteg betartja az előírt gyógyszerszedési javaslatot, valamint az UDCA-kezelés stabil, akkor elegendőnek tartják a 2-3 évente történő ellenőrzést. (Ez megegyezik CS személyes véleményével is.) Amennyiben azonban a diagnózis felállításkor F3-4 stádium igazolódik, évente történik ellenőrzés, az LSM kPa-érték változásának követésére és a progresszió időben történő felismerésére. Amióta a szövettani mintavételt nem ajánlják a diagnózis felállításához, és a tranziens elasztográfia kényelmes lehetőségként használható a májcirrózis vagy a súlyos fibrózis észlelésére, a máj szövettani vizsgálata korlátozott értékű a PBC prognózisának megítélésében. Az előrehaladott szövettani stádiumok azonban következetesen rossz prognózissal társulnak (33, 53, 63–65).
2. ábra: A primer biliaris cholangitis (PBC) kezelésének és gondozásának algoritmusa
Az LSM-mérésre egyéb noninvazív eszközös vizsgálatok is léteznek, mint az akusztikus lökéshullámon alapuló képalkotás (acoustic radiation force impulse (ARFI), amely point shear wave elasztográfia [pSWE] néven is ismert), valamint a szuperszonikus nyíráshullámmal működő elasztográfia (2D-shear wave elasztográfia [2D-SWE]) (59). Krónikus vírushepatitisekben számos vizsgálatban bizonyították, hogy a májfibrózis stádiummeghatározásában a 2D-SWE azonos értékű vagy jobb a tranziens elasztográfiához viszonyítva. PBC-ben eddig mindössze két tanulmány ismert, amelyben a 2D-SWE-módszer diagnosztikus hatékonyságát vizsgálták a májfibrózis stádiummeghatározásában. Yan et al. (2019) a jelentős fokú fibrózis (F2), a súlyos fibrózis (F3) és a cirrózis (F4) küszöbértékének a következőket találta PBC-s betegekben: 10,7 kPa, 12,2 kPa, 14,1 kPa. (66) Zeng et al. (2013) PBC-s és AIH-s betegekből álló kohorszában a 9,7 kPa, 13,2 kPa, 16,3 kPa voltak az F2-F3-F4 fibrózisstádiumok alsó küszöbértékei (67). ARFI/pSWE esetén egy vizsgálat történt, amibe PBC-s és AIH-es betegeket is bevontak (68). Ezekben a tanulmányokban a szövettani vizsgálat eredményét tekintették referenciastandardnak és nem történt direkt összehasonlítás tranziens elasztográfiával. PBC-s betegekben a tranziens elasztográfiával történő májtömöttség-mérés a 8,8 kPa, 10,7 kPa, 16,9 kPa értékeket találta a jelentős fokú fibrózis (F2), a súlyos fibrózis (F3) és a cirrózis (F4) küszöbértékének (59). Számos egyéb paraméterrel kapcsolatosan is közöltek olyan adatokat, miszerint előre jelezhetik a PBC-s betegek kezelésre adott válaszát és a progresszív betegséglefolyást, azonban ezek alkalmazhatósága általában korlátozott és további megerősítésük szükséges.
A különféle demográfiai jellemzők közül az életkor és a nem emelhető ki. A fiatalabb életkorban (<45 év) jelentkező betegség gyakran tünetes és kevésbé reagál UDCA-kezelésre (6). Ez összefüggésben van a fiatalabb életkori kategóriában diagnosztizáltaknál megfigyelhető, elsősorban a májbetegséggel összefüggő magasabb halálozási aránnyal. Ezzel szemben az idősebb korban diagnosztizált betegek halála inkább a nem-májbetegséggel kapcsolatos okokra vezethetők vissza (69). A férfinem a későbbi diagnózissal, a diagnóziskor észlelhető előrehaladottabb betegséggel mutat összefüggést, a UDCA-kezelésre adott válasz rosszabb, és a hepatocelluláris karcinóma (HCC) kialakulásának is magasabb a kockázata (6, 8, 70).
3. táblázat: Az urzodeoxikólsav (UDCA) kezelésre adott válasz értékelése primer biliaris cholangitisben (PBC)
A fáradékonyság és a viszketés a PBC-s betegek több mint 50%-át érinti (22). Előrehaladottabb betegségben gyakoribbak a tünetek. A tünetek jelenléte önmagában rosszabb UDCA-ra adott választ, illetve rosszabb prognózist jelezhet (71, 72). Az irodalomban ugyanakkor nem találunk egységes adatokat arra vonatkozóan, hogy a tünetek mennyire befolyásolják a prognózist (22, 73). Leírtak egy korai ductopeniával járó PBC-variánst, amelyben a súlyos viszketés progresszív icterusos epepangással társul és nem reagál UDCA-kezelésre. A szövettani vizsgálat az epeutak számának csökkenését mutatja szignifikáns fibrózis vagy cirrózis nélkül. Ezen betegeknél általában transzplantáció szükséges (74).
A szerológiai markerek közül a PBC-specifikus ANA (gp210 és sp100 antigének elleni antitestek) jelenléte a kedvezőtlen betegséglefolyás előrejelzője, a szérumbilirubin-
értéktől függetlenül (53, 75–78). A centromer elleni antitest lehetséges prognosztikai értékéről (portális hipertenzióval járó fenotípus) szintén beszámoltak (78–80). Hasonlóképpen a fibrózis szérummarkereiről [ELF, enhanced liver fibrosis (81, 82), APRI score (83), WFA + M2BP, wisteria floribunda agglutinin pozitív mac-2 kötő fehérje és a citokeratin 18 (84, 85)] is igazolták, hogy prognosztikai értékük lehet PBC-ben.
A PBC kezelése
A kezelés célja egyrészt a májbetegség végstádiumú komplikációinak megelőzése, másrészt a társuló tünetek kezelése. A betegségprogresszió lassítására szolgáló elsővonalbeli készítmény az orális urzodeoxikólsav (UDCA), reagáló betegeknél általában élethossziglan alkalmazandó. Az UDCA-refrakter betegekben a másodvonalbeli kezelés mellett kiegészítő kezelésként az UDCA-terápia folytatását javasolják. További randomizált kontrollált vizsgálatok szükségesek, hogy magas minőségű evidenciák álljanak rendelkezésre a nehezen kezelhető PBC-s betegek egységes kezelési elvének kidolgozásához (86).
Az orális UDCA hatékonyságát széles körben vizsgálták (87). Használata minden PBC-s betegnek ajánlott az Amerikai Májkutató Társaság (AASLD, American Association for the Study of Liver Diseases), az EASL, valamint a legújabb ajánlások nyomán (83–93). Az UDCA az epesavak kb. 1-3%-át teszi ki, de a gyógyszeres kezeléssel a domináló epesavvá válik; az epe dúsultságának mértéke a biokémiai eredmények javulásával korrelál (4, 99–101). Az UDCA egy poszttranszkripciós szekretagóg a hepatocytákban és cholangiocytákban, egy hatásos poszttranszkripciós jelrendszeren keresztül fokozza a transzportfehérjék és csatornák célmembránhoz való eljutását. Epepangás során ezen mechanizmus, valamint a HCO3–, epesavak, bilirubin és számos egyéb kolefil késői szekréciója károsodik (4). Az UDCA citoprotektív (mint pl. antiapoptotikus) hatást is kifejt a hepatocytákra és cholangiocytákra (4). Az UDCA terápiás hatékonyságának legerősebb, nem gyógyszertanulmányból származó bizonyítékát a Global PBC Kutatócsoport által végzett metaanalízis nyújtotta (7) (n=4845), amely különböző időpontokban szignifikánsan jobb transzplantációmentes túlélést mutatott a kezelt egyénekben, a nem kezeltekhez képest (5 évnél, 10 évnél és 15 évnél sorrendben: 90%, 78%, 66% vs. 79%, 59% és 32%; p <0,001 minden összevetésben). Egy frissített Cochrane-metaanalízis (98) alapján valószínűleg a betegség korai fázisában elkezdett, hosszú távú UDCA-kezelés szükséges ahhoz, hogy a gyógyszer a maximális pozitív hatását kifejtse. Az optimális dózis 13-15 mg/kg/nap, amely napi egyszeri adagban, vagy több része osztva adható, ha úgy jobban tolerálható; egyes betegek a folyékony készítményt jobban tolerálják. PBC esetén a 13-15 mg/kg/nap dózis igazoltan előnyösebb, mint az 5-6 mg/kg/nap vagy a 23-25 mg/kg/nap dózis. Az UDCA-vizsgálatok eredményeinek értékelésénél fontos megjegyezni az alkalmazott terápiás dózisban mutatkozó különbségeket – néhány korai vizsgálat alacsonyabb dózisokat alkalmazott, mint amit jelenleg optimálisnak tartunk. Az UDCA az ajánlott dózisban alkalmazva nagyon biztonságos, kevés mellékhatással rendelkezik (kb. 3 kg testsúlynövekedés az első 12 hónapban, hajhullás, illetve ritkán hasmenésről és puffadásról is beszámoltak). Nincs arra utaló adat, hogy az UDCA teratogén hatású lenne. A terhesség és szoptatás alatti alkalmazásra vonatkozó, evidencián alapuló ajánlások hiányoznak, azonban biztonságosnak tekinthető a használata az első trimeszter alatt, valamint azt követően, beleértve a szoptatást is. Biztonságosan használható terhesség alatti intrahepatikus cholestasis (ICP) esetén is (103, 104). Az orális obetikólsavat (OCA) feltételesen jóváhagyták kompenzált stádiumú PBC-s betegek kezelésére. UDCA-val kombinációban azon esetekben javasolják, akik nem megfelelően reagáltak az UDCA-ra (ALP >1,67×ULN és/vagy a bilirubin <2×ULN emelkedett), monoterápiaként pedig azon betegekben, akiknél UDCA-intolerancia észlelhető. A kezdeti dózis nem cirrózisos betegekben 5 mg; dózistitrálás szükséges (10 mg-ra hat hónap alatt) a tolerabilitásnak megfelelően. Kompenzált cirrózis esetén lényegesen alacsonyabb dózis adható, dekompenzált májműködés esetén pedig ellenjavallt. Alkalmazhatóságát mellékhatásai, és ára is korlátozhatják (Magyarországon egyelőre ártámogatással nem rendelkezik). Az OCA egy félig szintetikus, hidrofób epesavanalóg, nagy szelektivitással az FXR-re. Az endogén hasonmásához, a kenodeoxi-kólsavhoz viszonyítva exponenciális aktivációs hatással rendelkezik. Az OCA a bélből származó hormonok expresszióját is fokozza, különösen az FGF-19-ét. Az FXR egy sejtmagban található „ligand aktivált” receptor, amely nagy számban expresszálódik az epesavak enterohepatikus körforgásában részt vevő szövetekben (4, 105–107). Az UDCA-val ellentétben, amely poszttranszlációs szinten működik, az FXR-jelátvitel direkt úton szabályozza az epesavak szintézisében, szekréciójában, transzportjában, abszorpciójában és a detoxifikációban résztvevő géneket; emellett az FXR-jelátvitel hatással van a gyulladásra, metabolikus szabályozásra és a májfibrózisra. Az első randomizált, kettős vak kontrollált tanulmányban, amely az OCA alkalmazását vizsgálta PBC-ben, 3 különféle dózis terápiás hatékonyságát elemezték (10, 25, 50 mg/nap) az UDCA mellé adott kiegészítő terápiaként. A multicentrikus tanulmány tartósan emelkedett szérum ALP (>1,5 × ULN) értékkel rendelkező betegekre korlátozódott (108). Ezen vizsgálatban az elsődleges végpont a szérum ALP-érték szignifikáns csökkenése volt a kiindulási értékhez képest, amely mindhárom OCA-dózisnál teljesült, szemben a placebóval.
Ráadásul, az összes OCA-val kezelt és a terápiát befejező beteg 87%-a, 69%-a és 7%-a elérte a szérum ALP-érték legalább 10%, 20%-os csökkenését vagy annak teljes normalizálódását (vs. 14%, 8% és 0% a placebóval kezelt csoportban) (3). A PBC OCA International Study of Efficacy – POISE III. fázis tanulmány adatai is publikálásra kerültek (109). A POISE-tanulmányba olyan PBC-s betegek kerültek beválogatásra, akiknél tartósan emelkedett volt a szérum ALP-érték (előzetesen biokémiailag nem reagálók a módosított Torontói kritériumok alapján; ALP >1,67×ULN és/vagy emelkedett totál bilirubin <2×ULN). A kettős vak, 12 hónapos periódus elsődleges végpontja az ALP-érték <1,67×ULN (a kiindulási értéktől számított ≥15%-os csökkenés), és ezzel együttesen a normál szérumbilirubin-érték elérése volt. Az intention-to-treat analízisben („kezelési szándék szerinti”) 10% volt a biokémiai válasz a placebocsoportban, a 47% és a 46%-hoz képest a 10 mg-os és az 5-ről 10 mg-ra feltitrált dózisú OCA-csoportokban (p <0,0001 mindkét esetben). Ráadásul az ALP kiindulási értéktől számított átlagos csökkenése 39% és 33% volt a 10 mg-ot szedő és a feltitrált dózisú OCA-csoportban, míg 5% azon betegeknél, akik placebót kaptak (p <0,0001 mindkét esetben). Mindkét OCA-csoport elérte az előre meghatározott másodlagos végpontokat, beleértve a szérum AST és a totál bilirubin csökkenését (mindkettő p <0,001 vs. placebo). A PBC-ben alkalmazott OCA-ra vonatkozó kettős vak kontrollált adatok 12 havi követési időszakra korlátozódnak, ezen időponton túl nyílt kiterjesztésű adatokkal rendelkezünk. Az OCA hosszú távú hatékonyságának és a betegpopulációra történő általánosíthatóságának megerősítésére prospektív követéses vizsgálatok szükségesek. A túlélési előny még nem bizonyított, ezirányban jelenleg is folyik egy hosszú távú randomizált vizsgálat. A terápiás hatékonyságra vonatkozóan nincsenek olyan elérhető adatok, amelyek a vizsgálatba való beválasztáskor mért szérum ALP-emelkedés mértékén alapulnának. A klinikai kimenetel további releváns jelzőinek (beleértve az AST/trombocita arányt vagy a tranziens elasztográfia során származtatott LSM-et) értékelése további haszonnal járna. Az OCA-val történő kezelés dózisfüggő módon összefügg a viszketés kiújulásával, amely a betegek 4-10%-ánál a kezelés felfüggesztéséhez vezet (108, 109). Ezen megfigyelések hangsúlyozzák a dózistitrálás fontosságát, valamint a tüneti kezelés időben történő beállítását. A rifampicin előnyös lehet, azonban az epesavkiválasztó ágensekkel kölcsönhatásba kerülve a széklettel való OCA-vesztéshez vezet. Az OCA-val kezelt betegeknél a szérumlipid-értékekben is észlelhetők (reverzibilis) változások (109), különösképpen a nagy denzitású lipoprotein- (HDL) szint csökkenése, amelyet a totál koleszterin és az alacsony denzitású liporotein- (LDL) szint emelkedése kísér. Az egyelőre nem ismert, hogy ezen változások befolyásolják-e a hosszú távú kardiovaszkuláris kockázatot. Továbbá ezidáig csak korlátozott számú költséghatékonysági elemzés ismert. Az „off-label” indikációkhoz tartozó, budezonid és fibrinsav-származékoknak a PBC-kezelésben való alkalmazásával kapcsolatosan egyelőre az EASL nem tudott állásfoglalást megfogalmazni, ugyanis az UDCA-val kombinált budezonid (nem májcirrózisos betegekben) vagy bezafibrát alkalmazását vizsgáló III. fázis randomizált tanulmányok még nem zárultak le. PBC-ben az alkalmazásukat támogató bizonyítékok eddig csak kis betegcsoportra, és rövid követési időre korlátozódtak, akár első, akár másodvonalbeli kezelési alkalmazásukról volt is szó. A budezonid egy szintetikus kortikoszteroid, magas first-pass metabolizmussal a májban, amely a prednizolonnal összehasonlítva minimális szisztémás mellékhatásokat eredményez (110). Mindazonáltal, a budezonid farmakokinetikája fokozódhat a májbetegség progressziójával, és kedvezőtlen kimenetelt eredményezhet májcirrózisos, portális hipertenzióval rendelkező betegeknél (110).
A fibrátok erős anticholestaticus hatást gyakorolnak a peroxiszóma profilerátor-aktivált receptorok (PPAR) aktivációján keresztül, továbbá számos epesav-képződéshez vezető útvonalat gátolnak (111). Régóta nagy a szerek iránti érdeklődés cholestaticus májbetegségekben, némelyikül ellenjavallt PBC-ben, esetleges májkárosodás lehetősége miatt. A fibrátok nagy dózisban gátolnak néhány CYP-enzimet, különösen a CYP2C9-et. A CYP2C9 szabályozza a nem-szteroid gyulladáscsökkentők (NSAID) farmakokinetikáját, ezért különösen figyelni kell, hogy ne írjanak fel NSAID-ot nagy dózisú fibráttal együtt. Terápiás dózisban a fibrinsav-származékok emelik a szérum ALT- és AST-szinteket, amely az ismert, máj transzamináz-szintézisre való transzkripciós hatással lehet összefüggésben. Kreatininszint-emelkedés esetén az izomból származó fokozott termelés állhat fenn. Egyéb mellékhatásokat, mint pl. muszkuloszkeletális fájdalmak (leginkább bezafibrát kezelésnél) a betegek 5-10%-ánál írtak le. A
PBC kezelésének speciális szempontjai
Terhesség
Fiatal életkorú PBC-s betegekben gyakran a terhesség során kerül felismerésre a betegség (ICP megszűnésének elmaradása). Ismert PBC-s betegekben, májcirrózis hiányában a terhességnek általában nincs jelentősebb orvosi kockázata. A terhesség PBC-ben jellemző módon jól tolerálható, a terápia vezetését azonban szakember végezze. A kezeléssel kapcsolatos tapasztalatok esetismertetésekre korlátozódnak, de a szakértő klinikusok véleménye az, hogy az UDCA biztonságos a fogamzás és a terhesség alatt, valamint a szülést követő időszakban is, így annak folytatása javasolt (100). Fontos a viszketés kezelése, és szakember tanácsát igényelheti, megjegyzendő, hogy a rifampicint szakértők már használták a harmadik trimeszterben. A már kialakult májcirrózis és portális hipertenzió csökkentik a fertilitást, az anyai és magzati komplikációk magasabb kockázatával járnak. A terhesség vállalása előtt fontos az orvosi konzultáció és a terhesség kapcsán mindenképpen PBC-betegek ellátásában tapasztalt hepatológus általi követés javasolt. A diagnosztika és kezelés nem különbözik az egyéb eredetű májcirrózisos betegekétől (mint pl.: gasztroszkópia, ha portális hipertenzió merül fel; arteria lienalis aneurizma ultrahanggal történő kizárása). A portális hipertenzió fennállása esetén a legnagyobb a terhességgel összefüggő kockázat. Varixvérzés bármilyen eredetű májcirrózisos betegnél kialakulhat, a terhességhez társuló portális nyomásnövekedés következményeként. Az ilyen betegeknek a második trimeszterben elektív endoszkópia szükséges a varixok megítélése céljából, és megfelelően el kell látni azokat. Ismert az is, hogy PBC-s betegben a terhesség során a viszketés rosszabbodhat. A kolesztiramin és a rifampicin (harmadik trimesztertől kezdve) biztonságosnak tekinthető terhességben, habár az adatok korlátozottak (103, 113). Ritka esetekben a terhesség alatti viszketés elviselhetetlenné válik, ilyenkor a plazmaferezis segíthet (114). A cholestasis súlyos eseteiben a zsíroldékony vitaminok hiányára figyelni kell.
Posztpartum cholestaticus fellángolásról vannak klinikai beszámolók, fontos a követés a szülést követő időszakban is.
PBC autoimmun hepatitis jellegzetességeivel
A PBC változó mértékű hepatikus gyulladással jellemezhető. A klasszikus PBC csak minimális lobuláris és interface hepatitis aktivitást mutat, azonban a betegek kb. 8-10%-ánál az AIH jellegzetességei figyelhetők meg (115). Ezen betegeknél a betegség megnevezése „AIH-PBC overlap (átfedő) szindróma”, „PBC hepatikus formája”, vagy „PBC másodlagos AIH-val”. Ezen variánsok patogenezise kevéssé ismert (115–117). Többen gondolják úgy, hogy az AIH jellemzőivel társuló PBC a hepatitis aktivitásspektrum egyik vége PBC-ben, azonban mások szerint ez a szindróma egy különálló betegség. Itt a diagnózis útvonalán van a hangsúly, amelynek célja, hogy azonosítsuk azon betegeket, akik profitálhatnak az immunszuppresszív gyógyszereknek az UDCA-val történő kombinált alkalmazásából.
Definíció és diagnózis
A PBC és AIH típusos jellemzői általában egyszerre (1) jelentkeznek a betegeknél (115–117), de a korábban PBC-vel (2) vagy AIH-val (3) diagnosztizált betegeknél külön is jelentkezhet, akár évekkel az elsődleges diagnózist követően (118–120). Azon PBC-s betegeknél, akik 6-12 hónap után nem reagálnak megfelelően az UDCA-kezelésre, társuló AIH jellemzőit mindig vizsgálni szükséges.
Betegek, akiknél egyidejűleg észlelhetők a PBC és az AIH tünetei
A Paris-kritériumok használatosak a leginkább az AIH jellemzőivel társuló PBC diagnózisának felállításában (121), amelyet az EASL is jóváhagyott (24). A szövettani mintavétel minden esetben kötelező (mint AIH diagnózisához általában) (24). Ezen kritériumok szerint PBC-s betegekben az egyidejű AIH-diagnózis akkor állítható fel, ha az alábbi három jellemző közül legalább kettő jelen van:
- ALP >2×ULN vagy GGT >5×ULN;
- AMA >1:40;
- Florid epeúti sérülés a szövettani vizsgálat során.
Továbbá a következő három jellemzőből kettő jelen van:- ALT >5×ULN;
- IgG-szérumszint >2×ULN vagy simaizom elleni autoantitest-pozitivitás;
- közepes vagy súlyos interface hepatitis a szövettani vizsgálat során.
Szem előtt kell tartani, hogy a Paris-kritériumok különböznek a PBC vagy AIH, mint individuális betegségek meghatározásától (24, 122). A kritériumrendszer nagy specificitással, de közepes szenzitivitással segített azonosítani azon betegeket, akik kortikoszteroid-kezelésre szorultak a betegségük gyulladásos komponense miatt. A kezelés indikációja megfelel az AIH-ajánlásban leírtaknak (123). A legtöbb szakértő egyetért abban, hogy azon betegek esetén, akik kimerítik a Paris-kritériumokat, különösképpen a szövettani interface aktivitásra vonatkozóan, meg kell fontolni a kiegészítő immunszuppresszív kezelést. Azonban az nem tisztázott, hogy ezen kritériumrendszer azonosít-e minden olyan PBC-s beteget, akik számára potenciálisan előnyös lehet az immunszuppresszív kezelés. Ez azért fontos, mivel az aktuális EASL AIH-irányelv transzamináz- vagy IgG-szint vonatkozásában alacsonyabb küszöbértéket, illetve, a módosított szövettani aktivitási index vonatkozásában 18-ból 4 (vagy több) pont esetén javasolja a kezelést (122).
Mind az International Autoimmune Hepatitis Group (IAHG) átdolgozott (124), mind pedig a későbbiekben egyszerűsített AIH-pontrendszereit (125) retrospektíven alkalmazták a kortikoszteroiddal kezelt PBC-s betegek azonosítására. Ezen pontrendszereket azonban nem az AIH cholestaticus változatának vagy az AIH + PBC-s betegekben való diagnosztizálására dolgozták ki, ebből adódóan nem feltétlenül alkalmazhatók a klinikai gyakorlatban.
A szolúbilis májantigén (SLA)/máj-hasnyálmirigy (LP) és kettősszálú DNS-elleni autoantitestek jelenléte összefüggött az egyidejű AIH jelenlétével PBC-s betegekben (126–128). Ezért ezen autoantitestek mérése kifejezetten javasolható az AIH gyanús PBC-s betegek kivizsgálása során, és pozitivitás esetén eleve májbiopszia mérlegelése indokolt.
Ismert PBC-s betegek, akiknél AIH-re jellemző tünetek alakulnak ki
Az UDCA-kezelésben részesülő PBC-s betegeknél még évekkel a kezdeti diagnózist követően is kialakulhat fokozódó hepatitises aktivitás (119, 120). Ezen betegeknél májbiopszia elvégzése szükséges az interface hepatitis mértékének meghatározására.
Ismert AIH-s betegek, akiknél PBC-re jellemző tünetek alakulnak ki
Azon AIH-val diagnosztizált betegeket, akiknél tartósan emelkedettek a cholestaticus májenzimek, PBC fennállásának irányában vizsgálni kell. A PBC-nek azon AIH-betegek differenciáldiagnózisában is szerepelnie kell, akiknél idővel emelkedett cholestaticus enzimek alakulnak ki a PBC típusos tüneteivel együttesen (viszketés, sicca-szindróma). Az AMA jelen lehet akut hepatitises betegekben, a szintje idővel általában csökken; ezt figyelembe kell venni, amikor ismert AIH-betegnél diagnosztizálunk PBC-t, továbbá az akut AIH számottevő epeúti sérüléssel is társulhat (129). Az AMA folyamatos jelenléte AIH-betegekben nem feltétlenül nyilvánul meg epeúti sérülésként a szövettani vizsgálat során vagy az AMA-negatív AIH-től eltérő klinikai kórlefolyás formájában (117, 130, 131).
Összességében PBC kritériumát kimerítő ALP-emelkedés/cholestasis esetén az AIH kezelése mellett UDC egyidejű adása mérlegelendő, az AMA-státusztól függetlenül. (A szerzők véleménye.)
Kezelés és prognózis
Betegek, akiknél a PBC és az AIH jellegzetességei egyidejűleg, vagy először a PBC észlelhető
Azon PBC-s betegek prognózisa, akiknél az AIH jellemzői is egyidejűleg jelen vannak, rosszabb, mint akiknél kizárólag csak a PBC jellemzői. Az előbbi csoport hajlamosabb az előrehaladottabb fibrózis kialakulására (119, 132, 133). Ahogyan azt tárgyaltuk, az interface hepatitis jelenléte a PBC progressziójának egyik szövettani előrejelzője. Hiányoznak azonban a nagyobb betegszámú, hosszabb távú utánkövetéses vizsgálatok az UDCA-val és kortikoszteroiddal, vagy kombinált immunszuppresszív gyógyszerekkel kezelt betegek prognózisára vonatkozóan. Kontrollált klinikai vizsgálatok még nem történtek – és valószínűleg nem is lesznek – ilyen betegekben. A PBC-s komponenst standard dózisú UDCA-val kell kezelni. Az elérhető adatok azt mutatják, hogy azon betegek, akik teljesítik a Paris-kritériumrendszert az AIH-diagnózis vonatkozásában, a PBC-betegségük kezdetekor vagy a kórlefolyás alatt, rövid- és középtávon profitálhatnak a kiegészítő immunszuppresszív kezelésből (119, 121, 134, 135). A súlyos interface hepatitis, mint a hepatitis aktivitás legmegbízhatóbb markere, immunszuppresszív kezelést igényel (134). A régi kontrollált AIH-val kapcsolatos vizsgálatok eredményeiből következtetve, azon betegeknek, akiknek az aminotranszferáz értéke >5×ULN és a gamma-globulinok >2×ULN, kezeletlenül hagyva rossz a prognózisa (122). Közepes aktivitású interface hepatitis esetén az immunszuppresszív kezelést meg kell fontolni. Még nem tisztázott, hogy mérsékelt aktivitású interface hepatitis esetén előnyös-e az immunszuppresszív kezelés, úgy, ahogyan az az AIH-betegeknek javasolt (122).
A legtöbb beteget kortikoszteroiddal kezelték (főleg prednizolon/prednizon) és az AIH-betegekéhez hasonló volt a válaszarány (121, 128, 136–138). Az AIH-betegekkel összehasonlítva, a kombinált korikoszteroid- és azathioprin- kezelés esetén kevesebb a szteroid indukálta mellékhatás. Ezen kombinált kezelési módot nagy eredményességgel használták AIH jellemzőkkel is rendelkező PBC-s betegekben (119, 120, 134, 139). Az eredmények azt mutatják, hogy ezen betegek alacsonyabb dózisú immunszuppresszív kezelésre is reagálnak, és nagyobb arányban sikerül az immunszuppresszív kezelést elhagyni, mint a csak AIH-val rendelkezők (134, 135). Figyelmet szükséges fordítani a kortikoszteroid-mellékhatásokra, különösen társuló cholestaticus májbetegség esetén. Az immunszuppresszív kezelés leállítása megfontolandó AIH szempontjából remisszióban lévő betegeknél, hogy elkerüljük a szükségtelen, kezeléssel összefüggő mellékhatásokat. A kezelés időtartamát egyénileg kell meghatározni.
AIH-betegek, akiknél PBC alakul ki
Nem tisztázott, hogy azon AIH-betegek, akiknél a PBC-re jellemző szerológiai és hisztológiai jellemzők alakulnak ki, profitálnak-e a kiegészítő UDCA-kezelésből. Tekintettel az UDCA-kezelés biztonságosságára, és a lehetséges hosszú távú előnyére, célszerű az UDCA egyidejű adása, különösen fiatalabb betegekben, akiknél ductopenia és biliaris cirrózis alakulhat ki az életük során.
Bizonytalan területek
Jelenleg számos bizonytalan terület van a PBC és AIH jellemzőit együttesen mutató betegek kezelésében:
- Mi a klinikai gyakorlatban az az IgG-re/gammaglobulinokra és transzaminázokra vonatkozó küszöbérték, amelynél indokolt a májbiopszia elvégzése és azt követően az immunszuppresszív kezelés PBC-s betegeknél?
- Mi az a hepatitis aktivitás (vagy az annak megfelelő paraméter), amellyel kiválaszthatók azok a betegek, akik profitálhatnak az immunszuppressziv kezelésből?
- Létezik-e olyan pontrendszer, amely lehetővé teszi a klinikai gyakorlatban és a tanulmányokban az egyidejűleg PBC-s és AIH-betegek azonosítását?
- Milyen mértékű szövettani epeúti sérülés esetén állítható fel a PBC diagnózisa, ha egyidejűleg AIH is fennáll, és igényelnek-e az ilyen betegek UDCA-kezelést az immunszuppresszív kezelés mellett?
A tünetek és az extrahepatikus-hepatikus manifesztációk kezelése
A PBC-hez kapcsolódó különféle tünetek jelentősen befolyásolják a betegek életminőségét (QoL) (19). A tünetek jellemzően nem korrelálnak a betegség súlyosságával és nem feltétlenül javulnak az első- (UDCA) és/vagy másodvonalbeli (+ OCA) kezelésre. A klasszikus tüneteken (viszketés, sicca-szindróma, fáradtság) túl, a betegek által jelzett további tünetek a csontfájdalom-, az ízületi fájdalom, a hasi fájdalom és a nyugtalanláb szindróma (6).
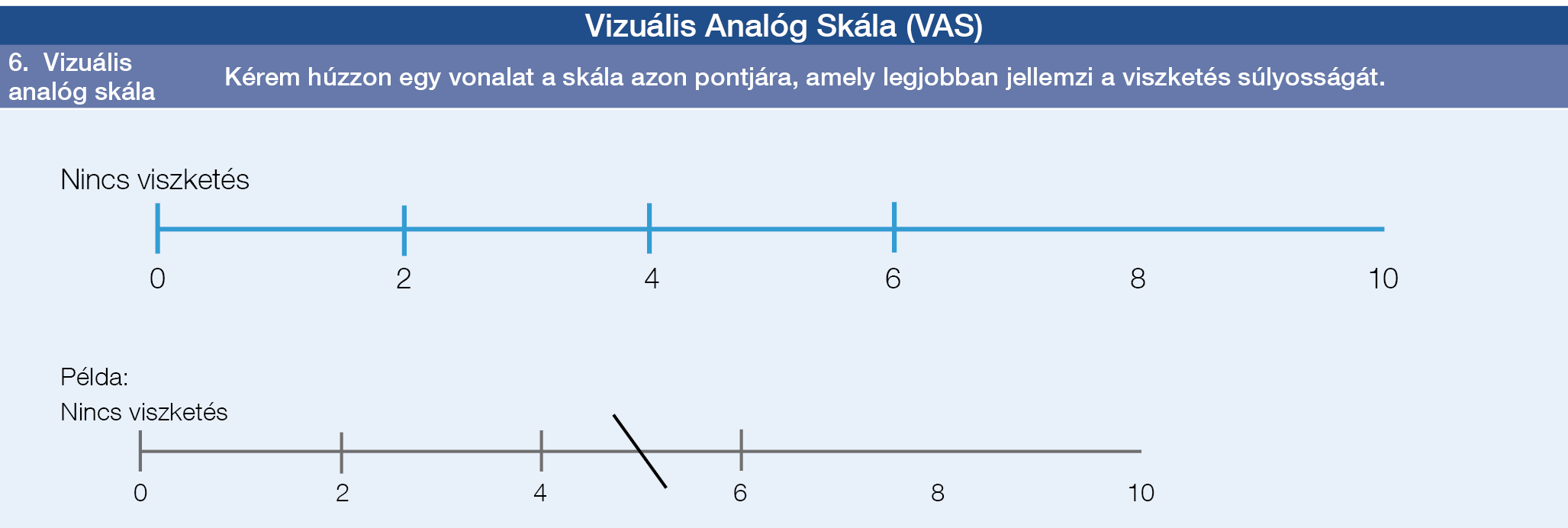
A betegek célzott kikérdezésével tárhatók fel ezek a tünetek, és hatásuk a betegek életvitelére, életminőségére (számszerűsített módon). Mindezek alapvetően hozzájárulnak a betegség egyénre gyakorolt hatásának teljes körű megértéséhez. A vizsgáló eljárások tartalmazhatják a Likert (egy pszichometriás skála, általában kérdőíveket alkalmazó kutatásokban használják), vagy vizuális analóg skálát (viszketés tekintetében jól megalapozott), de használhatók jóval összetettebb, a betegek által kitöltött felmérések (patient generated questionnaires) is, mint például a több elemet tartalmazó PBC-40 életminőségfelmérés (3. A ábra) (140, 141). A tüneti terápia szükségességét folyamatosan kell értékelni, nem pedig csak ad hoc módon. Fontos továbbá a tünetek újraértékelése, illetve a terápiára adott válasz értékelése. Fennáll annak a veszélye is, hogy a kezelés felfüggesztésével a tünetek visszatérnek, ezért a betegek többsége hosszú távú kezelést igényel. A betegtámogató szervezetek (lásd „Betegtámogatás” fejezet) fontos segítséget nyújthatnak abban, hogy a betegek kialakítsák a tüneteik saját maguk általi terápiás megközelítését.
3. ábra: Életminőséget (QoL, quality of life) felmérő kérdőívek primer biliaris cholangitisben (PBC). A: PBC-40, B: Vizuális Analóg Skála (VAS), C: 5-D Viszketés Skála
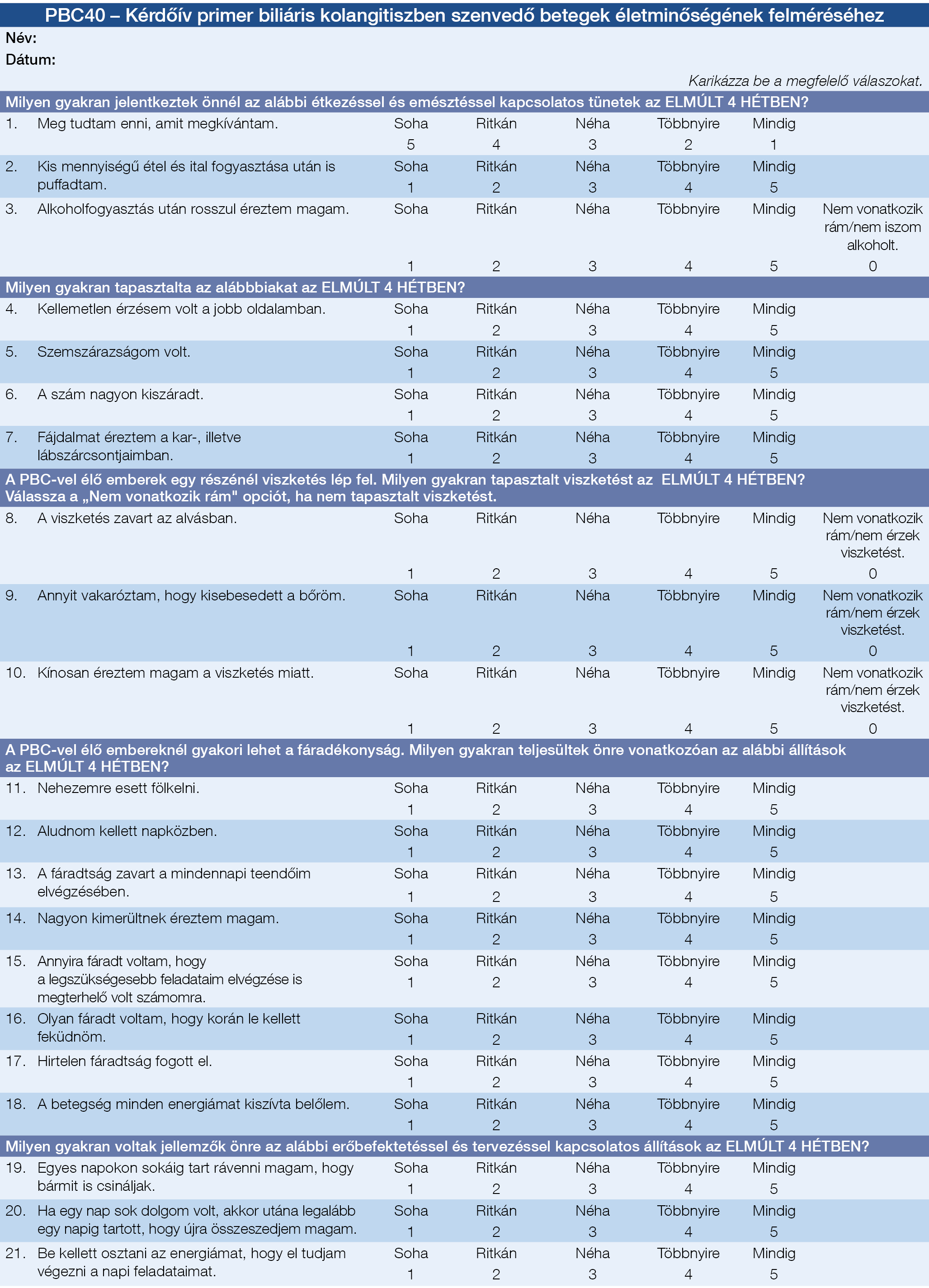
3. B ábra: 5-D Viszketés Skála

3. C ábra: Vizuális Analóg Skála (VAS)
Viszketés
A viszketés a PBC egyik jellemző cholestaticus tünete, és az egészséggel kapcsolatos életminőség (HRQoL, health related quality of life) csökkenését eredményezi (142, 143). Sok betegnél azonban nem tapasztalható, és hiánya nem szól PBC fennállása ellen. A viszketés a betegség bármely stádiumában előfordulhat, és arról számoltak be, hogy a májbetegség romlásával javulhat is (144). A PBC ductopeniás variánsa esetén a viszketés különösen problémát jelent (74). A betegek követése, és a viszketésben bekövetkező változások, valamint a lehetséges mellékhatások felmérése szükséges, amennyiben a viszketés elleni kezelésben módosítást tervezünk. A viszketés kezelésének strukturált megközelítése tűnik hatékonynak. Amennyiben a beteg viszketésről számol be, egyrészt annak súlyosságát felmérhetjük vizuális analóg skála (3. C ábra), vagy 5-D viszketési kérdőív segítségével (3. B ábra). Nincs arra utaló bizonyíték, hogy az UDCA a viszketésre bármilyen hatással lenne (6, 145), míg az OCA magasabb dózisban inkább súlyosbíthatja azt. A viszketés hátterében az epeúti elzáródást ki kell zárni, tekintettel az epeköves betegség és az ezzel összefüggő szövődmények fokozott kockázatára (146). A gyakorlatban ezek megkülönböztetése ritkán okoz problémát.
A betegeket gyakorlati tanácsokkal is el kell látni:
- Bőrpuhítók és zabpehelykivonat használata javasolt a száraz és gyulladt bőr gyógyítására.
- Hideg vízben való zuhanyzás vagy fürdés javasolt, hogy a meleg által fokozott vagy kiváltott viszketést enyhítsük (éjszakai ágynyugalom után).
- Pszichológiai vezetés szükséges a függőséget okozó viszketés/vakaródzás miatt.
- Keresni kell az egyidejű allergének jelenlétét is, különösen azon betegeknél, akiknél hypereosinophilia, vagy IgE-mediálta allergia is fennáll.
A korlátozott bizonyítékok ellenére az epekiválasztást fokozó szerek széles körben használatosak elsővonalbeli terápiaként; a tolerálhatóság gyakori probléma az olyan mellékhatások miatt, mint a puffadás és a székrekedés (147). A kolesztiramin egy nem felszívódó gyanta, ami enyhítheti a viszketést. Az epekiválasztást fokozókat 2-4 órával az egyéb gyógyszerek (beleértve az UDCA-t vagy az OCA-t) bevétele előtt vagy után kell alkalmazni, mivel befolyásolják a bélből történő felszívódást. A betegek oktatása ebben az esetben fontos a gyógyszerkölcsönhatások elkerülése végett. A szerzők megjegyzése: Magyarországon a kolesztiraminra behozatali engedély szükséges (OGYÉI és NEAK engedélyek szükségesek a gyógyszer rendeléséhez. Közeljövőben újra forgalmazzák majd Magyarországon). Indulásként 2×4 g adható és 24 g összdózisig emelhető szükség szerint.
A rifampicin második vonalbeli készítmény a PBC-hez társuló viszketés kezelésében, amely valószínűleg a pregnán X-receptor-agonista funkcióján keresztül hat (148). Randomizált, placebokontrollált vizsgálatok igazolták a rifampicin hatékonyságát a cholestasis okozta viszketés kezelésében (149–152). A kedvező hatást metaanalízisekben is alátámasztották (153, 154). Az ajánlott adagolás általában napi 150-300 mg. A rifampicin lehetséges mellékhatásai miatt (beleértve a potenciális hepatotoxicitást és a hemolízist) a kezelés bevezetésétől kezdve rendszeres laboratóriumi vizsgálat szükséges (155): a terápia megkezdését követően 6 és 12 héttel, valamint dózisemelést követően is. Amennyiben toxicitás észlelhető, a gyógyszert le kell állítani. Fontos továbbá, hogy a rifampicin befolyásolja a K-vitamin metabolizmusát, ami az INR-érték emelkedéséhez vezethet, főként icterusos betegekben (156).
A szerzők megjegyzése: Magyarországon a rifampicin csak tüdőgondozói hálózatban érhető el és csak tuberkulózisos betegek számára. A rifampicin folyamatos alkalmazása a májkárosító hatás mellett az antibiotikum-rezisztencia kialakulásának veszélyét is magában rejti, így a kockázat-haszon mérlegelése mindenképpen szükséges. PBC-ben az off-label alkalmazás szabályai szerint rendelhető.
Az orális opiát-antagonisták (naltrexon és nalmefen) harmadik vonalbeli terápiaként használatosak (153, 157–159). A naltrexont alacsony dózisban kell elkezdeni, hogy elkerüljük az opiátok megvonásszerű tüneteit a kezelés első néhány napján (160). Kérdéses lehet a hosszú távú tolerálhatóság, sok betegnél észlelhető opiáthoz társuló hozzászokás, illetve megvonási reakció vagy csökkent fájdalomküszöb (161, 162).
Egyéb gyógyszerek alkalmazásának lehetősége is felmerült a viszketéskezelésben, mint a szelektív szerotonin-visszavétel-gátlók (SSRI) (szertralin) (163) és gabapentin (164), azonban további vizsgálatok szükségesek az eddigi klinikai tapasztalat igazolása céljából. Az antihisztaminoknak időnként nemspecifikus viszketésellenes hatása van, valószínűleg a szedatív hatásuk miatt, de specifikus terápiaként nem ajánlottak; azonban használható kiegészítő kezelésként egyes esetekben. A fizikai megközelítések, mint a nazobiliaris drenázs (148, 165–167), a molekuláris abszorbancia recirkuláló rendszer (MARS) (168) és az ultraibolya (UV) fényterápia (169) mint kísérleti kezelések, esetismertetések/esetsorozatokban hatékonyságot mutattak, azonban klinikai vizsgálatokban még nem értékelték hatásukat (169, 170).
A cholestaticus viszketés miatt elvégzett májtranszplantáció kiemelten hatásos a viszketés súlyosságának gyors csökkentésére (gyakran a transzplantációt követő első 24 órán belül) (171). A viszketés, amely a terápiás próbálkozásokat követően „tartós és a kezelésre nem reagál”, azon PBC-szindrómák egyike, amely a jelenlegi ajánlások szerint a májtranszplantáció indikációját képezi.
Fáradtság
A betegek gyakran számolnak be fáradtságról (több mint 50%-uk) és amikor ez súlyos (a betegek 20%-ában), akkor az életminőség romlásának fontos faktora (19, 172–178). Perifériás és centrális komponensei vannak: a centrális fáradtság gyakran társul a kognitív funkciók romlásával (memóriazavar és koncentrációs képesség csökkenése), amely összetéveszthető a hepatikus encephalopathiával (176, 177). A fáradtság nem függ össze a májbetegség súlyosságával, kivéve a végstádiumot, aminek természetes velejáró (178). Általában nem reagál UDCA- vagy OCA-kezelésre (6, 109). Ezért a fáradtság kezelésének megközelítése a háttérben álló betegség kezelésével párhuzamosan kell történjen, mint a viszketés esetén is. A PBC-s betegek jellemzően fáradtságot tapasztalnak transzplantációt követően is, ezért a súlyos fáradtság (egyéb indikáció hiányában) nem indokolja a májtranszplantációt (178). Ezen a területen a jó minőségű klinikai tanulmányok korlátozott számban érhetőek csak el, valamint nincs engedélyezett kezelés. PBC-ben a fáradtság, mint más krónikus betegségben, eredendően komplex természetű (179). Fontos a fáradtság mértékének és hatásainak mennyiségi meghatározása (mint pl. a PBC-40 életminőség-mérő kérdőív segítségével) (3. A ábra), a hozzájáruló tényezők felderítése, és a betegek segítése, hogy megbirkózzanak ezek hatásaival (179). Az újabb adatok azt mutatják, hogy fáradtság esetén a társadalmi elszigetelődés súlyosbíthatja az életminőség csökkenését PBC-ben. Ezt figyelembe kell venni a kezelési stratégia kialakításánál. A fáradtság észlelésekor fontos, hogy azonosítsuk az egyéb, PBC-hez közvetlenül vagy közvetve kapcsolódó betegségeket, tüneteket és kezelési lehetőségeket. Ilyenek például az egyéb autoimmun kórképek, mint a hypothyreosis vagy az autoimmun anémiák, valamint a nem autoimmun társbetegségek és ezek kezelése, mint a 2-es típusú cukorbetegség és a magasvérnyomás-betegség (180). Az éjszakai viszketés, autonóm diszfunkció, dehidráció, nyugtalanláb-szindróma és bizonyos gyógyszeres kezelések (mint pl. béta-blokkolók) mind a fáradtság fokozódásának additív tényezői lehetnek. Nem ismert, hogy a fizikai aktivitás vagy az inaktivitás káros hatású-e a PBC-s, fáradt betegeknél. Vannak ugyanakkor arra utaló előzetes adatok, hogy a szervezett tornagyakorlatok előnyösek lehetnek, amennyiben olyan szinten kezdjük el felépíteni azokat, amit a fáradt betegek tolerálnak (181). A modefenilt, mint kezelési lehetőséget alkalmazzák, azonban ennek használata csak alvásproblémával diagnosztizált betegekben lehetséges.
Sicca szindróma
A sicca komplex gyakori PBC-ben (180, 182). A tüneteihez tartozik a szemszárazság és/vagy szájszárazság. A legtöbb betegnek inkább sicca tünetei vannak, mint sem elsődleges Sjögren-szindrómája. Egyéb tünetek is idesorolhatók, mint a nyelési nehezítettség, vagy a hüvelyszárazság. A klinikusnak célzottan rá kell kérdeznie ezekre a tünetekre. A műkönny és a műnyál gyakran segít. Ha a tünetek refrakterek, pilokarpin vagy cevimelin (muszkarinreceptor-agonista) használhatók (183, 184). Súlyos szájszárazság esetén szájhigiénés tanácsokkal kell ellátni a beteget a fogszuvasodás megelőzése céljából. Súlyos szájszárazság esetén az orális candidiasis fokozott kockázatára is figyelni kell. A hüvelyi hidratálók segíthetnek, de az ösztrogénkrémeket az alapellátásban vagy nőgyógyászaton kell javasolni (hepatológiai szempontból alkalmazásukkal kapcsolatosan nem merül fel aggály). A sicca tünetek és Sjögren-szindróma kezelésével kapcsolatos további részleteket az ezzel kapcsolatos specifikus irányelvek tartalmazzák (185). A kezelésre nem reagáló tünetes betegeket szakembernek kell referálni, mivel újabb terápiák léteznek.
Vegyes
A PBC-s betegek akár egynegyedének is lehet Raynaud-tünete, amelyet a görcsös artériás összehúzódás okoz a végtagokon (általában a kéz és láb ujjain, de néha az orron és a füleken is) (180). A betegeket célzottan ki kell kérdezni a klasszikus tünetekről: a végtagok fehér, majd kék és végül vörös elszíneződése, amelyet gyakran kísér fájdalom/égő érzés/bizsergés, amikor a vérkeringés visszatér. Enyhe tünetek esetén a gyakorlati tanácsok, mint kesztyű viselése, kézmelegítő használata, hideg környezet kerülése gyakran elégségesek. Súlyosabb tünetek esetén vazodilatátorok, mint például kalciumcsatorna-blokkolók használhatók (186). Kifejezett tünetek esetén, és amennyiben az ujjak fekélyképződésének fokozott kockázata áll fenn specifikus reumatológiai szakvizsgálat szükséges. A PBC-s betegek kb. 8%-ában körülhatárolt szkleroderma figyelhető meg (CREST-szindróma: calcinosis, Raynaud-jelenség, nyelőcső-diszmotilitás, szklerodaktilia, teleangiectasia) (180). Ezen tüneteket keresni kell, és ha fennállnak, a beteg reumatológiai véleményezése szükséges.
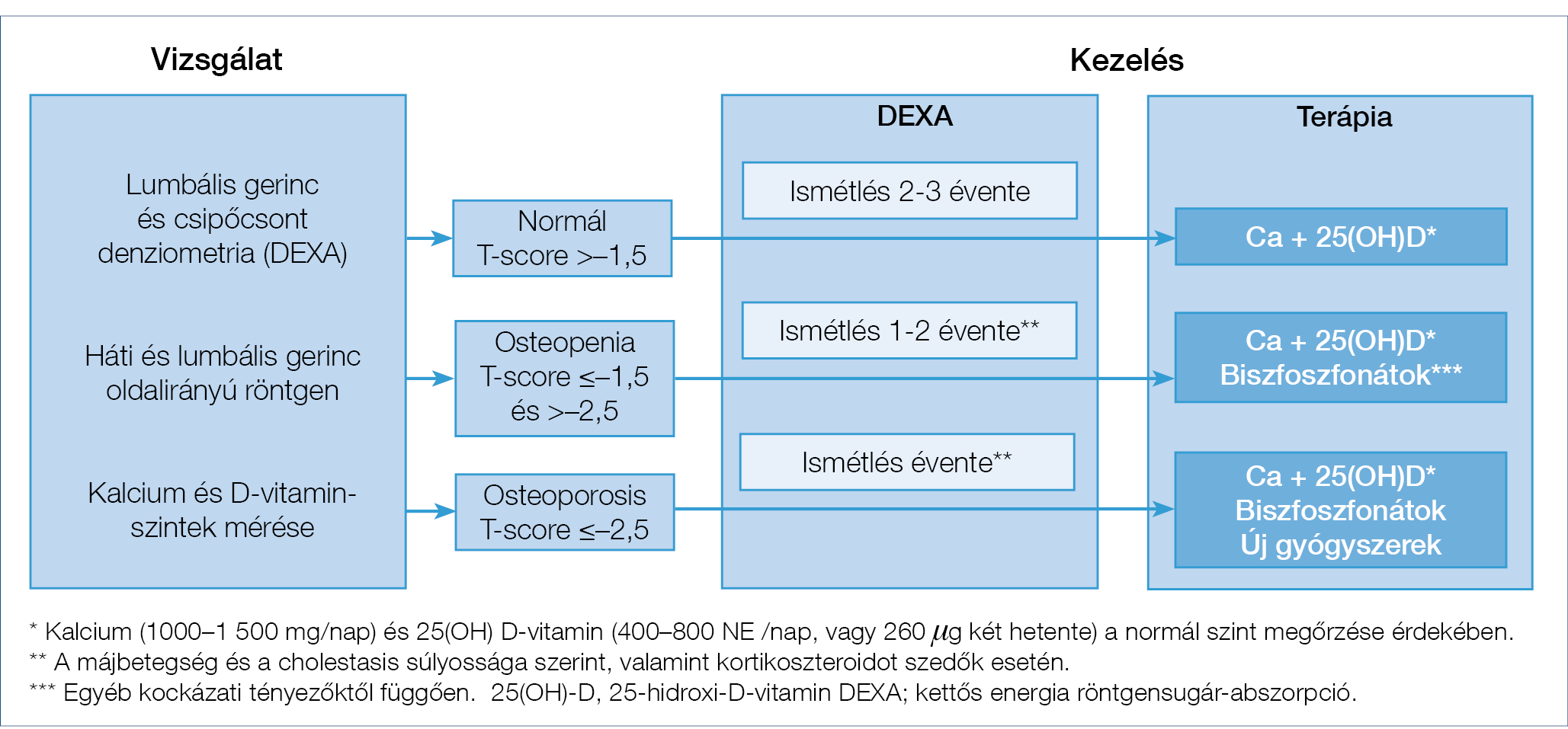
4. ábra: A csontbetegség vizsgálata és kezelése krónikus májbetegekben (191)
A májbetegség szövődményeinek kezelése
Osteoporosis
PBC-ben a kóros kalcium- és D-vitamin-metabolizmus azonosítását célzó laboratóriumi vizsgálatok elvégzése indokolt. Megfelelő életvitel és táplálkozás ajánlott a csontritkulás megelőzésére és kezelésére, továbbá az egyéb kockázati tényezők visszaszorítása (mint pl.: dohányzás és alkoholfogyasztás abbahagyása, saját testsúlyos edzés). Kalcium (ha nincs az anamnézisben vesekövesség) és D-vitamin pótlása szükséges. Napi 1000-1500 mg kalciumot és napi 400-800 NE, vagy kéthetente 260 mg 25(OH) D-vitamint kell pótolni, vagy annyit, amennyi a normális szint eléréséhez szükséges. Különösen fontos ez azoknál, akik epesavkötő gyantát kapnak, amelynek használata csökkentheti a D-vitamin bélből való felszívódását. Normál tápláltságú betegeknél, akiknél a kalciumfelszívódás nem károsodott (mint pl.: savcsökkentés vagy alultápláltság következtében), a kalcium pótlása nem ajánlott.
A csontritkulás gyakori szövődmény PBC-ben (187, 188), azonban a kockázat pontos mértéke egyelőre nem tisztázott, függ a vizsgált betegpopulációktól és a diagnosztikus kritériumoktól. Osteoporosis és az osteomalacia megítélésére csont ásványianyag-sűrűség (bone mineral density, BMD) meghatározása javasolt. Aranystandardja a lumbális gerinc és a csípő vizsgálata. Az Egészségügyi Világszervezet (WHO) ajánlása szerint osteoporosis akkor áll fenn, ha a BMD a fiatalokra jellemző értéktől 2,5 standard deviációnyival alacsonyabb (T-score ≤–2,5) és osteopenia, ha a T-score –1 és –2,5 között van. Súlyos osteoporosisra utal, ha a denzitometriás értékek a fentieknek megfelelnek és a betegnek egy, vagy több spontán csonttörése volt (189).
A csigolyatörés kizárása céljából a dorsalis és lumbális gerinc esetén az oldalirányú röntgen (RTG) elvégzése is szükséges (190). A csont turnover metabolikus markereinek meghatározása elsősorban a terápia hatékonyságának monitorozására alkalmas.
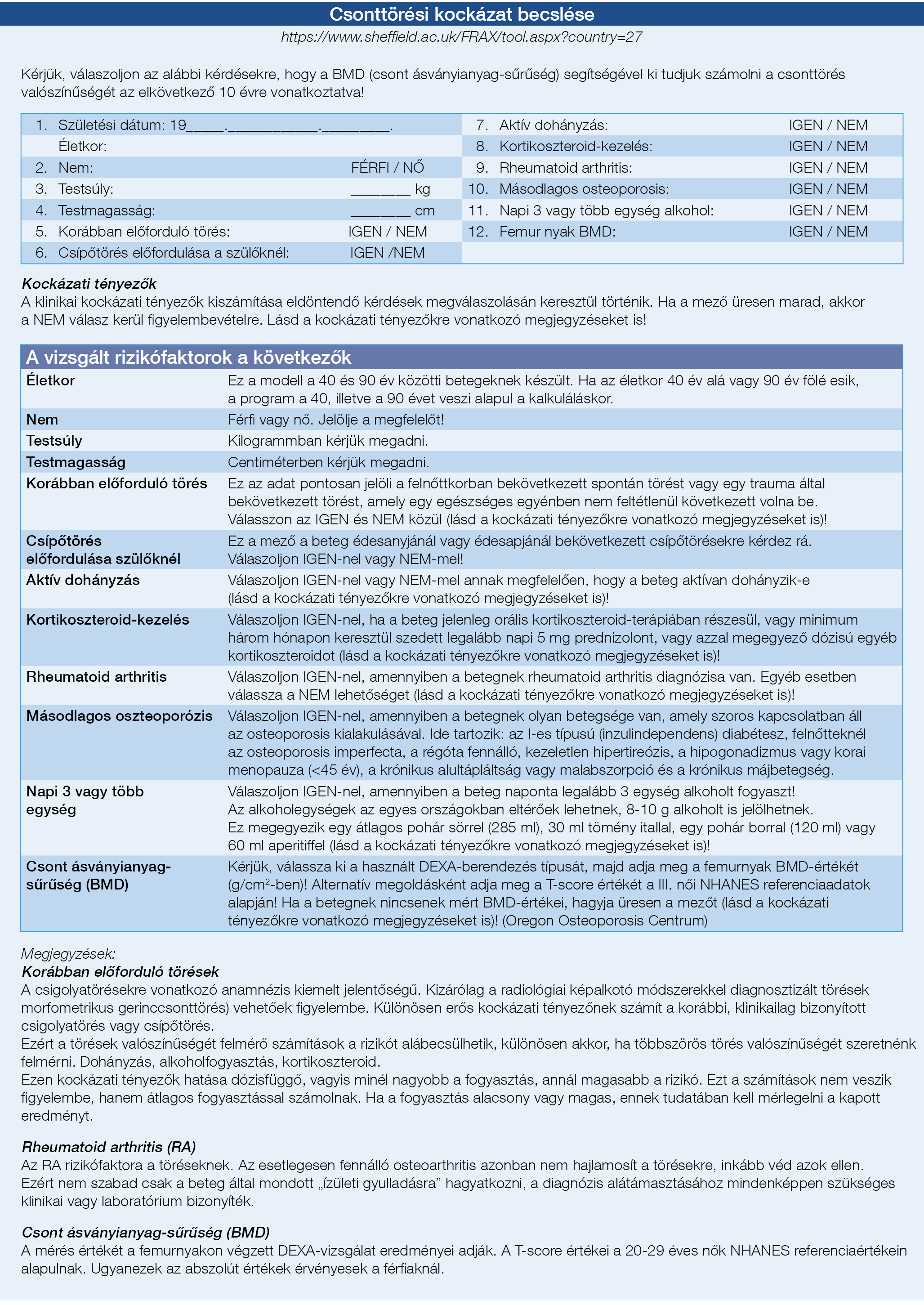
Az EASL nemrégiben megjelent A krónikus májbetegek táplálásterápiája CPG-je részletesen foglalkozik az osteopenia és az osteoporosis kezelésével, amelyet a 4. ábra foglal össze (191). A DEXA-vizsgálat eredménye hasznos iránymutató a kezeléshez és elvégzendő a betegség jelentkezésekor, valamint 1-5 évente újraértékelendő a betegség lefolyásától és az általános osteoporosis rizikótól függően (192). Mivel a –1,5-es T-score érték esetén magas a csípő-, és csigolyatörések kockázata, ajánlott a gyakorlatban ezt egy olyan határértéknek tekinteni, amely esetén a specifikus kezelést el kell kezdeni (193). Minden csontritkulás-irányú beavatkozás esetén figyelembe kell venni továbbá az összetett csonttörési kockázatot is, amely a WHO FRAX-pontszám alapján számolható ki (http://www.shef.ac.uk/FRAX/), például (5. ábra). Az osteoporosis kialakulásának kockázati tényezőit a 4. táblázat foglalja össze. Számos vizsgálat igazolta, hogy a biszfoszfonátok, különösen a hetente adott alendronát és a havonta adott ibandronát, hatékonyak a csonttömeg növelésében PBC-s betegekben (194). A szájon át szedhető nitrogéntartalmú biszfoszfonátok felső tápcsatornai gastritist vagy oesophagitist okozhatnak, emiatt óvatosan alkalmazandók nyelőcsővarixszal rendelkező betegek esetén; ilyen betegeknél parenterális biszfoszfonátok (mint pl.: pamidronát, ibandronát, vagy zolendronát) adása megfontolandó (195). Hormonpótló kezelés (transzdermális ösztrogén) hatékony a menopauza utáni nőbetegekben, anélkül, hogy a máj vonatkozásában mellékhatása lenne (196).
4. táblázat Az osteoporosis kialakulásának kockázati tényezői krónikus májbetegség esetén (191)
- Rendszeres, jelentős alkoholfogyasztás
- Dohányzás
- 19 kg/m2 alatti testtömegindex
- Férfi hipogonadizmus
- Korai menopauza
- Hat hónapnál hosszabb szekunder amenorrea
- Osteoporotikus csonttörés a családi anamnézisben
- Kortikoszteroid-kezelés (≥5 mg/nap dózisú prednizolon legalább 3 hónapon át)
- Előrehaladott életkor
Zsíroldékony vitaminok pótlása
A PBC-s betegeket érintő epepangás és az ezt követő csökkent epesavszekréció a lipidmalabszorpció fokozott kockázatát eredményezheti. A zsíroldékony A-, D-, E- és K-vitaminok hiánya azonban ritka PBC-ben (197–199). A legtöbb PBC-s betegben a 25-hidroxi-D-vitamin és az 1-25-dihidroxi-D-vitamin szérumszintje normális, azoktól a betegektől eltekintve, akiknél elhúzódó sárgaság van jelen, akik májtranszplantációra várnak, vagy osteomalaciában szenvednek. Gyermekekben fokozottabb a zsír- és a zsíroldékony vitaminmalabszorpció azokhoz a felnőttekhez képest, akiknél epepangás áll fenn. PBC-s betegeknél rutinszerűen a D-vitamin és az INR-érték meghatározására ajánlott. A más egyéb zsíroldékony vitaminok szintjének mérése bár az EASL szerint szintén ajánlott, Magyarországon csak térítéses betegellátás keretei között lehetséges. A zsíroldékony vitaminok pótlását már kisebb mértékű csökkenés esetén is el kell kezdeni különösen, ha sárgaság is jelen van. Súlyos epepangás esetén INR>1,5 profilaktikusan minden invazív beavatkozás előtt K-vitamin-pótlás szükséges. Vérzés esetén az érvényben lévő, erre vonatkozó útmutatók szerint kell eljárni (200).
Hyperlipidaemia
A PBC-s betegek akár 80%-ában is emelkedettek lehetnek a szérumvérzsírok (35); a háttérben álló mechanizmus azonban eltér az egyéb okból kialakuló hyperlipidaemiától. Korai betegségben a VLDL és az LDL koncentrációjának emelkedéséről számoltak be, valamint szignifikánsan emelkedett HDL-értékekről. A betegség progressziója során az LDL tovább emelkedhet, azonban a HDL-értékek csökkennek (habár a kontrollhoz képest így is emelkedettek maradhatnak). A trigliceridérték általában normális, vagy enyhén emelkedett. Néhány esetben az LDL-szaporulat rendellenes lipoprotein-részecskéből áll (lipoprotein-X), amely szabadkoleszterinben és foszfolipidekben gazdag, valamint anti-aterogén (201). Klinikailag jelentős, hogy a HDL-koleszterin emelkedett, míg az LDL-koleszterin nem, és a PBC-s betegekben az érelmeszesedés okozta halálozás kockázata nem fokozott, míg a PBC nélküli, emelkedett vérzsírral rendelkező betegek esetében igen (35, 36, 37) PBC-s betegekben a hyperlipidaemia rutinszerűen nem kezelendő, azonban akiknél egyidejűleg a klasszikus kardiovaszkuláris rizikófaktorok is fennállnak, a terápiát a normál gyakorlatnak megfelelően kell alkalmazni. Ahol a klinikai kétség megmarad, lipidológiai szakvizsgálat indokolt lehet.
Varixok
PBC-s betegekben a biliaris cirrózis következtében portális hipertenzió alakulhat ki (202, 203), ez pedig rossz prognózissal társul. Egyéb májbetegséggel ellentétben, a portális hipertenzió PBC-s betegekben a betegség korai és precirrotikus stádiumában is kialakulhat, a nodularis regeneratív hiperpláziával társulva, noha ez ritka (204). A nyelőcsővarixok és a varixvérzés kezelése PBC-s betegekben a Baveno-VI irányelvek szerint történhet (205). A szűrési, megelőzési és kezelési stratégiák az egyéb krónikus májbetegségben használt protokollokkal egyezően végzendők (205). Általánosságban klinikailag szignifikáns portális hipertenzióra utal, ha az májtömöttség ≥20 kPa vagy a vérlemezkeszám <150×109/l; ilyen betegeknél endoszkópos vizsgálat indokolt. A további teendőket – a vérzéses anamnézis és egyéb dekompenzációs jelenségek mellett – ennek eredménye határozza meg.
5. ábra: Csonttörési kockázat becslése (191)
Hepatocelluláris karcinóma
Mint a májcirrózis szinte bármely formájában, a PBC-s betegek esetén is az egyik legsúlyosabb szövődmény a HCC kialakulása. A HCC incidenciáját a diagnosztizált PBC-s betegek között 0,36/100 betegévre becsülik. A májbiopsziában észlelt magasabb szövettani stádium fokozott HCC-kockázatot jelentett PBC-s betegekben (206). Egy közelmúltban végzett 4565 PBC-s beteg hosszú távú megfigyelésén alapuló tanulmány 1000 betegévre 3,4 HCC eset incidenciát mutatott (8). A nemzetközileg reprezentatív betegcsoport vizsgálata azt is igazolta, hogy a férfinem, és az UDCA-kezelésre adott nem megfelelő válasz a HCC kialakulásának kockázati tényezője PBC-ben. Az EASL-irányelvek szerint májcirrózisos betegekben javasolt a HCC rendszeres szűrése hasi ultrahanggal (esetleg egyéb keresztmetszeti képalkotó módszerrel, alfa-fetoproteinnel [AFP] vagy anélkül), 6 hónapos időközönként (207).
Májtranszplantáció
Noha a PBC előfordulási gyakorisága nő, a PBC miatt szükséges májátültetés az elmúlt évtizedekben csökkent (208–210). A PBC-s betegek esetén a májátültetés indikációja az egyéb eredetű májbetegségekéhez hasonló. Májtranszplantáció szükségességét meg kell fontolni, ha
- jelentkeznek a májcirrózis szövődményei;
- ha a MELD-pontszám 15, vagy a fölötti;
- ha a bilirubinérték folyamatosan 51,3 mmol/l (3 mg/dl) fölé emelkedik (211);
- valamint válogatott esetekben, a gyógyszeres kezelésre nem reagáló, makacs viszketésben szenvedő betegekben (212, 213).
A májátültetés kimenetele általában kedvező, az 5 éves túlélési arány 80-85%, amely jobb, mint a májátültetés egyéb indikációi esetén (208–210). A tünetek, beleértve a fáradtságot, gyakran a májátültetést követően is fennállnak (178, 214). Májátültetés után a PBC visszatéréséről átlagosan a betegek 20%-ánál számoltak be (211, 215), azonban a szövettani kiújulás aránya valószínűleg magasabb (216). Az AMA-pozitivitás a májátültetést követően is fennmarad. A rekurrens PBC-diagnózis felállítása a máj szövettani vizsgálatát igényli, mivel a májenzimek akár normálisak is lehetnek (215). Az UDCA-val történő kezelés csökkenti a májenzimeket és csökkentheti a PBC-rekurrencia incidenciáját (216), azonban nincs elégséges bizonyíték, amely alapján abszolút ajánlást állíthatnánk fel a májátültetést követő UDCA alkalmazásra vonatkozóan. A májátültetést követő csontritkulást szintén proaktív módon kell kezelni.
A klinikai ellátási útvonal szervezése
Javasolt, hogy minden PBC-s beteget tervezett módon, élethossziglan kövessünk. Ugyanakkor fel kell ismerni azt, hogy az egyes betegeknél különböző a betegség lefolyása, ezért különböző fokú figyelmet igényelhetnek. Legalább évente egyszer történjen felülvizsgálat a májbetegség progressziója (labor, UH, elasztográfia is) és a tüneti státusz vonatkozásában. Fel kell mérni a kezelés eredményességét és az esetleges módosítás szükségességét mind a májbetegséget, mind pedig a társuló tüneteket illetően.
A klinikai ellátás standardjai
A felülvizsgálat alapvető eszköz a helyi szinten történő ellátás hozzáférésének javításában. Ezidáig a PBC-s betegek kezelésével kapcsolatban nincsenek olyan elfogadott felülvizsgálati standardok, amelyek a helyi minőségfejlesztési programok kialakítására használhatók lennének. A bonyolultabb ellátási szemléletek megjelenése azonban ezt egyre fontosabbá teszi. A dokumentumban szereplő útmutatások alapján a következő szabványokat javasolják a szakaszos végrehajtáshoz, a helyi erőforrások és az aktuális gyakorlat szerint.
- Az epepangás egyéb okainak kizárására minden PBC-gyanús beteg esetén hasi ultrahangot kell végezni az alapkivizsgálás részeként (Elvárt, 90%).
- Az UDCA napi 13–15 mg/kg dózisban ajánlott első vonalban történő kezelésként minden PBC-ben szenvedő betegnél. (Elvárt, a betegek 90%-a megfelelő dózisú terápiában részesül vagy az intolerancia rögzítésre kerül a betegdokumentációban.)
- A progresszív betegséglefolyás kockázatának kitett betegek azonosításának megkönnyítése érdekében egyénre szabott kockázatbecslést kell végezni az egyéves UDCA-kezelést követően, biokémiai válaszmutatók alkalmazásával. (Elvárt, az UDCA-kezelésben részesülő betegek 80%-ánál szükséges a terápiás válasz és az alkalmazott kritérium dokumentálása.)
- A betegség életminőségre (QoL) gyakorolt hatás jelentősége miatt, valamint a megfelelő kivizsgálás és a kezelés biztosítása érdekében minden betegnél fel kell mérni a tüneteket, különösen a viszketés, a sicca komplex és fáradtság jelenlétét. (Elvárt, az elmúlt évben a betegek 90%-ának legyen a viszketés, sicca komplex és fáradtság jelenléte/hiánya rögzítve a betegdokumentációban.)
- Annak érdekében, hogy minden beteg esetén biztosítsuk a májátültetés időben történő megfontolásának lehetőségét, amennyiben a bilirubinszint >51,3 mmol/l
(3 mg/dl), vagy már kialakultak a dekompenzált májbetegség jelei (varixvérzés, ascites, encephalopathia, mással nem magyarázható hypalbuminaemia vagy megnyúlt INR alapján CP-B vagy C, MELD >15), megbeszélést kell folytatni olyan hepatológussal, akinek közvetlen hozzáférése van a májtranszplantációs programhoz. (Elvárt, a betegdokumentáció 90%-ában szerepel, hogy a jellegzetes klinikai események bekövetkezését követően a megbeszélésre 3 hónapon belül sor került, és rögzíteni szükséges a végrehajtott intézkedéseket is.) - Az osteoporotikus csonttörések megelőzésének érdekében minden PBC-s betegnél el kell végezni az osteoporosisra vonatkozó kockázatbecslést. A kezelést és a követést a nemzeti irányelvek szerint kell végezni. (Elvárt, 80% esetén volt értékelés 5 éven belül.)
- Az időben történő, de átgondolt diagnózis és kezelésbiztosítása érdekében az AIH jellemzőivel társuló PBC-t ritka kórképnek kell tekinteni, és ha felmerül ennek a gyanúja, akkor májbiopszia elvégzése szükséges a diagnózis felállításához, amit gyakorlott klinikopatológusnak kell értékelni. (Elvárt, a betegek 90%-ánál, akiknél az AIH jellegzetességeivel társuló PBC-t diagnosztizálnak, májbiopsziával történő megerősítés és klinikopatológiai megbeszélés szükséges, amelyet a betegdokumentációban rögzíteni kell.)
A betegek támogatása
Célja, hogy az érintettek betegségüket ne éljék meg negatív élményként. Ehhez a tudás és az információ átadása szükséges a betegek szintjén, valamint a pozitív megközelítés és a következetesség (217). Fontos lenne magyar nyelvű betegtájékoztató összeállítása, mint ahogyan az Nyugat-Európában elérhető a különféle betegszervezeteknél.
A fáradtság az a tünet, amely a legnagyobb hatással van a betegekre. A kimerült betegek életminősége rossz, valamint kevésbé keresik a társas kapcsolatokat (19, 20). Kevés szakirodalom áll rendelkezésre a PBC-betegek társadalmi elszigeteltségével és a támogatási mechanizmusok fejlesztésével kapcsolatosan. Hasznos lehet a pszichológiai megközelítés, mint például a kognitív viselkedésterápia. Fontos, hogy a fáradtsággal járó, mély pszichés szorongással küzdő beteg megfelelő pszichológiai segítséghez jussanak. Fontos lehet továbbá a kiegészítő családi támogatás nyújtása is.
Következtetés
A PBC a krónikus epepangás gyakori oka, különösen a 40 év feletti nők esetében. A betegség progressziója végstádiumú májbetegség kialakulását eredményezheti, amelynek különféle, a kezelést megelőző és a kezelés alatti kockázati tényezői ismertek. A diagnózist biokémiai és szerológiai vizsgálatok alapján lehet felállítani – egyéb etiológiák kizárása, vagy egyidejű igazolása mellett. A diagnóziskor és a kezelés során is minden beteg esetén fel kell mérni a betegség stádiumát, és a progresszió egyéni kockázatát. Utóbbiban fontos szempont az elsővonalbeli (és általánosan alkalmazandó) UDCA-kezeléssel összefüggő biokémiai válasz. Az UDCA-ra nem kielégítő biokémiai választ adók számára – jelentős megkötésekkel és gondos szakmai mérlegelés alapján – másodvonalbeli szerként használható az OCA. PBC-ben folyamatosan figyelmet kell fordítani, nemcsak a végstádiumú májbetegség megelőzésére és szövődményeinek kezelésére, hanem az olyan párhuzamosan fennálló tünetek észlelésére és kezelésére is, mint például a viszketés, a sicca komplex és a fáradtság. A kezelési irányelvek megkönnyítik a PBC-ben szenvedő betegek kezelésének holisztikus, élethosszig tartó kezelését. A gondozási útvonalakat helyileg kell kidolgozni a betegek igényeit figyelembe véve. Ezeket pedig független minőségértékelésnek lehet alávetni.
EASL-ajánlások
- Cholestaticus májbetegségre utaló laboreltérések esetén a részletes kórtörténet felvétele és a fizikális vizsgálat javasolt (III, 1).
- Az elsővonalbeli nem invazív vizsgálatként ultrahang végzendő az intrahepatikus és extrahepatikus cholestasis elkülönítésére (III, 1).
- Minden tisztázatlan eredetű cholestasis esetén az AMA és a PBC-specifikus ANA immunfluoreszcens módszerrel történő szerológiai vizsgálatok elvégzése javasolt (III, 1).
- Tisztázatlan eredetű cholestasis esetén MRCP elvégzése javasolt. Disztális epeúti betegségek vizsgálatára az EUS egy alternatíva lehet (III, 1).
- Szerológiai és kiterjesztett képalkotó vizsgálatok ellenére is tisztázatlan intrahepatikus cholestasis esetén megfontolandó a májbiopszia elvégzése (III, 1).
- Klinikailag felmerülő esetekben megfontolandó genetikai vizsgálatok elvégzése örökletes cholestaticus szindróma fennállásának igazolására erre specializálódott laboratóriumban (III, 1).
- Azon felnőttkori cholestasissal járó esetekben, akiknél nem valószínűsíthető szisztémás betegség fennállása, a PBC diagnózisa az emelkedett ALP-érték és az AMA >1:40 titer alapján felállítható (III, 1).
- A megfelelő kontextusban alkalmazva, az AMA-negatív PBC diagnózisa felállítható a cholestasis és specifikus ANA immunofluoreszcencia jelenléte (mag vagy magmembrán pontozottság) vagy WB/ELISA-pozitivitás (sp100, gp210) alapján (III, 1).
- A májbiopszia elvégzése a diagnózis felállításához nem javasolt, kivéve, ha a PBC-specifikus antitestek hiányoznak, AIH vagy NASH társulása merül fel, vagy egyéb (általában szisztémás) társbetegség van jelen (III, 1).
- Az AMA-pozitivitás önmagában nem elégséges a PBC diagnózisához. A normál májenzimekkel rendelkező, AMA-pozitív betegek esetén követés javasolt évenkénti laborvizsgálat formájában, májbetegség fennállásának megítélésére (III, 1).
- A kezelés célja PBC-ben a májbetegség végstádiumú komplikációinak megelőzése és a társult tünetek kezelése (III, 1).
- Minden beteg esetén javasolt a progresszív betegségforma kialakulásának kockázatát értékelni (III, 1).
- A szövődményes PBC kialakulásának kockázata azon betegek esetén a legnagyobb, akiknél nem megfelelő a kezelésre adott biokémiai válasz, és akiknek májcirrózisa van (II-2,1).
- A nem megfelelő biokémiai válasz legjelentősebb kockázati tényezői a diagnóziskori fiatal életkor (<45 év), és a felismeréskori előrehaladott betegségstádium (III, 1).
- Minden betegnél a kiinduláskor, és a követés során is értékelni kell a betegség stádiumát, kombinált nem-invazív tesztek alkalmazásával (bilirubin, ALP, GOT, albumin, vérlemezkeszám, és elasztográfia) (III, 1).
- PBC-ben az emelkedett szérumbilirubin és ALP-szintek, mint kiemelkedő jelentőségű markerek használandók a betegség kimenetelének megítélésére. A rutin biokémiai és hematológiai mérőszámokat is használni kell, hogy megerősítsék a klinikai megközelítést a betegség progressziójának egyéni kockázatbecslésében (II-2,1).
- A korai stádiumú betegek (egy év UDCA-val való kezelést követően ALP <1,5×ULN és normál bilirubinérték) transzplantációmentes túlélése nem különbözik jelentősen az egészséges kontrollpopulációtól (II-2,1).
- Elasztográfia és/vagy kockázatbecslő pontrendszerek (mint például a GLOBE- és UK-PBC-pontrendszer) használata javasolt a jövőbeni előrehaladott májbetegség szövődményeinek kialakulására vonatkozó egyéni kockázat pontosabb meghatározására (III, 1).
- Elsővonalbeli kezelésként UDCA javasolt minden PBC-s betegnek, 13-15 mg/kg/nap dózisban szájon át alkalmazva. Az UDCA-kezelést általában élethosszig folytatni kell (I, 1).
- Egy III. fázisú vizsgálat során a szájon át alkalmazott OAC biokémiai hatékonyságát igazolták olyan betegeknél, akiknél az ALP >1,67×ULN és/vagy a bilirubin <2×ULN emelkedett. Az orális OCA-kezelést feltételesen jóváhagyták PBC-betegek kezelésére, UDCA-val kombinációban azon esetekre, akik nem megfelelően reagáltak az UDCA-ra, vagy monoterápiaként azon betegekben, akiknél UDCA-intolerancia észlelhető. Az EASL ilyen betegek esetén javasolja az OCA használatának megfontolását (nem cirrózisos betegeknél kezdeti dózis 5 mg; dózistitrálás 10 mg-ra hat hónap alatt, a tolerabilitásnak megfelelően) (I, 2)
- Az UDCA-val kombinált budezonid (nem májcirrózisos betegekben) vagy bezafibrát, alkalmazását vizsgáló III. fázis, randomizált tanulmányok adatai még nem ismertek, az EASL nem tud állást foglalni a használatuk tekintetében (II-2, 2).
- Nem cirrózisos PBC-s betegben a terhesség kedvező kimenetele várható. Szakemberrel történő konzultáció azonban feltétlenül javasolt minden várandós beteg esetén a terápia vezetésével kapcsolatosan. Az UDCA-kezelés alkalmazásának folytatása javasolt a terhesség alatt, habár az ezt támogató adatok korlátozottak. Fontos a viszketés kezelése, ami szakember tanácsát igényelheti. Megjegyzendő, hogy a rifampicint használták már a harmadik trimeszterben (III, 1).
- Májcirrózisos betegeknél a terhesség az anyai és magzati komplikációk magasabb kockázatával jár. Már a tervezett terhesség idején javasolt a konzultáció, a terhesség alatt pedig mindenképpen tapasztalt hepatológus által végzett követés indokolt (III, 1).
- PBC-s betegekben az esetek kb. 10%-ában AIH-ra jellemző tünetek jelenhetnek meg, leggyakrabban egyidejűleg, de néha egymást követően, akár évekkel a PBC diagnózisát követően. AIH gyanúja esetén kötelező a májbiopszia elvégzése az AIH jellemzőinek megerősítésére, és megfontolandó olyan betegeknél is, akiknél aránytalanul emelkedett az ALT és/vagy az IgG-szint (III, 1).
- Azon PBC-s betegeknek, akiknél az AIH típusos tünetei jelen vannak, az UDCA mellé adott immunszuppresszív terápia hasznos lehet. Immunszuppresszív kezelés javasolt súlyos interface hepatitist mutató betegeknél, és megfontolandó mérsékelt interface hepatitissel rendelkező betegnél is. A betegek tájékoztatása szükséges az immunszuppresszív gyógyszerek mellékhatásairól (III, 2).
- Minden beteg esetén javasolt a tünetek, különösen a viszketés, sicca komplex és a fáradtság jelenlétének felmérése. Míg a végstádiumú májbetegség általában a tünetek fokozódásával jár, a tünetek súlyossága nem feltétlenül korrelál a PBC-betegség stádiumával (III, 1).
- A viszketés kezelésének lépcsőzetesnek kell lennie. A súlyos viszketéstől szenvedő betegeknél valószínű az agresszív ductopeniával járó PBC-variáns, ami rossz prognózisú. Az ilyen betegek szakmai központ felé történő referálása ajánlott (III, 1).
- Kedvező mellékhatásprofilja miatt – korlátai ellenére – a kolesztiramin alkalmazása javasolt a viszketés elsővonalbeli kezelésére. Fel kell hívni a figyelmet a más gyógyszerekkel való kölcsönhatás elkerülésére, amelyet az anionkötő gyanta tulajdonsága eredményez (II-2, 1).
- A viszketés másodvonalbeli kezelésére rifampicin ajánlott, általában napi 150-300 mg dózisban. A gyógyszer bevezetését követően (6 és 12 héttel), majd pedig a dózisemelést követően a májenzimek ellenőrzése javasolt a lehetséges hepatotoxicitása miatt. Amennyiben toxicitás észlelhető, a gyógyszert le kell állítani (II-2, 1).
- Keresni és kezelni kell a fáradtsággal összefüggő egyéb okokat, különösen az anémiát, hypothyreosist, és az alvászavart (III, 1).
- A fáradékony betegeknek (amely egyes esetekben erőtlenséggel jár) a különféle megküzdési stratégiák kialakítása tanácsolandó, beleértve a szociális elszigetelődés kerülését, amely súlyosbíthatja a fáradtságot (III, 2).
- A sicca tünetek jelentősek lehetnek, és ronthatják a betegek életminőségét; az ilyen betegeket a témában járatos szakembernek kell referálni (III, 1).
- A kezelésre nem reagáló Raynaud-tünetek esetén a beteget immunológushoz kell irányítani, a betegség súlyosságától függetlenül (III, 1).
- Minden PBC-s betegnél figyelembe kell venni, hogy fokozott osteoporosiskockázat áll fenn (III, 1).
- Az osteoporosisrizikó értékelésének részeként a csontsűrűség meghatározására DEXA-vizsgálat javasolt a PBC-diagnózis felállításának időpontjában, és a követés során is, amelynek időintervallumát az induló DEXA-lelet és a beteg osteoporosis rizikófaktorai határoznak meg (III, 1).
- Minden beteg esetén kalcium- és D-vitamin-pótlás javasolt (III, 2).
- A biszfoszfonátok biztonságosak és hatékonyak azoknak a PBC-s betegeknek a kezelésében is, akiknél jelentősen emelkedett az osteoporosis okozta csonttörési kockázat. Óvatosság indokolt azonban nyelőcsővarixok jelenléte esetén. A specifikus osteoporosis irányelvek követése javasolt a terápia indításakor (II-2, 1).
- PBC-s betegekben előfordulhat a zsíroldékony vitaminok hiánya, különösen elhúzódó sárgaság esetén. A pótlás szükségességét egyénileg kell mérlegelni (III, 2).
- A hyperlipidaemia az epepangás jellemzője, arra azonban nincs valódi bizonyíték, hogy fokozott kardiovaszkuláris kockázattal járna PBC-s betegekben. PBC és metabolikus szindróma társulásakor (magas koleszterin, alacsony HDL- és magas LDL-koleszterin-szintekkel) egyéni mérlegelés alapján koleszterincsökkentő gyógyszerekkel gyógyszeres kezelés javasolt; a kezelés nem kontraindikált (III, 2).
- A nyelőcső/gyomorvarixok szűrésére és kezelésére a Baveno-VI irányelvek alkalmazhatók PBC-s betegeknél is (III, 2).
- Májcirrózisos betegekben a HCC korai felismerésére az EASL ezzel kapcsolatos irányelvei érvényesek, PBC-s betegeknél is: elsősorban hasi UH-val (de egyéb keresztmetszeti képalkotó módszerrel is lehetséges) alfa-fetoproteinnel vagy anélkül 6 hónapos időközönként (III, 2).
- A betegek májtranszplantációs kivizsgálása szükséges, ha a májcirrózis dekompenzálódik, illetve szövődménye alakul ki, ha a betegségsúlyosság markerei, mint pl. folyamatosan emelkedett bilirubinérték (51,3 mmol/l vagy 3 mg/dl) vagy MELD-pontszám >15 észlelhető, vagy súlyos, kezelésre nem reagáló viszketés jelentkezik. A helyi (általában nemzeti) irányelvek követése javasolt a transzplantációs listára történő felterjesztéshez (II-2, 1).
- A májtranszplantációt követő rekurrens PBC-s betegekben (bizonyított vagy valószínűsített esetekben is) UDCA-kezelés javasolt, amely biztonságos és javíthatja a májenzim-értékeket (II-2, 2).
- Minden PBC-s beteget tervezetten, élethosszig szükséges követni, figyelembe véve, hogy a betegeknél különböző a betegséglefolyás és különböző fokú figyelmet igényelhetnek (III, 1).
- A PBC Ellátási Útvonala” dokumentum kidolgozása javasolt (III, 2).
- Előre meghatározott, strukturált klinikai eszközöket kell alkalmazni a PBC-betegek gondozása során a betegeknek nyújtott ellátás javításához és jobb dokumentálásához (III, 2).
- A PBC-ben szenvedő betegek tájékoztatása szükséges a betegtámogatási csoportok által nyújtott támogatási lehetőségekkel kapcsolatosan, ideértve a betegoktatási anyagokhoz való hozzáférést is (III, 2).
Köszönetnyilvánítás:
A munkát az EFOP-3.6.1-16-2016-00022, EFOP 3.6.2-16-2017-00006 és GINO P-2.3.2-15-2016-00048 projektek támogatják. Az EFOP projektek részben az Európai Unió és az Európai Szociális Alap finanszírozásában valósulnak meg.
Dr. Papp Mária a Magyar Tudományos Akadémia Bolyai János Kutatási Ösztöndíjasa (BO/00232/17/5) volt.
A közlemény „Az Innovációs és Technológiai Minisztérium ÚNKP-19-4 kódszámú Új Nemzeti Kiválóság Programja” szakmai támogatásával készült.
