Összefoglaló közlemények / Reviews
New opportunities for immunology in oncology therapy
Summary
Immunotherapy is the fifth pillar of anti-cancer therapy. Immune checkpoint inhibitors are the most successful immunotherapy treatments. Their mechanism of action is based on the inhibition of negative immune regulation. Identification and management of immuno-related side effects require complex thinking and skill. Combining immune checkpoint therapies with each other and with other modalities can further improve the results so far, and the future will be a combination therapy.
Az immunterápia a daganatellenes kezelés ötödik pillére. Az immunellenőrzőpont-gátlók a legsikeresebb immunterápiás kezelések. Hatásmechanizmusuk a negatív immunszabályozás gátlásán alapul. Az immunrendszer eredetű mellékhatások felismerése és kezelése komplex gondolkodást és képzettséget igényel. Az immunellenőrzőpont-terápiák egymással és más modalitásokkal való kombinációja tovább javíthatja az eddigi eredményeket, a jövő a kombinációs kezeléseké lesz.
Bevezetés
Évente emberek milliói halnak meg daganatos betegségben, így a daganatellenes terápia az egyik legnagyobb egészségügyi kihívás napjainkban. A hagyományos modalitások, mint a sebészet, sugárterápia, kemoterápia és célzott terápia mellett jelenleg az immunterápia a daganatellenes kezelés ötödik pillére. Ez egy új terápiás lehetőség, amely során a szervezet a saját immunrendszerét aktiválva fejti ki a daganatellenes hatást. A korábbi, hagyományos terápiákra rezisztens daganatok (pl. melanoma, tüdő-, hólyagrák) esetén is hatékony lehet. Az immunellenőrzőpont-gátlók a legeredményesebb immunterápiák, amelyek alkalmazhatók monoterápiaként, de kombinálhatók egymással és más kezelésekkel is (1, 2, 3).
Az immunterápia születése
Az első immunterápia William Bradley Coley, amerikai sebész nevéhez fűződik, akit az immunterápia „atyjának” is hívnak. Az 1890-es években szarkómás betegeken kísérletezett, ezen betegeket először virulens Streptococcus pyogenes-szel oltotta, majd miután két páciense is meghalt az előidézett fertőzés következtében, de a daganat regresszióját észlelte, elölt S. pyogenes és Serratia marcescens keverékével, az azóta Coley-toxinként híressé vált vakcinával folytatta kísérleteit. Több száz beteget tett ezáltal tumormentessé. Azonban sokan kritizálták, és mivel módszere nem volt megfelelően reprodukálható és standardizálható, valamint időközben a sugárterápia, majd a kemoterápia is gyorsan elterjedt, kiszorult az onkológiai gyakorlatból (4, 5).
Daganatellenes immunválasz
A hatékony daganatellenes immunválasz kialakulásához számos lépés szükséges, amelyeket összefoglaló néven tumorimmunitási ciklusnak nevezünk (6). Az immunrendszer daganatsejtekkel először annak keletkezési helyén találkozhat. Az antigénprezentáló sejtek (APC) feldolgozzák a tumorsejtekből kijutó fehérjéket. Nyirokutakon keresztül bejutnak a nyirokcsomókba, ahol a fő hisztokompatibilitási komplex (MHC) molekulákon keresztül bemutatják a tumorból származó peptideket a T-sejteknek. A megfelelő antigént felismerő T-sejtek ezáltal aktiválódnak és klonálisan felszaporodnak, majd a nyirokutakon, illetve a vérkeringésbe bekerülve eljutnak a primer tumorba és az áttétekbe is, ott beszűrik a daganatot, majd elpusztítják a felismert tumorsejteket. Optimális esetben ez a folyamat pozitív visszacsatolást generál, az elpusztult daganatsejtekből kiáramló antigéneket felismerik az APC-k, amelyek a nyirokcsomókban újabb T-sejteket aktiválnak, amelyek infiltrálják és pusztítják a tumort, és így tovább (6). Azonban a daganat megpróbál elbújni az immunrendszer elől T-sejtek működését gátló immunszuppresszív mikrokörnyezet kialakításával. A T-sejtek tehát a tumorellenes immunválasz főszereplői, amelyek aktivációs állapota az aktiváló és a gátló mechanizmusok (ellenőrzőpontok) arányától függ. A tumorsejtek képesek ezeket az ellenőrző útvonalakat befolyásolni, megváltoztatva ezáltal az immunválaszt (7, 8).
Immunterápiás lehetőségek
Coley után több mint száz évet kellett várni, hogy az immunterápia a daganatellenes kezelés részévé váljon. Jelenleg is vannak daganatellenes vakcinák, amelyek a dendritikus sejtek tumorantigénnel való feltöltését jelentik. Az adoptív sejtterápia olyan eljárások összefoglaló neve, amelyek lényege az autológ T-sejtek levétele, ex vivo tenyésztése és/vagy módosítása, majd a betegbe való visszajuttatása (9, 10). Ez hatékony terápiás lehetőség, de magas az eszközigénye és csak speciális centrumokban végezhető. A mindennapi rutinban azonban sokkal könnyebb – akár járóbeteg-ellátás keretében is – egy monoklonális antitest-terápiát alkalmazni (9). A daganat általi T-sejt-szuppressziót feloldó immunellenőrzőpont-gátlók bizonyultak a leghatékonyabb immunterápiának. Ennek jelentőségét és aktualitását mi sem bizonyítja jobban, mint az, hogy 2018. október 1-jén a Karolinska Intézet Nobel bizottsága a 2018. évi élettani vagy orvosi kutatásokért járó Nobel-díjat közösen James P. Allison amerikai és Hondzso Taszuku japán tudósoknak ítélte meg a negatív immunszabályozás gátlásán alapuló daganatterápia felfedezésért (11).
1. ábra: T-sejt-aktiváció és gátlás CTLA-4 és PD-1 által. A T-sejt-aktivációhoz az MHC-antigén-TCR kapcsolaton kívül a B7-CD28-kapcsolódás, úgynevezett kostimuláció is szükséges. A CTLA-4 egy T-sejt-receptor, a B7/CD28-család tagja, a T-sejt-aktivációhoz szükséges kostimulációt akadályozza meg, mivel nagyobb affinitással kötődik a B7-molekulához, mint a CD28-receptor, de ez a kapcsolat nem vezet aktiváló szignálokhoz, a T-sejt nem aktiválódik. A PD-1-receptor is a B7/CD28-család tagja. Ha a PD-1 a daganatsejteken lévő ligandumaihoz (PD-L1, PD-L2) kötődik, a T-sejt inkativált állapotba kerül
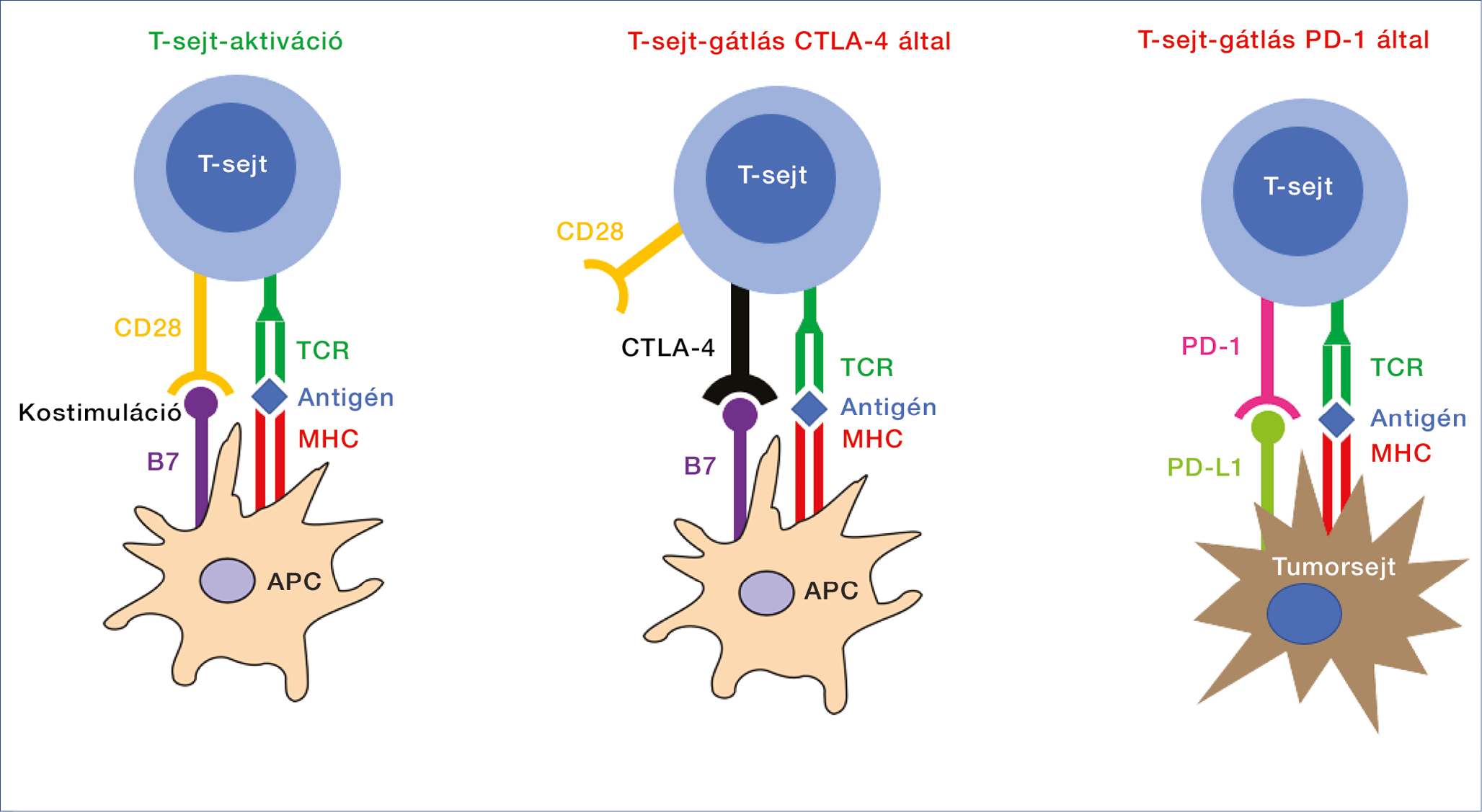
TCR: T-sejt-receptor; MHC: fő hisztokompatibilitási komplex; APC: antigénprezentáló sejt; CTLA-4: citotoxikus T-limfocita-antigén 4; PD-1: programozott sejthalál-fehéje-1; PD-L: programozott sejthalál-ligandum-1
Allison egy már korábban ismert fehérjét, a citotoxikus T-limfocita antigén-4-et (CTLA-4) vizsgált, ami egy immunfék. Felismerte, hogy a fék feloldásával felszabadítható az immunrendszer daganatsejteket megtámadó és elpusztító képessége. Ezzel egy időben (1990-es évek eleje) Taszuku felfedezett egy új fehérjét, a programozott sejthalál fehérje-1-et (PD 1) az immunsejteken. Azt találta, hogy ez is fékként működik, de hatásmechanizmusa különbözik az előzőtől (11).
Immunellenőrzési pontok
A T-sejtek aktivált állapotba kerüléséhez aktiváló szignálok jelenlétére és gátló szignálok hiányára van szükség (7, 8). Ezeket összefoglaló néven immunellenőrzési pontoknak („checkpoint”) nevezzük. Az immunellenőrző-pontok közül a két legfontosabb a CTLA-4 és a PD-1 útvonalak.
A CTLA-4 egy T-sejt-receptor, az immunrendszer természetes fékje. Szerepet játszik az autoimmun betegségek megelőzésében és a tumorgenezis alatti immunszuppresszióban (12). A nyirokcsomókban, a T-sejt-aktiváció kezdeti fázisában blokkolja a T-sejt aktivációt és proliferációt (13). A CTLA-4 a B7/CD28-család tagja, egy CD28 homológ. A T-sejt-aktivációhoz szükséges kostimulációt akadályozza meg, mivel nagyobb affinitással kötődik a B7-molekulához, mint a CD28-receptor, de ez a kapcsolat nem vezet aktiváló szignálokhoz, tehát egy kompetitív molekula (14). A CTLA-4 gátlása akadályozza a T-sejt-aktiváció és -proliferáció blokkolását, így potenciálisan növeli a T-sejtek képességét a tumorsejtek elpusztítására (1. ábra) (15).
2. ábra: T-sejt-aktiváció anti-CTLA-4, anti-PD-1 és anti-PD-L1 által. A T-sejtek működését gátló szignálok antitestekkel való blokkolása a T-sejtek aktivációjához vezet
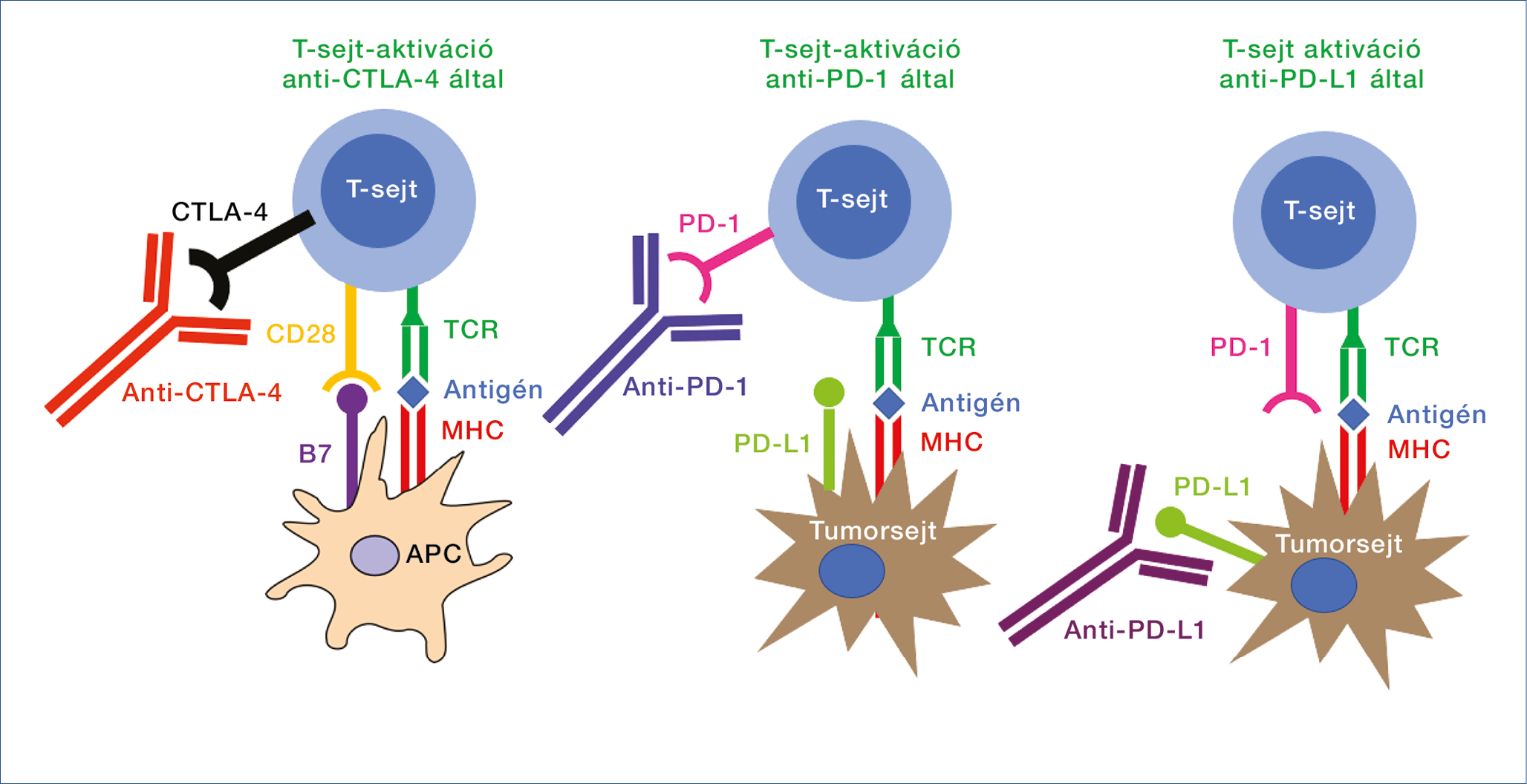
TCR: T-sejt-receptor; MHC: fő hisztokompatibilitási komplex; APC: antigénprezentáló sejt; CTLA-4: citotoxikus T-limfocita-antigén 4; PD-1: programozott sejthalál-fehéje-1; PD-L: programozott sejthalál-ligandum-1
A PD-1 ellenőrzési pont szintén egy T-sejt-receptor, amely a T-sejtek életciklusának egy későbbi szakaszában, a perifériás szövetekben, a tumor környezetében gátolja az effektor T-sejteket. A PD-1 is a B7/CD28-család tagja, de a T-sejteken kívül más immunsejteken is expresszálódik (14). Ha PD-1-receptor a daganatsejteken gyakran kifejeződő ligandumaihoz (PD-L1, PD-L2) kapcsolódik, a PD-1 útvonal a T-sejt-receptor (TCR) útvonallal együtt aktiválódva gátolja a T-sejtek proliferációját, citokintermelését, összességében a tumorellenes immunválaszt (1. ábra) (14, 16).
A két ellenőrzési pontot összehasonlítva mindkettő gátolja a T-sejtek aktivációját, proliferációját, citokintermelését, de más anatómiai helyen és az immunválasz különböző szakaszában fejtik ki a hatásukat. Míg a CTLA-4 a T-sejt-aktiváció kezdeti szakaszában a nyirokcsomókban, addig a PD-1 a T-sejt-aktiváció késői, végrehajtó fázisában a
perifériás szövetekben, a tumor környezetében gátolják a T-sejteket (8, 14).
Immunellenőrzőpont-gátlók
Az immunellenőrzőpont-gátlók olyan rekombináns humán vagy humanizált monoklonális antitestek, amelyek a T-sejt-gátló szignálokat blokkolva fokozzák a T-sejt mediált immunválaszt (2. ábra). Fiatal gyógyszerek az onkológiai palettán, 2011 óta alkalmazhatóak.
A CTLA-4-gátló ipilimumab (Yervoy®) volt az első checkpoint-inhibitor, amelyet az Egyesült Államok Élelmiszerbiztonsági és Gyógyszerészeti Hivatala (FDA) áttétes melanomában törzskönyvezett 2011. március 25-én. Jelenleg is ez az egyetlen FDA által törzskönyvezett CTLA-4-gátlónk, amely az Európai Gyógyszerügynökség (EMA) engedélyével is rendelkezik. Az alkalmazási köre az utóbbi időben gyarapodott, a nivolumabbal történő kombinációja révén (17).
A PD-1-blokkoló nivolumab (Opdivo®) és a pembrolizumab (Keytruda®) indikációja néhány év alatt robbanásszerűen bővült. A nivolumab adását már hat szolid tumoros indikációban (adjuváns és metasztatikus melanoma, fej-nyak laphámsejtes karcinóma, nem kissejtes tüdőrák, vesesejtes karcinóma, uroteliális karcinóma) engedélyezték (18).
Történelmi jelentőséggel bír, hogy az FDA 2017. május 23-án gyorsított eljárással törzskönyvezte a pembrolizumabot inoperábilis vagy metasztatikus mikroszatellita instabil vagy DNS mismatch repair deficiens (MSI-H/dMMR) szolid tumorokban a megelőző terápia hatástalanságát követően mind gyermekekben, mind felnőttekben. Ez volt az első olyan engedélyezés, amely független a daganat szövettani típusától és kiindulási helyétől (19). A korábbi szöveti altípusra alapozott törzskönyvezéssel szemben ez az első molekuláris profilra alapozott engedélyezés (19, 20). A pemrolizumab emellett alkalmazható inoperábilis vagy áttétes melanomában, gyomor, hólyag, máj, uroteliális, méhnyak-daganatokban, kissejtes és nem kissejtes tüdőrákban, és egy ritka, de nagyon agresszív bőrrákban, a Merkel-sejtes karcinómában (MCC) is (21).
A legifjabb PD-1-gátló cemiplimab 2018. szeptemberben került törzskönyvezésre áttétes, vagy olyan lokálisan előrehaladott bőr kután laphámsejtes daganatának kezelésére, ahol kuratív sebészeti beavatkozás, vagy sugárterápia nem jön szóba (22).
Az immunellenőrzőpont-gátlók legfiatalabb tagjait a PD-L1-blokkoló atezolizumab (Tecentriq®), avelumab (Bavencio®), és durvalumab (Imfinzi®) képviseli. Az atezolizumabot előrehaladott, ciszplatin kezelésre alkalmatlan vagy hatástalan hólyagrákban, 2019. március 8-tól már triple negatív emlőtumorban is, az avelumabot előrehaladott, platinatartalmú kezelésen progrediáló uroteliális karcinómában és áttétes MCC-ben, a durvalumabot pedig platinarezisztens előrehaladott uroteliális daganatban és nem kissejtes tüdőrákban alkalmazhatjuk (21, 23, 24).
1. táblázat: EMA és FDA által törzskönyvezett immunellenőrzőpont-gátlók
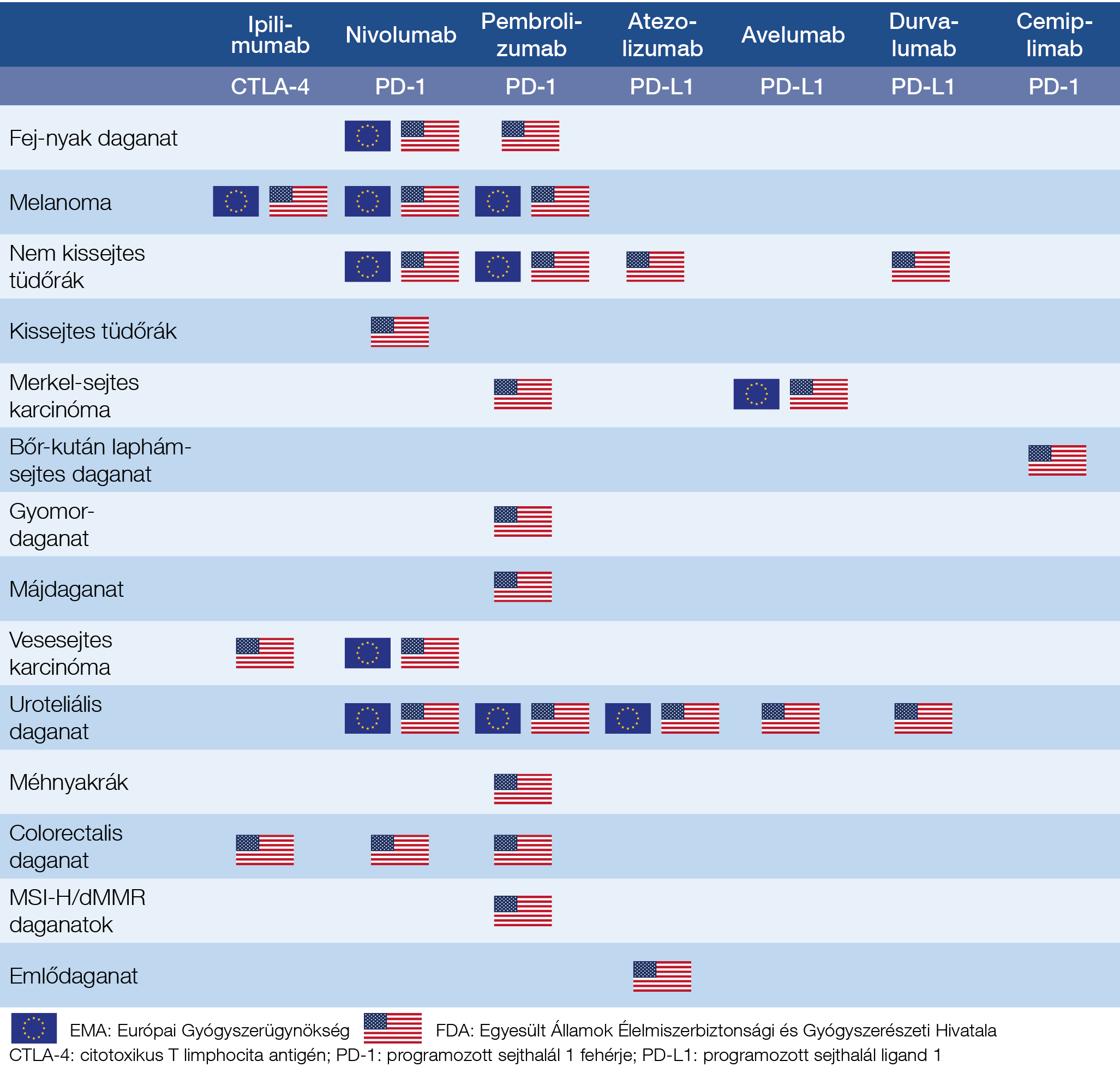
Az ipilimumab és nivolumab kombinációs kezelést inoperábilis vagy áttétes melanomában, vesesejtes karcinómában és MSI-H/dMMR metasztatikus, korábbi kezelésen progrediáló colorectalis daganatok kezelésére használhatjuk (17, 25, 26). A checkpoint-gátlók indikációit, valamint EMA és FDA engedélyéit az 1. táblázat foglalja össze.
Terápiás válasz
Az immunterápia a magas mutációs rátájú daganatok esetén lehet hatékony. A magas mutációs ráta következtében keletkező kóros fehérjék egy része neoantigénné válhat, amelyek fokozzák a daganatellenes immunválaszt. A megváltozott fehérjékből csak azokból lehetnek neoantigének, amelyek rendelkeznek antigéntulajdonságokkal és MHC-kötő képességgel (27). A legmagasabb szomatikus mutációs ráta a melanomában, tüdő, hólyagrákban igazolódott. Ezeknél a daganatoknál elsősorban exogén tényezők, mint az UV-sugárzás és dohányzás hatására fokozódik a mutációs aktivitás (28). Nem véletlenül ezekben a daganatokban kezdődtek el a legelső klinikai vizsgálatok. De vannak olyan daganatok (vastagbél, endometrium, petefészek, gyomordaganat) is, ahol DNS-hibajavító rendszer vagy rendszerek károsodása az elsődleges és a meghatározó (29). A DNS hibajavító fehérje mutációja (MSI-H) vagy inaktivációja (dMMR) következtében fokozódik a mutációs ráta, amely hatására növekszik a neoantigének mennyisége és ezáltal fokozható az immunrendszer aktivitása.
Mellékhatások
Az immunterápiás kezelések alkalmazása során szokatlan, a hagyományos (kemoterápia vagy célzott terápia) kezelések alatt nem észlelt mellékhatásokkal találkozhatunk. A mellékhatásokat az immunválasz túlaktiválódása nyomán bekövetkező autoimmun reakciók okozzák (11). Ezeket összefoglaló néven immunrendszer eredetű mellékhatásoknak nevezzük, amelyek leggyakrabban a bőrben, gyomor-bél traktusban, májban és az endokrin szervekben jelenhetnek meg. A grade 3-4 mellékhatások általában 10-20%-ban jelentkeznek (30). A CTLA-4-gátlóknál gyakoribbak a mellékhatások. A CTLA-4 és PD-1 kettős blokádja a szinergista hatás miatt emeli mind a mellékhatások előfordulási gyakoriságát, mind a súlyosságát (31).
Mellékhatások kezelése
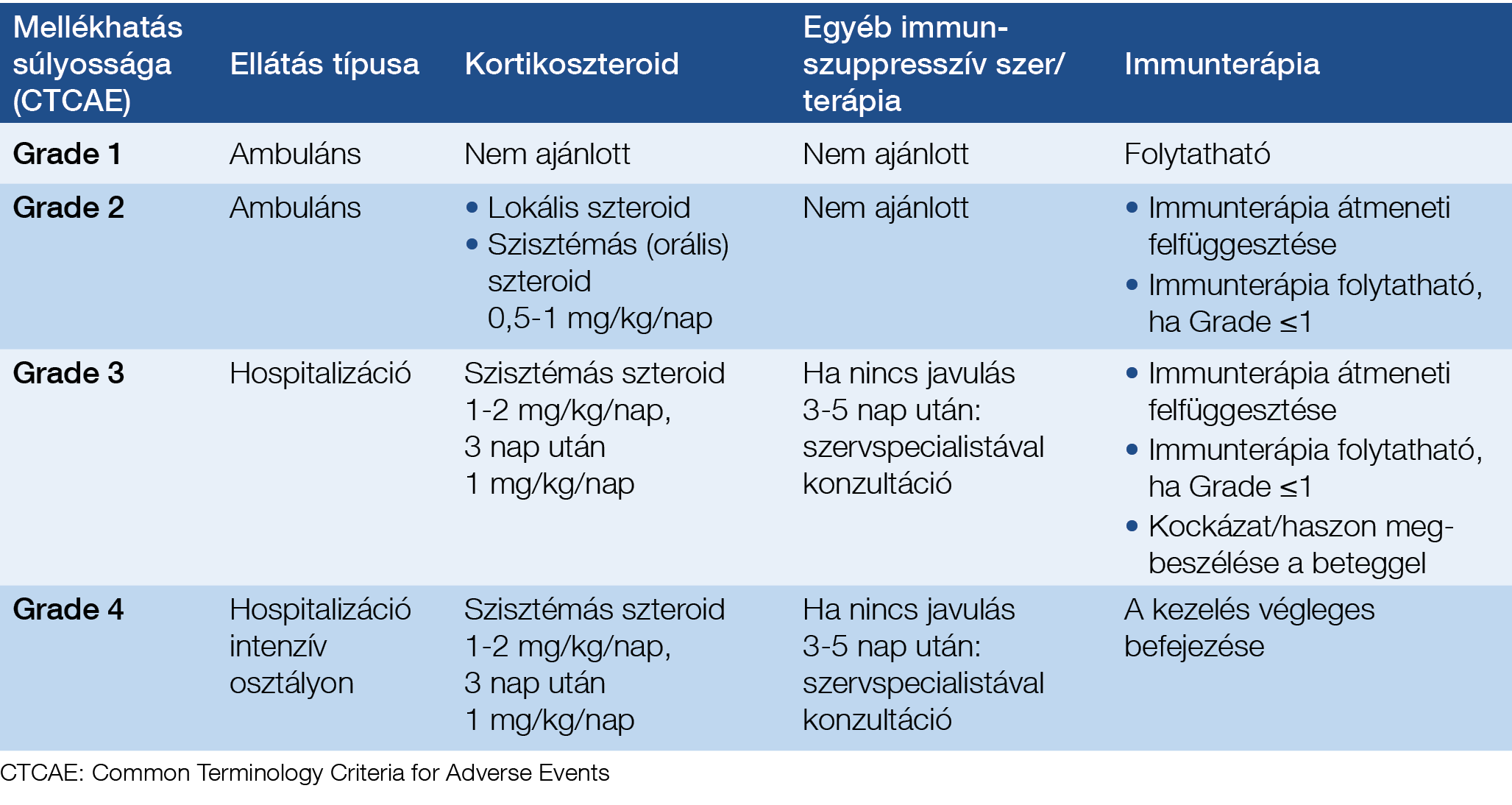
Az immunterápia okozta toxicitás kezelésének alapvető pillérei a megelőzés, a korai felismerés, az adekvát kezelés és az ellenőrzés (32). Ismernünk kell a terápia lehetséges mellékhatásait, fontos a megfelelő betegedukáció és a jó kommunikáció. Ha számítunk a mellékhatásokra, hamarabb felismerjük azokat. Ha felismertük a mellékhatást, el kell dönteni, hogy immuneredetű-e vagy sem, adekvát vizsgálatot kell végezni az etiológia megerősítése vagy az egyéb okok kizárása érdekében. Ezt követően mihamarabb meg kell kezdeni a célzott kezelést, a mellékhatás súlyossága alapján az immunterápia adását fel kell függeszteni, és kortikoszteroidokat kell alkalmazni. Ha nem észlelünk javulást a terápia ellenére, az adott társszakmát be kell vonni a kezelésbe, illetve egyéb immunszuppresszív terápiát kell alkalmazni (32). A betegeket folyamatosan ellenőrizni kell (az utolsó adag után legalább 5 hónapig), mivel az immuneredetű mellékhatások bármikor megjelenhetnek kezelés alatt vagy annak abbahagyását követően is. Az immunterápia adását minden olyan súlyos, visszatérő és bármilyen életveszélyes (grade 4) immunrendszeri eredetű mellékhatás esetén végleg abba kell hagyni (32). Az immunrendszer-eredetű mellékhatások felismeréséhez és menedzseléséhez tehát széles körű, interdiszciplináris gondolkodás és felkészültség szükséges. A mellékhatások súlyossága alapján történő kezelési irányelvet a 2. táblázat tartalmazza.
2. táblázat: Az immunrendszer eredetű mellékhatások súlyosság alapján történő kezelési irányelve
Hatékonyság-túlélés
Az immunterápia jelenti a legnagyobb áttörést az elmúlt évek rákkutatásában. A hagyományos kezelésekhez
képest kedvezőbb, tartós hatást érhetünk el, de csak a betegek egy részében. Szelektálás nélküli betegpopulációban ez 20% körül van. Szükség lenne az immunterápia hatását előjelző, megbízható, könnyen vizsgálható tumor- vagy immunológiai jellemzőkre, prediktív biomarkerekre, amelyekkel megjósolhatnánk, hogy mely betegek profitálhatnak leginkább ezen kezelésekből. PD-1/PD-L1-gátlók esetén az immunhisztokémiával kimutatható PD-L1-expresszió mértéke egy lehetséges biomarker (27),
a CTLA-4 ellenes terápia esetén viszont hiányzik ez a marker. Általánosságban az immunterápia hatását az immunaktivitás, a keringő és a tumort beszűrő immunsejtek mennyisége, valamint a daganatban detektálható mutációk mértéke befolyásolja.
A hagyományos kezelésekhez képest az immunterápia túlélési görbéjére jellemző, hogy az életben lévő beteg számát jelölő vonal egy idő után már nem süllyed tovább, hanem vízszintes lesz. Azok a betegek, akiknél hat az immunterápia, azok tartós túlélők lesznek. Az immunellenőrzőpont-terápiák egymással és más modalitássokkal való kombinációja tovább javíthatja az eddigi eredményeket, a jövő a kombinációs kezeléseké lesz (33).
Következtetések
A különböző hatásmechanizmusú immunterápiák közül az immunellenőrzőpont-gátlók bizonyultak a legeredményesebbnek, napjainkban forradalmasították a daganatok kezelését. Folyamatosan bővül mind a törzskönyvezett gyógyszerek, mind az új indikációk száma. Az immunrendszer eredetű mellékhatások felismeréséhez és megfelelő kezeléséhez széleskörű gondolkodás és képzettség, valamint a társszakmákkal való megfelelő együttműködés szükséges. A kombinációs kezelésekkel tovább fokozhatjuk a túlélést.
2. Kirkwood JM, et al. Immunotherapy of cancer in 2012 CA. Cancer J Clin 2012; 62: 309–335.
3. Murphy JF. Trends in cancer immunotherapy. Oncology 2010; 4: 67–80.
4. Coley WB. II. Contribution to the knowledge of sarcoma. Ann Surg 1891; 14: 199–220.
5. McCarthy E, The toxins of William B. Coley and the treatment of bone and soft-tissue sarcomas Iowa. Orthop J 2006; 26: 154–158. PMC1888599
6. Chen DS, Mellmann I. Oncology meets immunology: the cancer-immunitiy cycle. Immunity 2013; 39: 1–10.
7. Mellman I, et al. Cancer immunotherapy comes of age. Nature 2011; 480: 481–489.
8. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012 Mar 22; 12(4): 252–64. doi: 10.1038/nrc3239
9. Hammerbacher, et al. Informatics for cancer immunotherapy. Annals of Oncology 2017; 28 (Supplement 12): xii56–xii73. doi:10.1093/annonc/mdx682
10. Tátrai P. Daganatellenes T-sejt válasz – immunterápia ma és holnap. Klinikai Onkológia 2018; 5(3): 209–22.
11. https://www.nobelprize.org/prizes/medicine/2018/press-release/
12. Gabriel EM, Lattime EC. Anti-CTL-associated antigen 4: are regulatory T cells a target? Clin Cancer Res 2007; 13(3): 785–8.
13. Sharpe AH, Abbas AK. T-cell costimulation–biology, therapeutic potential, and challenges. N Engl J Med 2006; 355(10): 973–5.
14. Fésüs V. Az immunonkológia újdonságai szolid tumorok és haematológiai daganatok kezelésében-az immunellenőrzőpont gátlók. Magyar Onkológia 2017; 61: 116–125.
15. Korman A, et al. Tumor immunotherapy: preclinical and clinical activity of anti-CTLA4 antibodies. Curr Opin Investig Drugs 2005; 6(6): 582–91.
16. Parry RV, Chemnitz JM, Frauwirth KA, et al. CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Mol Cell Biol 2005; 25: 9543–9553.
17. https://www.drugs.com/history/yervoy.html
18. https://www.ema.europa.eu/medicines/human/EPAR/opdivo
19. www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm560040. htm
20. https://www.drugs.com/newdrugs/fda-approves-keytruda-pembrolizumab-first-cancer-any-solid-tumor-specific-genetic-feature-4538.html
21. https://www.cancerresearch.org/immunotherapy/timeline-of-progress
22. https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm 622251.htm
23. https://www.fda.gov/Drugs/InformationOnDrugs/ ApprovedDrugs/ucm 557162.htm
24. https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm 555930.htm
25.Lenz HJJ, Van Cutsem E, Limon ML, et al. Durable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first line therapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). Annals of Oncology 2018; 29(8).
26. Overman MJ, Lonardi S, et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repeir deficient/microsatellite instability-high metastatic colorectal cancer. J Clin Oncol 2018; 36: 773–779.
27. Tímár J, Ladányi A. A daganatok immunterápiájának prediktív markerei, a PD-L1 meghatározás gyakorlati kérdései. Magyar Onkológia 2017; 61: 158–166.
28. Lawrence MS, et al. Mutational heterogenety in cancer and the research for new cancer genes. Nature 2013 jul 11; 4997457: 214–218. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3919509/
29. Naboush A, Roman CA, Shapira I. Immune checkpoint inhibitors in malignancies with mismathc repair deficiency: a rewiew of the state of the current knowledge. J Investing Med 2017; 65: 754–758.
30. Landherr L. Az immunterápia mellékhatásai. Klinikai Onkológia 2016; 3(4): 241–247.
31. Palmieri DJ, Carlino MS. Immune checkpoint inhibitor toxicity. Curr Oncol Rep 2018; 20: 72.
32. Champiat S, Lambotte O, Barreau E, et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Annals of Oncology 2016; 27(4): 559–574. https://doi.org/10.1093/annonc/mdv623
33. Sharma P, Allison JP. Immune checkpoint targeting in cancer therapy: toward combination strategies with curative potential. Cell 2015; 161: 205–214.
