Esetismertetések / Case reports
Drug induced acute pancreatitis
Summary
Acute pancreatitis is one of the most common gastrointestinal disorders requiring hospital treatment. In Hungary 20-50 cases (per year per 100,000 inhabitant) are registered. Drug Induced Acute Pancreatitis is a rarely occurring and difficult to diagnose entity because it has no specific clinical features that make it easy to distinguish between more common etiologies. The median time between the administration of the drug and the onset of symptoms of pancreatitis can range from a few days to a few months, but may also occur with persistent medication. Our case study is about a young female patient who has been diagnosed with drug-induced pancreatitis by re-challenge.
Az akut pancreatitis az egyik leggyakoribb, kórházi kezelést igénylő gasztrointesztinális kórkép. Magyarországon 100 000 lakosra vonatkoztatva évente kb. 20-50 esetet regisztrálnak. A gyógyszer indukálta akut pancreatitis egy ritkán előforduló és nehezen diagnosztizálható entitás, mivel nem rendelkezik olyan speciális klinikai jellemzőkkel, amelyek alapján könnyen megkülönböztethetnénk a gyakoribb etiológiáktól. Az adott gyógyszer bevétele és a hasnyálmirigy-gyulladás tüneteinek kezdete között átlagosan eltelt idő néhány naptól néhány hónapig terjedhet, de tartós gyógyszerszedés mellett is jelentkezhetnek tünetek. Esetismertetésünk egy fiatal nőbetegről szól, akinél gyógyszer indukálta pancreatitist diagnosztizáltunk gyógyszervisszaadási teszt révén.
Az akut pancreatitis (AP) az egyik leggyakoribb, kórházi kezelést igénylő gasztrointesztinális kórkép, Magyarországon évente 20-50 esetet regisztrálnak 100 000 lakosra vonatkoztatva (1, 2). A diagnózis felállításához az alábbi három karakterisztikus eltérés közül legalább kettőnek teljesülnie kell: típusos hasi fájdalom, laboratóriumi eltérések (szérum amiláz vagy lipáz normális szint felső határértékéhez viszonyított legalább háromszoros megemelkedése, a képalkotón látott morfológiai eltérések (1).
Az AP etiológiája multifaktoriális, kórokként leggyakrabban (40-60%) az epeúti elzáródást okozó elváltozások, az alkohol toxikus hatása (20-30%) és a hypertrigliceridaemia (3-5%) szerepelnek (3). A gyógyszer indukálta AP diagnózisa nagy kihívást jelent, az idiopátiásként diagnosztizált esetek néhány százalékáért is felelős lehet. Számos, gyakran hosszú távon használt gyógyszert összefüggésbe hoztak az AP-vel, amelyeket a ’80-as években Mallory és Kern három osztályba csoportosított a bejelentett esetek száma és a pozitív visszaadási teszt („re-challenge”) eredménye alapján. A klasszifikációt Badalov és munkatársai 2007-ben módosították: jelenleg a hatóanyagok négy csoportba sorolhatók (4).
A gyógyszer indukálta AP felismerésének fontossága abban rejlik, hogy a gyógyszer ismételt visszaadásával újabb AP-epizód fejlődhet ki, annak minden kockázatát magában hordozva. Esetünk bemutatásával a gyógyszer indukálta AP diagnosztikus kihívásaira szeretnénk felhívni a figyelmet.
Esetbemutatás
A 22 éves nőbetegnél először 2014-ben jelentkezett hideg által provokált, végtagok ujjaira lokalizálódó keringészavar, amelyet Raynaud-szindrómának diagnosztizáltak. Ennek hátterében definitív szekunder okot részletes kivizsgálás ellenére (mellkasröntgen, transztorakális echokardiográfia, légzésfunkció, szialometria, kapilláris mikroszkópia, nyálmirigy-biopszia, kiterjesztett és ismételt immunszerológiai vizsgálatok, hasi ultrahang, nőgyógyászati vizsgálat és gasztroenterológiai vizsgálatok) sem sikerült igazolni. Ezt követően évente több alkalommal hideg hatástól függetlenül jelentkező és fokozódó Raynaud-tünetek, a kéz- és lábujjakon megjelenő egy-egy kisebb kezdődő fekély miatt részesült kórházi kezelésben. Kezdetben profilaktikus LMWH, szteroid, majd keringésjavító infúziós kúrát, trombocitaaggregáció-gátló terápiát kapott. Immunszerológiai vizsgálataiban szereplő atípusos ANCA-pozitivitás, egy alkalommal észlelt gyenge lupusz antikoaguláns pozitivitás, és alsó végtagi apró purpurák leginkább kisér-vasculitis lehetőségét vetették fel, erre szteroid spóroló célzattal 2018. május elején 1×50 mg azathioprin terápiát indítottak.
1. ábra: Vérvételi eredmények alakulása a kórházi kezelés alatt. Az ábrán látható piros nyíl a gyógyszer visszaadását jelzi
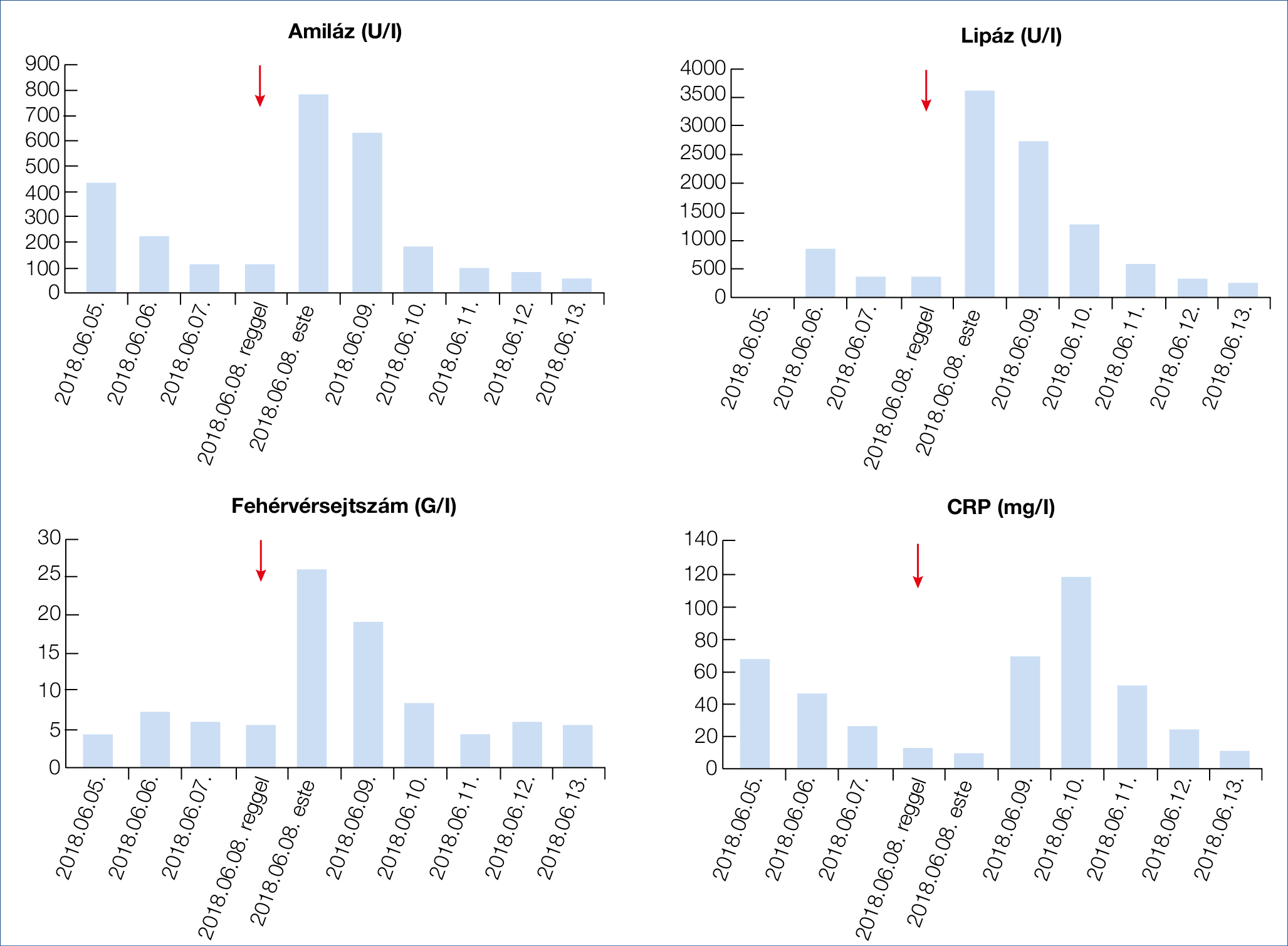
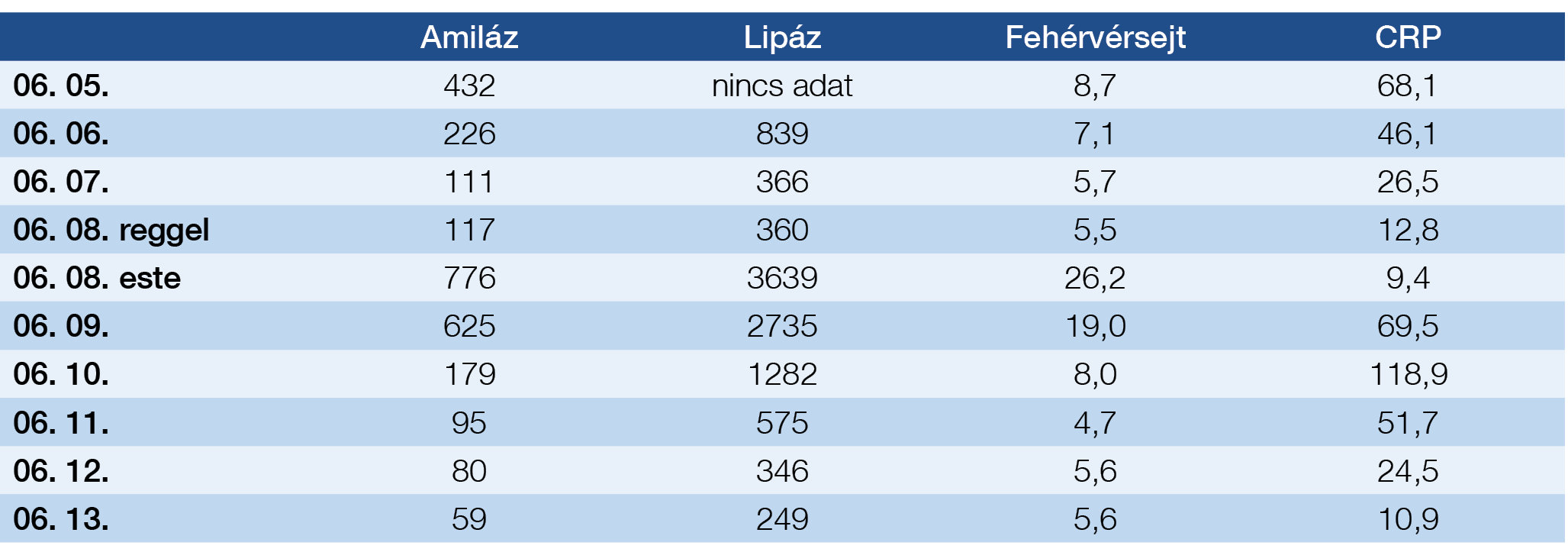
2018. június elején jelentkezett a Fejér Megyei Szt. György Egyetemi Oktató Kórház Sürgősségi Betegellátó Osztályán kb. két hete tartó epigasztriális fájdalom, hányinger, lázas állapot miatt. Felvételi laboratóriumi leletében emelkedett gyulladásos paraméterek (CRP: 68,1 mg/l, fehérvérsejt 8,7 G/l) és amilázszint 432 U/l szerepelt. Hasi ultrahangvizsgálat során a pancreas szerkezete megtartott volt, mellkas-röntgenvizsgálat kórjelzőt nem írt le. A „kettő a háromból” kritériumok alapján (1) akut pancreatitist diagnosztizáltak. Osztályunkon bőséges parenterális folyadékpótlást kezdtünk, nazogasztrikus szonda levezetését a beteg nem engedte. Kiegészítő laboratóriumi vizsgálatokat kértünk, amelyek enyhe fokú javuló tendenciát mutattak (CRP: 46,1 mg/l, amiláz: 226 U/l lipáz: 839 U/l, FVS: 7,1 G/l). Epigasztriális, étkezés után jelentkező hasi fájdalom differenciáldiagnosztikai lépéseként gasztroszkópiát végeztünk, amely idült antrum nyálkahártya-gyulladást igazolt. Pancreatitis etiológiájának tisztázása során egyéb tényezőket kizárva gyógyszer indukálta, illetve autoimmun eredet merült fel (5). IgG4 meghatározására a Honvéd Kórházba mintát küldtünk, ezt követően megfigyelésünk harmadik napján (06. 08-án reggel) a beteggel egyeztetve „re-challenge” mellett döntöttünk. Az azathioprin tablettát a korábban szedett dózisban visszaadtuk (1×50 mg), amely 24 órán belül jelentős enzimelváltozásokat eredményezett (1. ábra, 1. táblázat). Laboratóriumi leletek szignifikáns emelkedésével párhuzamosan hasi panaszok kifejezetten fokozódtak. Ekkor készült hasi ultrahangvizsgálat a pancreasfej mérsékelt kiszélesedését (33 mm) írta le. Korai enterális táplálását nazogasztikus szondán át kezdtük meg (6). Három nap szondatáplálás és parenterális folyadékpótlást követően javuló laboratóriumi értékek alapján a negyedik napon szonda mellett az orális táplálását sikeresen felépítettük. Időközben elkészült negatív IgG4 eredménye, illetve a pozitív re-challenge teszt együttes eredménye a korábban felmerült autoimmun pancreatitist kizárta. Az azathioprin szedését kontraindikáltuk, gondozó reumatológusához irányítottuk vissza a gyógyszeres terápia felülvizsgálata céljából. Egy hónapos kontrollvizsgálat alkalmával készült hasi UH és laboratóriumi vizsgálat negatív eredményű lett, a beteg tünet- és panaszmentes.
1. táblázat: Vérvételi eredmények számszerűsítve
Megbeszélés
A gyógyszer indukálta AP egy ritkán előforduló és nehezen diagnosztizálható entitás, mivel nem rendelkezik olyan speciális klinikai jellemzőkkel, melyek alapján könnyen megkülönböztethetnénk a gyakoribb etiológiáktól. Az adott gyógyszer bevétele és a hasnyálmirigy-gyulladás tüneteinek kezdete között átlagosan eltelt idő néhány naptól néhány hónapig terjedhet, de tartós gyógyszerszedés mellett is jelentkezhetnek tünetek (7). Badalov és munkatársai az AP-t okozó gyógyszereket négy csoportra bontották. Az Ib csoportba azon gyógyszereket sorolták, melyekről legalább egy pozitív re-challenge esettanulmány szerepel, de az egyéb AP-t okozó etiológiákat egyértelműen kizárni nem lehet. Az azathioprin ebbe a kategóriába sorolható. Betegünk több olyan gyógyszert is szedett (pantoprazol 1×20 mg, és methylprednisolon 1×4 mg), amelyekkel kapcsolatban korábban már dokumentáltak akut pancreatitises eseteket (8, 9), azonban ezek a szerek végig a terápiája részét képezték kórházi kezelésünk alatt. Emellett az enzimértékekben jelentős változás, illetve hasi panasz nem jelentkezett. Az azathioprin tablettát három napig megvontuk, majd visszaadtuk 1×50 mg dózisban, ekkor jelentkeztek újra az AP típusos tünetei. Esetünk a Naranjo által létrehozott adverz gyógyszerreakció valószínűségi skálán (10) kilenc pontot ért el, ez alapján határozott az ok-okozati összefüggés.
Következtetés
Akut pancreatitis esetén, amikor egyértelmű etiológiát nem tudunk megállapítani, gondolni kell gyógyszer indukálta formákra. Ilyen esetben diagnózishoz legkönnyebben „re-challenge” révén juthatunk, azonban fontos megjegyezni, hogy a súlyos AP mortalitása elérheti a 30%-ot is és az adverz reakció súlyossága előre nem megjósolható.
2. Az Aneszteziológiai és Intenzív Terápiás Szakmai Kollégium. Az Egészségügyi Minisztérium szakmai irányelve Súlyos heveny hasnyálmirigy gyulladás intenzív terápiás kezelése https://doi.org/10.1556/650.2018.31280
3. Guo-Jun Wang, Chun-Fang Gao, Dong Wei, et al. Acute pancreatitis: Etiology and common pathogenesis. World J Gastroenterol 2009 Mar 28; 15(12): 1427–1430. https://doi.org/10.3748/wjg.15.1427
4. Hung WY, Lanfranco OA. Contemporary review of drug-induced pancreatitis: A different view. WJGP 2014; 5(4): 405–415. https://doi.org/10.1080/10282580.2014.978644
5. Hritz I, Czakó L, Dubravcsik Zs, et al. Acute pancreatitis. Evidence based management guidelines of the Hungarian Pancreatic Study Group. Orv Hetil 2015; 156(7): 244–261. https://doi.org/10.1556/oh.2015.30059
6. Badalov N, Baradarian R, Iswara K, et al. Drug-Induced Acute Pancreatitis:An Evidence-Based Review. Clin Gastroenterol Hepatol 2007; 5: 648–661. https://doi.org/10.1016/j.cgh.2006.11.023
7. Toubanakis C, Batziou E, Sipsas N, et al. Acute pancreatitis after long-term therapy with mesalazine, and hyperamylasaemia associated with azathioprine in a patient with ulcerative colitis. Eur J Gastroenterol Hepatol 2003; 15: 933–934. https://doi.org/10.1097/00042737-200308000-00019
8. Das S, Ganguly A, Ghosh A, et al. Oral pantoprazole-induced acute pancreatitis in an 11-year-old child. Ther Drug Monit 2012; 34: 242–
244. https://doi.org/10.1590/s1413-86702009000300018
9. Bourne MS, Dawson H. Acute pancreatitis complicating prednisolone therapy. Lancet 1958; 2: 1209–1210. https://doi.org/10.1016/s0140-6736(58)92360-2
10. Naranjo CA, Busto U, Sellers EM, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981; 30: 239–245. https://dx.doi.org/10.1038/clpt.1981.154
