Ferring Tudástár
Gyulladásos bélbetegségek bőrgyógyászati vonatkozásai – a bél-mikrobiom tükrében
Summary
A komplex, multifaktoriális hátterű gyulladásos bélbetegségek multidiszciplináris jelentőségűek, társulhatnak extraintesztinális tünetekkel, ezen belül igen gyakori a bőrérintettség. Egyes bőrbetegségek esetén a gyulladásos bélbetegségekben leírt dysbiosis figyelhető meg, amely felveti a kórképek közötti szoros kapcsolatot. A dysbiosis célzott probiotikummal vagy antibiotikummal történő kezelése, illetve a probiotikumok preventív alkalmazása nem új keletű elképzelés egyes bőrgyógyászati kórképek esetén, azonban az irodalmi adatok gyakran ellentmondóak. Az alábbiakban áttekintjük a gyulladásos bélbetegségekkel társuló fontosabb bőrgyógyászati kórképeket, azok patomechanizmusát, illetve a bél–bőr-tengely kezelésének eddig ismert lehetőségeit.
A komplex, multifaktoriális hátterű gyulladásos bélbetegségek multidiszciplináris jelentőségűek, társulhatnak extraintesztinális tünetekkel, ezen belül igen gyakori a bőrérintettség. Egyes bőrbetegségek esetén a gyulladásos bélbetegségekben leírt dysbiosis figyelhető meg, amely felveti a kórképek közötti szoros kapcsolatot. A dysbiosis célzott probiotikummal vagy antibiotikummal történő kezelése, illetve a probiotikumok preventív alkalmazása nem új keletű elképzelés egyes bőrgyógyászati kórképek esetén, azonban az irodalmi adatok gyakran ellentmondóak. Az alábbiakban áttekintjük a gyulladásos bélbetegségekkel társuló fontosabb bőrgyógyászati kórképeket, azok patomechanizmusát, illetve a bél–bőr-tengely kezelésének eddig ismert lehetőségeit.
A Bevezetés
A gyulladásos bélbetegségek (IBD, inflammatory bowel disease), azaz a Crohn-betegség (CD, Crohn’s disease) és a colitis ulcerosa (UC) prevelanciája egyaránt meghaladja a 0,3%-ot, társadalmi és egészség-közgazdaságtani hatásuk vitathatatlan (1, 2). A bélrendszer érintettsége mellett gyakran (6-47%) extraintesztinális manifesztációk léphetnek fel (3). Ezek elsődlegesen a bőrt, a szemet, a vázizomrendszert és a hepatobiliáris egységet érintik (4).
Az IBD-ben ismert dysbiosis mellett egyre több bőrbetegség esetében derül fény a bél-mikrobiom zavarára és annak patognomikus szerepére. A cikk további részében az IBD bőrgyógyászati vonatkozásainak rövid bemutatását követően, azok bél-mikrobiom zavarral való kapcsolatát és az ezen alapuló terápiás megfontolásokat részletezzük. A továbbiakban a mikrobiom kifejezés alatt célzottan a bélrendszer mikrobiomjára utalunk, a cikk terjedelmi korlátai miatt a bőr mikrobiomjának tárgyalását mellőzzük.
IBD-vel összefüggő bőr- és nyálkahártya-tünetek
Az IBD-hez kapcsoltan gyakorta társulnak bőrgyógyászati eltérések, az esetek 25%-ában akár meg is előzhetik a bélpanaszok jelentkezését (3, 5). A bőrt- és nyálkahártyákat érintő tüneteket 5 csoportba lehet osztani (3), ezek főbb jellemzőit lásd az 1. táblázatban.
1. táblázat: A gyulladásos bélbetegségekkel összefüggő főbb bőrgyógyászati kórképek csoportosítása a patomechanizmus alapján, klinikai jellemzőik, epidemiológiájuk, a bél-mikrobiom eltérései és kezelési lehetőségeik
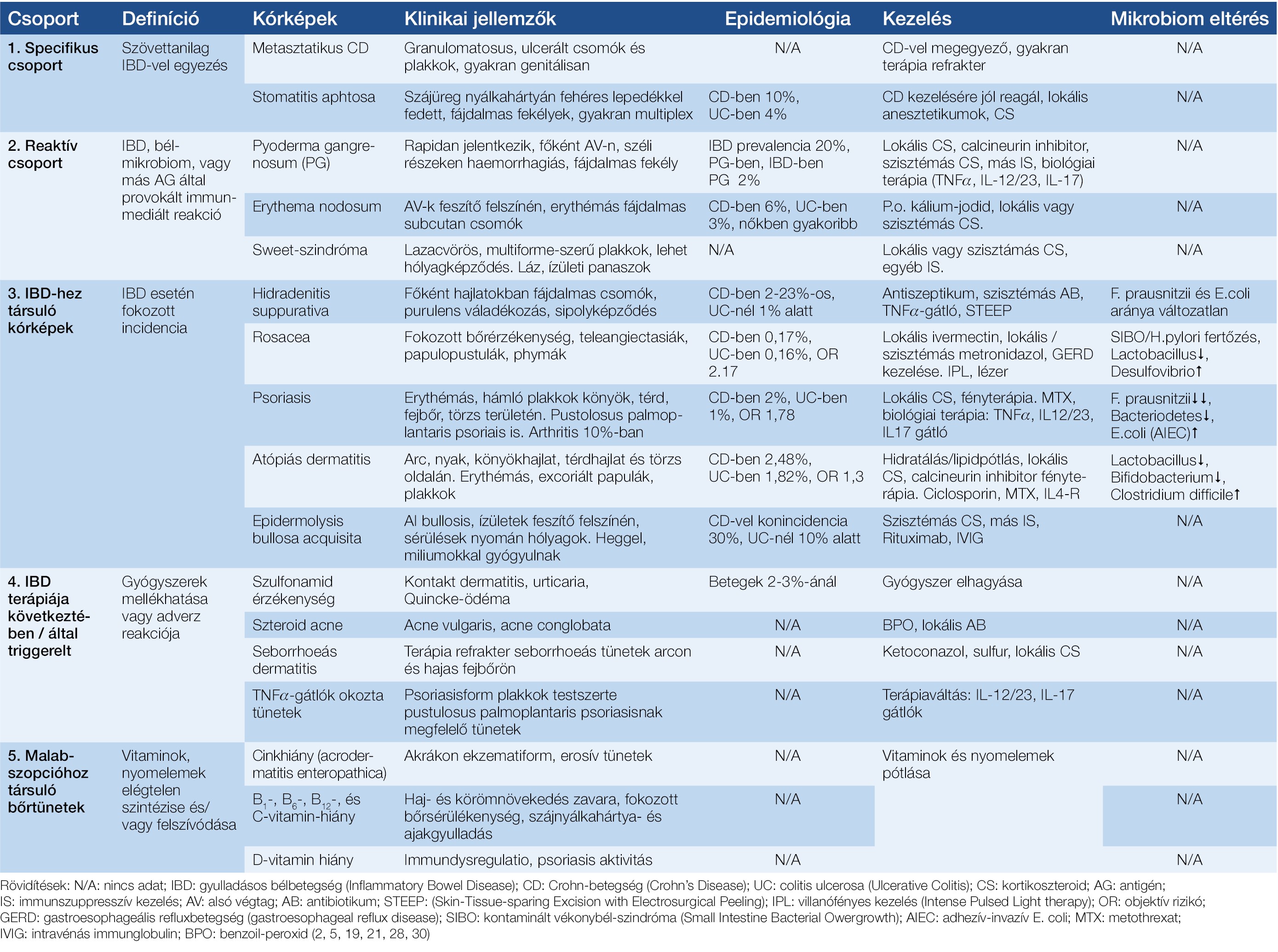
A specifikus csoportnál az elváltozások szövettani képe megegyezik a bélrendszer alapbetegségével. A második, azaz a reaktív csoportba immunmediált folyamatokat sorolnak, ahol az alapbetegséghez, vagy a bél-mikrobiomhoz kapcsolható antigének provokálják a tüneteket. A harmadik csoportba az IBD megléte esetén fokozott incidenciát mutató, ún. IBD-hez társuló kórképeket vesszük. A negyedik csoportot a terápia következtében mellékhatásként vagy adverz reakcióként fellépő bőrtünetek jelentik. Az utolsó csoportot a vitaminok vagy nyomelemek malabszorpcióhoz társuló hiánybetegségei alkotják. A kórképek részletes klinikai leírásától a cikk terjedelmi korlátai miatt eltekintünk, ezt illetően utalunk Károlyi és munkatársai kiváló közleményére (4). Továbbá az 1. ábrán a lényegesebb bőrbetegségek jellemző klinikai megjelenését képekkel illusztráljuk.
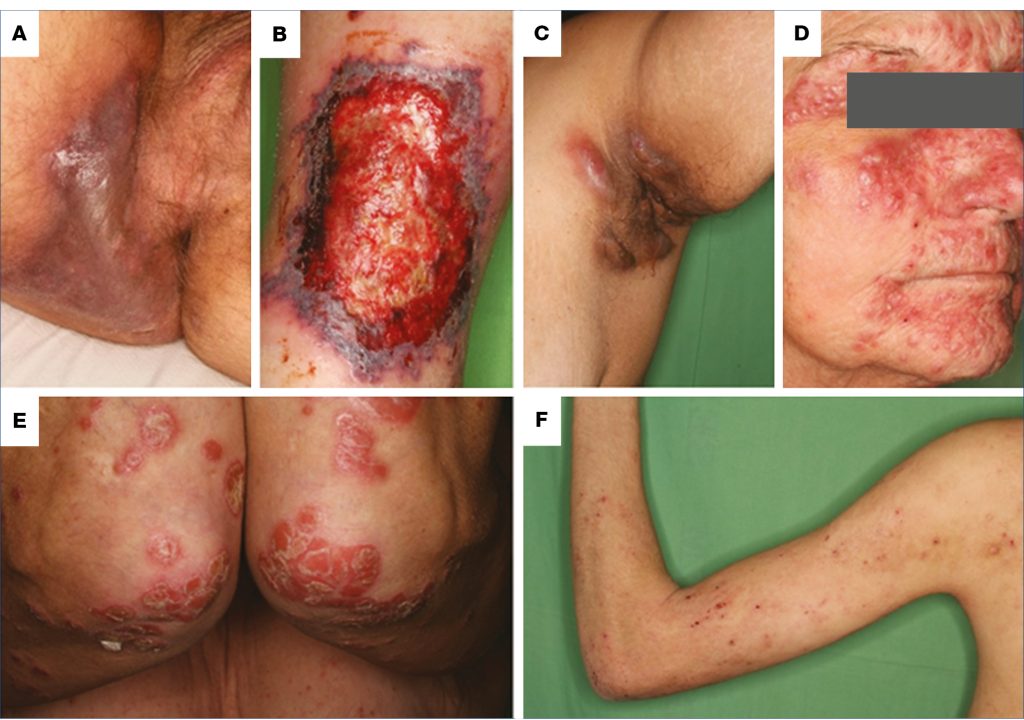
1. ábra: Gyulladásos bélbetegséghez kapcsolható bőrgyógyászati betegségek A: Metasztatikus Crohn-betegség, B: pyoderma gangrenosum, C: hidradenitis suppurativa, D: rosacea papulopustulosa, E: psoriasis vulgaris, nagyplakkos forma, F: atópiás dermatitis
Forrás: Semmelweis Egyetem, Bőr-, Nemikórtani és Bőronkológiai Klinika képanyaga
IBD betegséghajlam genetikai faktorai
A komplex, poligénes hátterű IBD tekintetében családvizsgálatok és genome-wide association studies (GWAS) adatai alapján napjainkra több mint 240 genetikai lókusz (funkcionáló gének és nem kódoló régiók egyaránt) additív vagy protektív szerepe körvonalazódott a betegséghajlam kialakításában (6). A NOD2/CARD15, ATG16L1 és az CDH1-gének polimorfizmusai CD-re, a HLA-DRB1 haplotípus UC-ra jellemzőek. Az IBD patomechanizmusában központi szerepet játszó IL23R-Th17 tengely aktivitását meghatározó citokin, citokinreceptor és egyéb effektor tényezők (pl. IL23R, JAK2, STAT3, IL12) génjeinek egyes mutációi az IBD rizikójára és súlyosságára gyakorolnak hatást (6). Ezek más immunmediált vagy gyulladásos bőrbetegségekben is kimutathatók.
Az IBD fenotípusát és az aktivitást befolyásoló nem genetikai faktorok közül kiemelendő a bél mikrobiomjának normálistól eltérő megoszlása, azaz a dysbiosis (7).
IBD-re jellemző mikrobiom-változások – a dysbiosis
Molnár Tamás a Gasztroenterológiai és Hepatológiai Szemlében 2018-ban megjelent cikkében kiválóan foglalja össze a normál mikrobiomra és az IBD-re jellemző
dysbiosis jellegzetességeit (8). Alább ennek mentén, illetve további ismeretekkel kiegészítve a bőrgyógyaszati szempontból lényeges elemek kiemelésével taglaljuk
a mikrobiom és az IBD kapcsolatát.
A bél mikrobiomot több mint 1000 törzs alkotja, a biodiverzitás megőrzése a normál működés szempontjából lényeges (9). A bélflóra 99%-át a Firmicutes, a Bacteroidetes, a Proteobacteria és Actinobacteria törzsek alkotják, ezen belül jelentős a Clostridium, Lactobacillus és Bifidobacterium csoportokba tartozó fajok aránya (10).
IBD és mikrobiom kapcsolatában „a tyúk vagy tojás” felvetés a mai napig nem eldöntött kérdés. Valószínűsíthető, hogy a mikrobiom kóros megváltozása egyaránt szerepel kiváltó okként az IBD kialakulása és aktivitás fokozódása mögött, illetve annak következménye is (10). A dysbiosisra jellemző legfontosabb változások a diverzitás és a Firmicutes törzsek arányának csökkenése. A Proteobacteria törzsbe tartozó E. coli kifejezetten az adhézióra-invázióra képes (AIEC, adhesive-invasive E. Coli) típus mennyisége növekszik, ez gyulladást és az immunaktivitás fokozódását válthatja ki (11). A Desulfovibrio fajok a hidrogén-szulfát-termelés fokozásával a mucosa károsodását váltják ki (12). A Clostridiumok IV. számú alcsoportjába tartozó Faecalibacterium prausnitzii kolonizációja csökken (13). A F. prausnitzii jelentőségét a gyulladáscsökkentő hatású rövidláncú zsírsavak közé tartozó butiráttermelő képessége adja. Mind CD, mind UC esetében a relapszus esélyével korrelációt mutatott a F. prausnitzii kolonizációjának mértéke (14, 15). A F. prausnitzii serkenti a regulátor T-limfociták (Treg) differenciálódását és az IL-10 termelődését, amely gátolja a TNFa-termelést, az antigénprezentáló és a T-helper-1 (Th1) sejtek aktiválódását. Továbbá a F. prausnitzii csökkenti az IL-12, az IFN-γ és NFkB szintjét (16). A bélrendszer dysbiosisában, nemcsak IBD esetén, a Treg – T-helper 17 (Th17) egyensúly az utóbbi javára billen, ez számos immunmediált kórkép aktivitását fokozhatja (17).
Bőrgyógyászati kórképekben észlelhető bél-mikrobiom-változások
A IBD-hez kapcsolódó bőrbetegségek közül sem a specifikus, sem a reaktív kórképek kapcsán a mikrobiomra irányuló vizsgálat eddig még nem történtek. A társult kórképek, főként a rosacea, az atopiás dermatitis (AD) és a psoriasis esetében ugyanakkor több adat áll rendelkezésre.
A rosacea esetén Parodi és munkatársai a kontaminált vékonybél-szindróma (SIBO, small intestine bacterial overgrowth) prevelanciája jelentősen meghaladta a kontrollcsoportét, és a rifamixin kezelés a rosacea státuszát szignifikánsan javította (18). Gravina és munkatársai 90 beteget vizsgálva a Helicobacter pylori fertőzés előfor-dulását szignifikánsan magasabbnak mérték rosaceás betegek körében, az eradikáció jelentősen javította a bőrtüneteket. Ugyanebben a vizsgálatban a SIBO prevelanciájával nem mutattak ki korrelációt (19). Egy metaanalízis viszont nem talált szignifikáns összefüggést a H. pylori fertőzöttség és a rosacea klinikai aktivitása között (20). Nam és munkatársai rosaceás betegek székletének metagenomikai vizsgálatával az IBD-ben is leírt Lactobacillus abundancia növekedését találták (21). A Citrobacter és Desulfovibrio fajok mértéke rosaceás betegekben csökkent, szemben az IBD esetén várt emelkedéssel (21, 22).
Az AD esetében egyes tanulmányokban a Bifidobacterium fajok aránya csökkent, másokban növekedett (23, 24).
A Clostridium csoport arányának növekedése korrelált az AD fellángolásának kockázatával, azonban később nem tudták ezt reprodukálni (25, 26). A Lactobacillus paracasei
az AD kialakulásának kockázatát csökkentette, viszont a további vizsgálatok már nem támasztották ezt alá (26, 27).
Psoriasisban és arthritis psoriaticában Scher és munkatársai igazolták, hogy a diverzitás, főként az Actinobacteria, Ruminococcus és Bacteroidetes törzsek relatív abundanciája csökkent (28). A Bacteroidetes törzsek csökkenését Codoner és munkatársai is kimutatták (29). Eppinga és munkatársai szerint az IBD dysbiosis mintázatához hasonlóan psoriásisban is csökken az F. prausniztii és növekszik az AIEC aránya (30).
Hidradenitis suppurativában (HS) eddig nem igazolták, hogy specifikus dysbiosis alakulna (30).
IBD dysbiosis és bőrgyógyászati kórképek kapcsolata – Lehetséges patomechanizmusok
Psoriasis esetén az F. prausnitzii arányának csökkenése és az AIEC-fajok mértékének növekedése jellemző.
Az F. prausnitzii az IL-10-termelést fokozásán keresztül a TNFa, IL-12, IFN-γ és IL-17-szintézist csökkenti. Egyedszámának csökkenése az előbbi citokinek mennyiségének növekedéséhez vezet, amelyek kulcsszerepet játszanak a psoriasis patomechanizmusában. Az IFN-g-szint növekedés felelős az IBD TNFa terápiája mellett adverzen kialakuló palmoplantaris psoriasisért (31). A TNFa és IL-17 rosaceában is fontos szerepet játszik, a vaszkuláris endotheliális növekedési faktor (VEGF) expressziója révén fokozza a neoangiogenezist (32). L. casei törzsek intraperitoneális beadását követően egerekben az IL-12 növekedését és az IgE-szint csökkenését mérték (33), amely AD esetében kedvező lehet. A patogén Clostridium fajok által termelt p-krezol és szabad fenol a keringésen keresztül a bőrbe jutva annak barrier funkcióját csökkentik és károsodott keratinizációhoz vezetnek (34).
Terápiás lehetőségek és megfontolások
Az IBD tekintetében a normál flóra helyreállítását célzó vizsgálatok eredményei szerények és jórészt ellentmondásosak. UC, illetve CD esetében egy kereskedelmi forgalomban lévő probiotikus készítmény hatása megegyezett az 5-ASA-terápiával, de a kis esetszámok miatt további vizsgálatok szükségesek (36, 37). A bőrtünetekre célzottan alkalmazott orális probiotikum-készítményeket a legtöbb tanulmány AD-ben vizsgálta. Az L. casei, L. paracasei, Lactobacillus fermentum és Lactobacillus salivarius, illetve a Bifidobacterium törzsek a bél-mikrobiom változása mellett az AD rizikóját vagy aktivitását csökkentették egyes klinikai vizsgálatokban, de más tanulmányok nem igazoltak kedvező hatást (38).
Gyermekeknél AD-ben L. fermentum és L. salivarius adása szignifikánsan csökkentette a betegségaktivitás mérésére szolgáló SCORAD (SCOREing Atopic Dermatitis) értéket, L. casei és Bifidobacterium törzsek együttes alkalmazásánál ugyancsak kedvező hatást mértek (38). Lactobacillus rhamnosus és L. paracasei törzsekkel ugyanakkor ellentmondásos eredmények születtek. Az összes ilyen irányú vizsgálat közel felében kedvező, a többi esetben elégtelen terápiás hatásról számoltak be (38).
Rosacea esetén az elsődleges a SIBO vagy H. pylori fertőzés terápiája. A rosaceás tünetek egyes tanulmányok szerint a kezelésre javultak, az eredmények azonban itt is ellentmondásosak (18–20).
Psoriasisnál eddig egy humán vizsgálat áll rendelkezésre, itt Bifidobacterium infantis adásával a szérum TNFa-szint csökkenését észlelték, azonban a bőrstátusz változását nem vizsgálták (39). Egerekben Lactobacillus pentosus adásával meggátolható volt a psoriasis kialakulása, a bőrükben az orális probiotikum-kezelés után a TNFa, IL-6, IL-23 és IL-17 citokinek szintje csökkent (40). HS esetében orális probiotikum alkalmazásával közlés nem áll rendelkezésre. Acne vulgaris esetén sikerrel alkalmaztak Lactobacillus acidophilus, Lactobacillus bulgaricus és Bifidobacterium bifidum tartalmú készítményeket, amelyek 30-67%-kal csökkentették a gyulladás mértékét (41).
Seborrhoeás dermatitisnél L. paracasei alkalmazásával értek el sikereket (42).
Következtetések
Az IBD és a bőrgyógyászati kórképek között szoros kapcsolat áll fenn, aktivitásuk sokszor együtt változik, az IBD kezelése a bőrtüneteken is javíthat. IBD-ben alapvető
a bélrendszer dysbiosisa, amelynek jelentőségére egyre több bőrbetegségben derül fény. A bél-mikrobiom egyes tagjai kifejezett immunmoduláló hatással bírnak, befolyásolni képesek bizonyos citokin útvonalakat, mint például a psoriasisban kulcsfontosságú TNFa-IL-12/23-IL-17-tengelyt. Rosaceában és psoriasisban az IBD-vel megegyező dysbiotikus eltérések alakulnak ki, ez közös etiopatogenetikai faktorok lehetőségét veti fel. A dysbiosis célzott probiotikummal vagy antibiotikummal történő kezelése, illetve a probiotikumok preventív alkalmazása AD-ben nem új keletű, az eredmények azonban ellentmondásosak. Psoriasisban, rosaceában, acne vulgarisban vagy seborrhoeás dermatitisben is végeztek orális probiotikumokkal a dysbiosis kezelésére irányuló vizsgálatokat, ezek eredménye biztató. A jövőben a vizsgálatok nagyobb esetszámmal, randomizált körülmények között való elvégzése szükséges a hatékonyság pontosabb megítélésére és a legmegfelelőbb probiotikum kiválasztására. Ezek eredményeként a jövőben képesek lehetünk a bél–bőr-tengely mentén a legkevesebb mellékhatással járó módon beavatkozni, a bél-mikrobiom harmonizálásával bőrbetegségek aktivitását befolyásolni.
Dr. Anker Pálma munkáját az EFOP-3.6.3-VEKOP-2017-00009 azonosító pályázat támogatta.
2. Kim M, Choi KH, Hwang SW, Lee YB, Park HJ, Bae JM. Inflammatory bowel disease is associated with an increased risk of inflammatory skin diseases: A population-based cross-sectional study. Journal of the American Academy of Dermatology 2017; 76(1): 40–8. https://doi.org/10.1016/j.jaad.2016.08.022
3. Greuter T, Navarini A, Vavricka SR. Skin Manifestations of Inflammatory Bowel Disease. Clinical reviews in allergy & immunology 2017; 53(3): 413–27. https://doi.org/10.1007/s12016-017-8617-4
4. Károlyi Z, Erős N, Újszászy L, Nagy G. Gyulladásos bélbetegségek bőr- és nyálkahártyatünetei Orvosi Hetilap 2000; 141(25).
5. Vavricka SR, Brun L, Ballabeni P, Pittet V, Prinz Vavricka BM, Zeitz J, et al. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. The American journal of gastroenterology 2011; 106(1): 110–9. https://doi.org/10.1038/ajg.2010.343
6. Zhao M, Burisch J. Impact of Genes and the Environment on the Pathogenesis and Disease Course of Inflammatory Bowel Disease. Digestive diseases and sciences 2019. https://doi.org/10.1007/s10620-019-05648-w
7. McIlroy J, Ianiro G, Mukhopadhya I, Hansen R, Hold GL. Review article: the gut microbiome in inflammatory bowel disease-avenues for microbial management. Alimentary pharmacology & therapeutics 2018; 47(1): 26–42. https://doi.org/10.1111/apt.14384
8. Molnár T. A mikrobiom szerepe gyulladásos bélbetegségekben. Gasztroenterológiai és Hepatológiai Szemle 2018; 4(3): pp. 161–3.
9. Kundu P, Blacher E, Elinav E, Pettersson S. Our Gut Microbiome: The Evolving Inner Self. Cell 2017; 171(7): 1481–93. https://doi.org/10.1016/j.cell.2017.11.024
10. Matsuoka K, Kanai T. The gut microbiota and inflammatory bowel disease. Seminars in immunopathology 2015; 37(1): 47–55. https://doi.org/10.1007/s00281-014-0454-4
11. Nishida A, Inoue R, Inatomi O, Bamba S, Naito Y, Andoh A. Gut microbiota in the pathogenesis of inflammatory bowel disease. Clinical journal of gastroenterology 2018; 11(1): 1–10. https://doi.org/10.1007/s12328-017-0813-5
12. Loubinoux J, Bronowicki JP, Pereira IA, Mougenel JL, Faou AE. Sulfate-reducing bacteria in human feces and their association with inflammatory bowel diseases. FEMS microbiology ecology 2002; 40(2): 107–12. https://doi.org/10.1111/j.1574-6941.2002.tb00942.x
13. Takahashi K, Nishida A, Fujimoto T, Fujii M, Shioya M, Imaeda H, et al. Reduced Abundance of Butyrate-Producing Bacteria Species in the Fecal Microbial Community in Crohn’s Disease. Digestion 2016; 93(1): 59–65. https://doi.org/10.1159/000441768
14. Fujimoto T, Imaeda H, Takahashi K, Kasumi E, Bamba S, Fujiyama Y, et al. Decreased abundance of Faecalibacterium prausnitzii in the gut microbiota of Crohn’s disease. Journal of gastroenterology and hepatology 2013; 28(4): 613–9. https://doi.org/10.1111/jgh.12073
15. Varela E, Manichanh C, Gallart M, Torrejon A, Borruel N, Casellas F, et al. Colonisation by Faecalibacterium prausnitzii and maintenance of clinical remission in patients with ulcerative colitis. Alimentary pharmacology & therapeutics 2013; 38(2): 151–61. https://doi.org/10.1111/apt.12365
16. Grimbaldeston MA, Nakae S, Kalesnikoff J, Tsai M, Galli SJ. Mast cell-derived interleukin 10 limits skin pathology in contact dermatitis and chronic irradiation with ultraviolet B. Nature immunology 2007; 8(10): 1095–104. https://doi.org/10.1038/ni1503
17. Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell 2014; 157(1): 121–41. https://doi.org/10.1016/j.cell.2014.03.011
18. Parodi A, Paolino S, Greco A, Drago F, Mansi C, Rebora A, et al. Small intestinal bacterial overgrowth in rosacea: clinical effectiveness of its eradication. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association 2008; 6(7): 759–64. https://doi.org/10.1016/j.cgh.2008.02.054
19. Gravina A, Federico A, Ruocco E, Lo Schiavo A, Masarone M, Tuccillo C, et al. Helicobacter pylori infection but not small intestinal bacterial overgrowth may play a pathogenic role in rosacea. United European gastroenterology journal 2015; 3(1): 17–24. https://doi.org/10.1177/2050640614559262
20. Jorgensen AR, Egeberg A, Gideonsson R, Weinstock LB, Thyssen EP, Thyssen JP. Rosacea is associated with Helicobacter pylori: a systematic review and meta-analysis. Journal of the European Academy of Dermatology and Venereology: JEADV 2017; 31(12): 2010–5. https://doi.org/10.1111/jdv.14352
21. Nam JH, Yun Y, Kim HS, Kim HN, Jung HJ, Chang Y, et al. Rosacea and its association with enteral microbiota in Korean females. Experimental dermatology 2018; 27(1): 37–42. https://doi.org/10.1111/exd.13398
22. Willing BP, Dicksved J, Halfvarson J, Andersson AF, Lucio M, Zheng Z, et al. A pyrosequencing study in twins shows that gastrointestinal microbial profiles vary with inflammatory bowel disease phenotypes. Gastroenterology 2010; 139(6): 1844–54.e1. https://doi.org/10.1053/j.gastro.2010.08.049
23. Hong P-Y, Lee BW, Aw M, Shek LPC, Yap GC, Chua KY, et al. Comparative Analysis of Fecal Microbiota in Infants with and without Eczema. PLOS ONE 2010; 5(4): e9964. https://doi.org/10.1371/journal.pone.0009964
24. Ismail IH, Boyle RJ, Licciardi PV, Oppedisano F, Lahtinen S, Robins-Browne RM, et al. Early gut colonization by Bifidobacterium breve and B. catenulatum differentially modulates eczema risk in children at high risk of developing allergic disease. Pediatric allergy and immunology: official publication of the European Society of Pediatric Allergy and Immunology 2016; 27(8): 838–46. https://doi.org/10.1111/pai.12646
25. Penders J, Gerhold K, Stobberingh EE, Thijs C, Zimmermann K, Lau S, et al. Establishment of the intestinal microbiota and its role for atopic dermatitis in early childhood. The Journal of allergy and clinical immunology 2013; 132(3): 601–7.e8.
26. Storro O, Oien T, Langsrud O, Rudi K, Dotterud C, Johnsen R. Temporal variations in early gut microbial colonization are associated with allergen-specific immunoglobulin E but not atopic eczema at 2 years of age. Clinical and experimental allergy: journal of the British Society for Allergy and Clinical Immunology 2011; 41(11): 1545–54.
27. Penders J, Thijs C, Mommers M, Stobberingh EE, Dompeling E, Reijmerink NE, et al. Intestinal lactobacilli and the DC-SIGN gene for their recognition by dendritic cells play a role in the aetiology of allergic manifestations. Microbiology 2010; 156(Pt 11): 3298–305.
28. Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, et al. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis & rheumatology (Hoboken, NJ) 2015; 67(1): 128–39.
29. Codoner FM, Ramirez-Bosca A, Climent E, Carrion-Gutierrez M, Guerrero M, Perez-Orquin JM, et al. Gut microbial composition in patients with psoriasis. Scientific reports 2018; 8(1): 3812.
30. Eppinga H, Sperna Weiland CJ, Thio HB, van der Woude CJ, Nijsten TE, Peppelenbosch MP, et al. Similar Depletion of Protective Faecalibacterium prausnitzii in Psoriasis and Inflammatory Bowel Disease, but not in Hidradenitis Suppurativa. Journal of Crohn’s & colitis 2016; 10(9): 1067–75.
31. Gyöngyösi N, Lőrincz K, Mihály E, Herszényi L, Tulassay Z, Wikonkál N. A gyulladásos bélbetegségek immunszuppresszív és az anti-TNF-alfa-kezelésének bőrgyógyászati mellékhatásai. Magyar belorvosi archívum 2015; 68(1): 34–45.
32. Gerber PA, Buhren BA, Steinhoff M, Homey B. Rosacea: The cytokine and chemokine network. The journal of investigative dermatology Symposium proceedings 2011; 15(1): 40–7.
33. Shida K, Takahashi R, Iwadate E, Takamizawa K, Yasui H, Sato T, et al. Lactobacillus casei strain Shirota suppresses serum immunoglobulin E and immunoglobulin G1 responses and systemic anaphylaxis in a food allergy model. Clinical and experimental allergy: journal of the British Society for Allergy and Clinical Immunology 2002; 32(4): 563–70.
34. O’Neill CA, Monteleone G, McLaughlin JT, Paus R. The gut-skin axis in health and disease: A paradigm with therapeutic implications. BioEssays: news and reviews in molecular, cellular and developmental biology. 2016; 38(11): 1167–76.
35. Chen M, O’Toole EA, Sanghavi J, Mahmud N, Kelleher D, Weir D, et al. The epidermolysis bullosa acquisita antigen (type VII collagen) is present in human colon and patients with crohn’s disease have autoantibodies to type VII collagen. The Journal of investigative dermatology 2002; 118(6): 1059–64.
36. Tursi A, Brandimarte G, Papa A, Giglio A, Elisei W, Giorgetti GM, et al. Treatment of relapsing mild-to-moderate ulcerative colitis with the probiotic VSL#3 as adjunctive to a standard pharmaceutical treatment: a double-blind, randomized, placebo-controlled study. The American journal of gastroenterology 2010; 105(10): 2218–27.
37. Fedorak RN, Feagan BG, Hotte N, Leddin D, Dieleman LA, Petrunia DM, et al. The probiotic VSL#3 has anti-inflammatory effects and could reduce endoscopic recurrence after surgery for Crohn’s disease. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association 2015; 13(5): 928–35.e2.
38. Yu Y, Dunaway S, Champer J, Kim J, Alikhan A. Changing our microbiome: Probiotics in dermatology. The British journal of dermatology 2019.
39. Groeger D, O’Mahony L, Murphy EF, Bourke JF, Dinan TG, Kiely B, et al. Bifidobacterium infantis 35624 modulates host inflammatory processes beyond the gut. Gut microbes 2013; 4(4): 325–39.
40. Chen YH, Wu CS, Chao YH, Lin CC, Tsai HY, Li YR, et al. Lactobacillus pentosus GMNL-77 inhibits skin lesions in imiquimod-induced psoriasis-like mice. Journal of food and drug analysis 2017; 25(3): 559–66.
41. Jung GW, Tse JE, Guiha I, Rao J. Prospective, randomized, open-label trial comparing the safety, efficacy, and tolerability of an acne treatment regimen with and without a probiotic supplement and minocycline in subjects with mild to moderate acne. Journal of cutaneous medicine and surgery 2013; 17(2): 114–22.
42. Reygagne P, Bastien P, Couavoux MP, Philippe D, Renouf M, Castiel-Higounenc I, et al. The positive benefit of Lactobacillus paracasei NCC2461 ST11 in healthy volunteers with moderate to severe dandruff. Beneficial microbes 2017; 8(5): 671–80.
