Összefoglaló közlemények / Reviews
Use of artificial intelligence in gastroenterology and endoscopy – review and our first clinical experiences
Summary
Artificial intelligence based softwares can lead gastroenterologists and endoscopist trough the emerging number of medical studies and publications during their everyday clinical practice. AI could be a useful to improve diagnostic accuracy and to tailor therapies. In the present article we concluded recent available literature on AI in gastrointestinal endoscopy and the results of our recent study.
A napjainkban egyre növekvő számú tudományos kutatás és közlemény feldolgozásában jelentős segítséget nyújthatnak a mesterséges intelligencia (AI) alapú számítógépes programok. Az AI alkalmazása segítheti a klinikusokat a diagnosztikus pontosság javításában és a terápiás döntések optimalizálásában is a gasztroenterológia és az endoszkópia csaknem teljes területén. A közleményben a napjainkban elérhető nemzetközi irodalmi adatokat és saját kutatási eredményeinket foglaltuk össze.
Bevezetés
Az egészségügyben a korszerű diagnosztikus és képalkotó vizsgálatok (CT, MRI, ultrahang, kapszulaendoszkópia, endoszkópia, endoszkópos ultrahang – EUS – patológia) egyre szélesebb körű elterjedése következtében a gasztroenterológiai kivizsgálások lehetséges gyorsasága és elméleti pontossága egyre növekszik. A felsorolt vizsgálóeljárások széles körű, részben szűrő jellegű elterjedésének azonban gátat szab az exponenciálisan növekvő, csaknem kontrollálhatatlan adat és képi információtömeg, amelynek kiértékeléséhez egyre kevesebb nagy tapasztalatú szakértő, illetve szakorvosi idő áll rendelkezésre. Csak 2015-ben az USA-ban 150 000 000 terabyte adatmennyiség keletkezett, és az egészségügyben keletkező adattömeg jelenleg a világon 73 naponta megduplázódik (1).
Mindezen felsorolt tényezők miatt a korszerű vizsgálómódszerek széles körű hozzáférhetőségének növekedési igényével a közeljövőben ellentmondásba kerülhet az orvosi kognitív képkiértékelő kapacitás egyre szűkülő lehetősége. Az USA-ban 2015-ben 60 milliárd digitálisan tárolt nagy felbontású HD orvosi képanyagot rögzítettek a kórházakban, és a felsorolt diagnosztikus szakmacsoportokban dolgozó szakorvosok munkaidejük közel kétharmadát (64%) negatív (kórjelzőeltérés nélküli) képek, illetve szövettani metszetek átnézésével töltötték. A kapszulaendoszkópia problematikája jól demonstrálja az elmondottakat, mivel egy átlagosan 7 órás kapszulavizsgálat során, ahol egy másodpercenként átlagosan 6 képet készítő kapszularendszert alkalmaznak, összesen 7×60×60×6 azaz 151 200 darab állókép készül, amelyet 60-90 perc alatt kell áttekinteni a kiértékelő szakorvosnak, ráadásul az esetek döntő többségében a kóros eltérést tartalmazó képek aránya mindössze 0,1% körül van.
További kritikus probléma, hogy az EU-ban, Kanadában és az USA-ban a következő 15 évben több mint 2 milliárd lakos kerül a betegségekre vulnerábilisabb 60 év feletti életkorba, ezáltal a lakosság 80%-ának minimum egy, 20%-ának legalább 4 krónikus, rendszeresen ellenőrizendő betegsége lesz! Mindeközben az egész világon csökken az orvosok, különösön a jól képzett szakorvosok és az egészségügyi szakdolgozók száma. Jellemző adat, hogy a felsorolt országokban jelenleg 10 000 lakosra jut egy szakképzett radiológus és 40 000 lakosra jut egy szakképzett endoszkópos vagy patológus szakorvos, amely arányok a közeljövőben inkább romlani fognak. Mindezen tényezők visszafordíthatatlanul az aktív egészségügyi szakemberek kiégéséhez valamint tartós hiányához vezetnek majd, alapjaiban megingatva az egészségügyi ellátórendszerek megbízható működését.
Ezek az ellentmondások csak akkor hidalhatók át, ha az orvosi diagnosztikus munka jelentős részét olyan orvosi informatikai döntéstámogató, illetve automatizált robotikai rendszerek veszik át, amelyek mesterséges intelligenciaalapú öntanító algoritmusokon keresztül diagnosztikus pontosságukat folyamatosan javítják. Ezen programok első generációi már napjainkban is fejlesztés alatt vannak, és elsődleges funkcióként a normális (kórjelző eltérést nem tartalmazó) képek azonosítására alkalmasak. Második lépcsőben a mesterséges neurális hálózatokat alkalmazó programok alkalmassá tehetők arra, hogy egyszerű választásos döntésekben nagy biztonsággal szakértői szintű javaslatot tegyenek a képi információtartalom és a diagnózis közötti összefüggésekre. Ezt követően a fejlesztés végső állomásaként elképzelhető az a szint, ahol az öntanító algoritmusokat tartalmazó mesterséges intelligenciaalapú szoftver alkalmassá válik egy vagy több képalkotó vizsgálat eredményeit szintetizálva önálló diagnózis(ok) felállítására és a képalkotó vizsgálatok orvosi beavatkozás nélküli, nagy pontosságú leletezésére is.
Informatikai alapok és a mesterséges intelligencia
Az informatika robbanásszerű technológiai fejlődése nélkülözhetetlen volt ahhoz, hogy a digitális adatmennyiség és a számítási kapacitás elérje azt a mai szintet, amelyben a mesterséges intelligenciaalapú programok kifejleszthetővé és valós időben futtathatóvá váltak. Ehhez hozzájárultak a nagy számítási teljesítményű processzorok (kifejezetten a GPU-k) exponenciális fejlődése és a közeljövőben meghonosodó kvantumszámítógépek mellett a beágyazott felhőalapú informatikai adattároló rendszerek, úgymint a megfelelő méretű és sebességű fájlszerverek és webalapú szerverparkok, amelyekkel nemcsak létrehozható, hanem ultragyors hozzáféréssel a föld bármely hálózati pontjáról elérhető úgynevezett „big data”, jelentős méretű adatállomány hozható létre. Bár ennek a jól hozzáférhető adattömegnek 80%-a nyers, jelöletlen adat, azonban már jelenleg is elérhető 20% olyan adatállomány, amely jelölt vagy más néven felcímkézett adatokat tartalmaz és ez által alkalmas precíz mesterséges intelligenciaalapú programok kifejlesztésére és betanítására.
Definíció szerint mesterséges intelligencia- (artificial intelligence/AI) alapú szoftvernek nevezünk minden olyan számítógépes programot, amely alkalmassá teszi a számítógépet arra, hogy az emberi viselkedést vagy döntéshozatalt szimulálja. Gépi tanulásnak („machine learning”) nevezzük a mesterséges intelligenciaprogramok azon csoportját, amely statisztikai módszerek felhasználásával és a gyakorlással képes hatékonyan javítani az eredeti algoritmus tudását és pontosságát. Végül pedig, mély tanító neurális hálózat (deep learning, multilayered neural network) a mesterséges intelligencián alapuló számítógépes algoritmusok azon csoportját alkotja, amely a többszintű neurális hálózatokat alkalmazva, az emberi agy működéséhez hasonlóan öntanuló programként működve, és példákon tanítva (felcímkézett adatok) folyamatosan fejlődik és tanul a gyakorlattal (1. ábra).
1. ábra: A mesterséges intelligencia-alapú számítógépes algoritmusok alaptípusai
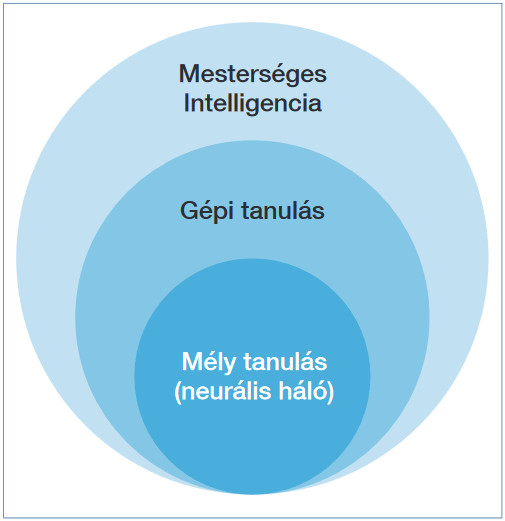
Az öntanító algoritmus jellemzője – az egyszerű gépi tanulással szemben, mely pontossága egy határon túl nem növelhető – hogy a tanításhoz alkalmazott jelölt adatmennyiséggel arányosan pontossága folyamatosan növelhető, amelynek értéke ideális esetben közelíthető a száz százalékhoz. A neurális mély tanítóhálózatok tehát olyan matematikai algoritmusok, amelyeket a biológiai ideghálózatokról mintázva terveztek meg minta felismerési céllal. A neuronoknak megfelelően a számítási modellek is rétegekbe vannak szervezve, egy rétegen belüli neuronok azonos feladatokat látnak el, így az emberi neurális percepcióhoz hasonlóan itt is vannak bemeneti-, rejtett-, kimeneti neuronok/rétegek. A neuronok/rétegek közötti kapcsolatok súlyozzák a kimeneti értékeket. Ezen működési elvek teszik lehetővé, hogy a mélytanuló neurális hálózatok automatikusan azonosítják a kép jellemzőit (feature extraction) és klasszifikációt hajtanak végre emberi beavatkozás nélkül, a hagyományos gépi tanulással szemben. Ahhoz, hogy a mélytanuló neurális hálózattal megoldhatóvá váljon az adott diagnosztikai probléma, minden esetben szükség van az algoritmusjelölt adatokon (train set) történő, megfelelő mélységű tanítására, amelynek során a jellegzetes diagnosztikus információkat tartalmazó adatokat vagy képeket megmutatjuk az algoritmusnak, majd a program lefuttatása után közöljük vele a helyes eredményt vagy döntést is, ezáltal lehetőséget biztosítva arra, hogy a hibáit visszafelé terjesztve (backpropagation) az algoritmus változtasson a belső súlyokat befolyásoló tényezőkön (változók), ilyen módon a tanítás során felmerülő hibáiból tanuljon.
Amennyiben egy adott diagnosztikus kérdést mesterséges intelligenciaalapú mélytanuló neurális hálózattal akarunk megoldani, a program kialakításához az alábbi fejlesztői lépéseket kell megtenni. Először is tisztázni kell, hogy az adott klinikai vagy diagnosztikus probléma megoldható-e mesterséges intelligencián alapuló algoritmusokkal. Ezután a legfontosabb lépés a program tanításához szükséges releváns adattömeg azonosítása és előkészítése a tanításra (megjelölése). Ez utóbbi sokszor többéves kutatómunka eredménye, mivel általában csak jelöletlen adatok állnak rendelkezésünkre, azaz a jelöletlen adatok megjelölése elengedhetetlen (annotálás). Ennek lényege, hogy minden egyes képen meg kell jelölni és pontos diagnosztikai végeredménnyel fel kell címkézni az adott kóros eltéréseket, ahhoz, hogy a tanítási folyamat során ezek a tanuláshoz alkalmazhatók legyenek. Ezt követi a probléma megoldásához optimális mélytanuló neurális hálózat fejlesztése, megfelelő előzetes parametrizálása és ennek validálása (validation set). Ezután kezdődhet meg a mélytanuló neurális hálózat megtervezése, illetve fejlesztése. Érdemes ennek során a már meglévő konvolúciós neurális hálózatok struktúráját alkalmazni. Ezután kezdődhet a létrehozott számítási modell megfelelő szintű tanítása az előzetesen kialakított nagy mennyiségű jelölt adatállományunkon (training set). Végezetül a klinikai alkalmazás előtt szükség van a már megtanított mélytanuló neurális hálózati modell tudományos tesztelésére jelöletlen adatsorokon, a diagnosztikus szenzitivitás, specificitás és a pontosság meghatározásával (prediction).
A mesterséges intelligenciaalapú mélytanuló neurális hálózatok általában nyílt forráskódú, szabadon hozzáférhető programok segítségével fejleszthetők, illetve rendelkezésre állnak nyílt forrású neurális hálózatalapú modellek is, amelyeknek számos változata létezik. Az ilyen rendszerek jellemzője, hogy a tanítási folyamat nagy számítási teljesítményigényű, így a hardverek (processzor, memória) fejlődésével együtt fejlődtek a számítási modellek is. A GPU-k (grafikus processzor) előnye, hogy képesek ugyanolyan műveleteket különböző adatokon párhuzamosan elvégezni, így nagyságrendekkel gyorsabban lehet a neurális hálózatalapú rendszereket tanítani és futtatni rajtuk, mint a hagyományos központi feldolgozóegységekkel (central precessing unit=CPU). A GPU-k teljesítményének folyamatos növekedése, illetve az áruk csökkenése miatt teret adtak a neurális hálózatok fejlesztésének. Általánosságban elmondható, hogy a nagyobb modellek, amelyek több réteget (a számítási modellben ugyanazon a logikai helyen elhelyezkedő neuronok halmaza) tartalmaznak, jobb és több absztrakciót tudnak elvégezni, így pontosabb eredményeket képesek szolgáltatni.
A mesterséges intelligencia és a tápcsatornai endoszkópia – Nemzetközi irodalmi kitekintés
A mesterséges intelligenciaalapú számítógépes programok a tápcsatorna teljes hosszában hatékonyan használható módszerek, a nemzetközi irodalomban már összefoglaló közlemények is megjelentek a közelmúltban a felhasználásával kapcsolatban (2).
Nyelőcső
Karcinóma-, dysplasiaszűrésben a mesterséges intelligenciaprogram használható magas hatékonysággal a Barrett-oesophagus és laphámrák korai stádiumban történő felismerésére.
Swager és munkatársai (3) volumetrikus lézer endomikroszkópia (VLE) alapú képeket elemeztek és szövettani vizsgálatok eredményeiből hoztak létre számítógépes algoritmust. Vizsgálatukban ex vivo korai Barrett-nyelőcsőről készült VLE-képeket használtak fel és tapasztalt orvosok, illetve a számítógépes algoritmus diagnosztikus pontosságát vetették össze. Az algoritmus jó hatékonysággal diagnosztizálta a betegséget (AUC 0,95), amely bizakodásra ad okot azügyben, hogy a későbbiekben in vivo is az orvosok segítségére lehet endoszkópia közben az eltérések korai azonosításában. További nagyobb és valós idejű vizsgálatok szükségesek azonban ahhoz, hogy a módszer pontosságát igazolni és tovább javítani is lehessen.
Egy másik, Van der Sommen munkacsoportja (4) által fejlesztett számítógépes algoritmus a Barrett-nyelőcső-nyálkahártya felszíni eltéréseinek és színbeli változásainak azonosításán alapul. Az ő tanulmányukban 44 beteg endoszkópiája során készült 100 képet használtak fel az automatizált algoritmus fejlesztéséhez, amelyet 4 nemzetközi, tapasztalt endoszkópos „vakon” validált, tehát ők nem ismerték a beteg kórtörténetét és a szövettani diagnózist a vizsgálat közben. A program szenzitivitása és specificitása 0,83 volt képenkénti feldolgozásban és 0,86 szenzitivitást és 0,87 specificitást lehetett elérni betegenként, a korai neoplasztikus eltérések vonatkozásában.
Korai nyelőcsőrákok diagnózisára Horie és munkatársai (5) is fejlesztettek neurális háló alapú számítógépes programot, amely 95%-os szenzitivitással használható az elváltozások diagnózisában és a program hatékonyságát bizonyítja, hogy minden 10 mm-nél kisebb eltérést felismert a vizsgálat során.
Nyelőcső-laphámrák felismerésére egyéb munkacsoportok is fejlesztettek saját számítógépes programot, Shin és munkatársai (6) módszerének szenzitivitása 87%, specifitása 97%, Quang munkacsoportja (7) esetén pedig 95 és 91%-ot sikerült elérni.
A nemzetközi eredmények tehát nagyon ígéretesek a Barrett-nyelőcső és a korai nyelőcső-laphámrák felismerésében, amellyel a jövőben a betegség morbiditása és mortalitása jelentősen csökkenthető lehet az előrehaladott stádiumban történő felismeréshez képest.
Gyomor
Az AI segítséget nyújthat a korai gyomorrák diagnosztikájában (8, 9) a karcinóma stádiummeghatározásban (10), a szövettani mélységi invázió meghatározásában. Az algoritmusok segítségével az elváltozás kiterjedése körülhatárolható, illetve a H. pylori infekció jelenlétének meghatározásában is hatékony lehet (11–13).
A gyomorrák korai stádiumban történő felismerése különösen fontos a későbbi kezelés hatékonyságának növelése szempontjából, ezáltal a mortalitás csökkentése céljából is. A korai felismeréshez az új, virtuális kromoendoszkópos technikák és az AI együttes felhasználása jelentős segítséget nyújt.
Miyaki és munkatársai (8) által fejlesztett, új számítógépes, vektoralapú algoritmus (SVM) a BLI-endoszkópos képalkotási technikával készült képeken a nyálkahártya helyi eltéréseit képes hatékonyan felismerni. Ezt a programot 587 szövettanilag igazolt gyomorrákról és 503 normál nyálkahártyáról készült képpel tanították. A vizsgálat validációját pedig 95 betegből, BLI LASEREO-endoszkópos technikával készült, 100 korai gyomorrákképen végezték. Az SVM-érték szignifikánsan magasabb volt igazoltan gyomorrákról készült képeken, mint a vörösebb képeken és a környező szöveteken (0,846 ± 0,220 vs. 0,381 ± 0,349 vs. 0,219 ± 0,277). A differenciált és differenciálatlan típusú tumor esetében is különbség mutatkozott a program által meghatározott értékekben (0,840 ± 0,207 vs. 0,865 ± 0,259). Ezek alapján pedig a program segíthet ezen elváltozások elkülönítésében, természetesen ebben az esetben is szükségesek további vizsgálatok a módszer fejlesztéséhez, pontosításához.
Kapszulaendoszkópia
A vékonybélbetegségek elsődleges diagnosztikus módszere az érvényben lévő nemzetközi szakmai irányelvek alapján a vékonybél kapszulaendoszkópos vizsgálata. A kapszulaendoszkópia a betegek számára is jól tolerálható vizsgálat, így nagy erőfeszítések zajlanak a minél részletesebb képalkotást lehetővé tevő, panenterikus kapszulaendoszkóp kifejlesztésére. Ezzel párhuzamosan, persze a rengeteg keletkező képanyag feldolgozása és a kiértékeléssel járó idő is nagy terhet ró az egészségügyi ellátó rendszerre és az orvosokra. Az AI ebben az esetben is nagy terhet vehet le az orvosok válláról, az automatizált számítógép-vezérelt diagnosztikus módszerek segítségével, pl. vérző angiectasiák, coeliakia, bélférgesség azonosításában.
A vérzésforrás azonosításában az egyik fő módszer a különböző színintenzitásokon alapuló elkülönítés (15, 16), a másik az eltérő szöveti szerkezeten alapuló képi eltérések elkülönítésén (17) alapuló vérzésforrás-meghatározás. Ezen módszerek együttes alkalmazásával (18) tovább javítható a diagnosztikus pontosság. Aoki és munkatársai egy közelmúltban megjelent vizsgálatának eredményei egy mély tanulási algoritmus és neurális háló segítségével a kapszulaendoszkópia során készült képeken határozták meg a vérzés jelenlétét a normál nyálkahártyával összehasonlítva. A görbe alatti terület módszerükkel 0,9998. A szenzitivitás és specificitás és a vizsgálat pontossága 96,63%, 99,96% és 99,89% voltak. A programnak végül 250 másodpercre volt szüksége 10 208 tesztkép kiértékelésére.
A mesterséges intelligencia tehát nagy pontossággal segíthet a kapszulaendoszkópia során készült hatalmas mennyiségű képanyag kiértékelésében. Az orvosi diagnózist természetesen nem helyettesíti, de előszűrheti a felvételeket, például akár vérzés jeleinek megtalálásában, így gyorsítva a képanyag kiértékelésének idejét (19).
Vastagbél
A vastagbélrák magas előfordulása és az ebből adódó magas mortalitás miatt kiemelten fontos jelentőségű a minél pontosabb diagnosztikus módszerek fejlesztése, amelyek segítenek a megelőzésben, a korai diagnózisban és a betegek kezelésében is.
A vastagbéltükrözést számos úton tudják támogatni a különböző AI-rendszerek. Egyrészt az emberi hibából adódó tévedések csökkentésében, az elnézett polipok számának csökkentésében (20), akár különböző béltisztasági fok esetén is (21), amely fontos minőségi szempont vastagbéltükrözés során. Másrészt a polip elnézési arány csökkentésében, a polipdetekció javításában és a felismerés pontosításában, a felismert polipok klasszifikációjában (22, 23), valamint a szövettani eredmény előzetes becslésében (24, 25).
Misawa és munkatársai által végzett vizsgálatban tapasztalt endoszkóposok utólag jelölték be a polipokat tartalmazó képeket vastagbéltükrözésről készült videofelvételeken. Később ezeket a videókat és az orvosok által adott eredményeket (miszerint az adott kép tartalmaz polipot vagy sem) egy számítógépes algoritmus tanítására használták fel. A program tesztelése során annak meg kellett határozni, hogy mekkora a polip jelenlétének a valószínűsége egy 1–100%-ig terjedő skálán az adott aktuális képkockán. Az eredményeik alapján a program 94%-ban találta meg a polipokat (47/50) és az álpozitív arány 60% volt (51/85). Az algoritmus segíthet az orvosok hiányzó endoszkópos tapasztalatának kiegészítésében, a valós idejű döntéshozatal támogatásában, már a vastagbéltükrözés során (20).
Számos egyéb munkacsoport által fejlesztett algoritmusok is a polipok valós idejű, minél hatékonyabb detekcióját célozzák. Az eredmények az AI-programot felépítő algoritmus típusától függenek, a különböző tanulmányokban 70%-100% közötti szenzitivitásról, specificitásról is beszámoltak a közelmúltban. A tanulmányokban használt számítógépes módszereken túl azonban az endoszkópos technikák is különbözőek voltak, így mindenképpen további vizsgálatok lesznek szükségesek, de az eddigi eredmények mindenesetre ígéretesek. Yamada és munkatársai valós idejű endoszkópos támogató rendszert fejlesztenek, amely a korai CRC jellegzetességeit mutató polipok felismerését segíti. Az AI-program összesített szenzitivitása és specificitása 97,3% (95% CI: 95,9%–98,4%) és 99,0% (95% CI: 98,6%–99,2%), a validációs teszt során a görbe alatti terület 0,975 (95% CI: 0,964–0,986). Az alcsoportok elemzése során, a polipoidelváltozások esetén azonban még meggyőzőbbek voltak az eredményeik, szenzitivitás 98,0% (95% CI: 96,6%–98,8%) szemben a 93,7%-os eredménnyel a (95% CI: 87,6%–96,9%) nonpolipoid alcsoportban. A carcinomatosus-elváltozásokat a program átlagosan 21,9 ms alatt azonosította. A vizsgálat jelentőségét a szerzők abban látják, hogy segíthet a nem egyértelmű nyálkahártya-elváltozások azonosításában, tehát már a tükrözés során, így javítva akár a szűrés eredményességét is, a polipelnézési arány csökkentésével (26).
Az eltávolításra kerülő polipból származó majdani szövettani eredmény előrejelzése már a vastagbéltükrözés során hatékony módszer lehet az endoszkópos ellátás és egyéb kezelési formák mielőbbi meghatározásában.
Misawa és munkacsoportja által fejlesztett, endocisztoszkópos (EC) és NBI-képek alapján az elváltozások vastagbéltükrözés során történő valós idejű diagnózisát segíti. E módszerek kombinációja a nyálkahártya pontosabb megítélését teszi lehetővé, hosszadalmas és nehezen kivitelezhető festési technikák nélkül. Ezt az ENDOBRAIN-szoftver 85 elváltozásról, összesen 1079 EC-NBI-technikával készült kép felhasználásával biztosítja. A rendszer 100% pontossággal határozta meg 100 képből összeállított validációs teszt során az adott elváltozások diagnózisát, átlagosan 0,3 s döntési idővel képenként. A program legfontosabb limitációja, hogy nem alkalmas a karcinóma és a sessilis serrated adenomák, polipok felismerésére, mivel ezekből kevés került be a tanításhoz használt képhalmazba (22). Előbbieken túl az AI alkalmas lehet a colorectalis tumorok esetén a sebészeti reszekciós műtét szükségének meghatározása T1-stádiumú tumorok endoszkópos eltávolítását követően, valamint a nyirokcsomó és távoli metasztázisok jelenlétének becslésre (27) Takeda és munkacsoportja által publikált vizsgálatban az AI-program invazív CRC diagnosztikus pontossága 91%, szenzitivitása 74% és specificitása 97% volt.
Összességében tehát a mesterséges intelligencia nagy segítséget nyújthat az endoszkópiát végző orvosnak a szövettani eredmény előrejelzésében.
Gyulladásos bélbetegségek esetében gyulladás fokának felmérésére a betegség aktivitásának meghatározásához, illetve a relapszus előrejelzésében nyújthat segítséget az AI. Maeda és munkatársai által közölt eredmények szerint a meglévő szövettani gyulladás pontos jelzésére volt használható a mesterséges intelligenciaalapú számítógépes program colitis ulcerosa betegek tükrözése során (AI pontossága 91%, szenzitivitás 74%, specificitás 97%) (27). Kolonoszkópia során az AI alkalmas lehet még az eszköz könnyebb vezetésének támogatásához, hurkok kialakulásának megelőzésére tanulási fázisban kezdő endoszkópos orvosoknál (29).
Saját kutatásunk bemutatása
Munkacsoportunk elsődleges célja egy olyan orvosi döntéshozatalt támogató, mesterséges intelligenciaalapú öntanító neurális hálózat létrehozása volt, amely képes nagy pontossággal elkülöníteni a vastagbélben talált és polypectomiával eltávolított hiperplasztikus, illetve adenomatosus szubcentrimetrikus polipokat. A kutatás első fázisában Fujifilm 760 Eluxeo zoom endoszkóppal végzett kolonoszkópos vizsgálatok során több mint 2000 különálló, subcentrimetrikus polipot azonosítottunk, amelyekről HD videofilm-rögzítés mellett közel 26 000 nagy felbontású, 50× optikai nagyítással (zoomal) és zoom nélkül készítettünk fehér fénnyel, valamint kék lézerfénnyel BLI (blue light imaging) állóképeket, majd ezt követően minden polipot eltávolítottunk és szövettanilag is azonosítottunk. Az így elkészített és szövettanilag tipizált HD digitális képeket anonim webalapú adatbázisunkban rögzítettük (2. ábra).
2. ábra: Felhőalapú, anonim polip adatbázisunk, amely 26 000 WL, BLI, LCI állóképet (normál, nem nagyított és 50× optikai nagyítással) tartalmaz közel 2000 olyan vastagbélpolipról, amelyeket ezt követően eltávolítva szövettani vizsgálattal sikeresen beazonosítottunk
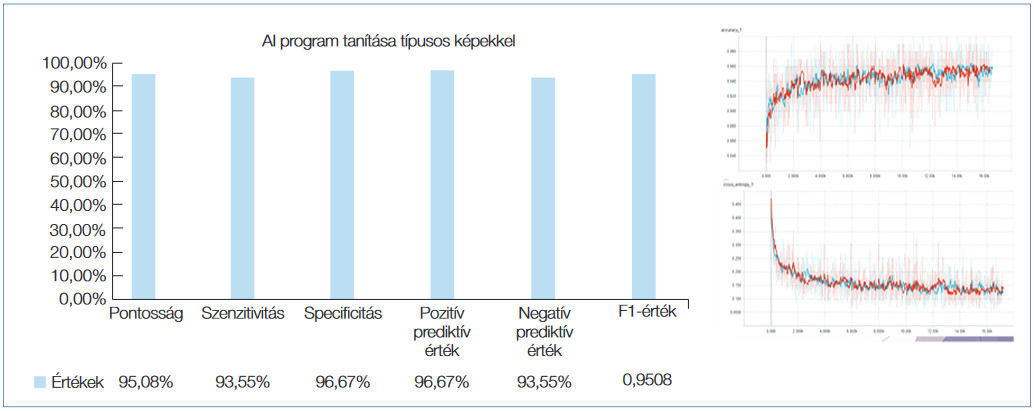
Ezt követően kifejlesztettük az öntanító számítógépes algoritmust. A programozást egy klasszikus konvolúciós neurális hálózat felépítésével kezdtük, amelybe a teljes polip képét belefoglaltuk. Mivel a polip mérete a legtöbb esetben változó a képen, és a neurális hálózat bemenetére mindig egyforma méretű adathalmazt kell biztosítani, így a polipok manuális körbejelölése után egységes méretű négyzeteket vágtunk ki belőle átlapoltan, így egy képből több száz kisebb méretű, bár hasonló adattartalmú, de egymástól mégis eltérő képeket tudtunk kiemelni, amely legalább két nagyságrenddel növelte meg az input esetszámot. A rendszer hiperparamétereit változtattuk, de jelentős javulást nem tudtunk elérni. Ezután már meglévő, ingyenesen hozzáférhető képfeldolgozó modelleket teszteltünk, hogy kiválasszuk a legoptimálisabb algoritmust. Az ilyen jellegű modelleket a fejlesztés során hasonló adathalmazokon tesztelik, amelyek közül a legismertebb az ImageNet. Itt több ezer címkézett kép érhető el, amelyeken a kutatásban részt vevő modelleket tanítják és tesztelik. Ezek méretükben, és pontosságukban változóak. Így választottuk ki végül az Inception v3 modellt, amely pontosságban magas, de komplexitásban átlagos, így gyorsabb és hatékonyabb. A modell „jellemző kiemelési” részét meghagytuk, viszont a klasszifikációs részét az igényeinknek megfelelően átalakítottuk. A meglévő képhalmazainkon tanításokat végeztük, drasztikusan jobb eredménnyel. Végül a tanítási halmaz finomhangolásával sikerült a legjobb eredményeket elérnünk. Az AI-program tanítása során csupán egyfajta virtuális kromoendoszkópos képkészítési technológiával készült szakértőink által típusosnak címkézett fotókat használtuk fel (Fujinon BLI) kombinálva az 50× optikai zoom technológiával, amely a korábbi kutatásaink alapján a legpontosabb eredményeket adta a szakértők optikai értékelésénél is (3. ábra). Random képeken tanítva az algoritmust kissé pontatlanabb, de még így is 90% feletti szenzitivitás és specificitás értékeket kaptunk (4. ábra).
Az AI-programunk klinikai teszteléséhez kizárólag olyan polipok fotóit használtuk, amelyek nem szerepeltek a tanítási halmazban. A további tesztek során (31 adenomatosus és 30 hiperplasztikus) polipokról BLI-módban és 50× optikai nagyítással készült felvételeket kezdő és haladó (expert) endoszkópos szakemberekkel és az általunk fejlesztett AI-szakértő-programmal is kiértékeltük, amelynek során elsősorban az adenoma és hyperplasia szövettani differenciálására fókuszáltunk, ezáltal segítve a vedd le és dobd el (resect and discard) stratégiát.
3. ábra: Típusos képeken tanított AI-alapú orvosi döntéshozást támogató számítógépes programunk (PolypBrain) tesztelése során kapott eredményeink az adenoma szövettani előrejelzésében, ezáltal támogatva a „vedd le és dobd el” stratégiát (resect and discard)
4. ábra: Vegyes képeken tanított AI-alapú orvosi döntéshozást támogató számítógépes programunk (PolypBrain) tesztelése során kapott eredményeink az adenoma szövettani előrejelzésében, ezáltal támogatva a „vedd le és dobd el” stratégiát (resect and discard)
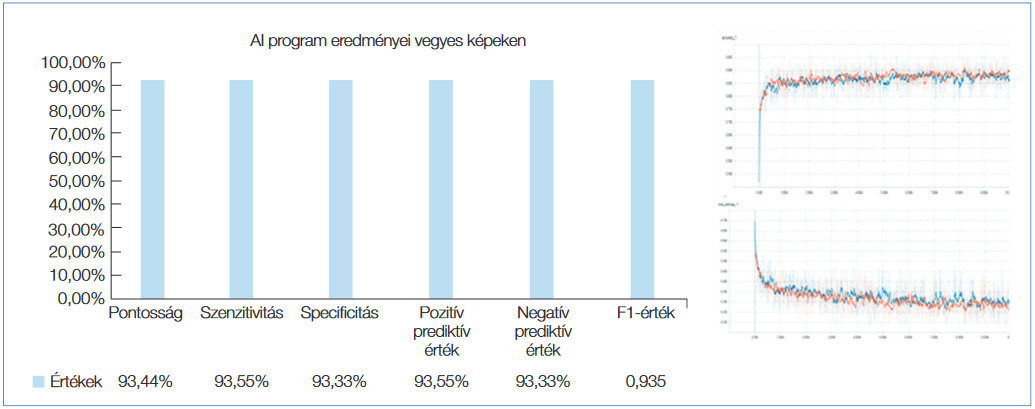
Amint az várható volt, az adenomatosus szövettani jelleg előrejelzésében a végleges szövettannal összehasonlítva a tapasztalt endoszkóposok (expertek) szignifikánsan magasabb pontosságot értek el, mint a tanuló endoszkóposok: pontosság, szenzitivitás, specificitás, PPV és NPV: 93,03% vs. 72,95%, 92,74% vs. 58,07%, 93,34% vs. 88,34%, 93,85% vs. 83,49% and 93,09% vs. 67,82%. Ezzel szemben amikor az általunk kifejlesztett AI-alapú orvosi döntést támogató programunk (PolypBrain) teljesítményét hasonlítottuk az expert endoszkóposokhoz, nem volt szignifikáns különbség az eredményekben, ezzel is igazolva a mesterséges intelligenciaalapú számítógépes értékelés noninferior voltát, sőt bizonyos paraméterek tekintetében érzékelhető volt a számítógépes értékelés potenciális jövőbeli előnye is: pontosság, szenzitivitás, specificitás, PPV és NPV: 96,72% vs. 93,03%, 100% vs. 92,74%, 93,55% vs. 93,34%, 100% vs. 93,85% and 93,75% vs. 93,09%.
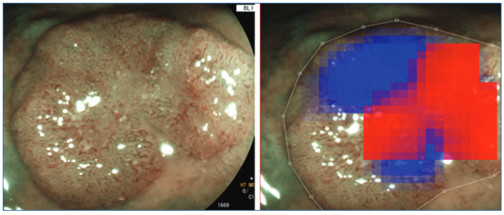
Ezt követően az általunk kifejlesztett AI-alapú informatikai algoritmust módosítva és enyhe, illetve fokálisan súlyos dysplasiás és insitu karcinómás szövettani jellegzetességű polipokon tanítva (300 polip) sikerült egy olyan továbbfejlesztett orvosi döntéshozó rendszer-prototípust létrehozzunk, amely 80-85% körüli pontossággal előre jelzi a polipban a súlyos dysplasia vagy intramucosalis karcinóma jelenlétét és egy hőtérképen is kijelzi annak feltételezett lokalizációját, ezzel is segítve az optikai biopsziát, és az optimális endoszkópos eltávolítási technika megtervezését.
Az általunk fejlesztett AI-program BLI virtuális kromoendoszkópiával kombinálva hatékonyan segít a kisméretű colorectalis polipok hiperplasztikus és neoplasztikus voltának elkülönítésében és a súlyos dysplasia előrejelzésében (30, 31, 32) (5–7. ábra).
5. ábra: Szövettanilag hiperplasztikus szubcentrimetrikus polip AI-alapú számítógépes értékelése (kék: hyperplasia, piros: adenoma)
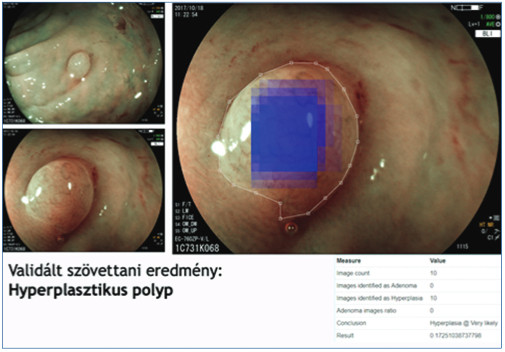
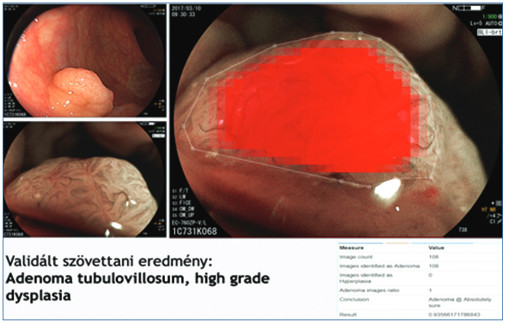
6. ábra: Szövettanilag adenomatosus szubcentrimetrikus polip AI-alapú számítógépes értékelése (kék: hyperplasia, piros: adenoma)
7. ábra: Súlyos diszpláziás területek AI-alapú azonosítása és hőtérképpel való kijelölése a biopszia optimális helyének azonosítása céljából (optikai biopszia)
Következtetéseink
Az elmúlt néhány évben robbanásszerűen nőtt meg a nemzetközi kutatások és ebből adódóan a tudományos közlemények száma is a mesterséges intelligencia alkalmazását illetően a tápcsatornai endoszkópia területén. Az AI gyakorlati alkalmazása az endoszkópos vizsgálatok során jó szolgálatot nyújthat az egyre növekvő betegszám mellett fokozódó orvosi terhelés és a specializált szakemberhiány enyhítésére, emellett segít a vizsgálók közti különbségek (interobserver variabilitás) kiegyenlítésében, ezáltal képes javítani a diagnosztikus pontosságot és optimalizálni a terápiás döntéseket, akár kevésbé tapasztalt gasztroenterológusok, endoszkópos orvosok számára is. Így a jövőben időt, költséget kímélő és hatékonyságot növelő módszer lehet az endoszkópos beavatkozások alkalmazása során.
2. El Hajjar A, Rey JF Artificial intelligence in gastrointestinal endoscopy: general overview Chin Med J (Engl) 2020 Feb 5; 133(3): 326–334. Published online 2020 Feb 5. https://doi.org/10.1097/CM9.0000000000000623
3. Swager A-F, van der Sommen F, Klomp SR, Zinger S, Meijer SL, Schoon EJ, Bergman J, With PH, Curvers WL Computer-aided detection of early Barrett’s neoplasia using volumetric laser endomicroscopy. Gastrointest Endosc November 2017; 86(5): 839–846. https://doi.org/10.1016/j.gie.2017.03.011
4. van der Sommen F, Zinger S, Curvers WL, Bisschops R, Pech O, Weusten Blam, Bergman J, With P, Schoon EJ Computer-aided detection of early neoplastic lesions in Barrett’s esophagus. Endoscopy 2016; 48(07): 617–624. https://doi.org/10.1055/s-0042-105284
5. Horie Y, Yoshio T, Aoyama K, Yoshimizu S, Horiuchi Y, Ishiyama A, Hirasawa T, Tsuchida T, Ozawa T, Ishihara S, Kumagai Y, Fujishiro M, Maetani I, Fujisaki J, Tada T. Diagnostic outcomes of esophageal cancer by artificial intelligence using convolutional neural networks. Gastrointest Endosc 2019; 89: 25–32. https://doi.org/10.1016/j.gie.2018.07.037
6. Shin D, Protano M-A, Polydorides AD, Dawsey SM, Pierce MC, Kim MK, Schwarz RA, Quang T, ET AL. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol 2015; 13: 272–279. e2. https://doi.org/10.1016/j.cgh.2014.07.030
7. Quang T, Schwarz RA, Dawsey SM, Tan MC, Patel K, Yu X, ET AL. A tablet-interfaced high-resolution microendoscope with automated image interpretation for real-time evaluation of esophageal squamous cell neoplasia. Gastrointest Endosc 2016; 84: 834–841. https://doi.org/10.1016/j.gie.2016.03.1472
8. Kanesaka T, Lee TC, Uedo N, Lin KP, Chen HZ, Lee JY, ET AL. Computer-aided diagnosis for identifying and delineating early gastric cancers in magnifying narrow-band imaging. Gastrointest Endosc 2018; 87: 1339–1344. https://doi.org/10.1016/j.gie.2017.11.029
9. Miyaki R, Yoshida S, Tanaka S, Kominami Y, Sanomura Y, Matsuo T, Oka S, ET AL. A computer system to be used with laser-based endoscopy for quantitative diagnosis of early gastric cancer. J Clin Gastroenterol 2015; 49: 108–115. https://doi.org/10.1097/MCG.0000000000000104
10. Yoon HJ, Kim S, Kim JH, Keum JS, Jo J, Cha JH, Jung DH, Park JJ, Youn YH, Park H al. Sa1235 Application of artificial intelligence for prediction of invasion depth in early gastric cancer: preliminary study. Gastrointest Endosc 2018; 87: AB176. https://doi.org/10.1016/j.gie.2018.04.273
11. Huang CR, Sheu BS, Chung PC, Yang HB. Computerized diagnosis of Helicobacter pylori infection and associated gastric inflammation from endoscopic images by refined feature selection using a neural network. Endoscopy 2004; 36: 601–608.
12. Itoh T, Kawahira H, Nakashima H, Yata N. Deep learning analyzes Helicobacter pylori infection by upper gastrointestinal endoscopy images. Endosc Int Open 2018; 6: E139–E144. https://doi.org/10.1055/s-0043-120830
13. Shichijo S, Nomura S, Aoyama K, Nishikawa Y, Miura M, Shinagawa T, et al. Application of convolutional neural networks in the diagnosis of Helicobacter pylori infection based on endoscopic images. EBioMedicine 2017 Nov; 25: 106–111. https://doi.org/10.1016/j.ebiom.2017.10.014
14. Nakashima H, Kawahira H, Kawachi H, Sakaki N. Artificial intelligence diagnosis of Helicobacter pylori infection using blue laser imaging-bright and linked color imaging: a single-center prospective study. Ann Gastroenterol 2018; 31: 462–468. https://doi.org/10.20524/aog.2018.0269
15. Pan G, Yan G, Qiu X, Cui J. Bleeding detection in wireless capsule endoscopy based on probabilistic neural network. J Med Syst 2011; 35: 1477–1484. https://doi.org/10.1007/s10916-009-9424-0
16. Liu J, Yuan X. Obscure bleeding detection in endoscopy images using support vector machines. Optim Eng 2009; 10: 289–299. https://doi.org/10.1007/s11081-008-9066-y
17. Coimbra MT, Cunha JPS. MPEG-7 visual descriptors-contributions for automated feature extraction in capsule endoscopy. IEEE Trans Circuits Syst Video Technol 2006; 16: 628–637. https://doi.org/10.1109/TCSVT.2006.873158
18. Li B, Meng MQH. Tumor recognition in wireless capsule endoscopy images using textural features and SVM-based feature selection. IEEE Trans Inf Technol Biomed Publ IEEE Eng Med Biol Soc 2012; 16: 323–329. https://doi.org/10.1109/TITB.2012.2185807
19. Aoki T, Yamada A, Kato Y, Saito H, Tsuboi A, Nakada A, Niikura R, et al. Automatic detection of blood content in capsule endoscopy images based on a deep convolutional neural network. J Gastroenterol Hepatol 2019 Nov 23. https://doi.org/10.1111/jgh.14941
20. Cesare Hassan, Tom Eelbode, Raf Bisschops. Equivalence between low adenoma detection and high miss rates: Is AI the ultimate response? Endosc Int Open 2019 Nov; 7(11): E1355–E1356. https://doi.org/10.1055/a-0900-3935
21. Becq A, Chandnani M, Bharadwaj S, Baran B, Ernest-Suarez K, et al. Effectiveness of a Deep-learning Polyp Detection System in Prospectively Collected Colonoscopy Videos With Variable Bowel Preparation Quality. J Clin Gastroenterol 2019 Nov 26. https://doi.org/10.1097/MCG.0000000000001272
22. Mori Y, Kudo SE, Misawa M, Saito Y, Ikematsu H, Hotta K, Ohtsuka K, Urushibara F, Kataoka S, et al. Real-time use of artificial intelligence in identification of diminutive polyps during colonoscopy: a prospective study. Ann Intern Med 2018; 169: 357–366. https://doi.org/10.7326/M18-0249
23. Misawa M, Kudo S, Mori Y, Cho T, Kataoka S, Yamauchi A, Ogawa Y, et al. Artificial intelligence-assisted polyp detection for colonoscopy: initial experience gastroenterology 2018; 154: 2027–2029.e3. https://doi.org/10.1053/j.gastro.2018.04.003
24. Mori Y, Kudo SE, Chiu PWY, Singh R, Misawa M, Wakamura K, Kudo T, et al. Impact of an automated system for endocytoscopic diagnosis of small colorectal lesions: an international web-based study. Endoscopy 2016; 48: 1110–1118. https://doi.org/10.1055/s-0042-113609
25. Misawa M, Kudo SE, Mori Y, Nakamura H, Kataoka S, et al. Characterization of colorectal lesions using a computer-aided diagnostic system for narrow-band imaging endocytoscopy. Gastroenterology 2016; 150: 1531–1532.e3. https://doi.org/10.1053/j.gastro.2016.04.004
26. Yamada M, Saito Y, Imaoka H, Saiko M, Yamada S, Kondo H, et al. Development of a real-time endoscopic image diagnosis support system using deep learning technology in colonoscopy. Sci Rep 2019 Oct 8; 9(1): 14465. https://doi.org/10.1038/s41598-019-50567-5
27. Ichimasa K, Kudo SE, Mori Y, Misawa M, Matsudaira S, Kouyama Y, et al. Artificial intelligence is a powerful tool to determine the need for additional surgery after endoscopic resection of t1 colorectal cancer − analysis based on a big data for machine learning. Endoscopy 2018 Mar; 50(3): 230–240. https://doi.org/10.1055/s-0043-122385. Epub 2017 Dec 22. Erratum in: Endoscopy 2018 Mar; 50(3): C2
28. Maeda Y, Kudo S, Mori Y, Misawa M, Ogata N, Sasanuma S, Wakamura K, Oda M, Mori K, Ohtsuka K. Fully automated diagnostic system with artificial intelligence using endocytoscopy to identify the presence of histologic inflammation associated with ulcerative colitis (with video). Gastrointest Endosc 2019; 89: 408–415. https://doi.org/10.1016/j.gie.2018.09.024
29. Eickhoff A, van Dam J, Jakobs R, Kudis V, Hartmann D, Damian U, Weickert U, Schilling D, Riemann JF. Computer-assisted colonoscopy (the NeoGuide Endoscopy System): results of the first human clinical trial (“PACE study”). Am J Gastroenterol 2007; 102: 261–266. https://doi.org/10.1111/j.1572-0241.2006.01002.x
30. Szalai M, Oczella L, Dubravcsik Z, Szepes A, Miheller P, Madácsy L. differentiation between neoplastic and non-neoplastic diminutive colorectal polyps with Fujinon Blue Light Imaging electronic chromoendoscopy with and without optical magnification – a randomized, prospective, multicenter trial Endoscopy 2018; 50(04): S2.
31. Szalai M, Zsobrak K, Lovasz BD, Oczella L, Dubravcsik Z, Madacsy L. Application of deep learning neural network for histological prediction of colon polyp images with BLI zoom technology Endoscopy 2019; 51(04): S5.
32. Lovász BD, Oczella O, Szalai M, Schmiedt P, Zsobrák K, Madácsy L. Application of Artificial Intelligence and deep learning algorithm in the prediction of advanced histology of colorectal adenomas. United European Gastroenterology Journal 2019 October; 7: ISSN 2050-6406 im.13572 PMID: 26118925
