Klinikai kérdések / Clinical question
Gastroenterologist-rheumatologist expert consensus addressing the need of effective gastroprotection during therapy with non-steroidal anti-inflammatory drugs
Summary
Non-steroidal anti-inflammatory drugs (NSAIDs) are essential agents in the treatment of musculoskeletal disorders. However, their use is associated with mucosal injury of gastrointestinal tract, including the development of peptic ulcer disease and its complications. During the effective prevention of NSAIDs induced side effects and complications both gastrointestinal and cardiovascular risks should be taken into account. There are no up-to-date Hungarian guidelines or recommendations regarding the effective gastroprotection. This paper aims to develop statements and guidance devoted to these specific issues through a review of current evidence by a multidisciplinary group of experts from the field of gastroenterology and rheumatology.
A nemszteroid gyulladáscsökkentő (NSAID) szerek nélkülözhetetlenek a mozgásszervi betegségek kezelésében. Az NSAID-szerek alkalmazása azonban a tápcsatorna nyálkahártyájának károsodásával, beleértve peptikusfekély-betegség képződésével és szövődményeinek kialakulásával járhat. A mellékhatások és szövődmények megelőzése során a gasztrointesztinális kockázati tényezők mellett elsősorban a kardiovaszkuláris kockázatot is figyelembe kell venni. A hatékony gasztroprotekciót illetően jelenleg nem áll rendelkezésre naprakész hazai útmutató vagy ajánlás. A közlemény a legújabb evidenciák tükrében, gasztroenterológus és reumatológus szakértők multidiszciplináris konszenzusa alapján összefoglalja az NSAID-kezeléssel kapcsolatos legfontosabb útmutatásokat.
Bevezetés
A mozgásszervi betegségek fájdalommal járnak, jelentősen rontják az életminőséget. A reumatológiai kórképek közül leginkább a degeneratív betegségek (osteoarthrosis, spondylosis, discopathia) valamint a gyulladásos kórképek (rheumatoid arthritis, spondylarthropathiák, köszvény) igényelnek hatékony fájdalomcsillapítást (1). A nemszteroid gyulladáscsökkentők (NSAID-szerek) a fenti reumatológiai kórképekben hatásosan csökkentik a gyulladást, csillapítják a fájdalmat, enyhítik az ízületi merevséget, duzzanatot, csökkentik a mozgáskorlátozottságot, elősegítik az ízületi funkciók fenntartását, összességében jelentősen javítják az életminőséget. Az NSAID-szerek nem megfelelő alkalmazása azonban számottevő morbiditással-mortalitással jár, jelentős gazdasági terhet ró az egészségügyi ellátásra (2–5). Az NSAID világszerte, így Magyarországon is az egyik legelterjedtebb gyógyszercsoport. A hazai NSAID gyógyszerforgalom közel tíz év alatt megduplázódott. Külön kiemelendő, hogy az NSAID-szerek jelentős része (kb. 50%-a) recept nélkül, OTC (over the counter) formában is kaphatók (6).
A fájdalomcsillapítás tekintetében az elmúlt években több nemzetközi ajánlás, útmutató született, amelyek nyomatékosan hangsúlyozzák a lehetséges mellékhatások és a biztonságosság kérdését (7–9).
NSAID-szerek mellékhatásai
Az NSAID-szerek alkalmazása számos mellékhatással járhat (1. táblázat). Az NSAID-szerek által kiváltott mellékhatások közül kiemelkedő a gasztrointesztinális (GI) toxicitás, de gyakoriak a renális, a hepatikus, a csontvelő-mellékhatások, továbbá az immunológiai reakciók és allergiás bőreltérések, valamint a központi idegrendszeri szövődmények is. Az utóbbi években a kardiovaszkuláris (CV) mellékhatások is előtérbe kerültek. Az NSAID-szerek által okozott mellékhatások különösen időskorban és társbetegségek jelenlétében számottevők (10–12).
1. táblázat: A nemszteroid gyulladáscsökkentő (NSAID) szerek mellékhatásai
- Gasztrointesztinális (lásd 2. táblázat)
- Kardiovaszkuláris (miokardiális infarktus, hipertenzió, szívelégtelenség, trombembóliás szövődmények, cererebrovaszkuláris szövődmények)
- Renális: nátriumretenció, ödémaképződés, glomerulus filtrációcsökkenés, tubulopathia, hipertenzió, szívelégtelenség, heveny veseelégtelenség, idült veseelégtelenség
- Hepatikus: gyógyszer-indukálta májkárosodás (drug-induced liver injury – DILI)
- Csontvelő: leukopenia, thrombocytopenia
- Vérzékenység: trombocitaaggregáció-gátlás
- Immunológiai-allergiás: NSAID-hiperszenzitivitás; aszpirin-hiperszenzitivitás (asztma, rhinitis, polyposis nasi), urticaria, angioödéma, allergiás bőreltérések, Stevens–Johnson-szindróma, interstitialis nephritis, allergiás hepatitis
- Központi idegrendszeri: szédülés, zavartság, delírium
Gasztrointesztinális mellékhatások
Az NSAID-szedő betegek kb. 30%-ában dyspepsiás panaszok jelentkeznek. A felső GI nyálkahártya-károsodás spektruma a submucosus pettechiális vérzésektől, a felszínes eróziókon át fekélyekig terjedhet, de akár súlyos, életet veszélyeztető fekélyszövődmények (vérzés, perforáció) is felléphetnek. Az NSAID-asszociált tünetek nincsenek egyenes arányban az endoszkópos eltérésekkel. Az endoszkópos vizsgálatok során a krónikus NSAID-szedők 15-30%-ában peptikus fekélyek (főleg gyomorfekély), 30-50%-ban pedig gyomornyálkahártya-eróziók igazolhatók. A fekélyek jelentős része un. „néma” (silent) fekély (nem okoznak tüneteket, és spontán meggyógyulnak), ezért a felső GI súlyos szövődmények aránya jóval kisebb (1-3%). A krónikus NSAID-szedő betegek között a felső tápcsatornai szövődmények éves gyakorisága 1,0-1,5%. A szövődmények morbiditása és mortalitása azonban számottevő. Az összes tápcsatornai vérzés kb. 30%-a NSAID-szedéssel hozható összefüggésbe. NSAID-szedő fekélybetegekben 4-5-ször gyakoribb a vérzés és nő a perforáció kockázata is. Az NSAID-szerek szedése esetén alsó GI-szövődményekkel is számolni kell: a vékonybélben és a vastagbélben fekélyeket, perforációt, vérzést, szűkületet idézhetnek elő, továbbá hasmenés, colitis, fehérjevesztés, vérszegénység is felléphet. A vastagbél-diverticulumok szövődményeinek (vérzés, perforáció) hátterében is gyakran NSAID-szedés húzódik meg (2. táblázat) (13–16).
2. táblázat: Az NSAID-szerek gasztrointesztinális mellékhatásai

Nemzetközi adatok arra utalnak, hogy a GI-szövődmények szempontjából nagykockázatú betegcsoportban, több rizikótényező ellenére, a betegek csupán töredéke részesül hatékony gyomornyálkahártya-védelemben (gasztroprotekcióban) (17–20).
3. táblázat: Az NSAID-asszociált szövődmények kockázati tényezői

A hatékony gasztroprotekciót illetően jelenleg nem áll rendelkezésre naprakész magyar útmutató vagy ajánlás. Emiatt a hazai gasztroenterológus és reumatológus szakmavezető szakértőinek bevonásával 2020. március 24-én webkonferencia keretén belül konszenzus megbeszélésre került sor. Az NSAID-kezeléssel kapcsolatosan a legújabb evidenciák figyelembevételével összefoglaljuk a multidiszciplináris konszenzus legfontosabb megállapításait-útmutatásait.
Gasztrointesztinális kockázati tényezők
Mivel az NSAID asszociált-gastropathia jelentős része tünetmentes, a megelőzés szempontjából alapvető feladat a GI szempontból fokozott kockázatú („high risk”) betegcsoport meghatározása. Az alacsony-átlagos kockázati betegcsoportba azok a 65 év alatti, aszpirint, vagy trombocitaaggregáció-gátló (TAG), antitrombotikus szert nem szedő betegek tartoznak, akiknek a kórtörténetében nem szerepel fekélybetegség vagy korábbi érdemi tápcsatornai esemény. Az NSAID-asszociált szövődmények kockázati tényezőit az 3. táblázat tartalmazza (21–24). A szív-ér rendszeri betegségekben rutinszerűen alkalmazott kockázatfelmérés analógiájára jelenleg még nem áll rendelkezésre olyan validált GI-kockázatfelmérő kalkulátor, amely révén egyértelműen meg tudnánk határozni a NSAID-asszociált gastropathia abszolút kockázatát (25, 26).
4. táblázat: Az NSAID-kezelés során elkövetett leggyakoribb hibák
- Pontos diagnózis nélküli adagolás
- Fájdalomcsillapítóként alkalmazott tartós NSAID-kezelés
- Hatástalanság esetén egyidejűleg újabb NSAID-szerek bevezetése
- Az NSAID-kezelés folytatása a panaszok megszűnte után
- „Veszélyes” gyógyszer-kombinációk alkalmazása egyidejű NSAID + antikoaguláns, TAG, kortikoszteroid
- Nem fordítunak időt a gyógyszeres anamnézisre
- Kockázati tényezők figyelmen kívül hagyása
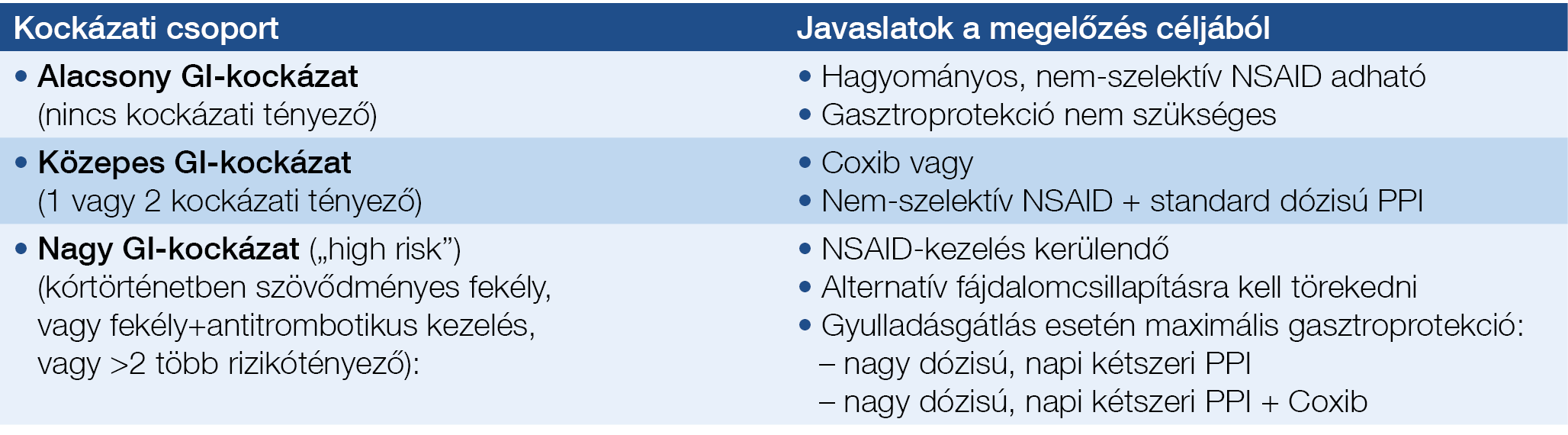
Az Amerikai Gasztroenterológia Kollégium egy önkényesen megalkotott, nem validált, a rizikótényezők súlyozásán és számán alapuló kockázatelemzést javasol (23). Az alacsony (átlagos) GI-kockázatú csoportba olyan betegek tartoznak, akiknek nincs kockázati tényezője. A közepes GI-kockázatú csoportot 1 vagy 2 rizikótényezővel rendelkező betegek alkotják, míg a nagy GI-kockázatú („high risk”) csoportba azok tartoznak, akiknek kórtörténetében szövődményes fekélybetegség szerepel vagy többszörös (kettőnél több) kockázati tényezővel rendelkeznek. A nemrég lezajlott szövődményes fekélybetegek különösen nagy kockázatnak vannak kitéve, akiknél, ha csak egy mód van rá, lehetőség szerint kerülni kell az NSAID-kezelést, alternatív fájdalomcsillapításra kell törekedni. Ha a gyulladásgátlás mégsem kerülhető meg, akkor azt csupán a legnagyobb gondosság mellett, a lehető legrövidebb ideig és maximális gyomorvédelem (gasztroprotekció) mellett szabad alkalmazni. Az anamnézisben szereplő fekélybetegség esetében (függetlenül attól, hogy fellépett-e bármikor szövődmény), az egyidejű kisdózisú aszpirin (ASA), TAG, antikoaguláns, kortikoszteroid-kezelés vagy az egyidejűleg kettőnél több fennálló kockázati tényező esetében az adott beteg szintén az igen nagy GI-kockázatú csoportba tartozik. Ebben az esetben is maximális gyomorvédelemre (gasztroprotekcióra) kell törekedni. A kockázati tényezők nélküli betegek (alacsony GI-kockázati csoport) esetében nincs szükség rutinszerű gasztroprotekcióra (23).
A gasztroprotekció lehetőségei
Az NSAID-kezelés során elkövetett gyakori hibákat a 4. táblázat foglalja össze.
Az NSAID-asszociált gastropathia kezelésében döntő tényező a megelőzés. A szövődmények megelőzése céljából a legfontosabb szempontokat 5. táblázat foglalja össze.
Krónikus NSAID-szedés esetén, a közepes és az igen nagy GI-kockázatú („high risk”) csoportban kiegészítő stratégiára, profilaktikus kezelésre, gyomornyálkahártya-védelemre (gasztroprotekcióra) kell törekedni. A gyakorlatban a gasztroprotekcó céljából a prosztaglandinanalóg misoprostol, a szelektív COX-2-gátlók (coxibok) és a hatékony savszekréció-gátlók alkalmazása jön szóba. A gasztroprekció egyéb lehetséges módozatai (nitrogéndonor-NSAID, egyidejű ciklooxigenáz- és leukotrién-gátlás, laktoferrin) kísérletes stádiumban vannak, vagy klinikailag nem váltak be (6. táblázat) (27, 28).
5. táblázat: Az NSAID-szerek által okozott tápcsatornai szövődmények megelőzése céljából legfontosabb gyakorlati szempontok
- Kezelés előtt mérjük fel a gasztrointesztinális és a kardiovaszkuláris kockázati tényezőket
- Mérlegeljük a renális és a hepatikus kockázatokat
- Rövidtávon próbáljunk más, nem NSAID-típusú szert alkalmazni
- Lehetőség szerint kerüljük a folyamatos NSAID-kezelést
- A veszélyeztetett csoportban csak körültekintően kezdeményezzünk NSAID-kezelést
- A legkisebb, de még hatékony NSAID-dózist a legrövidebb ideig adjuk
- A kezelést minden esetben individuálisan állítsuk be
- Kerüljük a nagykockázatú, veszélyes gyógyszer-kombinációkat
- Tartós NSAID-kezelés előtt végezzük el a H. pylori eradikációt
A prosztaglandinanalóg misoprostol több vizsgálatban is hatékony gyomorvédelmet nyújtott: dózisfüggő módon a gyomor- és nyombélfekélyekkel szemben egyaránt védőhatása van, de alkalmazásának határt szabnak a gyakori dózisfüggő mellékhatások, mint pl. a hasmenés, hányás, hasi görcsök, ezért rutinszerű alkalmazása nem terjedt el (29, 30).
6. táblázat: A gasztroprotekció lehetséges módozatai
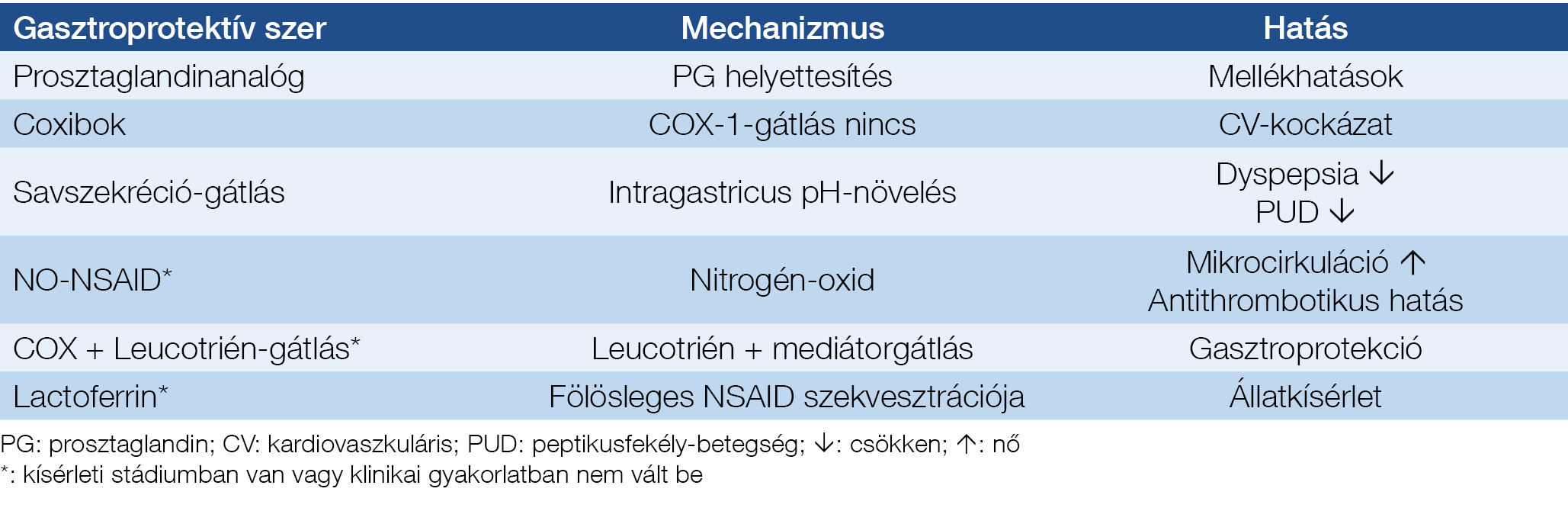
A szelektív COX-2-gátlók (coxibok) nagy betegcsoportokon végzett, multicentrikus klinikai viszgálatokban a GI-mellékhatások tekintetében egyértelműen előnyösebbnek bizonyultak, mint a hagyományos, nem szelektív NSAID-szerek. A coxibok összességében kb. 50%-kal csökkentik a klinikailag jelentős felső GI-események-szövődmények relatív kockázatát. Fontos azonban hangsúlyozni, hogy a CV-profilaxis céljából alkalmazott egyidejű aszpirin (ASA)-szedés esetén a coxibok kedvező GI-profilja már nem érvényesül: egyidejű ASA- és coxibszedés mellett azonos arányú fekélyes szövődménnyel kell számolni, mint a hagyományos, nem-szelektív NSAID-szerek esetében (30, 31–34).
A gasztroprotekció legelterjedtebb módja a hatékony savszekréció-gátlás. A H2-receptor-antagonisták (H2RA) a PPI-szerekhez képest kevésbé hatékonyak: a H2RA-szerek standard dózisban ugyan csökkentik az NSAID-asszociált duodenális fekélyek incidenciáját, de a gyomorfekélyek, valamint a szövődmények arányát érdemben nem befolyásolják. A már kialakult eltérések (fekélyek, eróziók) esetén az első teendőnk az NSAID szedésének felfüggesztése vagy legalábbis a szer dózisának csökkentése. Az NSAID-szer elhagyása esetén a gyógyulást hatékony savszekréciógátló-kezeléssel segíthetjük elő. E téren is a leghatékonyabbak a PPI-szerek, a H2RA-szerek lassabban és kisebb arányban gyógyítják a már kialakult fekélyeket (35, 36). Számos metaanalízis igazolta, hogy a PPI-gasztroprotekció hatékonyabban megelőzi az endoszkóposan igazolt fekélyek, a tüneteket okozó fekélyek és a felső GI-szövődmények (elsősorban a felső tápcsatornai vérzés) előfordulását, mint a H2RA vagy a misoprostol. Az is igazolódott, hogy a már fellépő felső GI-vérzés esetén a PPI hatékonyabban csökkenti a transzfúziós igényt és az újravérzés kockázatát, mint a H2RA (29, 30). A fentiek alapján megállapítható, hogy a PPI-szerek minden vonatkozásban hatásosabb gasztroprotektív szerek, mint a H2RA-k. Folyamatos H2RA-szedés esetén ráadásul a tachyphylaxia jelenségével is számolni lehet, amely hatáscsökkenést eredményezhet (37).
Több vizsgálat metaanalízise értelmében a leghatékonyabb gasztroprotekciót a coxib és a PPI kombinációja biztosítja (38, 39).
Az Amerikai Gasztroenterológia Kollégium által megalkotott, a rizikótényezők számából és jelentőségéből kiinduló kockázatelemzés alapján (23) az NSAID-asszociált gastropathia és fekélyes szövődmények megelőzése céljából az alábbi stratégia javasolható:
- alacsony GI-kockázatú csoport (nincs GI-kockázati tényező): hagyományos, nem-szelektív NSAID adható, gasztroprotekció nem szükséges;
- közepes GI-kockázatú csoport (1 vagy 2 rizikótényező): szelektív COX-2-gátló (coxib) vagy hagyományos, nem-szelektív NSAID + standard dózisú PPI kombináció;
- a nagy GI-kockázatú („high risk”) csoport (kórtörténetben szereplő szövődményes fekélybetegség, vagy szövődménytől független fekélybetegség és egyidejű kisdózisú
ASA, TAG, antikoaguláns, kortikoszteroid-kezelés, végül egyidejűleg fennálló kettőnél több kockázati tényező): lehetőség szerint kerülni kell az NSAID-kezelést, alternatív fájdalomcsillapításra kell törekedni. Amennyiben a gyulladásgátlás mégsem kerülhető meg, akkor azt csak a lehető legrövidebb ideig szabad alkalmazni és maximális gasztroprotekciót (nagy dózisú, napi kétszeri PPI-t vagy coxib és nagy dózisú, napi kétszeri PPI-kombinációt) kell biztosítani (7. táblázat).
7. táblázat: Az NSAID-asszociált felső gasztrointesztinális (GI) szövődmények megelőzésének stratégiája a különböző kockázati csoportok függvényében
NSAID-asszociált dyspepsia kezelése
NSAID-szedés mellett a betegek akár 30%-ában dyspepsia jelentkezik, amely miatt a betegek kb. 10%-a félbeszakítja a gyógyszeres kezelést. Az NSAID-asszociált dyspepsia nem mutat összefüggést az endoszkópos eltérésekkel, nem jelzi előre a fekélyes szövődményeket. Számos vizsgálat igazolta, hogy a PPI-védelemben alkalmazott hagyományos NSAID-kezelés során ritkábban jelentkezik dyspepsia, mint a coxibkezelés során. Az NSAID-asszociált dyspepsia megelőzésében a PPI-védelem költséghatékony stratégia (40, 41).
Milyen PPI-dózist alkalmazzunk a gasztroprotekció során?
A nagyesetszámú randomizált vizsgálatok arra utalnak, hogy akár a hosszú távú NSAID-kezelés esetén is a közepes GI-kockázatú csoportban (1 vagy 2 rizikófaktor jelenlétében) a napi egyszeri standarddózisú PPI hatékonyan kivédi az NSAID-asszociált gastropathiát, fekélyképződést és a fekélyes szövődményeket (29, 30, 42). A nagy GI-kockázatú („high risk”) csoportban, amennyiben a gyulladásgátlás elkerülhetetlen, maximális gasztroprotekcióra kell törekedni: nagy dózisú, napi kétszeri PPI vagy amennyiben a CV-kockázat is lehetővé teszi, coxib és nagy dózisú, napi kétszeri PPI kombináció (pl. 2×40 mg pantoprazol, 2×40 mg esomeprazol, 2×30 mg lansoprazol, 2×20 mg rabeprazol, 2×20 mg omeprazol).
A PPI-gasztroprotekció időtartama
A közepes és nagy GI-kockázatú betegcsoportban a hosszú távú NSAID-kezelés teljes időtartama alatt biztosítani kell a megfelelő dózisú PPI-védelmet (ld. előző pontot). Hasonlóképpen, a közepes és nagy GI-kockázatú betegcsoportban a rövid távú (10-14 napos) NSAID-kezelés ideje alatt is szükséges a megfelelő dózisú PPI-gasztroprotekció.
Minden PPI egyformán hatékony a gasztroprotekció során?
A PPI-szerek hatásmechanizmusa alapvetően azonos, csupán a farmakokinetika-farmakodinámia terén vannak bizonyos különbségek, az eltérések klinikai jelentősége azonban nem egyértelmű. Mindegyik PPI-szer klinikailag hatékony gasztroprotekciót biztosít.
PPI-gasztroprotekció és a gyógyszer-interakció kérdése
A mindennapos gyakorlatban azonban, különösen idős, multimorbid, több gyógyszert szedő beteg esetében számolni kell a gyógyszer-interakció lehetőségével. A legtöbb gyógyszer-interakciót a legrégebbi PPI, az omeprazol esetében írták le, míg e téren a pantoprazol rendelkezik a legkedvezőbb tulajdonságokkal (43).
Elsősorban farmakodinámiás-experimentális és megfigyeléses vizsgálatok alapján merült fel a PPI-clopidogrel interakció lehetősége, amelynek következtében csökkenhet a clopidogrel trombocitaaggregáció-gátló hatása. A prospektív, randomizált vizsgálatok azonban egyértelműen igazolták, hogy a clopidogrel és a PPI együttes adása nem növeli a szív-ér rendszeri kockázatot. A mérvadó randomizált, kontrollált eredmények alapján, amennyiben jelentős a GI-vérzés kockázata (pl. kettős TAG-gátlás, clopidogrel és ASA együttes adása esetén), PPI-alapú gyomorvédelmet (gasztroprotekciót) kell alkalmazni (44–48).
Egy friss nemzetközi, nagy esetszámú, 17 598 beteget bevonásával végzett multicentrikus, prospektív, kettős vak, randomizált (COMPASS – Cardiovascular Outcomes for People Using Anticoagulation Strategy) vizsgálat is megerősítette a PPI-kezelés CV biztonságosságát (49).
Helicobacter pylori eradikáció és NSAID-kezelés
Az NSAID-asszociált fekélybetegség kialakulásában a Helicobacter pylori (H. pylori) szerepe bizonytalan. A fekélyes szövődmények szempontjából a H. pylori és az NSAID-szedés azonban független rizikótényezőknek tekinthetők, amelyek külön-külön károsítják a gyomornyálkahártyát. A nemzetközi ajánlások értelmében az NSAID-kezelés előtt (ún. „NSAID-naiv” betegekben) elvégzett H. pylori eradikáció csökkenti a fekélyek incidenciáját, a vérzések arányát. Fekélyes anamnézis esetén, tervezetten tartós NSAID-szedés előtt, vagy az egyébként is nagy GI-kockázatú („high risk”) csoportban H. pylori tesztelést kell végezni és pozitivitás esetén eradikációs kezelés szükséges (50, 51).
A nem-szelektív NSAID-szerek és a coxibok kardiovaszkuláris biztonságossága
A rofecoxibbal végzett VIGOR-vizsgálat eredményei irányították a figyelmet arra, hogy a szelektív COX-2-gátlók (coxibok) a naproxennel történő összehasonlítás során megnövelhetik a CV-kockázatot és a miokardiális infarktus gyakoriságát (52). Az APPROVE-vizsgálatban a colorectalis polypok kemoprevenciója céljából alkalmazott tartós rofecoxib kezelés mellett 18 hónap után a kumulatív trombotikus szövődmények (miokardiális infarktus, cerebrovaszkuláris szövődmények) incidenciája szignifikánsan magasabb volt, mint a placebocsoportban, de emellett a hipertenzió, a szívelégtelenség, a tüdőödéma gyakorisága is megnőtt a rofecoxibbal kezelt csoportban (53). Mindezek a nemkívánatos CV-mellékhatások vezettek oda, hogy a rofecoxibot 2004-ben kivonták a gyógyszerpiacról. Az APC- (Adenoma Prevention with Celecoxib) vizsgálatban a celecoxib esetében is dózisfüggő arányban fokozott CV-kockázat igazolódott (54). Ezt követően a többi coxib esetében is felmerült a megnövekedett CV-kockázat lehetősége (55). A fokozott CV-kockázat elméleti háttere az, hogy a coxibok elsősorban az endothelsejtek által termelt érprotektív prosztaciklin (PGI2) termelését gátolják, míg a vazokonstrikciót és trombocitaaggregációt fokozó thromboxán-A2 (TxA2) termelődése változatlan marad, ez a konstelláció pedig megnöveli a trombózishajlamot (56). Ezt követően a 2000-es években nagy adatbázisok alapján nemcsak a coxibok, hanem a hagyományos, nem-szelektív NSAID-szerek CV-kockázatát is vizsgálták. A mérvadó, nagy esetszámú metaanalízisek azt igazolták, hogy a fokozottabb CV-kockázat nem coxib-specifikus, hanem számos nem-szelektív NSAID esetében is megfigyelhető a rizikónövekedés, ráadásul a CV-kockázat terén az egyes hagyományos NSAID-szerek között is különbségek igazolhatók (57–60). A metaanalízisek eredményei arra utalnak, hogy a naproxen esetében figyelhető meg a legalacsonyabb CV-kockázat. A naproxen kedvező tromboembóliás és CV biztonságossága alapvetően azzal magyarázható, hogy alacsony a COX-2-szelektivitása, nagyobb mértékben, reverzibilisen gátolja a COX-1 és a TxA2-enzimet. Mivel a naproxen hatására a PGI2-csökkenés mellett kifejezettebb a TxA2-csökkenés, a PGI2/TxA2-arány pozitív marad, amely ún. „kardiosemleges” hatást eredményez (56, 61).
A fentiek tükrében egyértelmű, hogy az NSAID-kezelés mérlegelésekor a GI-kockázat mellett a CV-kockázatot is messzemenően figyelembe kell venni. A coxibok alkalmazása GI szempontból közepes vagy nagy kockázatú, de alacsony CV-rizikóval rendelkező betegcsoportban indokolt. A lehetséges legkisebb, még hatásos coxib dózist kell alkalmazni, ahhoz, hogy minimalizáljuk az esetleges CV- és trombembóliás mellékhatásokat. Mivel a hagyományos NSAID-szerek esetében is fennáll a CV-mellékhatások lehetősége, ismert CV-kockázat esetén naproxenkezelésre kell törekedni. A CV-profilaxis céljából alkalmazott egyidejű ASA-szedés esetén a coxibok kedvező GI-profilja már nem érvényesül, ezért CV-megelőzés céljából történő kis dózisú ASA-szedés esetén is naproxen és PPI-kombinációt kell alkalmazni. Hasonlóképpen, közepes GI- és magas CV-kockázat esetén a naproxen és PPI-kombináció választandó. Egyidejűleg fennálló nagy GI-kockázat („high risk”) és magas CV-kockázat esetén az NSAID- és a coxibkezelés lehetőség szerint egyaránt kerülendő, alternatív terápia választandó (3, 23, 62).
8. táblázat: NSAID-kezelési stratégia a gasztrointesztinális (GI) és a kardiovaszkuláris (CV) kockázatok függvényében

A GI- és a CV-kockázat figyelembevételével az NSAID-kezelési stratégiát a 8. táblázat foglalja össze.
Renális és hepatikus kockázat
A GI- és a CV-mellékhatások mellett a renális és hepatikus mellékhatásokat is minden esetben mérlegelni kell. Különösen idős betegekben, beszűkült vesefunkció, szívelégtelenség vagy nehezen beállítható magas vérnyomás esetén az NSAID-szerek alkalmazása során a renális mellékhatások kockázata igen jelentős (nátriumretenció, ödémaképződés, glomerulus filtrációcsökkenés, tubulopathia, hipertenzió, heveny veseelégtelenség, idült veseelégtelenség). Ezért a mindennapos gyakorlatban, amennyiben fennáll a veseszövődmények kockázata, megfelelő gasztroprotekció esetén sem javasolt az NSAID-szerek tartós (egy hétnél hosszabb idejű) alkalmazása, sőt renális kockázat fennállása esetén az NSAID-terápia akár ellenjavallt is lehet.
NSAID-kezelés során fennáll az NSAID-indukálta májkárosodás (drug-induced liver injury – DILI) lehetősége, K-vitamin-antagonistákat szedő betegek esetében pedig gyakori az INR-érték eltolódása. Ezért tartósabb NSAID-kezelés esetén alapvető a körültekintő, korlátozott gyógyszerhasználat, és rendszeres májfunkció, INR-ellenőrzés szükséges (10–12).
Az etoricoxib szerepe a mozgásszervi kórképek kezelésében
Az etoricoxib szelektív COX-2-gátló szer, amely a COX-1 gátlása nélkül, dózisfüggő mértékben gátolja a COX-2-enzimet, de nem befolyásolja a gyomor prosztaglandinszintézisét vagy a vérlemezkék működését. Az etoricoxibot Európában az osteoarthritis, rheumatoid arthritis, spondylitis ankylopoetica és heveny köszvényes arthritis tüneti kezelésére törzskönyvezték. A coxibcsalád egyes tagjainak (rofecoxib, celecoxib, valdecoxib, lumiracoxib, etoricoxib) eltérő farmakokinetikai és farmakodinámiás paraméterei vannak, amelyek bizonyos különbségeket eredményezhetnek a biológiai aktivitás, a klinikai hatékonyság és a biztonságosság terén. Így, pl. az etoricoxib szulfonil csoportja, míg a celecoxib és valdecoxib szulfonamid csoportja felelős az esetleges allergiás reakciókért. Külön kiemelendő, hogy az etoricoxib esetén gyorsan elérhető a maximális szérumkoncentráció (Tmax=1 óra), míg ez az érték celecoxib esetén 2-3 óra. A gyors hatáskezdet miatt az etoricoxib hatékonyan alkalmazható heveny fájdalomcsillapításra (63–66).
Az etoricoxib klinikai hatékonyságát számos nagy esetszámú vizsgálat igazolta. Az osteoarthritises betegek kezelése során az 6-12 hetes etoricoxibkezelés (30 és 60 mg) hatékonyabb volt, mint a placebo, és a hatékonysága megegyezett a celecoxib (2×100 mg), vagy a diclofenac (3×50 mg), az ibuprofen (3×800 mg) és a naproxen
(2×500 mg) hatékonyságával. Rheumatoid arthritis és spondylitis ankylopoetica esetén nem végeztek etoricoxibot és celecoxibot közvetlenül összehasonlító vizsgálatot. Rheumatoid arthritisben az etoricoxib (1×90 mg) kezelés a 8-12 hetes terápiás időszak alatt hatékonyabb volt, mint a placebo és legalább annyira hatékonynak bizonyult, mint a naproxen (2×500 mg). Spondylitis ankylopoetica esetén a 6 hetes kezelés során a napi 90 mg etoricoxib hatékonyabbnak bizonyult, mint a placebo. Egy másik vizsgálatban a napi 90 mg etoricoxib 6 hetes, valamint 52 hetes kezelés során szignifikánsan hatékonyabb volt, mint a napi 1000 mg naproxen (65–68). Heveny köszvényben, 851 beteg bevonásával végzett 6 vizsgálat összesített eredményei alapján a napi 120 mg etoricoxib, a 3×50 mg indometacin és a 3×50 mg diclofenac hatékonysága megegyezett. A köszvényes betegek az etoricoxibot jobban tolerálták, mint a nem-szelektív hagyományos NSAID indometacint vagy a diclofenacot. A Cochrane-adatbázis szerinti 22 vizsgálat elemzése során az etoricoxib fájdalomcsillapító és gyulladáscsökkentő hatása szintén megegyezett a hagyományos NSAID-szerekével (indometacin, diclofenac, naproxen), de az etoricoxib esetén ezúttal is kisebb volt a mellékhatások aránya (69, 70). Az etoricoxibot a mozgásszervi kezelések során a betegek jól tolerálták. A GI (dyspepsia, felhasi fájdalom, hasmenés, hányinger) és a CV-mellékhatások (hipertenzió, perifériás ödéma) jelentkeztek leggyakrabban.
A MEDAL (Multinational Etoricoxib and Diclofenac Arthritis Long-term) program keretén belül több mint 34 000 beteg összesített adatait elemezve azt találták, hogy az etoricoxibkezelés során szignifikánsan kevesebb GI-mellékhatás lépett fel, mint a hagyományos, nem-szelektív NSAID (diclofenac) esetében. Ez a különbség PPI- és kis dózisú ASA-kezelés mellett is fennmaradt. A hosszú távú etoricoxib- és diclofenackezelések során a trombotikus CV-mellékhatások aránya megegyezett, de az etoricoxib esetében a GI mellett a hepatikus mellékhatások is ritkábban jelentkeztek. Egy 12 vizsgálat alapján készült metaanalízis során azt találták, hogy az etoricoxib esetében számszerűen ugyan több trombotikus esemény lépett fel, mint naproxen esetében (de a különbség nem volt statisztikailag szignifikáns), míg az etoricoxib és a nem-naproxen típusú hagyományos NSAID-szerek között e téren nem volt különbség (71–74).
Ezek alapján, nagyobb GI és hepatikus kockázatú betegekben, akiknek nincs CV-kockázata, a fentiekben részletezett mozgásszervi betegségekben a gyors hatáskezdetű és jól tolerálható etoricoxib hatékonyan alkalmazható elsővonalbeli kezelésként.
Következtetések
Az NSAID-szerek hosszú távú (1 hetet meghaladó) alkalmazása számos szervrendszert érintő mellékhatásokkal járhat, ezek többsége specifikus prevenciós kezelés hiányában csak a legkisebb hatékony dózis lehető legrövidebb ideig történő alkalmazással csökkenthető. A felső tápcsatornát érintő GI-kockázat és a CV-kockázat együttes értékelésével és a kockázati besorolástól függően kiválasztott kezelési stratégiával azonban a GI- és a CV-kockázat tovább mérsékelhető. Gasztroprotekció csak GI-rizikótényezők hiányában mellőzhető, közepes, illetve nagy GI-kockázat esetén napi egyszeri dózisú, illetve napi kétszeri dózisú PPI-kezelés javasolt. Hosszú távú NSAID-terápia bevezetésekor a H. pylori pozitív betegek eradikációs kezelése szükséges. Magas CV-kockázat esetén a coxibok mellőzendők, ebben a betegcsoportban elsősorban a naproxen használata javasolt.
2. Herszényi L. A nem szteroid gyulladáscsökkentő (NSAID) okozta gastropathia klinikai jelentősége és hatékony megelőzése. Háziorvos Továbbképző szemle 2019; 24: 441–445.
3. Scarpignato C, Lanas A, Blandizzi C, Lems WF, Hermann M, Hunt RH; International NSAID Consensus Group. Safe prescribing of non-steroidal anti-inflammatory drugs in patients with osteoarthritisan expert consensus addressing benefits as well as gastrointestinal and cardiovascular risks. BMC Med 2015 Mar 19; 13: 55.
4. Moriarty F, Cahir C, Bennett K, Fahey T. Economic impact of potentially inappropriate prescribing and related adverse events in older people: a cost-utility analysing using Markov models. BMJ Open 2019; 9: e021832.
5. Lu Y, Sverdén E, Ljung R, et al. Use of non-steroidal anti-inflammatory drugs and proton pump inhibitors in correlation with incidence, recurrence and death of peptic ulcer bleeding: an ecological study. BMJ Open 2013; 3: e002056.
6. Herszényi L. Havi egy millió- van amikor sok, van amikor kevés. Háziorvos Továbbképző szemle 2019; 24: 654–657.
7. Hochberg MC, Altman RD, April KT, Benkhalti M, Guyatt G, McGowan J, Towheed T, Welch V, Wells G, Tugwell P; American College of Rheumatology. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res (Hoboken) 2012; 64: 465–474.
8. Geenen R, Overman CL, Christensen R, Åsenlöf P, Capela S, Huisinga KL, et al. EULAR recommendations for the health professional’s approach to pain management in inflammatory arthritis and osteoarthritis. Ann Rheum Dis 2018; 77: 797–807.
9. Kloppenburg M, Kroon FP, Blanco FJ, Doherty M, Dziedzic KS, Greibrokk E, Haugen IK, Herrero-Beaumont G, Jonsson H, Kjeken I, Maheu E, Ramonda R, Ritt MJ, Smeets W, Smolen JS, Stamm TA, Szekanecz Z, Wittoek R, Carmona L. 2018 update of the EULAR recommendations for the management of hand osteoarthritis. Ann Rheum Dis 2019; 78: 16–24.
10. Wehling M. Non-steroidal anti-inflammatory drug use in chronic pain conditions with special emphasis on the elderly and patients with relevant comorbidities: management and mitigation of risks and adverse effects. Eur J Clin Pharmacol 2014; 70:1159–1172.
További irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.olo.hu weboldalon.
