Orvostörténet / History in medicine
Vaccination in infectious digestive diseases: a historical overview
Summary
Epidemics have decimated the human population for thousands of years, even endangering their survival in some cases. The history of vaccinations began at the end of 18th century. Thereafter, with the development of bacteriology and immunology, the laboratory production of vaccines became possible using the inactivation and attenuation of viruses and bacteria. Vaccination programs were developed in different countries using different schedules. Later, vaccines using cell cultures and viral vectors were also created. With the advent of genetics, the use of molecular engineering and markers enabled the production of specific vaccines, which were used successfully in the prevention of some digestive infectious diseases such as cholera, rotavirus, hepatitis A and B. In spite of all the efforts, however, the science of vaccinology has yet to come up with vaccines for some diseases of great importance to public health: Helicobacter pylori and hepatitis C virus and Clostridioides difficile infection.
A járványok évszázadokig megtizedelték az emberiséget, területenként veszélyeztetve egyes népcsoportok fennmaradását. Az oltások története a 18. század végén kezdődött. A bakteriológia és immunológia lehetővé tette az oltóanyagok laboratóriumi fejlesztését: ehhez a baktériumok, és vírusok inaktivációját és attenuálását használták. Ezzel párhuzamosan országonként különböző és időben változó oltási programok alakultak ki. Utóbb kialakultak a sejttenyészetet és virális vektorokat alkalmazó vakcinák. A genetika fejlődésével a 20-21. században lehetőség nyílt molekuláris genetikai markerek segítségével új típusú oltóanyagok bevezetésére, amelyekkel sikeresen lehetett felvenni a harcot számos emésztőszervi fertőző betegséggel (kolera, rotavírus, hepatitis A- és B-vírus-fertőzés). Minden kutatási erőfeszítés ellenére a tudomány adós maradt néhány közegészségügyileg jelentős fertőzésben az oltóanyaggal: ezek a Helicobacter pylori, a hepatitis C-vírus és a Clostridioides difficile-fertőzés.
Járványos időszakot élünk: e dolgozat fogalmazásakor zajlik országszerte a SARS-CoV-2-fertőzés harmadik hulláma, és a lakossági oltás kor- és kockázati csoport szerinti szervezésben. Mivel az emésztőtraktus számos fertőző betegségben érintett, időszerű, hogy az oltások történetét áttekintsük. Az oltásokkal hatalmas irodalom foglalkozik: a Pubmed adatbázisban (https://www.pubmed.ncbi.nih, kapcsolódás: 2021. április 12) a „vaccine” keresőszónál 409 609 közlemény található. A vakcinák történetével 1807–2020 között 15 421 cikk foglalkozik. Az Orvosi Hetilapban 1952–2020 között 312 cikk jelent meg az oltásokról.
Meghatározás
A vakcina kifejezés a latin vacca (tehén) szóból ered. A vakcináció terminust Louis Pasteur (1822–1892) vezette be 1881-ben. Az inoculatio latin eredetű, az in = be + oculus = bimbó, kiemelkedés szavakból alakult ki (1–3).
Az évmilliók során az élővilág fennmaradását a klímaváltozások és a járványok befolyásolták. Amióta a történetírás létezik, számos endémiát/pandémiát írtak le, amelyek egyes területeken a populációk túlélését veszélyeztették: áttekintésük az 1. táblázatban olvasható. E járványok egy része a történelmi Magyarországot is érintette, amelyről számos korabeli dokumentum szól: ez nem része jelen dolgozatnak.
Epidemiológusok és orvostörténészek gyakran hangoztatják, hogy az oltások bevezetése az orvostudomány legjelentősebb hozzájárulása a közegészségügyhöz. Bár kétségtelen, hogy a fertőző betegségek mortalitása jelentősen csökkent az oltások bevezetésével, a demográfiai adatok tanulmányozásából kiderül, hogy a köztisztaság és táplálkozás javulása már az oltások bevezetése előtt a halálozás csökkenéséhez vezetett (4).
Az oltási módszerek kialakulása
Variolizáció és vakcináció: a himlőoltás
A himlőt Kr. e. 1700 körül ismerték fel Kínában. A himlőről és kanyaróról 910-ben értekezett először Mohammed ibn Zakariya al-Razi (Rhazes) (Kr. u. 860–932). A himlőoltást megelőzően Indiában végeztek inoculatiót, a himlős beteg váladékát a bőr alá fecskendezve. A variola kifejezést Constantinus Africanus (1020–1087) vezette be 1081-ben. A himlő fertőző jellegét Gilbertus Angelicus (1180–1250) írta le. A himlő és a kanyaró közötti különbséget Giovanni Filippo Ingrasia (1510–1580) Paduában tevékenykedő anatómus és törvényszéki orvos figyelte meg (2, 3).
A variolizációt Kínában már a 7. században, majd a 16. században a Ming dinasztia idején gyakorolták (2). 1717-ben Lady Mary Wortley Montagu (1689–1762), Anglia törökországi nagykövetének felesége alkalmazta, aki 1715-ben, felhasználva török orvosok írásait, a követség sebészével beoltatta gyermekeit. A variolizációban a pustulákból vett váladékot fecskendezték bőr alá, mások a hegesedett sebekből készítettek kaparékot, megtörték, növényi főzetben feloldották és az orrba adagolták. A módszert később sikerrel próbálták ki fegyenceken Angliában. Gyorsan elterjedt Angliában, majd átkerült a kontinensre: a francia enciklopédisták az eljárást támogatták. XV. Lajos (1710–1774) himlőben hunyt el: halála után unokáját és utódját, XVI. Lajost (1754–1793) variolizálták: a himlőt megúszta, de a guillotine-t nem, a forradalomban a mai Place de la Concorde-on nyilvánosan kivégezték (1).
Az oltások atyjának az angliai Berkeley-ből származó Edward Jennert (1749–1823) tekintik, aki 1773-ban megfigyelte, hogy a tehénhimlős állatok gondozói ellenállóvá válnak az emberi himlővel szemben. Húszéves obszerváció után (!) oltott be egy 8 éves fiút egy állatgondozó nő kezén kialakult pustula váladékával, aki a fertőzést egy jól tejelő Old Gloucester tarka tehéntől kapta (a pustulák a tehenek tőgyén jelennek meg). Jenner két felületes incisiót végzett az alkaron, és pustulából származó váladékkal kente be: helyén apró hólyag jelent meg, a 7-10. napon láz lépett fel. Három hónap múlva emberi himlő váladékával újraoltotta a gyermeket, de a fertőzés nem jelentkezett. Eredményéről be szeretett volna számolni a Royal Societyben, de az nem fogadta el. Újabb 10 személyt oltott be, majd 16 esetbemutatást közölt egy vékonyka könyvben (5).
1. táblázat: Járványok az emberiség történetében (1)
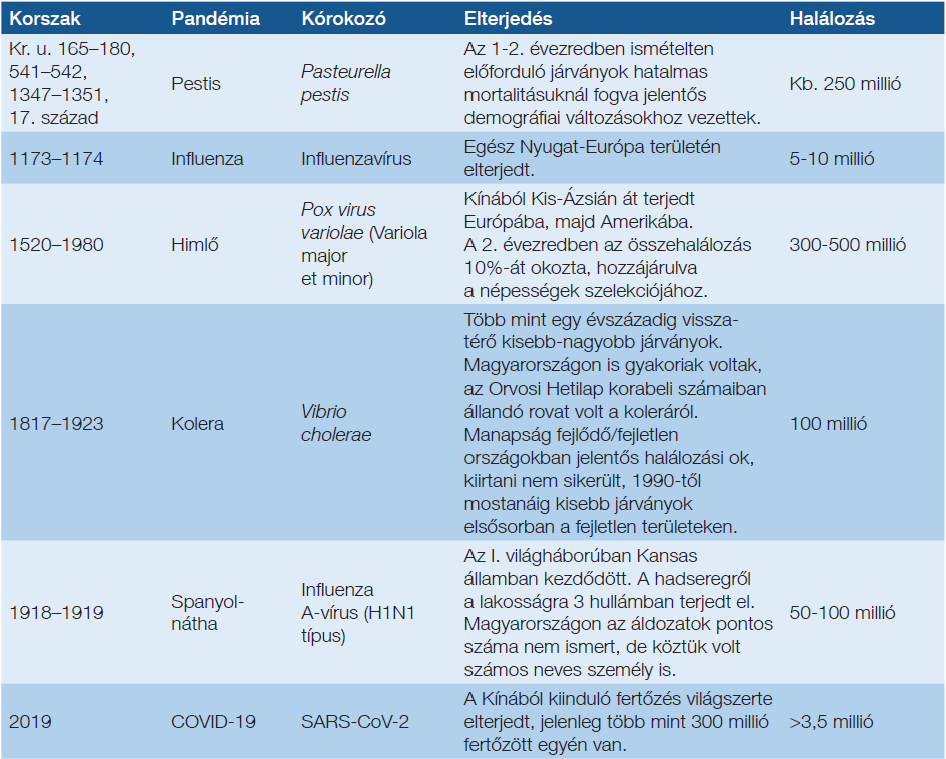
Az irodalomban ezt tekintik a vakcináció kezdetének. Kísérleteit megismételte egy londoni orvos, aki 500 pácienst oltott be, számos esetben nemcsak az oltás helyén, hanem az egész testen pustulák jelentek meg, és egy beteg meghalt: közleménye támadások sorozatát indította el Jenner ellen, tanúsítva, hogy az oltásellenesség egyidős magával az oltással: oka egyként lehet a tudatlanság és/vagy szakmai irigység, féltékenység (6).
Az oltás híre gyorsan terjedt, Napóleon (1769–1821) elrendelte katonái beoltását, és 1811-ben őt magát orvosa, Jean-Nicolas Corvisart (1755–1821) oltotta be, hogy hadseregének példaképül szolgáljon. A himlőoltás kötelezővé vált Dalmáciában (1807), Bajorországban (1807), Dániában (1820), Svédországban és Norvégiában (1826), Angliában (1863), Németországban (1874) és Olaszországban (1888). Az Egyesült Államokban az első oltást 1799-ben végezte Jenner barátja, John Clinch (1749–1819), a kötelező oltást 1809-ben vezették be Massachusetts államban, de az egyes államok eltérő törvénykezése és az ellenkezések miatt csak a század végére terjedt el az egész országban (1).
Hazánkban a himlőoltás az 1801–1887 közötti időszakban szerveződött sok-sok buktatóval, adminisztratív nehézséggel tarkítva, nem beszélve a népi oltásellenességről. Orvostörténészek szerint „ahány megye, annyi oltási rendelkezés” született (7, 8).
A himlővírus a poxvírusok családjába, ezen belül az ortopox vírusok alcsaládjába tartozik. A vírust 1931-ben fedezték fel (9), 1940-ben azonosították a virionban lévő nukleinsavat, 1962-ben mutatták ki, hogy kettős szálú DNS-ből áll: ennek szekvenciáját 1990-ben határozták meg. Genetikai kutatással kimutatták, hogy a vírus kb. Kr. e. 1500–110 között Kínában és Indiában jelent meg. Kr. e. 1580–1110-ből származó egyiptomi múmiákon is kimutattak típusos himlőhelyeket. A genetikai és paleopatológiai adatok ellentmondásosak. Feltételezik, hogy az évezredek során számos genetikai típus alakult ki: ezek közül egyesek eltűntek, mások megjelentek. Az ortopoxvírusok számos állatfajban előfordulnak, a vírus lineáris kétláncú DNS-ben 200, konzervált gén található, de nem ismert, hogy az állati és emberi vírusok mikor váltak szét (10, 11).
A világszerte elterjedt oltás következtében a WHO a himlőt 1980-ban eradikált fertőzésnek nyilvánította. Védett laboratóriumokban (CDC, Atlanta, Egyesült Államok, VECTOR Novoszibirszk, Oroszország) felelhető a himlővírus mint A osztályba tartozó biológiai fegyver (11).
Bár prioritási vita nem keletkezett, francia történész megemlíti, hogy Jacques Antoine Rabaut-Pomier (1744–1820) protestáns lelkész szerint a languedoc-i parasztok megfigyelték, a juh- és tehénhimlő azonos, és átadható az embereknek, akik ellenállóvá válnak a himlővel szemben (1).
A himlő elsősorban bőrtüneteiről ismert. A betegségnek egy enyhe (variola minor) és súlyos (variola major) formája van. Az előbbi mortalitása 30%, az utóbbié 96-97%. A súlyos formát kiterjedt külső és belső vérzések jellemzik, amelyek az emésztőtraktusban a fogínytől a rectumig mindenütt felléphetnek, a májban is kiterjedt vérzések keletkeznek. Amíg a betegség létezett, endoszkópos vizsgálat himlős betegben nem történt, patológiai leírás is kevés: ez valószínűleg a betegség fertőző jellegéből adódott, az orvosok őrizkedtek a betegek ante- vagy post-mortem vizsgálatától (11).
A himlőoltást ma sejttenyészeteken állítják elő. Kísérleti jelleggel az Egyesült Államokban a 2000-es években önkénteseken történtek oltások. Ezekkel felhagytak, de stratégiai készleteket félretettek arra az esetre, ha újabb járvány keletkezne. A lakossági oltást 1982-ben befejezték (11).
Ellentétben a variolizációval, az oltás nem jár mellékhatásokkal: a ritka lokális reakciókon (ekcéma, eritéma) elterjedése után igen ritkán (1-31/1 millió) esetben leírtak encephalitist és szepszist. Mortalitása 1/1 millió volt.
Attenuáció
A kórokozók legyengítésének ötlete a fertőzések leküzdésében fokozatosan alakult ki az elmúlt két évszázadban. A variolizáció módszere a homeopátia analógiája: a kis adagban adott méreg ellenállóvá teszi a szervezetet a mérgező hatással szemben. A kórokozók legyengítésének elvét és módszerét Louis Pasteur fogalmazta meg: először kimutatta, hogy attenuációval megelőzhető a csirkék Pasteurella multocida által okozott hasmenése, majd az antraxot előzte meg hasonló módon juhokban (12); szenzációt azonban a veszettség elleni oltás kidolgozásával keltett. 1880 után sorozatos – részben sikertelen –, nyulakon végzett kísérlet után kimutatta, hogy a veszettség vírusával fertőzött nyúlgerincvelő sorozatos kiszárításával (oxigén + hő) a vírus legyengülése lép fel. 1885-ben a 9 éves Joseph Meister elzászi gyermek háziorvosa kíséretében, veszettség gyanúja miatt kereste fel Pasteurt, aki 12, egyenként 14 napig szárított nyúlvelő-injekciót kapott, és meggyógyult. Haláláig a Pasteur intézet portása volt. 1886-ban Pasteur már 2490 pácienst oltott be: 10 haláleset volt, amelyek megalapozták az ellene indított vehemens, de sikertelen támadásokat (1).
A francia Orvosi Akadémia 2 500 000 frankot adott egy veszettség elleni oltás gyártását szolgáló épületre, amely 1888-ban nyílt meg. Ez lett a Pasteur Intézet, amelyet a felfedező 1895-ös halálig vezetett: nemcsak kutatóhely, de a társasági és kulturális élet központja is volt, máig a francia bakteriológiai kutatások fellegvára. Honlapja a http://www.pasteut.fr; https://fr.wikipedia.org/wiki/Institut-Pasteur), múzeuma a jelenlegi járvány előtt személyesen, most virtuálisan látogatható (http://www.pasteur.fr/fr/institut-pasteur/musee-pasteur). Utódai között a bakteriológia, virológia és vakcinakutatás jelentős alakjai szerepelnek, mint Émile Roux (1853–1933), a diftériatoxin, a svájci Alexandre Émile Yersin (1863–1943), a pestis kórokozójának felfedezője, az orosz Ilja Iljics Mecsnykikov (1845–1916), a fagocitózis leírója (Nobel-díj: 1908), a román Constantin Levaditi (1874–1953) a filtrálható poliomyelitis-vírus leírója, vagy Luc Montagnier, a HIV azonosítója (Nobel-díj: 2008). A dicső múlt azonban nem elég: még a francia sajtó szerint is, az intézet a COVID-19 elleni oltás kutatásában lemaradt (Paris Match, 2021; 3747: 2.26–3.3).
Később rájöttek, hogy a kórokozók legyengíthetők sorozatos in vitro tenyésztéssel: így sikerült a tbc elleni oltás kidolgozása. Calmette és Guerin a Lille-i Pasteur intézetben a Mycobacterium bovist 230-szor tenyésztette mesterséges, ökörepét tartalmazó táptalaján, amíg olyan törzset talált, amelyik véd az emberi tbc ellen: a törzs a nevüket viseli. Egy tenyésztési ciklus 28 napig tartott (13). 1937-ben a hepatitist is okozó sárgaláz elleni oltást a vírus csirkeembrióba való sorozatos oltásával dolgozta ki Max Theiler (1899–1972) a Rockefeller intézetben: 1951-ben Nobel-díjat kapott (14).
Inaktiválás
A 19. század végén figyelték meg, hogy a hővel és vegyszerekkel kezelt baktériumok elpusztulnak, de megőrzik immunogén tulajdonságaikat. 1885–87-ben amerikai és
a Pasteur Intézetben dolgozó francia kutatók inaktiválták a tífusz-, a pestis- és a kolerabacilust. A korszakban a német, a francia és az angol szakemberek között nagy versengés folyt a vakcinák előállításáért. Ennek eredményeképpen az első tífusz elleni vakcinát nem francia, hanem 1896-ban német, 1897-ben angol intézetben állították elő (15, 16). 1899-ben a Pasteur intézetben Mecsnyikov tanítványa, az odesszai Waldemar Mordeháj Wolf Hafkine (1860–1930) pestis és kolera elleni vakcinát dolgozott ki (17).
Önkísérletében hővel inaktivált koleravibriót inoculált magának. 1893-ban Indiában 40 000 embert oltott be kolera ellen. 1902-ben Mulkowal városában a pestist élő vakcina adásával próbálta megelőzni, de készítménye fertőzött volt, és 19 személy tetanuszban elpusztult, de az azt követő perben felmentették (3). Az 1896-ban készített német, tífusz elleni vakcina adása fájdalmas volt, és csak rövid idejű immunitást adott. Évtizedekkel később a kolera elleni oltás orális változatát dolgozták ki: az elölt vibrióból kivonták a B toxint: utóbb ezt a módszer standardizálták a koleraoltásban (2). 1923-ban angol kutatók a diftériatoxint formalinnal inaktiválták, és az így nyert toxoidot használták oltóanyagként: a módszert utóbb tökéletesítették, és az így nyert készítmény toxinneutralizáló ellenanyagot termelt (2).
Az inaktiválást vírusoknál is alkalmazták. Elsőként az influenza vírusát inaktiválták, és ezen felbuzdulva Jonas Edward Salk (1914–1995) New Yorkban formalinnal inaktiválta a gyermekbénulás vírusát, majd injekcióban adható oltóanyagot készített: ez nem helyettesítette az attenuált vírusból készített Sabin cseppeket. 1963-ban a San Diegóban létesített Salk Institute igazgatója lett (3). Korában világhíressé vált.
A HAV-ellenes oltóanyag fejlesztése több évtizedes. Az 1967-ben felfedezett HAV ellen 1978-ban elölt vírust, majd 1979-ben attenuált vírust, 1982–1986 között inaktivációt használtak: ez utóbbinál a vírus CR326 jelzésű törzsét LLC-MK2 majomvese epithelialis sejtjein tenyésztették, majd formalinnal kezelték: a készítmény egerekben és mormotákban antitestek megjelenéséhez vezetett. A mormoták ellenállóvá váltak a HAV-vel szemben (2, 18). Mivel az LLC-MK2 sejtekből preparált oltóanyagot emberben nem lehetett alkalmazni, utóbb MRC-5 sejttenyészetből készült az emberi HAV elleni oltóanyag, amely sikeresnek bizonyult, igazolva, hogy a kémiai inaktivációval a vírusok immunogenitása megőrizhető. Az MRC-5 sejtek azonban abortált foetusok tüdejéből származó fibroblasztok voltak, ez tiltakozást váltott ki a magzatvédőkből. A COVID-érában tévesen felmerült a gyanú, hogy hasonló eredetű sejteket használnak.
Az első, kereskedelmi forgalomba került oltás a GlaxoSmith- Kline Biologicals gyártotta Havrix volt (1992), ezt a Vaqta (1993) (Merck, Sharp & Dohme), az Avaxim (1996) (Sanofi) követte, majd 2002–2006 között kínai oltóanyagok jelentek meg (19). Több más oltóanyagot inaktivációval állítottak elő (kullancs encephalitis – FSME, 1962), japán encephalitis (1970) (2).
Az oltóanyagoknak hatásuk kifejtéséhez adjuvánsokra van szükségük: az első adjuvánst Freund Gyula Tamás (1891–1960) magyar származású amerikai bakteriológus dolgozta ki 1942-ben: tengerimalacokat immunizált lószérum ellen, amelyhez elölt tbc-baktériumokat adott, felerősítve az immunválaszt. Munkájáért Albert Lasker-díjat kapott (ami tudományos berkekben a Nobel-díj előszobájának számít) (20).
Sejttenyésztés
1928-ban sikerült először vírusok tenyésztése veseszövetdarabokon, amelyhez szérumot és szerves sókat adtak. Az 1940-es években a virológusok rájöttek, hogy a kórokozók legyengítése elérhető sorozatos sejttenyésztésbe való átvitellel is. 1946-ban John Enders (1897–1985) Bostonban Thomas Huckle Weller (1915–2008) és Frederick Robbins (1916–2003) csirke- és egérembrióban, majd humán preputium fibroblasztokban a veszettség- és poliomyelitis-vírus tenyésztését dolgozták ki (Nobel-díj: 1954).
Rájöttek, hogy a sorozatos tenyésztéssel olyan vírusmutánsok alakulnak ki, amelyek elvesztik patogenitásukat, de megtartják immunológiai tulajdonságaikat. Munkájuk alapján fejlesztette ki Albert Bruce Sabin (1906–1993) lengyel–amerikai mikrobiológus a gyermekbénulás elleni oltást (21), de a kanyaró-, a rubeola-, a mumpsz-, a varicella- és a citomegáliavírus és a HAV elleni oltást is hasonló módon állították elő. A módszert mindmáig alkalmazzák, 1998-ban a hasmenést okozó rotavírus elleni oltást Vero-sejteken (afrikai zöld majom veséjének epithelialis sejtje) állították elő (2).
Virális vektorok
A vector a latin vehere = vinni, hordozni, utazni jelentésű igéből származik, és eredetileg kórokozókat (parazitát) szállító élőlényt jelentett: pl. a cecelégy (moszkitó) a malária, dengue láz vektora. A terminust először 1878-ban használta a skót Sir Patrick Manson (1844–1922), a trópusi medicina atyja (3). Új értelmezést a molekuláris genetika megjelenésével kapott. A virális vektor olyan módszer, amellyel genetikai anyagot lehet bevinni élő (in vivo) szervekbe vagy sejttenyésztésekbe (in vitro). Az első virális vektorokat az 1970-es években dolgozta Paul Berg (1926) (Nobel-díj: 1980), Herbert Boyer (1936) és Stanley Cohen (1922–2020) (az epidermális növekedési faktor felfedezéséért Nobel-díj: 1986). Kulcsfontoságú volt a reverz transzkriptáz 1970-es felfedezése, amely az mRNS-t bemásolja a DNS-láncba: Howard Temin (1934–1994) (Wisconsini Egyetem) és David Baltimore (1938) (Massachusetts Institute of Technology) egymástól függetlenül fedezték fel, és munkájukért 1975-ben kaptak Nobel-díjat.
Virális vektorként nem patogén adenovírust használnak. Az első adenovírust 1953-ban fedezte fel Wallace Prescott Rowe amerikai virológus (1926–1983) sebészetileg eltávolított tonsillákból tenyésztett sejtekben, innen az adeno- név, a latin aden = mirigy szóból (3).
A vírusba/baktériumba bevitt genetikai anyag replikálódik, és az új gének expresszálódnak, azok specifikus ellenanyagok termelődéséhez vezetnek. Oltóanyag állati, rovar, növényi vagy gomba eredetű sejtek tenyésztésével is termelhető.
A virális vektor technológiát sikerrel alkalmazták a hepatitis B-vakcina előállításában. Kezdetben a HBs előállítása bonyolult, többlépcsős eljárás volt (a felszíni antigén koncentrálása ammonium-szulfát-precipitációval és -centrifugálással, majd pepszines emésztés után ureaoldatban feloldva, gélszűréssel koncentrálták, formalinnal kezelték és tartósították). Így tiszta HBs-antigént nyertek, amely semmilyen más virális, potenciálisan patogén összetevőt nem tartalmazott (22). Ezt váltotta fel a HBs-antigén szintetizálása Saccharomyces cerevisiae-ben, amelyhez promoterként a gombaalkohol dehidrogenázának egy szekvenciáját használták, és ezáltal az antigén ipari méretű szintetizálása vált lehetővé (23). 1986-tól rekombináns HBs-antigént használnak.
Az első kombinált HAV+HBV vakcinát 1997-ben állították elő a GlaxoSmithKline Biologicals cégnél: ebben inaktivált HAV és rekombináns HBs található (Twinrix), és az előzetesen használt Havrix (HAV) és Engerix-B (HBV) oltóanyagok kombinációja. Francia adatok szerint az első HBV-ellenes, genetikai módszerrel előállított oltóanyagot 1985-ben a Pasteur Intézetben fejlesztették ki, ebből azonban nem került kereskedelmi forgalomba oltóanyag (24).
Több más eljárás létezik oltóanyagok készítésére: a baktériumok kapszulájában lévő poliszacharidok erős antigének, és fagocitózist váltanak ki; a Hemophilus influenzae elleni oltásban kerültek alkalmazásra. A toxoidokat mint acelluláris fehérjéket a diftéria, a tetánusz és a szamárköhögés megelőzésére használják. Az újraválogatás (reassortment) során két RNS vírus együttes tenyésztésével lehetséges az immunogén szegmentumok kiválogatása és összeillesztése: a hasmenést okozó rotavírus elleni oltás szarvasmarha és emberi vírus összetevőiből készült (2).
Az mRNS-vakcinák
A messenger (hírvivő) ribonukleinsavat a francia ellenállás résztvevője, François Jacob (1920–2013) és Jacques Lucien Monod (1910–1976), a Pasteur Intézet genetikusai írták le 1960-ban (Nobel-díj: 1965) (1, 3). A felfedezéssel tisztázódott a genetikai információ továbbításának és a fehérjeszintézisnek a mechanizmusa. 1961-ben Sydney Brenner (1927–2019) Jacob és Matthew Meselson (1930) azonosították az mRNS-t mint olyan vegyületet, amely a génekből származó információt továbbítja a riboszómákhoz (3).
Az mRNS gyógyászati alkalmazását előkészítendő évtizedek óta folynak vizsgálatok (25, 26). Oltóanyagként való első sikeres felhasználásáról 1993-ban jelent meg francia szerzőktől közlemény (27).
A DNS-alapú oltóanyagokkal szemben az mRNS előnye, hogy nem jut be a sejtmagba. Ezzel annak lehetősége is kizárt, hogy közvetlenül interakcióba lép a sejtmagban lévő genomiális DNS-sel. Az oltóanyag csupán azt a nukleotidszekvenciát tartalmazza, amely a benne kódolt fehérje szintéziséhez vezet. Az mRNS-szekvencia módosításával bármilyen fehérje kódolható, ami jelentős előny a vakcinák kidolgozásában. Az mRNS néhány nap alatt lebomlik, így nem termelődik ezután a kódolt protein (26).
Az mRNS-vakcinák előállítása több szakaszra osztható: kidolgozásukban kulcsszerepet töltött be a Szolnokon született, Kisújszálláson érettségizett Karikó Katalin, aki a Szegeden végzett egyetemi tanulmányai után előbb a philadelphiai Temple University, majd a University of Pennsylvania kutatójaként dolgozott. Életútjával kapcsolatos információk elérhetők az interneten (https://hu.wikipedia.org/wiki/Karik%C3%B3). Eredményeit a COVID-érában jelentős sajtóérdeklődés kísérte, már-már celeb státusba emelve; megelőlegezték a Nobel-díját is. Kevéssé ismert azonban, mivel járult hozzá az mRNS-oltóanyagok kifejlesztéséhez, így a következőkben azt vázoljuk.
Az mRNS-t in vitro transzkripcióval (IVT) állítják elő, amelyhez DNS-templátot használnak. Karikó és munkatársai igazolták, hogy az IVT-vel készített mRNS milyen intracelluláris receptorokat aktivál, amelyek az immunogenitásért felelősek. Ezután tanulmányozta a természetben előforduló, módosított nukleozidokkal, IVT során előállított mRNS-t, rámutatva, hogy az nem immunogén (28). A módosított nukleozidokat tartalmazó mRNS-sel, majd a szekvencia további optimalizálásával több fehérje transzlációját érték el (29, 30). Az IVT során olyan másodlagos termékek is keletkeznek, amelyek szintén felelősek az így készült mRNS immunogenitásáért. Ennek felismerését és kiküszöbölésének módszerét szintén Karikó és munkatársai közölték (29).
Az mRNS tervezésében az eukarióta sejtekben létező RNS másolatát dolgozzák ki: ennek fontos lépése az mRNS-molekula végének lezárása: ezek a nem lemásolt régiók (UTR), amelyek igen fontosak az mRNS stabilitásának biztosításában, ugyanis megvédik az exonukleázok hatásától. Karikó az eritropoetint kódoló mRNS-molekula szintézisét oldotta meg. További eredménye, hogy kidolgozta az mRNS módosításának technikáját a pszeudouridin csatolásával, ezáltal növelve nemcsak a molekula biológiai stabilitását, de transzlációs képességét is (30, 31).
Hatásuk eléréséhez az mRNS-eknek be kell jutniuk a sejtbe: számos sejttípusban leírták, hogy az mRNS caveolák és lipidcsatornák (ún. tutajok) képződése révén kerül a sejtbe, a folyamatot scavenger receptorok irányítják.
Az mRNS gyógyászati alkalmazásának következő mérföldköve annak a megfelelő szállítóanyagnak a felismerése volt, ami a beadás és a sejtbe való belépés közti úton megvédi az mRNS-t a szervezetben mindenütt jelen lévő ribonukleázoktól, és lehetővé teszi a megfelelő célsejt elérését. Ennek kidolgozásában Pardi Norbert biokémikus vállalt jelentős szerepet. A lipid-nanorészecskékkel bejuttatott mRNS alkalmazásáról Karikó Katalinnal közös közleményükben számoltak be (32). A lipidrészecske felszínére specifikus ligandfelismerő molekulákat lehet felvinni, lehetővé téve a célzott terápiát (31). Ritkán a nanorészecskében lévő polietilénglikol allergiát válthat ki. Mivel az mRNS önmaga is rendelkezik immunstimuláló hatással, 2004-ben Karikó kimutatta, hogy az mRNS-t felismerik a TLR3 receptorok, beindítva az immunválaszt: ezáltal az mRNS önmaga adjuvánsa lehet (33).
Az RNS alkalmazására vonatkozó biokémiai eljárásait Karikó egy munkatársával, Drew Weismannal szabadalmaztatta. Az mRNS technológiai klinikai bevezetésére vállalkozást alapítottak. A társaság és az azzal járó szellemi tulajdonjog előbb a Cellscript, majd a Moderna céghez került, ahol azonban nézeteltérés támadt az AstraZeneca cégek közös kutatásával kapcsolatban. 2020-ban, alkalmazva előző kutatási eredményeit, munkatársaival kidolgozta a COVID-19 elleni oltást, amely a Pfizer és BioNTech közös terméke lett (34).
Az mRNS-alapú vakcinák előállítását a COVID-19-járvány jelentősen felgyorsította, de nem hagyható figyelmen kívül, hogy ugyanezzel a módszerrel számos más betegség ellen próbáltak oltást előállítani, és teszteltek állatmodellekben (Zika-, Ebola-vírus, HIV, influenza), valamint több humán kísérlet van folyamatban (HIV, veszettség, influenza, Zika-vírus). mRNS-vakcinát használnak a tumorellenes kezelésben is: több egyetemen, kutatóközpontban tanulmányok folynak, amelyek a myeloma multiplex, a gliobastoma, a pancreascarcinoma, a melanoma, az emlő- és prosztatarák, az akut és krónikus leukémiák kezelésére irányulnak.
A jövőben dől el, mennyiben fogják helyettesíteni az mRNS-alapú vakcinák a hagyományos oltóanyagokat, illetve milyen helyre kerülnek a daganatellenes terápiában (35, 36).
A vakcinakutatás adósságai
A több mint 200 éves múlt ellenére a vakcinakutatás adós maradt néhány, világszerte jelentős emésztőszervi fertőző betegség elleni oltóanyag kidolgozásával.
Helicobacter pylori
Közel négy évtizeddel a H. pylori felfedezése után (Barry J. Marshall és Robert Warren, 1982, Nobel-díj: 2005) továbbra is megoldatlan a fertőzés és szövődményeinek megelőzése.
A H. pylori-fertőzés elleni globális stratégiának 3 összetevője van:
a) A köztisztaság és gazdasági fejlődés a fertőzés terjedését akadályozza: ennek tulajdonítható, hogy a fertőzés prevalenciája a fejlett országokban, de hazánkban is csökkenő tendenciát mutat: Csongrád-Csanád megyei felmérés szerint egészséges véradókban az IgG prevalenciája 32% volt, szemben az 1993-ban és 1999-ben mért 63,3 és 62,3%-os gyakorisághoz (37).
b) Az eradikációs kezelés a H. pylori okozta betegségek morbiditásának csökkenéséhez vezet, de az eradikációs kezelés a fertőzés prevalenciájának csekély, kb. 10%-os csökkenését okozza.
c) A H. pylori elleni oltás lehetővé tenné a profilaktikus és terápiás immunizációt.
A baktérium felfedezése óta eltelt majdnem 40 évben történtek erőfeszítések hatékony oltóanyagok kifejlesztésére. A H. pylori-ellenes oltásról 1990–2021 között 1157 közlemény jelent meg (https://www.pubmed.ncbi.nih. , kapcsolódás: 2021. 04. 12.).
Sajnálatos módon azonban az oltóanyagok fejlesztése kis cégeknél történik, a tőkeerős világcégek a vakcina kifejlesztését nem tartják prioritásnak (38). Ezért a legtöbb esetben a kutatások megrekedtek a preklinikai fázisban.
Az oltóanyagok kifejlesztésében azonosították a H. pylori azon immunogén molekuláit, amelyek ellen nem toxikus ellenanyagot lehet termelni: ureáz, hő-sokk fehérjék, adhezinek, bakteriális szuperoxid-diszmutáz, CagA protein, vacuolizáló citoxin A, gamma-glutamil-transzpeptidáz. A fejlesztés során alkalmazták a fentebb leírt módszerek többségét. Számos sikeres állatkísérlet történt, de a humán adatok nem biztatóak (38).
2008-ban német csoport rekombináns CagA-, VacA- és neutrofilaktiváló proteint tartalmazó oltóanyaggal sikerült a fertőzést állatokban megelőzni, önkéntesek pedig jól tolerálták az oltást (39), de fázis ½ randomizált tanulmányban az oltóanyag nem bizonyult hatásosnak (40). A H. pylori rafinált védekező mechanizmusokkal rendelkezik: ezek közül a külső membránján elhelyezkedő GGT erős immunszupresszív hatású (41).
Svájci–német–holland kutatócsoport GGT + VacA ellenes oltóanyagot dolgozott ki, de a kutatások az I. fázisú vizsgálattal megszakadtak (42).
Kínai munkacsoport rekombináns módszerrel ureáz B alegységet + hőérzékeny enterotoxin B alegységet tartalmazó antigénekkel orálisan adható oltóanyagot kísérletezett ki, amely biztonságosnak és immunogénnek tűnt nem fertőzött gyermekekben, de a kutatás a III. fázisban megszakadt (43).
2020-as áttekintés szerint továbbra sincs széles körben alkalmazható profilaktikus vagy kuratív oltóanyag a H. pylori-fertőzés megelőzésére/kezelésére, és így a baktérium okozta betegségek megelőzésére sem (44).
Hepatitis C-vírus
A HCV 1989-es felfedezése (Michael Houghton és munkatársai, 1989, Nobel-díj: 2020) után a HCV megelőzése sem megoldott, holott világszerte 71 millió, Magyarországon kb. 30 ezer fertőzőképes beteg van. A HCV rendkívüli genetikai, strukturális és virológiai változatossága miatt hatásos oltóanyag kifejlesztése sikertelen maradt (45). Bár a HCV kórlefolyását kedvezően változtatták meg direkt antivirális szerek, ezek nem tették feleslegessé az oltást, mivel a fertőzött betegek többsége tünetmentes, és csak előrehaladott betegség során jut kezeléshez, egy részük rezisztenssé válik, más részük – iv. kábítószert használók, MSM egyének, egészségügyi dolgozók – újrafertőződnek, mert a sikeres kezelés után nem keletkezik immunitás. A HCV globális kontrollja azt jelenti, hogy a gyógyult HCV-beteg száma magasabb, mint az új fertőzötteké: ez csak kevés országban érhető el. Az oltóanyag kidolgozásának legfőbb akadálya a HCV diverzitása: a 7 genotípus mellett 80 altípus létezik, és az aminosavak szekvenciája csak 15-30%-ban egyezik. A gyakori mutációk további menekülési útvonalat jelentenek az immunválasszal szemben. További nehézség, hogy csak egyetlen HCV-hez hasonló Hepacivírus létezik, amellyel patkányban kísérletes modellt lehet létrehozni, így a kísérleteket csimpánzokon végzik, amely rendkívül drága.
A kutatások egy része a CD4+ és CD8+ T-sejtes immunválasz serkentésére irányul, amely rekombináns virális proteinek (NS3-5) adásával vagy adenovírus vektorba kódolt proteinekkel lehetséges: itt az I. fázisig (önkéntesek) jutottak. A másik kutatási irány a humorális vírusellenes válasz növelése, ehhez a HCV-burkon lévő E1-2 heterodimér fehérjéket, elölt HCV-t vagy vírusfehérjék kódját tartalmazó DNS-t lehet használni: az állat- és I. fázisú kísérleteken itt sem jutottak túl. 2021-es amerikai közleményben adenovírusba kódolt, nem strukturális HCV-fehérjéből álló oltással I-II. fázisú tanulmányban az oltóanyag serkentette a T-sejtes választ, csökkentette a HCV RNS-kópiaszámát, biztonságos volt, de nem előzte meg a krónikus HCV-fertőzést (46). Iráni szerzők a HCV core antigénjét kódoló mRNS-oltóanyagon dolgoznak: humán eredmények még itt sincsenek (47). A hatékony HCV-ellenes oltás kidolgozása tehát további kutatásokat igényel, ha el akarjuk érni a 2030-as évekre kitűzött célt, a HCV-fertőzés globális eliminálását.
Clostridioides difficile
A Clostridium törzsbe tartozó baktériumokat a 19/20. századfordulón fedezték fel: 1892-ben New Yorkban William Henry Welch (1850–1934) a gázgangrénát okozó C. welchit, 1892-ben a belga Émile Pierre Marie Ermengen (1851–1932) a botulinizmust okozó C. perfringenst (a botulus latinul kolbászt jelent), 1900-ban Louisville-ben Simon Flexner (1863–1946) a C. difficilét írta le.
Nevük a görög kloszter = orsó szóból származik, jelezve formájukat, míg a difficile utónév arra utal, hogy a kórokozó nehezen tenyészthető. A CD-t 2016-ban nevezték át Clostridioidesre, megkülönböztetésül a többi C-től. A felfedezése idején ritka kórokozó mára az egyik legelterjedtebb nozokomiális fertőzést okozza, az Egyesült Államokban 2011/12-ben évi 453 000, Európában 172,00 eset lépett fel, a mortalitás 9,3% volt (48, 49). A fertőzés egyre gyakoribb előfordulása és a kezelések korlátozott eredményessége (metronidazol vankomicin fidaxomicin széklettranszplantáció bezlotoxumab monoklonális toxin B antitest) miatt feltevődött a hatékony oltóanyag kidolgozása. Mivel a baktérium fő virulenciatényezője az A és B toxin, a kutatások ez irányban bontakoztak ki, de számos alternatív úton is elindultak. Számos sikertelen előzmény után, az oltóanyagok genetikai úton detoxifikált A és/vagy B toxint tartalmaznak alumínium-hidroxid adjuvánsban, amelyek erősen immunogének és biztonságosak: a Sanofi-Pasteur Intézet oltóanyaga II. fázisban sikeres volt, de a III. fázisban nem előzte meg a CD-t.
A Pfizer oltóanyagában detoxifikált, módosított A és B toxin van, amelyet rekombináns módszerrel állítottak elő; 2020-as, II. fázisú eredményei biztatóak (49). Kísérleti fázisban van az ún. harmadik toxin antigén, amely kevésbé citotoxikus, de a CD kolonizációját segíti elő. Tengerimalacnak egyedül vagy az A/B toxoiddal együtt adták abban a reményben, hogy a baktérium megtelepedését gátolja. A baktérium sejtfalában lévő proteinek és poliszacharidok szintén antigénként szolgálhatnak, akárcsak a spórák falában található proteinek: ez utóbbiak azért ígéretesek, mert az ellenanyagok a spórák sérüléséhez és kiürüléséhez vezetnek, még mielőtt elszaporodnak a bélben. Szakértők szerint klinikailag hatékony oltóanyag kb. 5 év múlva várható (48).
Köszönetnyilvánítás
A kézirat szakmai áttekintését és javítását hálásan köszönöm dr. Karikó Katalin professzornőnek és dr. Szabó Gábor Tamás kolléga úrnak (University of Pennsylvania, Philadelphia, Egyesült Államok). Az angol összefoglaló lektorálásáért Douglas Arnott úrnak (EDMF Translations, Budapest), a szövegszerkesztésért Józan Jolánnak jár köszönet.

1. Berche L. Un histoire des microbes. John Libbey Eurotext, Montrouge, 2007; 149–167., 208.
2. Plotkin SA (szerk.) History of vaccine development. Springer, New York, 2011; 1–339.
3. Sebastian A. A Dictionary of the History of Medicine, Parthenon Publishing Group, New York-London, 1999.
4. Greenwood B. The contribution of vaccination to global health: past, present, and future. Philosophical Trans Roy Soc 2014; 369: 1–9, doi: 10. 1098/rstb. 2013. 0433.
5. Jenner E. An inquiry into the causes and effects of the variolae vaccinae, a disease, discovered in some of western countries of England particularly in Gloucestershire and known by the name The Cow Pox. Sampson Low, 1789.
6. Boylston A. The origins of vaccination: No inoculation, no vaccination. J Royal Soc Med 2013; 106: 395–398.
7. Kiss L. A védhimlőoltás hatósági megszervezése Magyarországon a 19. század első felében – a megyék viszonyulása a közegészségügyi kérdések megoldásához a vakcináció tükrében. Comm de Hist Artist Med 2014; 226–229: 109–128.
8. Kapronczay K. Adatok a himlőoltás magyarországi elterjedéséhez. Orv Hetil 2003; 144: 1093–1095.
9. Ledingham JCG. The aetiological importance of the elementary bodies in vaccina and fowl-pox. Lancet 1931; 2: 525–526.
10. Thèves C, Biagini P, Cruzéby E. The rediscovery of smallpox. Clin Microbiol Infect 2014; 20: 210–218.
11. Cann JA, Jahrling PB, Hensely LE, et al. Comparative pathology of smallpox and monkeypox in man and macaques. J Comp Pathol 2013; 148: 6–21.
12. Pasteur L. Méthode pour prevenir la rage après morsure. CR Acad Sci Paris 1885; 101: 765–772.
13. Calmette A. La vaccination preventive contre la tuberculose par le „BCG”. Masson, Paris, 1927.
14. Theiler M, Smith HH. Effect of prolonged cultivation in vitro upon pathogenecity of yellow fever. J Exp Med 1937; 65: 767–786.
15. Pfeiffer R, Kolle W. Experimentelle Untersuchungen zur Frage der Schutzimpfung des Menschen gegen typhus abdominalis. Deut Med Wsachr 1896; 22: 735–737.
16. Wright AE, Semple D. Remarks on vaccination against typhoid fever. Brit Med J 1897; 1: 256–259.
17. Hafkine WM. Protective inoculation against plague and cholera. Brit Med J, 1899; 1: 35–36.
18. Provost PJ, Hughes JV, Miller WJ et al. An inactivated hepatitis A viral vaccine of cell culture origin. J Med Virol 1986, 19: 23–31.
19. Zheng L. Hepatitis A vaccination, Human Vaccines and Immunotherap 2020; 16: 1565–1573.
20. Freund J, McDermott KL. Sensitization to horse serum by means of adjuvants. Proc Soc Exp Biol Med 1942; 49: 548–553.
21. Sabin AB, Hennessen WA, Winser J. Studies on variants of poliomyelitis virus. I. Experimental segregation and properties of a virulent variant of three immunologic types. J Exp Med 1954; 99: 551–576.
22. Hilleman MR, McAleer WJ, Buynak EB, et al. The preparation and safety of hepatitis B vaccine. J Infect Dis 1983; Suppl. 1: 3–8.
23. Valenzuela P, Medina A, Rutter WJ et al. Synthesis and assembly of hepatitis B virus surface antigen particles in yeast. Nature 1982; 298: 347–350.
24. Tiollais P, Pourcel C, Dejean A. Hepatitis B virus. Nature 1985; 317: 489–495.
25. Hilleman MR. Recombinant vector vaccines in vaccinology. Dev Biol Stand 1994; 82: 3–20.
26. Schlake T, Thess A, Fortin-Mleczek M, et al. Developing mRNA-vaccine technologies. RNA Biology 2012; 9: 1319–1330.
27. Martinon F, Krishan S, Lenzen G et al. Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. Eur J Immunol 1993; 23: 1719–1722.
28. Karikó K, Buckstein M, Ni H, et al. Suppression of RNA recognition by toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 2005; 23: 165–175.
29. Karikó K, Nuzramatsu H, Ludwig J, et al. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acid Res 2011; 39: e142.
30. Karikó K, Muramatsu H, Keller JM, et al. Increased erythropoiesis in mice injected with submicrogram quantities of pseudouridine-containing mRNA encoding erythropoetin. Mol Ther 2012; 20: 948–953.
31. Karikó K, Muramatsu H, Welsh FA et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 2008; 16: 1833–1840.
32. Pardi N, Tuyishime S, Muramatsu H et al. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticules to mice by various routes. J Control Release 2015; 217: 345–351.
33. Karikó K, Ni H, Capadoci J et al. mRNA is an endogenous ligand for Toll-like receptor 3. J Biol Chem 2004; 279: 12542–50.
34. Sahin U, Muik A, Derhovanessian E et al. COVID-19 vaccine BNT162b1 elicits human antibody and TH1T cell responses. Nature 2020; 586: 594–599.
35. Pardi N, Hogan M, Porter FW, et al. mRNA vaccines – a new era in vaccinology. Nat Rev Drug Discov 2018; 17: 261–279.
36. Kemenesi G, Jakab F. COVID-19-vakcinák: a gyorsaság tudománya. Orvostovábbképző Szemle 2021; 28: 102–104.
37. Bálint L, Tiszai A, Kozák G et al. Epidemiologic characteristics of Helicobacter pylori infection in southeast Hungary. World J Gastroenterol. 2019; 25: 6365–6372.
38. Sutton P, Boag JM. Status of vaccine research and development for Helicobacter pylori. Vaccine 2019; 37: 7295–7299.
39. Malfertheiner P, Schultze V, Rosenkranz B et al. Safety and immunogeniticy of an intramuscular Helicobacter pylori vaccine in noninfected volunters: a phase 1 study. Gastroenterology 2008; 135: 787–795.
40. Malfertheiner P, Selgrad M, Wex T et al. Efficacy, immunogenecity and safety of a parenteral vaccine against Helicobacter pylori in health volunteers challenged with a Cag-positive strain: a randomised, placebo-controlled phase ½ study. Lancet Gastroenterol Hepatol 2018; 10: 696–707.
41. Wustner S, Anderf F, Wasnisch A, et al. Helicobacter pylori gamma-glutamyl transferase contributes to colonization and differential recruitment of T cells during persistence. Scio Rep 2017; 7: 13636.
42. Oertli M, Noben M, Emngler D et al. Helicobacter pylori g-glutamyl transpeptidase and vacuolating cytotoxin promote gastric persistence and immune tolerance. Proc Natl Acad Sci 2013; 110: 3047–3052.
43. Zeng M, Mao XH, Li JX et al. Efficacy, safety and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double blind, placebo-controlled, phase 3 trial. Lancet 2015; 386: 1457–1464.
44. Robinson K, Lehouers P. Review: Helicobacter, inflammation, immunology and vaccines. Helicobacter 2020; 25: Suppl. 1. e12737.
45. Bailey JR, Barnes E, Cox AL. Approaches, progress and challanges to hepatitis C vaccine development. Gastroenterology, 2019; 156: 418–430.
46. Page K, Melia MT, Veenhuis RT et al. Randomized trial of a vaccine regimens to prevent chronic HCV infection. New Eng J Med 2021; 384: 541–149.
47. Sharifnia Z, Bandehpour M, Kazemi B. et al. Design and development of modified mRNA encoding core antigen of hepatitis C virus: a possible application in vaccine production. Iran Biomed J 2019; 23: 57–67.
48. Riley TV, Lyras D, Douce GR. Status of vaccine research and development for Clostridium difficile. Vaccine 2019; 37: 7300–7306.
49. Kitchin N, Remich SA, Peterson J et al. A phase 2 study evaluating the safety, tolerability and immunogenicity of two 3-dose regimens of a Clostridium difficile vaccine in healthy US adults aged 65 to 85 years. Clin Infect Dis 2020; 70: 1–10.
