Összefoglaló közlemények / Reviews
Variceal bleeding
Summary
In case of an upper gastrointestinal bleeding in cirrhotic patients, variceal bleeding must be suspected as it is much more common than bleeding from other localizations. After airway securing, the first step is the restoring of hemodynamic stabilization and preforming necessary laboratory tests, including blood group determination. Two veins should be provided through two catheters and intravenous fluid replacement should be initiated promptly. A restrictive volume resuscitation and transfusion strategy is suggested. The patient requires intensive care due to severe underlying liver disease. Vasoactive treatment (octreotide or terlipressin) and antibiotic prophylaxis should be started before endoscopy when upper gastrointestinal bleeding is detected. Gastroscopy and local hemostasis should be performed as soon as possible within the first 12 hours after admission. Endoscopical treatment (ligation, sclerotherapy, cyanoacrylate injection) should be performed even when bleeding is no longer detectable. If the hemoglobine is below 70 g/L as soon as the blood is available, the transfusion should be started, but do not increase the hemoglobin level above 90 g/L! The prophylactic antibiotic treatment is needed for at least 5 days and the intravenous vasopressor therapy for at least 3 days.
Májzsugoros beteg felső tápcsatornai vérzése esetén varixvérzést kell feltételezni, mivel jóval gyakoribb, mint az egyéb lokalizációból származó vérzések. Légútbiztosítás után az első lépés a keringés stabilizálása és a szükséges laboratóriumi vizsgálatok elvégzése, köztük a vércsoport meghatározása. Két branülön át vénát kell biztosítani, és el kell indítani az intravénás folyadékpótlást, amely során a restriktív töltés elvét kell érvényesíteni. A beteget a súlyos alapbetegsége miatt lehetőleg intenzív osztályon kell elhelyezni. A felső tápcsatornai vérzés észlelésekor, még az endoszkópiát megelőzően el kell indítani az oktreotid- vagy terlipressinkezelést, illetve az antibiotikumprofilaxist. A keringésstabilizálást követően, de mindenképpen 12 órán belül meg kell hogy történjen a gasztroszkópia és a lokális vérzéscsillapítás. Varixvérzés esetén akkor is el kell végezni a ligációt (szkleroterápiát), cianoakrilát-kezelést, ha aktuálisan vérzés már nem észlelhető. Amennyiben a Hgb 70 g/l alatti, amint a vér megérkezik, a transzfúziót el kell indítani, de az értékét 90 g/l fölé lehetőleg ne emeljük! Az antibiotikumot legalább 5 napig, az intravénás vazopresszorokat minimum 3 napig kell alkalmazni.
Bevezetés
A varixvérzés (VV) a májzsugor második leggyakoribb dekompenzációs eseménye (az ascites után). A diagnosztika és a terápia jelentős javulása után a halálozása javult, de még ma is a betegek kb. 20%-át elveszítjük.
Cirrózis és portális hipertenzió
A porta nyomása a varixrupturának és a vérzés súlyosságának is meghatározó tényezője (1). A máj szerkezetének átalakulása és a gyulladás miatt aktiválódó és myofibrocytává alakuló stellate sejtek összehúzódása miatt a máj érellenállása nő. A rezisztenciafokozódás 70%-áért a mechanikus összenyomás, 30%-áért a funkcionális komponensek felelősek (2). A párhuzamosan növekvő nyírófeszültség aktiválja az endothelsejteket. A felszabaduló NO vazodilatációt okoz a szplanchnikus területen, amely a porta nyomását tovább növeli (3). A nyomás bizonyos szintje felett a belek pangása és egyéb tényezők miatt kórossá válik az intesztinális bakteriális transzlokáció, amelynek további vazodilatációs hatása van. A portális hipertenzió a májzsugor előrehaladásával folyamatosan emelkedik. Mérése hepatovenozus nyomásgradiens (HVPG) meghatározásával történik. A varixok kialakulása 10 Hgmm-es HVPG-nél indul meg. Ezt tekintjük a klinikailag szignifikáns értéknek. 12 Hgmm felett várható VV (4).
Diagnózis
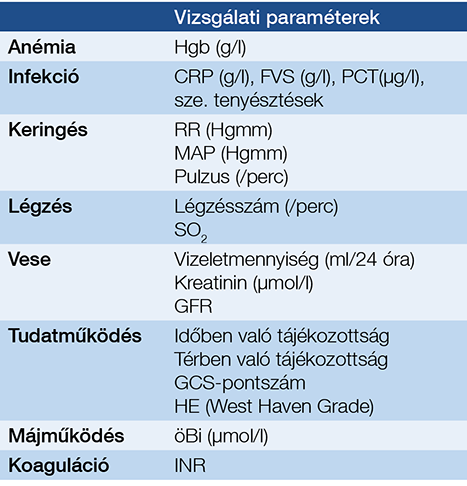
Ismert, vagy nagyon valószínűen cirrózisos beteg felső gasztrointesztinális vérzése az esetek 70%-ában VV, ezért minden májzsugoros betegben kialakuló felső tápcsatornai vérzést mindaddig VV-nek kell tartani, és ennek megfelelően kell kezelni, amíg egyéb ok nem igazolódik (5). A VV nagyon gyakran haematemesissel jelentkezik, de sok esetben a beteg beszámol arról, hogy már napok óta fekete a széklete. A látványos vérzés előtt ugyanis a varixok vérezgethetnek. Az enyhe vérzés 40-50%-ban megáll, és kb. 40%-ban újraindul az első 5 napban (6). A beteg figyelmét a gondozás idején fel kell arra hívni, hogy ilyen esetben azonnal jelentkezzen. Bár a hirtelen kialakuló nagy vérzés esetén a laboratóriumilag detektálható anémia csak néhány óra múlva jelenik meg, az említett elővérezgetések miatt ezek a betegek már kezdetben is lehetnek anémiásak. Nagy volumenű vér hirtelen elvesztésekor a keringés instabillá válhat. Az esetek egy részében ez áll a klinikai tünetek előterében. A volumenvesztés első jele a tachycardia, majd az ortostasis (a beteg gyakran a WC-be igyekezve kollabál), és végül a manifeszt hipotónia. Ilyenkor a rectalis vizsgálat kapcsán észlelt melaena segíti a diagnózist. A szapora szívműködést komolyan kell venni, mert a kardiális rezerv kimerülése hirtelen bekövetkezhet, és a keringés néhány pillanat alatt összeomolhat. A beteg állapotának értékeléséhez szükséges vizsgálatokat az 1. táblázatban részletezzük.
1. táblázat: A felső tápcsatornai vérzéssel érkező májzsugoros beteg állapotának értékelése
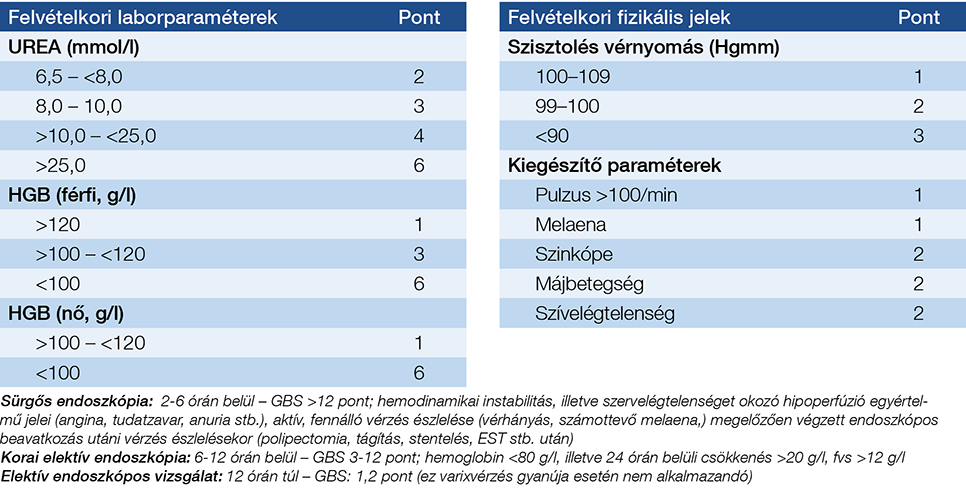
A vérzésforrás biztos megállapítása endoszkópiával történik, azonban nagyon fontos, hogy a vizsgálatot megelőzően a keringést stabilizálni kell. Az endoszkópia csak ez után következhet, de amint elérhető, elvégzése a lehető leghamarabb, még az első 12 órában javasolt (5). A vérzés súlyosságát objektivizálni lehet a Glasgow–Blatchford-pontrendszer segítségével (2. táblázat).
A varixok legtöbbször a nyelőcsőben láthatóak, de az esetek kb. 20%-ában a gyomorban vagy a gyomorban is előfordulnak. Gastrooesophagealis varixok estén a tágult vénák a nyelőcsőből a kardián túl a kisgörbületre (GOV1) vagy a fundusba futnak (GOV2). Izoláltan is megjelenhetnek a fundusban (izolált gyomorvarix = IGV 1. típus), vagy a gyomor egyéb területein (IGV 2. típus) (7). A fundusban lévő varixok ritkábban véreznek, de nehezebb a csillapításuk, mint az egyéb területeken látott visszértágulatoké. Mivel a későbbiekben részletezett terápiás lépések miatt előfordul, hogy aktuálisan vérzés nem észlelhető, emiatt fontos tisztázni, hogy mikor tekinthető a vérzés varix eredetűnek. Az első bavenói ajánlás (8) alapján VV okozza a tüneteket, ha az endoszkópia alkalmával varixokból származó aktív vérzés látható (lövellő vagy folyamatosan szivárgó), ha a varixokon a közelmúltban lezajlott vérzés jelei láthatóak (fehér fibrincsomó vagy nem lemosható, átfedő vérrög), vagy ha varixok láthatóak, a gyomorban vér van, és egyéb vérzésforrás nem azonosítható. Célszerű még ide sorolni az Ázsiai Májkutató Társaság ajánlása (9) alapján azokat az eseteket, amikor ugyan vér nincs a gyomorban, de a varixokon vörös jelek láthatóak, és egyértelműek a felső tápcsatornai vérzés jelei. A vérzés varix eredetét azért fontos tisztázni, mivel a varixok endoszkópos ellátása ezekben az esetekben kötelező, akkor is, amikor aktív vérzés már nem látszik, mivel az újravérzés megelőzésében a kombinált terápia (endoszkópos + gyógyszeres) hatékonysága magasabb a monoterápiáénál (lásd később) (9).
2. táblázat: A felső tápcsatornai vérzés súlyosságának értékelése
Terápia
A VV magas szövődményrátával és mortalitással járó sürgősségi állapotot jelent, amely intenzív ellátást igényel (5).
A kezelési stratégia felépítéséhez nagyon fontos ismerni a VV várható lefolyását. Az első 5 napon belül a betegek halálát a kivérzés és az ehhez társuló keringés-összeomlás okozza, vagyis a vérzés kontrolljának sikertelensége. Az 5. nap után az első 6 hétben a szövődmények (pl. infekciók, hipoxiás májkárosodás) vezethetnek a beteg halálához (10).
A kezelés első lépése a keringés stabilizálása. Aktív vérzésre utaló jelek és hemodinamikai instabilitás esetén amilyen gyorsan lehet, el kell kezdeni a volumenpótlást. Ebből a célból krisztaloid oldatot használunk (Isolyte-ot, Ringer-laktátot). A kolloidoldatok előnye VV esetén nem bizonyítható (5). Helyes a beteg perifériás vénáiba két branült helyezni. A töltés ütemét a hiányzó vértérfogat mennyiségéhez kell szabni, amihez a beteg vérnyomásának és szívfrekvenciájának folyamatos követése, monitorizálása szükséges. Az induló dózis 20 ml/testsúlykilogramm. Alacsony vérnyomás esetén a bevitt folyadékkal a 100 Hgmm elérését kell megcélozni, e fölé nem szabad emelni, a túltöltéstől tartózkodni kell (11). A vérpótlás fontos, de a vér megérkezése időt igényel. A transzfúzió során is a restrikciós szabályokat kell betartani: vér adása csak akkor szükséges, ha a hemoglobin (Hgb) kisebb, mint 70 g/l, és korrekciókor nem szabad 90 g/l fölé emelni az értékét. Az érpálya túltöltése emeli a porta nyomását, és emiatt csökkenti a vérzés megállásának esélyét, növeli az újravérzés kockázatát (5). Ezektől az értékektől akkor kell eltérni, ha a betegnek olyan társbetegsége van, ami a keringési alkalmazkodást csökkenti, vagy más módon a szervek perfúzióját rontja (pl. súlyos érszűkület). Ugyancsak figyelmeztető jel, ha a beteg laktátszintje alacsony (<8 mmol/l), mivel ez oxigénhiányt jelez, és ez esetben magasabb Hgb-érték relatíve gyors elérésére van szükség a hipoxiás károsodások megelőzéséhez (12). Alacsony oxigénszint esetén (<94-96%) oxigénbelélegeztetés indokolt (11).
Ha a beteg encephalopathiás, proffúzan hány, az átjárható légutak biztosítására, az aspiráció profilaxisára különös figyelmet kell fordítani, akár intubáció is szükségessé válhat (5). A beteg észlelése kapcsán erről is korán döntést kell hozni.
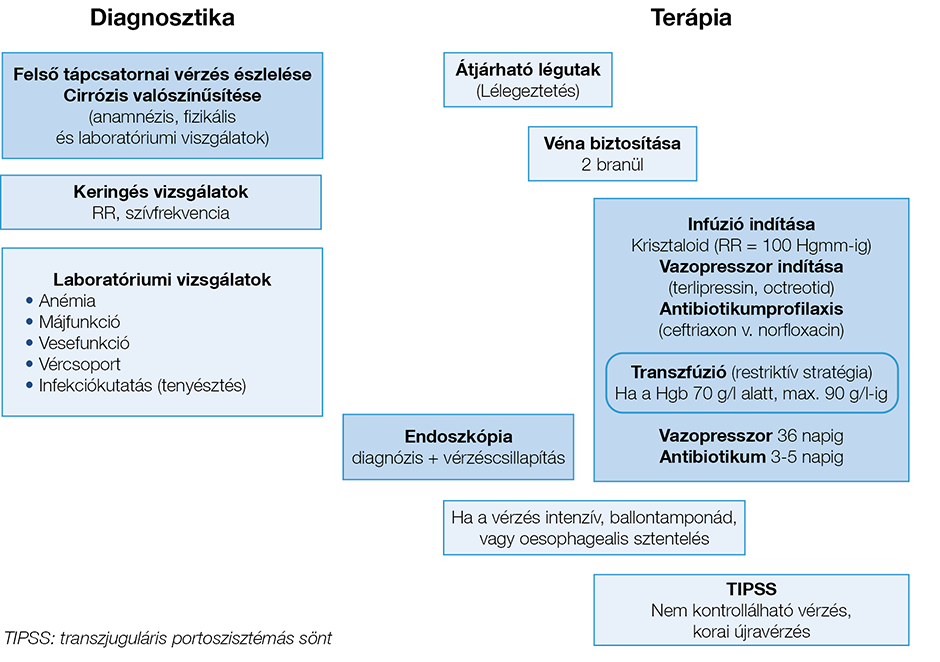
A VV kialakulását az infekciók fokozzák (a betegek kb. 20%-ában a fertőzés a VV provokáló tényezője), illetve a VV-t követően nagyon gyakran (kb. a betegek 50%-ában) alakul ki fertőzés, spontán bakteriális peritonitis, pneumónia stb. Ez rontja a vérzés kontrollálhatóságát, növeli az újravérzés kockázatát, és jelentősen rontja a 6 héten belüli halálozást (4, 13 ). Emiatt a VV gyanújának esetén azonnal antibiotikumprofilaxist kell indítani. A profilaxis cirrózisos beteg nem varixból származó vérzése esetén is kötelező. Ha a beteg alkalmas a szájon át történő gyógyszerelésre, napi 2×400 mg norfloxacin adása javasolt. Amennyiben 1.) a beteg a VV előtt SBP megelőzése céljából tartós kinolonprofilaxist kapott, vagy 2.) az adott ellátóhelyen gyakori a magas kinolonrezisztencia-arány, illetve 3.) ha a beteg állapota rossz, a májzsugor előrehaladott stádiumú, parenterális alkalmazásra van szükség, napi 1 g ceftriaxon iv. adása indokolt. A vérzés miatt adott antibiotikumprofilaxis hossza 5-7 nap (5). Tekintettel arra, hogy Child–Pugh A stádiumban az infekciós kockázat alacsony (14), megfelelően táplált, a vérzésen túl egyéb dekompenzációs jellel nem bíró betegek esetén a profilaxistól eltekinthetünk. (A diagnosztikus és terápiás lépések egymáshoz viszonyított időbeni elrendezését mutatja a 1. ábra.)
1. ábra: A varixvérzés diagnosztikájának és kezelésének algoritmusa
Májzsugoros betegben a megnyúlt INR alapján nem következtethetünk arra, hogy a beteg vérzékeny. A globális haemostasis vizsgálatok (tromboelasztográfia [TEG] tromboelasztometria [ROTEM]) alapján a normálisnál hosszabb vérzési idők ellenére a haemostasis a legtöbb esetben a trombózisképződés irányába tolódik el (15). Emiatt rutinszerűen sem friss fagyasztott plazma (FFP), sem faktorok adása az alvadási idők korrekciója céljából nem javasolt. Nem lehet velük korrigálni a haemostasiseltérést, így nem javítják a vérzés kimenetelét, fokozzák azonban a trombózis kialakulásának esélyét (16). Ráadásul az FFP jelentős volumenterhelést okoz, ami nem tervezett hirtelen vérnyomás-emelkedés miatt a vérzés újraindulásához vezethet. Thrombocytakészítmény adására sincs szükség, amíg a vérlemezkeszám >50 g/l (17).
A vérzéscsillapítás törtéhet gyógyszeresen, endoszkópos ellátással, ballontamponáddal vagy transzjuguláris intrahepatikus portoszisztémás sönt (TIPSS) behelyezésével.
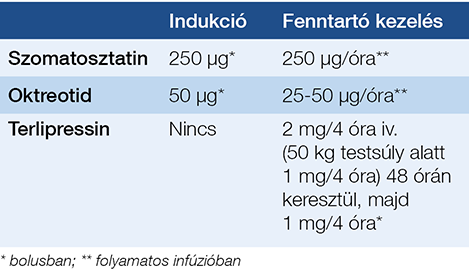
Gyógyszeres vérzéscsillapításra oktreotid (szomatosztatin-analóg) szomatosztatin vagy terlipressin (vazopresszin-analóg) használható. Hatásukra csökken a portában uralkodó nyomás, aminek következtében minden más beavatkozás nélkül is a vérzés az esetek kb. 63-80%-ában megáll (5). Az adagolást a 3. táblázat mutatja.
3. táblázat: A varixvérzés során használt vazopresszorok adagolása
A terlipressin iszkémiát provokálhat, ezért idősek, hipertóniások, kardiovaszkuláris betegségben szenvedők esetén pontos követés indokolt. Szeptikus sokkban szenvedő, alacsony perctérfogatú betegben nem alkalmazható. Nem szabad elfeledkezni arról, hogy VV gyanúja esetén a béta-blokkolót ki kell hagyni (5).
Endoszkópia előtt 20-120 perccel prokinetikum (eritromicin, metoclopramid) adását javasolják, mivel a gyomorürülést gyorsítva a látási viszonyokat javítják, ugyanakkor a túlélésre, a kimenetelre nincsenek hatással (18). Az antibiotikum prokinetikumként való alkalmazásával kapcsolatban infektológiai ellenérvek is vannak.
Endoszkópos vérzéscsillapításra nyelőcsővarixok esetén alkalmas a szkleroterápia és a varixligáció (endoscopic band ligation, EBL) is. Az utóbbinak kevesebb a szövődménye, és nagyobb valószínűséggel állítható meg vele a VV (19), ám jelentős vérzés esetén a kivitelezése nehezebb lehet, mint a szkleroterápiáé. Ligáció során a varixokat gumigyűrű vagy hurok segítségével leszorítjuk, ami miatt megszűnik bennük az áramlás, később a leszorított rész elhal, lelökődik. Helyén kisebb-nagyobb fekély keletkezik, amely egyes esetekben ismételt vérzés forrása lehet. Van adat arra, hogy ligációt követően 9 napig alkalmazott protonpumpagátló csökkenti a fekélyek méretét és a belőlük származó vérzés valószínűségét (20). Szkleroterápia során a varixokba és melléjük aethoxysklerolt injektálunk. Ez lokális ödémát, később hegesedést provokál, amely szintén a vérző vénák elzáródásához vezet. Ha a szangvináció gyomorvarixból származik, EBL végzését, vagy a vérző varix cianoakriláttal történő beinjektálását javasolják (21). A két módszer egyformán hatékony, de cianoakrilát-kezelés után ritkább az újravérzés. Az EBL viszont technikailag egyszerűbb (22).
Ha nem sikerül a vérzést megállítani, a nyelőcsőbe helyezett ballon vízzel történő feltöltésével tamponálhatjuk a varixokat. Nyelőcsővarixok esetén Sengstaken–
Blakemore-szonda, fundális varixvérzés esetén Linton-szonda használható. A pozicionálásuk gyakorlatot igényel. A nem megfelelően behelyezett ballon elzárhatja a légutakat. 4-6 óránként célszerű legalább átmenetileg felengedni, mivel a tartós nyomás a nyálkahártya keringésének akadályozása miatt annak elhalását okozhatja (8). Ezek mellett a ballontamponád alternatívá-
jaként öntáguló nyelőcsősztent behelyezésére van lehetőség (23).
A fenti beavatkozások a betegek 85%-ában elegendőek a vérzés megállításához, azonban kb. 15%-ukban sikertelen a vérzéskontroll, illetve korai újravérzés alakul ki. Ez esetben akut transzjuguláris intrahepatikus portoszisztémás sönt (TIPSS) helyezhető be. A sönt csökkenti a porta nyomását, azonban lehetnek szövődményei (lásd később) (5).
VV idején kerülni kell a nefrotoxikus gyógyszerek, mint az aminoglikozidok vagy a nem szteroid gyulladáscsökkentők (NSAID) alkalmazását. Hasonlóan tartózkodni kell a nagy volumenű (>5000 ml) ascites lebocsátástól. El kell hagyni a béta-blokkolókat, a vazodilatátorokat és egyéb vérnyomáscsökkentő szereket (5). A hepatikus encephalopathia (HE) megelőzésére nem felszívódó diszacharidok adhatók (19).
A beteg elhelyezése
A beteget, amennyiben lehetőség van rá, célszerű intenzív osztályon vagy állandó felügyeletet biztosító, gasztroenterológus által felügyelt vérző szubintenzív osztályon (szakmaspecifikus őrzőben) elhelyezni. Nem egyszerűen a vérzés szövődményeivel kell számolnunk, hanem a súlyos alapbetegséggel (májzsugor) is, amely a kezdetben látszólag stabil betegben is hirtelen összeomlást okozhat. Bárhol is helyezik el a beteget, a folyamatos szívfrekvencia és vérnyomás-monitorozás, a tudatállapot és a vesefunkció követése elengedhetetlen.
A varixvérzés profilaxisa
Primer és szekunder profilaxis során a porta nyomásának csökkentését célozzuk meg, vagy a vérzés szempontjából magas kockázatúnak tartható vénatágulatok elzárására törekszünk.
A nem szelektív béta-blokkolók (NSBB) csökkentik a cirrózisos betegekre jellemző fokozott szimpatikus aktivitást. A béta-receptor-blokád védi a szívet a katekolaminok kardiotoxikus hatásával szemben, a mesenteriális erekben kifejtett α-adrenerg hatás révén vazokonstrikciót provokál, amely a szplanchnikus vazodilatáció mérséklésén át csökkenti a porta nyomását. Sajnos a betegek egy részében adásuk kontraindikált. A betegek egy másik csoportjában a HPVG-mérések szerint nem csökkentik a portanyomást (az ún. nonreszponder betegek).
A portális hipertenzió csökkentésének másik módja a TIPSS behelyezése, amely megelőzi a VV kialakulását, azonban HE-t provokálhat elsősorban azokban a betegekben, akiknek a májbetegségük előrehaladott stádiumban van.
A VV szemponjából nagy rizikójú (nagy, vörös foltokat mutató) varixokat EBL elvégzésével lehet eradikálni. Ez ugyan a vérzést megelőzi, de a portában uralkodó nyomást nem befolyásolja.
Primer profilaxis
Kontraindikáció hiányában az első választandó szer az NSBB, amely a varixok megjelenését és a kis varixok növekedését nem befolyásolja. Emiatt a jelenlegi ajánlás értelmében a kezelést jelentős vérzéskockázat esetén (nagy varixok, vagy mérettől függetlenül, ha rajtuk vörös foltozottság látszik, vagy ha a cirrózis Child–Pugh C stádiumú) kell elindítani. Hazánkban a propranolol áll rendelkezésre, amelyet 2×10-20 mg-ról lassan több nap alatt kell feltitrálni. A maximum adagja napi 320 mg, amelyet ritkán sikerül elérni. A vérnyomás 95 Hgmm vagy a pulzus 60/perc alatti értéke esetén a dózis nem emelhető. Azok esetén, akiknek ascitesük van, a maximális napi adag 160 mg. A nonreszponderekben megpróbálható a carvedilolterápia, amelynek az NSBB-nél jelentősebb szisztémás artériás vérnyomáscsökkentő hatása van. Ez elsősorban dekompenzált betegekben jelenthet problémát. Adagja 6,25-12,5 mg-ról 50 mg-ig emelhető. Ha a beteg nem tolerálja az NSBB-kezelést, vagy kontraindikáció áll fenn, nagy varixok esetén EBL is végezhető. Magas vérzéskockázatú varixok jelenléte esetén az NSBB és az EBL hatékonysága megegyező az első vérzés megelőzésében. A két módszer (NSBB+EBL) kombinálásával nem csökken tovább sem a vérzés rizikója, sem a mortalitás a monoterápiához képest. Gyomorvarix esetén primer prevenció céljából egy tanulmány szerint a cianoakriláttal történő injektálás hatékonyabb, mint az NSBB. Egyelőre erre még kellő bizonyíték nem áll rendelkezésre, így addig a javaslat az NSBB-kezelés.
Szekunder profilaxis
Az újravérzés kockázata magas, egy-két éven belül 60-70%. Megfelelően alkalmazott profilaxis mellett azonban ez a kockázat jelentősen mérsékelhető. Szekunder prevencióra kombinált kezelés ajánlott (NSSB+EBL), mivel ez jelentősebben csökkenti az újravérzés valószínűségét a monoterápiaként alkalmazott gyógyszeres vagy az EBL-kezeléshez képest. Gyomorvarixokból származó újravérzés megakadályozására az ismételt cianoakrilát-kezelés talán hatékonyabb, mint az NSBB, és a kombinált terápia ezen az eredményen nem javít.
Gyakran ismétlődő VV vagy NSBB-kontraindikáció esetén a varix lokalizációjától függetlenül a TIPSS behelyezését kell megfontolni.
A TIPSS hatékonyan csökkenti a porta nyomását, az újravérzés kockázatát és a halálozást is. Lehetnek azonban nemkívánatos hatásai. A legsúlyosabb ezek közül a vér elterelése miatt kialakuló vérellátási zavar a májban, következményes akut májelégtelenséggel, amely 15-18 MELD-pont alatt ritka. Ennél gyakoribb szövődmény a HE kialakulása, rosszabbodása, amely a kezeltek 40%-ában várható, gyakrabban akkor, ha a betegnek korábban volt HE-je, idős, súlyos máj- és vesefunkciós elégtelenség áll fenn. Ezért nem javasolt a beavatkozás, ha a szérum bilirubinszintje >51 μmol/l, és a vérlemezkeszám <75 000/μl, akut (≥2. fokozatú) vagy krónikus, manifeszt HE áll fenn. Nem javasolt továbbá zajló infekciós epizód, progresszív veseműködési zavar, súlyos szisztolés vagy diasztolés szívműködési zavar és pulmonalis hipertenzió fennállása esetén sem (5). Ugyanakkor akut vérzés kapcsán, életmentő TIPSS esetén abszolút kontraindikáció nincs, az előnyöket és a hátrányokat mérlegelve kell dönteni.
Összefoglalás
A VV a májzsugor súlyos akut dekompenzációja, amelynek kialakulása a portában uralkodó nyomástól függ. Magas halálozása miatt a sok beteg adatainak elemzése alapján született irányelvek alkalmazása kötelező, mivel ez biztosítja a lehető legjobb túlélést. A VV-t mindenképpen jobb megelőzni, mint kezelni. Megelőzése a porta nyomásának csökkentésén és a cirrózis megfelelő vezetésén, gondozásán alapszik.
https://doi.org/10.1016/j.jhep.2015.01.003.
2. Gunarathne LS, Rajapaksha H, Shackel N, et al. Cirrhotic portal hypertension: From pathophysiology to novel therapeutics. World J Gastroenterol. 2020; 26: 6111–6140.
https://doi.org/10.3748/wjg.v26.i40.6111.
3. Abraldes JG, Iwakiri Y, Loureiro-Silva M, et al. Mild increases in portal pressure upregulate vascular endothelial growth factor and endothelial nitric oxide synthase in the intestinal microcirculatory bed, leading to a hyperdynamic state. Am J Physiol Gastrointest Liver Physiol. 2006; 290: G980–987.
https://doi.org/10.1152/ajpgi.00336.2005.
4. Garcia-Tsao G, Abraldes JG, Berzigotti A, et al. Portal hypertensive bleeding in cirrhosis: risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the Study of Liver Diseases. 2017; 65: 310–335.
https://doi.org/10.1002/hep.28906.
5. European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018; 69: 406–460. doi: https://doi.org/10.1016/j.jhep.2018.03.024.
6. D’Amico G, Pagliaro L, Bosch J. Pharmacological treatment of portal hypertension: an evidence-based approach. Semin Liver Dis. 1999; 19: 475–505.
https://doi.org/10.1055/s-2007-1007133.
7. Sarin SK, Lahoti D, Saxena SP, et al. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology. 1992; 16: 1343–1349.
https://doi.org/10.1002/hep.1840160607.
8. de Franchis R, Pascal JP, Ancona E, et al. Definitions, methodology and therapeutic strategies in portal hypertension. A Consensus Development Workshop, Baveno, Lake Maggiore, Italy, April 5 and 6, 1990. J Hepatol. 1992; 15: 256–261.
https://doi.org/10.1016/0168-8278(92)90044-p.
9. Sarin SK, Kumar A, Angus PW, et al. Asian Pacific Association for the Study of the Liver (APASL) Working Party on Portal Hypertension. Diagnosis and management of acute variceal bleeding: Asian Pacific Association for Study of the Liver recommendations. Hepatol Int. 2011; 5: 607–624.
https://doi.org/10.1007/s12072-010-9236-9.
10. Graham DY, Smith JL. The course of patients after variceal hemorrhage. Gastroenterology. 1981; 80: 800–809.
11. Gyökeres T, Schäfer E, Szepes A, et al. Heveny gastrointestinalis vérzések ellátása. Multidiszciplináris útmutató javaslat [Management of acute gastrointestinal bleeding. Multidisciplinary guideline proposal]. Orv Hetil. 2020; 161: 1231–1242.
https://doi.org/10.1556/650.2020.31807.
12. Scott S, Antonaglia V, Guiotto G, et al. Two-hour lactate clearance predicts negative outcome in patients with cardiorespiratory insufficiency. Crit Care Res Pract. 2010; 2010: 917053.
https://doi.org/10.1155/2010/917053.
13. Bernard B, Grangé JD, Khac EN, et al. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology. 1999; 29: 1655–1661. doi: https://doi.org/10.1002/hep.510290608.
14. Tandon P, Abraldes JG, Keough A, et al. Risk of Bacterial Infection in Patients With Cirrhosis and Acute Variceal Hemorrhage, Based on Child–Pugh Class, and Effects of Antibiotics. Clin Gastroenterol Hepatol. 2015; 13: 1189–1196.e2.
https://doi.org/10.1016/j.cgh.2014.11.019.
15. Thalheimer U, Triantos CK, Samonakis DN, et al. Infection, coagulation, and variceal bleeding in cirrhosis. Gut. 2005; 54: 556–563.
https://doi.org/10.1136/gut.2004.048181.
16. Abdel-Wahab OI, Healy B, Dzik WH. Effect of fresh-frozen plasma transfusion on prothrombin time and bleeding in patients with mild coagulation abnormalities. Transfusion. 2006; 46: 1279–1285.
https://doi.org/10.1111/j.1537-2995.2006.00891.
17. Lisman T, Bernal W. Management of Hemostatic Disorders in Patients With Advanced Liver Disease Admitted to an Intensive Care Unit. Transfus Med Rev. 2017; 31: 245–251.
https://doi.org/10.1016/j.tmrv.2017.06.002.
18. Altraif I, Handoo FA, Aljumah A, et al. Effect of erythromycin before endoscopy in patients presenting with variceal bleeding: a prospective, randomized, double-blind, placebo-controlled trial. Gastrointest Endosc. 2011; 73: 245–250.
https://doi.org/10.1016/j.gie.2010.09.043.
19. Garcia-Tsao G, Sanyal AJ, Grace ND, et al. Practice Guidelines Committee of the American Association for the Study of Liver Diseases; Practice Parameters Committee of the American College of Gastroenterology. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007; 46: 922–938.
https://doi.org/10.1002/hep.21907.
20. Shaheen NJ, Stuart E, Schmitz SM, et al. Pantoprazole reduces the size of postbanding ulcers after variceal band ligation: a randomized, controlled trial. Hepatology. 2005; 41: 588–594.
https://doi.org/10.1002/hep.20593.
21. Ríos Castellanos E, Seron P, Gisbert JP, et al. Endoscopic injection of cyanoacrylate glue versus other endoscopic procedures for acute bleeding gastric varices in people with portal hypertension. Cochrane Database Syst Rev. 2015; 5: CD010180.
https://doi.org/10.1002/14651858.CD010180.pub2.
22. Chau TN, Patch D, Chan YW, et al. “Salvage” transjugular intrahepatic portosystemic shunts: gastric fundal compared with esophageal variceal bleeding. Gastroenterology. 1998; 114: 981–987.
https://doi.org/10.1016/s0016-5085(98)00640-4.
23. Escorsell À, Pavel O, Cárdenas A, et al. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory variceal bleeding: A multicenter randomized, controlled trial. Hepatology. 2016; 63: 1957–1967.
https://doi.org/10.1002/hep.28360.
