Összefoglaló közlemény / Review
Microbiome-associated inflammation and migraine: a new link in the brain-gut axis?
Summary
The gut-brain axis, which represents an important functional relationship between the digestive tract and the central nervous system, is grossly influenced by the gut microbiota. The Human Microbiome Project has resulted in a significant breakthrough and brought new perspectives into the etiopathological research on migraine headache which takes a central part in contemporary neuroscience and clinical pharmacology. Present review addresses the most recent results of migraine research with a focus on the long-lasting effects of environmental factors, especially metabolic and inflammatory changes. Our goal is to highlight key ideas for patient care in symptom discovery and root cause analysis in order to identify valuable lifestyle modifications. By influencing causative environmental factors, the latter can successfully supplement targeted pharmacotherapy and may help migraine prevention. The significance of a cause-oriented therapeutic approach with lifestyle interventions can hardly be overestimated due to the large prevalence of migraine headache in the Western World, and to the long-term adverse effects of current, merely symptomatic, analgesic treatments.
Bél–agy tengelynek nevezzük az emésztőrendszer és a központi idegrendszer működése közötti funkcionális kapcsolatot. A humán mikrobiom ezen a területen is nagy áttörést hozott, és új perspektívába helyezte a migrén kóroktanának tényezőit is, amelyek ma a klinikai agykutatás és a farmakológia fontos kutatási területei. Jelen összefoglaló a környezeti tényezők hosszú távú hatásait – a mikrobiom-változással kialakuló gyulladásos és anyagcsere-eltéréseket – helyezi el a migrén patofiziológiájának legújabb eredményei mellé.
Gyakorlati támpontokat kíván adni a betegellátásban a tüneti és oki tényezők feltérképezéséhez, illetve ezekkel kapcsolatos életmódtényezők azonosításához. Ez lehetővé teszi ezen környezeti oki tényezők változtatását és a célzott gyógyszeres kezelés kiegészítését a krónikus fejfájásban szenvedő, migrénre is hajlamos betegek sikeres preventív kezelése érdekében.
Ennek a jelentősége óriási a migrén nagy prevalenciája miatt a nyugati világban, illetve a kezelésére széles körben alkalmazott fájdalomcsillapító (tüneti) kezelések hosszú távú szövődményei miatt.
Bevezetés
A bél–agy tengelynek is nevezett összefüggés a tápcsatorna és az idegrendszer működése között évtizedek óta külön szakaszt jelent az élettan és kórélettan fejezeteiben (1). Historikusan talán Pavlov kísérleteivel kezdődően tudjuk, hogy az emésztőrendszer működése és szabályozása nem csupán a bejutott táplálék és tápanyagigény vonatkozásában értelmezendő. Ha egy ismerős ételt látunk, az illatát érezzük, de akár csak képen megpillantjuk, az emésztőrendszer fiziológiásan kondicionált reakciója hasonlatos ahhoz, mintha megenni készülnénk azt (2).
Az, hogy a táplálék maga idegrendszeri folyamatokat is képes befolyásolni, ez előzőekből nem egyértelműen következett, de logikus következő lépés volt a folyamatok összefüggéseinek értelmezésében. Az elfogyasztott élelmiszerek emésztési metabolitjai befolyásolják a gondolkodásunkat, minimum olyan szinten, hogy „kívánunk” egy adott ételt, „észleljük” a szükségleteinket (3). Azt, hogy ez a nagyobb kalóriatartalmú ételekre is vonatkozik, az emberiség evolúciós történetéből, az esetleges táplálékhiányos időszakokból ered, és a túlélés tekintetében sokáig uralta a tudományos gondolkodást. A II. világháború utáni iparosodott jólét mellett egyre inkább meghatározóvá vált a túltáplálás, valamint a túltáplálás egészségügyi következményei (4). Ebben a relációban már nehezen lehetett értelmezni, hogy a súlyosan elhízott emberek központi idegrendszerének akkor még kevéssé értett szabályozásai miért engedik, hogy a betegségekbe és halálos „szövődményekbe egyék” magukat (5).
Fontos kapocs volt ennek értelmezésében a humán mikrobiom, elsősorban a vastagbélben élő bélflóra szerepének felismerése. Kiderült ugyanis, hogy a vékony- és a vastagbélben élő baktériumok fontos szerepet játszanak az emésztési és felszívódási folyamatokban (6). Egészséges körülmények között ez az ökoszisztéma egy belső egyensúly alapján hatékonyan működik együtt, ami közös evolúciós előnyökkel jár. Ez azonban nem egy, a környezettől független inerciarendszer. Az élelmiszerek, főként a nagyüzemi növénytermesztés során az élelmiszer-alapanyagként használt kultúrnövények mikro- és nyomelemtartalma jelentősen csökkent az elmúlt évtizedekben. A tápanyagok ilyetén minőségének és mennyiségének változásai az egész ökoszisztéma egészségét befolyásolják (7). Látni kell, hogy az emberi szervezet betegségei a teljes ökoszisztéma szempontjából indifferensek. A Richard Dawkins-i értelemben vett gének közötti versengés (8) tekintetében csak az emberi vastagbélben élő bakteriális génállomány mintegy háromszázszor számosabb, mint a teljes emberi génkészlet. A környezetszennyezés, a helytelen táplálkozás az ökoszisztéma vonatkozásában nem értelmezhető ilyen határozottan, hiszen számos, számunkra kedvezőtlen hatás a velünk élő baktériumok közül sok fajnak kiváló életkörülményeket teremthet, miközben az emberi szervezet gyulladásos, daganatos és degeneratív folyamataira, diszfunkcionális működésére vezet, és az életminőség romlását idézi elő (9). Ezek a baktériumok pl. a kóros elhízáshoz vezető metabolikus szignálok fenntartása szempontjából maximális evolúciós logikával pozitív szabályozási visszacsatolást adnak az emberi központi idegrendszer releváns központjainak, ami ebben a kontextusban értelmezendő logikával erősíti az önpusztító folyamatot (10). Ezt nagyon fontos megértenünk, és tudatosan ez ellen fellázadnunk.
A betegségek globális súlyát, azon belül a károsodott egészségi állapotban leélt időt tekintve a migrén listavezető az 50 évnél fiatalabb népességben (11). Ez a krónikus neurológiai betegség jellegzetes fejfájásrohamokban jelentkezik, és reverzibilis idegrendszeri, valamint szisztémás tünetekkel jár. Az utóbbiak között szerepelnek gasztroenterális tünetek (hányinger, hányás, diarrhoea vagy konstipáció), és van kapcsolat a migrén és a bélbetegségek között (12). Az intesztinálisbarrier-funkció zavarából eredő proinflammatorikus citokinek – úm. TNF-α, IL-1β, IL-6 – befolyásolják a trigeminális pálya nociceptiv válaszait, és szerepet játszhatnak a migrén patomechanizmusában (13).
A jelen összefoglalás célja azoknak a gyulladásos összefüggéseknek az áttekintése, amelyek a trigeminovaszkuláris rendszer jól ismert kóros aktiválódásához vezetnek a mikrobiom életmóddal összefüggő, gyulladásos eltolódása révén. Ez a folyamat fenntart egy olyan low-grade gyulladást, amely a thalamus fájdalomrelay-szabályozásának kimerülése révén krónikus fejfájás kialakulásához vezethet.
A fájdalommoduláció és annak zavarai
A krónikusfájdalom-szindrómák a modern társadalmak nagy népegészségügyi problémái. A gasztroenterológiában egyik fontos példa erre az irritábilis bél szindróma (IBS). Ennek megértését segítő alapkísérlet, amikor egy ballont fújunk fel a rectumban 15 Hgmm nyomásra. Egészséges önkéntesekben ennek interpretációja „talán székelési ingerem van”, míg ugyanez az objektív nyomás az IBS-ben szenvedő betegeknél tűrhetetlen fájdalmat okoz (14). A fájdalomkapu elmélet ezt jól magyarázza, még akkor is, ha ennek pontos mechanizmusáról az elképzelések az elmúlt 60 évben jelentősen megváltoztak (15). Az ugyanakkor nem volt világos, hogy a megváltozott fájdalomérzékeléshez milyen kórélettani folyamatok vezetnek. Mai elképzelésünk szerint ennek hátterében elsősorban a bélmikrobiom eltolódása és diszbiotikus változása nyomán kialakult low-grade gyulladás (16) áll. Ezt általában endoszkóposan nem kíséri jellegzetes kép, esetleg súlyosabb esetekben aspecifikus lymphocytaszaporulat látható a bioptátumban (17).
A mikrobiom mint a bélnyálkahártya-asszociált gyulladás egyik oka és az IBS kialakításáért felelős egyik oki tényező ma egy kurrens elképzelés (18). Ennek hátterében az intesztinális barrier sérülése és a bélflórát alkotó baktériumok sejtdegradátumainak (ezeket ma pathogen-associated molecular patternként [PAMP] is említik) transzlokációja egy fontos patogenetikai tényező (19). Tudjuk azonban, hogy az intesztinális barrier sérülése nélkül is történhet PAMP-antigénprezentáció a nyálkahártya-asszociált nyirokrendszerben a Microfold-sejteken keresztül. Ezeknek a sejteknek kifejezetten az a funkciójuk, hogy a lumináris antigének pásztázását és transzportját végzik, majd a dendritikus sejtekben zajlik a szokásos úton az antigénprezentáció a perifériás nyirokszervekben (20). Ez nagyon fontos formája a luminárisantigén-mappingnek még ép barrier mellett: a szervezet tulajdonképp a luminárisantigén-egyensúly felborulása nyomán a kóros arányban felszaporodott baktériumfajok megnövekedett arányban megjelenő antigénjei ellen készít elő immunválaszt. Ez előkészületet jelent egy potenciális barriersérülés következményeire, bakteriális invázióra (21). Minél homogénebb diszbiotikus antigénkörnyezet alakul ki (amely típusosan a diverzitáscsökkenés mellett jön létre), annál inkább egy nyálkahártyafelszínen kialakuló fertőzést megelőző állapotot jellemez még a szöveti invázió előtt, amire a szervezetünk preventív gyulladásos válasszal készül (22).
A PAMP-vezérelt, veleszületett immunválasz regulációjának ismertetése meghaladná ennek az összefoglalónak a kereteit (23), de a toll-like receptorokon keresztül megvalósuló reguláció evolúciósan konzervált módon az eukarióta szervezetek védekezését szolgálja a potenciális parazita prokarióták ellen (24). A környezetszennyezés a mi esetünkben elsősorban az életmódbeli tényezőkkel kapcsolatos, mint a humán sejtek és a mikrobiom között kialakult ökoszisztéma felborulása, amely fontos forrása ennek a low-grade gyulladásnak, ami az IBS-nél megismert módon a fájdalommoduláció zavaraihoz vezet.
Ez az antigén-prezentáció nem csupán az intesztinális barrier kapcsán jelenik meg a fent leírt módon, de a légúti (25) és a sinusnyálkahártyán is ugyanígy működik (26). Szerepe hasonló (27), hiszen a legúti potenciális patogének és a nyálkahártyán reziduális bakteriális kolónia (légúti mikrobiom) diverzitása és fertőzőképessége is hasonló következményekkel jár.
A fejfájás
A fejfájások nemzetközi klasszifikációja nem oki alapon történik, hanem a fejfájástípusokat elsősorban tüneti és a kezelés vonatkozásában különítik el. Ugyanazon betegnél azonban előfordulhat egyik és másik forma is (28). Ezek közül mind a tenziós fejfájás, mind a migrén patomechanizmusát tekintve fontos szerepe van a fej-nyak izmainak, a fasciáinak, a koponyacsonthártyák és a kemény agyhártya szenzoros beidegzését adó agyi idegpályáknak, amelyek között kiemelt jelentőséggel bír a n. trigeminus kóros aktiválódása (29). Ennek pontos kóroktana intenzív kutatás tárgyát képezi. Ebben a bonyolult, multifaktoriális folyamatban az utóbbi időben a mikrobiom potenciális kóroki szerepe is előtérbe került, amely hátterében részben gyulladásos mediátorok (IL-1β, IL-6, IL-8, TNF-α), és különböző neuropeptidek (CGRP, substance P, vasoactive intestinal peptide, neuropeptide Y) állnak (30).
Az afferens – szenzoros – neuronok által közvetített információk jellemzően áthaladnak a köztiagyon, és a thalamuson keresztül érik el az érzékelés kérgi központjait. A thalamus szabályozza, hogy a perifériáról érkező ingerek az egyed túlélése szempontjából relevánsak-e, vagy tudatos kérgi válaszreakcióra nincs szükség, és elnyomja őket (31). Ez a figyelemfókuszálás szempontjából fontos evolúciós jelentőségű. A sinus mucosa, illetve a sinusokat borító csonthártya szenzoros beidegzését nem mielinizált C rostokat tartalmazó neuronok adják (32), amelyek neuropeptid-receptorai (33) a n. trigeminus szenzoros pályáit aktiválják. Ezek gyulladásos és kemoirritáns ingerekre fájdalomingereket, vazodilatációt, az utóbbi kapcsán extravazációt, illetve tüsszentési reflexet kell hogy indítsanak, amelyek a fentebb említett a patogén prokarióták elleni védelem fontos mechanizmusai (34). A CGRP a fejfájás kialakulásának egyik végső közös mediátora a központi idegrendszerben, amely ma a célzott migrénterápia egyik fontos farmakológiai célpontja (35).
A krónikus gyulladás a kemokinreceptorokon keresztül állandó szenzoros aktiválószignált indít, és fontos hangsúlyozni, hogy a sinusnyálkahártya, illetve a csonthártya vagy a dura triggerpontokként szerepelhetnek (36). Ugyanígy kiindulópontja lehet a fájdalomingernek a nyakizmok vagy az arcizmok görcsös összehúzódása is, aminek a hátterében diverz, részben örökletes, részben a Ca-csatornák érzékenységéhez köthető mechanizmusok (37), a stressz (38) és nyakizomterhelés, kényszertartás szerepelhetnek (39). A lényeges elem még a fejfájás kialakulásában, hogy a C rost aktivációja tartóssá válik, amely együtt jár egy low-grade neurogén gyulladással és fájdalomérzettel is.
A thalamusnak fontos szerepe, hogy a C rostokból származó afferens ingerületeket szűrje, és a nem releváns ingerületek ne tudatosuljanak. A patológiás fájdalom akkor alakul ki, amikor a thalamus reléfunkció-zavara miatt ez nem megfelelően valósul meg. Ez a kulcsmomentum a betegek stratifikációjánál: a reléfunkció zavarához milyen prediszponáló tényezők vezetnek. Ez lehet még individuálisan is a magyarázata annak, hogy hasonló fizikai behatások, pl. az életmódkörülmények bizonyos esetekben fejfájástriggerként szerepelnek, míg máskor nem váltanak ki fájdalmat (40). A betegek pszichés terhelését épp ez a kiszámíthatatlanság okozza: miért van az, hogy valamikor az éhezés, máskor a nagyobb, megterhelőbb étkezés okoz fejfájást? Miért okoz néha az alváshiány, ugyanakkor jellemzően épp annak a megszűnése, a hétvégi hosszabb alvás migrént? Ehhez meg kellett értenünk a thalamus reléfunkciójának szabályozó mechanizmusait.
A thalamusszabályozás tényezői
Azonos ingereknek nagyon más evolúciós (= túlélési) jelentősége lehet különböző kontextusban, különbözi környezeti hatások mellett, így a thalamusnak a reléfunkcióját is ehhez kell megfelelően hangolnia. Amikor az egyed menekülő élethelyzetben, stresszben van, vagy épp támadásra készülve pattanásig feszülnek az izmai, egész másként kell tudnia reagálni a környezet változásaira; az érzékek ébersége, érzékenysége modulálható kell hogy legyen. Ebben a bonyolult szabályozó mechanizmusban jelentős feladatot lát el a köztiagy specifikus része, a hypothalamus (41). Jelenősége pont abban van, hogy a perifériáról jövő ingerek modulációját végző thalamus érzékenységének szabályozásával az egyed reakciókészségét nagyban tudja befolyásolni. Ez a múltbeli tapasztalatok és az ösztön szabályozásközpontja, amely nemcsak a tudatosulás, de a tanulás kérgi folyamatait is az érzelemvilágunkon keresztül döntően befolyásolja. Mai tudásunk szerint a thalamus „priming”, azaz a szenzoros átkapcsolás kondicionálását a hypothalamus az élethelyzetünkkel kapcsolatos szabályozási rendszereken keresztül befolyásolja. Ennek egyszerűsített vázlatát mutatja be az 1. ábra.
1. ábra: A thalamus szabályozásának kiemelt neurohormonális tényezői
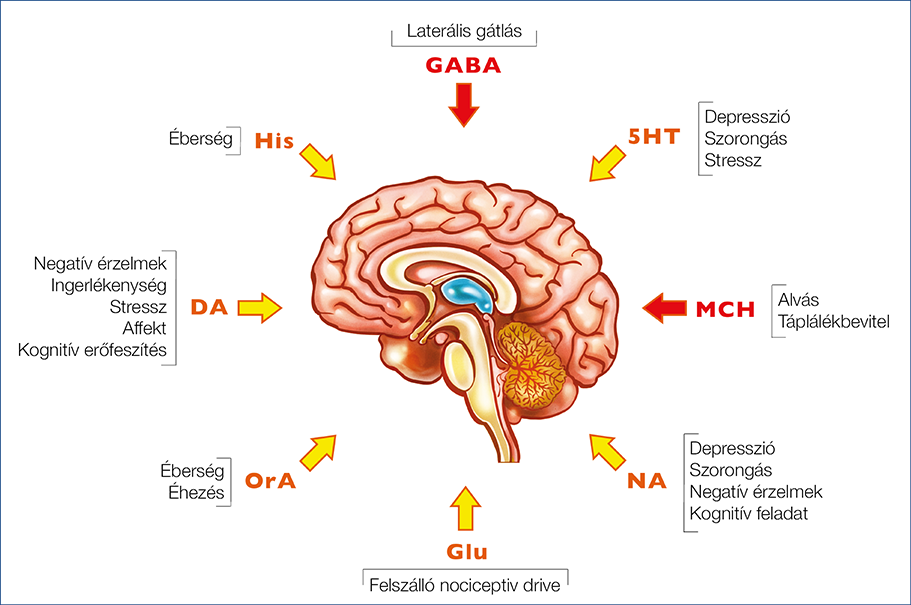
Ezek között a szabályozó mechanizmusok között több excitatorikus és inhibitorikus hatású van. A thalamusaktivitást és -konnektivitást bizonyítottan csökkentő tényező az MCH és a GABA (42). Előbbi szerepe kiemelt jelentőségű az alvásban, a fejfájás és az alvásmegvonás vonatkozásában. A thalamusfáradás ugyanis túlstimuláció nyomán következik be (43). Az alvás ideje alatt történik a fiziológiás regeneráció. Az alvásmegvonás (MCH-csökkenés = a gátlás hiánya) együttesen a túlstimulált állapottal együtt, ami – pl. fokozott stressz vagy éhezés/vércukoresés (orexin), vagy tartós fájdalomszignálok és gyulladás esetén következik be (glutamate-signalling) – oda vezet, hogy a thalamikus relé kiesik, azaz fokozott konnektivitás nyomán a kérgi tudatosuló fájdalomérzet állandósul. Az 1. ábrán bemutatott túlstimulációhoz vezető életmódtényezőket röviden felsoroljuk.
Dopamin
A neurotranszmitterként viselkedés szempontjából a jutalmazásért, a motivációért felelős vegyület. Hiányát – egyes függőségek esetén ismerten, akár relatív hiányát is – a negatív érzelmekhez, stresszhez kötjük (44). Az agy jutalmazási dopaminergszabályozási mechanizmusának középpontjában az egyed túlélése szempontjából sikeres viselkedésmintázat megerősítése áll: annak eldöntésében, hogy a számos lehetséges viselkedés közül melyiket kell végrehajtani egy adott időpontban. Az, hogy a thalamus trigeminovaszkuláris neuronjait a dopaminergrostok gazdagon beidegzik, arra utal, hogy a nociceptiv trigeminovaszkuláris jelek dopaminmodulálása a thalamusban is fontos szerepet játszik.
Noradrenalin (NA)
Szerepe a „fight or flight response” kialakításában jól dokumentált (45). Jellemzően amíg a veszély fennáll, és a stresszfaktor nem szűnik meg, magát a fájdalomérzetet az adrenergválasz elnyomja, illetve a fájdalomérzet modulációjában fontos szerepet játszik (46). Amikor a stresszhatás elmúlik, vagy a thalamusfáradás révén a moduláció a fájdalomtudatosulást lehetővé teszi, a fejfájás előjön (weekend headache) (47).
Orexin
A vércukoresés szabályozza a felszabadulását. A fejfájástrigger egyik jól ismert tényezője, amely a fentiekhez hasonlóan hozzájárul a thalamusfáradáshoz (48). Sok esetben az épp még kompenzált alváshiány mellett fontos második vagy harmadik additív faktor, ami a thalamusfáradás-fenotípus kialakulásához vezethet.
Szerotonin (5HT)
Az 5HT a hangulati élet stressz-, szorongás- és depressziószabályozásában vesz részt, amely az érzelmi feszültség kialakításán keresztül mediálódik. Az 5HT-túlsúly kialakulása ugyanakkor fontos migrénellenes hatású tényező (49). Ennek ismert a farmakológiai háttere is, hiszen a triptánok elsődleges hatása az 5HT-szint emelkedése révén akutfejfájás-ellenes hatásban jelentkezik (50).
Hisztamin
Külön figyelmet érdemel a hisztamin. Egyrészt gasztroenterológiai gyakorlatból ismerjük a hisztamint felszabadító ételek, illetve az ezzel összefüggésben megismert barriersérülés kóroktani jelentőségét (51). Ennek klinikai tünetegyüttese rendkívül gazdag, jól jellemzi súlyos esetben a total IgE emelkedése a vérben, illetve bőrön dermografizmus, csalánkiütések, ételintoleranciák. Ebbe a sorba csatlakozik a fejfájás is, ahol a hisztamintrigger tényezőként megjelenik (52). Kísérletes körülmények között iv. hisztamininfúzió fejfájást provokál (53). A gasztroenterológiai klinikai gyakorlatban az intesztinálisbarrier-diszfunkció, illetve a bakteriális endotoxin-transzlokáció nyomán kialakult low-grade gyulladás során felszabaduló hisztamin nemcsak az IBS patogenezisében vehet részt (54), de fejfájástriggerként is szerepelhet.
GABA
A laterális inhibitorikus jelek summájának eredője, ami a thalamusfáradás alváson kívüli mechanizmusának fontos eleme (55).
A thalamusrelének az egyed számára megkívánt funkciójának ellátása multifaktoriális alapokon – így az excitatorikus és inhibitorikus hatások summájának függvényében – nyugszik. A ma ismert szabályozó mechanizmusok közül sokkal több excitatorikus faktor van, mint inhibitorikus, ami talán evolúciós jelentőséggel bír. A túlélés szempontjából a készenléti feszültség és figyelemkoncentráció, illetve az érzelmek által megerősített tanulási folyamatok sokkal nagyobb jelentőséggel bírnak, mint az inhibitorikus tényezők – ezáltal az alvás – hiánya. Az elmúlt 100 év és a villanyvilágítással összefüggő fényszennyezés hozta előtérbe ezt a szemléletet, hiszen a világítás nélkül a cirkadián ritmus diszfunkciójának kockázata elenyésző volt (56). Ugyanez a helyzet a túlevéssel és a zsírban gazdag táplálkozással is. Ennek az emberi evolúció időléptékében szemlélve nem volt jelentősége. Ugyanakkor ezek az antagonisztikus peptiderg szabályozó mechanizmusok mintázatszerű megjelenése jól mutatja, hogy egymással antagonisztikus erők eredője határozza meg a trigeminovaszkuláris rendszerben az afferens neuronok által továbbított információk thalamocorticalis modulációját állandóan változó fiziológiás (pl. alvás, ébrenlét, étkezés), viselkedésbeli (addikció, izoláció), kognitív (figyelem, tanulás, memóriahasználat) és hangulati (úm. stressz, szorongás, düh, depresszió) viszonyok között.
A fejfájás tünettana
Külön jelentőséggel bír döntően a primer fejfájások esetében a fejfájás tünettana abból a szempontból, hogy a jelenlegi klasszifikáció nagy részben erre (és nem a kialakulás okára) fókuszál. Orvostörténeti példával élve az antibiotikumok előtti éra döntően prognosztikai fókuszú diagnosztikai megközelítésében a pontos tünettani leírás, lázgörbék, fizikai vizsgálat jelentősége sokkal meghatározóbb volt, mint a mai gyakorlatban, amikor egy fertőzés lokalizációja, esetleg annak morfológiai (ultrahang, CT stb.) megjelenése, illetve a kórokozó (az ok) azonosítása, gyógyszerérzékenysége határozza meg a klinikai gondolkodásunkat.
A migrén jellegű fejfájás komplex tünettana és annak – részben – patofiziológiája is jól ismert. A trigemino-hypothalamicus (THT), illetve retino-hypothalamicus (RHT) pályák (57) közvetítik a fentiekben már említett hypothalamusmagoknak azokat a környezeti információkat, továbbá szenzoros szignálokat, amelyek a szomatoszenzoros pályák thalamusrelé-szabályozását befolyásolni fogják (1. táblázat).
1. táblázat: A hypothalamusmagok és legfontosabb funkcióik
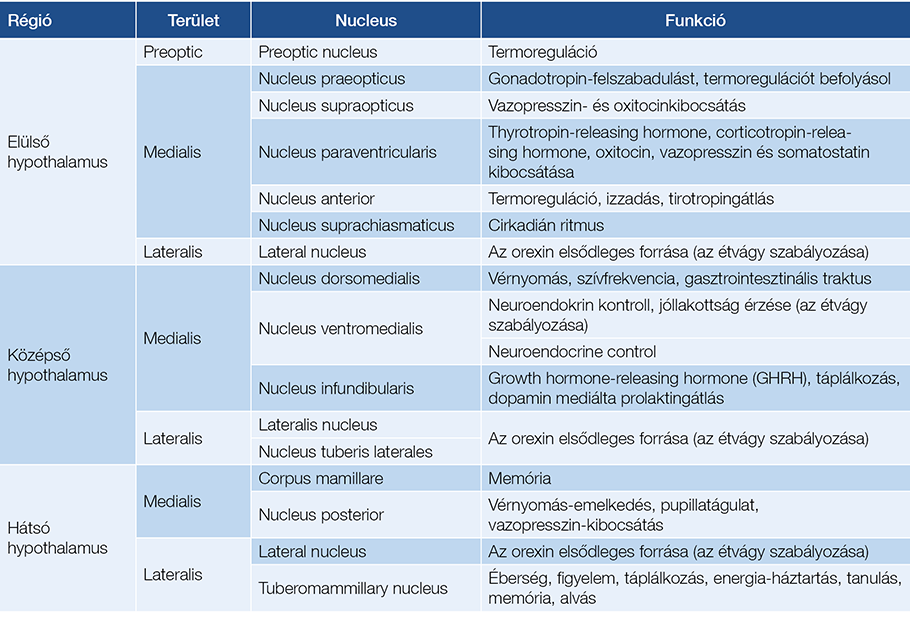
Ezeknek a hypothalamusmagoknak a kóros működésével járnak együtt azok a thalamusfáradással egyidejűleg jelentkező prodromális (pl. étvágycsökkenés, fotofóbia, allodynia, ásítás, könnyezés stb. (58, 59), illetve a fejfájást kísérő tünetek, amelyek együttállását migrénként definiáljuk. Ezt leegyszerűsítve, kóroktani megközelítést alkalmazva a krónikus fejfájásoknál felmerül a kérdés, hogy a preventív kezelés tekintetében valóban külön csoportot képez-e a migrénes tünetegyüttessel jelentkező beteg, vagy annak kérgi tudatosulásában a thalamusfáradás centrális szerepe a döntő a kezelés szempontjából. A kísérő tünetek pedig nagyrészt attól függnek, hogy a fájdalomszignál és annak átkapcsolása mely THT-pályákhoz kötődik. Megint egy leegyszerűsítő hasonlattal élve, az appendicitisnek fontos tünete lehet a fűrészelő láz és a hasi fájdalom, de annak pontos karakterisztikája függ a beteg társbetegségeitől (pl. diabéteszes neuropathia), az appendix helyzetétől (pl. retrocaecalis), a beteg tápláltsági állapotától, illetve attól, hogy a gyulladás korai stádiumáról, esetleg már a vakbél perforációjáról van szó. A jellegzetes tünetek vagy kísérik ezt, vagy nem típusos formában jelentkeznek, de a megoldás a gyulladt szerv sebészi eltávolítása és az antibiotikus kezelés.
A krónikus fejfájások eddigi tünetorientált kezelési stratégiájában az új generációs célzott terápiák és a kóroktan pontosabb ismerete újdonságot hozhatnak, ha prospektív randomizált vizsgálatok megerősítik a jelenleg sporadikusan dokumentált megfigyeléseket, és objektivizálható lesz a mikrobiom-asszociált gyulladás kóroki szerepe a thalamusfáradásban és a migrén progressziójának megelőzésében.
2. Pavlov PI. Conditioned reflexes: An investigation of the physiological activity of the cerebral cortex. Ann Neurosci 2010 Jul; 17(3): 136–41.
3. van de Wouw M, Schellekens H, Dinan TG, Cryan JF. Microbiota-Gut-Brain Axis: Modulator of Host Metabolism and Appetite. J Nutr 2017 May; 147(5): 727–745.
4. de Vries R, Morquecho-Campos P, de Vet E, de Rijk M, Postma E, de Graaf K, Engel B, Boesveldt S. Human spatial memory implicitly prioritizes high-calorie foods. Sci Rep 2020 Oct 8; 10: 15174.
5. Hofmann J, Meule A, Reichenberger J, Weghuber D, Ardelt-Gattinger E, Blechert J. Crave, Like, Eat: Determinants of Food Intake in a Sample of Children and Adolescents with a Wide Range in Body Mass. Front. Psychol 2016 Sept 21; 7: 1389.
6. Valdes AM, Walter J, Segal E, Spector TD. Role of the gut microbiota in nutrition and health. BMJ 2008 Jun 13; 361: k2179
7. Ekholm P, Reinivuo H, Mattila P, Pakkala H, Koponen J, Happonen A, Hellström J, Ovaskainen ML. Changes in the mineral and trace element contents of cereals, fruits and vegetables in Finland. J Food Compost Anal 2007 Sept; 20(6): 487–495.
8. Dawkins R. 1941-. The Selfish Gene. Oxford; New York: Oxford University Press, 1989.
9. Sanna S, van Zuydam NR, Mahajan A, Kurilshikov A, Vila AV, Urmo Võsa U, Mujagic Z, Masclee AAM, Jonkers DMAE, Oosting M, Joosten LAB, Netea MG, Franke L, Zhernakova A, Fu J, Wijmenga C, McCarthy MI. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases. Nat Genet 2019 Febr 18; 51: 600–605.
A további irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.hu weboldalon.
