Összefoglaló közlemények / Reviews
Extraintestinal manifestations of IBD with emphasis on dermatological aspects
Summary
The prevalence of extraintestinal manifestations of chronic non-specific intestinal inflammatory disorders is around 30%. They may appear before, in parallel or after the diagnosis of IBD and have major impact on patients’ quality of life. Practically any organ can be affected, but joint, skin, hepatobiliary and eye manifestations are the most frequent. A key to successful treatment is a systematic and multidisciplinary approach.
A krónikus, nem specifikus gyulladásos bélbetegségekben (IBD) az extraintesztinális tünetek a különböző szervek és szervrendszerek érintettségének jeleként az esetek kb. 30%-ában jelennek meg. Az IBD diagnózisa előtt vagy után, az aktivitással párhuzamosan, vagy attól függetlenül zajló extraintesztinális manifesztációk alapvetően meghatározzák a beteg életminőségét. Tulajdonképpen bármely szerv érintett lehet, de a leggyakrabbak az ízületi, a bőr-, a hepatobiliaris és a szemészeti manifesztációk. A tünetek szisztematikus keresése és a multidiszciplináris közelítés a sikeres kezelés záloga.
Bevezetés
A krónikus, nem specifikus gyulladásos bélbetegségek (IBD) mint immunmediált kórképek leginkább szisztémás gyulladásnak felelnek meg, ahol a gasztrointesztinális rendszer különböző mértékű, formájú és elhelyezkedésű érintettsége mellett az esetek kb. 30%-ában más szervek, szervrendszerek is érintettek (1). Ezen úgynevezett extraintesztinális manifesztációk (EIM) változó mértékű megjelenése, akár az IBD diagnózis előtti jelenléte, a kezelés megválasztása szempontjából is kiemelkedő jelentőségű, és alapvetően meghatározza a betegek életminőségét (2). Egy részük a béltünetekkel, a gyulladásos aktivitással párhuzamosan jelentkezik, és a kezelésre szűnik, mások az IBD aktivitásától függetlenek. Az EIM az IBD mindkét klinikai megjelenési formájára, a colitis ulcerosára (CU) és a Crohn-betegségre (CD) egyaránt jellemző (1, 2).
Fontos megkülönböztetni az extraintesztinális manifesztációkat az extraintesztinális szövődményektől, ahol az EIM a gyulladásos patológiai folyamat gasztrointesztinális rendszeren kívüli megjelenése IBD-ben, az immunválasz kiterjedése más szervekre, közös genetikai és környezeti hajlamosító tényezőkkel (3).
Tulajdonképpen bármely szerv érintett lehet, de a leggyakrabbak az ízületi (perifériás és centrális), a bőr- (pyoderma gangrenosum, erythema nodosum, Sweet-szindróma, aphtosus stomatitis, hidradenitis suppurativa, psoriasis), a hepatobiliaris (primer szklerotizáló cholangitis) és szemészeti (episcleritis, uveitis és iritis) manifesztációk. Az EIM jelenléte igazi kihívást jelent a betegekkel való foglalkozásban, a multidiszciplináris egységes, komplex szemlélet és gyakorlat a hatékony, sikeres ellátás záloga (4).
Az extraintesztinális manifesztációk gyakorisága
Az EIM gyakorisága változó a különböző szervek, szervrendszerek között, összességében 6-47%-ra tehető (5). A képet színezi az a tény, hogy a betegek jelentős részében több EIM is jelen van, egyes adatok szerint ennek gyakorisága akár 25%-ra is tehető (6). Gyakrabban fordulnak elő az IBD korai szakaszában és fiatalabb betegekben, de ezek az eredmények nem konzisztensek. Egyes vizsgálatok gyerekkorban 68%-os előfordulást észleltek, colitis ulcerosában 50%-ot, Crohn-betegségben 80%-ot írtak le (7). Az orofacialis granulomatosis főleg Crohn-beteg fiú gyerekekben jelenik meg, ugyanakkor a stomatitis gyakoribb előfordulásában csak enyhe tendencia észlelhető (8).
A betegek 26%-ában az EIM az IBD diagnózisa előtt jelenik meg (átlag öt hónappal), ilyenkor is bármely szervi érintettség előfordulhat. Az IBD diagnózisa után észlelt EIM megjelenésének átlagos ideje 92 hónap (6).
Az EIM patofiziológiája
A gasztrointesztinális gyulladás és az EIM patogenezise hasonló, illetve gyakran azonos utakon halad (4). A genetikai rizikófaktorok szerepe valószínű, miután ugyanazok az elváltozások fellelhetők a különböző IBD-formák és EIM-ek között is. Szintén fontos a környezeti tényezők és a veleszületett, valamint az adaptív immunválasz szerepe az adott szerv gyulladásának kiváltásában és fenntartásában, amely közvetlenül a mikrobiommal való kölcsönhatás révén valósul meg.
Genetikai rizikófaktorok
A genetikai tényezők jelentőségét az EIM vonatkozásában a gyerek-szülő, illetve testvérpárok vizsgálatában kimutatható 70%-os, illetve 84%-os konkordanciaértékek erősítik, valamint a jelentős átfedés az IBD és az EIM genetikai rizikólocusok között (9). A genetikai tényezők szerepét támasztja alá a gyerekpopulációban előforduló monogénes IBD kimutatását célzó teljesgenom-vizsgálatok során észlelt 15,36-os (p<0,0001) esélyhányados az EIM megjelenésére, amely 76%-os prevalenciát jelent CD-ben, és 42%-ot UC-ben (10). A CD-ben elsőként azonosított genetikai rizikóvariáns, a NOD2/CARD15, sacroileitisben és uveitisben is kimutatható (11, 12). A bőrmanifesztációk közül a pyoderma gangrenosum esetében az IL8RA, PRDM1, USP15 és a TIMP3 locusok között észleltek kapcsolatot az IBD-vel, míg erythema nodosumban a PTGER4, ITGAL, SOCS5, CD207, ITGB3 ismert IBD genetikai locusok mutattak szignifikáns összefüggést (13).
Környezeti tényezők
A legtöbb és legegyértelműbb adatok a dohányzással kapcsolatosak, amelyek szerint a dohányos Crohn-betegekben nagyobb az EIM esélye, 10%-kal magasabb a bőr- és ízületi érintettség előfordulása, ugyanakkor a dohányzás elhagyásával csökken az EIM megjelenése (14). Az nem teljesen tisztázott, hogy a dohányfüst milyen módon vesz részt az IBD patogenezisében és járul hozzá a folyamat súlyosságához és az EIM gyakoribb megjelenéséhez.
Az immunrendszer aktiválódása
Feltételezik, hogy az intesztinális antigének elleni specifikus immunválasz során létrejövő keresztreaktivitás eredményeként alakulhatnak ki EIM-ek. Ugyanakkor az intesztinális vaszkuláris rendszer adresszinjei, mint a MAdCAM-1 (a leukocyta α4β7 integrinek targetjei) ektópiás májexpresszióját is leírták (15, 16). Ezen mechanizmusok szerepe egyelőre bizonyításra vár.
A mikrobiom szerepe
Több lehetőség is felmerült a mikrobiom lehetséges szerepével kapcsolatban az EIM kialakulásában. Ilyen lehet a bélmikrobióta-antigén és az extraintesztinális célszervek sejtjeinek epitópjai közötti molekuláris hasonlóság, ami immun-keresztreaktivitáshoz vezethet, áteresztő intesztinális barrier mellett létrejövő transzlokáció a szisztémás gyulladás kialakulásában, vagy a „dysbiosis”, illetve a diverzitás elvesztése, amely az intesztinális immunsejtek aktivitását és migrációját okozhatja (4, 17).
Mozgásszervi manifesztációk
A musculoskeletalis EIM a leggyakoribb, IBD-s betegek 46%-ában is jelen lehet az alkalmazott klinikai és radiológiai kritériumok függvényében (ízületi fájdalom [arthralgia], ízületi gyulladás [arthritis]). A gyulladásos arthritis a leggyakoribb EIM, amelynek 20-50%-a axialis formában, 5-20%-a pedig perifériás arthritis formában jelentkezik (18). A perifériás (pSpA) forma főleg aszimmetrikus, és elsősorban CD-ben észlelhető. Az életkor előrehaladtával az arthritis prevalenciája jelentősen csökken, ennek megfelelően egyes megfigyelések szerint a 20-30 éves populációban 25%-ban, míg az 50-60 évesek körében csupán 2%-ban fordul elő.
Reumatológiai szempontból az IBD-s betegek mozgásszervi EIM-je a spondylarthritis (SpA) családjába sorolható (19).
A rheumatoid arthritistől eltérően az SpA ritkábban okoz deformitást, és ritkábban társul erozív elváltozásokkal a röntgenfelvételeken. Az SpA mértékének megállapításában gold standardnak számít az Ankylosing Spondylitis Disease Activity Score, amely lehetővé teszi a betegség aktivitásának időbeni követését (20).
Az SpA-csoportba sorolható elváltozások típusosan szeronegatívak a reumafaktor (RF) szempontjából, korábbi elnevezés szerint „szeronegatív spondyloarthropathiák”, ugyanígy többnyire negatív az anticitrullin peptid antitest (ACPA), bár mindkét esetben több a pozitív eset, mint az általános populációban (15%, 10% vs. 5%) (20, 21).
Az axialis arthritisre/spondyloarthropahiára (axSpA) jellemző a perzisztáló (elsősorban nyugalomban jelentkező) derékfájdalom. Sok esetben a tünetek jelentkezése és a radiológiai eltérések megjelenése között hosszú évek is eltelhetnek. Az IBD-hez társuló sacroileitis általában bilaterális, és a CD-s betegek akár 50%-ában tünetmentes formában jelentkezik.
Az alapbetegség kezelésének fontos szerepe van az ízületi panaszok csökkenésében, de a betegek jelentős részében ennek ellenére is perzisztálnak a mozgásszervi panaszok.
Szemtünetek
Az ízületi és bőrtünetek után a szemtünetek a leggyakoribb EIM-ek, 2–7%-ban jelentkeznek, gyakrabban CD-ben és gyerekekben (22).
A leggyakoribb formái a szemszárazság, a szemhéjgyulladás, illetve az episcleritis. Az IBD-hez társuló szemtünetek egy része lehet a kezelés következménye is. Az episcleritis enyhe diszkomfortot okoz, aktív gyulladással, illetve relapszusokkal társul, így az alapbetegség kezelése csökkenti a panaszokat. A scleritis igen ritka, de hosszú távon permanens látásvesztéshez vezethet, így fontos, hogy időben felismerjük. Az uveitis a szivárványhártya, a sugártestek és az érhártya gyulladása. Kevésbé függ össze az alapbetegség aktivitásával (22, 23).
Azonnali szemészeti vizsgálat javasolt látásromlás, idegentest-érzés, fixált pupilla, súlyos fejfájás és hányinger esetében.
Kardiovaszkuláris manifesztációk
Pericarditis, myocarditis, vénás és artériás trombózis, arrhythmia, átvezetési zavar, infektív endocarditis, valamint Takayasu-arteritis formájában jelentkezhet (1, 24).
A leggyakoribb kardiovaszkuláris EIM a pericarditis, amely nem mutat összefüggést a betegség aktivitásával (1).
Metaanalízisek szerint az artériás tromboembóliák, illetve a kardiovaszkuláris mortalitás kockázata nem magasabb IBD-s betegekben, de gyakrabban fordulnak elő kardiovaszkuláris betegségek, főleg nőkben (15, 26, 27).
IBD-s betegekben gyakrabban fordul elő hyperhomocysteinaemia, mint az átlag populációban, ami a trombózis kockázatát növeli (28).
Hepatobiliaris manifesztációk
Az IBD-s betegek 20-30%-ában észlelhető abnormális májfunkciós érték (29).
Primer szklerotizáló cholangitis (PSC) esetében 50-80%-ban IBD is jelen van, ugyanakkor az UC-s betegek csak 5%-ában észlelhető PSC, CD-ben (elsősorban a vastagbél-érintettségű) még ennél is kisebb arányban fordul elő (30).
Az UC-vel és a PSC-vel diagnosztizáltak esetében gyakoribb a jobb oldali forma, az ún. „backwash” ileitis jelenléte és a rectum megkíméltsége. Hajlamosító tényező lehet a férfi nem, a dohányzás, az appendectomia és a pancolitis jelenléte a diagnózis felállításakor. Total colectomián átesett betegeknél a PSC progresszióját figyelték meg, míg a májtranszplantáltak esetében sokszor az IBD progressziója látható. PSC esetében magasabb az epeúti és kolorektális daganatok kockázata, emiatt fontos a betegek rendszeres szűrése (31–34).
Autoimmun hepatitis (AIH)/PSC overlap syndroma gyakrabban társul UC-hez, mind CD-hez (29).
Ritka EIM-ek
Az akut idiopátiás pancreatitis (AP) ritka, főleg CD-s betegekben látható EIM. Fontos az elkülönítése az IBD-ben alkalmazott kezelések okozta pancreatitistől (35).
A bronchopulmonalis manifesztáció szintén ritka, jelentkezhet bronchialis megbetegedés, intersticiális (ILD) és granulomatosus tüdőbetegség formájában. Az utóbbi főleg CD-hez társultan, míg az ILD elsősorban UC-ben figyelhető meg (36).
Szintén ritka a glomerulonephritis, az amyloidosis, a nephrolithiasis előfordulása.
Mucocutan extraintesztinális manifesztációk
Az IBD bőrt és szájnyálkahártyát érintő extraintesztinális manifesztációi relatíve gyakoriak, prevalenciájuk Crohn-betegségben magasabb, mint a colitis ulcerosában (37). A patofiziológia, a diagnosztikus megközelítések és a terápiás lehetőségek figyelembevételével a következő csoportosítás lehetséges (1. táblázat): I. specifikus bőr-EIM, ami szövettani egyezést mutat a Crohn-betegséggel („metasztatikus Crohn”); II. IBD-asszociált kórképek (pl. erythema nodosum, aphtosus stomatitis, psoriasis, hidradenitis suppurativa); III. reaktív manifesztációk (pl. pyoderma gangrenosum, Sweet-szindróma) (38).
1. táblázat: Az IBD mucocutan extraintesztinális manifesztációinak csoportosítása patofiziológia, diagnosztikus megközelítések és terápiás lehetőségek alapján
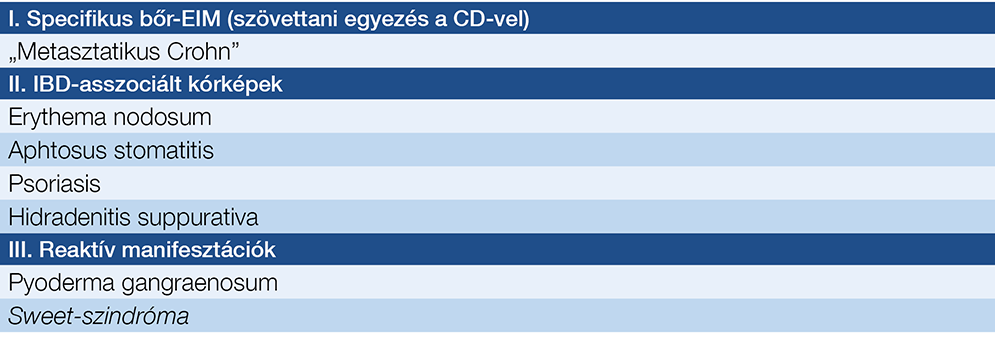
Erythema nodosum (EN)
Az EN fő tünetei fájdalmas, vörös (vagy lilás), előemelkedő, 1-5 cm átmérőjű bőr alatti csomók, jellemzően az alsó végtagok feszítő oldalán, leggyakrabban a tibia elülső felszínén (1. ábra). A combtájék és az alkarok is érintettek lehetnek. Női predominancia jellemző, a nőbetegek 15%-ánál több testtáj is érintett (2, 39). A klinikai kép jellegzetessége miatt a diagnózis felállításához bőrbiopsziára nincs szükség. Az EN prevalenciája IBD-s betegek körében CD esetén 5-15%, UC esetében 2-10% közötti (2). Egy nagy elemszámú svájci kohorszvizsgálat eredménye szerint az EN előfordulási aránya 6,8% inaktív, és 2,4% aktív stádiumú CD-s betegek körében (37). Egymásnak ellentmondó eredmények szerepelnek az irodalomban azzal kapcsolatban, hogy a bőrtünet jelenléte az intesztinális gyulladás mértékével egyenesen vagy fordítottan arányos. Az UC betegek körében az EN prevalenciája inaktív UC esetén 2%, aktív gyulladás jelenléte esetén 4,7% (37). Az IBD-hez társuló EN terápiája első vonalban (lokális vagy szisztémás) kortikoszteroid, illetve az anti-TNF-alfa-kezelés is kiváló hatékonyságú alternatíva.
1. ábra: Az erythema nodosum klinikai megjelenése Crohn-betegben
(a Debreceni Egyetem Bőrgyógyászati Klinika fotógyűjteményéből)
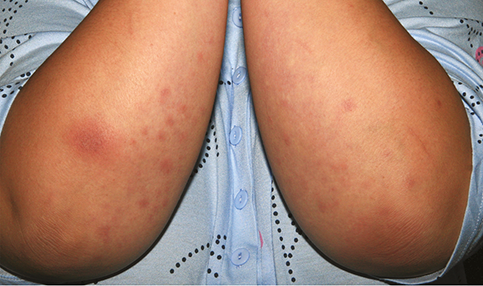
Pyoderma gangraenosum (PG)
A PG általában rapidan növekvő, erythematosus pustulák vagy nodulusok formájában kezdődik, amelyek gyakran mély, szabálytalan szélű, váladékozó ulcusokká alakulnak (2. ábra). A sebváladék-tenyésztés általában negatív (39). A PG előfordulása IBD-ben 0,4–2,6% közöttire tehető (40). Főleg az alsó végtagokat érinti, de megjelenhet 4–7%-ban a fej-nyak régóban, 4–5%-ban a törzsön is (2). A fekélyek lehetnek soliterek vagy multiplexek, egy- vagy kétoldaliak, és méretük a pár centiméterestől a teljes végtagi érintettségig terjedhet (2). Bár kevésbé gyakori, mint az EN, a PG súlyosabb, és az életminőséget nagyobb mértékben befolyásolja. Női predominancia jellemző (39). Egy svájci, nagy elemszámú kohorszvizsgálat szerint inaktív Crohn-betegség esetén 1,4%, aktív CD-ben 2,4% volt a PG előfordulási aránya. UC-betegek esetén inaktív szakban a betegek 1,5%-ánál, aktív szakban a betegek 3%-ánál fordult elő (37). A PG hátterében az esetek 50%-ában IBD áll, és súlyosabb lefolyású, vastagbél-érintettséggel járó IBD-hez gyakrabban társul PG (2). Alkalmanként peristomalis PG is előfordulhat. A diagnózis a klinikai képen alapul, a bőrbiopszia vétele kifejezetten ellenjavalt, mivel súlyosbíthatja a tüneteket (patergiás jel). A terápiás lehetőségek közt orális kortikoszteroid (40-60 mg/nap, majd fokozatos csökkentés), cyclosporin A (kezdeti szérumszintcél 150-300 ng/ml), tacrolimus (kezdeti szérumszint 10-15 ng/ml) vagy anti-TNF-alfa (infliximab, adalimumab) adása szerepel. Helyileg alkalmazott tacrolimus is hatékony lehet korai, peristomalis léziók esetén (0,1% tacrolimuskenőcs napi 2 alkalommal).
2. ábra: Pyoderma gangraenosum klinikai megjelenése Crohn-betegben
(a Debreceni Egyetem Bőrgyógyászati Klinika fotógyűjteményéből)
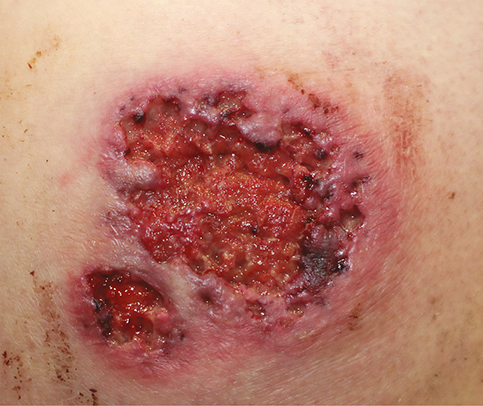
„Metasztatikus Crohn”
A Crohn-betegség „metasztázisának” tekinthetőek azok a léziók, amelyek a gasztrointesztinális (GI) traktushoz közvetlenül nem kapcsolódva jelennek meg, de a szövettani képet nem elsajtosodó granulomatosis jellemzi a CD intesztinális léziókhoz hasonlóan (42). Előfordulása ritka, leginkább esettanulmányokból ismert. Az életminőséget főleg a genitális, vulvovaginális érintettség nagymértékben befolyásolja. A metasztatikus CD megjelenése és a bélben zajló gyulladás aktivitása közt nem találtak összefüggést (39). Kezelése történhet helyi vagy szisztémás kortikoszteroiddal, immunmodulátorokkal, TNF-alfa-gátlókkal (43–47).
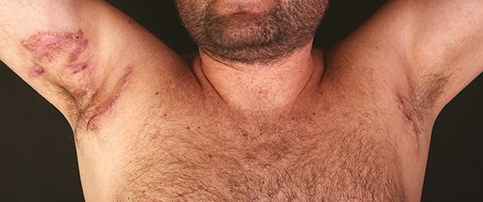
3. ábra: Hidradenitis suppurativa axilláris lokalizációjú heges, fistulázó, gyulladt
nodusok és abscessusok formájában való megjelenése Crohn-betegben
(a Debreceni Egyetem Bőrgyógyászati Klinika fotógyűjteményéből)
Sweet-szindróma
A Sweet-szindróma vagy más néven akut lázas neutrophil dermatosis ritka extraintesztinális manifesztációja az IBD-nek (2, 39). A kórképre jellemző a változatos méretű, végtagokat, kézfejet, törzset, arcot érintő, fájdalmas, papulosquamosus exanthemák vagy nodulusok jelenléte. Jellemzően malignus kórképekkel, fertőzésekkel hozhatók összefüggésbe, és csak ritkább esetben IBD-vel. Túlnyomórészt nőket érint (>80%), és társulhat más EIM-ekkel (arthritis, láz, szemtünetek), és lehet gyógyszermellékhatás következménye is (pl. azatioprin) (41). A tünetek intenzitása a bélben zajló gyulladás mértékével párhuzamosan változik. A diagnózis leggyakrabban (52%) már ismert IBD esetén születik (39, 41). Terápiája elsősorban helyi és szisztémás szteroid (40-60 mg/nap), valamint immunmodulátorok.
Szájnyálkahártyát érintő EIM
Vita tárgyát képezi, hogy a szájnyálkahártyát érintő léziók az IBD EIM-jének vagy a GI traktus felső szakaszát érintő IBD-nek tekinthetőek. Az IBD-s betegek körében az aphtosus stomatitis (főleg CD-ben) és a periodontitis is gyakori. A szájnyálkahártyát érintő léziók előfordulási aránya 5-50% közötti (48–50), gyermekeknél 7-23% (50). Egy nagy elemszámú fogászati kohorszvizsgálat szerint az aphtosus stomatitis prevalenciája CD-betegek körében 10%, UC-ben 4% (39). A fekélyek morfológiája hasonló az ileumot vagy colont érintőkéhez: kerek vagy ovális, fájdalmas, sárga pseudomembránnal fedett, erythematosus szegélyű léziók. Általában a buccalis és labiális mucosát érintik. Helyileg kortikoszteroid- és fájdalomcsillapító-kezelés, illetve szisztémásan kortikoszteroid, anti-TNF-alfa adása javasolt. A periodontitis ödémával, vérzéssel járó krónikus ínygyulladás, amely hosszú távon a fogakat kihorgonyzó csont és lágyszövet károsodásához, a fogak elvesztéséhez vezet. A gingivitis és a periodontitis gyakorisága magasabb IBD-s betegek körében, mint az egészséges populációban (51). A periodontitis patomechanizmusában az orális mucosa baktériumflórájának változása is szerepet játszik (52). Fő rizikófaktora (a nem megfelelő szájhigiéné mellett) a dohányzás (51, 53). Az aphtosus stomatitis és a periodontitis tüneteinek súlyossága általában arányos a bélben zajló gyulladás aktivitásával, és főleg a perianalis érintettséggel kapcsoltan gyakori.
IBD-hez társuló, immunmediált bőrbetegségek
IBD-s betegek körében a bőrt érintő, immunmediált gyulladásos betegségek előfordulási aránya magasabb, mint az átlagpopulációban. A psoriasis prevalenciája 9,6% Crohn-betegek, és 5,7% colitis ulcerosások közt. Hasonló immunpatomechanizmus lehetőségét veti fel a gyulladásos bélbetegeknél alkalmazott anti-TNF-alfa-terápia psoriasist indukáló/súlyosbító mellékhatása (54).
A hidradenitis suppurativa (HS) előfordulása 6,8-10,6% közötti IBD-s betegpopulációban, a Crohn-betegek szignifikánsan nagyobb arányban (71,6%) érintettek (55). Szoros asszociáció feltételezhető a két kórkép közt a klinikai (3. ábra) és szövettani kép (sipolyok, fistulák, granulomatosus gyulladás, hegesedés), a patogenezis (genetikai és mikrobiom-eltérések, immundiszreguláció) és a TNF-alfa-gátló-kezelésre adott hasonló terápiás válasz alapján (56).
Összefoglalás
Az extraintesztinális manifesztációk alapvetően meghatározzák a beteg életminőségét. IBD-ben ezen gyulladásos manifesztációk szisztematikus keresése, azonosítása fontos a sikeres kezelés érdekében (57). A változatos klinikum multidiszciplináris megközelítést és ellátást igényel.
https://doi.org/10.1007/s11894-019-0698-1
2. Vavricka SR, Schoepfer A, Scharl M, et al. Extraintestinal Manifestations of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015; 21: 1982–92.
https://doi.org/10.1097/MIB.0000000000000392
3. Orchard T. Extraintestinal complications of inflammatory bowel disease. Curr Gastroenterol Rep 2003; 5: 512–7.
https://doi.org/10.1007/s11894-003-0042-6
4. Hedin CRH, Vavricka SR, Stagg AJ, et al. The Pathogenesis of Extraintestinal Manifestations: Implications for IBD Research, Diagnosis, and Therapy. J Crohns Colitis 2019; 13: 541–554.
https://doi.org/10.1093/ecco-jcc/jjy191
5. Bernstein CN, Blanchard JF, Rawsthorne P, et al. The prevalence of extraintestinal diseases in inflammatory bowel disease: a population-based study. Am J Gastroenterol 2001; 96: 1116–22.
https://doi.org/10.1111/j.1572-0241.2001.03756.x
6. Vavricka SR, Rogler G, Gantenbein C, et al. Chronological Order of Appearance of Extraintestinal Manifestations Relative to the Time of IBD Diagnosis in the Swiss Inflammatory Bowel Disease Cohort. Inflamm Bowel Dis 2015; 21: 1794–800.
https://doi.org/10.1097/MIB.0000000000000429
7. Stawarski A, Iwanczak B, Krzesiek E, et al. Intestinal complications and extraintestinal manifestations in children with inflammatory bowel disease. Pol Merkur Lekarski 2006; 20: 22–5.
8. Lazzerini M, Bramuzzo M, Ventura A. Association between orofacial granulomatosis and Crohn’s disease in children: systematic review. World J Gastroenterol 2014; 20: 7497–504.
https://doi.org/10.3748/wjg.v20.i23.7497
9. Satsangi J, Grootscholten C, Holt H, et al. Clinical patterns of familial inflammatory bowel disease. Gut 1996; 38: 738–41.
https://doi.org/10.1136/gut.38.5.738
A további irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.hu weboldalon.
10. Crowley E, Warner N, Pan J, et al. Prevalence and Clinical Features of Inflammatory Bowel Diseases Associated With Monogenic Variants, Identified by Whole-Exome Sequencing in 1000 Children at a Single Center. Gastroenterology 2020; 158: 2208–2220.
https://doi.org/10.1053/j.gastro.2020.02.023
11. Kim JM, Cheon JH. Pathogenesis and clinical perspectives of extraintestinal manifestations in inflammatory bowel diseases. Intest Res 2020; 18: 249–264.https://doi.org/10.5217/ir.2019.00128
12. Peeters H, Vander Cruyssen B, Laukens D, et al. Radiological sacroiliitis, a hallmark of spondylitis, is linked with CARD15 gene polymorphisms in patients with Crohn’s disease. Ann Rheum Dis 2004; 63: 1131–4.
https://doi.org/10.1136/ard.2004.021774
13. Weizman A, Huang B, Berel D, et al. Clinical, serologic, and genetic factors associated with pyoderma gangrenosum and erythema nodosum in inflammatory bowel disease patients. Inflamm Bowel Dis 2014; 20: 525–33.
https://doi.org/10.1097/01.MIB.0000442011.60285.68
14. Severs M, van Erp SJ, van der Valk ME, et al. Smoking is Associated With Extra-intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis 2016; 10: 455–61.
https://doi.org/10.1093/ecco-jcc/jjv238
15. Grant AJ, Lalor PF, Salmi M, et al. Homing of mucosal lymphocytes to the liver in the pathogenesis of hepatic complications of inflammatory bowel disease. Lancet 2002; 359: 150–7.
https://doi.org/10.1016/S0140-6736(02)07374-9
16. Grant AJ, Lalor PF, Hubscher SG, et al. MAdCAM-1 expressed in chronic inflammatory liver disease supports mucosal lymphocyte adhesion to hepatic endothelium (MAdCAM-1 in chronic inflammatory liver disease). Hepatology 2001; 33: 1065–72.
https://doi.org/10.1053/jhep.2001.24231
17. Breban M, Tap J, Leboime A, et al. Faecal microbiota study reveals specific dysbiosis in spondyloarthritis. Ann Rheum Dis 2017; 76: 1614–1622.
https://doi.org/10.1136/annrheumdis-2016-211064
18. Karreman MC, Luime JJ, Hazes JMW, et al. The Prevalence and Incidence of Axial and Peripheral Spondyloarthritis in Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. J Crohns Colitis 2017; 11: 631–642.
https://doi.org/10.1093/ecco-jcc/jjw199
19. Stolwijk C, Pierik M, Landewe R, et al. Prevalence of self-reported spondyloarthritis features in a cohort of patients with inflammatory bowel disease. Can J Gastroenterol 2013; 27: 199–205.
https://doi.org/10.1155/2013/139702
20. Bourikas LA, Papadakis KA. Musculoskeletal manifestations of inflammatory bowel disease. Inflamm Bowel Dis 2009; 15: 1915–24.
https://doi.org/10.1002/ibd.20942
21. Rogler G, Singh A, Kavanaugh A, et al. Extraintestinal Manifestations of Inflammatory Bowel Disease: Current Concepts, Treatment, and Implications for Disease Management, Gastroenterology 2021; 161(4): 1118–1132.
https://doi.org/10.1053/j.gastro.
22. Taleban S, Li D, Targan SR, et al. Ocular Manifestations in Inflammatory Bowel Disease Are Associated with Other Extra-intestinal Manifestations, Gender, and Genes Implicated in Other Immune-related Traits. J Crohns Colitis 2016; 10: 43–9.
https://doi.org/10.1093/ecco-jcc/jjv178
23. Troncoso LL, Biancardi AL, de Moraes HV Jr., et al. Ophthalmic manifestations in patients with inflammatory bowel disease: A review. World J Gastroenterol 2017; 23: 5836–5848.
https://doi.org/10.3748/wjg.v23.i32.5836
24. Zanoli L, Mikhailidis DP, Bruno RM, et al. Aortic Stiffening Is an Extraintestinal Manifestation of Inflammatory Bowel Disease: Review of the Literature and Expert Panel Statement. Angiology 2020; 3319720918509.
https://doi.org/10.1177/0003319720918509
25. Panhwar MS, Mansoor E, Al-Kindi SG, et al. Risk of Myocardial Infarction in Inflammatory Bowel Disease: A Population-based National Study. Inflamm Bowel Dis 2019; 25: 1080–1087.
https://doi.org/10.1093/ibd/izy354
26. Kirchgesner J, Beaugerie L, Carrat F, et al. Increased risk of acute arterial events in young patients and severely active IBD: a nationwide French cohort study. Gut 2018; 67: 1261–1268.
https://doi.org/10.1136/gutjnl-2017-314015
27. Murthy SK, Robertson McCurdy AB, Carrier M, et al. Venous thromboembolic events in inflammatory bowel diseases: A review of current evidence and guidance on risk in the post-hospitalization setting. Thromb Res 2020; 194: 26–32.
https://doi.org/10.1016/j.thromres.2020.06.005
28. Oussalah A, Guéant JL, Peyrin-Biroulet L. Meta-analysis: hyperhomocysteinaemia in inflammatory bowel diseases. Aliment Pharmacol Ther 2011; 34: 1173–1184.
https://doi.org/10.1111/j.1365-2036.2011.04864.x
29. Restellini S, Chazouilleres O, Frossard JL. Hepatic manifestations of inflammatory bowel diseases. Liver Int 2017; 37: 475–489.
https://doi.org/10.1111/liv.13265
30. Rossi RE, Conte D, Massironi S. Primary sclerosing cholangitis associated with inflammatory bowel disease: an update. Eur J Gastroenterol Hepatol 2016; 28: 123–31.
https://doi.org/10.1097/MEG.0000000000000532
31. Treeprasertsuk S, Bjornsson E, Sinakos E, et al. Outcome of patients with primary sclerosing cholangitis and ulcerative colitis undergoing colectomy. World J Gastrointest Pharmacol Ther 2013; 4: 61–8.
https://doi.org/10.4292/wjgpt.v4.i3.61
32. Gelley F, Zadori G, Gorog D, et al. Recurrence of primary sclerosing cholangitis after liver transplantation – The Hungarian experience. Interv Med Appl Sci 2014; 6: 16–8.
https://doi.org/10.1556/IMAS.6.2014.1.2
33. Gelley F, Miheller P, Peter A, et al. Activity of ulcerative colitis before and after liver transplantation in primary sclerosing cholangitis: the Hungarian experience. Transplant Proc 2012; 44: 2164–5.
https://doi.org/10.1016/j.transproceed.2012.07.098
34. Fevery J, Verslype C, Lai G, et al. Incidence, diagnosis, and therapy of cholangiocarcinoma in patients with primary sclerosing cholangitis. Dig Dis Sci 2007; 52: 3123–35.
https://doi.org/10.1007/s10620-006-9681-4
35. Jasdanwala S, Babyatsky M. Crohn’s disease and acute pancreatitis. A review of literature. JOP 2015; 16: 136–42. DOI: https://doi.org/10.6092/1590-8577/2951
36. Eliadou E, Moleiro J, Ribaldone DG, et al. Interstitial and Granulomatous Lung Disease in Inflammatory Bowel Disease Patients. J Crohns Colitis 2020; 14: 480–489.
https://doi.org/10.1093/ecco-jcc/jjz165
37. Vavricka SR, Brun L, Ballabeni P, et al. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol 2011; 106: 110–9.
https://doi.org/10.1038/ajg.2010.343
38. Antonelli E, Bassotti G, Tramontana M, Hansel K, Stingeni KL, Ardizzone S, et al. Dermatological Manifestations in Inflammatory Bowel Diseases. J Clin Med 2021; 10: 364.
https://doi.org/10.3390/jcm10020364
39. Greuter T, Navarini A, Vavricka SR. Skin Manifestations of Inflammatory Bowel Disease. Clin Rev Allergy Immunol 2017; 53: 413–427.
https://doi.org/10.1007/s12016-017-8617-4
40. States V, O’Brien S, Rai JP, et al. Pyoderma Gangrenosum in Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. Dig Dis Sci 2020; 65: 2675–2685.
https://doi.org/10.1007/s10620-019-05999-4
41. Imhof L, Meier B, Frei P, et al. Severe Sweet’s Syndrome with Elevated Cutaneous Interleukin-1 beta after Azathioprine Exposure: Case Report and Review of the Literature. Dermatology 2015; 230: 293–8.
https://doi.org/10.1159/000371879
42. Ickrath F, Stoevesandt J, Schulmeyer L, Glatzel C, Goebeler M, Kerstan A. Metastatic Crohn’s disease: an underestimated entity. J Dtsch Dermatol Ges. 2021 Jul; 19(7): 973–982.
https://doi.org/10.1111/ddg.14447
43. Amarapurkar DN, Sonavane A, Amarapurkar AD. Metastatic Crohn’s Disease. J Assoc Physicians India 2017; 65: 86–88.
44. Aberumand B, Howard J, Howard J. Metastatic Crohn’s Disease: An Approach to an Uncommon but Important Cutaneous Disorder. Biomed Res Int 2017; 2017: 8192150.
https://doi.org/10.1155/2017/8192150
45. Rani U, Russell A, Tanaka S, et al. Urogenital Manifestations of Metastatic Crohn’s Disease in Children: Case Series and Review of the Literature. Urology 2016; 92: 117–21.
https://doi.org/10.1016/j.urology.2016.02.026 DOI: 10.1016/j.urology.2016.02.026
46. Patel AV, Jones DM, Hill JC, et al. Development of metastatic Crohn’s disease of the skin while on anti-TNF biologics. Inflamm Bowel Dis 2012; 18: 1188–90.
https://doi.org/10.1002/ibd.22904
47. Cury DB, Moss AC, Elias G, et al. Adalimumab for cutaneous metastatic Crohn’s disease. Inflamm Bowel Dis 2010; 16: 723–4.
https://doi.org/10.1002/ibd.21082
48. Ribaldone DG, Brigo S, Mangia M, et al. Oral Manifestations of Inflammatory Bowel Disease and the Role of Non-Invasive Surrogate Markers of Disease Activity. Medicines (Basel) 2020; 7.
https://doi.org/10.3390/medicines7060033
49. Muhvic-Urek M, Tomac-Stojmenovic M, Mijandrusic-Sincic B. Oral pathology in inflammatory bowel disease. World J Gastroenterol 2016; 22: 5655–67.
https://doi.org/10.3748/wjg.v22.i25.5655
50. Lauritano D, Boccalari E, Di Stasio D, et al. Prevalence of Oral Lesions and Correlation with Intestinal Symptoms of Inflammatory Bowel Disease: A Systematic Review. Diagnostics (Basel) 2019; 9.
https://doi.org/10.3390/diagnostics9030077
51. Vavricka SR, Manser CN, Hediger S, et al. Periodontitis and gingivitis in inflammatory bowel disease: a case-control study. Inflamm Bowel Dis 2013; 19: 2768–77.
https://doi.org/10.1097/01.MIB.0000438356.84263.3b
52. Brito F, Zaltman C, Carvalho AT, et al. Subgingival microflora in inflammatory bowel disease patients with untreated periodontitis. Eur J Gastroenterol Hepatol 2013; 25: 239–45.
https://doi.org/10.1097/MEG.0b013e32835a2b70
53. Brito F, de Barros FC, Zaltman C, et al. Prevalence of periodontitis and DMFT index in patients with Crohn’s disease and ulcerative colitis. J Clin Periodontol 2008; 35: 555–60.
https://doi.org/10.1111/j.1600-051X.2008.01231.x
54. Li SJ, Perez-Chada LM, Merola JF. TNF Inhibitor-Induced Psoriasis: Proposed Algorithm for Treatment and Management. J Psoriasis Psoriatic Arthritis. 2019; 4(2): 70–80.
https://doi.org/10.1177/2475530318810851
55. Janse IC, Koldijk MJ, Spekhorst LM, Vila AV, Weersma RK, Dijkstra G, et al. Identification of Clinical and Genetic Parameters Associated with Hidradenitis Suppurativa in Inflammatory Bowel Disease. Inflamm Bowel Dis 2016 Jan; 22(1): 106–13.
https://doi.org/10.1097/MIB.0000000000000579.
56. Zhang M, Chen QD, Xu HX, Xu YM, Chen HJ, Yang BL. Association of hidradenitis suppurativa with Crohn’s disease. World J Clin Cases 2021 May 26; 9(15): 3506–3516.
https://doi.org/10.12998/wjcc.v9.i15.3506.
57. Harbord M, Annese V, Vavricka SR, et al. The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis 2016; 10(3): 239–254.
https://doi.org/10.1093/ecco-jcc/jjv213
