Összefoglaló közlemények / Reviews
The role and importance of percutaneous endoscopic gastrostomy in clinical nutrition in light of several decades practice
Summary
Percutaneous endoscopic gastrostomy (PEG) is a worldwide accepted procedure of artificial enteral nutrition for patients who are unable to eat the required amount in the long run. However due to the fact that it is a safe and easy technique it might lead to use with inappropriate indications and with questionable timing. Due to PEG we know more about artificial enteral nutrition, and our mindset about indications changed as well. This publication gives any overview of the procedure and its clinical usage in light of the three decades of experience that we have.
A perkután endoszkópos gastrostomia (PEG) elterjedt szondatáplálási technika azon betegek számára, akik hosszú távon nem képesek megfelelő mennyiségű táplálékot magukhoz venni. Mivel a PEG biztonságos és egyszerű eljárás, előfordulhat, hogy nem kellő körültekintéssel, és nem a megfelelő időben helyezik be ezeket a tápszondákat. A mesterséges enterális táplálásról a PEG-nek is köszönhetően gyarapodtak a gyakorlati ismereteink, és megváltozott a gondolkozásunk az indikációkról. A közlemény három évtized tapasztalata alapján ad áttekintést az eljárásról és annak mindennapi klinikai alkalmazásáról.
Bevezetés
A perkután endoszkópos gastrostomia (PEG) technikáját Gauderer és munkatársai dolgozták ki és közölték 1980-ban (1). A PEG minimálisan invazív, biztonságos és egyszerű endoszkópos terápia, amely laparotomia nélkül – de a szervezet integritásának megsértésével – teszi lehetővé a tápsipolyképzést. Az eljárás az elmúlt 40 évben világszerte elterjedt, és hazánkban is a napi gyakorlat részévé vált. A PEG használható a gyomor vagy a coecum dekompressziójára, az epe tápcsatornába történő visszavezetésére, gyomorvolvulus korrekciójára és a rossz ízű, per os alkalmazhatatlan gyógyszerek bevitelére is, de a leggyakoribb indikáció változatlanul a gasztroenterális táplálás biztosítása.
A PEG az első olyan operatív endoszkópia, amelyet nem egyetlen endoszkópos orvos végez, hanem – mint a sebészeti műtőkben – több kolléga összehangolt munkáját igényli. Az első endoszkópos terápia, amelynek során „kiléptünk a tápcsatorna lumenéből”. Mindez megváltoztatta az endoszkópos szakemberek gondolkozását, kitágította az operatív endoszkópia lehetőségeit, behozta az endoszkópos laborokba a műtői körülmények közt végzett munka szigorát, és új, komplex lehetőséget jelentett a problémák endoszkópos megoldásában. A szövődmények elkerüléséhez elsősorban az előírások szigorú betartása szükséges, a hosszú távú sikerhez azonban elengedhetetlen a körültekintő betegbeválasztás és a megfelelő tartós gondozás.
A PEG behozta az endoszkópos laborokba a belgyógyászati, holisztikus gondolkozást is. Az elmúlt évek tapasztalata igazolta, hogy a PEG akkor szolgálja a beteg érdekeit, ha a tényeken alapuló orvosláson túl az endoszkópos szakember képessé válik személyre szabott, jól átgondolt, megalapozott, előrelátó és megfelelő felvilágosítás után a beteggel egyetértésben döntéseket hozni. Ha csak azért részesül a beteg PEG-táplálásban, mert az technikailag kivitelezhető, azzal senki sem jár jól. A rövid életkilátás, a sok szervi elégtelenség és a szepszis esetén behelyezett PEG a beteg állapotán ronthat, és a szövődmények esélyét is növeli.
A PEG-táplálásra szorulók jellemzően súlyos betegek, gyakran nehezen prognosztizálható életkilátással, akiknél a metodikához kapcsolódó morbiditás és mortalitás sem elhanyagolható. Az elmúlt évtizedek tapasztalata alapján a PEG-táplálás indikációs köre a kezdetekhez képest jelentősen bővült és finomodott. Az elmúlt negyven évben számos technikai változtatást, speciális helyzetekre alkalmazható megoldást közöltek, de a legelterjedtebb, legbiztonságosabb módszer továbbra is a Keymling szerint módosított fonaláthúzásos, ún. pull-through eljárás (2).
A tápsipolyképzésnek elterjedt, de nem kompetitív, hanem komplementer lehetőségei a radiológiai intervenciós és a laparoszkópos sebészi eljárás. Közel kettőszázezer, a három lehetőség egyikével készült gastrostomia retrospektív vizsgálata alapján az endoszkópos technika esetén a legkevesebb a szövődmény (colonperforáció, infekció, transzfúziót igénylő vérzés), a mortalitás és a kórházi újrafelvétel (3).
A sikeres PEG-tápláláshoz ismerni kell az indikációkat, a kontraindikációkat, fel kell mérni a beteg tápláltsági állapotát, meg kell győződni arról, hogy a beteg és/vagy a környezete alkalmas-e a szondatáplálás gyakorlati kivitelezésére. A társszakmák bevonásával meghozott döntést igényel a PEG, amelyben azonban a technikai kivitelező gasztroenterológusnak kulcsszerepe van.
1. táblázat: A malnutríció és a cachexia szűrésére használt módszerek
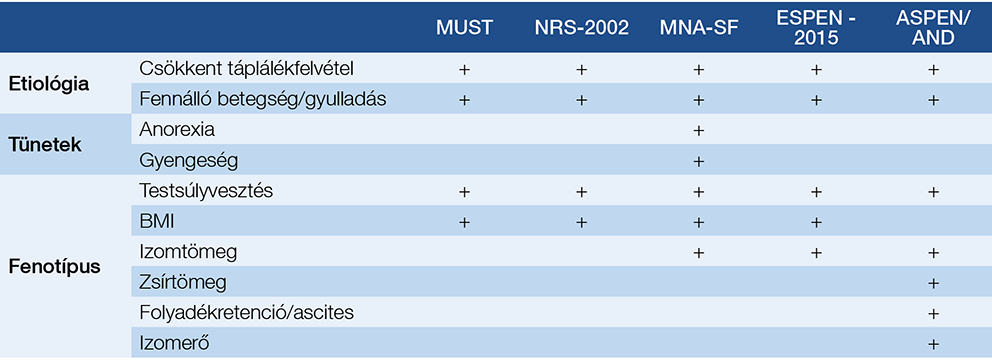
Rövidítések:
ASPEN/AND = American Society of Parenteral and Enteral Nutrition / Academy of Nutrition and Dietetics;
ESPEN = European Society for Clinical Nutrition and Metabolism; MNA-SF = Mini Nutritional Assessment Short Form;
MUST = Malnutrition Universal Screening Tool; NRS-2002 = Nutritional Risk Screening-2002
A tápláltsági állapot felmérése
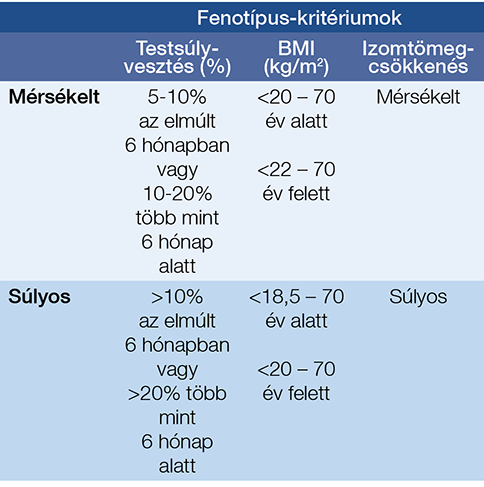
A beteg tápláltsági állapotát minden orvos-beteg találkozás során fel kell mérni. A rizikóállapotok meghatározására több módszer is ismert (1. táblázat). A MUST (Malnutrition Universal Screening Tool) a legáltalánosabban használtak egyike. Új és egyszerű módszer a GLIM- (Global Leadership Initiative on Malnutrition) kritériumok alkalmazása (4). A GLIM három fenotípust (nem akaratlagos testsúlyvesztés, alacsony BMI, csökkent izomtömeg) és két etiológiai kritériumot (csökkent táplálékfelvétel és -hasznosulás, súlyos heveny vagy krónikus betegség) vesz figyelembe. Egy fenotípus és egy etiológiai kritérium szükséges a malnutríció diagnózisához. A fenotípus-kritériumok számokkal kifejezhetők, és ezek alapján kimondható, hogy milyen mértékű (mérsékelt vagy súlyos) malnutrícióról van szó (2. táblázat). Az etiológiai kritériumok a táplálásterápia módjának megválasztásában segítenek. A csökkent táplálékfelvételnek és -hasznosulásnak több oka is lehet, amelyeket szintén figyelembe kell venni a mesterséges táplálás megkezdésekor. Ok lehet a nem megfelelő összetételű táplálkozáson túl a rossz szájhigiénia, az anorexia, a dysphagia, a nyelőcsőszűkület, az emésztőrendszeri betegségek, a malabszorpció, valamint a hányingerrel, hányással, hasmenéssel, szorulással, hasi fádalommal, gastroparesissel járó betegségek, a depresszió, de akár gyógyszermellékhatás is.
2. táblázat: A malnutríció súlyosságának csoportosítása a GLIM-kritériumok
Az egyén alkalmasságának felmérése
A hozzátartozók, de gyakorta a beteg és az orvos is túlbecsüli a PEG-táplálás várható előnyeit, aztán látva a kedvezőtlen kimenetelt, elégedetlenné és az eljárással szemben általánosságban elutasítóvá válhatnak. A malnutríció tényének megállapítása után számos kérdést kell feltenni és megválaszolni: akarja-e a beteg a PEG-táplálást, milyen a konkrét beteg prognózisa; milyen hatással lesz a betegség a tápláltsági állapotra; milyen hatása lesz a PEG-táplálásnak a betegség lefolyására és az életminőségre; a tápszonda-behelyezéssel járó rizikó lényegesen kisebb-e, mint a táplálás várható haszna, előnye; milyen hatásuk lesz a társbetegségeknek a szövődményekre.
A PEG-táplálás korlátozza a mindennapi tevékenységet, és ezt a betegek ötöde negatívan éli meg. Nők, idősek és magasan iskolázottak viselik nehezebben ezeket a korlátokat, de befolyással van az alapbetegség és a táplálási forma is (5). Az életminőséget nem befolyásoló, azt javító és rontó hatásról szóló közlemények egyaránt vannak (6). Ezért is fontos, hogy a betegek és a táplálásban segédkezők megfelelő tájékoztatást kapjanak a várható előnyökről, a kockázatokról, a korlátokról és a lehetséges szövődményekről, mielőtt írásos beleegyezésüket adják.
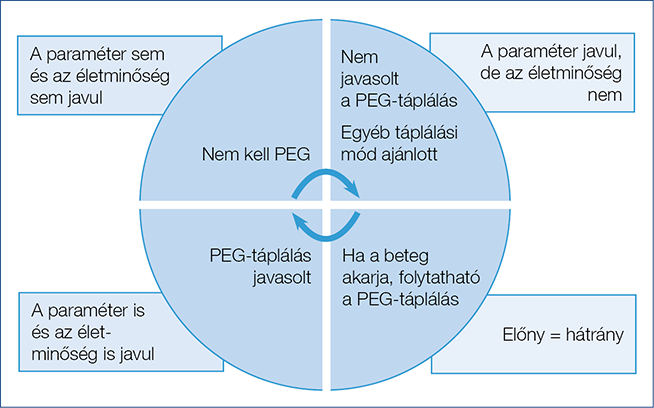
A PEG-táplálás alkalmas az élet meghosszabbítására, de nem minden esetben jár az életminőség javulásával (7). A beteg az életszemlélete szerint kívánhat mennyiségi, azaz egyszerűen években kifejezhető, vagy minőségi életet, amit az orvosnak tiszteletben kell tartania. A hozzátartozók a kritikus és nehezen prognosztizálható esetekben jellemzően mennyiségi életet szeretnének; de a döntés nem az övék. A PEG indikációjának etikailag is megalapozott algoritmusát, beépítve abba a beteg döntéshozatalának elfogadását is, az 1. ábra szemlélteti.
1. ábra: A PEG-javallat etikai szempontok figyelembevételével felállítható algoritmusa
A PEG időzítése
A PEG-táplálás nem az infaust esetek terminális időszakában alkalmazandó (7). A malnutríció megfelelő táplálással és oki kezeléssel visszafordítható, a cachexia érdemben már nem befolyásolható. Ha a beteg a testsúlyának 15-20%-át már elveszítette, vagy ha három hónap alatt több mint 12 kg-ot fogyott, akkor a tápláltsági állapotot csak stabilizálni lehet, javítani nem (8).
Ma a mesterséges táplálásra már nem mint az ápolás szükséges velejárójára tekintünk, hanem a terápia szerves részének tartjuk. Bizonytalanság esetén 1-2 hetes átmeneti nasogastricus (NG) szondatáplálás mellett javasolt az általános állapot alakulásának megfigyelése. Pozitív irányú változás esetén ajánlott a PEG. Felnőtt betegek esetén a kizárólagos PEG-táplálás létjogosultsága – ritka kivételektől eltekintve – megkérdőjelezhető. A PEG-re inkább mint a kiegészítő táplálék- és folyadékbevitel lehetőségére kell tekinteni. A szondatáplálás megkezdése indokolt szuboptimális tápláltsági állapotban és optimális tápláltsági állapot esetén is, ha a betegség kezelése közben hypoalimentatio léphet fel.
Vannak állapotok, betegségek, amikor csak átmeneti, de négy hetet meghaladó PEG-táplálásra van szükség. Ilyenkor sor kerülhet preventív PEG-re, vagy dönthetünk reaktív PEG-ről, azaz csak akkor helyezzük be a tápszondát, ha az kikerülhetetlenül szükségessé vált. A beteg terhei csökkennek, ha az endoszkópos intervenció műtéttel egyidejűleg, intraoperatíve történik.
Indikációk és kontraindikációk
A nem kielégítő táplálékfelvételnek számos és sokszor komplex oka lehet. Az okok alapján az indikációk három csoportba oszthatók: neurológiai okok, stenosissal, illetve hiperkatabolikus állapottal járó heveny vagy krónikus betegségek (3. táblázat). Mivel minden egyes esetnek a betegség stádiumától, a társuló betegségektől, a szociális, a mentális és a gazdasági helyzettől függően eltérő prognózisa van, egyénre szabott döntést kell hozni. PEG-táplálást ma – szemben a korábban javasolt 2-3 héttel – 4 hetet meghaladó szondatáplálási igény esetén tartunk indokoltnak. A 4 hét nem merev javaslat, inkább az elhamarkodott alkalmazástól véd.
3. táblázat: A PEG-táplálás indikációi

A gyomorba történő táplálás élettani, a vékonybéltáplálás kevésbé az, de indokolt, ha a gyomorürülés akadályozott, ha korábbi műtétek miatt a gyomorba nem lehet a tápszondát behelyezni, ha befolyásolhatatlan a gastrooesophagealis reflux, vagy ha aspirációs pneumónia veszélye áll fenn. A táplálás módjának megválasztásakor arról sem szabad megfeledkezni, hogy a jejunalis táplálás szövődményei meghaladják a gyomorba történő táplálásét.
4. táblázat: A PEG ellenjavallatai
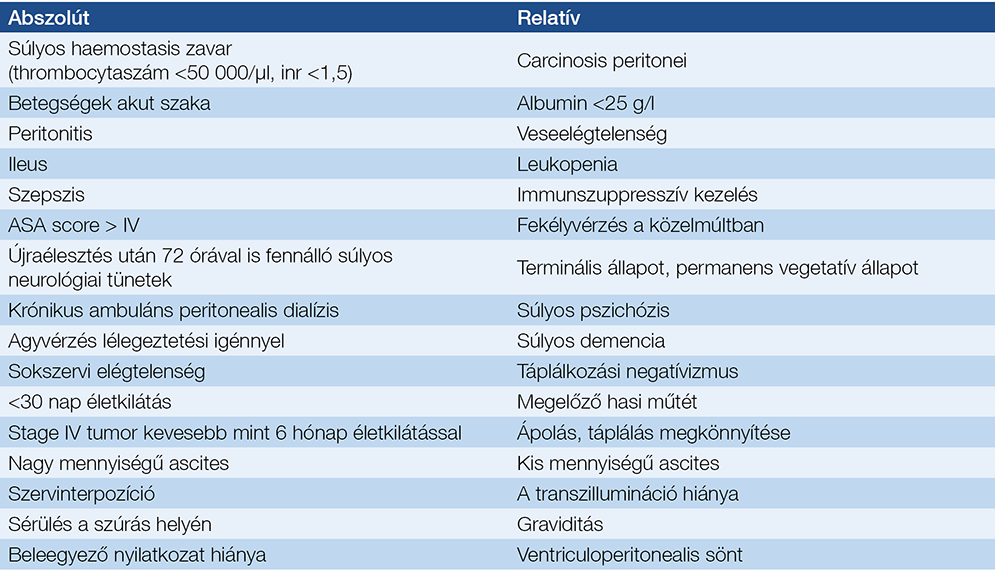
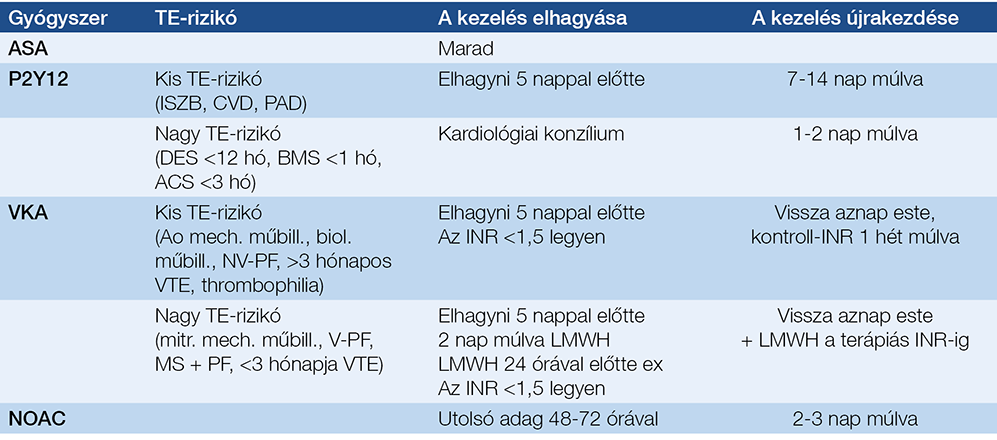
A legfontosabb ellenjavallatok a 4. táblázatban láthatók. Relatív ellenjavallat az ascites. Ha nem nagy mennyiségű, és paracentesis után egy hét alatt nem telődik vissza, a PEG behelyezhető, de csak gastropexiával kiegészítve. Relatív ellenjavallat a ventriculoperitonealis sönt (VPS) is. A javasolt sorrend a VPS-t követő PEG. Ha előbb helyezik be a PEG-et, nagyobb az esélye VPS-fertőzésnek. A PEG előtt röntgenátvilágítással meg kell győződni a VPS pozíciójáról, hogy az esetleges söntsérülést a hasfal átszúrása közben elkerüljük. Ennek az esélye nagyobb, ha a sönt a mellkas bal oldalán fut le. Megelőző hasi műtétek esetén javasolt a szúrás helyét a műtéti hegtől legalább 2 cm-rel távolabbra helyezni és „safe-tract technikával” (fiziológiás sóoldattal félig töltött fecskendővel folyamatos szívás mellett) szúrni. (A PEG behelyezésétől el kell tekinteni, ha a fecskendőben előbb jelenne meg levegőbuborék, minthogy a tű a gyomor űrterébe érne.) Fokozott a vérzésveszély az antitrombotikus kezelésen lévőknél. A tromboembólia kockázatától függően eltérő stratégiára van szükség. A javasolt stratégiát az 5. táblázat foglalja össze.
5. táblázat: PEG az antitrombotikus kezelésen lévőknél
Neurológiai indikációk
A PEG-et igénylő neurológiai okok lehetnek potenciálisan reverzibilis (stroke, tumor, trauma) és irreverzibilis (amyotrophiás lateralsclerosis [ALS], sclerosis multiplex, Huntington-chorea) oropharyngealis dysphagiával járók. Előbbi esetben – a bizonytalan prognózis és a gyakori tápcsatornamotilitás-zavar miatt PEG (vagy PEJ) 10-14 napos nasogastricus szondatáplálás után javasolt, akkor, ha a szondatáplálásnak kimutatható a pozitív hatása. Az irreverzibilis dysphagiával járó állapotokban csak protektív, preventív és palliatív szerepe van a PEG-táplálásnak. A gyakori gasztrointesztinális motilitászavar miatt javasolt a PEG előtt NG-szonda használata. Ha a nyelési képesség 2 héten belül nem áll helyre, és a beteg általános állapota kielégítő, továbbá várhatóan több mint 4 hetes szondatáplálásra lesz szükség, akkor indokolt a PEG. A fiatal, koponyatrauma miatt szondatáplálásra szorulók kivételt jelentenek: számukra ajánlatos a PEG-szonda mielőbbi behelyezése.
A felnőttkori neurológiai kórképek közül a cerebrovaszkuláris lézió, a koponyatrauma, illetve az ALS és a Parkinson-kór a leggyakoribb PEG-indikációk (9). Az első két kórkép esetén a nyelési zavar áthidalása, ALS-ben pedig a tápláltsági állapot javítása, az aspiráció kivédése és az ápolás megkönnyítése céljából alkalmazzuk.
Post-stroke dysphagia
Az agyi vaszkuláris léziók gyakorta vezetnek a megváltozó mozgás- és beszédkészségen, illetve depresszión túl dysphagiához is. A dysphagia következménye a malnutríció és az életminőség további csökkenése. Ha a tápláltsági állapot stroke után gyorsan romlik, annak rövid távon is negatív hatása lesz az életkilátásra. A betegek zöménél a dysphagia négy hét alatt megszűnik, de kb. 15%-uknál tartósan megmarad (10, 11). A korai szondatáplálás javítja az életkilátásokat, csökkenti a halálozást, de a PEG-táplálás megkezdése legkorábban két hét elteltével jöhet szóba, addig a nasogastricus szonda használata javasolt. A PEG segíti a rehabilitációt, lehetővé teszi a nyelési gyakorlatok korai megkezdését, kivédheti az aspirációt és a dekubitálódást. Aspirációs pneumónia, gyakori regurgitáció, hányás és egyéb motilitászavar esetén jejunalis táplálás javasolt. Idős, vaszkuláris lézió miatt nyelésképtelenek esetén elfogadható, ha PEG-táplálásban csak a rehabilitálhatók részesülnek.
ALS
Az ALS a leggyakoribb motoneuron- (mozgatóneuron-) betegség, amellyel PEG vonatkozásában a gasztroenterológust megkeresik. Orális kiegészítő táplálás ellenére bekövetkező fogyás, változatlan testsúly, de 20 kg/m2 alatti BMI vagy a nyelés nehezítettsége esetén PEG javasolt (12). A szonda behelyezése addig történjen meg, amíg az erőltetett kilégzési vitálkapacitás (FVC) 50% feletti, és a pCO2 45 Hgmm feletti. Optimális, ha a PEG-et változatlan per os táplálkozás mellett kiegészítő kalóriabevitel céljából használják, de akár csak a folyadékigény vagy a gyógyszerbevitel biztosítása is történhet azon keresztül. Harminc százalék alatti FVC ellenjavallata a PEG-nek, ebben a stádiumban intravénás rehidráció és nasogastricus szondán át folytatott táplálás javasolt. Különös körültekintést igényel a premedikáció, és fontos, hogy a beavatkozás után megtörténjen a gyomor desufflatiója is.
Parkinson-kór
Parkinson-kórban a dyskinesis progressziója a mindennapi tevékenységet korlátozva, az életminőséget rontva rokkantsághoz vezethet. Levodopa-carbidopa intesztinális gél portábilis pumpán át a duodenumba történő folyamatos infúziójával a mozgászavarok jól kezelhetők. A gyógyszerbevitel PEG-DET-tel (duodenal extension tube) oldható meg (13, 14). A Parkinson-kórban gyakori dysphagia és fogyás is lehet PEG-indikáció.
Arckoponya-trauma
Koponyasérülteken a perorális gasztroszkópiával szemben előnyösebb lehet a transznazális endoszkópia.
Demencia
Előrehaladott demencia idején a táplálékfelvétel csökken, megkezdődik a testsúlyvesztés, és növekszik a mortalitás. A táplálkozási negativizmus miatt – a tápláltsági állapot és az életminőség javításának a reményében, illetve az ápolás megkönnyítése céljából – szokták a PEG-et kérni.
A kérés ilyenkor sosem a betegtől, hanem a hozzátartozók és kollégák felől érkezik. Az fogalmazódik meg, hogy az megengedhetetlen, hogy valaki éhen vagy szomjan haljon. Azt kevesen fogadják el, pedig vizsgálatok igazolják, hogy ezekben az állapotokban már nincs éhségérzet, és a szomjúságérzet is csökkent (15). Számos irodalmi adat és ajánlás szól amellett, hogy előrehaladott demencia esetén PEG-táplálás nem javasolt, mert nem javul sem a tápláltsági állapot, sem a komfortérzet, sem az élettartam, sem az életminőség, nincs javulás a mérhető laborparaméterekben, viszont a szövődmények esélye e betegeket fokozottan veszélyezteti (16). A demencia korai fázisában, amikor a beteg még felfogja, hogy miért helyezik be a tápszondát, és együtt is működik, javasolt a PEG.
Gyermekgyógyászati indikációk
Kiegészítő vagy kizárólagos szondatáplálást igénylő krónikus betegségben szenvedő gyermekeknek a PEG-táplálás megoldást jelent. A PEG-szonda behelyezésével kapcsolatban alsó súlyhatár nem ismert. A gyermekgyógyászati indikációk némileg eltérnek a felnőttkoriaktól, de mindenképpen más megközelítést igényelnek (17). A tápláltsági állapot, a folyadékháztartás és a növekedés, fejlődés biztosítása mellett a megfelelő gyógyszerbevitel szükségessége is képezheti az indikáció alapját. Elsősorban neuromuscularis, fejlődésneurológiai, progresszív metabolikus, illetve anyagcsere-betegségek állnak a szondatáplálást indokoló nyelési zavarok hátterében, de PEG válhat szükségessé onkológiai kezelés miatt, illetve malnutrícióhoz vezető krónikus betegségek (szívbetegség, vesebetegség, mucoviscidosis, rövidbél-szindróma, Crohn-betegség, HIV) miatt is. A neurológiai kórképek járhatnak olyan deformitással (pl. súlyos kyphoscoliosis), amelyek, ha lehetetlenné nem is teszik a PEG-et, de precíz fizikális vizsgálatot, majd a PEG behelyezése során fokozott figyelmet igényelnek. Biztosan több mint 3 hónapon át szükséges szondatáplálás esetén javasolt a PEG; addig NG-szonda használata ajánlott. Kivételt csak a jól ismert prognózisú betegségek jelentenek. Amíg pl. mucoviscidosisban egybehangzóan előnyökről számolnak be, addig más kórképekben (neuromuscularis, örökletes anyagcsere-betegségek stb.) vitatható az optimális tápláltsági állapot elérése, fenntartása. A PEG gyermekgyógyászati alkalmazása nemegyszer a geriátriában felvetődő problémákhoz hasonló etikai dilemmákat okoz.
Stenosissal járó kórképek
Fej-nyak-régió tumorai
A tumoros betegek jellemzően alultápláltak. A táplálásterápia a komplex daganatterápia sikerességének elengedhetetlen része. PEG javasolt radiokemoterápia, dysphagia, nem kielégítő tápanyagfelvétel és fogyás esetén. A tápszonda behelyezhető a daganatterápia megkezdése előtt (profilaktikus PEG), a kezelés során (reaktív PEG), a műtét közben (intraoperatív PEG), és alkalmazható az irreszekábilis, inkurábilis tumoros folyamatok esetén a táplálás és a folyadékszükséglet biztosítása céljából. Az irradiáció és a kemoterápia mellékhatásai (mucositis, rágási és nyelési nehézségek stb.) és/vagy a reszekciót követő defektusok a tápláltsági állapotot tovább rontják, ezért javasolt már normális tápláltsági állapotban is a preventív PEG-táplálás. Ennek köszönhetően a betegek jobban tolerálják az onkoradiológiai kezelést, javul az életminőségük, megáll a testsúlycsökkenésük, és ritkábban jelennek meg mellékhatások, kevesebbszer igényelnek kórházi felvételt (18–20). Rizikócsoportba tartoznak az idősek, a jelentős testsúlycsökkenést elszenvedők, a hypopharyngealis tumorosok és azok, akik nagy dózisú besugárzásra szorulnak. PEG-táplálásra lehet szükség a perioperatív időszakban is. A műtéttel egy időben végzett PEG csökkenti a beteg megterhelését és a peristomalis infekció kockázatát is. Az endoszkópia és a szonda behelyezése elvégezhető a tumorreszekció előtt, vagy akár az után, a nyitott garaton át. Az irreszekábilis tumor endoszkóppal át nem járható stenosist vagy trismust okozva lehetetlenné teheti a gasztroszkóp levezetését. Megoldást a garat Kleinsasser-féle laringoszkóppal való feltárása, illetve a transznazális endoszkópia jelenthet, vagy levezethető az endoszkóp pharyngo-cutan fisztulán keresztül is (21, 22).
Nyelőcsődaganat
Azok a reszekábilis nyelőcsődaganatos betegek, akiknél jelentős malnutríció áll fenn, vagy akiknél a neoadjuváns kezelés során nagy valószínűséggel romlik a tápláltsági állapot, profitálhatnak a preoperatív PEG-táplálásból. Ez a megoldás a műtét kimenetelére sincs negatív hatással (23).
Oesophagotrachealis fisztula
Oesophagotrachealis fisztula esetén – elsősorban akkor, ha az benignus folyamat vagy sérülés következményeként jött létre – javasolt a PEG-táplálás megkezdése, mielőtt még malnutríció alakulna ki (24).
Hiperkatabolizmussal járó állapotok
Az olyan, hiperkatabolizmussal járó állapotok, mint a súlyos égési sérülés, a politrauma, a prolongált kóma, a critical illness, a krónikus tüdő- és szívbetegség, onkológiai kórképek, mucoviscidosis, AIDS, Crohn-betegség, rövidbél-szindróma, pszichiátriai betegségek szintén szükségessé tehetik a PEG-táplálást. Mucoviscidosisban előnyös az éjszakai, folyamatos táplálás. A súlyos állapotú betegeknél a fokozott katabolizmus, a csökkent étvágy, trauma vagy fennálló gyulladásos folyamat miatt malnutríció gyakran alakul ki. Az intenzív osztályokon kezelt ilyen betegnél a tápszondán át nem mindig lehet a szükséges kalóriabevitelt biztosítani, ezért ők kiegészítő parenterális táplálásra is szorulhatnak (25).
A biztonságos technika
A PEG feltétele az üres gyomor. A beavatkozás hatórás koplalás után végezhető el. A dermatitis kockázata jelentősen csökkenthető profilaktikus béta-laktám antibiotikum adásával és a steril, aszeptikus körülmények között végzett eljárással (26). A külső rögzítőt a bőrtől 5 mm-re felhelyezve nemcsak a dermatitis és a mucosa decubitus, hanem a csorgás is megelőzhető.
A szedáció kardiovaszkuláris kockázattal (hemodinamikai instabilitás, ritmuszavar) és aspiráció veszélyével jár (27, 28). Utóbbi fokozott a hanyatt fekvő helyzet miatt, de negatív hatása lehet az időskornak, a neurológiai eltéréseknek, a szedáció formájának és az alkalmazott szedatívum dózisának is. Ez a kockázat a körültekintő betegbeválasztással kiküszöbölhető. Az azonnali technikai szövődmények (vérzés, interpositum szerv [bél, máj, lép] sérülése, peritonitis) a szedáció okozta mellékhatásoknál is ritkábbak, a 0,1%-ot sem érik el (28). Az intraluminális és a hasfali vérzés azonnal észlelhető és kezelhető. A hasi erek sérüléséből származó intraabdominalis vérzés csak a beavatkozást követő órákban válhat nyilvánvalóvá, ezért szükséges legalább néhány órán át a vitális paraméterek monitorozása. A gyomor és a hasfal közti szervinterpozíció és a következményes sérülés esélye minimalizálható, ha annyi levegővel lesz a gyomor felfújva, hogy a gyomorfal hozzáfeküdjön a hasfalhoz. Ekkor lesz jól látható a transzillumináció és ugyanezen a ponton a gyomor felől az ujjbenyomat. A szervsérülés elkerülését tovább segíti a safe tract technikával történő szúrás. Pneumoperitoneum az esetek több mint felében kialakul, de klinikai jelentősége csak elvétve van, jellemzően spontán rendeződik (29).
Az egy héten belül jelentkező mellékhatás gyakoribb tumoros betegség, és a korai, de egy héten túli pedig 70 év feletti életkor és cukorbetegség esetén. A PEG technika mortalitása nulla. Az irodalomban korai (30 napon belüli) és egy éven belüli mortalitást szoktak feltüntetni. A mortalitási adatok – bár az évek során csökkenő tendenciát mutatnak – nagyon eltérőek. A mortalitást az alapbetegség, a társbetegségek, de leginkább a (körültekintő) betegbeválasztás határozza meg. Az egy hónapon belüli mortalitás gyakoribb, ha a thrombocytaszám százezer alatti, ha alacsony a szérumalbumin, a BMI, ha magas a kreatininszint és a CRP (30).
A szondatáplálás és gondozás
Akár 3-4 órával a szondabehelyezés után megkezdhető a táplálás (31). Adható rögtön tápszer is, de célszerűbb első alkalommal vizet adni. Az adott beteg kalóriaszükségletét gyári szondatápszerek adagjának, a cseppszámnak, illetve a volumennek a fokozatos emelésével néhány nap alatt kell elérni. A tápszer adható fecskendővel bolusban, vagy folyamatosan (80-120 ml/óra 12-18 órán át) gravitációs szerelékkel, illetve pumpával. A bolustáplálás nem lehet gyorsabb, mint amennyi idő alatt az adott volument a beteg kanalazva elfogyasztaná. Tápszeradás előtt és az után a szondát 30-50 ml vízzel át kell mosni.
Tíz nap múlva a szondát – a buried bumper szindróma kivédése végett – néhány naponta mozgatni kell; 5 cm-t betolni, majd visszahúzni, és újra lazán, akár 1 cm mozgásteret hagyva rögzíteni (31). Ekkortól megengedett (vízhatlan kötés mellett) a zuhanyzás és a fürdés is (32). A szonda élettartama elsősorban a használat minőségétől függ. A megfelelő stomagondozás, a higiénés rendszabályok és a tápszeradagolási javaslatok betartásával a szondák akár éveken át funkcionálnak. A belülről ballonnal rögzülő szondákat 3-6 havonta cserélni kell, de a merev gallérral rögzülők rutinszerű cserét nem igényelnek. Gasztrotubust megfelelően kooperáló beteg kaphat. Button-PEG helyezhető be aktív mindennapokat élő, jól reszocializálódottak esetében. Dezorientált és nem kielégítően együttműködő beteg azonban PEG-csere esetén kapjon ismét merev gallérral rögzülő szondát.
Ha a tápszondára nincs már szükség, és azt a beteg több mint 10 napja nem használja, eltávolítható. De nem távolítható el a behelyezést követő négy héten belül. Az eltávolítás akkor történhet meg, ha a tápsipoly kialakult. Az általános állapottól függően a maturálódás akár négy hétnél tovább is eltarthat. Az eltávolítás egyszerű és elterjedt módja a „cut and push” eljárás; amikor a szondát a hasfal bőrénél átvágjuk, és a szondavéget a gyomorba betolva a perisztaltikára bízzuk ennek az idegen testnek a kiürítését (33). Megelőző hasi műtét, intraabdominalis adhéziók és ileus kockázatával járó egyéb állapotok esetén endoszkópos eltávolítás javasolt.
A megkezdett PEG-táplálás megszüntetése még több etikai, erkölcsi, jogi aspektussal bír, mint amilyenekkel a kritikus esetek indikációjának felállításakor szembesülünk. A PEG-táplálás megszüntethető, ha az életkilátás csak napokban mérhető, ha a performance-státusz hanyatlik, ha uralhatatlan a fájdalom, ha csillapíthatatlan a hányás és a dyspnoe, ha delírium alakul ki, ha a táplálás ellenére progrediál az alapbetegség, vagy ha ez a beteg kívánsága (34).
https://doi.org/10.1016/s0022-3468(80)80296-x.
2. Keymling M. First results with percutaneous endoscopic gastrostomy. Adv Exp Med Biol 1987; 209: 227–229.
https://doi.org/10.1007/978-1-4684-5302-7_34.
3. Kohli DR, Kennedy KF, Desai M, et al. Safety of endoscopic gastrostomy tube placement compared with radiologic or surgical gastrostomy: nationwide inpatient assessment. Gastrointest Endosc 2021; 93: 1077–1085.
https://doi.org/10.1016/j.gie.2020.09.012.
4. Cederholm T, Jensen GL, Correia MITD, et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin Nutr 2019; 38: 1–9.
https://doi.org/10.1016/j.clnu.2018.08.002.
5. Martin L, Blomberg J, Lagergren P. Patients’ perspectives of living with a percutaneous endoscopic gastrostomy (PEG). BMC Gastroenterol 2012; 12: 126.
https://doi.org/10.1186/1471-230X-12-126.
6. Ojo O, Keaveney E, Wang XH, et al. The Effect of Enteral Tube Feeding on Patients’ Health-Related Quality of Life: A Systematic Review. Nutrients 2019; 11: 1046.
https://doi.org/10.3390/nu11051046.
7. Rabeneck L, McCullough LB, Wray NP. Ethically justified, clinically comprehensive guidelines for percutaneous endoscopic gastrostomy tube placement. Lancet 1997; 349: 496–498.
https://doi.org/10.1016/S0140-6736(96)07369-2.
8. Löser C, Wolters S, Fölsch UR. Enteral long-term nutrition via percutaneous endoscopic gastrostomy (PEG) in 210 patients: a four-year prospective study. Dig Dis Sci 1998; 43: 2549–2557.
https://doi.org/10.1023/a:1026615106348.
9. Burgos R, Bretón I, Cereda E, et al. ESPEN guideline clinical nutrition in neurology. Clin Nutr 2018; 37: 354–396.
https://doi.org/10.1016/j.clnu.2017.09.003.
10. Ojo J, Brooke J. The use of enteral nutrition in the management of stroke. Nutrients 2016; 8: 827.
https://doi.org/10.3390/nu8120827
A további irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.hu weboldalon.
11. Gong L, Wang Y, Shi J. Enteral nutrition management in stroke patients: a narrative review Ann Palliat Med 2021; 10: 11191–11202.
https://doi.org/10.21037/apm-21-2922.
12. Greenwood DI. Nutrition management of amyotrophic lateral sclerosis. Nutr Clin Pract 2013; 28: 392–399.
https://doi.org/10.1177/0884533613476554.
13. Virhammar J, Nyholm D. Levodopa-carbidopa enteral suspension in advanced Parkinson’s disease: clinical evidence and experience. Ther Adv Neurol Disord 2017; 10: 171–187.
https://doi.org/10.1177/1756285616681280.
14. Gheorghe C, Dumitru E, Ciocîrlan M, et al. Percutaneous Endoscopic Gastrostomy with Jejunal Extension Tube for the Delivery of Levodopa Carbidopa Intestinal Gel: Clinical Practice Guidelines of the Romanian Society of Digestive Endoscopy. J Gastrointestin Liver Dis 2019; 28: 349–354.
https://doi.org/10.15403/jgld-404.
15. van Bruchem-Visser RL, Mattace-Raso FUS, de Beaufort ID, Kuipers JE. Percutaneous endoscopic gastrostomy in older patients with and without dementia: Survival and ethical considerations. J Gastroenterol Hepatol 2019; 34: 736–741.
https://doi.org/10.1111/jgh.14573.
16. Lee YF, Hsu TW, Liang CS, et al. The Efficacy and Safety of Tube Feeding in Advanced Dementia Patients: A Systemic Review and Meta-Analysis Study. J Am Med Dir Assoc 2021; 22: 357–363.
https://doi.org/10.1016/j.jamda.2020.06.035.
17. El-Matary W. Percutaneous endoscopic gastrostomy in children. Can J Gastroenterol 2008; 22: 993–998.
https://doi.org/10.1155/2008/583470.
18. McClelland S, Andrews JZ, Chaudhry H, et al. Prophylactic versus reactive gastrostomy tube placement in advanced head and neck cancer treated with definitive chemoradiotherapy: A systematic review. Oral Oncol 2018; 87: 77–81.
https://doi.org/10.1016/j.oraloncology.2018.10.028.
19. Dechaphunkul T, Ngamphaiboon N, Danchaivijitr P, et al. Benefits of prophylactic percutaneous gastrostomy in patients with nasopharyngeal cancer receiving concurrent chemoradiotherapy: A multicenter analysis. Am J Otolaryngol 2021; 43: 103356.
https://doi.org/10.1016/j.amjoto.2021.103356.
20. Willemsen ACH, Kok A, van Kuijk SMJ, et al. Prediction model for tube feeding dependency during chemoradiotherapy for at least four weeks in head and neck cancer patients: A tool for prophylactic gastrostomy decision making Clin Nutr 2020; 39: 2600–2608.
https://doi.org/10.1016/j.clnu.2019.11.033.
21. Taller A, Horvath E, Ilias L, et al. Technical modifications for improving the success rate of PEG tube placement in patients with head and neck cancer. Gastrointest Endosc 2001; 54: 633–636.
https://doi.org/10.1067/mge.2001.119221.
22. Lujber L, Fábián G, Pytel J. Inserting a percutaneous endoscopic gastrostomy tube via a cervical fistula formed after major surgery on a patient with a head and neck tumor. Surg Laparosc Endosc Percutan Tech 2001; 11: 327–329.
https://doi.org/10.1097/00129689-200110000-00008.
23. Fang HC, Farah MH, Shiue SJ, et al. Percutaneous endoscopic gastrostomy prior to esophagectomy for esophageal cancer – a systematic review and meta-analysis. Expert Rev Gastroenterol Hepatol 2022; 16: 155–162.
https://doi.org/10.1080/17474124.2022.2027754.
24. Santos CA, Pereira M, Martins VS, et al. Traqueoesophageal fistula patients fed through percutaneous endoscopic gastrostomy/gastrojejunostomy: nutritional status and clinical outcome. Nutr Hosp 2015; 32: 691–695.
https://doi.org/10.3305/nh.2015.32.2.9078.
25. Wei M, Ho E, Hegde P. An overview of percutaneous endoscopic gastrostomy tube placement in the intensive care unit. J Thorac Dis 2021; 13: 5277–5296.
https://doi.org/10.21037/jtd-19-3728.
26. Lipp A, Lusardi G. Systemic antimicrobial prophylaxis for percutaneous endoscopic gastrostomy. Cochrane Database Syst Rev 2013; 2013: CD005571.
https://doi.org/10.1002/14651858.CD005571.pub3.
27. Delgado AAA, Moura DTH, Ribeiro IB, et al. Propofol vs traditional sedatives for sedation in endoscopy: A systematic review and meta-analysis. World J Gastrointest Endosc 2019; 11: 573–588.
https://doi.org/10.4253/wjge.v11.i12.573.
28. Singh A, Gelrud A. Adverse events associated with percutaneous enteral access. Gastrointest Endosc Clin N Am 2015; 25: 71–82.
https://doi.org/10.1016/j.giec.2014.09.003.
29. Brotherton T, Chhaparia A, Presti M, et al. Symptomatic Pneumoperitoneum After Gastrostomy Tube Placement Managed by Pneumocentesis. ACG Case Rep J 2021; 8: e00700.
https://doi.org/10.14309/crj.0000000000000700.
30. Pih GY, Na HK, Ahn JY, et al. Risk factors for complications and mortality of percutaneous endoscopic gastrostomy insertion. BMC Gastroenterol 2018; 18: 101.
https://doi.org/10.1186/s12876-018-0825-8.
31. Roveron G, Antonini M, Barbierato M, et al. Clinical Practice Guidelines for the Nursing Management of Percutaneous Endoscopic Gastrostomy and Jejunostomy (PEG/PEJ) in Adult Patients: An Executive Summary. J Wound Ostomy Continence Nurs 2018; 45: 326–334.
https://doi.org/10.1097/WON.0000000000000442.
32. Bischoff SC, Austin P, Boeykens K, et al. ESPEN practical guideline: Home enteral nutrition. Clin Nutr 2022; 41: 468–488.
https://doi.org/10.1016/j.clnu.2021.10.018.
33. Kejariwal D, Bromley D, Miao Y. The “cut and push” method of percutaneous endoscopic gastrostomy tube removal in adult patients: the Ipswich experience. Nutr Clin Pract 2009; 24: 281–283.
https://doi.org/10.1177/0884533608323420.
34. Druml C, Ballmer PE, Druml W, et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clin Nutr 2016; 35: 545–556.
https://doi.org/10.1016/j.clnu.2016.02.006.
