Összefoglaló közlemények / Reviews
Evaluation of inflammatory markers in acute pancreatitis
Summary
Acute pancreatitis begins as a sterile inflammation, which can become superinfected if necrosis develops in the pancreas. It affects a small part (5%) of patients with acute pancreatitis, but it is severe and has high a mortality rate. This probably explains why most doctors start antibiotic treatment even without proof of infection, that does not improve the outcome of pancreatitis, and unnecessary antibiotic treatment has many negative effects. The decision is usually based on high inflammatory parameters (C-reactive protein, white blood cell count) and the occurrence of fever, even though any of these can be caused by sterile inflammation of the pancreas. Before starting antibiotics, it is necessary to clarify the localization of the infection and, if possible, to perform a culture. Pancreatic necrosis superinfection develops mainly from the second week, at which time the patient usually has multi-organ failure. As a first step, it is necessary to prove the fact of pancreatic necrosis with imaging techniques. Determination of the procalcitonin level helps in the decision. In case of proven or probable superinfection, a broad-spectrum antibiotic that penetrates the necrotic tissue should be chosen.
Az akut pancreatitis a szerv steril gyulladásával kezdődik, amely, ha a szervben necrosis alakul ki, felülfertőződhet. Ez a betegek kis hányadát (5%-át) érinti, azonban súlyos betegséget jelent, és magas halálozással jár. Valószínűleg ezzel magyarázható, hogy az orvosok nagy része az infekció bizonyítása nélkül is antibiotikumkezelést indít, amely a pancreatitis kimenetelét nem javítja, ugyanakkor a felesleges antibiotikumkezelésnek számos negatív hatása van. A döntést általában a magas gyulladásos paraméterekre (C-reaktív protein, fehérvérsejtszám) és a láz jelentkezésére alapozzák, pedig ezek bármelyikét okozhatja a hasnyálmirigy steril gyulladása is. Az antibiotikum indítása előtt tisztázni kell az infekció lokalizációját, lehetőleg tenyésztést kell kérni. A pancreasnekrózis elfertőződése elsősorban a második héttől kezdve merül fel, ilyenkor a betegnek általában sokszervi elégtelensége is van. Első lépésként bizonyítani szükséges a hasnyálmirigy-necrosis tényét képalkotóval. A döntésben segít a prokalcitoninszint meghatározása. Bizonyított vagy valószínű felülfertőződés esetén széles spektrumú, a nekrotikus szövetbe penetráló antibiotikumot kell választani.
Az akut pancreatitis és a gyulladás
Az akut pancreatitis (AP) a hasnyálmirigy önemésztődéssel járó gyulladása, amelyet a leggyakrabban (75-85%-ban) epeúti kő vagy alkoholfogyasztás provokál (1). A betegség spektruma az enyhe, minimális panaszt okozó tünetektől a súlyos, sokszervi elégtelenséggel járó formákig terjed. Szerencsére a betegek kb. 80%-ában enyhe formában zajlik a betegség (2), azonban a nekrózissal, szisztémás immunválasszal (SIRS) járó állapotok halálozása magas. Különösen magas a halálozás, ha az elhalt hasnyálmirigyszövet bakteriálisan felülfertőződik. Az enyhe formák kevés orvosi segítséggel meggyógyulnak, a problémát az utóbbiak jelentik.
Az AP általában steril gyulladásként indul, amely enyhe esetben csak a szerv ödémáját jelenti, súlyosabb folyamatokban a hasnyálmirigy egy részének nekrózisával jár. A bél barrierfunkciójának romlása miatt nő a bakteriális transzlokáció a bélfalon át, a baktériumok a vérárammal a nekrotikus pancreas szövetbe jutnak, az addig steril nekrózisból tályog lesz. Többszervi elégtelenség nagyobb valószínűséggel jelenik meg nekrotizáló formában. A különböző tanulmányok szerint, elhúzódó betegség esetén a steril nekrózis 25-40%-ban (3) felülfertőződik, amely a leggyakrabban a 2-3. héten (1 hét 25%, 3. hét 75%) (4, 5) következik be szepszis kíséretében. Minél nagyobb az elhalt terület, annál valószínűbb a felülfertőződés (6). Steril nekrózis esetén a mortalitás 12%, míg szuperinfekció esetén ez 25-30% (5, 7). Mindezek miatt jelentős a törekvés arra, hogy a nekrózis kialakulását és annak felülfertőződését megakadályozzuk. Mára már általánosan elfogadottá vált, hogy erre a célra a profilaktikusan adott antibiotikum nem alkalmas (8). Helyette a megfelelően alkalmazott folyadék- és táplálásterápia lehet a segítségünkre. Ugyanakkor arra is adatok vannak, hogy szepszis esetén – amely a pancreasnekrózis bakteriális szuperinfekciója során mindig kialakul – a hatékony antibiotikumkezelés időben (az észlelést követően 1 órán belül) történő elindítása meghatározza a kimenetelt (9). A fő probléma a fertőzés kezdetének a meghatározása.
A gyulladás minden fázisába bekapcsolódik az immunrendszer. Már a kezdeti lépések során az acinussejt sérülése gyulladásos citokinválaszt provokál, amely beindítja az eltakarító mechanizmusokat (10). Az első 10-14 napban a gyulladásos mediátorok szintje emelkedik, SIRS alakulhat ki (11). Amikor a gyulladás szisztémássá válik, a válaszreakciók – függetlenül attól, hogy bakteriális fertőzés vagy egyéb ok provokálta – nagyon hasonlóak. A steril gyulladás alatt megjelenő bakteriális komponens felismeréséhez AP-ben kevés objektív támpontunk van.
Infekcióra általában akkor gondolunk, ha a betegnek gyulladásra utaló jelei vannak: láz, esetleg fájdalom, C-reaktív protein (CRP-) vagy fehérvérsejt- (fvs-) szám-emelkedés. Azonban sem a láz, sem a CRP-, sem az fvs-szám nem különíti el megbízhatóan a bakteriális és a steril gyulladást.
A gyakorlatban használt gyulladásos markerek
A CRP a nevét a Pneumococcus és egyéb baktériumok kapszuláris poliszacharidjához való kötődőképességéről kapta. Gyulladások és szöveti sérülések kapcsán felszabaduló citokinek, esősorban az interleukin-6 (IL-6) és a tumornekrózis-faktor-alfa (TNFα), indukálják a képződését. A CRP a C1q aktiválásán keresztül beindítja a klasszikus komplementutat, így fokozza az opszonizációt. Az IgG Fc receptorához kötődve gyulladásos citokinek felszabadulását is kiváltja. Mintázatfelismerő molekulaként olyan mintázatokat detektál, amelyeket pl. az IgG nem tud azonosítani. A CRP tehát nem egyszerű markere a gyulladásnak, hanem aktív részvevője annak. Ezentúl aktiválja az apoptosist, és gátolja az endothelsejtekből történő nitrogén-oxid-felszabadulást. Akutfázis-proteinként nemcsak fertőzésekben, hanem egyéb gyulladások, illetve szöveti károsodások kapcsán is emelkedik a szintje (12). AP esetén a különböző okok miatt kialakult szöveti károsodás citokin- és CRP-felszabadulással jár, ami a gyulladás mértékéről informál, de nem jelzi a bakteriális infekciót. A CRP-nek bizonyos prognosztikai szerepet tulajdonítanak. Ha a felvételt követő 48. órában 190 mg/l vagy annál magasabb a CRP, vagy ha hirtelen emelkedik (>90 mg/l az első két napon), nagyobb valószínűséggel lehet súlyosabb kórformára számítani (13). Azonban a tanulmányok, amelyek alapján ezt meghatározták, régiek és kis esetszámúak. Farkas és munkatársainak nagy esetszámú vizsgálata szerint a CRP predikciós értéke mind a betegség lefolyásának súlyosságát, mind a halálozást illetően alacsony (14). (Bár sokan a hasnyálmirigyenzimek szintje alapján igyekeznek megbecsülni az AP súlyosságát, Pázniczki és munkatársainak tanulmánya alapján nincs ilyen összefüggés [15].)
A prokalcitonin (PCT) az endothelsejtekből szabadul fel bakteriális antigének, endotoxinok és az immunválasz (IL-1β, TNFα, IL-6) hatására. Az endotoxinok keringésbe történő bejutása után 3-4 órával már magasabb a szérumszintje, a felezési ideje 24-30 óra, ami azt jelenti, hogy gyorsan reagál a keringő baktériumokra, illetve a bacteriaemia megszűnésére. (A CRP és az fvs több napig magas marad.) A PCT sem tökéletesen specifikus infekcióra, mivel sérülés, égés, a tüdő kissejtes tumora, a pajzsmirigy medulláris C-sejt-karcinómája esetén, valamint veseelégtelenségben is emelkedik a szérumszint. A PCT valamivel pontosabban jelzi a bakteriális fertőzést, mint a CRP, de SIRS-ben infekció nélkül is lehet magas. Kétségtelen azonban, hogy az emelkedés nem olyan jelentős, mint szepszis esetén. Egy tanulmányban a határértéket 1,1 mg/l-nek találták, ami 83%-os szenzitivitással és 77%-os specificitással jelezte a bakteriális fertőzést, olyan betegekben, akiknek minimum 24 órája volt szisztémás gyulladásos választ jelző tünetük (16). AP-ben steril gyulladás esetén is emelkedhet az értéke, azonban bakteriális fertőzés és sokszervi elégtelenség idején a szintje szignifikánsan magasabb (17). 3,5 mg/l feletti értéke 90%-os szenzitivitással és specificitással jelzi a fertőzött pancreasnekrózist (16, 18). Nagyon jól használható a PTC negatív prediktív értéke, vagyis ha a szintje normális, a bakteriális fertőzés biztosan kizárható (19).
Bár az fvs-szám emelkedése a bakteriális fertőzések jellegzetes markere, egyéb gyulladásos és allergiás állapotokban, gyógyszer hatására (pl. kortikoszteroid), csontvelőbetegségekben is jelentkezhet, illetve szolid tumorok is kiprovokálhatják a jelenséget (leukemoid reakció). Nem tehető tehát egyenlőségjel a leukocytosis és a fertőzés közé (20).
A különböző patogén mintázatok a Toll-like receptorokon keresztül beindítják az interleukin-1β (IL-1β), a TNFα és az IL-6 termelését, ami prosztaglandin E2 (PGE2-) termelést stimulál. A PGE2 a hypothalamus lázközpontjában lévő PG EP3 receptorhoz kapcsolódva testhőmérséklet-emelkedéshez, láz kialakulásához vezet. Azonban egyéb hatások, amelyek az említett citokinek (IL-1β, TNF, IL-6) szintjének emelkedésével járnak, szintén indukálhatnak lázat infekció nélkül is (21).
Az akut pancreatitis és az antibiotikumkezelés
Az utóbbi időben egyre gyakrabban és egyre több antibiotikumot használunk, sok esetben feleslegesen, annak minden további következményével. Számolnunk kell a bakteriális rezisztencia fokozódásával, a Clostridium okozta hasmenés gyakoribbá válásával, ráadásul felesleges kiadást jelent. Különösen így van ez AP esetén. Az akut pancreatitises betegek kb. 5%-ában alakul ki pancreasnekrózis-szuperinfekció. Kb. a betegek további 14-37%-ában nem hasnyálmirigy-eredetű fertőzés van jelen, cholangitis, pneumónia stb. Ismerve a statisztikai adatokat, indokoltan az akut pancreatitises betegek 20-40%-ának kellene antibiotikumterápiában részesülnie. Ezzel szemben a Magyar Hasnyálmirigy Munkacsoport multicentrikus követéses vizsgálata során prospektíven gyűjtött adatok szerint az akut pancreatitises betegek 71%-a kap antibiotikumot, kétharmaduk úgy, hogy nincs igazolt fertőzésük (14). Vizsgálatukban arra keresték a választ, hogy mi lehet az antibiotikum túlzott használatának oka. Rávilágítottak, hogy a bakteriális fertőzés gyanúja sok esetben helytelenül vetődik fel. Gyakran a nagyon magas (100-200 mg/l feletti) CRP, láz vagy leukocytosis miatt vélik úgy, hogy bakteriális infekciója van a betegnek. További ok valószínűleg a defenzív attitűd, esetleg az ajánlások ismeretének a hiánya. A tanulmány szerint a CRP-emelkedés mértéke nem különbözött azokban a betegekben, akiknek volt pozitív hemokultúra-eredményük, és akiknek nem volt. Ez azt jelenti, hogy a magasabb CRP nem erősíti a fertőzés gyanúját. Az első napokban infekció nélkül is emelkedés várható. Ennek mértékét nem befolyásolja, hogy a beteg kapott-e antibiotikumot, és az antibiotikumkezelés nem gyorsítja a CRP- és az fvs-szám csökkenését, ha nincs a betegnek igazolt fertőzése (14). Helyesebb a PCT emelkedését követni (15).
Természetesen AP esetén nemcsak a pancreason belüli tályogképződés provokálhat szepszist, a betegnek lehet egyéb lokalizációjú fertőzése is. A kettőt fontos elkülöníteni, mivel az előbbinek jóval magasabb a mortalitása (15).
Az akut cholangitis a közös etiológia miatt relatíve gyakori AP esetén. Ugyanakkor AP-s betegekben nem könnyű bizonyítani, mivel a diagnosztikus kritériumok (22) a hasi fájdalom, a cholestasis (emelkedett májenzimek, bilirubin) és az epeúti tágulat jelei mellett az emelkedett gyulladásos értékekre (CRP, fvs), lázra támaszkodnak (1. táblázat).
1. táblázat: A cholangitis diagnosztikus kritériumai (22)

Az epeelfolyási nehezíte
ttség mellett megjelenő gyulladás minden más esetben az epeúti gyulladást valószínűsíti, azonban AP idején a CRP- és az fvs-számok a hasnyálmirigy gyulladása miatt is magasak, az epeúti elzáródás pedig önmagában nem bizonyítja, hogy epeúti fertőzés is jelen van.
Az akut cholangitisre utaló eltérések tehát átfedést mutatnak az AP-ben észlelhető jelekkel. Ilyenkor segítségünkre lehet a PCT, illetve annak növekedő tendenciája. A hemokultúra 21-71%-ban pozitív, illetve ha korai ERCP mellett döntünk, az epe tenyésztése 90%-ban igazolja a kórokozó(ka)t (23). A Magyar Hasnyálmirigy Munkacsoport eredményei szerint a leggyakrabban Escherichia colit (25–50%) Klebsiella speciest (15–20%) Enterococcus speciest (10–20%) és Enterobacter speciest (5–10%) azonosítanak (15). AP esetén az epeúti gyulladás gyanúja miatt korán alkalmazott antibiotikum- (AB-) kezelést valószínűleg az magyarázza, hogy a felmérések szerint cholangitis esetén az időben elindított, hatékony antibakteriális terápia és az epeutak átjárhatóságának mielőbbi biztosítása csökkenti a halálozást (23).
Az antibiotikumkezelés indításának szempontjai akut pancreatitisben (1. ábra)
Nem könnyű tehát döntést hozni arról, hogy AP esetén elindítsuk-e, illetve mikor indítsuk el az antibiotikumkezelést. Egyértelműen azonosítható extrapancreaticus fertőzések esetén az adott fertőzéssel kapcsolatos ajánlások szerint kell eljárni. AP-ben azonban számos befolyásoló tényezővel kell számolni. Magasak a gyulladásos értékek (CRP, fvs), a beteg lázas lehet, aminek hátterében állhat a hasnyálmirigy steril gyulladása. Ugyanakkor tudjuk, hogy a pancreasnekrózis felülfertőződése és késve kezdett hatékony antibiotikumkezelése rontja a beteg esélyeit a túlélésre. Sajnos nehéz pontosan megmondani, hogy az a szuperinfekció mikor következik be.
Bár minden esetet egyénileg kell mérlegelni, a fentiekre alapozva adható néhány hasznos szempont.
1. ábra: Az antibiotikumterápia akut pancreatitisben
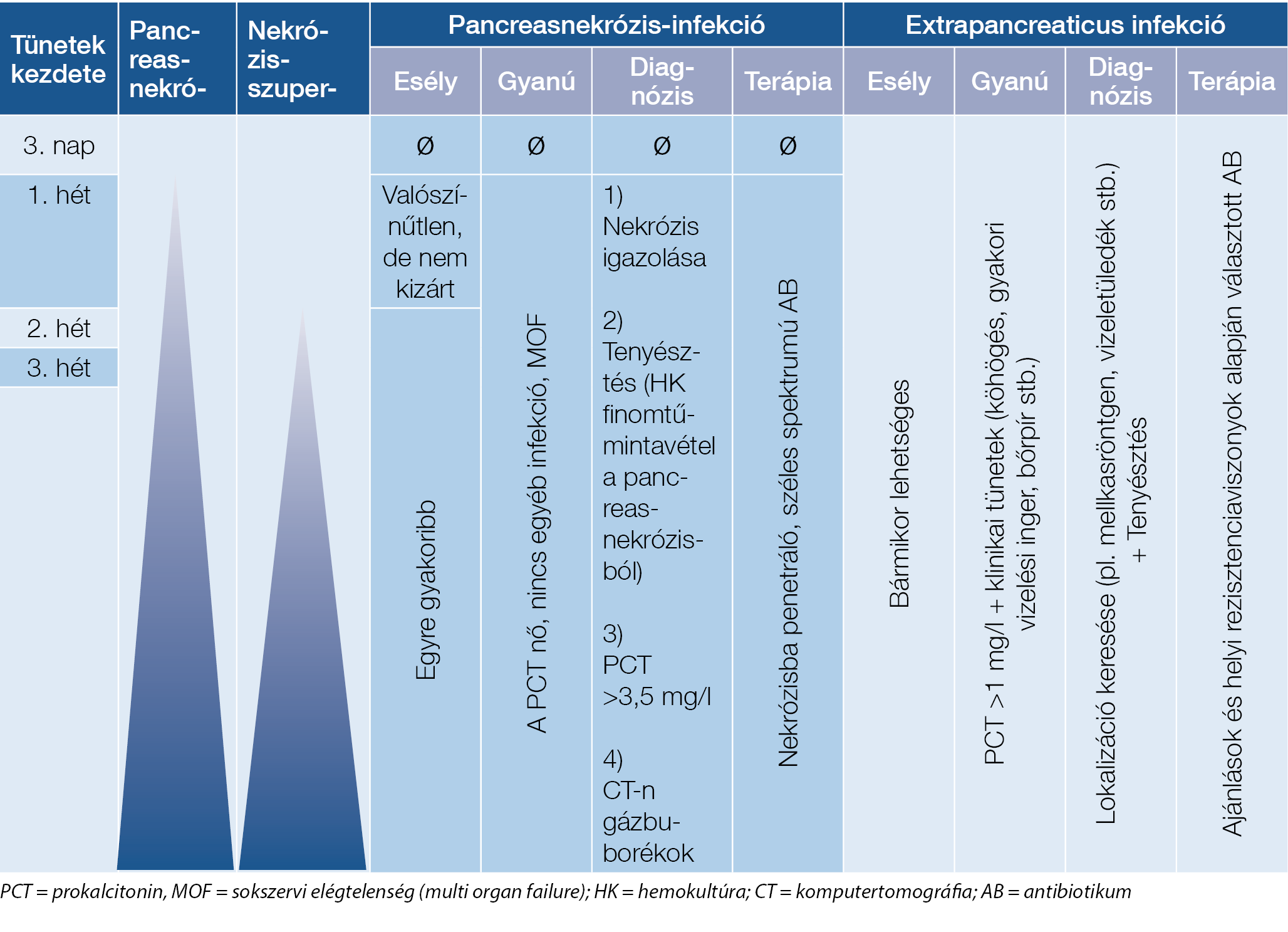
Felvételre kerülő AP beteg esetén tisztázni kell a panaszok kezdetének időpontját. Az első három napban nem várható nekrózis, és a CT sem tisztázza pontosan a betegség súlyosságát (13). A nekrózis szuperinfekciója a 2-3. héten a leggyakoribb. Ennek megfelelően az első három napon akkor indokolt az AB indítása, ha a betegnek azonosítható extrapancreaticus infekciója van. A bőr- és lágyrész-fertőzés, a húgyúti fertőzés, a pneumónia relatíve könnyen felismerhető. Ilyen esetben a lokalizáció, a fertőződés helyének (közösségben szerzett, kórházhoz kötött, nosocomialis) és a helyi rezisztenciaviszonyoknak megfelelően kell antibiotikumot választani, illetve törekedni kell arra, hogy tenyésztési eredmények álljanak rendelkezésre az esetleges terápiamódosításkor. A kezelés hosszáról a gyulladásos paraméterek (CRP, PCT) és a klinikai tünetek alapján kell dönteni. Biliáris AP esetén gyakran felmerül a cholangitis lehetősége, ez esetben is a diagnosztikus kritériumok alapján érdemes dönteni. Hasznos lehet a PCT 1,1 mg/l-es határértékét szem előtt tartani, mely alatt a bakteriális fertőzés valószínűsége kisebb. Ha bizonytalanság van az AB-terápia szükségességét illetően, helyesebb 1-2 napot várni, követni a PCT változását, és szükség esetén az AB-kezelést később indítani. Amikor az epeúti gyulladás lehetősége felmerül, hemokultúra vétele indokolt. A korán bevezetett AB-nak nincs kedvező hatása a kimenetelre (15). Ez alól természetesen kivétel a súlyos szeptikus állapot, ahol a hatékony terápia nem várhat.
Pancreason belüli infekció akkor alakul ki, ha a betegnek nekrotizáló pancreatitise van. Sajnos a klinikum nem jelzi egyértelműen a pancreasban kialakuló elhalást. Ez kontrasztanyagos CT-vel ítélhető meg, illetve endoszkópos UH-val is azonosítható lehet. A CT-vizsgálat elvégzését azonban nehezítheti, ha a betegnek veseelégtelensége van. A szuperinfekció határozottan a klinikai állapot rosszabbodásával jár, ezért lehetősége elsősorban a súlyos állapotú betegekben merül fel, különösen sokszervi elégtelenség észlelésekor. Ha szuperinfekcióra van gyanú, első lépésként, ha csak lehetséges, igazolni kell a nekrózis tényét. A nekrózis azonban önmagában még nem indikációja az AB-kezelésnek. A fertőzést igazolja a pozitív hemokultúra, a CT-n látott gázképződés. Az egyes szerzők által javasolt, a pancreasnekrózisból történő finomtű-mintavétel a legtöbb ellátóhelyen nem elérhető. Segítséget jelent a PCT, 3,5 mg/l felett biztosra vehető a szuperinfekció (17, 18), alacsonyabb értékek esetén emelkedő tendenciája fokozza a fertőzés gyanúját. Ha a pancreas szuperinfekciója bizonyított, vagy a klinikai gyanú erős, olyan antibiotikumot kell választani, amely kellően széles spektrumú, és penetrál az elhalt szövetbe (kinolon, piperacillin/tazobactam, imipenem, carbapenem) (18). A beteg állapotának javulása és a PCT normalizálódása jelzi, hogy az antibiotikum elhagyható.
Természetesen egy, minden beteg ellátására alkalmas, szigorú szabályozást nehéz hozni, de ha a fenti szempontokat figyelembe vesszük, talán csökkenthető a feleslegesen elindított antibiotikumkezelés, mérsékelhető az alkalmazás hossza, illetve optimalizálható lehet az antibiotikumválasztás.
Irodalom
https://doi.org/10.1136/gut.46.2.239.
2. Papachristou GI. Prediction of severe acute pancreatitis: current knowledge and novel insights. World J Gastroenterol 2008; 14: 6273–6275.
https://doi.org/10.3748/wjg.14.6273.
3. Zerem E. Treatment of severe acute pancreatitis and its complications. World J Gastroenterol 2014; 20: 13879–13892.
https://doi.org/10.3748/wjg.v20.i38.13879.
4. Leppäniemi A, Tolonen M, Tarasconi A, et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg 2019; 14: 27.
https://doi.org/10.1186/s13017-019-0247-0.
5. Charbonney E, Nathens AB. Severe acute pancreatitis: a review. Surg Infect (Larchmt) 2008; 9: 573–578.
https://doi.org/10.1089/sur.2008.9953.
6. Sakorafas GH, Lappas C, Mastoraki A, et al. Current trends in the management of infected necrotizing pancreatitis. Infect Disord Drug Targets 2010; 10: 9–14.
https://doi.org/10.2174/187152610790410936.
7. Baron TH, DiMaio CJ, Wang AZ, et al. American Gastroenterological Association Clinical Practice Update: Management of Pancreatic Necrosis. Gastroenterology 2020; 158: 67–75.e1.
https://doi.org/10.1053/j.gastro.2019.07.064.
8. Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology 2013; 13: e1-15.
https://doi.org/10.1016/j.pan.2013.07.063.
9. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 2017; 43: 304–377.
https://doi.org/10.1007/s00134-017-4683-6.
10. Lee PJ, Papachristou GI. New insights into acute pancreatitis. Nat Rev Gastroenterol Hepatol 2019; 16: 479–496.
https://doi.org/10.1038/s41575-019-0158-2.
11. Zerem E. Treatment of severe acute pancreatitis and its complications. World J Gastroenterol 2014; 20: 13879–92.
https://doi.org/10.3748/wjg.v20.i38.13879.
12. Sproston NR, Ashworth JJ. Role of C-Reactive Protein at Sites of Inflammation and Infection. Front Immunol 2018; 9: 754.
https://doi.org/10.3389/fimmu.2018.00754.
13. Mederos MA, Reber HA, Girgis MD. Acute Pancreatitis: A Review. JAMA 2021; 325: 382–390.
https://doi.org/10.1001/jama.2020.20317.
14. Farkas N, Hanák L, Mikó A, et al. A Multicenter, International Cohort Analysis of 1435 Cases to Support Clinical Trial Design in Acute Pancreatitis. Front Physiol 2019 Sep 4; 10: 1092.
https://doi.org/10.3389/fphys.2019.01092.
15. Párniczky A, Lantos T, Tóth EM, et al. Antibiotic therapy in acute pancreatitis: From global overuse to evidence based recommendations. Pancreatology 2019; 19: 488–499.
https://doi.org/10.1016/j.pan.2019.04.003.
16. Harbarth S, Holeckova K, Froidevaux C, et al. Diagnostic value of procalcitonin, interleukin-6, and interleukin-8 in critically ill patients admitted with suspected sepsis. Am J Respir Crit Care Med 2001; 164: 396–402.
https://doi.org/10.1164/ajrccm.164.3.2009052.
17. Rau BM, Kemppainen EA, Gumbs AA, et al. Early assessment of pancreatic infections and overall prognosis in severe acute pancreatitis by procalcitonin (PCT): a prospective international multicenter study. Ann Surg 2007; 245: 745–754.
https://doi.org/10.1097/01.sla.0000252443.22360.46.
18. Staubli SM, Oertli D, Nebiker CA. Laboratory markers predicting severity of acute pancreatitis. Crit Rev Clin Lab Sci 2015; 52: 273–283.
https://doi.org/10.3109/10408363.2015.1051659.
19. Leppäniemi A, Tolonen M, Tarasconi A, et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg 2019; 14: 27.
https://doi.org/10.1186/s13017-019-0247-0.
20. Abramson N, Melton B. Leukocytosis: basics of clinical assessment. Am Fam Physician 2000; 62: 2053–2060.
21.Bartfai T, Conti B. Fever. Scientific World Journal 2010; 10: 490–503.
https://doi.org/10.1100/tsw.2010.50
22. Kiriyama S, Kozaka K, Takada T, et al. Tokyo Guidelines 2018: diagnostic criteria and severity grading of acute cholangitis (with videos). J Hepatobiliary Pancreat Sci 2018; 25: 17–30.
https://doi.org/10.1002/jhbp.512.
23. Gomi H, Solomkin JS, Schlossberg D et al. Tokyo Guidelines 2018: antimicrobial therapy for acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci 2018; 25: 3–16.
https://doi.org/10.1002/jhbp.518.
