Összefoglaló közlemények / Reviews
Inflammatory bowel disease and pregnancy
Summary
Inflammatory bowel disease (IBD) poses complex issues in pregnancy, but with adequate, high-quality care excellent pregnancy outcomes are achievable. In this article, we review the current evidence and recommendations for fertility, pregnancy, delivery, and lactation in IBD patients and aim to provide guidance for clinicians involved in their care. Seventeen per cent of women with IBD are voluntarily childless compared with 6% of women in the general population. It is associated with disease burden, poor knowledge, or incorrect information about pregnancy and IBD. Active IBD is associated with an increased risk of preterm birth, low for gestation weight and fetal loss. Except for methotrexate and tofacitinib the risk of a flare outweighs the risk of IBD medication and maintenance of remission from IBD should be the main of care. Most women with IBD will experience a normal pregnancy and can have a vaginal delivery. Active perianal Crohn’s disease is an absolute and ileal pouch surgery a relative indication for a caesarean section. Breast feeding is beneficial to the infant and the risk from most IBD medications is negligible.
Összefoglalás
Gyulladásos bélbeteg kezelése terhesség alatt komplex megközelítést igényel, de az adekvát, magas szintű kezeléssel elérhetjük, hogy a terhesség lefolyása zavartalan legyen. A következő cikkben szeretném összefoglalni a legfontosabb teendőket, irányelveket a fertilitással, terhességgel, szüléssel, szoptatással kapcsolatosan, amelyeket a mindennapi gyakorlatban alkalmazhatnak. Elmondható tény, hogy gyulladásos bélbetegségben szenvedő betegek szignifikánsan kevesebb gyermeket vállalnak az átlagos populációhoz képest, gyakoribb az önként vállalt gyermektelenség (17% vs. 6%), amelynek hátterében sokszor a nem megfelelő edukáció áll. Aktív gyulladásos bélbetegség a koraszülés, az alacsony születési súly és a magzati halálozás rizikóját fokozza. A metotrexát és a tofacitinib kivételével a folyamatos gyógyszeres kezelés javasolt a remisszió fenntartása céljából. A legtöbb bélbeteg kismama normál, hüvelyi szülésen eshet át. Aktív perianális betegség abszolút, az ileoanalis pouch (IPAA) relatív indikációját jelenti az elektív császármetszésnek. A szoptatás fontos az újszülöttnek, és a fenti kettő kivételével biztonságosan adhatók gyógyszerek a szoptatás alatt is.
A fertilitás és a gyulladásos bélbetegség (inflammatory bowel disease, IBD)
IBD-ben szenvedő nőknél alacsonyabb a gyermekvállalási kedv. Ennek egyik oka az attól való félelem, hogy a betegséget az utódok is örökölhetik. Továbbá az IBD-s betegekre jellemző a krónikus fáradtság, ami alacsonyabb szexuális vággyal és aktivitással társul. Ugyanakkor a közösségi és populációs alapú vizsgálatok azt mutatják, hogy az IBD-s nők fogamzóképessége hasonló az általános populációéhoz. A sebészi kezelés csökkentheti a fogamzóképességet, összehasonlítva a gyógyszeres kezeléssel, amit fontos megbeszélni a beteggel a műtét elvégzése előtt. IBD-s betegeknél terhességben ugyanazok a műtéti kezelés indikációi, mint a nem terhes nőknél. Férfiak esetében limitált adat áll rendelkezésünkre azzal kapcsolatban, hogy a sebészeti műtétek milyen mértékben befolyásolják a fertilitást. A kismedencét érintő sebészeti beavatkozások vezethetnek impotenciához, valamint ejakulációs problémákhoz. A colitis ulcerosa standard műtéti kezelése a restoratív proctocolectomia, amely során a colont és a rectumot távolítják el, majd a tápcsatorna folytonosságát az ileumból képzett pouch és a canalis analis anastomosisával állítják helyre (IPAA). Ezen műtéten átesett betegeknél a helytelen rétegben való preparálás következtében kialakuló idegsérülés(ek) miatt jelentkezhet retrográd ejakuláció, valamint erektilis diszfunkció, amelyek potenciálisan megnehezíthetik a megtermékenyítést. Nők esetében megfigyelték, hogy a kismedencét érintő műtét után a szubfertilitás (egy éven belül nem következik be a fogamzás) előfordulásának gyakorisága emelkedik. Több különböző metaanalízis szerint az infertilitás rizikója 2-3-szorosra emelkedik az IPAA műtét után (a gyógyszeres kezelés alatt álló betegekéhez képest). Ennek hátterében leggyakrabban a kismedencei adhéziók következtében kialakuló hydrosalpinx, fimbriakárosodás, illetve tubalis obstrukció állnak. Megjegyzendő, hogy szemben az IPAA-val, az ileorectalis anastomosis a termékenységet nem befolyásolja jelentős mértékben, így ha a rectumot nem érinti a gyulladás, gyermekvállalást tervező hölgyek esetében ez a műtéti eljárás is választható (colitis ulcerosás betegeknél azonban ez a kritérium az esetek döntő többségében nem teljesül). Retrospektív tanulmányok alapján laparoszkópos műtét után a kevesebb visszamaradó adhéziónak köszönhetően jóval kisebb arányú az infertilitás, mint nyílt műtétek esetén. Ugyanezt támasztja alá, hogy posztoperatív kialakult infertilitás esetében az egészséges populációval megegyező arányban sikeres az in vitro fertilizáció (IVF). Mindazonáltal súlyos betegségben az aktív betegség nagyobb kockázatot jelent a magzatra, mint a műtét (1, 5).
Betegedukáció IBD-ben
A gyulladásos bélbetegség (IBD) rendszerint a fogamzóképes korban érinti a nőket, ami számos problémát vet fel. Nagyon fontos a multidiszciplináris team által végzett, terhesség előtti tanácsadás. Fel kell világosítani a beteget annak fontosságáról, hogy a teherbe esés remissziós periódusban történjen, mivel aktív betegségben a fogamzás exacerbációt válthat ki a betegek kétharmadánál, ami anyai és magzati szövődményekhez vezethet. A gyógyszeres kezelés félelmet válthat ki a leendő anyából, de tudni kell, hogy az IBD kezelésére alkalmazott szerek többsége biztonságos, ezért fontos a kezelés folytatása a terhesség ideje alatt is. Fontos a teherbe esés előtt a megfelelő tápláltsági állapot elérése, és a dohányzás elhagyása. A beteg folyamatos követése segít eloszlatni a kezeléssel kapcsolatos félelmeit, csökkenthetjük az önként vállalt gyermektelenség arányát, és hozzásegíti a betegeket az optimális körülmények eléréséhez egy egészséges gyermek kihordásához (2).
IBD és genetika
Kohorszvizsgálatok eredményei azt mondják, hogy Crohn-betegségben az öröklődés kockázata nagyobb, mint colitis ulcerosában. Anyai Crohn-betegség esetén az abszolút rizikó 2,7%, colitis ulcerosa esetén 1,6% (3). Ha mindkét szülőnek gyulladásos bélbetegsége van, az öröklődés kockázata a 30%-ot is elérheti, és ez a kockázat bizonyos etnikai csoportokban és fiatal életkor esetén tovább emelkedhet (4). Jelenleg nem áll rendelkezésünkre olyan teszt, amellyel megjósolható lenne a genetikai rizikó.
A terhesség hatása az IBD-re és vice versa
Az IBD hatása a terhességre
Az IBD terhességre gyakorolt hatását alapvetően a betegségnek a fogamzás idején való aktivitása határozza meg. Ha inaktív periódus alatt történik a fogamzás, mind a spontán abortusz, mind a terhesség alatti, valamint perinatális szövődmények tekintetében nem növekszik a rizikó az átlagos populációhoz képest. Ha a fogamzás aktív időszakban következik be, úgy a spontán abortusz, a koraszülés és a kis születési súly kockázata is magasabb. A magzatot érintő perinatális szövődményekre nézve is igen jelentős rizikófaktor a terhesség alatti betegségaktivitás. Magzati halálozás a műtéti beavatkozást igénylő esetekben nagy, a vetélés/halvaszületés aránya 18-40% lehet (5, 6). A terhesség lefolyására hat még a perianális érintettség, a vénás tromboembóliás szövődmények és a terhesség alatti sebészeti beavatkozások. A gyógyszeres kezelés melletti súlyos gyulladásos betegség súlyosabb szövődményekkel járhat a beteg számra, mint a sebészeti beavatkozás. Az első trimeszterben végzett műtétek a spontán abortusz rizikóját fokozhatják, míg a 3. trimeszterben végzett műtét a koraszülés rizikóját fokozza. A terhesség előrehaladásával sztómaproblémák jelenhetnek meg: a sztóma besüllyedése, retrakciója, prolapszusa, amelyek szükség estén a sztóma áthelyezéséhez, megnagyobbításához vezethetnek (7).
A terhesség hatása az IBD-re
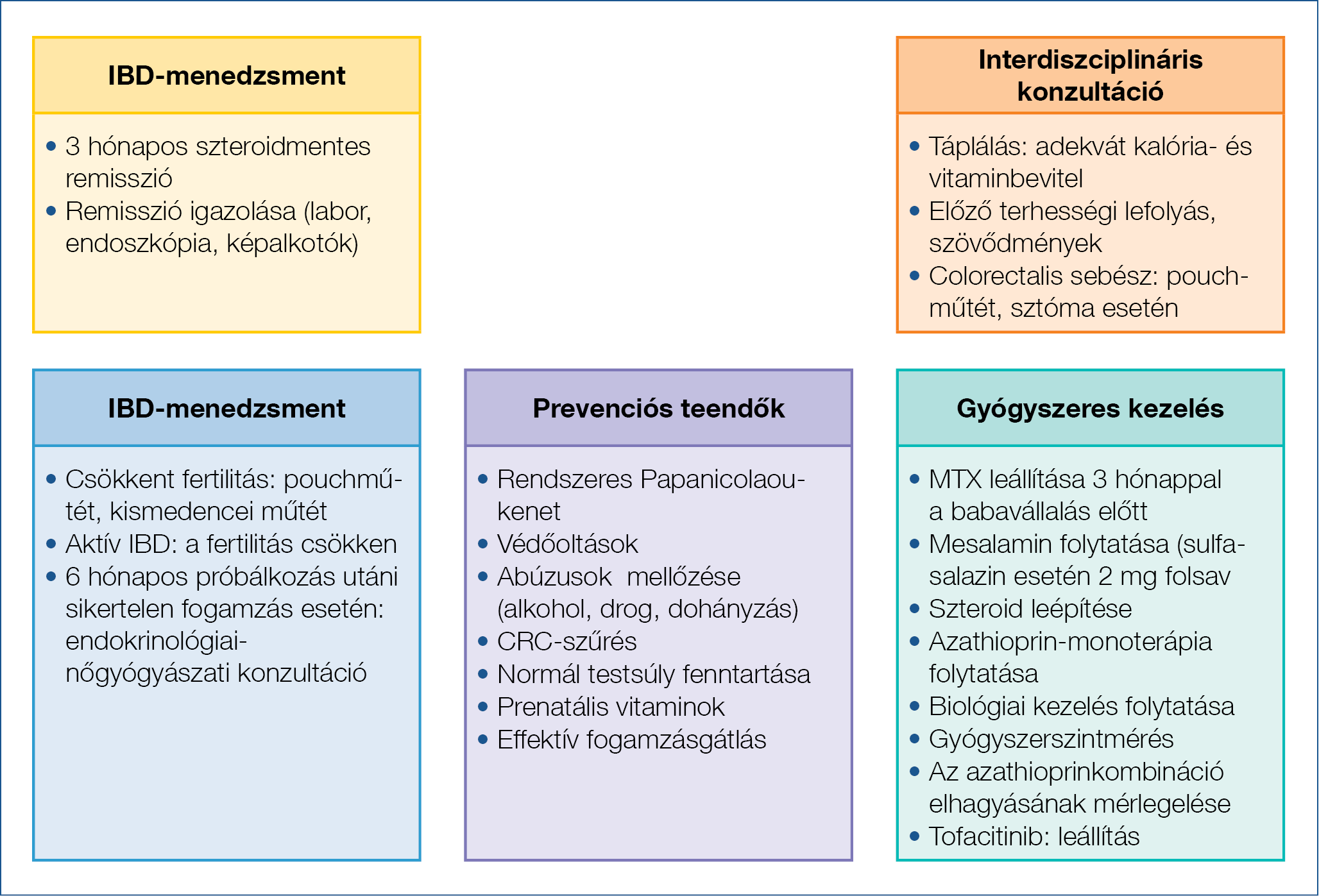
Colitis ulcerosa esetén, ha a fogamzás a betegség inaktív állapotában történik, a visszaesés kockázata megegyezik a nem állapotos nőknél tapasztaltakkal. Ha a fogamzás aktív betegségben jön létre, a betegek kétharmadánál továbbra is aktív marad a betegség, és ezek kétharmadánál még súlyosbodik is, ezért fontos, hogy a fogamzás remissziós fázisban történjen. Colitis ulcerosa esetén a relapszus kockázata nagyobb, mint Crohn-betegek esetén. A legújabb prospektív vizsgálatok szerint a Crohn-betegeknél terhesség alatt a relapszus kockázata nem volt nagyobb a nem terhes betegekéhez képest. A babavállalás előtti gondozás, betegedukáció kiemelten fontos a terheség alatti relapszus megelőzésében, kiemelve a gyógyszerszedés adherenciáját és a dohányzás elhagyását (1a ábra). A terhesség és a szülés az IBD-s betegek életminőségének javulásával jár, akár a szülést követő 10 évben is csökkenhet a relapszusok előfordulása (8). Az aktvitást mutató IBD-s beteg kezelése multidiszciplináris megközelítést igényel a terhesség során (9).
1a ábra: Babavállalás előtt
Kismamagondozás IBD-ben
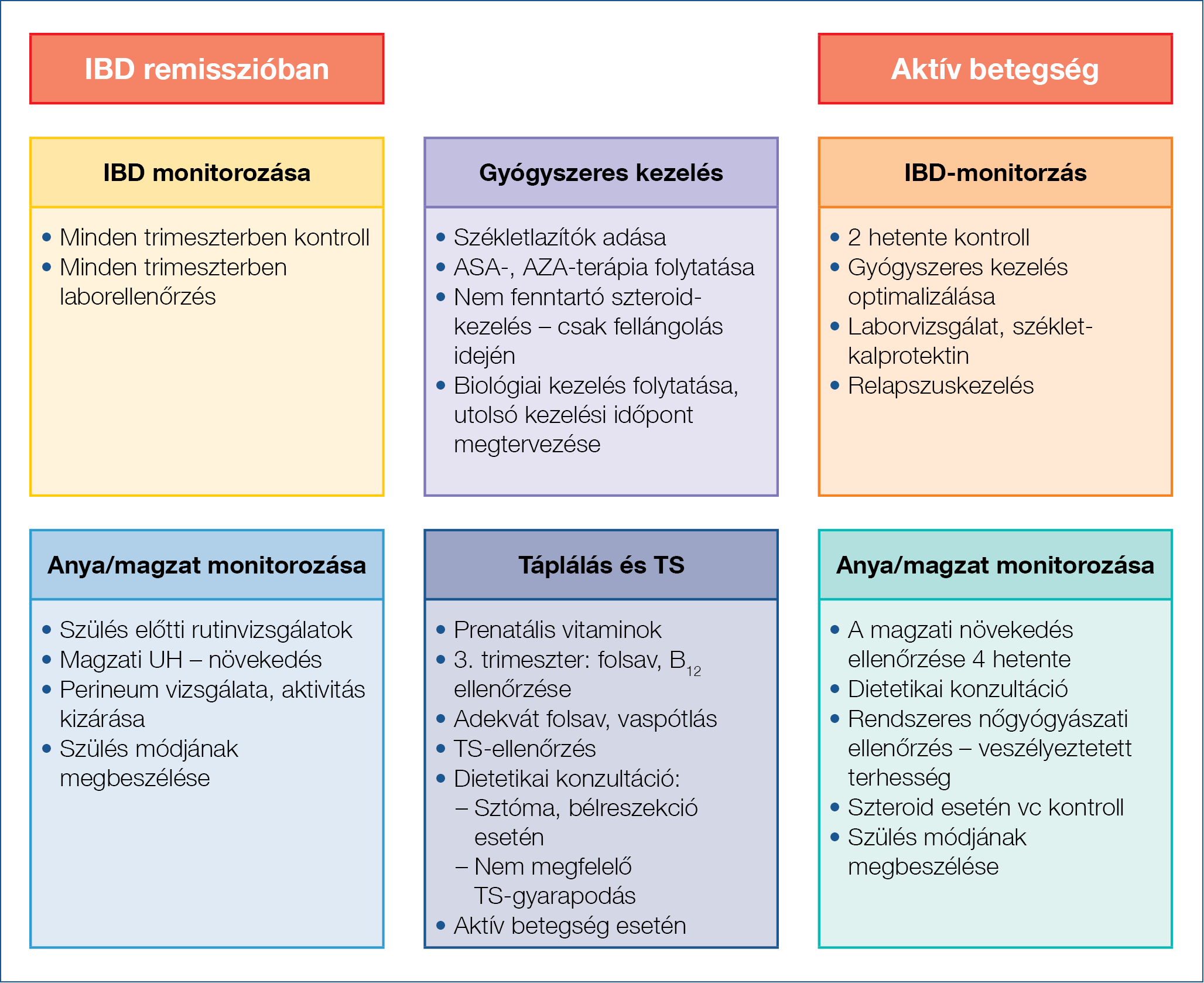
Rendszeres laboratóriumi ellenőrzés szükséges, legalább minden trimeszterben egyszer vizsgáljuk meg az ált. laboratóriumi paramétereket. Végezzük mindezt úgy, hogy tudjuk, ezek a paraméterek fiziológiásan is eltérnek a terhesség alatt a normál értékektől (1. táblázat).
1. táblázat: Laboratóriumi ellenőrzés terhesség alatt
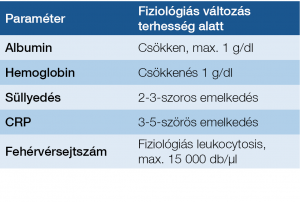
A terhesség nem kóros, ha a CRP 20-ig megemelkedik, az albumin- és a hemoglobinérték a dilúció következtében csökken (10, 11). A székletkalprotektin-vizsgálat jól alkalmazható terhességben is, 250 Ug/g feletti érték mindhárom trimeszterben jól korrelál a betegség aktivitásával (12). Célszerű ezt a noninvazív módszert a terhességi szűrési stratégiába integrálni, gyakorisága egyéni elbírálást igényel.
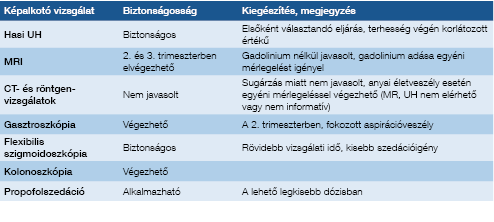
Az ECCO (European Crohn’s & Colitis Organization), az ASGE (American Society for Gastrointestinal Endoscopy) és a Toronto konszenzus alapján kolonoszkópiát akkor végezzünk csak (vérzés, súlyos anaemia stb.), ha befolyásolja az antenatális kezelési stratégiánkat, jól meggondolt indikációval, és lehetőleg a 2. trimeszterben (6, 9). Szigmoidoszkópia előnyben részesítendő a teljes kolonoszkópiával szemben. Kolonoszkópia során hypoxia léphet fel, mind az anyánál, mind a magzatnál, figyelembe kell venni a kolonoszkópiához alkalmazott gyógyszerek (hashajtók, szedatívumok, antibiotikumok) teratogén hatását és a koraszülés veszélyét. Szedáció esetén a legkisebb hatékony dózis adása javasolt: a meperidin- és a fentanylszedáció biztonságos, a benzodiazepineknél felmerült teratogén hatás. Vaszkuláris kompresszió megelőzése miatt háton fektetés nem javasolt, hiszen az uterus kompressziót gyakorol az aortára és a v. cavára, és így anyai hypotensiót és romló placentáris keringést okozhat (11, 12, 13). Magzati szedáció veszélye miatt magzati monitorozás javasolt a beavatkozás után (14).
A képalkotó vizsgálatok biztonságosságát a 2. táblázat foglalja össze. A multidiszciplináris gondozás feladatait az 1b ábra mutatja be. A relapszus kezelése megegyezik a nem terhesség alattival, kivéve azathioprinnaiv betegek esetén, azt ne kezdjük az esetleges mellékhatások miatt (14, 15, 16).
2. táblázat: Képalkotó vizsgálatok biztonságossága terhesség alatt gyulladásos bélbetegség esetén
1b ábra: Terhesgondozás IBD-ben
Gyógyszeres kezelés
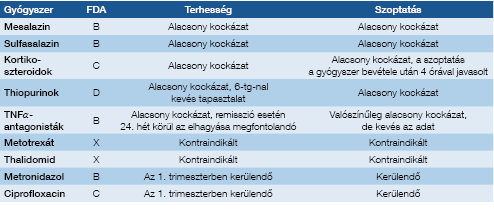
A gyulladásos bélbetegségek kezelésében használatos legtöbb gyógyszer várandósság alatti használatakor alacsony kockázattal számolhatunk (9). Így például az 5-ASA-származékok (kivéve a dibutyl-phthalate-tartalmú formulát), kortikoszteroidok, thiopurinok és biológiai szerek esetében sem anyai, sem magzati komplikációkkal való szignifikáns összefüggés nem mutatható ki. Ugyanakkor a metotrexát alkalmazása teratogén hatása miatt kontraindikált mind a várandósság, mind a szoptatás alatt, valamint a tervezett terhesség előtti 3-6 hónapban elhagyása javasolt mind férfiak, mind nők számára. Általánosságban elmondható, hogy a betegség fellángolásából adódó komplikációk nagyobb veszélyt jelentenek mind az anya, mind a magzat számára, mint a terhesség időszakában megfelelő körültekintéssel alkalmazott gyógyszeres kezelés esetleges mellékhatásai.
A 3. táblázatban áttekinthetjük az IBD kezelésében leg-gyakrabban használt gyógyszereket, az amerikai Élelmiszer- és Gyógyszerfelügyeleti Hatóság (Food and Drug Administration, FDA) által a terhesség alatti alkalmazásra vonatkozóan megalkotott klasszifikációs beosztást, valamint a szoptatás időszakára vonatkozó ajánlásokat.
3. táblázat: Terhesség és szoptatás alatt alkalmazott gyógyszerek biztonságossága
Biológiai kezelés terhesség és szoptatás alatt
Az IgG aktívan átjut a placentán a terhesség 2. trimeszterétől kezdve egészen a szülésig. A legtöbb hatóanyag a harmadik trimeszterben jut át, mindez a placenta neonatális Fc-receptorain keresztül. Az infliximab, az adalimumab, a golimumab, a vedolizumab és az ustekinumab mind IgG1 típusú monoklonális antitestek.
Infliximab
A legtöbb biztonsági adatot a gyulladásos bélbetegek terhesség alatti alkalmazásáról az anti-TNF-antitestek esetén tudjuk (infliximab, adalimumab). Az anti-TNF-antitestek a harmadik trimeszterben jelentenek fötális expozíciót. A köldökzsinór anti-TNF-szintje korrelál a terhességi héttel és az utolsó dózis alkalmazásának idejével. Az európai és az észak-amerikai irányelvek alacsony rizikójú kezelésként ajánlják az anti-TNF-antitest-kezeléseket. Az ECCO (European Crohn and Colitis Organization) 2015-ös konszenzusa a 24–26. héten ajánlja a kezelés leállítását, a 2016-os ajánlás a kezelés további folytatását is lehetővé teszi. Az AGA (American Gastroenterological Association) 2019-es ajánlása szerint a kezelés megszakítás nélkül folytatható a harmadik trimeszterben, úgy, hogy az utolsó kezelést 6-10 héttel a tervezett szülés előttre időzítsük (6, 9, 17, 18, 19, 20).
Vedolizumab
Kevés humán adat áll rendelkezésünkre. Retrospektív vizsgálatok, kis esetszámú prospektív vizsgálatok, illetve klinikai tanulmányok alapján a vedolizumab biztonsággal adható terhesség alatt, kezeléssel összefüggésbe hozható direkt vagy indirekt szövődményt nem észleltek (21, 22).
Ustekinumab
A terhesség alatti tapasztalatok elsősorban psoriasisos, illetve arthritis psoriathicában szenvedő beteg esetriportjaiból származnak. Ezekben az indikációkban az ustekinumab alacsonyabb dózisát alkalmazzák. Az eddigi legtöbb vizsgálatban, amint a terhesség kiderült, az ustekinumabkezelést leállították (23).
Tofacitinib
A tofacitinib mint kismolekula átjut a placentán. Állatkísérletekben alkalmazva a humán dózisokat, a szer teratogénnek bizonyult. A jelenlegi ajánlás szerint tofacitinibkezelés alatt fogamzásgátlás javasolt, legalább a kezelés leállítása után 4–6 héten keresztül (24, 25).
Szülés
A gyulladásos bélbetegek félnek, hogy milyen hatással lesz a szülés a betegségükre, illetve a sphincterfunkciójukra. Az utolsó hónapok előtt célszerű a nőgyógyász kollégával a tervezett szülés módját megbeszélni (1c ábra).
1c ábra: 35. heti teendők (18)
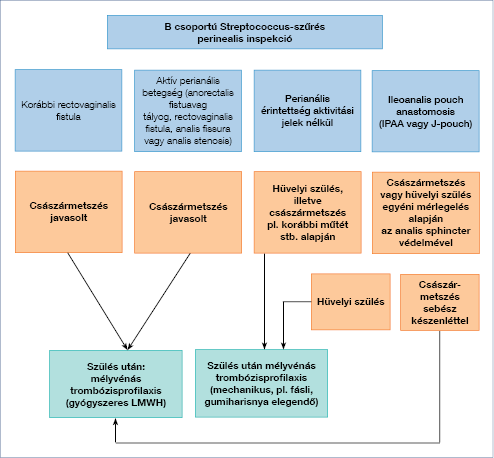
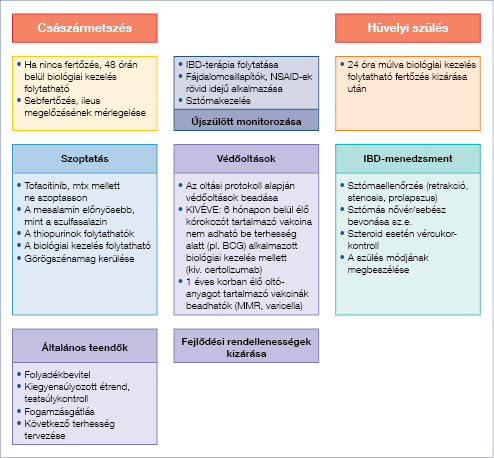
Aktív perianális betegség (fistula, fissura, tályog, rectovaginalis fistula, analis stenosis) esetén elektív császármetszés javasolt. IPAA műtéten átesett betegnél is császármetszés relatív indikációja áll fenn, egyénileg kell mérlegelni a kismedencei flóra, az inkontinencia veszélye szempontjából (26, 27). Élő kórokozót tartalmazó védőoltást az újszülött az első 6 hónapban nem kaphat biológiai kezelés mellett. A szüléssel nem fejeződik be a bélbeteg komplex kezelése, a multidiszciplináris feladatokat az 1d ábra mutatja be.
1d ábra: Szülés utáni gondozás
Összefoglalás
Annak ellenére, hogy a nyugalomban levő IBD ma már az esetek többségében nem kontraindikációja a gyermekvállalásnak, és a tudatos gyermekvállalással igen alacsonyra csökkenthető a betegség és a kezelésekhez köthető szövődmények előfordulása, a betegek gyermekvállalással kapcsolatos félelmei mégis igen gyakoriak. Sőt jelentős azon betegek aránya, akik a betegség és a kezelések miatt vállalnak kevesebb gyermeket. Emellett a betegek több mint fele nem kezelőorvosától kéri, illetve kapja meg a témában számára leghasznosabb információt. IBD-s betegek kezelése során, különösen gyermekvállalás tervezése esetén igen fontos a beteg együttműködése és a kezelőorvos által nyújtott megfelelő felvilágosítás, így segítve a betegeket a felelős döntéshozatalban (28).
Irodalom
https://doi.org/10.1093/ecco-jcc/jjw078
2. de Lima A, Zelinkova Z, Mulders AGMGJ, et al. Preconception care reduces relapse of inflammatory bowel disease during pregnancy. Clin Gastroenterol Hepatol 2016; 14: 1285–92.
https://doi.org/10.1016/j.cgh.2016.03.018
3. Moller FT, Andersen V, Wohlfahrt J, et al. Familial risk of inflammatory bowel disease: a population-based cohort study 1977–2011. Am J Gastroenterol 2015; 110: 564–71.
https://doi.org/10.1038/ajg.2015.50
4. Bennett RA, Rubin PH, Present DH. Frequency of inflammatory bowel disease in offspring of couples both presenting with inflammatory bowel disease. Gastroenterology 1991; 100: 1638–43.
https://doi.org/10.1016/0016-5085(91)90663-6.
5. van der Woude CJ, Ardizzone S, Bengtson MB, et al. The second European evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9: 107–24.
https://doi.org/10.1093/ecco-jcc/jju006
6. Bortoli A, Pedersen N, Duricova D, et al. Pregnancy outcome in inflammatory bowel disease: prospective European case-control ECCO-EpiCom study, 2003–2006. Aliment Pharmacol Ther 2011; 34: 724–34.
https://doi.org/10.1111/j.1365-2036.2011.04794
7. Aukamp V, Sredl D. Collaborative care management for a pregnant woman with an ostomy. Complementary Therapies in Nursing and Midwifery 2004; 10: 5–12.
https://doi.org/10.1016/S1353-6117(03)00077-5.
8. Abhyankar A, Ham M, Moss AC. Meta-Analysis: the impact of disease activity at conception on disease activity during pregnancy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 460–6.
https://doi.org/10.1111/apt.12417.
9. Nguyen GC, Seow CH, Maxwell C, et al. The Toronto consensus statements for the management of inflammatory bowel disease in pregnancy. Gastroenterology 2016; 150: 734–57.
https://doi: 10.1053/j.gastro.2015.12.003.
10. Abhyankar A, Ham M, Moss AC. Meta-Analysis: the impact of disease activity at conception on disease activity during pregnancy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 460–6.
https://doi.org/10.1111/apt.12417.
11. De Lima A, Galjart B, Wisse PHA, et al. Does lower gastrointestinal endoscopy during pregnancy pose a risk for mother and child? – A systematic review. BMC Gastroenterol 2015; 15: 15.
https://doi.org/10.1186/s12876-015-0244-z
12. Enato E, Moretti M, Koren G. The fetal safety of benzodiazepines: an updated meta-analysis. J Obstet Gynaecol Can 2011; 33: 46–8.
https://doi.org/10.1016/S1701-2163(16)34772-7
13. Nitsun M, Szokol J, Saleh H, et al. Pharmacokinetics of midazolam, propofol, and fentanyl transfer to human breast milk. Clin Pharmacol Ther 2006; 79: 549–57.
https://doi.org/10.1016/j.clpt.2006.02.010.
14. Tremblay E, Thérasse E, Thomassin-Naggara I, et al. Quality initiatives: guidelines for use of medical imaging during pregnancy and lactation. RadioGraphics 2012; 32: 897–911.
https://doi.org/10.1148/rg.323115120
15. Panés J, Bouzas R, Chaparro M, et al. Systematic review: the use of ultrasonography, computed tomography and magnetic resonance imaging for the diagnosis, assessment of activity and abdominal complications of Crohn’s disease. Aliment Pharmacol Ther 2011; 34: 125–45.
https://doi.org/10.1111/j.1365-2036.2011.04710
16. Maaser C, Sturm A, Vavricka SR, et al. ECCO-ESGAR guideline for diagnostic assessment in IBD Part 1: initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis 2019; 13: 144–64.
https://doi.org/10.1093/ecco-jcc/jjy113
17. Mahadevan U, Wolf DC, Dubinsky M, et al. Placental transfer of anti-tumor necrosis factor agents in pregnant patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11: quiz e24: 286–92.
https://doi.org/10.1016/j.cgh.2012.11.011.
A további irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.hu weboldalon.
18. Julsgaard M, Christensen LA, Gibson PR, et al. Concentrations of Adalimumab and Infliximab in Mothers and Newborns, and Effects on Infection. Gastroenterology 2016; 151: 110–9.
https://doi.org/10.1053/j.gastro.2016.04.002.
19. Bortlik M, Machkova N, Duricova D, et al. Pregnancy and newborn outcome of mothers with inflammatory bowel diseases exposed to anti-TNFa therapy during pregnancy: three-center study. Scand J Gastroenterol 2013; 48: 951–8.
https://doi.org/10.3109/00365521.2013.812141.
20. Narula N, Al-Dabbagh R, Dhillon A, et al. Anti-TNFa therapies are safe during pregnancy in women with inflammatory bowel disease: a systematic review and meta-analysis. Inflamm Bowel Dis 2014; 20: 1862–9.
https://doi.org/10.1097/MIB.0000000000000092.
21. Moens A, van Hoeve K, Humblet E, et al. Outcome of pregnancies in female patients with inflammatory bowel diseases treated with Vedolizumab. J Crohn’s Colitis 2019; 13: 12–18.
https://doi.org/10.1093/ecco-jcc/jjy142
22. Bar-Gil Shitrit A, Ben Ya’acov A, Livovsky DM, et al. Exposure to Vedolizumab in IBD pregnant women appears of low risk for mother and neonate: a first prospective comparison study. Am J Gastroenterol 2019; 114: 1172–5.
https://doi.org/10.14309/ajg.0000000000000186.
23. Klenske E, Osaba L, Nagore D, et al. Drug levels in the maternal serum, cord blood and breast milk of a Ustekinumab-Treated Patient with Crohn’s Disease.
https://doi.org/10.1093/ecco-jcc/jjy153.
24. Picardo S, Seow CH. A pharmacological approach to managing inflammatory bowel disease during conception, pregnancy and breastfeeding: biologic and oral small molecule therapy. Drugs 2019; 79: 1053–63.
https://doi.org/10.1007/s40265-019-01141-w.
25. Mahadevan U, Dubinsky MC, Su C, et al. Outcomes of pregnancies with Maternal/Paternal exposure in the tofacitinib safety databases for ulcerative colitis. Inflamm Bowel Dis 2018; 24: 2494–500.
https://doi.org/10.1093/ibd/izy160.
26. Remzi FH, Gorgun E, Bast J, et al. Vaginal delivery after ileal pouch-anal anastomosis: a word of caution. Dis Colon Rectum 2005; 48: 1691–9.
https://doi.org/10.1007/s10350-005-0124-7
27. Hahnloser D, Pemberton JH, Wolff BG, et al. Pregnancy and delivery before and after ileal pouch-anal anastomosis for inflammatory bowel disease: immediate and longterm consequences and outcomes. Dis Colon Rectum 2004; 47: 1127–35.
https://doi.org/10.1007/s10350-004-0569-0.
28. Mahadevan U, Robinson C, Bernasko N, et al. Inflammatory bowel disease in pregnancy clinical care pathway: a report from the American gastroenterological association IBD parenthood project Working group. Gastroenterology 2019; 156: 1508–24.
https://doi.org/10.1093/ibd/izz037.