Összefoglaló közlemények / Reviews
Intestinal histaminosis: a summary of the etiopathogenesis and therapeutic aspects of the clinical syndrome also known as histamine intolerance
Summary
Histamine intolerance (HIT) is an ill-defined clinical entity that has not yet been included in the official medical nomenclature. Symptoms are mediated by histamine, but its origin is largely disputed: increased release, reduced elimination and the role of exogenous histamine sources have all been suggested. The role of the alimentary tract in the etiopathogenesis is underlined by the fact that certain foods and nutrients typically trigger the symptoms. At the same time, what separates this syndrome from simple food allergy is that the allergens typically cause variable severity of symptoms at different time points. In the last 20 years, a serum ELISA biomarker has become available: diamine oxidase (DAO) shows a reproducibly correlates with the severity of the symptoms, and dietary recommendations have been introduced for symptomatic relief from histamine release and exogenous sources of histamine. At the same time, randomized controlled clinical trials are not available to prove their effectiveness, subjective clinical experience is that they improve the patient's symptoms in many cases, yet do not eliminate them completely and have massive negative impact on the quality of life. However, research on the microbiome and on the intestinal barrier has opened new insights to this field as well. According to our current knowledge, the decrease in the serum DAO level is an indicator of the consumption of the "DAO-pool" stored in leukocytes, which most often develops in connection with chronic histamine release due to the barrier damage. That is why intestinal histaminosis seems more appropriate for the name of the disease. We suggest that the main clinical focus should be targeted at identification of the cause of histamine release: changes of the gut microbiome and intestinal barrier damage, which in turn directs targeted nutritional therapy at the forefront of the treatment of the disease.
Összefoglalás
A gyakran hisztaminintoleranciaként (HIT) is említett, komplex etiológiájú tünetegyüttes egy nem pontosan definiált klinikai entitás, amelyet mind a mai napig nem fogadtak be a hivatalos orvosi nómenklatúrába. A tünetek megjelenését hisztamin mediálja, amelynek eredete vitatott: felmerül a fokozott felszabadulás, a csökkent elimináció és az exogén hisztaminforrások szerepe is. A tápcsatorna szerepét az etiopatogenezisben alátámasztja, hogy bizonyos ételek és tápanyagok jellegzetesen kiváltják a tüneteket. Az egyszerű táplálékallergiától ugyanakkor elkülöníti ezt a tünetegyüttest, hogy ugyanazon allergének szokatlanul eltérő súlyosságú formáját idézik elő más és más időpontokban.Az elmúlt 20 évben elérhetővé vált egy ELISA-szérumbiomarker: a diamino-oxidáz- (DAO-) meghatározás, amely reprodukálható módon korrelációt mutat a tünetek súlyosságával, illetve megfogalmazódtak diétás ajánlások, amelyek a hisztaminfelszabadításért felelős tényezők, illetve exogén hisztaminforrások eliminációja révén enyhíteni hivatottak a betegek tüneteit. Nem állnak ugyanakkor rendelkezésre randomizált kontrollált klinikai vizsgálatok ezek hatékonyságának megítélésére, és a klinikus szubjektív tapasztalata, hogy bár sok esetben javítanak a páciens tünetein, nem szüntetik meg őket, és az életminőséget negatívan befolyásolják.A mikrobiommal és az intesztinális barrierrel kapcsolatos kutatások ugyanakkor szemléletváltást hoztak ezen a területen is. Mai ismereteink szerint a szérum DAO-szintjének csökkenése a leukocytákban tárolt „DAO-pool” konszumpciós hiányának az indikátora, amely többnyire a barriersérülés miatti krónikus hisztaminfelszabadulással összefüggésben alakul ki. Épp ezért a kórkép elnevezésére az intesztinális histaminosis megfelelőbbnek látszik. A kórkép kezelésének előterébe ugyanakkor a hisztaminfelszabadulás oka, a mikrobiom- és a bélbarrier-sérülés okainak felderítése és ezek célzott táplálásterápiás megoldása kell hogy kerüljön.
Bevezetés
A hisztamin kóroki szerepe allergiás kórképekben egyike a XX. század orvosbiológiai kutatási vívmányainak, amely korán klinikai jelentőséget is kapott. A később Nobel-díjas Henry Dale izolálta kollégáival 1910-ben (1), és még abban az évben fény derült a szerepére az azonnali hiperszenzitivitási reakcióban (2). Már abban az időben tudott volt, hogy a hisztamin rendkívül ubikviter módon jelenik meg az élővilágban, növényekben is megtalálható, valamint rothasztóbaktériumok (ezek között a bélflórát alkotó fajok) is termelik (3). A hisztamin szerepe az emberi szervezetben azóta kutatás tárgya, és egyelőre úgy tűnik, hogy minél többet tudunk a megjelenéséről, azzal egyre inkább azt látjuk, hogy mennyire nem értjük az egymással látszólag összefüggésben nem lévő funkciókat a gyomorsav-szekréció szabályozásától a thalamus fájdalommodulációján át a gyulladásban betöltött komplex szerepéig. Paul Ehrlich nevéhez fűződik (1879-ben) a hízósejtek felfedezése (4). Szerepüket az anafilaxiás reakció patogenezisében a század 40-es éveiben írták le (5), és mai tudásunk szerint is a bazofil granulocytákkal együtt az elsődleges hisztamintermelésért felelős sejtjei az immunrendszernek. Korábban úgy gondolták, hogy a hízósejtek ezekből differenciálódnak és vándorolnak a nyálkahártyákba és az ezzel asszociált kötőszövetekbe, de mára kiderült, hogy a haematopoesis során más sejtvonalakból származnak (6).
A hisztamin ezekben a sejtekben citoplazmatikus granulumokban tárolódik, ahonnan a sejtek aktiválódása kapcsán exocytosissal szabadul fel. Az aktiválódás lehet immunológiai és attól független stimulusok eredménye is (7). Az antigéneknek legkitettebb nyálkahártya-felületek a szervezetben a légúti és a gasztrointesztinális traktus hámborítása és az ez alatt található kötőszövet. Itt mind a levegőben szálló, mind a táplálékkal bevitt, valamint a rezidens flórából származó bakteriális, illetve egyéb, ma a mikrobiomhoz sorolt PAMP- (pathogen associated molecular pattern, kórokozóasszociált molekuláris mintázat) struktúrák szolgálnak „gazdag” antigénforrásként.
A hisztamin potens biológiai feladata miatt fontos, hogy célzottan, térben és időben lokalizáltan szabaduljon fel, fejtse ki proinflammatorikus és egyéb hatásait, majd gyors bomlása révén eliminálódjon. Ennek két útja lehetséges a szervezetben. Jelenleg elsődlegesen számon tartott degradációs út az endogén hisztamin eliminációjára a hisztamin-metil-transzferáz (HMT) útvonal. A HMT a cytosolban jelen lévő enzim, amely nagyon sok egyéb sejtben is előfordul, pl: a vese tubulus- és glomeruláris sejtjeiben, az itt is jelen lévő hízósejtekben, illetve a máj Kupffer-sejtjeiben, de ezeken kívül a bronchusok, trachea, lép, prosztata, ováriumok, gerincvelő és az agyszövet is tartalmazza. Továbbá a HMT enzim polimorfizmusa és a hisztamin megváltozott metabolizmusa összefüggést mutat bizonyos pszichiátriai betegségek megjelenésével is (8). A HMT-aktivitás mérése klinikai körülmények között nem megoldott, ezért csak a HMT expressziós mintázatát és polimorfizmusait lehet jelenleg vizsgálni, de ebből is látható, hogy patofiziológiai szerepének a ma ismert betegségasszociációk csak a jéghegy csúcsát jelentik.
A hisztamin bontásáért az extracelluláris térben felelős enzim a diamino-oxidaz (DAO). A DAO jellemzően a nyálkahártya felszínén termelődik, amiből adódott az a ma is közkeletű következtetés, hogy az exogénhisztamin-források eliminációját szolgálja elsősorban, de erre kísérletes bizonyítékok nemigen vannak. Tudjuk ugyanakkor, hogy az orrnyálkahártya hámsejtjeinek HMT-expressziója nagyságrendekkel magasabb, mint a DAO-expresszió, ami ennél szofisztikáltabb magyarázatot sejtet (9). Miután a DAO szérumszintje mérhetővé vált, rengeteg megfigyelés és kísérletes adat áll rendelkezésünkre ennek mechanizmusáról és az ezzel együtt sok esetben megjelenő klinikai hatásáról, de ennek részletes bemutatására később kerül sor.
A lokálisan termelődő, illetve a keringő hisztamin hatásainak szelektivitását közvetítő tényezője a különböző hisztaminreceptorok megoszlása a szervezetben. Ennek leegyszerűsített modellje az 1. ábrán látható.
1. ábra: A hisztaminreceptorok altípusai és élettani szerepük
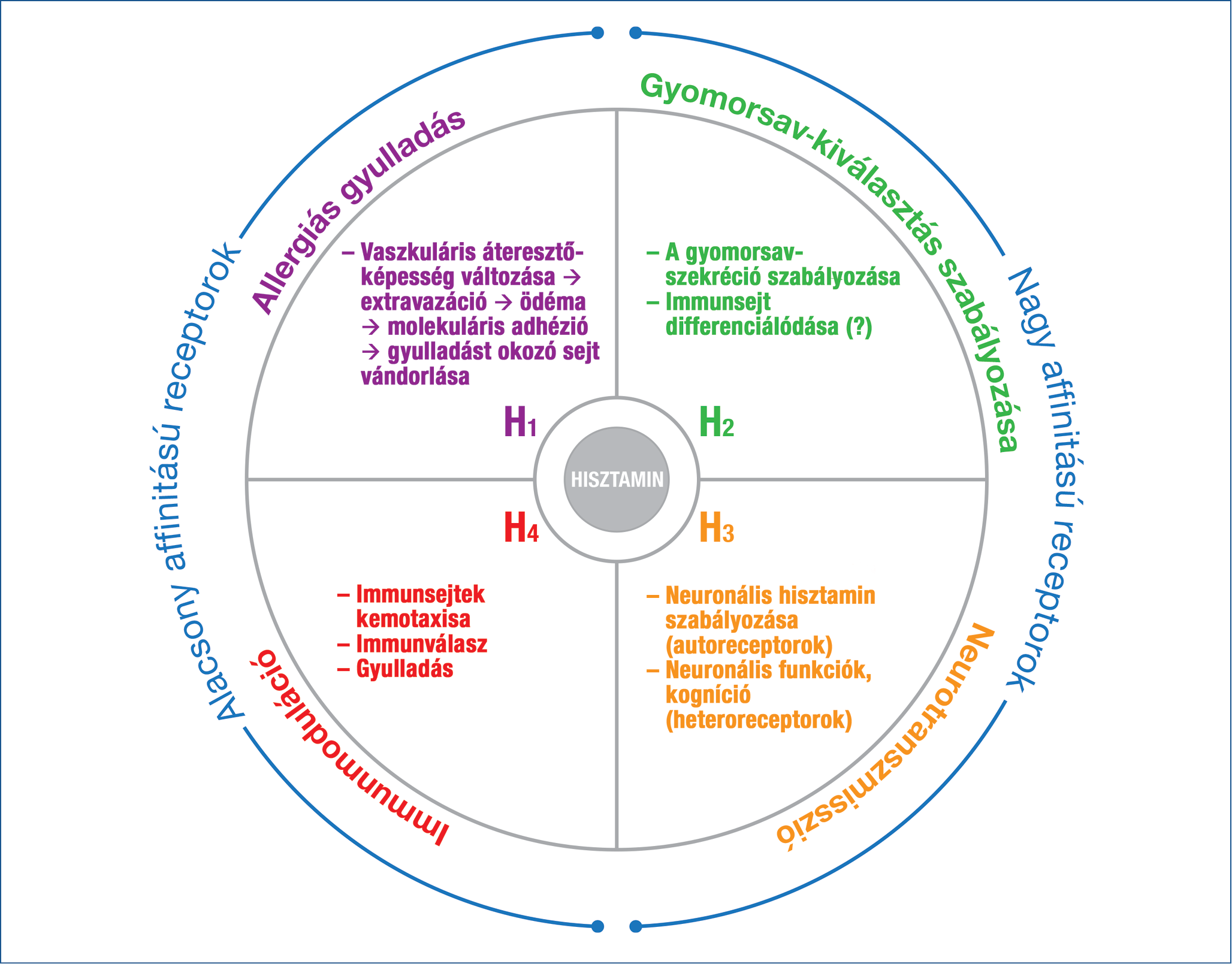
A hisztamint a biogén aminok közül elsőként fedezték fel, ezért az egyike a legtöbbet vizsgált vegyületeknek. Hatását a G-protein-kapcsolt „rhodopsin-like” receptorhoz köthető hatásai közvetítik, amelyek közül 4 altípust különítettek el, mind filogenetikai, mind hatásmechanizmus vonatkozásában (10).A jelen összefoglalás, illetve a gasztroenterológiai tünetképzés szempontjából a H1 receptorhoz köthető gyulladásmediáló hatáson kívül a simaizomra gyakorolt komplex (rapid átmeneti relaxáció és tartós kontrakció) hatás emelhető ki, amely speciesfüggő (11). Ezek a hisztaminfüggő hatások további kutatások ígéretes célpontját jelentik (12) az irritábilis bél szindróma patogenezisében, amelynek egyik fontos végső közös jelátviteli útvonala is lehet különböző etiológiai tényezők mentén (13).
A hisztaminparadoxon
A „hisztaminfelszabadító” tényezők között empirikus módon ma felsorolják a magas hisztamintartalmú élelmiszereket, illetve azokat az előanyagokat, elsősorban a histidint, amely elősegíti a hisztamintermelést. Ez egy mechanisztikus elképzelés arról, hogy ha egy szubsztrátot túltelítünk egy oldatban, reakcióközegben, akkor több végtermék keletkezik. Ez paradox feltételezés, egyrészt azért, mert az enzimatikus reakciókra ez nem jellemző, miután ezek energiafüggő, szorosan szabályozott folyamatok. Mégis ellentmondásos, mert klinikailag igazolva látják a betegek a tünetek megjelenését a hisztaminfelszabadító ételek fogyasztása után.
Ennek hipotetikus magyarázatához először a probléma összetettségét kell jobban megérteni biokémiai szinten, ami lehetőséget ad oki kezelés tervezésére személyre szabottan, a ma elérhető biológiai, biokémiai ismeretekkel a birtokunkban is. Itt érdemes említést tenni a krónikus spontán urticaria (CSU) „szindrómáról”, amely egy tünetileg definiált klinikai entitás: 6 hétnél hosszabb lefolyású, a hét „majdnem minden napján” megjelenő, urticariform bőrtünetek jellemzik. Ennek patogenezisében mind a hisztamin, mind az IgE-mediált immunitás szerepe terápiásan igazolt: a H1 antihisztaminok és új generációs célzott biológiai ágensek szerepe van előtérben (omalizumab), de a kezelési arzenált kiegészíti a klasszikus immunszupresszió teljes tárháza a szteroidoktól a cyclosporinon, a tacrolimuson és a dapsonon át a sulfasalazynig (14). Didaktikai szempontból azért lényeges ezt a klinikailag és tünettanilag, illetve terápiásan nagyon jól körülírt, ha úgy tetszik, „extrém súlyos” formáját mint modellbetegséget megismerni közelebbről a hisztaminkóroktan közelebbi megértéséhez, mert jól demonstrálják a „végső közös út” mechanizmust.Az oki kezelések tervezésénél ez az egyik legfontosabb klinikai fenomén, amelyet szem előtt kell tartani. Az ok és okozat elkülönítése során ugyanis a végső közös út egy olyan tünetileg homogénnek látszó entitást takar, amelynek a hátterében ugyanakkor rendkívül heterogén patogenezis állhat. A gasztroenterológiában ennek a típuspéldája a hasmenés. Itt a végső közös út a colonba jutó magas ozmolaritású székletbennék megjelenése, amely megakadályozza a víz visszaszívódását. Annak számos oka van, hogy miért jut ozmotikusan aktív bennék a vastagbélbe: ionpumpák bénulásától a motilitás felgyorsulásán át a legkülönbözőbb felszívódási zavarokig. Ezek mind hasmenés formájában manifesztálódnak.A CSU „szindróma” (idézőjelben, mert ezt a hivatalos orvosi nómenklatúra nem szindrómaként jelöli, de értelmezésünk szerint valójában az – tehát nem önálló betegségentitás, „csak” egy heterogén tünetegyüttes). Tehát a histaminosis egy olyan végső közös útját jelöli, amikor az IgE-mediált hisztaminfelszabadulás, illetve az eliminációs zavar együttesen tartós hisztaminszint-emelkedést okoz, ami jellegzetes bőr- és egyéb klinikai tünetekkel társul. Mindez egy circulus vitiosus formájában állandósul. A patomechanizmusban igazolt a véralvadási kaszkád aktivációja, fertőzések, különösen Gram-negatív, lipopoliszacharid- (LPS-) tartalmú sejtfalkomponensek és ezek toll-like receptor (TLR) aktivációja (15).A hisztaminparadoxon és a CSU szindróma összevetése azért érdekes, mert a gasztroenterológiában sokszor hisztaminintoleranciaként említett, de a hivatalos nevezéktanba be nem fogadott klinikai entitás a CSU tünetegyüttes intesztinális megjelenési formájának felel meg. Az intesztinális eredetű hisztamintúltengésnek tünetileg része a krónikus urticaria, de jellegzetesen együtt jár ételintoleranciával jellemezhető tünetekkel is, illetve egyéb extraintesztinális manifesztációkkal. Helyesebb lenne tehát hisztaminintolerancia szindróma helyett intesztinális histaminosisként definiálni.Az intesztinális histaminosisFoglaljuk tehát össze, hogy mely kórfolyamatok végső közös útja jelenti az intesztinális hisztamintúltengést, és ennek milyen kapcsolata van az általános légúti, illetve a kültakarót érintő allergiás jelenségekkel.Didaktikai megközelítésben a hisztamintúltengés leggyakoribb okának a fokozott hisztaminfelszabadulás tűnik, amelynek legfontosabb forrása az intesztinális barrier sérülésével együtt járó permeabilitási zavar (16). Ennek következtében részben tápanyagantigének, részben bakteriális sejttörmelékek (PAMP-struktúrák) jutnak át a szövetek közötti térbe a béltraktusból. A krónikus antigén-, illetve PAMP-expozíció a biokémiai jellegüknél fogva váltanak ki különböző immunreakciókat, amelyek közül kiemelkedik a toll-like receptorok (TLR) aktiválódásának szerepe (17). Ezt a PAMP-struktúrák tudják aktiválni, és szerepük azért kiemelkedő, mert egyrészt a TLR-rendszereken keresztül szisztémás gyulladásos hatásokat tudnak közvetíteni (18), miután ezek a keringésbe kerülve a portális vénás rendszerbe jutnak (19). Ugyanakkor a hízósejteken is találhatók TLR receptorok, és a távoli célszerveken keresztül erősíteni tudják az IgE-mediált immunválaszt, jellegzetesen a hízósejt-degranulációt.Ez a „hízósejt priming” nagy jelentőséggel bír különböző táplálékantigének, illetve akut barrierkárosodás nyomán (pl. alkoholfogyasztás) kialakuló, indokolatlanul erősnek tűnő klinikai tünetegyüttesre. Ezt fontos szem előtt tartani, és a megfelelő compliance felépítése céljából a pácienseknek elmagyarázni. A gyakorlatban a barrierregeneráció/célzott táplálásterápia indulása után heteknek, hónapoknak kell eltelniük, hogy a páciens szubjektív javulást tapasztaljon. A javulást itt javasoljuk egy tüneti napló segítségével kvantifikálni, és mindennap egységes skálán értékelni a jellegzetes lokális, szisztémás tüneteknek mind a kiterjedését, mind a súlyosságát. Ennek a naplónak az adott hétre vetített napi súlyozott átlaga (kiterjedés × súlyosság) olyan érzékeny mutató, amely segíti a lassan javuló tendencia értékelését a betegnek is követni, és erőt ad a sokszor megterhelő életmód- és táplálásterápiás protokollok követéséhez. A didaktikai megfontolásokhoz visszatérve: a másik fontos tényező a histaminosis kialakításában a degradáció csökkenése. Ebben jóval nagyobb szerepet kap a szérum-DAO meghatározása, mintsem oki tényezőként indokolt lenne, ugyanakkor egyszerű és költséghatékony módja az állapot követésének. A szérumban megjelenő DAO enzim ugyanis nem reprezentálja a hisztamineliminációs kapacitást, sokkal inkább egy konszumpciós hiányállapotot mutat. A DAO enzim szabad formában nem kering a testnedvekben, hanem a koagulációs kaszkád aktivációja során, granulocytákból szabadul fel elsősorban. Szerepe főként az ilyenkor felszabaduló hisztamin negatív feed-back-regulációjában van. A korábbi elképzelésekkel szemben tehát nem egy szerzett, genetikusan kódolt laktázhiány → felnőttkori laktózintolerancia jelenséggel állunk szemben, ahogy a félrevezető hisztaminintolerancia elnevezés is tükrözi. Az intesztinális barrierregenerációt célzó táplálásterápia sikere esetén a DAO enzim szintje fokozatosan emelkedik, és a mennyisége egyenes arányban áll a klinikai tünetek javulásával (20). Ilyen értelemben a histaminosis súlyosságának indirekt mérőszámaként szolgál a leukocytákban tárolt DAO mennyisége, amely klinikai laborokban ugyanakkor könnyen mérhető. Az ételintolerancia-tesztek értékelése is ide tartozik. Saját gyakorlatunkban a személyre szabott diéta összeállításánál ezekre egyáltalán nem támaszkodunk, ugyanakkor az intesztinális barriersérülés érzékeny és specifikus mérőszámát adja az IgG-pozitív allergének és a tesztpanel hányadosa (például 59/200). Ezeknek az antitesteknek a szintje is csökkenni tud a barrierregeneráció mellett, és jól követhető a regenerációs folyamat. Saját gyakorlatunkban 3 havonta végezzük a DAO és egyéb gyulladásos (aspecifikus), illetve barrierspecifikusabbnak mondott (pl. zonulin és calprotectin) paraméterek értékelését. Ezek előnye elsősorban a betegcompliance fenntartásában és a táplálásterápia hatékonyságának jellemzésében van (mint pl. a cöliákiapanelnek lisztérzékeny betegek diétás gondozása során). Hátrányuk a költségük. Sajnos az a tapasztalat, hogy a megfelelő szenzitivitáshoz kombináltan célszerű vizsgálni őket, majd a kiválasztott paraméterek követése javasolt. Ennek ellenére ezek költsége 100 euró körül van, kombináltan elérheti az 500 eurót a kivizsgálás keretében, ami a mikrobiom-genetikai tesztek és interpretációjuk költségével kb. ugyanennyibe kerül.Az intesztinális barriersérülés okaés diagnosztikája. Terjedelmi okoknál fogva ezeket jelen közleményben felsoroljuk csak, a részletes patomechanizmust érintő magyarázat az egyes etiológiai tényezőknél meghaladja a tartalmi korlátok nyújtotta lehetőségeket. Az 1. táblázatban felsorolt barrierkárosító tényezők összefoglalása ugyanakkor fontos, mert tapasztalatunk szerint ezt az intesztinális histaminosis kóreredete tisztázása során a kórelőzmény felvételekor listaszerűen rögzíteni kell, egyenként rákérdezve az egyes potenciális tényezőkre. Sok esetben ugyanis nem egy major tényezőfaktor felelős a sérülésért, hanem sok kis tényező összessége.
Épp ezért a páciensek empirikusan 1-1 nyilvánvaló kiváltó tényező elkerülésével nem tudják megoldani a tünetegyüttest, ami néha ugyanazon tényező után megjelenik, néha pedig nem, miután több tényező együttes hatása alakítja ki az aktuális barrierpermeabilitási zavart.A diagnosztika vonatkozásában elsődleges szerepe van a konvencionális gasztroenterológiai vizsgálatoknak, úm. képalkotók, rutinlaborok, endoszkópos vizsgálatok és célzott anamnézisfelvétel. Ezt a mi gyakorlatunkban kiegészíti a cöliákiapanel, a totál IgE, a szérum-DAO, illetve a székletzonulin-, a calprotectin- és az S16 mikrobiom molekuláris diagnosztika, amelynek fontos része az eredmény klinikai interpretációja is. Itt elsősorban a barriersérülést okozó baktériumgenusok kimutatása a bélflórában és ezekre vonatkozó célzott táplálásterápiás javaslatok összeállítása fontos. Kiegészítésképp hasznos lehet a korábbiakban említett táplálékintoleranciapanel-teszt és genetikai laktázteszt, viszont kifejezetten félrevezetőnek tartjuk a H2 kilégzési teszteket. A legproblémásabb ezek alkalmazása abból a szempontból, hogy a teljesen aspecifikusan magas H2 vagy metán kilégzett levegőben történt kimutatása nyomán úgy történik enyhébb vagy komolyabb ablatív antibiotikus kezelésre javaslat, hogy a bélflóra diverzitására nem adnak információt. Minél súlyosabb ez utóbbi károsodása, annál nagyobb a kockázata a panaszok visszatérésének vagy súlyosbodásának, illetve nem oldják meg a barriersérülést okozó specifikus dysbiosisokat, sőt a háttérdiverzitás csökkentése révén valójában rontanak a beteg állapotán egy rövid távú tüneti javulás után.
Keveset említett, de rendkívül fontos tényező az intesztinális barriersérülés hátterében az alvászavar. A nemzetközi alvástársaságok ajánlása erre vonatkozóan úgy szól, hogy ha heti 1 alkalomnál többször ébred valaki fel bármilyen okból (pl. vécére), akkor már alvászavara van. Ennek a jelentősége nem az 5 perces ébredés vonatkozásában van, hanem a mélyalvás hiánya, stressz, mozgásszegény életmód miatt a központi idegrendszer készültségének állandósulása, amely fájdalommodulációs zavarokhoz is vezet (21). Ennek felderítésére sincs elegendő alváslabor-kapacitás sehol a világon, de az esetek 80%-ában elegendő egy okosóra segítségével monitorozni a REM-ciklusok számát és a mélyalvás arányát. A kettő statisztikai naplózása a gondozás során saját gyakorlatunkban az esetek többségében elegendő.
Terápiás megfontolásokMiután nagy értékű diagnosztikai vizsgálatot nem lehet minden ételintoleranciában szenvedő betegnek végezni, az alapellátásban, illetve az általános gasztroenterológiai szakrendelői gyakorlatban a rutinszerű antibiotikus kezelés helyett ex juvantibus barrierregenerációt célzó táplálásterápiát kellene alkalmazni. Terjedelmi korlátok miatt itt is csak a kezelés alapelveire tudunk kitérni.Az oki kezelés legfontosabb része az anamnézisfelvétel. Az 1. táblázat alapján identifikált kóroki tényező kiiktatása: pl. heti 1-2 deciliternyi bor- vagy sörfogyasztás helyett teljes alkoholabsztinencia. Az emulgeálószerek tiltása, ezek közül saját gyakorlatunkban pl. a növényi tejpótló italok, vegán húspótló készítmények, salátaöntetek, nyers tojás stb. teljes elhagyása.
1. táblázat: Az intesztinális permeabilitást meghatározó tényezők

A kiemelten allergizáló tápanyag-összetevők átmeneti kiiktatása (úm. glutén és kazein). A magas oxálsavtartalmú élelmiszerek elhagyása: úm. rukkola, spenót, sóska, rebarbara stb.
Aspecifikus barriervédelem: magas fehérjetartalmú hypoallergén tápszerek bevezetése. Ezek patikai forgalomban korábban csak csecsemőtápszerek formájában voltak elérhetők tejfehérje-intolerancia esetén (Neocate junior), jelenleg azonban elementáris diéta támogatására több készítmény is elérhető (Elemental 028). A probiotikumok alkalmazásánál kevés a tudományos evidencia. Arra elég megbízható adat áll rendelkezésre, hogy a probiotikumok önmagukban a bélflóra diverzitásának helyreállítását nem tudják megoldani, sőt lassíthatják azt. Ezért kiemelt fontosságú, hogy ezeket se tüneti alapon válasszuk ki, hanem a meglévő, publikált klinikai tapasztalatokra építve. Itt nem elég specifikus fajokat tartalmazó készítményt választani, miután a géntranszfer és metilációs mintázat döntően befolyásolni tudja az egyes fajok védőnyáktermelő kapacitását, illetve a specifikus fajok megtapadását segítő funkciót a multispecies készítményen belül. Ebben a tekintetben legtöbbet vizsgált nemzetközi készítmény az Ecologic 825, amely Magyarországon ProGastro 825 néven kerül forgalomba (22). Kiemelendők emellett az L-glutamin-készítmények, amelyek barrierregenerációs hatása intenzív osztályos táplálásterápiás gyakorlatból jól ismert és dokumentált (23, 24). Miután ismert barriersérülés mellett alkalmazzuk ezeket a készítményeket is, nagyon fontos itt is olyan készítményt használni, ahol a gyártástechnológia során nem marad allergizáló adalékanyag, metabolit a készítményben. Hazánkban is kapható, és hasonló technológiai körülmények között készült termék (KABI-Glutamin) humán kísérletben segítette az intesztinális permeabilitás fenntartását, így áttételesen megakadályozta a szepszis kialakulását (25).
Nem szabad elfeledkezni az alvászavarok, a mozgáshiány és a stresszkezelés szerepéről sem. Ezek a páciens életmódjába vannak kódolva, és könnyebb őket azonosítani, mint megoldani. A sikeres kezelés feltétele saját tapasztalatunk szerint az interdiszciplináris teamek megszervezése, ahol egységes diagnosztikus és gondozási elveket dolgoznak ki (amelyek nemzetközi standardjai egyelőre hiányoznak), és egyszerre, egymásra épülve korrigálják a betegnél. A tényezők összefüggnek, de sok esetben nem igénylik minden területen specialista bevonását, elég a szempontrendszer összeállításánál és frissítésénél egységes protokollokat kidolgozni. Az egyes betegek vonatkozásában egyenletesen oszlanak meg a különböző területeket érintő, komplexebb problémák, és a mi gyakorlatunkban végül ahhoz a szakemberhez kerül a beteg referálásra gondozásba vétel céljából, ahol a legsúlyosabb, legkomplexebb problémát sikerül identifikálni. Az interdiszciplináris team stabil tagjai a gasztroenterológus orvos mellett a terápiás dietetikus, gyógytornász/humánkineziológus, alvásterápiás szakorvos.ÖsszefoglalásAz intesztinális histaminosis komplex etiológiájú, jellemzően szerzett barriersérülés következtében kialakult kórállapot. Diagnosztikája költséges, de megoldott, általános ajánlásként megfogalmazhatjuk, hogy ezek országos táplálásterápiás centrumban elérhetők kell hogy legyenek, és a komplexebb esetekben szükséges őket elvégezni (kb. az összes eset 20%-a). Az általános szakorvosi feladat a barriersérülés okainak felderítése és ezek eliminációja a megfelelő általános gasztroenterológiai kivizsgálás után. Itt sor kerülhet az aspecifikus barrierregenerációs táplálási ajánlások megfogalmazására is. Fontos tudni, hogy a fent javasolt, társadalombiztosítási támogatással elérhető készítmények többsége már háziorvosi kompetenciában is felírható hazánkban.A komplexebb refrakter eseteket mindenképp javasolt táplálásterápiás országos centrumba irányítani, ahol a specifikus diagnosztikai modalitások mindegyike elérhető, illetve megfelelő tapasztalat áll rendelkezésre ezek klinikai interpretációjára is. Ezen komplex eseteket tapasztalatunk szerint interdiszciplináris táplálásterápiás teamek keretében lehet hatékonyan megoldani, ahol nemcsak a megfelelő nemzetközi kitekintés és prospektív tapasztalatgyűjtés, protokollszerű szervezett működés, illetve szoros, teamen belüli kommunikáció megoldott.
Irodalom
2. Dale HH, Laidlaw PP. The physiological action of b-imidazolylethylamine. J Physiol 1910; 41: 318–341.
3. Ackermann D. Über den bakteriellen Abbau des Histidin. Hoppe-Seylers. Z Physiol Chem 1910; 65: 504–510.
4. Ehrlich P. Beitrage Zur Kenntniss der Granulirten Bindegewebszellen und der Eosinophilen Leukocythen. Arch Anat Physiol Physiol 1879; 6: 166–169.
5. Jacques LB, Water ET. The identity and origin of theanticoagulant of anaphylactic shock in the dog. J Physiol (London) 1941; 99: 454–466.
6. Franco CB, Ching-Cheng C, Drukker M, Weissman IL, Galli SJ. Cell Distinguishing mast cell and granulocyte differentiation at the single-cell level. Stem Cell 2010 Apr 2; 6(4): 361–8.
7. Borriello F, Iannone R, Marone G. Histamine release from mast cells and basophils. Handb Exp Pharmacol 2017; 241: 121–139.
8. Naganuma F, Nakamura T, Yoshikawa T, Iida T, Miura Y, Kárpáti A, Matsuzawa T, Yanai A, Mogi A, Mochizuki T, Okamura N, Yanai K. Histamine N-methyltransferase regulates aggression and the sleep-wake cycle. Sci Rep 2017; 7: 15899.
https://doi.org/10.1038/s41598-017-16019-8
9. M Okayama, K Yamauchi, K Sekizawa, H Okayama, H Sasaki, N Inamura, K Maeyama, T Watanabe, T Takishima, K Shirato. Localization of histamine N-methyltransferase messenger RNA in human nasal mucosa. J Allergy Clin Immunol 1995 Jan; 95(1 Pt 1): 96–102.
https://doi.org/10.1016/s0091-6749(95)70157-5
10. Parsons ME, Ganellin CR. Histamine and its receptors. Br J Pharmacol. 2006 Jan; 147(Suppl 1): S127–35.
https://doi.org/10.1038/sj.bjp.0706440
PMID: 16402096; PMCID: PMC1760721.
11. Poli E, Pozzoli C, Regina G, Menozzi A, Roncoroni L, Coruzzi G. Dualistic H1-mediated effect of histamine on the human isolated intestine. Inflamm res 2006; 55: S65–S66.
https://doi.org/10.1007/s00011-005-0045-x
12. Fabisiak A, Włodarczyk J, Fabisiak N, Storr M, Fichna J, Targeting Histamine Receptors in Irritable Bowel Syndrome: A Critical Appraisal. J Neurogastroenterol Motil. 2017 Jul; 23(3): 341–348.
13. Chen M, Ruan G, Chen L, Ying S, Li G, Xu F, Xiao Z, Tan Y, Lv L, Ping Y, Cheng Y, Wei Y. Neurotransmitter and Intestinal Interactions: Focus on the Microbiota-Gut-Brain Axis in Irritable Bowel Syndrome. Front Endocrinol (Lausanne) 2022 Feb 16; 13: 817100.
https://doi.org/10.3389/fendo.2022.817100.
14. David A Khan: Chronic spontaneous urticaria: Treatment of refractory symptoms. UpToDate 2022 (Wolters Kluwer).
15. Yanase Y, Morioke S, Iwamoto K, Takahagi S, Uchida K, Kawaguchi T, Ishii K, Hide I, Hide M. Histamine and Toll-like receptor ligands synergistically induce endothelial cell gap formation by the extrinsic coagulating pathway. J Allergy Clin Immunol 2018; 141(3): P1115-1118.E7.
16. Schink M, Konturek PC, Tietz E, Dieterich W, Pinzer TC, Wirtz S, Neurath MF, Zop Y. Microbial patterns in patients with histamine intolerance Journal of Physiology Pharmacology 2018 Aug; 69(4).
https://doi: 10.26402/jpp.2018.4.09.
17. Bán O, Lisziewicz J, Nyúl D, Peták I, Tordai A, Baffy Gy, Schwab R. A bélmikrobiom szerepe az alkoholos és nem alkoholos zsírmáj kialakulásában, progressziójában. Central European Journal of Gastroenterology and Hepatology 2019; 5(3).
https://doi.org/10.33570/CEUJGH.5.2.129
18. El-Zayat SR, Sibaii H, Mannaa FA. Toll-like receptors activation, signaling, andtargeting: an overview Bulletin of the National Research Centre 2019; 43: 187.
https://doi.org/10.1186/s42269-019-0227-2.
19. Hanslin K, Sjölin J, Skorup P, Wilske F, Frithiof R, Larsson A, Castegren M, Tano E, Lipcsey M. The impact of the systemic inflammatoryresponse on hepatic bacterial eliminationin experimental abdominal sepsis Intensive Care Medicine Experimental 2019; 7: 52.
https://doi.org/10 .1186/s40635-019-0266-x
20. Schwab R. Az intesztinális barrier és a mikrobiom szerepe reaktív gyulladásos kórképek patogenezisében. mikrobiomakademia.hu; Révész A. A táplálás terápia gyakorlata a barrier-regeneráció vonatkozásában – esetbemutatások. mikrobiomakademia.hu
21. Jarecsny T, Trencséni D, Peták I, Mechtler L, Frecska E, Schwab R. A mikrobiom-asszociált gyulladás és a migrén: a bél–agy tengely újabb állomása? Central European Journal of Gastroenterology and Hepatology 2022; 8(1).
https://doi.org/10.33570/CEUJGH.5.2.129
22. van Hemert S, Verwer J, Schütz B. Clinical Studies Evaluating Effects of Probiotics on Parameters of Intestinal Barrier Function. Advances in Microbiology 2013; 3(2): Article ID: 32433, 10.
https://doi.org/10.4236/aim.2013.32032
23. Martins P. Glutamine in critically ill patients: is it a fundamental nutritional supplement? Rev Bras Ter Intensiva 2016 Apr-Jun; 28(2): 100–103.
https://doi.org/10.5935/0103-507X.20160022
24. Wang B, Wu G, Zhou Z, Dai Z, Sun Y, Ji Y, Li W, Wang W, Liu C, Han F, Wu Z. Glutamine and intestinal barrier function Amino Acids 2015; 47: 2143–2154.
25. Jian ZM, Cao JD, Zhu XG, Zhao WX, Yu JC, Ma EL, Wang XR, Zhu MW, Shu H, Liu YW. The impact of alanyl-glutamine on clinical safety, nitrogen balance, intestinal permeability, and clinical outcome in postoperative patients: a randomized, double-blind, controlled study of 120 patients JPEN Journal of Parenteral and Enteral Nutrition 1999 Sep-Oct; 23(5 Suppl): S62–6.
https://doi.org/10.1177/014860719902300516
