The role of pathologists in the determination of the biomarkers of colorectal tumors
Summary
Nowadays, histopathological samples do not only serve pathological diagnostics, but are also subjects of biomarker tests for prognosis and prediction of drug effects. Based on a recently published guide line, we review the practice of pathological biomarkers assessment of colorectal tumours. In view of its importance, particular attention is paid to the aspects of microsatellite instability.
Napjainkban a kórszövettani minták nemcsak a patológiai diagnosztikát szolgálják, hanem azokból történnek prognózist és gyógyszerhatást előre jelző biomarker-vizsgálatok is. Nemrégiben megjelent útmutató mentén tekintjük át a colorectalis daganatok biomarkereinek patológiai meghatározási gyakorlatát. Jelentősége miatt kiemelt figyelmet szentelünk a mikroszatellita instabilitás aspektusainak.
A colorectalis rákok (CRC), hasonlóan a többi rosszindulatú megbetegedéshez az egymást követő genetikai és epigenetikai változások során jönnek létre, amelyek kialakulásáért örökletes és környezeti tényezők együttesen felelősek. Az érintett molekulákat kódoló gének mutációi, amelyek a sejtes proliferáció, differenciáció, érújdonképződés, invázió és áttétképződés felelősei, a szövettani mintákból kimutatható biomarkerként használhatóak a pontosabb diagnózis, a prognózis és a gyógyszerhatásosság előrejelzése, vagyis a perdikáció céljaira.
Az epidermális növekedési faktor receptor (EGFR) gátlás lehetőségének beépülése a hagyományos kemoterápiás kezelések közé, valamint a biomarkerekkel kapcsolatban felhalmozódott tömeges ismeretanyag szükségessé tette a bizonyítékokon alapuló meghatározás gyakorlatának kidolgozását. Ezt a munkát a The American Society for Clinical Pathology (ASCP), College of American Pathologists (CAP), Association for Molecular Pathology (AMP), and American Society of Clinical Oncology (ASCO) szakértői végzeték el. Útmutatójukat – amelyet Intézetünk is átvett – 21 súlyozott javaslatként, mint
I. erősen ajánlott,
II. ajánlott,
III. szakértői konszenzus és
IV. nem ajánlott, fogalmazták meg, létrehozva a CRC molekuláris biomarkereinek meghatározási standardját (1).
Bár a javaslatok hosszasan részletezett sora lefedi a biomarker-meghatározás folyamatának egészét, a módszertantól az eredmények interpretációján át a vizsgálandó markerekig, lehetőségünk van azt tömbösítve áttekinteni és a legfontosabb vizsgálatokat példákkal is alátámasztani. Továbbá mód nyílik az abban még csak feltörekvőként említett immunterápia markereire is kitérni. Nyugodtan elmondhatjuk, hogy mindezen vizsgálatok jelen vannak a hazai patológiai gyakorlatban és az onkoteameken keresztül el is érhetőek.
A szöveti alapú biomarker-meghatározás standardjai
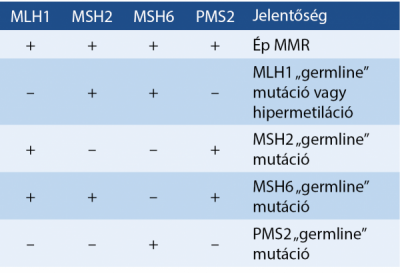
Az erős ajánlást (I.) négy olyan szempont kapott, amelyek alapvetően a CRC biomarker-meghatározás validációjának szükségességét húzzák alá, hangsúlyozva azt, hogy annak egészét az általános laboratóriumi minőségbiztosítási rendszerbe kell beépíteni. Hangsúlyos szerepe van az MLH1, MSH2, MSH6, PMS2 immunhisztokémiai (IHC) vizsgálatok validációjának, utalva a mikroszatellita instabilitást (MSI) okozó, DNS-hibajavító mistmatch repair gének (MMR) meghibásodásának a CRC klinikumában játszott szerepére.
Tekintettel arra, hogy napjainkra a National Comprehensive Cancer Network (NCCN) Guideline is megfontolásra javasolja a minden hetven év alatti, vagy második stádiumú és legújabban az áttétes colontumoros beteg esetén a mikroszatellita státusz meghatározását, függetlenül a családi halmozódástól, ezért azt részletesen is áttekintjük.
A mikroszatellita instabilitás és meghatározása
A mikroszatelliták a genomban százezres nagyságrendben elszórt olyan, aminosavat nem kódoló, egy-, két-, három-, négyszeres nukleotid ismétlődések, amelyek a sejtosztódás során meglehetős szigorúsággal megtartják ismétlődés számukat. Tehát ha egy osztódó sejtben az arra a lókuszra jellemző dinukleotid repeat ötször ismétlődik, akkor ez az osztódás utáni sejtekben is konzervatívan így marad.
A genom azonban folyamatosan károsodik. Igen hamar működésképtelenné válna, ha nem lennének DNS-kijavító mechanizmusok, amelyek közül napjainkban hatot ismerünk s ezek közül egyik az MMR-rendszer. Amennyiben ennek legfontosabb génjei, az MLH1, MSH2, MSH6 és a PMS2 károsodnak, nem lesznek képesek kijavítani a folyamatosan keletkező DNS-hibákat és ez legnyilvánvalóbban a mikroszatellita lókuszokon fog megjelenni. Ugyanis egy ép enzim is hajlamos – hasonlóan az emberi szemhez amikor monoton ismétlődő értelmetlen betűsort kell olvasnia – eltévedni, hát még egy mutáns! Példánkban, ha az utódsejtekben a dinukleotidok nem ötször, hanem attól sejtenként eltérő számban ismétlődnek, felborul a karakterisztikus konzervativizmus, vagyis MSI jön létre. Az MSI közvetlen vizsgálatára az ún. Bethesda-konszenzus panel alkalmas, amely 5+5 mikroszatellita marker PCR-vizsgálatát jelenti. Használatával lehet különbséget tenni az alacsony MSI-daganat (MSI low) ahol egy, illetve a magas (MSI high) tumor közt, ahol kettő, vagy annál több mikroszatellita lókusz érintett. Ezek a kis DNS-szakaszhossz-változások a fehérjére történő átíródás során ún. keret leolvasási eltéréseket is okoznak, vagyis további mutációk generálódnak, létrehozva a „hipermutációs fenotípust”. Az IHC-vel kimutatható fent részletezett gének fehérjetermékeinek hiánya utalhat az MSI-re és egyben oki magyarázatul is szolgálhat annak kialakulására, de nem informatív azon ritka esetekre, ahol más enzimek érintettek vagy eltérő a kiváltó ok.
A vizsgálatot ezért az elsőként IHC-vel érdemes kezdeni
(1. ábra) és annak bizonytalansága esetén alkalmazni a PCR-technikát (2. ábra).
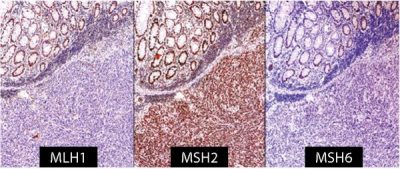
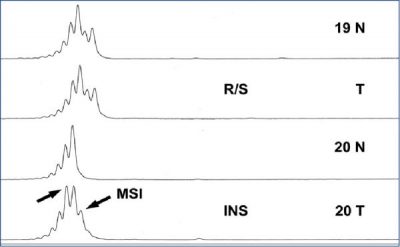
- Az MSI okozta hipermutációs állapot a CRC-k 15%-ában a karcinogenezis fő útvonalaként szerepel. Lehet sporadikus, többnyire MLH1-mutáció és promóter hipermetiláció okozta funkciókiesés vagy autoszomális domináns öröklődésű az MMR-gének csírasejtes mutációja miatt. Ez utóbbi a Lynch-szindróma (veleszületett nem polipózis révén keletkező CRC) amikor is a daganatok korábbi életkorban jelentkeznek, felgyorsult karcinogenezissel, gyakran szinkron vagy metakrón tumorok társulásával.
Az MSI-karcinómák klinikai és patológiai jellemzői eltérnek a mikroszatellita stabil daganatokétól. Immunterápiás vonatkozásaikra önálló alfejezetben térünk ki. Klinikailag jobb prognózisúak, kisebb az áttétet képző hajlamuk és úgy tűnik, bár a kérdésben nagy a bizonytalanság, nem befolyásolja az 5-fluorouracil terápia hatékonyságát (2). Érdekes módon a második stádiumú daganatok nagyobb arányban mutatnak MSI-t mint az előrehaladott daganatok (3).
Felismerésében a következők segíthetnek: - A klinikumban: az Amsterdam-kritériumok (szinkron és metakron daganatok jelenléte, fiatal életkor [<50 év], két első vagy másodági rokon MSI karcinómája) keresése. Predikciót a PREMM5 (PREdiction Model for gene Mutations) számítógépes modell tud adni (4).
- A makroszkópos kép: jobb colonfél-lokalizáció, mucinosus megjelenésű daganat.
- A mikroszkópos kép: rosszul differenciált tumor, mucinosus, pecsétgyűrűsejtes, medullaris morfológia, TIL-jelenség (tumort infiltráló limfociták), Crohn-szerű gyulladásos válasszal.
Amennyiben a fent részletezett tulajdonságok alapján felmerül mikroszatellita instabilitás lehetősége, javasolt az IHC (1. ábra). Az esetek kb. 90%-ában az MLH1- és MSH2-mutáció áll a háttérben, amelyhez a partner MMR-gén destabilizációja is társulhat (MLH1 esetén a PMS2, MSH2 esetén MSH6) (1. táblázat).
Habár a kettes immunhisztokémiai panel (MLH1, MSH2) érzékenysége jó, a legmagasabb érzékenységet a 4-es panel alkalmazásával lehet elérni. Ha pozitív a reakció, akkor kiegészítő BRAF V600 mutációanalízis történik, mivel érintettsége erősen valószínűsíti a sporadikus kiindulást, de hiánya nem zárja ki a Lynch-szindrómát.
Az MSI irányában végzett IHC-vizsgálat értékelése:
• egy vagy több marker hiánya, pozitív endogén kontroll mellett → MSI,
• pozitív endogén kontroll mellett gyenge magreakció és citoplazma-pozitivitás → protein destabilizációjára utal,
• erős festődés a daganatsejtek magjában pozitív endogén kontroll mellett → mikroszatellita stabil a daganat.
A colorectalis tumorok elfogadott biomarkerei
A konkrét biomarkerekre vonatkozó javaslatok, ajánlásként (II.) súlyozódtak a Molecular Biomarkers for the Evaluation of Colorectal Cancer standardjai közt: Minden olyan betegnél akinek anti-EGFR-kezelésre kerülne sor, meg kell határozni a „kiterjesztett RAS-panelt” (KRAS és NRAS 12, 13, 59, 61 117 és 146-os kodon), valamint prognosztikus célból a BRAF p. V600-mutációt, amit MLH-1 proteinvesztés immunhisztokémiailag igazolt vesztése esetén is javasol a Lynch-szindróma valószínűségének vizsgálatára. (Mint fentebb láttuk a BRAF-mutáció erősen támogatja a sporadikus kialakulás valószínűségét, de a hiánya biztonsággal nem zárja ki a szindrómáét.) A KRAS- és BRAF-mutációk colorectumon belüli eloszlásáról szemléletes ábrát közöltek Yamauchi és munkatársai
(3. ábra) (5).
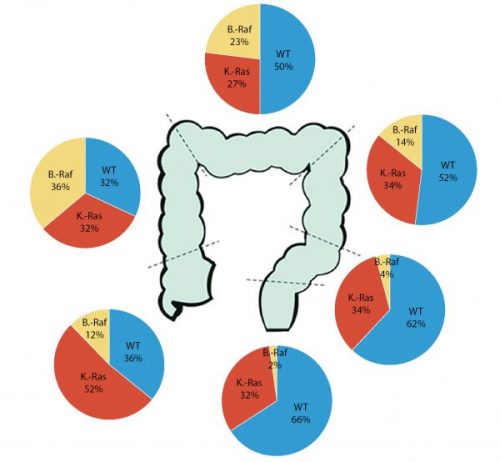
Ugyanakkor a három (IV) nem ajánlott vizsgálat közé a BRAF mutáció meghatározás, mint elégtelen anti-EGFR kezelés predikció szintén bekerült, mert arra vonatkozóan nincs elégséges adat, hogy negatív előrejelzőként szerepelhessen. Ugyan így sem a PIK3CA-mutáció analízisnek sem a PTEN-vesztésnek (meghatározása történjen az IHC-val vagy FISH-sel) sincs még elég bizonyítéka a terápiás döntések vonatkozásában. (Természetesen a klinikai vizsgálatokat leszámítva.) Bár a PIK3CA-mutációval kapcsolatban megjegyzik, hogy retrospektív vizsgálatok hosszabb túlélést mutattak aszpirint szedők esetén (1).
A biomarker-meghatározás gyakorlata
A további tizenegy javaslat a (III.) vizsgálók konszenzusos véleményén alapult: Irodalmilag alátámasztott evidenciának tekinthetjük, hogy a biomarker-meghatározásoknak lehetőleg az áttétből, vagy a kiújuló daganatból kell történnie, lehetőleg a paraffinos szövetblokkból. A sejtkenetek és sejtblokkok abban az esetben használhatók, ha erre vonatkozóan is validálták az eljárást. Patológusnak kell kiválasztani a megfelelő szövetblokkot, jelölve a vizsgálatra alkalmas területet, meghatározva a minta daganatsejt/normálsejt arányát.
A vizsgáló laboratóriumnak pedig a CRC 5%-os tumorsejt aránya esetén is ki kell tudni mutatni a kérdéses mutációt. Mindezt a minta beérkezését követő tíz munkanapon belül és az eredményeket érthetően, a Human Genom Organisation nomenklatúráját követve kell dokumentálni.
Ugyanakkor beszédes az is, hogy az ASCP, CAP, AMP, ASCO szakértői a tobzódó biomarkerek világában (a ma még) megfelelő erejű bizonyítottság hiányában olyanokra nem tett ajánlást, mint pl. vascular endothel growth factor (VEG-F), insulin-like growth factor (IGF), micro RNA, CpG island metilátor fenotípus (CIMP), HER2, kromoszomális instabilitás (CIN), loss of heterozigozity (LOH). Továbbá csak az invazív daganatokra vonatkozó adatokat értékelték olyan esetekben, ahol az összehasonlító karon legalább ötven beteg szerepelt.
Az imunterápia biomarkerei
Régóta ismert, hogy a tumort infiltráló limfociták (TIL) jelenléte összefügg a jobb prognózissal. Az MSI-daganatok állományában megfigyelhető intenzív jelenlétük utal arra, hogy a mutációs fenotípus számos, a gazdaszervezet számára új fehérjét kreálva, az citotoxikus immunválaszt indít a tumor megsemmisítésére. Ha azonban az eliminációs fázis nem tökéletes, akkor kisszámú daganatsejt visszamarad, ami az egyensúlyi fázis során az immunellenőrző ponton keresztül kikapcsolja a védekező mechanizmust, vagyis immuntolerabilitást vált ki.
Az immunellenőrző pont két legjobban ismert receptora a PD-1, aminek ligandja a PD-L1, valamint a CTLA-4. Amennyiben gátoljuk ezeket a ma már gyógyszerként is alkalmazható ipilimumab, nivolumab vagy prembrolizumab monoklonális antitestekkel, kikapcsolva az immunsejtek programozott sejthalálát, fokozott T-sejt-aktivációt, következményes tumorellenes választ kapunk.
Az MSI low-daganatok viszonylag kevés molekuláris különbséget hordoznak az MSS-tumorokhoz képest ezért immunológiai vonatkozásban egy csoportként kezelhetőek (6). Az MSI high tumorok immunogenitása miatt az MRR analízise prediktív, s mivel az IHC közel 95%-os konkordanciát mutat az aranystandardként kezelt PCR-rel, az a fentiek figyelembevételével, végezhető.
Az MSI-daganatok immunkezelésének sikerességét az is fokozhatja, hogy e tumorok szignifikánsan nagyobb számban fejeznek ki ilyen receptor ligandokat, és az állományi TIL-en is jelentősebb a receptor és ligand expresszió mint az MSS-esetekben (7, 8). A PD-1 és PD-L1-tumorsejt vagy TIL felszíni jelenléte, ha nem is szoros, de összefüggést mutat az immunterápia sikerességével a melanoma, tüdő- vagy vesetumorok esetében (9). Ezekhez képest a colorectalis daganatok kisebb arányban mutatnak PD-L1-pozitivitást és negatív esetben is várható objektív tumorválasz (10, 11). Ezen biomarkerek meghatározása új az IHC gyakorlatában. Néha nagyon kis jelekre kell figyelemmel lenni szigorú, esetenkénti párhuzamos kontrollok mellett, speciális, többnyire antitest és gyártó függő értékelését végezve. Sőt magát a gyógyszerbefogadást lehetővé tevő klinikai vizsgálatot is egy meghatározott antitesttel végezve (nem colorectalis daganat esetén) először fordult elő, hogy egy biomarker határozta meg az adható gyógyszert! Ezt megelőzendő a terápia- vezérelt onkológia korában az onkoteamnek kell a biomarker vonatkozásában is döntést hoznia.
Az onkoteam szerepe
A colorectalis tumoros betegek megfelelő színvonalú kezelése az ellátásukban résztvevő valamennyi résztvevő, így a gasztroenterológus, radiológus, sebész, onkoradiológus, patológus és onkológus szoros együttműködésével lehetséges. Egyetemünkön a 90-es években kezdődött el a közös munka, amelynek eredményeiről 2001-ben számoltunk be (12).
Az esetek tárgyalásakor a teljes klinikai dokumentáció, röntgen, ultrahang és CT-leletek mellett, felhasználjuk a patológiai dokumentációt is (makrofotók, leletek, digitalizált szövettani metszetek, immunhisztokémiai reakciók). Szükség esetén a terápia- vezérelt gyógyítás céljából újabb biomarkerek meghatározását is indikálhatjuk. Műtétre csak a team valamennyi tagjának írásos beleegyezésével kerülhet az összes beteg. Az onkoteamek munkáját 1/2012. (V. 31.) EMMI rendelet szabályozza.
2. Webber EM, Kauffman TL, O’Connor E, Goddard KA. Systematic review of the predictive effect of MSI status in colorectal cancer patients undergoing 5FU-based chemotherapy. BMC Cancer 2015; 15: 156.
3. Thibodeau SN, Bren G, Schaid D. Microsatellite instability in cancer of the proximal colon. Science 1993; 260: 816–819.
4. Kastrinos F, Uno H, Ukaegbu C, et al. Development and Validation of the PREMM5 Model for Comprehensive Risk Assessment of Lynch Syndrome. J Clin Oncol 2017; 35: 2165–2172.
5. Yamauchi M, Morikawa T, Kuchiba A, et al. Assessment of colorectal cancer molecular features along bowel subsites challenges the conception of distinct dichotomy of proximal versus distal colorectum. Gut 2012; 61: 847–854.
6. Laiho P, Launonen V, Lahermo P, et al. Low-level microsatellite instability in most colorectal carcinomas. Cancer Res 2002; 62: 1166–1170.
7. Lal N, Beggs AD, Willcox BE, Middleton GW. An immunogenomic stratification of colorectal cancer: Implications for development of targeted immunotherapy. Oncoimmunology 2015; 4: e976052.
8. Llosa NJ, Cruise M, Tam A, et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints. Cancer Discov 2015; 5: 43–51.
9. Obeid JM, Erdag G, Smolkin ME, et al. PD-L1, PD-L2 and PD-1 expression in metastatic melanoma: Correlation with tumor-infiltrating immune cells and clinical outcome. Oncoimmunology 2016; 5: e1235107.
10. Rosenbaum MW, Bledsoe JR, Morales-Oyarvide V, et al. PD-L1 expression in colorectal cancer is associated with microsatellite instability, BRAF mutation, medullary morphology and cytotoxic tumor-infiltrating lymphocytes. Mod Pathol 2016; 29: 1104–1112.
11. de Guillebon E, Roussille P, Frouin E, Tougeron D. Anti program death-1/anti program death-ligand 1 in digestive cancers. World J Gastrointest Oncol 2015; 7: 95–101.
12. Balogh Á, Kahán Zs, Maráz A, et al. A colorectalis tumorok multidisciplináris kezelése. Orv Hetil 2001; 142: 547–555.
