Összefoglaló közlemények / Reviews
Update on autoimmune hepatitis: diagnosis and therapy
Summary
Autoimmune hepatitis (AIH) is a rare, immune-mediated, chronic inflammatory liver disease of unknown origin, characterised by elevated serum transaminase levels, hypergammaglobulinaemia, the presence of circulating autoantibodies, and distinctive histological findings, such as lymphoplasmacytic infiltrate with interface hepatitis. Clinical presentation of the disease is heterogenous and may pose diagnostic dilemmas. AIH requires lifelong treatment in a significant proportion of patients. The aim of treatment is to prevent the progression of liver disease (decompensated cirrhosis) and to avoid the need for liver transplantation. The management and care of AIH is often a professional challenge for the treating physician and requires an individualized approach. The cornerstone of drug therapy is steroid treatment to induce remission followed by maintenance therapy with azathioprine. This standard treatment regime has been proven to be effective in most of the cases. The goal of treatment is to achieve complete biochemical remission, defined by concomitant normalisation of transaminase and IgG levels to below the upper limit of normal (ULN). Close monitoring of both clinical signs and laboratory results is recommended after treatment initiation because of the potential side effects. Intolerance (10%) or a lack of response (15%) to standard therapy may require second- or third-line treatment with other immunosuppressive agents. In this regard, guidelines are less well-defined, and there is considerable variation in clinical practice. If there is uncertainty about the diagnosis or if the disease does not respond well to standard treatment or is otherwise difficult to treat, early contact and professional consultation with a specialist centre is strongly recommended. An international panel of experts may also be involved within the framework of the European Reference Network for Rare Liver Diseases (ERN RARE-LIVER), using a remote consultation system (CPMS).
Összefoglalás
Az autoimmun hepatitis (AIH) egy ritka, ismeretlen eredetű, immunmediált, krónikus gyulladással járó májbetegség, amelyet az emelkedett szérum-transzaminázszintek és a globulinszaporulat (immunglobulin G/gamma-globulin), a keringő autoantitestek jelenléte és a jellegzetes májszövettani eltérések – mint lymphoplasmocytás infiltrátum interface hepatitisszel – jellemeznek. A betegség változatos megjelenési formája miatt a diagnózis felállítása nehéz. Az AIH a betegek jelentős részében életre szóló kezelést igényel. A kezelés célja pedig a májbetegség progressziójának megakadályozása (dekompenzált májcirrózis kialakulása) és májátültetés szükségességének elkerülhetősége. Az AIH kezelése és gondozása sokszor jelent szakmai kihívást a kezelőorvos számára, és egyénre szabott megközelítést igényel. A gyógyszeres terápia sarokköve a remisszió indukciójára szolgáló szteroidkezelés, majd pedig a remisszió fenntartására az azatioprinkezelés beépítése. Ez a standard kezelés az esetek jelentős részében hatékony, a célja pedig a teljes biokémiai remisszió elérése, amelyet a transzaminázszintek és az IgG együttes normalizálódása jellemeznek. Az alkalmazott terápiák nem mentesek a mellékhatásoktól, ezért a kezelés indítása után mind a klinikai tünetek, mind pedig a laboratóriumi eredmények szoros követése javasolt. A standard terápia esetén kialakuló intolerancia (10%) vagy a terápiás válasz hiánya (15%) másod- vagy akár harmadvonalbeli kezelést is szükségessé tehet, egyéb immunszuppresszív szerek alkalmazásával. Ezekre vonatkozóan az iránymutatások kevésbé jól meghatározottak, és jelentősek a különbségek a klinikai gyakorlatban. Ha a diagnózis felállítása során bizonytalanság merül fel, vagy ha a betegség a standard kezelésre nem reagál megfelelően, vagy egyéb okok miatt a beteg nehezen kezelhető, mindenképpen javasolt a korai kapcsolatfelvétel és szakmai konzultáció szakértői központtal. A Ritka Májbetegségek Európai Referenciahálózatának (ERN RARE-LIVER) keretein belül nemzetközi szakértői panel bevonására is sor kerülhet távkonzultációs rendszer (CPMS) használatával.
Bevezetés
Az autoimmun hepatitis (AIH) egy ritka, ismeretlen eredetű, immunmediált, krónikus gyulladással járó májbetegség, amely elsősorban nőket érint. Kialakulása független az életkortól és a rassztól. Európában a betegség prevalenciája 16-18/100 000 lakos. Jellegzetes a társuló autoimmun megbetegedések jelenléte, az esetek mintegy 20%-ában. A fő patofiziológiai mechanizmusnak a máj-autoantigének elleni toleranciavesztést tartják, amelyet genetikailag fogékony egyénekben környezeti faktorok idézhetnek elő (1). A sikeres kezelés feltétele a biztos diagnózis, amelynek felállítása gyakran hosszadalmas, és számos nehézséggel járhat. A standard terápia az esetek 25%-ában nem hatékony, így másod- vagy akár harmadvonalbeli kezelés is szükségessé válhat.
A jelen összefoglaló célja, hogy a gasztroenterológus és hepatológus kollégák számára iránymutatással szolgáljon az AIH pontos diagnózisának felállításában és kezelésében.
Az AIH diagnosztikája
Az AIH diagnózisa betegségspecifikus markerek hiányában komplex módon, különféle klinikai, biokémiai, immunszerológiai és hisztológiai jellegzetességek együttese alapján és egyéb májbetegség fennállásának kizárásával történik. Több mint 25 évvel ezelőtt egy szakértői panel, az International Autoimmun Hepatitis Group (IAIHG) (2) megalkotta a betegség diagnosztikus kritériumait, amelyet 1999-ben (3) átdolgoztak. Ezt a klinikai pontrendszert elsősorban kutatási céllal alkották meg, hogy a klinikai vizsgálatokba homogénebb AIH-s betegcsoportokat lehessen létrehozni. Alkalmazását a mindennapi klinikai gyakorlatban ugyan nehézkesnek tartják, mi magunk továbbra is rendszeresen használjuk. Az IAIHG a fenti okok miatt 2008-ban egy egyszerűsített, ismételten átdolgozott pont- (score-) rendszert (4) hozott létre, amely 4 paramétert értékel együttesen (1. a különféle autoantitestek jelenlétét, 2. az IgG-szintet, 3. a szövettani eredményt és 4. a vírushepatitis kizárását). Az egyszerűsített pontrendszer szenzitivitását és specificitását 88 és 97%-nak találták 6 küszöbértéknél (valószínű AIH), valamint 81 és
99%-nak ≥7 küszöbértéknél (definitív AIH). Egy független tanulmányban összehasonlították a revideált eredeti és az egyszerűsített pontrendszer diagnosztikus hatékonyságát, és azt találták, hogy az előbbinek jobb a szenzitivitása (100% vs. 95%), míg az utóbbinak a specificitása (90% vs. 73%).
A szerzők arra a következtetésre jutottak, hogy a két pontrendszer komplementer, és a revideált eredeti pontrendszer különösen hasznos azokban az esetekben, amikor kevés vagy atípusos jellegzetességeket mutat az AIH (5). Ennek egyik legjobb példája az akut, súlyos hepatitis formájában jelentkező AIH (AS-AIH), amely mind a szerológiai diagnosztikát, mind pedig a hisztológiai jellegzetességeket tekintve nem mutatja a krónikus AIH-ra jellemző képet. Az AS-AIH-t különösen nehéz elkülöníteni az akut vírushepatitisektől és a gyógyszer okozta májkárosodástól (DILI) (6). Felmerül akár egy új diagnosztikus kritériumrendszer kidolgozásának szükségessége is az AS-AIH hatékonyabb azonosítására. Mindazonáltal napjainkban az AIH diagnózisának felállításában elsősorban az egyszerűsített pontrendszert használják, amelyre ingyenes internetes kalkulátor is elérhető. Az IAIHG átfogó diagnosztikus pontrendszerét és az egyszerűsített diagnosztikus kritériumokat az 1. és a 2. táblázat foglalja össze.
1. táblázat: Az International Autoimmun Hepatitis Group (IAIHG) átfogó diagnosztikus pontrendszere (2, 3)
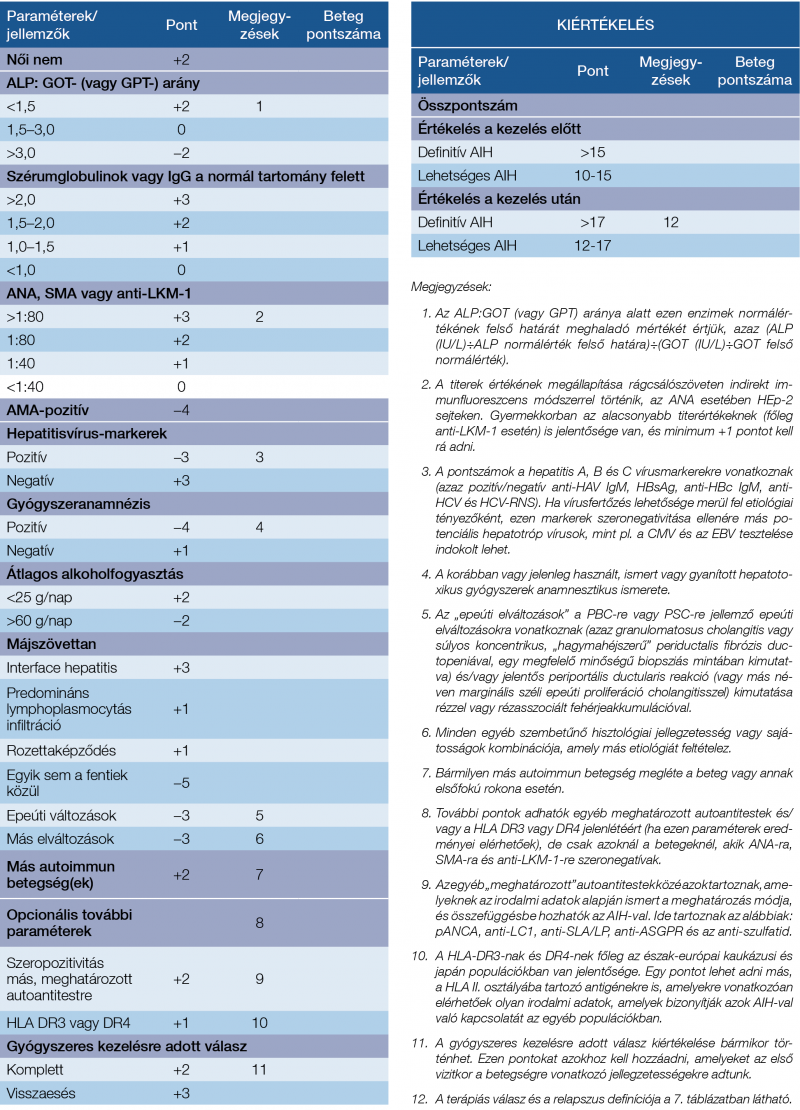
2. táblázat: Az autoimmun hepatitis egyszerűsített diagnosztikus kritériumainak
alternatív laboratóriumi diagnosztikai paraméterekkel kiegészített változata (4).
Az internetes kalkulátor elérhetősége: https://www.mdcalc.com/simplified-autoimmune-hepatitis-aih-score

A laboratóriumi adatok típusosan hepatocelluláris károsodást mutatnak, azaz a transzaminázértékek a mérsékelt emelkedéstől kezdve akár a felső normálérték (upper limit of normal, ULN) 50-szeresét is elérheti. A GPT- (glutamát-piruvát-transzamináz-) érték rendszerint magasabb, mint a GOT (glutamát-oxálacetát-transzamináz). A kolesztatikus májenzimek általában normálisak, vagy csak enyhén emelkedettek, hacsak nem átfedő szindróma (primer biliáris cholangitis, PBC vagy primer szklerotizáló cholangitis, PSC társulása) képében jelentkezik a betegség. Jellegzetesek az immunszerológiai eltérések: a szérumglobulinok (gamma-globulin vagy IgG) emelkedése és a keringő autoantitestek jelenléte, amelyek támogatják a betegség diagnózisát. Ugyanakkor az AIH-ra jellegzetes autoantitestek betegségspecificitása relatíve alacsony, egyéb különféle akut és krónikus májbetegségekben, sőt még egészséges egyénekben is jelen lehetnek. A betegek mintegy 10-15%-ában hiányozhat a gamma-globulin-szaporulat és/vagy a máj-autoantitestek jelenléte (szeronegatív AIH), és csak a betegség lefolyása során, később alakulnak ki az akut betegségkezdet után.
Máj-autoantitestek (7, 8)
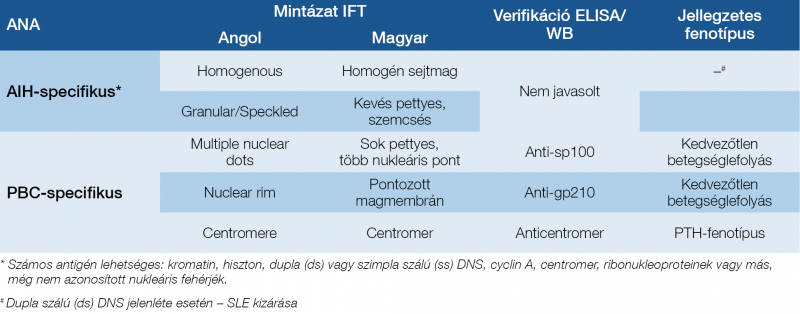
Európában a máj-autoantitestek jelenlétének szűrővizsgálatát hagyományosan indirekt immunfluoreszcens teszt (IFT) segítségével rágcsáló-SKL-preparátumon (stomach/kidney/liver-, gyomor-, vese- és májszövet) és humán epitheliomasejteken (HEp-2) végzik (3. táblázat).
3. táblázat: Jellegzetes antinukleáris antitest (ANA) immunfluoreszcens (IFT) mintázatok HEp-2 sejteken és ezek verifikációs módszerei különböző autoimmun májbetegségekben (7, 8)
Szolidfázis-assay-t (enzimkapcsolt immunoszorbens assay [ELISA] vagy immunoblot) szűrőtesztként kizárólag az anti-SLA/LP (szolúbilis májantigén/máj-pancreas antigén) esetén használnak. Ezen antitestek ugyanis nem detektálhatóak IFT segítségével, ugyanakkor magas specificitással rendelkeznek az AIH diagnosztikájában. Az AIH-betegek 10%-ában az anti-SLA/LP az egyetlen jelen lévő autoantitest.
Az IFT előnye, hogy nemcsak az autoantitest titere, hanem a fluoreszcens mintázata is meghatározható, amelynek az antitest jelenléte mellett kiegészítő értéke van a diagnosztikában. Ugyanakkor az IFT szubjektív módszer, kivitelezése és értékelése abban járatos laboratóriumi szakembert igényel, és a nemzetközi standardok még hiányoznak. Az antitesttiterek az egyes laboratóriumok között különbözőek lehetnek az IFT módszerhez használt eltérő szubsztrátok miatt. Az SKL-preparátumon az alábbi antitesteket lehet kimutatni: antinukleáris antitest (ANA), simaizom elleni antitest (SMA), máj-vese mikroszóma elleni antitest (anti-LKM) és mitokondrium elleni antitest (AMA). Az antitest-pozitivitás küszöbértékének pedig felnőttekben az 1:40 vagy annál magasabb titerértéket tekintik.
Újabb irodalmi adatok alapján mind a HEp-2, mind az ELISA-alapú autoantitest-értékelés lehetséges alternatívája a szöveti metszeteken (SKL-preparátum) végzett IFT-nek az ANA kimutatására, azonban magasabb küszöbértékeket kell alkalmazni, és azokat helyileg validálni. Az ANA ELISA esetén fontos, hogy a kitek HEp-2 nukleáris kivonatokat tartalmazzanak, és ne tisztított antigéneket, az ismeretlen nukleáris antigének felismerése érdekében (9).
Antinukleáris antitest (ANA vagy ANF)
Az ANA volt az első antitest, amelyet felismertek az AIH-val kapcsolatosan, ugyanakkor nem betegségspecifikus. Az AIH-betegek 50-75%-a ANA-pozitív (SMA egyidejű jelenlétével vagy anélkül). Az ANA ugyanakkor, akár magas titerben is, jelen lehet egészséges egyénekben vagy egyéb májbetegség fennállása esetén (nem alkoholos zsírmáj [NAFLD], DILI vagy vírushepatitis). AIH-ban az ANA homogén sejtmag („homogenous”) vagy szemcsés (kevés pettyes, „speckled”) mintázatot mutat. Nem ismert, hogy valamelyik mintázat AIH-specificitása magasabb-e. Az antigének biokémiai differenciálása nem javasolt, mivel sem az AIH betegséglefolyása, sem annak diagnosztikus specificitása nem különbözik az egyes antigének és az ellenük irányuló antitest alapján.
A különféle antinukleáris antitest mintázatokat és nevezéktanukat, valamint a hozzájuk tartozó jellegzetes autoimmun májbetegségeket és verifikációs assay-ket a 3. táblázat tartalmazza.
Simaizom elleni antitest (SMA)Az ANA-hoz hasonlóan az SMA is AIH-ban az egyik elsők között felfedezett autoantitest volt, szintén nem betegségspecifikus, és egyéb májbetegségekben is jelen lehet, mint pl. NAFLD-ben. Az SMA az 1. típusú AIH-betegek 50%-ában jelen van, és van, hogy az egyetlen detektálható antitest. Molekuláris szinten az SMA egy heterogén autoantitest. Az SMA IFT-mintázatok közül a vaszkuláris/glomeruláris (VG) vagy vaszkuláris/glomeruláris és tubuláris (VGT) rajzolatok sokkal inkább specifikusak az AIH fennállására, mint a vaszkuláris (V) mintázat. A VGT mintázat megerősíthető IFT-vel, ha azt fibroblaszt vagy vaszkuláris simaizomsejteken vizsgálják (VSM47).
Továbbá az SMA, amely antifilamentózus aktinra (F-aktin) is mutat pozitivitást, jóval specifikusabb AIH-ra, de az anti-F-aktin egyéb májbetegségekben is előfordulhat. Az SMA-VG/T korrelál az F-aktin-reaktivitással. Az anti-F-aktin antitest jelenléte szolidfázis-assay-vel is megerősíthető (ELISA teszt). Az anti-F-aktin antitestek mikrofilamentumokat (MF) festenek HEp-2 sejteken. Összességében az SMA-pozitivitás érzékenysége és specificitása erősen függ a fluoreszcenciamintázattól, amit a jelenlegi AIH-pontozási rendszerek nem vesznek figyelembe.
Máj-vese mikroszóma elleni antitest (anti-LKM)
Az anti-LKM-1 és -3, valamint az anti-LC1 (májcitoszol) antitestek a betegek kevesebb mint 10%-ában vannak jelen akár egyedileg, akár együttesen, és a 2. típusú AIH szerológiai jellegzetességei. Ha az anti-LC1 az egyetlen jelen lévő antitest, az erősen támogatja a 2. típusú AIH fennállását. Ugyanakkor az anti-LKM-1-hez és -3-hoz hasonlóan az anti-LC1 antitest sem AIH-specifikus, HCV-fertőzés esetén is jelen lehet. Az anti-LKM-1 jelenléte esetén az anti-LC1 IFT során technikai okok miatt nem azonosítható. Az IFT során kimutatott anti-LKM antitestek és az anti-LC1 verifikációjára ELISA vagy WB teszt javasolt.
Mitokondrium elleni antitest (AMA)
Az AMA a primer biliáris cholangitis (PBC) és nem az AIH specifikus szerológiai markere. Az AMA jelenléte a PBC-esetek több mint 90%-ában jelen van. Az AMA azonban aspecifikus módon bármely akut májsérülés vagy akut májelégtelenség esetén kialakulhat, majd idővel eltűnhet az akut májbetegség rezolúciója után. Az AMA-negatív PBC-betegek mintegy felében megtalálható a PBC-specifikus ANA, amelynek azonosítása szintén SKL IFT, majd HEp-2 sejteken történő verifikációval lehetséges a jellegzetes fluoreszcens mintázat alapján. Jellegzetes az ANA IFT-kép HEp-2 sejteken, amelyek megerősítése szintén szükséges szolidfázis-assay-vel is (3. táblázat).
Egyéb, AIH-hoz társuló autoantitestek
Az antineutrofil citoplazmatikus antitestek közül az atípusos p-ANCA (IFT) – különösen, ha az az egyetlen jelenlévő autoantitest – támogathatja az AIH diagnózisát. Ugyanakkor az atípusos p-ANCA is, ahogyan az egyéb autoantitestek, számos egyéb betegségben jelen lehet, mint például gyulladásos bélbetegségek (IBD), primer szklerotizáló cholangitis (PSC) és májcirrózis. Az anti-SLA/LP társulást mutat egy ANA-szubtípussal (anti-Ro52).
A máj-autoantitestek esetén a pontos titer ismerete mind az IFT, mind a szolidfázis-assay-k esetén is fontos, hiszen minél magasabb az érték, annál biztosabb, hogy valódi pozitivitást tükröz. A magasabb autoantitest-értékek az IAIHG diagnosztikus pontrendszerben is magasabb súlyszámokkal szerepelnek. A diagnosztikus értékük mellett bizonyos antitestek az AIH-ban különböző klinikai megjelenési formákkal és eltérő prognózissal társulnak. Mind felnőtt-, mind gyermekkorban az 1. típusú AIH a domináló forma, és az ANA- és/vagy SMA-pozitivitás jellemzi. Az SMA, és különösen az anti-F-aktin antitest jelenléte felnőtt AIH-betegben magasabb gyulladásos aktivitással társul. Ezen eredmény azonban még további validálást igényel. A 2. típusú AIH (az AIH-betegek 5-10%-a) jellegzetessége az anti-LKM-1 antitest jelenléte vagy ritkább esetben az anti-LKM3 vagy anti-LC1 antitestek. A 2. típusú AIH elsősorban fiatalabb életkorban jelentkezik, gyakran gyermekkorban, és sokkal agresszívabb betegséglefolyással társul, mint az 1. típusú AIH.
Továbbra is ellentmondásos, hogy az anti-SLA/LP antitest jelenléte egy különálló, azaz egy ún. 3. típusú AIH-csoportot definiál-e, amely potenciálisan agresszívabb, vagy az 1. típusú AIH-hoz hasonló klinikai betegséglefolyással társul (1. ábra). Terhesség esetén az anti-SLA/LP és az anti-Ro52 antitest jelenlétét a terhesség kedvezőtlen kimenetelével hozták összefüggésbe.
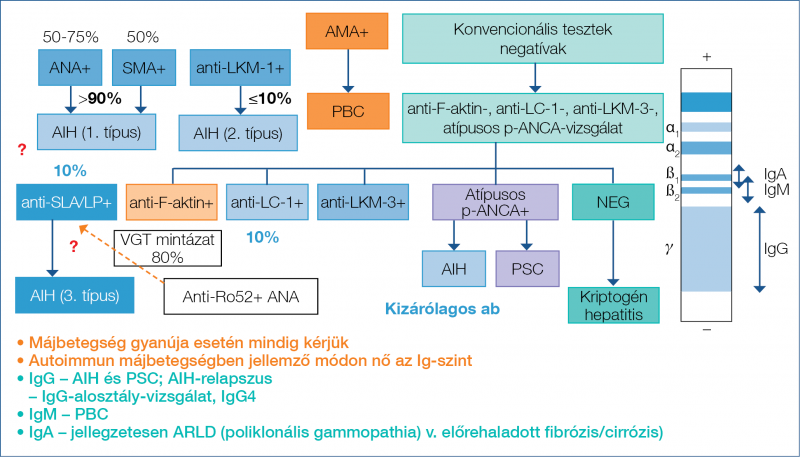
1. ábra: Szérum-autoantitestek autoimmun májbetegségekben (11, 20)
A szerológiai profil alapján meghatározható az autoimmun májbetegség típusa, úgymint autoimmun hepatitis (AIH), primer biliáris cholangitis (PBC) és primer szklerotizáló cholangitis (PSC). Továbbá a betegség egyes altípusai is, mint AIH 1. típus és 2. típus. Az 1. típusú AIH a domináló forma, és az ANA- és/vagy SMA-pozitivitás jellemzi. A 2. típusú AIH (az AIH-betegek 5-10%-a) jellegzetessége az anti-LKM-1 antitest jelenléte, vagy ritkább esetben az anti-LKM-3 vagy anti-LC1 antitesteké. Továbbra is ellentmondásos, hogy az anti-SLA/LP antitest jelenléte egy különálló, azaz egy ún. 3. típusú AIH-csoportot definiál-e. A betegek mintegy 5%-ában az anti-SLA/LP antitest ANA- és/vagy SMA-pozitivitással társul. Az AIH-betegek 10%-ában ez az egyetlen jelen lévő autoantitest.
Felnőttekben a májautoantitest-vizsgálatok ismétlése regulárisan nem javasolt, kivételes esetekben azonban segítséget jelenthet: akut hepatitis esetén a kezdeti szeronegativitás után 3-6 hónappal érdemes a vizsgálatokat ismét elvégezni, ugyanis az autoantitestek a betegség lefolyása során megjelenhetnek. Az AIH variáns formája, amely PBC-szerű jellegzetességet mutat, évekkel később is megjelenhet a kezdetben klasszikus AIH fenotípust mutató esetekben is. A PBC-specifikus ANA és AMA ismételt meghatározása IFT-vel javasolt, ha cholestasis alakul ki újonnan, vagy perzisztál, illetve PBC-re utaló klinikai tünetek jelentkeznek. Felnőttekben a májautoantitest-vizsgálatok a betegség aktivitáskövetésére nem javasolhatóak, mert nem mutatnak összefüggést azzal.
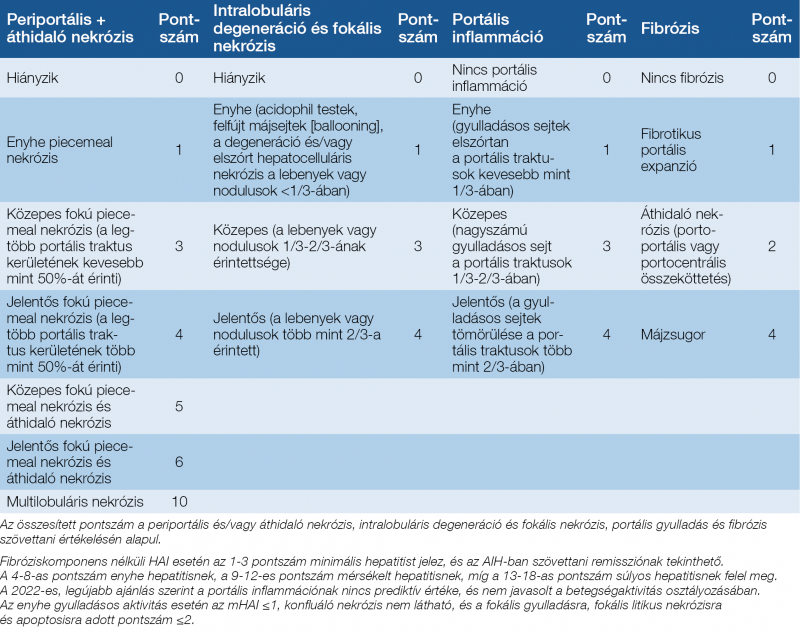
A diagnózis harmadik fontos pillére a májbiopszia szövettani eredménye. Kontraindikáció hiányában a májbiopszia a diagnózis felállításához kötelező, és az immunszuppresszív kezelés megkezdése előtt szükséges azt elvégezni. Egyrészt a jellemző vonások jelenléte (interface hepatitis [lymphocytás piecemeal nekrózis], plazmasejtes infiltráció, hepatocyta-rozettaképződés vagy emperipolesis) támogatja a diagnózist, másrészt segítség az egyéb etiológiájú májbetegségek kizárásában. Fontos a gyulladásos aktivitás (grading) és a fibrotikus stádium (staging) megállapítása, és ezen eredményeknek meghatározó szerepük van a kezelés szempontjából is (10, 11). A 2022-ben, az A. Lohse és munkatársai által publikált szövettani ajánlás az eredeti pontrendszer bizonyos pontjain módosításokat javasol, amelyek klinikai gyakorlatba való átültetése folyamatban van. Pontosították a definitív és lehetséges AIH hisztológiai definícióit, valamint a szövettani aktivitás értékelésére vonatkozóan is ajánlásokat fogalmaztak meg. Az eredeti Ishak-féle pontrendszert és a javasolt módosításokat a 4. táblázat tartalmazza (12).
4. táblázat: Az autoimmun hepatitis szövettani értékelése a krónikus hepatitisekben alkalmazott szövettani aktivitási index (HAI) segítségével (12, 51)
Az akut és elsősorban súlyos AIH (AS-AIH) képében jelentkező betegségformára igaz, hogy az atípusos immunszerológiai lelet mellett a szövettani kép sem típusos. Az IAIHG szövettani pontrendszer használata limitált (lásd bővebben az AS-AIH fejezetben) (13, 14).
Az egyéb etiológiájú májbetegségek kizárása, mint pl. vírushepatitisek, alkoholos májbetegség vagy gyógyszer okozta májkárosodás szintén támogatja az AIH diagnózisát. Ez az anamnézis, a klinikai adatok, a laboratóriumi és hisztológiai adatok együttese alapján lehetséges.
Az AIH kezelése
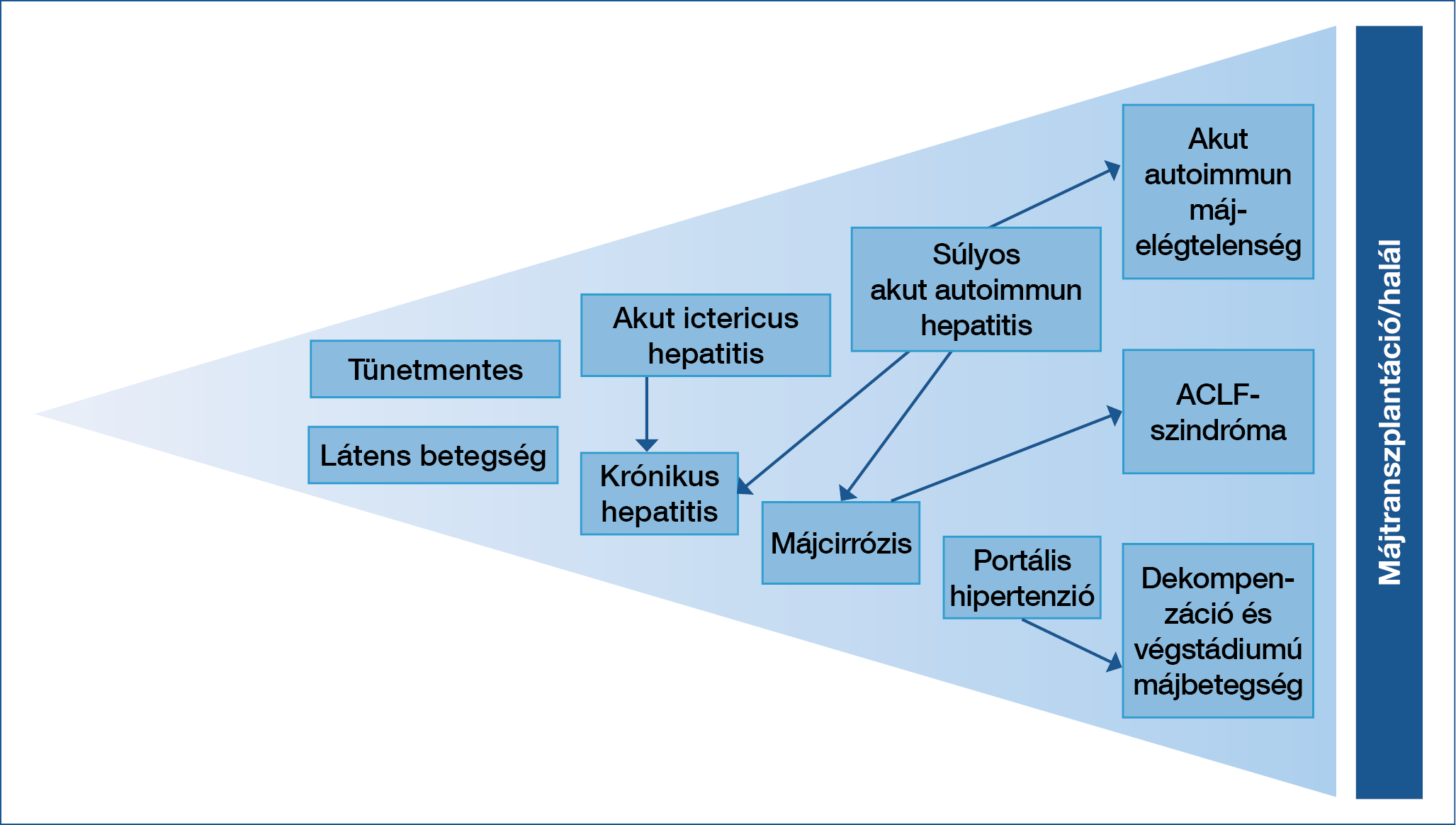
Az AIH ellátása nem egyszerű klinikai feladat. Egyrészt a betegek jelentős részében életre szóló kezelést igényel, és az alkalmazott terápiák nem mentesek a mellékhatásoktól. A betegség klinikai megjelenése ugyanakkor rendkívül sokszínű: a tünetmentes állapottól a heveny, sokszor igen súlyos, akut májelégtelenséggel járó formán keresztül a krónikus májbetegségig és annak előrehaladott stádiumáig (dekompenzált májcirrózis) mindegyik lehetséges (2. ábra).
2. ábra: Az autoimmun hepatitis klinikai megjelenési formáinak spektruma (30)
Az AIH klinikai megjelenése sokrétű: az esetek többségében krónikus hepatitis képében jelentkezik, kisebb százalékban különböző lefolyású akut hepatitis formájában ismerik fel. Kezelés nélkül a legtöbb esetben a folyamat májcirrózisba progrediál. Végstádiumú májbetegség, illetve akut súlyos betegségmegjelenés esetén a beteg állapotától függően májtranszplantáció válhat szükségessé.
Ezek gyakran a betegség gyógyszeres kezelése és a gondozás során eltérő megközelítést tesznek szükségessé.
Az AIH kezelése során felmerülő alapvető kérdések:
- Miért is kell kezelni az AIH-beteget?
- Kell-e kezelni minden AIH-beteget?
- Az AIH kezelésének életre szólónak kell-e lennie?
Korai tanulmányok igazolták, hogy a nem kezelt AIH a májfibrózis progressziójához és cirrózis kialakulásához vezet, amely végül is dekompenzált májzsugort és végstádiumú májbetegséget (end-stage liver disease, ESLD) eredményez, és májátültetést tesz szükségessé. Igazolták azt is, hogy az AIH-betegekben immunszuppresszív szteroidkezelést alkalmazva nemcsak a májenzimek, hanem a tünetek és a túlélés is javult (15, 16, 17). A korai diagnózis és a hatékony kezelés esetén az életkilátások nem romlanak (18). Újabb tanulmányok azt is igazolták, hogy a májfibrózis regressziója is bekövetkezhet, még májcirrózis stádiumában is (19). Ezen adatok alátámasztják az AIH-betegek kezelésének fontosságát. Az amerikai (American Association for the Study of Liver Diseases, AASLD) és az európai májkutató társaság (European Association for the Study of the Liver, EASL) jelenleg aktuális irányelvei ennek fényében a betegség aktivitására utaló biokémiai (GPT >3 ULN) és szövettani (HAI ≥4/18) paraméterek, illetőleg előrehaladott fibrózis, valamint cirrózis fennállása esetén a kezelés mielőbbi megkezdését javasolják. Nem tudjuk azonban, hogy enyhe betegség fennállása esetén (GPT <3 ULN, hisztológiai aktivitási index [HAI] ≤3, és nincs előrehaladott fibrózis) a beteg a kezelésből valóban profitál-e, mivel a tanulmányokba elsősorban a középsúlyos és súlyos betegségaktivitású betegeket vonták be.
Az enyhébb betegség kezelésének kérdése így jelenleg igen ellentmondásos. A terápia indítása mellett szól, hogy szubklinikai betegség is járhat a fibrózis progressziójával, és az ilyen esetekben észlelt kis mértékű aminotranszferáz-emelkedés alábecsülheti a szövettani aktivitás mértékét. A kezelés szükségességének elbírálásához a transzaminázértékek és a szövettan HAI-értéke mellett figyelembe kell venni a hypergammaglobulinaemia mértékét, a tünetek súlyosságát és a lehetséges mellékhatásokat, a társbetegségeket is. Dekompenzált cirrózis fennállásakor szövettani aktivitásra utaló eltérések esetén jön csak szóba immunszuppresszív terápia indítása. A kezelés célja a teljes remisszió elérése a betegség progressziójának megelőzése érdekében (11, 20).
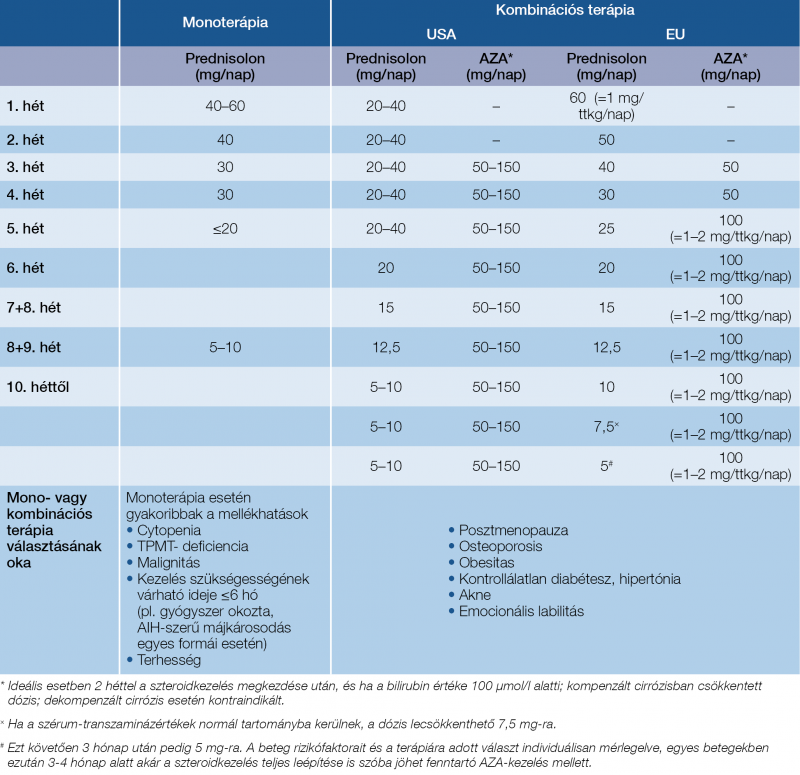
Autoimmun hepatitis elsővonalbeli kezelésében a szteroidokat alkalmazzuk remisszióindukcióra (0,5–1 mg/tskg/nap predniso[lo]ne), míg az azatioprint (AZA) a remisszió fenntartására (1–2 mg/tskg/nap) (11). A fenntartó AZA-kezelés indítását pedig általában a szteroidkezelés megkezdése után 2 héten belül érdemes elkezdeni. A standard immunszuppresszív kezelésre a betegek 75-80%-a általában 6 (de legalábbis 12) hónap alatt jól reagál, májcirrózis esetén ez az arány alacsonyabb: 60-70%. Az optimális dózisok és a kezelési séma tekintetében azonban továbbra is vannak kérdéses pontok (pontos kezdődózis, mono- [AZA] vagy alacsonyabb dózisú, de kombinált [AZA + prednisolon] fenntartó terápia). A budesonid (9 mg/nap) a prednisolonkezelés alternatívája lehet a remisszió indukciójában, de csak nem cirrózisos AIH-betegekben (21). Előnye, hogy a szteroid okozta mellékhatások előfordulása ritkább. A szteroid lépcsőzetes leépítésének módszerét az 5. táblázat tartalmazza.
5. táblázat: A szteroid lépcsőzetes leépítésének módszertana (11, 20)
Autoimmun hepatitisben az immunszuppresszív kezelést általában életre szólóan kell alkalmazni. Annak felfüggesztése után az esetek jelentős részében relapszusra lehet számítani (22). Az immunszuppresszív kezelés felfüggesztését csak abban az esetben érdemes megkísérelni, ha a beteg legalább 2 éve stabilan teljes remisszióban van alacsony dózisú immunszuppresszív kezelés mellett. Az immunszuppresszív kezelés megvonását azonban egyáltalán nem javasolják az AIH 2. típusa esetén, és akkor sem, ha a betegség gyermekkorban kezdődött.
A kezelőorvosnak az immunszuppresszív kezelés időtartama alatt kiemelt figyelmet kell fordítania a gyógyszermellékhatások folyamatos monitorizálására, amelyhez megfelelő mélységű, részletes, naprakész ismeretekkel kell rendelkeznie az adott készítményeket, valamint a szükséges klinikai teendőket illetően. Bizonyos esetekben az egyes immunszuppresszív szerek nem adhatóak, mint például tumoros betegség esetén az AZA. Súlyos autoimmun hepatitis esetén az AZA pedig csak akkor indítható, ha a totál bilirubinszint a szérumban már nem haladja meg a 100 µmol/l-t (11). Májcirrózisos betegnek budesonid nem adható, ugyanis ebben a betegcsoportban a budesonid metabolizmusa során a gyógyszer ún. „first pass” effektusának zavara miatt fokozódik annak biológiai hozzáférhetősége, és ezáltal megnő a gyógyszer által okozott mellékhatások, valamint a v. portae thrombosis kialakulásának valószínűsége (23, 24, 25).
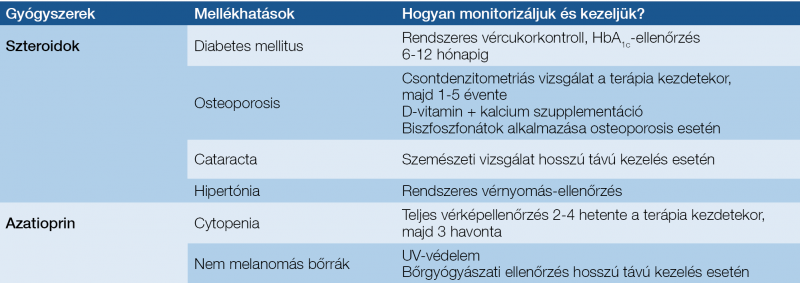
Az elsővonalbeli kezelés megkezdése után a terápiás válasz hatékonyságának lemérése elengedhetetlenül fontos, hiszen ez határozza meg, hogy szükséges-e annak módosítása. A betegek általában 6-12 hónap alatt érik el a teljes biokémiai remissziót, amely függ a betegségsúlyosságtól és az egyidejűleg fennálló társbetegségektől. Az elsővonalbeli szerek lehetséges mellékhatásai, monitorozási és kezelési lehetőségei a 6. táblázatban láthatóak, az elsővonalbeli kezelésre adott válaszokkal kapcsolatos definíciókat a 7. táblázat foglalja össze (26, 27). A betegek 10-20%-ában különféle okok miatt nem érhető el a teljes remisszió.
6. táblázat: Az autoimmun hepatitis elsővonalbeli kezelése során alkalmazott immunszupresszív szerek lehetséges mellékhatásai, monitorozási és kezelési lehetőségei (52, 53)
7. táblázat: Az autoimmun hepatitis elsővonalbeli kezelésére adott válaszokkal kapcsolatos definíciók (54)

Elégtelen terápiás válasz esetén AZA-metabolitszint-mérés (az immunszuppresszív hatásért felelős 6-tioguanin nukleotidok [6-TGN] és a gyógyszertoxicitásért felelős 6-metil-merkaptopurin metabolitok [6-MMP]), illetve tiopurin-S-metiltranszferáz (TPMT) polimorfizmusainak és aktivitásának laboratóriumi vizsgálata segítheti a háttér tisztázását (terápiás nonadherencia, AZA-gyógyszermetabolizmus individuális eltérései). Indirekt laboratóriumi jel lehet ezekben az esetekben az AZA-val kezelt betegek normál MCV- (átlagos korpuszkuláris erythrocyta-térfogat) szintje. Non-compliance kizárása után alacsony 6-TGN-szint (<220 pmol/8×108 VVT) esetén az AZA dózisának optimalizálása (2-2,5 mg/ttkg) javasolt. Ha így sem érhető el a teljes remisszió, ún. harmadvonalbeli kezelést kell alkalmazni, amely tekintetében az alábbi gyógyszereket találták hatékonynak: kalcineuringátlók (tacrolimus [0,1 mg/kg naponta kétszer], ciklosporin [2 mg/kg naponta kétszer]), és mTOR- (mammalian target of rapamycin) gátló (everolimus [0,75-1,5 mg/nap]), ciklofoszfamid (1-1,5 mg/kg vagy 1 g intravénásan négyhetente) és metotrexát (heti 7,5-15 mg).
Harmadvonalbeli terápia részeként a mikofenolát-mofetil (MMF) nem javasolt, mivel nem bizonyult hatékonynak. A harmadvonalbeli kezelésekre vonatkozó iránymutatások azonban kevésbé standardizáltak, és jelentős különbségek észlelhetők a klinikai gyakorlatban. Ennek az az oka, hogy az egyes gyógyszereket csak kis esetszámú tanulmányokban vizsgálták, vagy esetsorozatokban számoltak be róluk. Az összehasonlító vizsgálatok hiánya miatt, és mivel az alkalmazott kezelések egyike sem engedélyezett még, nem lehet határozottan előnyben részesíteni egyik immunszuppresszív szert sem a másik szerrel szemben. Az a tapasztalat, hogy ha az első- és másodvonalbeli terápia nem váltott ki megfelelő immunszuppressziót, a remisszió kiváltásához gyakran szükség lehet kettős vagy akár hármas immunszuppresszióra is, legalábbis a harmadvonalbeli gyógyszeradás megkezdésének időszakában. Ugyanakkor a harmadvonalbeli kezelés megkezdésének célja mindig az, hogy a harmadvonalbeli gyógyszer önmagában fenntartsa a remissziót. A gyógyszerválasztás esetén a kezelési kockázat minimalizálása elengedhetetlenül fontos, amelyhez a beteg általános egészségi állapotának felmérése, a testsúly folyamatos kontrollja, a kardiovaszkuláris és a vesét érintő kockázati tényezők felismerése, valamint az infekciók megelőzése (oltottsági állapot felmérése és szükséges oltások megadása) szükséges.
A betegek egy másik csoportja a standard kezelésre intoleráns esetek. Az AZA-intolerancia a kezelés megkezdésétől rendszerint <2 hét alatt alakul ki, idioszinkráziás folyamat, és az alábbiakat foglalja magában: akut gastroenteritisnek megfelelő tünetegyüttes (hányinger, hányás, általános gyengeség, hasi fájdalom és/vagy láz, hasmenés), ízületi, illetve izomfájdalmak, szignifikáns csontvelői depresszió (neutrophil <1000/µl), hepatotoxicitás és akut pancreatitis. Az AZA-intoleráns esetekben a 6-mercaptopurinra (6-MP) történő váltás vagy az MMF adása jön szóba mint lehetséges másodvonalbeli terápiás alternatíva.
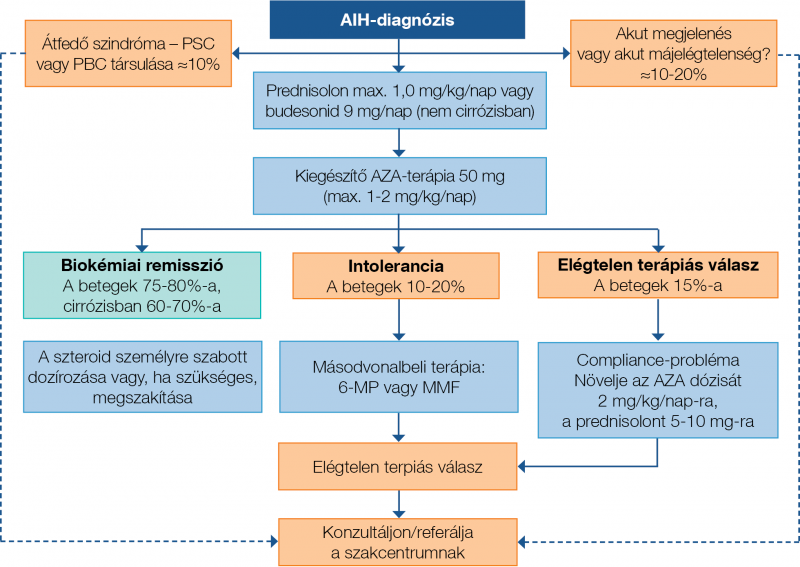
Teratogén hatása miatt az MMF azonban kifejezetten kontraindikált terhesség vagy családtervezés esetén. Az ajánlott kezdő dózis 1000 mg/nap (500 mg naponta kétszer), majd fenntartó dózisként 2000 mg/nap javasolt. Az MMF mellékhatásspektruma hasonló az AZA-éhoz, leginkább gasztrointesztinális tünetek (hányás, hányinger, hasmenés), ritkábban fekélyképződés, vérzés is előfordulhat. Immunszuppresszív hatásánál fogva fokozott lehet a fertőzésekre való hajlam. Laboreltérések tekintetében hypogammaglobulinaemiát és neutropeniát okozhat, emiatt az immunglobulinszintek mellett a vérkép rendszeres ellenőrzése is fontos. Ha neutropenia fejlődik ki (abszolút neutrofilszám <1,3×10 G/l), megfontolandó az MMF-kezelés teljes megszakítása vagy átmeneti abbahagyása. A másod- és harmadvonalbeli kezelésre szoruló AIH-beteg esetén mindenképpen a korai kapcsolatfelvétel és szakmai konzultáció javasolt szakértői központtal. A Ritka Májbetegségek Európai Referenciahálózatának (ERN RARE-LIVER) keretein belül nemzetközi szakértői panel is bevonható távkonzultációs rendszer (CPMS) használatával. A másod- és harmadvonalbeli kezelés részletes ismertetése meghaladja jelen dolgozat kereteit, így ebben munkacsoportunk korábbi cikkére hivatkozunk (28). Az AIH terápiás algoritmusát a 3. ábra foglalja össze.
3. ábra: Az autoimmun hepatitis kezelési algoritmusa (53)
A remisszióindukcióra alkalmazott szteroidkezelés fokozatos leépítése és a szteroidspóroló szer (általában azatioprin [AZA]) lépcsőzetes emelése régóta alkalmazott klinikai gyakorlat. Az elsővonalbeli terápia során kulcsfontosságú az immunszuppresszív kezelésre adott válaszreakció felmérése. Ha a beteg megfelelően reagál (vagyis biokémiai remisszió alakul ki), a szteroid elhagyható. Elégtelen terápiás válasz vagy intolerancia esetén másod-, illetve harmadvonalbeli szerek adása jön szóba.
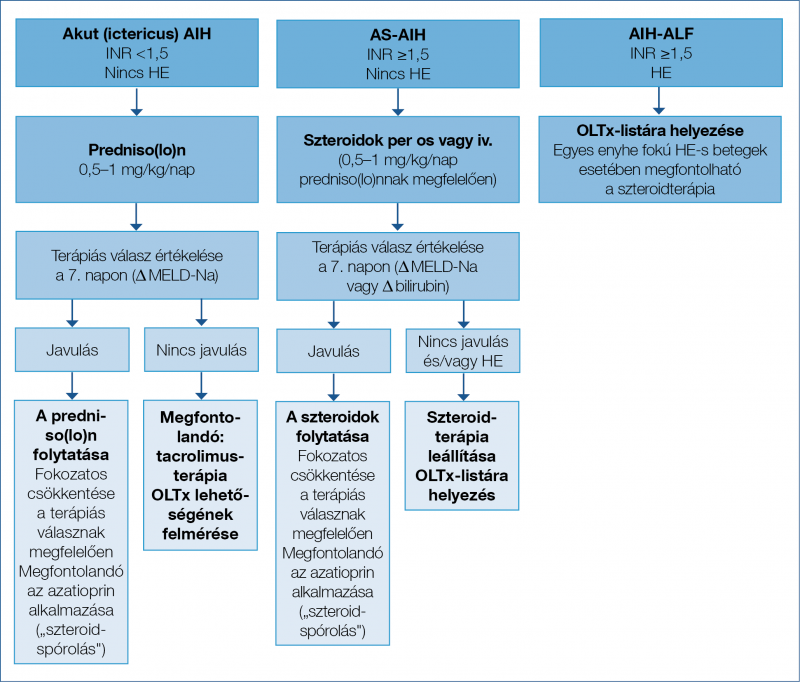
Fontos kiemelni, hogy az eddig felsorolt első-, másod-, illetve harmadvonalbeli terápiák nem specifikus immunszuppressziót hoznak létre, azonban az új, innovatív immunterápiák már a szabályozó (regulátor) (adaptív Treg-sejt-terápia; alacsony dózisú IL-2-kezelés) és végrehajtó (effektor) T-sejteket (anti-TNFα: infliximab; anti-IL-12/23: ustekinumab; anti-sIL-6: tocilizumab), valamint a B-sejteket (anti-CD20: rituximab; anti-B-sejt-aktiváló faktor receptor [BAFF-R]: ianalumab) célozzák meg (29). Speciális betegcsoportok Súlyos akut hepatitis képében jelentkező AIH (AS-AIH) A betegség viszonylag ritka klinikai megjelenési formája a súlyos akut hepatitis képében jelentkező AIH (AS-AIH), amelynek valódi incidenciája és prevalenciája egyelőre pontos epidemiológiai adatok hiányában nem ismert. A kórkép nehezen felismerhető, diagnosztikája kihívást jelenthet még a tapasztaltabb klinikusok számára is. Ezt nehezíti, hogy a kórképnek nincs standardizált, egységesen elfogadott definíciója. Rahim és munkatársai nyomán, ha hosszabb ideje fennálló májbetegség kizárható (legyen ez akár krónikus AIH akut fellángolása vagy más etiológiájú májbetegség), az alábbi paraméterek együttes fennállása esetén mondható ki az AS-AIH diagnózisa: 1. icterus, 2. coagulopathia (≥1,5) és 3. encephalopathia hiánya. Fontos kiemelni, hogy az időbeliséget tekintve a véralvadás zavara ebben az esetben 2-6 héten belül követi a sárgaság megjelenését. Az AS-AIH-eseteknek becslések szerint mintegy 50-60%-a progrediál akut májelégtelenségbe (ALF), amelynek az encephalopathia megjelenése az ismertetőjegye (6). Az AIH különböző heveny és krónikus megjelenési formáit és összefüggéseit a 2. ábra ismerteti. A diagnosztika nehézségei a főként váratlan, akut megjelenésből adódnak, amely az atípusos laboratóriumi és szövettani leletekkel együtt nehezítik egy egységesített diagnosztikus kritériumrendszer megalkotását. A patognomikus jellemzők hiánya miatt az AS-AIH diagnózisa a legtöbb esetben az akut hepatitis egyéb, alternatív okainak (mint például a DILI és akut vírushepatitisek) kizárásán alapul (30).
A fokozott szakmai figyelemnek és országokon átívelő szakmai együttműködéseknek – mint az ERN R-LIVER Program – köszönhetően egyre gyakrabban (akár az esetek 62%-ában) ismerik fel ismeretlen eredetű ALF hátterében az AIH-t (6). A krónikus lefolyású AIH-t jól tükröző klasszikus diagnosztikus kritériumok a legtöbb esetben nem alkalmazhatóak az AS-AIH esetén. Az autoantitest-pozitivitás az esetek 10-40%-ában, míg a hypergammaglobulinaemia 25-47%-ában hiányozhat (31, 32). A diagnózis felállításának elengedhetetlen feltétele a máj szövettani vizsgálata, amely történhet perkután vagy transjugularis májbiopszia során nyert mintából vagy ex vivo, a transzplantáció során eltávolított májból (30). A hisztológiai minta értékelését mindenképpen a hepatológia ezen területén jártas patológusra érdemes bízni, ugyanis a hisztológiai kép a szerológiához hasonlóan szintén aspecifikus képet mutathat, és vírushepatitisekben, illetve a DILI-ben talált elváltozásoktól nehezen elkülöníthető. Az akut AIH-ra jellemző szövettani eltérések elsősorban a centrilobuláris zónában észlelhetők. Az akut és krónikus AIH elkülönítésében fontos szerepe van a fibrózis kimutatásának, amelyhez speciális festéseket alkalmaznak, ugyanis a posztnekrotikus szövettani elváltozások is igen hasonló képet adnak (30). Fontos a leletek értékelése során szem előtt tartani, hogy mind a szerológia, mind pedig a szövettani vizsgálat a betegség lefolyása során csupán egy pillanatképet mutat, idő és gyógyszeres kezelés függvényében változhat. Kérdéses esetekben a vizsgálatok megismétlése megfontolandó. Szeronegativitás esetén az immunszerológiát 3-6 hónap múlva érdemes megismételni (30).
Képalkotó vizsgálatok is elősegíthetik a diagnózis felállítását. Hasi ultrahang révén a vaszkuláris etiológia kizárható. Míg a máj CT-vizsgálattal kimutatott volumencsökkenése a szubakut/akut megjelenési forma mellett szólhat. A betegek 65%-ában pedig heterogén hipoattenuált régiókat is igazolhat (30). Összességében elmondható, hogy a jelenleg használatban lévő klinikai pontrendszerek közül egyelőre az IAIHG által kifejlesztett átfogó pontrendszer jobban alkalmazható az akut megjelenésű AIH diagnosztikájában, mint az egyszerűsített forma (33). Kezelés nélkül az esetek mindössze 7-15%-ban várható spontán remisszió. Az elsővonalbeli terápia a krónikus AIH-hoz hasonlóan akut, sárgasággal járó, és AS-AIH-esetekben is kortikoszteroidok adását jelenti, azonban itt kisebb a kezelésre jól reagálók aránya. ALF kialakulása esetén a beteg májtranszplantáció (LT) irányába történő sürgős referálása az első lépés. Kortikoszteroid indítása csak válogatott ALF-betegekben, a haszon és a kockázat mérlegelése mellett, alacsony grádusú HE és szövettani vizsgálat során masszív májnekrózis kizárása esetén jön szóba. Bár az optimális kezdő kortikoszteroid-terápia paramétereinek kidolgozása még várat magára, a jelenlegi ajánlások alapján a 0,5-1 mg/kg/nap dózis az irányadó. Magasabb dózisok, illetve intravénás alkalmazás a per os bevitellel szemben az eddigi vizsgálatok alapján nem jártak terápiás előnnyel. Tekintettel arra, hogy a folyamat progressziója, ALF kialakulása önmagában fokozza az infektív szövődmények kialakulásának valószínűséget, szteroidkezelés indítása után ezek monitorizálására fokozott figyelmet kell fordítani. A kezelés hatékonyságának korai felmérése kulcsfontosságú, amelynek követésére ebben a konstellációban a transzaminázértékek nem alkalmasak. Erre a célra ehelyett a szérumbilirubin-, az INR-, a MELD-Na- (nátriummal korrigált végstádiumú májbetegségek matematikai modellje), az UKELD- (United Kingdom Model for End-Stage Liver Disease) pontértékek alkalmazhatók (30–33).
Azon betegek esetén, akiknél 7 napos kortikoszteroid-kezelés után nem látható állapotjavulás, vagy már felvételkor magas grádusú HE áll fenn – vagyis a folyamat már ALF-be progrediált –, azonnali kapcsolatfelvétel a transzplantációs centrummal, és a beteg mielőbbi várólistára helyezése javasolt (6). Gyakorlati szempontból a vizsgálatok időigényessége miatt a transzplantációs kivizsgálást már a szteroidkezelés indításával párhuzamosan érdemes elkezdeni. Ebben az indikációban végzett LT esetén a túlélési mutatók az eltérő etiológiájú májbetegségekével összevethetők: az egyéves túlélés 80-94%, ellenben a transzplantációt követő akut és késői kilökődés valószínűsége magasabb. A betegség az LT-t követő évben 8-12%-os, míg 5 év múlva 36-68%-os valószínűséggel visszatérhet, aminek előjelei lehetnek az LT-t megelőző időszakban észlelt magas májenzim- és immunglobulinszintek, valamint az eltávolított máj szövettani vizsgálata során észlelt, mérsékelt vagy magas gyulladásos aktivitással járó lymphoplasmocytás infiltrátum. A krónikus AIH-val szemben az akut megjelenési forma esetén azonban kisebb az esélye a betegség ismételt kialakulásának. Az akut hepatitis képében jelentkező AIH kezelési lehetőségeit a 4. ábra foglalja össze (30, 31, 32, 33).
4. ábra: Az akut formában jelentkező autoimmun hepatitis kezelési lehetőségei (6)
A terápia során kulcsfontosságú az első vonalban alkalmazott szteroidokra adott válasz felmérése a kezelés megkezdését követő 7. napon. Ha a terápiás válasz kielégítő, javasolt a szteroidterápia folytatása, ellenkező esetben megfontolandó egyéb immunszuppresszív szerek (pl. tacrolimus) adása, vagy adott esetben a májtranszplantáció mérlegelése. Akut májelégtelenség esetén a transzplantációs centrummal való konzultáció és a beteg várólistára helyezése javasolt.
Az AIH és a terhesség Az AIH kezelése a terhesség alatt nehéz hepatológiai feladat, egyrészt maga a betegség és az alkalmazott gyógyszerek egyaránt veszélyt jelenthetnek mind az anyára, mind pedig a magzatra. A betegség fellángolása a terhesség alatt ritkább, aminek az áll a hátterében, hogy a terhesség immuntoleranciát indukál a magas ösztrogénszint következtében kialakuló citokinprofil-eltolódás miatt. Ugyanakkor a posztpartum időszakban gyakrabban lehet számítani erre, ami az anyai immunrendszer rekonstitúciójával magyarázható. A posztpartum időszakban ezért a májenzimek szoros monitorozása szükséges, főként az első 3 hónapban. Ismert a terhesség alatt újonnan manifesztálódó AIH is. Az intrapartum időszakban a betegség fellángolása >20%, míg a posztpartum időszakban akár 30-50% is lehet (34). A terhesség kedvező kimenetelének (mind az anyai, mind a magzati szempontokat tekintve) legfontosabb meghatározója a betegség megfelelő gyógyszeres kontrollja a prekoncepcionális időszakban. A legkedvezőbb az, ha már a tervezett terhesség előtt a betegség remisszióba kerül, és még nem alakult ki májcirrózis és portális hipertenzió (35). Ha azonban a terhességet megelőző időszakban a betegség remissziója nem érhető el, számítani kell annak kedvezőtlen kimenetelére (magzat elvesztése vagy koraszülés) (36, 37).
Egy tanulmány szerint továbbá az anti-SLA/LP és anti-Ro antitestek jelenléte (SSA) is a terhesség kedvezőtlen kimenetelének kockázati tényezői (38).
A legfontosabb feladat tehát, hogy már a fogantatás előtt elérjük a betegség megfelelő kontrollját. Fontos, hogy a beteg kellő tájékoztatást kapjon arról is, hogy a gyógyszeres kezelés elhagyása a terhesség során az AIH fellángolásának fontos kockázati tényezője. A terhesség alatti betegségaktiválódás egyik fontos oka a gyógyszeres kezelés önkéntes felfüggesztése. Az AIH terhesség alatti kezelésével kapcsolatosan nagyszámú, átfogó tanulmányok nem állnak rendelkezésre, ugyanakkor a gyulladásos bélbetegségekben az AZA terhesség alatti használata során (3000 terhesség alatti AZA-expozíció) koraszülésről, alacsony születési súlyról vagy kongenitális malformációkról nem számoltak be, ami alapján az AZA biztonságosnak tartható (39). A terhesség során a korábbi kezelés folytatása (prednisolon és/vagy azatioprin) javasolt elsősorban (stabil immunszuppresszív kezelés) (40). Az AIH megfelelő gyógyszeres kontrollja jóval több előnnyel jár, és ellensúlyozza azt a minimális kockázatot, amivel a prednisolon vagy az AZA szedése jár terhesség alatt. Az MMF alkalmazása azonban tilos, mert kongenitális malformációk kialakulásához vezet (16). Ha az AIH fellángol, annak konvencionális kezelése javasolt, prednisolonkezelés újraindítása vagy a dózis emelése (29, 34).
A nem alkoholos zsírmáj (NAFLD) és a nem alkoholos steatohepatitis (NASH)
Ismert, hogy a máj-autoantitestek előfordulási gyakorisága NAFLD/NASH betegek esetén 12-48%. Ugyanakkor a NAFLD/NASH betegekkel foglalkozó klinikai tanulmányok nem feltétlenül vizsgálták az összes AIH-asszociált szerológiai antitestet, vagy alkalmazták az egyszerűsített IAIHG pontrendszert a diagnosztika során. Nem értékelték minden esetben azt sem, mennyi azoknak a betegeknek az aránya, akikben az AIH lehetséges hisztopatológiai jellegzetességei is jelen vannak (41).
Nem ismert a diagnosztizált AIH-betegek körében a NAFLD/NASH előfordulási gyakorisága, valamint a betegség lefolyására és a gyógyszeres kezelés hatékonyságára gyakorolt hatásuk sem. Egyéb autoimmun betegségekben ismert, hogy az obesitas rontja a betegség lefolyását és a gyógyszeres kezelésre adott választ (42). Citokróm P450 2D6 egérmodellben az AIH súlyosságát a NAFLD együttes jelenléte fokozta (43). Autoimmun hepatitises betegekben ez idáig mindössze egyetlen, kis esetszámú, retrospektív tanulmány vizsgálta az egyidejűleg fennálló NASH/NAFLD hatását, és azt találták, hogy a NASH jelenlétekor gyakoribb az előrehaladott betegség (de a NAFLD esetén nem), a kedvezőtlen kimenetel, és rosszabb a túlélés (44).
Májcirrózis
Az újonnan felfedezett AIH-esetek mintegy 30%-a már cirrózisba progrediált, és rossz prognózissal társul. Ezen esetekben a szubklinikus betegség már hónapokkal, akár évekkel korábban fennáll. Kompenzált májcirrózis esetén (ascites és nyelőcsővarix-vérzés hiánya) alkalmazható a standard kezelés, azonban az AZA dózisát redukálni kell, különösen, ha leukopenia is jelen van (fehérvérsejtszám <4 G/l). Az AZA indítása előtt fontos tesztelni a TPMT enzim működését. Dekompenzált májcirrózis esetén a kockázat/előny megfontolás alapján a beteg szteroidot vagy egyéb immunszuppresszív szert ne kapjon. Ez alól csak az képez kivételt, ha a szövettani vizsgálat során a májban aktív gyulladás látható. A szteroidkezelés mellett a szepszis kialakulásának kockázata fokozott, ugyanakkor nem késlelteti a májtranszplantáció szükségességének idejét (45). A fertőzések kialakulása pedig májcirrózisban jelentősen növeli a halálozást (46). Dekompenzált májcirrózisban, mint ahogyan egyéb etiológia esetén is, a portális hipertóniához kapcsolódó szövődmények szűrése és kezelése és kontraindikáció hiányában májtranszplantációra való mihamarabbi felkészítés az elsődleges feladat. Fontos a hepatocelluláris karcinóma (HCC) rendszeres szűrése is 6 havonta elvégzett hasi ultrahanggal, amely kiegészíthető szérum-alfa-fetoprotein- (AFP-) vizsgálattal is. Ha a HCC kialakul, szintén elsődlegesen májtranszplantáció javasolt (47).
Az AIH-betegek 10-20%-ában válik szükségessé májtranszplantáció az élet folyamán. Az AIH miatt végzett májtranszplantáció esetén az 5 éves túlélés jó, mintegy 73% (48). Az AIH visszatérése nagyjából 20% (49). A szérumantitestek májtranszplantáció után nem megbízhatóak a diagnózis felállításában, a májszövettan azonban mutatja az AIH jellegzetességeit. A transzplantációt követően visszatérő AIH kezelése túlmutat a jelen összefoglalón.
Hangulatzavar
A fáradtság és a depresszió gyakoribb társulása az AIH-hoz jól ismert jelenség, és a betegség egyik extraintesztinális manifesztációjának tartják. Kialakulásában egyrészt szerepük lehet a különféle citokineknek, másrészt pedig a betegség szisztémás gyógyszeres kezelésének következményei (különösképpen a szteroidok alkalmazása esetén) (50). Egyelőre nem tisztázott, hogy más, krónikus májbetegségekhez hasonlóan (mint pl. HCV-fertőzés vagy PBC) a májbetegség által indukált központi idegrendszeri eltérések szerepet játszanak-e (41).
Összefoglalás
Az AIH egy ritka, főleg középkorú nőket érintő, ismeretlen eredetű megbetegedés. A kialakulás oka és mechanizmusa a mai napig nem pontosan ismert, a tudomány jelenlegi állása szerint a genetikailag hajlamos egyénekben egy ismeretlen trigger hatására toleranciavesztés alakul ki bizonyos májantigénekkel szemben, ami immunválaszt generálva vezet a betegség kialakulásához. A kórkép diagnosztikája és kezelése is kihívásokkal teli feladat, amely sokszor a tapasztaltabb hepatológusok számára is nehézséget okozhat. A pontos diagnózis felállítása nagy körültekintést igényel, mert kezelés nélkül a folyamat rövid időn belül cirrózisba progrediálhat, és ennek talaján akár életet veszélyeztető májelégtelenség alakulhat ki. A diagnózis részét képezi a laborleletek (amelyek a legtöbb esetben főként a GPT és a GOT emelkedése) és az autoimmun szerológia áttekintése. Itt külön figyelmet érdemel az autoantitestek meghatározására alkalmazott eszközök (IFT, ELISA), illetve az autoantitestek titerének és mintázatának értékelése, amelyek adott esetben segíthetik a pontos diagnózis felállítását. A májbiopszia kötelező a diagnózis kimondásához, az autoimmun hepatitisre jellemző hisztológiai kép értékelése tapasztalt, a hepatológia területén jártas patológus szakértelmét igényli. A speciális betegcsoportok (úgymint az AS-AIH, a terhesség, az NAFLD, a NASH és a májcirrózis) külön figyelmet érdemelnek mind a diagnosztika, mind a terápia szempontjából. A diagnózis megállapítása után a kezelést mihamarabb meg kell kezdeni. A standard terápiára (a szteroidra és az AZA-ra) a betegek 80%-a jól reagál. Mivel a betegséglefolyás során gyakori a relapszus, adott esetben a terápiát élethosszig kell alkalmazni, amire fontos felhívni a betegek figyelmét a jobb adherencia érdekében. A másod- vagy harmadvonalbeli terápiát igénylő betegek speciális centrumba irányítandók. Bár ma még a kórkép kezelése kihívásokkal teli, remény van arra, hogy a jövőben az AIH-ban szenvedő betegek esetén májtranszplantációra már nem lesz szükség.
https://doi.org10.1038/nrdp.2018.17
2. Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group. Hepatology 1993; 18(4): 998–1005.
https://doi.org10.1002/hep.1840180435
3. Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 1999; 31(5): 929–38.
https://doi.org10.1016/s0168-8278(99)80297-9
4. Hennes EM, Zeniya M, Czaja AJ, Parés A, Dalekos GN, Krawitt EL, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology 2008; 48(1): 169–76.
https://doi.org10.1002/hep.22322
5. Czaja AJ. Performance parameters of the diagnostic scoring systems for autoimmune hepatitis. Hepatology 2008; 48(5): 1540–8.
https://doi.org10.1002/hep.22513
6. Rahim MN, Liberal R, Miquel R, Heaton ND, Heneghan MA. Acute Severe Autoimmune Hepatitis: Corticosteroids or Liver Transplantation? Liver Transpl 2019; 25(6): 946–59.
https://doi.org10.1002/lt.25451
7. Vergani D, Alvarez F, Bianchi FB, Cançado EL, Mackay IR, Manns MP, et al. Liver autoimmune serology: a consensus statement from the committee for autoimmune serology of the International Autoimmune Hepatitis Group. J Hepatol 2004; 41(4): 677–83.
https://doi.org10.1016/j.jhep.2004.08.002
8. Sebode M, Weiler-Normann C, Liwinski T, Schramm C. Autoantibodies in Autoimmune Liver Disease-Clinical and Diagnostic Relevance. Front Immunol 2018; 9: 609.
https://doi.org10.3389/fimmu.2018.00609
9. Galaski J, Weiler-Normann C, Schakat M, Zachou K, Muratori P, Lampalzer S, et al. Update of the simplified criteria for autoimmune hepatitis: Evaluation of the methodology for immunoserological testing. J Hepatol 2021; 74(2): 312–20.
https://doi.org10.1016/j.jhep.2020.07.032
10. Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and management of autoimmune hepatitis. Hepatology 2010; 51(6): 2193–213.
https://doi.org10.1002/hep.23584
11. EASL Clinical Practice Guidelines: Autoimmune hepatitis. J Hepatol 2015; 63(4): 971–1004.
https://doi.org10.1016/j.jhep.2015.06.030
12. Lohse AW, Sebode M, Bhathal PS, Clouston AD, Dienes HP, Jain D, et al. Consensus recommendations for histological criteria of autoimmune hepatitis from the International AIH Pathology Group: Results of a workshop on AIH histology hosted by the European Reference Network on Hepatological Diseases and the European Society of Pathology: Results of a workshop on AIH histology hosted by the European Reference Network on Hepatological Diseases and the European Society of Pathology. Liver Int 2022; 42(5): 1058–69.
https://doi.org10.1111/liv.15217
13. Balitzer D, Shafizadeh N, Peters MG, Ferrell LD, Alshak N, Kakar S. Autoimmune hepatitis: review of histologic features included in the simplified criteria proposed by the international autoimmune hepatitis group and proposal for new histologic criteria. Mod Pathol 2017; 30(5): 773–83.
https://doi.org10.1038/modpathol.2016.267
14. Stravitz RT, Lefkowitch JH, Fontana RJ, Gershwin ME, Leung PS, Sterling RK, et al. Autoimmune acute liver failure: proposed clinical and histological criteria. Hepatology 2011; 53(2): 517–26.
https://doi.org10.1002/hep.24080
15. Kirk AP, Jain S, Pocock S, Thomas HC, Sherlock S. Late results of the Royal Free Hospital prospective controlled trial of prednisolone therapy in hepatitis B surface antigen negative chronic active hepatitis. Gut 1980; 21(1): 78–83.
https://doi.org10.1136/gut.21.1.78
16. Lamers MM, Van Oijen MG, Pronk M, Drenth JP. Treatment options for autoimmune hepatitis: a systematic review of randomized controlled trials. J Hepatol 2010; 53(1): 191–8.
https://doi.org10.1016/j.jhep.2010.01.037
17. Soloway RD, Summerskill WH, Baggenstoss AH, Geall MG, Gitnićk GL, Elveback IR, et al. Clinical, biochemical, and histological remission of severe chronic active liver disease: a controlled study of treatments and early prognosis. Gastroenterology 1972; 63(5): 820–33.
18. Kanzler S, Löhr H, Gerken G, Galle PR, Lohse AW. Long-term management and prognosis of autoimmune hepatitis (AIH): a single center experience. Z Gastroenterol 2001; 39(5): 339–41, 44–8.
https://doi.org10.1055/s-2001-13708
19. Hartl J, Ehlken H, Sebode M, Peiseler M, Krech T, Zenouzi R, et al. Usefulness of biochemical remission and transient elastography in monitoring disease course in autoimmune hepatitis. J Hepatol 2018; 68(4): 754–63. https://doi.org10.1016/j.jhep.2017.11.020
20. Mack CL, Adams D, Assis DN, Kerkar N, Manns MP, Mayo MJ, et al. Diagnosis and Management of Autoimmune Hepatitis in Adults and Children: 2019 Practice Guidance and Guidelines From the American Association for the Study of Liver Diseases. Hepatology 2020; 72(2): 671–722.
https://doi.org10.1002/hep.31065
21. Manns MP, Woynarowski M, Kreisel W, Lurie Y, Rust C, Zuckerman E, et al. Budesonide induces remission more effectively than prednisone in a controlled trial of patients with autoimmune hepatitis. Gastroenterology 2010; 139(4): 1198–206.
https://doi.org10.1053/j.gastro.2010.06.046
22. Van Gerven NM, Verwer BJ, Witte BI, Van Hoek B, Coenraad MJ, Van Erpecum KJ, et al. Relapse is almost universal after withdrawal of immunosuppressive medication in patients with autoimmune hepatitis in remission. J Hepatol 2013; 58(1): 141–7.
https://doi.org10.1016/j.jhep.2012.09.009
23. Efe C, Ozaslan E, Kav T, Purnak T, Shorbagi A, Ozkayar O, et al. Liver fibrosis may reduce the efficacy of budesonide in the treatment of autoimmune hepatitis and overlap syndrome. Autoimmun Rev 2012; 11(5): 330–4.
https://doi.org10.1016/j.autrev.2011.09.006
24. Geier A, Gartung C, Dietrich CG, Wasmuth HE, Reinartz P, Matern S. Side effects of budesonide in liver cirrhosis due to chronic autoimmune hepatitis: influence of hepatic metabolism versus portosystemic shunts on a patient complicated with HCC. World J Gastroenterol 2003; 9(12): 2681–5.
https://doi.org10.3748/wjg.v9.i12.2681
25. Hempfling W, Grunhage F, Dilger K, Reichel C, Beuers U, Sauerbruch T. Pharmacokinetics and pharmacodynamic action of budesonide in early- and late-stage primary biliary cirrhosis. Hepatology 2003; 38(1): 196–202.
https://doi.org10.1053/jhep.2003.50266
26. Czaja AJ. Rapidity of treatment response and outcome in type 1 autoimmune hepatitis. J Hepatol 2009; 51(1): 161–7.
https://doi.org10.1016/j.jhep.2009.02.026
27. Pape S, Gevers TJG, Vrolijk JM, Van Hoek B, Bouma G, Van Nieuwkerk CMJ, et al. Rapid Response to Treatment of Autoimmune Hepatitis Associated With Remission at 6 and 12 Months. Clin Gastroenterol Hepatol 2020; 18(7): 1609-17.e4.
https://doi.org10.1016/j.cgh.2019.11.013
28. Papp M. Autoimmun hepatitis – A nehezen kezelhető beteg. Medical Tribune 2022; 7: 22–24.
29. Liberal R, de Boer YS, Heneghan MA. Established and novel therapeutic options for autoimmune hepatitis. Lancet Gastroenterol Hepatol 2021; 6(4): 315–26.
https://doi.org10.1016/s2468-1253(20)30328-9
30. Rahim MN, Miquel R, Heneghan MA. Approach to the patient with acute severe autoimmune hepatitis. JHEP Rep 2020; 2(6): 100149.
https://doi.org10.1016/j.jhepr.2020.100149
31. Yasui S, Fujiwara K, Yonemitsu Y, Oda S, Nakano M, Yokosuka O. Clinicopathological features of severe and fulminant forms of autoimmune hepatitis. J Gastroenterol 2011; 46(3): 378–90.
https://doi.org10.1007/s00535-010-0316-3
32. Fujiwara K, Fukuda Y, Yokosuka O. Precise histological evaluation of liver biopsy specimen is indispensable for diagnosis and treatment of acute-onset autoimmune hepatitis. J Gastroenterol 2008; 43(12): 951–8.
https://doi.org10.1007/s00535-008-2254-x
33. Fujiwara K, Yasui S, Tawada A, Fukuda Y, Nakano M, Yokosuka O. Diagnostic value and utility of the simplified International Autoimmune Hepatitis Group criteria in acute-onset autoimmune hepatitis. Liver Int 2011; 31(7): 1013–20.
https://doi.org10.1111/j.1478-3231.2011.02524.x
34. Joshi D, James A, Quaglia A, Westbrook RH, Heneghan MA. Liver disease in pregnancy. Lancet 2010; 375(9714): 594–605. https://doi.org/10.1016/s0140-6736(09)61495-1
35. Ma K, Berger D, Reau N. Liver Diseases During Pregnancy. Clin Liver Dis 2019; 23(2): 345–61.
https://doi.org10.1016/j.cld.2018.12.013
36. Westbrook RH, Yeoman AD, Kriese S, Heneghan MA. Outcomes of pregnancy in women with autoimmune hepatitis. J Autoimmun 2012; 38(2–3): J239–44.
https://doi.org10.1016/j.jaut.2011.12.002
37. Westbrook RH, Dusheiko G, Williamson C. Pregnancy and liver disease. J Hepatol 2016; 64(4): 933–45.
https://doi.org10.1016/j.jhep.2015.11.030
38. Schramm C, Herkel J, Beuers U, Kanzler S, Galle PR, Lohse AW. Pregnancy in autoimmune hepatitis: outcome and risk factors. Am J Gastroenterol 2006; 101(3): 556–60.
https://doi.org10.1111/j.1572-0241.2006.00479.x
39. Akbari M, Shah S, Velayos FS, Mahadevan U, Cheifetz AS. Systematic review and meta-analysis on the effects of thiopurines on birth outcomes from female and male patients with inflammatory bowel disease. Inflamm Bowel Dis 2013; 19(1): 15–22.
https://doi.org10.1002/ibd.22948
40. Tran TT, Ahn J, Reau NS. ACG Clinical Guideline: Liver Disease and Pregnancy. Am J Gastroenterol 2016; 111(2): 176–94; quiz 96.
https://doi.org10.1038/ajg.2015.430
41. Dyson JK, De Martin E, Dalekos GN, Drenth JPH, Herkel J, Hubscher SG, et al. Review article: unanswered clinical and research questions in autoimmune hepatitis-conclusions of the International Autoimmune Hepatitis Group Research Workshop. Aliment Pharmacol Ther 2019; 49(5): 528–36.
https://doi.org10.1111/apt.15111
42. Versini M, Jeandel PY, Rosenthal E, Shoenfeld Y. Obesity in autoimmune diseases: not a passive bystander. Autoimmun Rev 2014; 13(9): 981–1000.
https://doi.org10.1016/j.autrev.2014.07.001
43. Müller P, Messmer M, Bayer M, Pfeilschifter JM, Hintermann E, Christen U. Non-alcoholic fatty liver disease (NAFLD) potentiates autoimmune hepatitis in the CYP2D6 mouse model. J Autoimmun 2016; 69: 51–8.
https://doi.org10.1016/j.jaut.2016.02.007
44. De Luca-Johnson J, Wangensteen KJ, Hanson J, Krawitt E, Wilcox R. Natural History of Patients Presenting with Autoimmune Hepatitis and Coincident Nonalcoholic Fatty Liver Disease. Dig Dis Sci 2016; 61(9): 2710–20.
https://doi.org10.1007/s10620-016-4213-3
45. Schmeltzer PA, Russo MW. Clinical narrative: autoimmune hepatitis. Am J Gastroenterol 2018; 113(7): 951–8.
https://doi.org10.1038/s41395-018-0058-z
46. Arvaniti V, D’Amico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology 2010; 139(4): 1246–56, 56.e1-5.
https://doi.org10.1053/j.gastro.2010.06.019
47. Papp R, Papp M, Tornai I, Vitalis Z. A hepatocellularis carcinoma előfordulása és kezelésének tanulságai az északkelet-magyarországi régióban. Orv Hetil 2016; 157(45): 1793–801.
48. Heinemann M, Adam R, Berenguer M, Mirza D, Malek-Hosseini SA, O’Grady JG, et al. Longterm Survival After Liver Transplantation for Autoimmune Hepatitis: Results From the European Liver Transplant Registry. Liver Transpl 2020; 26(7): 866–77.
https://doi.org10.1002/lt.25739
49. Gautam M, Cheruvattath R, Balan V. Recurrence of autoimmune liver disease after liver transplantation: a systematic review. Liver Transpl 2006; 12(12): 1813–24.
https://doi.org10.1002/lt.20910
50. Wong LL, Fisher HF, Stocken DD, Rice S, Khanna A, Heneghan MA, et al. The Impact of Autoimmune Hepatitis and Its Treatment on Health Utility. Hepatology 2018; 68(4): 1487–97.
https://doi.org10.1002/hep.30031
51. Ishak K, Baptista A, Bianchi L, Callea F, De Groote J, Gudat F, et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995; 22(6): 696–9.
https://doi.org10.1016/0168-8278(95)80226-6
52. Janmohamed A, Hirschfield GM. Autoimmune hepatitis and complexities in management. Frontline Gastroenterol 2019; 10(1): 77–87.
https://doi.org10.1136/flgastro-2018-101015
53. Pape S, Schramm C, Gevers TJ. Clinical management of autoimmune hepatitis. United European Gastroenterol J 2019; 7(9): 1156–63.
https://doi.org10.1177/2050640619872408
54. Pape S, Snijders R, Gevers TJG, Chazouilleres O, Dalekos GN, Hirschfield GM, et al. Systematic review of response criteria and endpoints in autoimmune hepatitis by the International Autoimmune Hepatitis Group. J Hepatol 2022; 76(4): 841–9.
https://doi.org10.1016/j.jhep.2021.12.041
