Összefoglaló közlemények / Reviews
Use of immunosuppressive and biological therapy in inflammatory bowel disease
Summary
The management of inflammatory bowel disease has changed dramatically with the development of immunosuppressive and biological therapies. Recent literature suggest that the impact of biological and immunomodulatory therapy on the natural history of disease might be dependent on the timing of their introduction. However, the challenge remains to identify patients for whom early effective treatment would provide the most beneficial outcome, protecting individuals with milder disease phenotype from unnecessary risks and potential side effects. The aim of this review is to highlight the therapeutic options for moderate to severe IBD currently available in Hungary, to summarize our current knowledge on the optimal timing of their initiation, and to propose a treatment algorithm that can be used in everyday patient care.
Az antitrombotikus kezelés jelentősen megnöveli a tápcsatornai vérzések kockázatát. Az ehhez társuló mortalitás hátterében részben a vérzés miatti keringésmegingás, sokk, iszkémia, részben éppen a vérzés miatt felfüggesztett antitrombotikus kezelés következtében fellépő tromboembóliás szövődmények állnak. A kezelés során lényeges szempont a korai endoszkópia időzítése. Súlyos, életet veszélyeztető vérzés esetén szükséges lehet az antikoaguláns szerek hatásának felfüggesztése. K-vitamin-antagonisták esetén protrombinkomplex-koncentrátum adása javasolt, friss, fagyasztott plazma csak ennek hiányában alkalmazandó. Direkt hatású orális antikoaguláns szerek esetében specifikus antidótumok, vagy ha ezek nem elérhetők, szintén protrombinkomplex-koncentrátum adása javasolt. Az acetil-szalicilsavat kontrollálható vérzésben nem szükséges kihagyni, kettős thrombocytaaggregáció-gátlás esetén a második szer adását azonban célszerű ideiglenesen felfüggeszteni. A tromboembólia megelőzése gasztrointesztinális vérzés esetén is létfontosságú, ezért a vérzés megszűnése után az antikoaguláns-kezelés korai újraindítása indokolt. Ha az újravérzés rizikója magas, a véralvadásgátlók 7. nap utáni, alacsony kockázat esetén 4-7 napon belüli újrakezdése javasolt.
A gyulladásos bélbetegségben (IBD – colitis ulcerosa [UC]; Crohn-betegség [CD]) szenvedők gondozása jelentős változáson ment keresztül az elmúlt néhány évben. A korábban elsődleges terápiás célként megfogalmazott klinikai és szteroidmentes remisszióindukció és -fenntartás mellett egyre nagyobb hangsúlyt kapott a biomarkerek normalizációja, valamint az endoszkópos és a hisztológiai (UC)/transzmurális gyógyulás (CD) elérése is (1, 2). Bár a biologikumok és kis molekulájú szerek alkalmazása forradalmasította az IBD-ben szenvedő betegek ellátását, ezek és a hagyományos immunszuppresszív szerek gyakorlati alkalmazása, illetve a kezelési algoritmusban való elhelyezése sokszor nem könnyű feladat. A jelen összefoglaló közlemény egy gyakorlatorientált áttekintést kíván adni a jelenleg IBD-ben alkalmazható, Magyarországon is elérhető terápiás lehetőségekről, miközben az immunszuppresszív készítmények és biologikumok megfelelő időzítéséhez is próbál segítséget nyújtani.
Az IBD-s betegek kezelési elvében az elmúlt években paradigmaváltás következett be. Az ezelőtt elsőként alkalmazott felépítő séma („step up”) mellett megjelent a „top down” megközelítés is. Míg az előbbi a kórkép súlyosságához fokozatosan igazodik, addig az utóbbi séma már a betegség korai stádiumában alkalmazott agresszív kezelést részesíti előnyben azoknál a betegeknél, akiknél súlyosabb betegséglefolyásra számíthatunk. Baert F. és munkatársai által végzett prospektív klinikai vizsgálat eredményei alapján a top-down kezelési stratégiát követő Crohn-betegek körében jóval nagyobb arányban volt megfigyelhető teljes nyálkahártya-gyógyulás a 4 éves utánkövetési periódus alatt, mint a konvencionális terápiában részesülő betegcsoportnál (72% vs. 28,6%). Ezenfelül a korai stádiumú CD-ben (<2 év a diagnózis után) a komplett nyálkahártya-gyógyulás elérése után szignifikánsan magasabb volt a szteroidmentes remisszió aránya a terápiainiciálást követő 4 évben (16/24 [70,8%] vs. 6/22 [27,3%]; p=0,036). Ezen adatok tovább bizonyítják, hogy a korai nyálkahártya-gyógyulást eredményező kezelés kedvezően befolyásolja a későbbi lefolyást (3).
Az IBD patogenezisének széles körű vizsgálata során bebizonyosodni látszik, hogy a korai, hatékony kezelés csökkenti a gyulladásos aktivitást, megelőzheti a bélkárosodást, a későbbi bélreszekció szükségességét, valamint jelentősen csökkentheti a szövődmények rizikóját, illetve az életminőségbeli romlást. Ugyanakkor kihívást jelent azon betegek kiválasztása, akik a legtöbbet profitálnának a korai intenzív terápiából, megkímélve az indolens kórképlefolyást mutató betegcsoportot a felesleges kockázatoktól és potenciális mellékhatásoktól (4–8). Az optimális terápia megválasztásához elengedhetetlen a szövődményes CD- és UC-fenotípusra hajlamos betegcsoport identifikálása már a diagnóziskor, illetve a kezelés folyamán. A napi gyakorlatban a rizikóbesorolás egyelőre elsősorban a klinikai és az endoszkópos eredmények alapján történik, az újabb genetikai, szerológiai, esetleg mikrobiom-alapú prediktorok rutinszerű alkalmazására még nincs lehetőség. A CD negatív kimenetelének előrejelzői többek között a fiatal kor (<30 év), vékonybél- és perianalis érintettség, dohányzás, szteroidkezelés és bélreszekció korai szükségessége, illetve mély fekélyek jelenléte az endoszkópia során. UC esetén szintén kedvezőtlen prognosztikai tényezőnek számít a fiatal életkor (<30 év) és a korai szteroidigény, ugyanakkor a kiterjedt betegség, az anamnesztikus Clostridioides difficile és CMV-infekció, illetve a C-reaktív protein magas szintje is a komplikált betegséglefolyás magasabb kockázatára utalhat (1. táblázat) (8–12).

Bázisterápiára nem reagáló IBD esetén, illetve fellángolás alkalmával lehet szükség a szisztémás kortikoszteroidok (metilprednisolon, prednisolon) alkalmazására. Kiemelendő, hogy sem UC-ben, sem CD-ben nem javasolt alkalmazásuk fenntartó kezelésként, így a remisszió elérése után fokozatos leépítésük szükséges a hosszú távú szövődmények elkerülése érdekében. Ennek ellenére az IBD-s betegek kb. egyharmadánál szteroiddependencia figyelhető meg (13).
A kortikoszteroid-igény csökkentésére, illetve a gyógyszeresen vagy műtétileg indukált remisszió fenntartására jól alkalmazhatók az immunmoduláns készítmények középsúlyos-súlyos CD-ben és UC-ben. Számos tanulmány bizonyította már az anti-TNF és immunszuppresszív szerek együttes használatának hatékonyságát a kortikoszteroid-mentes klinikai és endoszkópos remisszió elérésében. Az infliximab (IFX) és a tiopurinok kombinációja igazoltan hatékony a remisszió kiváltásában, illetve együttes alkalmazásuk az immunogenitás csökkentése révén a súlyos adverz reakciók kialakulásának esélyét is redukálja. Ezzel szemben az immunmodulátorok adalimumabbal (ADA) történő kombinációjáról ellentmondásosak az eredmények (14, 15). A DIAMOND-tanulmány nem talált szignifikáns különbséget a 26. heti klinikai remissziók arányában (monoterápia: 71,8% vs. kombinált terápia: 68,1%; p=0,63), ugyanakkor jobb endoszkópos válasz volt megfigyelhető a kombinált kezelésben részesülő betegeknél (63,8% vs. 79,6%; p=0,36), ami arra utalhat, hogy az ADA és az azatioprin kombinációja hamarabb idéz elő javulást a nyálkahártya állapotában, mint az ADA-monoterápia (16). Reenaers és munkatársai által végzett retrospektív vizsgálat során a kombinációs terápia az indukciót követő 6 hónapban csökkentette a relapszusok előfordulási gyakoriságát (36% vs. 14%; p=0,02), ugyanakkor ezen vizsgálat sem tudta kimutatni a kombinációs terápia előnyét a klinikai válasz és remisszió kiváltásában (17). Yanai és társai által közölt adatok szerint azon IBD-s betegek, akiknél immunogenitás miatt történt terápiaváltás IFX-ről ADA-ra, hajlamosabbak ADA-ellenes antitestek termelésére, és ez a rizikó az anti-TNF switch idejében indított konkomittáns immunmodulátor alkalmazásával sem csökkenthető ebben a betegcsoportban (p=0,3076). A másodvonalbeli anti-TNF-terápián maradás ideje azonban szignifikánsan hosszabb volt immunmodulátor együttes adása esetén (IFX-ről ADA-ra, p=0,045; ADA-ról IFX-re, p=0,05) (18). Míg a kombinált kezeléstől számos terápiás előny várható, egyre több adat utal rizikófokozó hatásukra az opportunista fertőzések és daganatos megbetegedések kialakulásában (19, 20). A CESAME (Cancers Et Surrisque Associé aux Maladies Inflammatoires Intestinales En France) kohorsz eredményei alapján a biologikum tiopurinnal való együttes alkalmazása hosszú távon növeli a limfoproliferatív betegségek (pl. hepatosplenicus T-sejtes lymphoma) kockázatát (21). A tiopurinok vedolizumabbal vagy ustekinumabbal történő kombinált használatának előnyeit egyelőre egy tanulmány sem tudta bizonyítani (22).
Az IBD korai szakaszában indított immunszuppresszióval kapcsolatban ellentmondásosak az eredmények. Bár számos prospektív és retrospektív vizsgálat az immunmoduláns-kezelés (azatioprin, metotrexát) korai alkalmazása mellett csökkenő sebészeti igényt és nagyobb klinikai remissziós rátát igazolt (7, 23), ezen feltevést nem támogató szakirodalmi adatok is megjelentek már. Az AZTEC-tanulmány újonnan diagnosztizált CD-betegeknél (<8 hét) nem mutatott szignifikáns különbséget a szteroidmentes remisszió tekintetében a korai azatioprinterápia és a placebo között (44% vs. 36,5%; p=0,48) (24). Hasonlóképpen, a 6 hónapon belül diagnosztizált Crohn-betegek körében végzett RAPID-vizsgálat sem mutatott érdemi eltérést a klinikai remisszió kiváltásának sikerességében (p=0,69), ugyanakkor a korai azatioprinkezelésben részesülőknél szignifikánsan kisebb volt a perianalis sebészeti beavatkozások kockázata az utánkövetés 36. hónapjában (p=0,049) (25). Ezen tanulmányok eredményeinek ellentmondanak a Kwak és munkatársai által leírtak, miszerint a korai immunmodulátor-használat effektívebb a klinikai (p=0,043) és kortikoszteroid-mentes (p=0,035) remisszió indukciójában, mint a konvencionális terápia (26).
Habár a kortikoszteroid- vagy immunmoduláns-kezelésre refrakter IBD-s betegek terápiájában nagy előrelépést hoztak a biológiai készítmények – elsőként az anti-TNF szerek – megjelenése, bevezetésük időzítése nem mindig egyértelmű. CD-ben különösen a rossz prognosztikai faktorokkal (pl. fistulázó, illetve perianalis kórkép, kiterjedt bélbetegség, mély fekélyek jelenléte, szövődményes fenotípus) rendelkező egyének számára lehet előnyös az anti-TNF szerek korai – diagnózist követő első két évben történő – bevezetése a sebészeti beavatkozások, hospitalizáció, illetve a kórképpel kapcsolatos szövődmények elkerülése érdekében (13, 27). Kugathasan és munkatársai által közölt tanulmány eredményei is ezt bizonyítják, miszerint a korai anti-TNF-kezelés mellett kevesebb penetráló szövődménnyel számolhatunk, ugyanakkor a szűkületek kialakulásából adódó komplikációk arányát szignifikánsan nem csökkenti (p=0,0296 vs. p=0,76) (28). A CD-vel ellentétben az UC korábbi szakaszában alkalmazott anti-TNF szerek fokozott hatékonyságát eddig nem sikerült igazolni (27, 29, 30).
Még az IBD-ben a mai napig leggyakrabban alkalmazott biologikumok (IFX és ADA) esetében is a betegek jelentős részében primer hatástalanság, illetve a szekunder hatásvesztés figyelhető meg, amelyek másod-, harmad-, vagy akár negyedvonalbeli szerek alkalmazását is szükségessé tehetik. Singh és társai által készített metaanalízis biológiaiszer-naiv és expozíción átesett UC- és CD-betegek körében vizsgálta a különböző biologikumok és kis molekulájú szerek hatékonyságát a klinikai remisszió indukciójában. UC-ben első vonalban az IFX (OR: 4,22; p<0,00001) és a vedolizumab (OR: 4,26; p=0,004), míg másodvonalbeli terápiaként a tofacitinib (OR: 12,57; p=0,002) bizonyult a legsikeresebbnek közvetett összehasonlítások alapján (31). CD-ben az eredmények arra utalnak, hogy az IFX (OR :6,35; p<0,00001) és az ADA (OR: 3,80; p< 0,0006) előnyben részesítendő első vonalban, míg az ustekinumab (OR: 2,66; p<0,0001) alkalmazása leginkább másodvonalban preferálandó (32). Mindazonáltal a jelenleg elérhető készítmények terápiás algoritmusban elfoglalt helyének optimális meghatározásához további head-to-head vizsgálatok szükségesek biológiaiterápia-naiv, illetve annak kitett betegeken.
A NEAK finanszírozási protokollja nyújtotta lehetőségek UC-ben anti-TNF hatástalanság esetén a vedolizumab, ustekinumab, illetve a kis molekulájú szerek közül a tofacitinib. Kiemelendő, hogy az antiintegrin készítmények hatékonysága csökken megelőző anti-TNF-expozíció után (29), azonban számos esetben (pl. demyelinisatióval járó szindrómák, gasztrointesztinális traktuson kívüli, aktív malignus daganat, szívelégtelenség súlyos formája) bélszelektivitása révén elsővonalbeli alkalmazása előnyös lehet (16, 32). Továbbá előzetes szakirodalmi adatok alapján – az anti-TNF készítményekhez hasonlóan – a CD korai szakaszában
(diagnózist követő 2 évben) alkalmazott vedolizumabterápia növeli a szteroidmentes klinikai és endoszkópos remisszió gyakoriságát (33). A gyors hatáskezdetű ustekinumab biologikumra naiv és anti-TNF-ellenes kezelésben már részesült IBD esetén is hatékonynak bizonyult, továbbá extraintesztinális manifesztációt mutató betegcsoportnál is biztonsággal alkalmazható (34–36). A nem szelektív JAK-gátló tofacitinib is hatékonynak mutatkozott a kortikoszteroid-mentes remisszió kiváltásában anti-TNF-expozíció után (másodvonalban: 57,4%; p=0,77; harmadvonalban: 55,4%; p=0,61%; negyedvonalban: 56,7% p=0,007) UC-ben (37). Anti-TNF mellett megfigyelhető hatásvesztés vagy allergiás reakció esetén elsősorban hatóanyagcsoporton belüli váltás, „switch” javasolt (38). A folyamatábrák a luminalis CD (1. ábra), a szteroiddependens és a szteroidrefrakter UC (2. ábra) terápiás algoritmusát ábrázolják.
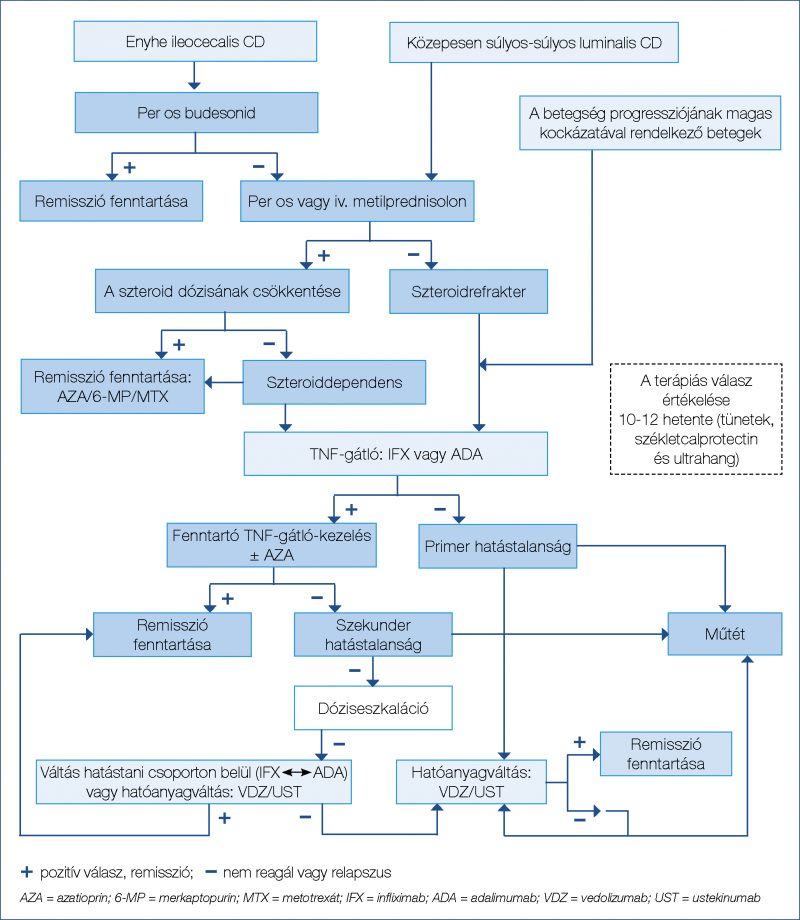
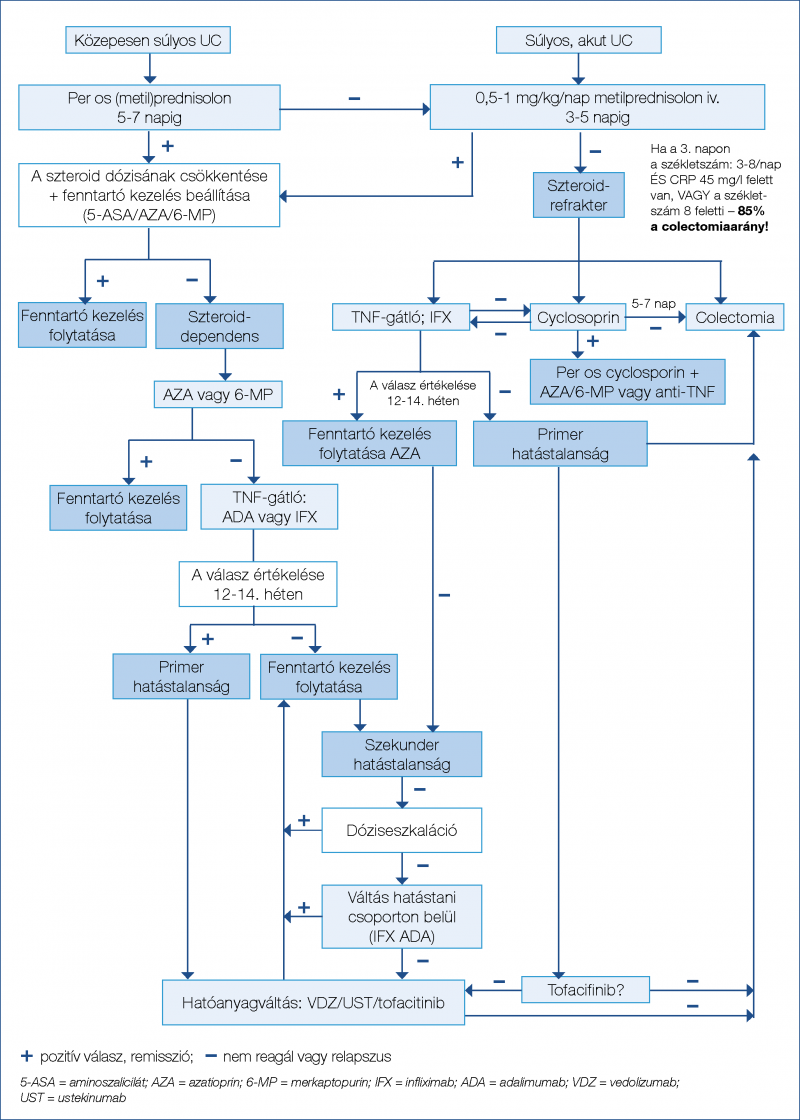
A korai és hatékony gyógyszeres kezelési lehetőségek ellenére az IBD terápiájában továbbra is jelentős szerepet töltenek be a sebészeti beavatkozások, mivel bizonyos esetekben ezek kínálják a legjobb kimenetelt a betegek számára, rövid és hosszú távon egyaránt.
Összefoglalás
A leghatékonyabb terápiás stratégia megtalálása és alkalmazása a betegség kezdeti szakaszában kulcsfontosságú az IBD progressziójának elkerülése érdekében. A korai intervenció mérsékelheti a gyulladásos aktivitást, megelőzheti a bélkárosodást, és ezáltal csökkentheti a sebészeti beavatkozások szükségességét, valamint javíthatja az életminőséget. Megfelelő klinikai döntéstámogató eszközök hiányában azonban továbbra is kihívást jelent azon vulnerábilis betegpopuláció identifikálása, amelynek tagjai számára a legelőnyösebb ezen kezelési stratégia alkalmazása. Összességében elmondható, hogy a fiatal korban kialakuló, korai kortikoszteroid-igényű, penetráló típusú, izolált vékonybél-lokalizációjú vagy kiterjedt bélbetegségnek nagy a kockázata a súlyos lefolyásra és szövődmények kialakulására, így a korai intenzív terápia ennél a betegcsoportnál jótékony hatású lehet. A biológiai készítmények és kis molekulájú szerek tekintetében további vizsgálatok szükségesek az elérhető hatóanyagok optimális alkalmazási rendjének felállításához.
https://doi.org10.1053/j.gastro.2020.12.031
2. Le Berre C, Peyrin-Biroulet L, Sandborn WJ, et al. Selecting End
Points for Disease-Modification Trials in Inflammatory Bowel Disease: the SPIRIT Consensus From the IOIBD. Gastroenterology 2021; 160(5): 1452–1460.e21.
https://doi.org10.1053/j.gastro.2020.10.065
3. Baert F, Moortgat L, Van Assche G, et al. Mucosal Healing Predicts Sustained Clinical Remission in Patients With Early-Stage Crohn’s Disease. Gastroenterology 2010; 138(2): 463–468.
https://doi.org10.1053/j.gastro.2009.09.056
4. Hashash JG, Mourad FH. Positioning biologics in the management of moderate to severe Crohn’s disease. Curr Opin Gastroenterol 2021; 37(4): 351–356.
https://doi.org10.1097/MOG.0000000000000735
5. Peyrin-Biroulet L, Loftus EV, Colombel JF, Sandborn WJ. The natural history of adult crohn’s disease in population-based cohorts. Am J Gastroenterol 2010; 105(2): 289–297.
https://doi.org10.1038/ajg.2009.579
6. Colombel JF, Narula N, Peyrin-Biroulet L. Management Strategies to Improve Outcomes of Patients With Inflammatory Bowel Diseases. Gastroenterology 2017; 152(2): 351–361.e5.
https://doi.org10.1053/j.gastro.2016.09.046
7. Danese S, Fiorino G, Peyrin-Biroulet L. Early intervention in Crohn’s disease: Towards disease modification trials. Gut 2017; 66(12): 2179–2187. https://doi.org10.1136/gutjnl-2017-314519
8. Torres J, Caprioli F, Katsanos KH, et al. Predicting outcomes to optimize disease management in inflammatory bowel diseases. J Crohn’s Colitis 2016; 10(12): 1385–1394. https://doi.org10.1093/ecco-jcc/jjw116
9. Yarur AJ, Strobel SG, Deshpande AR, Abreu MT. Predictors of aggressive inflammatory bowel disease. Gastroenterol Hepatol (NY) 2011; 7(10): 652–659.
10. Loly C, Belaiche J, Louis E. Predictors of severe Crohn’s disease. Scand J Gastroenterol 2008; 43(8): 948–954. https://doi.org10.1080/00365520801957149
11. Sandborn WJ. Crohn’s disease evaluation and treatment: Clinical decision tool. Gastroenterology 2014; 147(3): 702–705. https://doi.org10.1053/j.gastro.2014.07.022
12. Dassopoulos T, Cohen RD, Scherl EJ, et al. Ulcerative Colitis Care Pathway. Gastroenterology 2015; 149(1): 238–245. https://doi.org10.1053/j.gastro.2015.05.036
13. Torres J, Bonovas S, Doherty G, et al. ECCO guidelines on therapeutics in Crohn’s disease: Medical treatment. J Crohn’s Colitis 2020; 14(1): 4–22. https://doi.org10.1093/ecco-jcc/jjz180
14. Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362(15): 1383–1395. https://doi.org 10.1056/NEJMoa0904492
15. Colombel JF, Jharap B, Sandborn WJ, et al. Effects of concomitant immunomodulators on the pharmacokinetics, efficacy and safety of adalimumab in patients with Crohn’s disease or ulcerative colitis who had failed conventional therapy. Aliment Pharmacol Ther 2017; 45(1): 50–62. https://doi.org110.1111/apt.13838
16. Kopylov U, Verstockt B, Biedermann L, et al. Effectiveness and safety of vedolizumab in anti-TNF-naive patients with inflammatory bowel disease – A multicenter retrospective European study. Inflamm Bowel Dis 2018; 24(11): 2442–2451. https://doi.org10.1093/ibd/izy155
17. Reenaers C, Louis E, Belaiche J, et al. Does co-treatment with immunosuppressors improve outcome in patients with Crohn’s disease treated with adalimumab? Aliment Pharmacol Ther 2012; 36(11–12): 1040–1048. https://doi.org10.1111/apt.12076
18. Yanai H, Ungar B, Kopylov U, et al. Risk of consecutive immunogenic failure in switchers of anti-tumor necrosis factor alpha among patients with inflammatory bowel diseases. Therap Adv Gastroenterol 2022; 15. https://doi.org10.1177/17562848211068659
19. Kirchgesner J, Lemaitre M, Carrat F, et al. Risk of Serious and Opportunistic Infections Associated With Treatment of Inflammatory Bowel Diseases. Gastroenterology 2018; 155(2): 337–346.e10. https://doi.org10.1053/j.gastro.2018.04.012
20. Sattler L, Hanauer SB, Malter L. Immunomodulatory Agents for Treatment of Patients with Inflammatory Bowel Disease (Review safety of anti-TNF, Anti-Integrin, Anti IL-12/23, JAK Inhibition, Sphingosine 1-Phosphate Receptor Modulator, Azathioprine / 6-MP and Methotrexate). Curr Gastroenterol Rep 2021; 23(12). https://doi.org10.1007/s11894-021-00829-y
21. Beaugerie L, Brousse N, Bouvier AM, et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet 2009; 374(9701): 1617–1625. https://doi.org10.1016/S0140-6736(09)61302-7
22. Bots S, Gecse K, Barclay M, D’Haens G. Combination immunosuppression in IBD. Inflamm Bowel Dis 2018; 24(3): 539–545. https://doi.org10.1093/ibd/izx065
23. D’Haens G, Baert F, van Assche G, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet 2008; 371(9613): 660–667. https://doi.org10.1016/S0140-6736(08)60304-9
24. Panés J, López-Sanromán A, Bermejo F, et al. Early azathioprine therapy is no more effective than placebo for newly diagnosed Crohn’s disease. Gastroenterology 2013; 145(4). https://doi.org10.1053/j.gastro.2013.06.009
25. Cosnes J, Bourrier A, Laharie D, et al. Early administration of azathioprine vs. conventional management of Crohn’s disease: A randomized controlled trial. Gastroenterology 2013; 145(4): 758–765. https://doi.org10.1053/j.gastro.2013.04.048
26. Kwak MS, Kim DH, Park SJ, et al. Efficacy of early immunomodulator therapy on the outcomes of Crohn’s disease. BMC Gastroenterol 2014; 14(1): 1–6. https://doi.org10.1186/1471-230X-14-85
27. Ben-Horin S, Novack L, Mao R, et al. Efficacy of Biologic Drugs in Short-Duration Versus Long-Duration Inflammatory Bowel Disease: A Systematic Review and an Individual-Patient Data Meta-Analysis of Randomized Controlled Trials. Gastroenterology 2022; 162(2): 482–494. https://doi.org10.1053/j.gastro.2021.10.037
28. Kugathasan S, Denson LA, Walters TD, et al. Prediction of complicated disease course for children newly diagnosed with Crohn’s disease: a multicentre inception cohort study. Lancet 2017; 389: 1710–8. https://doi.org10.1016/S0140-6736(17)30317-3.Prediction
29. Han M, Jung YS, Cheon JH, Park S. Similar clinical outcomes of early and late anti-TNF initiation for ulcerative colitis: A nationwide population-based study. Yonsei Med J 2020; 61(5): 382–390. https://doi.org10.3349/ymj.2020.61.5.382
30. Raine T, Bonovas S, Burisch J, et al. ECCO Guidelines on Therapeutics in Ulcerative Colitis: Medical Treatment. J Crohn’s Colitis 2022; 16(2): 179–189. https://doi.org 10.1093/ecco-jcc/jjab177
31. Singh S, Fumery M, Sandborn WJ, Murad MH. Systematic review with network meta-analysis: first- and second-line pharmacotherapy for moderate-severe ulcerative colitis. Aliment Pharmacol Ther 2018; 47(2): 162–175. https://doi.org10.1111/apt.14422
32. Singh S, Fumery M, Sandborn WJ, Murad MH. Systematic review and network meta-analysis: first- and second-line biologic therapies for moderate-severe Crohn’s disease. Aliment Pharmacol Ther 2018; 48(4): 394–409. https://doi.org10.1111/apt.14852
33. Faleck DM, Winters A, Chablaney S, et al. Shorter Disease Duration Is Associated With Higher Rates of Response to Vedolizumab in Patients With Crohn’s Disease But Not Ulcerative Colitis. Clin Gastroenterol Hepatol 2019; 17(12): 2497–2505.e1. https://doi.org10.1016/j.cgh.2018.12.040
34. D’amico F, Peyrin-Biroulet L, Danese S. Ustekinumab in Crohn’s Disease: New Data for Positioning in Treatment Algorithm. J Crohn’s Colitis 2022; 16: II30–II41. https://doi.org10.1093/ecco-jcc/jjac011
35. Adedokun OJ, Xu Z, Marano C, et al. Ustekinumab Pharmacokinetics and Exposure Response in a Phase 3 Randomized Trial of Patients With Ulcerative Colitis. Clin Gastroenterol Hepatol 2020; 18(10): 2244–2255.e9. https://doi.org10.1016/j.cgh.2019.11.059
36. Irving PM, Sands BE, Hoops T, et al. Ustekinumab versus adalimumab for induction and maintenance therapy in Moderate-to-Severe Crohn’s Disease: The SEAVUE study. Published online 2021: 1–2. https://doi.org10.1093/ecco-jcc/jjab075
37. Buisson A, Nachury M, Fumery M, et al. DOP76 Real-world multicenter comparison of effectiveness between tofacitinib and vedolizumab in patients with Ulcerative Colitis after failure to at least one anti-TNF agent. Aliment Pharmacol Ther 2023 Mar; 57(6): 676–688. https://doi.org10.1111/apt.17305. Published online 2020: 120.
38. Juillerat P, Grueber MM, Ruetsch R, et al. Positioning biologics in the treatment of IBD: A practical guide – Which mechanism of action for whom? Curr Res Pharmacol Drug Discov 2022; 3. https://doi.org10.1016/j.crphar.2022.100104
