Klinikai kérdések / Clinical questions
Gastroenterological issues of the new coronavirus infection
Summary
Besides the pulmonary disease caused by the new type of coronavirus, digestive symptoms can often occur. Olfactory and gustatory disturbances are quite frequent and can precede pulmonary symptoms. The frequency and severity of diarrhea are variable and can be caused by the infection itself but also by the given medication. Nausea and vomiting also vary in frequency and severity. Gastrointestinal bleeding is rare. Elevations of liver enzymes are common, as a consequence of the inflammatory state, drug-induced liver injury or pre-existent liver disease. Angiotensin-converting enzyme 2 receptors are widely distributed along the digestive tract, where the coupling of the virus is facilitated by serine proteases. Once having entered the epithelial cells, the virus follows its life cycle, damaging the infected cells. Endoscopic examinations are strictly restricted to emergencies and must be performed under the bidirectional protection of both patients and staff. The diagnostic approach, management and follow-up of liver diseases – including transplantation – should also be conducted with preventive restrictions. Dozens of drugs are under investigation: their efficacy for COVID-19 is not yet established but the digestive side effects are well known. There is no innovative compound against the virus. It is presumed that probiotics may have preventive and protective effects, but their routine administration is not recommended.
Az új típusú koronavírus okozta járványban a tüdő érintettsége mellett gyakoriak az emésztőszervi tünetek. A fertőzés kezdetén a szaglás és ízérzés zavara gyakori és megelőzheti a légzőszervi panaszokat. A hasmenés gyakorisága változó, keletkezésében nemcsak a fertőzés, de a gyógyszerhatások is közrejátszhatnak. A hányinger, hányás, gyakorisága és súlyossága változó. A tápcsatornai vérzések ritkák. Májenzim-emelkedések gyakoriak, hátterükben a fertőzés, a gyulladásos állapot és gyógyszeres sérülések állhatnak. A panaszok hátterében az angiotenzin-konvertáló enzim-2 áll, amelyhez a vírus tüskéi szerin-proteázok segítségével kötődnek és behatolnak az epithelsejtekbe. Az endoszkópos vizsgálatok végzése szigorúan szabályozott, előtérbe helyezve a betegek és a vizsgáló személyzet biztonságát. A májbetegek kivizsgálása, gondozása és kezelése – beleértve a májátültetést is – szintén az infektológiai szemlélet jegyében történik. Több tucat gyógyszer áll kivizsgálás alatt: ezek hatásossága még nem ismert, de emésztőszervi mellékhatásaik igen. Célzott, innovatív szer nincs. A probiotikumok preventív és protektív hatása feltételezhető, de rutinszerű adásuk nem indokolt.
A 2019 decemberétől Kínából kiinduló és világszerte elterjedt koronavírus-fertőzés felkészületlenül érte az orvostársadalmat, az egészségügyi hatóságokat, sőt a politikusokat is. A COVID-19 tudományos közlemények lavináját indította el: a kézirat írásakor a PUBMED-adatbázisban 2019 decemberétől több mint 9000 közlemény sorakozik (1). A fertőzéssel kapcsolatos teendőkről ismételt minisztériumi rendeletekből és szakmai kollégiumi állásfoglalásokból tájékozódhattunk (2, 3), az Orvosi Hetilap ez évi 17. számában 13, szakértők által írt közleményben foglalták össze a tudni- és tennivalókat: ebből azonban a COVID-19 gasztroenterológiai vonatkozásai kimaradtak (4). A jelen közlemény célja a SARS-CoV2-fertőzés és az emésztőszervek kapcsolatának összefoglalása.
A koronavírusok története
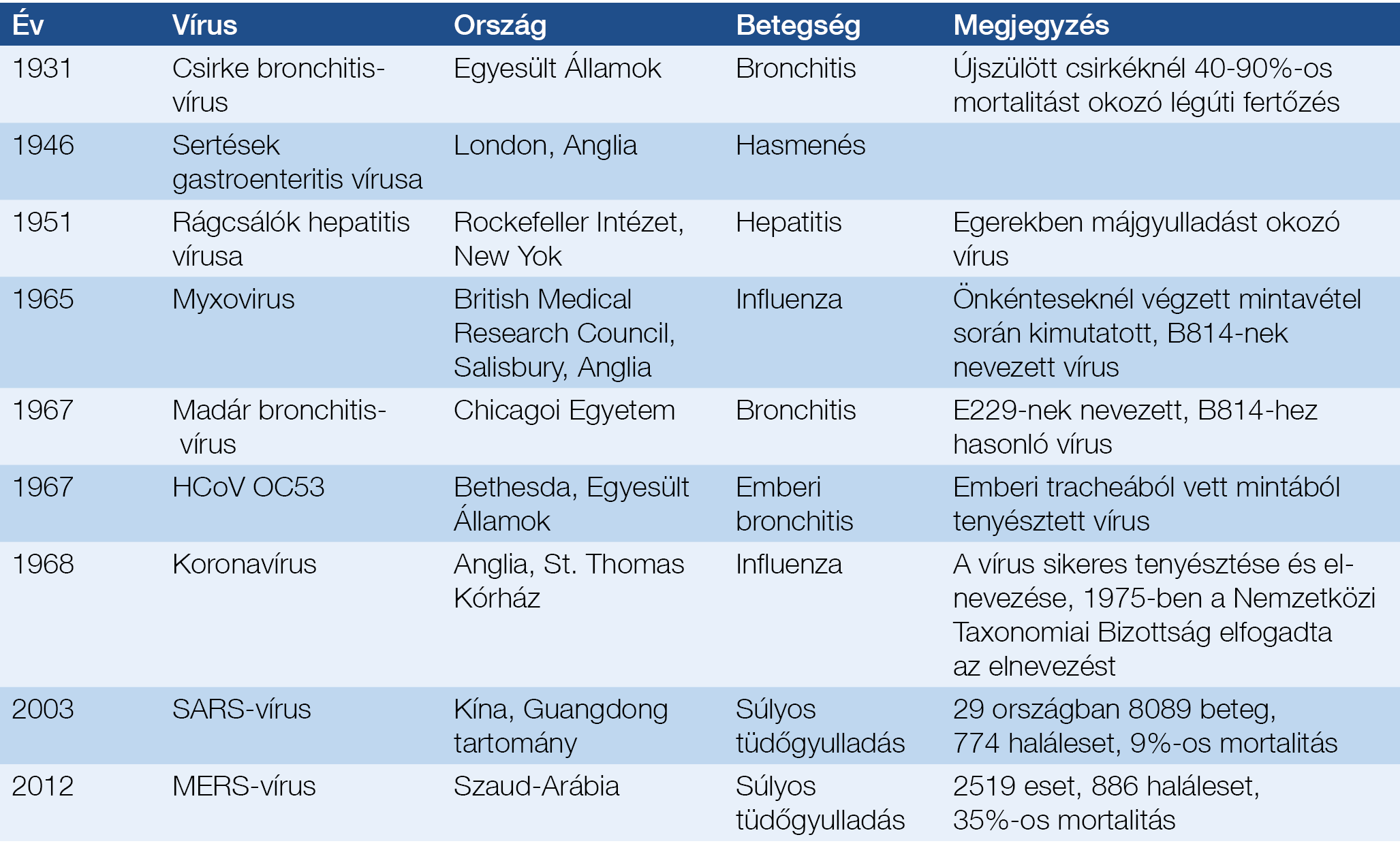
Az emberiség történetében az első fertőzések a neolitikumban (Kr. e. 10 000-15 000 év) jelentek meg párhuzamosan a mezőgazdaság és állattenyésztés kialakulásával, illetve a lakosság településekbe való tömörülése idején. Az első emberi fertőzések állati eredetűek voltak. Az első európai grippejárvány 1173–1174-ben, az első pandémia 1510–1557 között zajlott le, majd következett az 1918-as, tévesen spanyolnáthának nevezett világjárvány. Elsőként 1898-ban írták le a szarvasmarhák száj- és körömfájás vírusát, majd 1902-ben a sárgaláz kórokozóját azonosították: ez volt az első igazolt emberi vírusos betegség. A humáninfluenza vírusát 1933-ban mutatták ki (5). Az 1. táblázatban ismertetjük az eddig felfedezett koronavírusok adatait. Eredetük kb. 8000 évre vezethető vissza, természetes gazdájuk a denevér és a madarak, köztesgazdaként felmerült a teve és újabban a házimacska szerepe is (5–7). Magyarországon az első koronavírus-fertőzést 2005-ben észlelték a Honvéd Kórházban: egy Indiából hazatért férfinél SARS-CoV-fertőzést igazoltak (8).
A SARS-CoV2-fertőzés emésztőszervi tünetei
Bár a SARS-CoV2 elsődleges affinitása a felső és alsó légutak, a tünetek alapján felmerült az emésztőszervek érintettsége is, amely nemcsak a betegek sorsát befolyásolhatja, de a vírus terjedését is. Az emésztőszervek részvételét támasztják alá a tünetek jelenléte, a virális RNS kimutatása a székletből, illetve az ACE2-receptorok kimutatása egyes emésztőszervi epithelsejteken. Indirekt bizonyíték, hogy a MERS-t okozó koronavírus is emésztőszervi panaszokat okozott (9).
Az eddigi tanulmányok kórházi esetsorozatok rövid idejű megfigyelésén alapulnak és a tünetek értékelése hozzávetőleges, ugyanis azokat a domináns légzőszervi panaszok hátterében kevésbé pontosan regisztrálták.
1. táblázat: A koronavírusok története (5–7)
A fertőzés hosszú távú hatása az emésztőszervekre nem ismert. A 2. táblázatban egy áttekintés (10), két kínai metaanalízis (11, 12) és egy amerikai esetkontroll-tanulmány (13) alapján a SARS-CoV2-fertőzés emésztőszervi tüneteit ismertetjük.
A járvány rövid ideje tart, a szerzők a forrongó téma miatt igyekeztek gyorsan közölni eredményeiket, így az adatok ideiglenesnek tekintendők és az egyes tünetek gyakorisága, súlyossága a tapasztalatok bővülésével biztosan változni fog.
2. táblázat: A SARS-CoV2-fertőzés emésztőszervi tünetei (9–13)
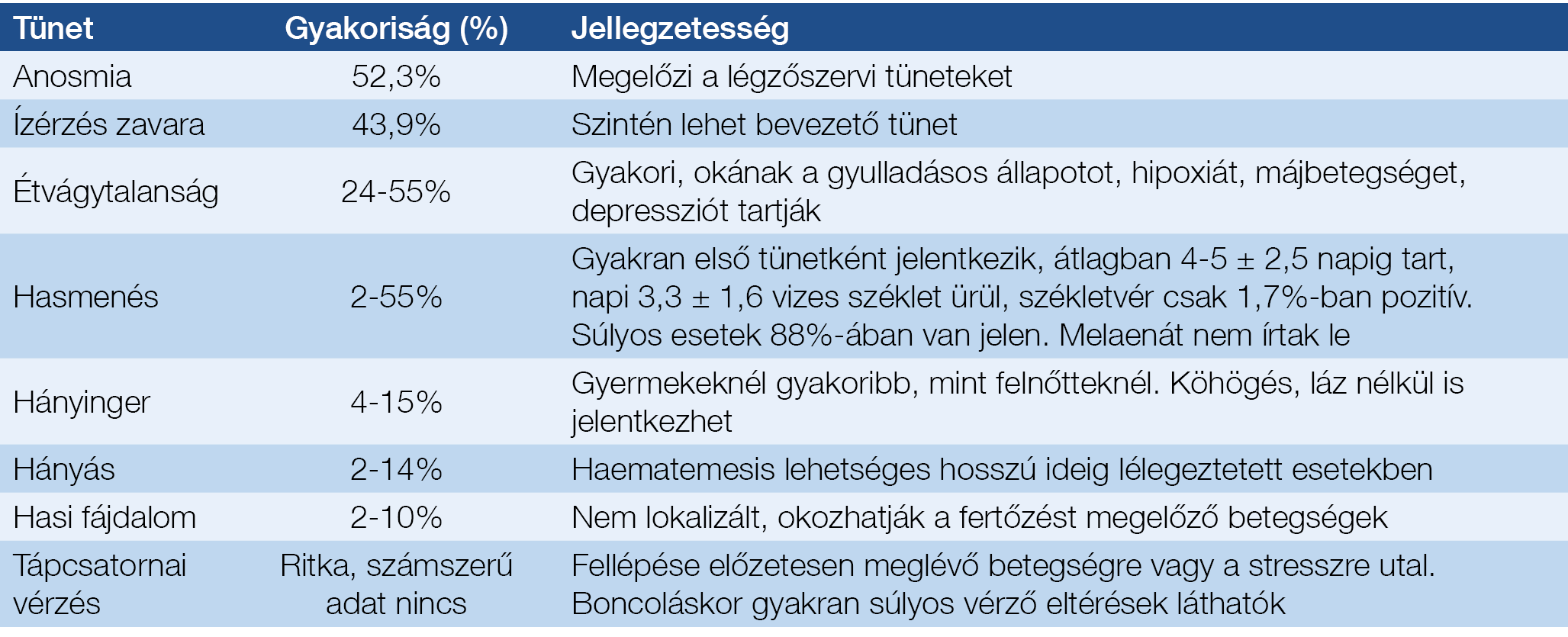
Amit mind a gasztroenterológusnak, mind a háziorvosnak fontos tudni, hogy az esetek 20%-ában az emésztőszervi panaszok légúti betegség hiányában keletkeznek. Összességében, a COVID-19 esetek 18-36%-ában jelentkeznek emésztőszervi tünetek. Fontos, hogy a szaglás- és ízérzés zavara igen gyakori, és megelőzik a légzőszervi/emésztőszervi panaszokat. A hasmenés keletkezéséhez az antibiotikum-kezelések is hozzájárulhatnak. Manifeszt tápcsatornai vérzés ritka, bár boncoláskor gyakran találtak többszörös, vérző elváltozásokat (nyelőcsővarix, gyomor- és béleroziók): nem tudni, hogy ezek direkt virális hatástól vagy a gépi lélegeztetés okozta stressztől keletkeztek, illetve már előzetesen léteztek.
Az emésztőszervi tünetek gyakoribbak a súlyos klinikai formákban, mint a kevésbé súlyosakban (17, illetve 12%).
A tünetek értelmezésében zavaró tényező, hogy különösen idős betegeknél a már azelőtt meglévő emésztőszervi betegségek, esetleg daganatok tünetei rátevődnek a fertőzés tüneteire (9–12).
Speciális csoportot képeznek a gyulladásos bélbetegségek, amelyben a SARS-CoV2 a tünetek fellángolásához vezethet, bár úgy tűnik, az IBD nem jár a fertőzés fokozott kockázatával. A szakmai társaságok (BSG, ECCO, IOIBD) részben egymásnak ellentmondó javaslatokat tettek az IBD kezelésére COVID-19-ben (szteroidok, azathioprin adása/felfüggesztése? Biológiai terápia megválasztása, cseréje, megkezdése vagy folytatása?). Az IBD-s betegeknek centrumokban való ellátása és követése szükséges (14).
Endoszkópia COVID-19-ben
A hazai és nemzetközi szakmai szervezetek, társaságok elsők között dolgozták ki az endoszkópos vizsgálatok végzésének irányelveit, szabályait COVID-19-ben (3, 15). Általános az egyetértés abban, hogy fertőzött vagy fertőzésre gyanús betegben elektív vizsgálatok végzése tilos és meghatározták azon sürgős állapotokat, ahol a beteg és a vizsgálók személyes védelme mellett az endoszkópia elvégezhető. Az elektív vizsgálatok halasztása révén jelentős várólisták alakultak ki mindenütt és az eltelt hetekben már azon gondolkoztak, hogyan lehetne visszatérni a rutinendoszkópos vizsgálatok végzéséhez (16). Bizonyosnak tűnik, hogy az endoszkópos vizsgálatok tárgyi és személyi követelményei jelentősen szigorodni, költségei pedig növekedni fognak. A szigorú korlátozások miatt csak néhány közlemény jelent meg a COVID-19-ben végzett vizsgálatokról: Wuhanban – a járvány kiindulópontja! – 31 sürgős ERCP-t végeztek el, egyetlen eset bizonyult SARS-CoV2-pozitívnak, bár a gyakorlatban, több esetben a teszt végzése csak az endoszkópos beavatkozás után volt lehetséges, ezért ott minden új beteget potenciális SARS-CoV2-fertőzöttnek tekintettek, függetlenül, attól, hogy alacsony vagy magas kockázatú csoportba sorolták be (17). Leírták nyelőcsővarix ligatúráját is gépi lélegeztetésű COVID-19-betegben, ahol sikerült a vérzést megállítani és a beteg állapota nem romlott (18).
Tekintettel az endoszkópia invazív jellegére és a fertőzés lokalizációjára a légutakban és emésztőszervekben, felmerül a lehetősége a vírus nozokomiális továbbításának kockázata az aeroszolok és cseppfertőzések révén: ennek elkerülésére különböző protokollokat dolgoztak ki (kínai, japán, angol, spanyol, amerikai), lebontva a tennivalókat a beavatkozás előtti triázs időszakára, a vizsgálat közbeni és utáni védekezésre: aranystandard irányelv még nincs (19).
Nincs adat arról, hogy sikerült-e COVID-19-betegeken végzett vizsgálatok után a kórokozó kimutatása a használt eszközökről (20).
A teendők alapos és ismételt oktatása és a tréning igen fontos, mert vészhelyzetben a stressz, a tapasztalat hiánya, a kifáradás és a kiégés az emberi hibák halmozódásához vezet (20).
Képalkotó vizsgálatok
A nemzetközi és hazai ajánlások az elektív, előjegyzett ultrahang- és CT/MRI-vizsgálatok halasztását javasolják mind a gyomor-bél traktus, mind a máj, epeutak és pancreas esetében: ez értelemszerűen hosszú távon a vizsgálatok felhalmozódásához és várólistákhoz vezet. SARS-CoV-fertőzött betegek vizsgálatánál az endoszkópiában használt protokollokat kell alkalmazni. Mind a mellkas, mind a has vizsgálatában az ágy mellett használható hordozható készülékeket javasolják (21, 22).
Kilégzési tesztek
Bár nem invazív vizsgálatok, de hasonló problémák merülnek fel a kilégzési tesztek esetében is – urea teszt, hidrogén kilégzési teszt -, mivel a beteg szájnyálkahártyája kontaktusba kerül a mintavételi eszközzel és az alveolaris levegőmintákban meghúzódhat a vírus: erre vonatkozóan állásfoglalás nincs. A néhány napja az anglia Coventry-ben megjelent útmutatás szerint kilégzési tesztek végzésénél is szükséges a beteg kérdőíves triázsa, a vizsgálatot végző szakasszisztens védekezése (maszk, kesztyű, szemüveg vagy plexi arcvédő), gyanús esetben előzetesen PCR végzése, valamint az egyszer használatos tartozékok megfelelő kezelése és az alapos felületfertőtlenítés (22). Nincs elképzelés arról, hogyan lehetne fertőtleníteni a nagy értékű mérőműszereket.
A széklet-PCR-vizsgálat jelentősége
A SARS-fertőzés óta ismert, hogy SARS-CoV kimutatható a biopsziás mintákból és székletből. Elsőként az Egyesült Államokban mutatták ki a SARS-CoV2 jelenlétét a székletben, azt követően Kínából jelentettek hasonló eseteket (10). Utóbb kiderült, hogy az igazolt betegek 36-56%-ában a vírus kimutatható a székletből és ez nincs összefüggésben sem a betegség súlyosságával, sem a tünetekkel és a betegek életkorával. A székletpozitivitás időtartama 1-16 nap.
Az esetek 23-82%-ában lehetséges, hogy a negatív felső légúti eredmény ellenére a széklet PCR-pozitív marad 1-11 napig, utalva arra, hogy a vírus hosszabb ideig él az emésztő- mind a légzőszervben (23). Az adatok alapján feltevődik a fekális-orális terjedés lehetősége, ennek minden higiéniai következményével. A kezdeti hezitálás után most már eldöntött, hogy COVID-19-betegeknél rutinszerűen széklet-PCR-vizsgálatot kell végezni a betegség során, sőt, gyógyulás után is.
A COVID-19 és a máj
SARS-CoV2-fertőzésben változatos májelváltozások jelenhetnek meg. Májenzim-emelkedések a fertőzött esetek 15-50%-ában észlelhetők, általában a normális értékek felső határának az 1-2-szeresére növekednek. Ezt követi az alkalikus foszfatáz és bilirubin emelkedése: ezek értéke a COVID-19 során hullámzó. Súlyos esetekben jelentős transzamináz-emelkedés látható (9). A magas májenzim-értékeknek prediktív szerepe van, jelzik a kedvezőtlen kórjóslatot, ezért monitorozásuk indokolt. Az intrahepatikus cholestasis lehetséges, de ritkább. A hypoalbuminaemia utalhat a fertőzésre is, de azt megelőző májbetegségre is. Leírtak súlyos májelégtelenséget (24), és felléphet az „acute on chronic” májelégtelenség is (25). Nem tisztázott, hogy a májelváltozásokat maga a vírus okozza vagy az általános gyulladás, citokinvihar következményei, vagy már létező májbetegség miatt lépnek fel. Felmerült a vírusellenes kezelés okozta DILI is (26). A COVID-19 kezelésére adott, különböző csoportba tartozó szerek okozhatnak májenzim-emelkedést (remdesivir, tocilizumab, umifenovir, favipiravir, baricitinib, camostat) (27).
Az EASL állásfoglalása szerint a krónikus vírusos hepatitises betegeknél nincs fokozott kockázat a COVID-19 súlyosabb kimenetelére, viszont NAFLD/NSASH esetében az obesitas, cukorbetegség és hipertónia jelenthet fokozott kockázatot. Autoimmun hepatitisben az immunszuppresszív kezelés megszakítása nem javasolt. Májátültetést csak előrehaladott májbetegség esetén szabad végezni, mind a donort, mint a recipienst tesztelni kell. Az orvos–beteg-találkozások számát csökkenteni kell, ahol lehetséges, a telemedicinát kell igénybe venni. A májbiopsziák, endoszkópos és képalkotó vizsgálatok halasztása szükséges (25–27).
Kórélettan
Az ACE2-receptor gén expressziója fokozott a gyomor-bél traktusban, ennek megfelelően az ACE2-fehérjereceptor kifejeződése is magasabb a duodenumban, vékonybélben, vastag- és végbélben és az epehólyagban. Az ileumban az epithelsejtek 32%-a ACE2-receptor-pozitív (28). Az ACE2-receptor az enterocyták kefeszegélyén helyezkedik el. A májban kimutatták jelenlétét a cholangiocytákon, amely magyarázza a cholestasist, viszont nincs jelen a hepatocytákon.
A vékonybélben jelen lévő szerin-proteáz enzim két ágra bontja a vírus tüskéit, így azok az ACE2-receptorokhoz (S1-domén) és a sejthártyához is kapcsolódnak (S2-domén), biztosítva a vírus behatolását a sejtbe, ahol beépülve azok genetikai állományába, sejthalálhoz vezetnek (29). Az ACE2-receptor expresszióját nem befolyásolja az életkor és a nem, így nem magyarázza az idősek fokozott fogékonyságát és férfiaknál a gyakoribb fertőzést. A DPP4 szerin-exopeptidáz jellegű enzim, amely jelen van a tüdőben, bélrendszerben, májban, vesében és immunsejteken. Szerepe a kemokinek, növekedési faktorok, vazoaktív peptidek és inkretinek lebontása. Ennek alapján feltételezték, hogy a diabetológiában használt DPP4-gátlók hatásosak lehetnek a SARS-CoV2-fertőzés megelőzésében/progressziójában. Kísérleti modellekben azonban nem sikerült kimutatni kapcsolatot a DPP4 és SARS-CoV2 között, de ez nem zárja ki, hogy a DDP4-gátlóknak gyulladást és fibrogenezist gátló hatása kedvező lehet (30). A pancreasban az ACE2-receptorok megtalálhatók mind az endokrin, mind az exokrin sejteken és ez magyarázhatja a cukorbetegek fokozott fogékonyságát a fertőzés iránt, a hyperglykaemia megjelenését és a betegeknél észlelt magasabb mortalitást. Társszerephez jut a hipertónia és az obesitas is (31).
Patológia
Boncoláskor az emésztőszervek makroszkópos vizsgálatánál ödéma, nekrózis, a nyálkahártya hámlása látható. Szövettanilag jellemző a nyelőcső, gyomor, vékonybél és rectum limficitás beszűrődése. Az ACE2-receptorok festése kimutatta jelenlétüket e területeken, a virális nukleokapszid proteint is ki lehet mutatni, ami arra utal, hogy az elváltozásokat a vírus direkt hatása okozza (32). A máj vizsgálatánál sinusoidalis dilatáció, glikogénlerakódás, fokális macrovesicularis steatosis és a portális traktusok limfocitás infiltrációja látható. Regeneratív elváltozások és rostos kötegek arra utalnak, hogy régebbi májbetegség állt fenn. A májban még nem sikerült a SARS-CoV2-t kimutatni.
A SARS-CoV2 és a probiotikumok
Mint annyi más területen, itt is feltételezték a probiotikumok kedvező hatását a COVID-19 lefolyására. Két előző metaanalízisben kimutatták, hogy a probiotikumok mérsékelten lerövidítik és enyhítik a vírusos légúti fertőzések lefolyását (33, 34) és két randomizált tanulmányban mutatták ki, hogy a probiotikumok (Lactobacillus rhamnosus, Bacillus subtilism, Enterococcus faecalis) placebóhoz képest csökkentik a gépi lélegeztetést igénylő betegek tüdőgyulladásának gyakoriságát (35, 36). Kínai adatok szerint a SARS-CoV2 dysbiosist okoz, csökkentve a Lactobacillus és bifidobacterium fajok arányát (37). Állatkísérletben a probiotikumok nem csökkentik az ACE2-receptorok kifejeződését. Kontrollált klinikai tanulmányok még nincsenek, így a probiotikumok adása COVID-19-ben egyénileg lehetséges, de rutinszerű adásuk egyelőre nem indokolt és hatásuk az emésztőszervi tünetekre nem ismert. Nem tudható, hogy a probiotikumoknak van-e profilaktikus hatásuk a fertőzéssel szemben.
Perspektívák
Az új típusú koronavírus pandémia váratlanul, jelentős morbiditást és mortalitást okozva csapott le a világra. A gyakran egymásnak ellentmondó klinikai és kutatási eredmények mellett továbbra sem ismerjük pontosan a vírus terjedésének módozatait: A járvány becslésére magyar szerzők és nemzetközi csoportok által kidolgozott modellekben a pandémia mérete és időtartama jellemezhető, de nem tudni, hogy egyedi vagy visszatérő eseményről van szó (38, 39). A COVID-19 kezelésére bizonyítottan hatékony, innovatív gyógyszer nincs: a nagy reményekkel várt klorokin/hidroxiklorikin egy nemzetközi regiszter adatai szerint nem bizonyult hatásosnak, sőt, növelte a mortalitást (40), aminthogy várni kell az oltóanyagra is. Mindezek mellett ne feledkezzünk meg arról, hogy a SARS-CoV-2-fertőzés okozhat jelentős emésztőszervi panaszokat, amelyek befolyásolhatják a betegség lefolyását és a beteg sorsát.

Köszönetnyilvánítás
A szerző köszönettel tartozik Oláh Ilonának (Semmelweis Egyetem, Élettani Tanszék) az irodalomkutatásért, Józan Jolánnak a szövegszerkesztésért és Douglas Arnott úrnak (EDMF translation, Budapest) az angol összefoglaló lektorálásáért.
2. [Nemzeti Népegészségügyi Központ. Eljárásrend a 2020. évben azonosított új koronavírussal kapcsolatban (követendő járványügyi és infekció szabályok)]. 2020. március 31.
3. Szepes Z, Bor R, Fábián A, Dubravcsik Zs. A Magyar Gasztroenterológiai Társaság Endoszkópos Szekciójának SARS-CoV-2 járványügyi vészhelyzeti protokoll javaslata az endoszkópos ellátásra vonatkozóan (http://www.gastronews.hu/cikkek, accessed at 08.05.2020)
4. Váradi A, Ferenci T, Falus A. The coronavirus-induced COVID-19 pandemic. Previous experiences and scientific evidences at the end of March, 2020. (A koronavírus okozta COVID-19-pandémia. Korábbi tapasztalatok és tudományos evidenciák 2020. március végén.) Orv Hetil 2020; 161: 644–651.
5. Berche P. Une histoire des microbes. John Libbey Eurotext, Mountrouge 2007; 149–164.
6. Tyrrell DAJ, Bynoie ML. Cultivation of a novel type of common-cold virus in organ cultures. BMJ 1965; 1: 1467–1470.
7. Weiss SR. Forty years with coronaviruses. J Exp Med 2020; 217: e10100537, doi: https://doi.org/10.1084/jem.2020537
8. Rókusz L, Jankovics I, Jankovics M, et al. Miért aktuális 2013-ban a súlyos akut respirációs szindrómát okoz coronavírus-fertőzés 2005-ben Magyarországon igazolt esete? Orv Hetil 2013; 154: 1877–1882.
9. Aroniadis OC, DiMaio CJ, Rebekah E, et al. Current knowledge and research priorities in the digestive manifestations of COVID-19. Clin Gastroent Hepatol 2020. doi: https://doi.org/10.1016/j.cgh.2010.04.039 (pre-proof)
10. Tian Y, Rong L, Nian W, He Y. Review article: gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Ther 2020; 51: 843–851.
11. Tong JY, Wong A, Zhu D, et al. The prevalence of olfactory and gustatory dysfunction in COVID-19 patients: a systematic review and meta-analysis. Otolaryngol Head Neck Surg 2020, doi: https://doi.org/10.1177/0194599820926473. [Epub ahead of print]
12. Cheung KS, Hung IF, Chan PP, et al. Gastrointestinal manifestations of SARS-CoV-2 infection and virus load in fecal samples from the Hong Kong cohort and systematic review and meta-analysis. Gastroenterology 2020. doi: https://doi.org/10.1053/j.gastro.2020.03.065. (Epub ahead of print)
13. Nobel YR, Phipps M, Zucker J, et al. Gastrointestinal symptoms and COVID-19: case-control study from the United States. Gastroenterology 2020, doi: https://doi.org/10.1053/j.gastro.2020.04.017. (Journal pre-proof, epub ahead of print).
14. Hanzel J, Ma C, Marshall K, et al. Managing inflammatory bowel disease during COVID-19: summary of recommendations from gastrointestinal societies. Clin Gastroenterol Hepatol 2020; doi: https://doi.org/10.1016/j.xgh.2020.04.033 (Journal pre-proof, Epub ahead of print)
15. Grainek IM, Hassan C, Beilenhoff U, et al. ESGE and ESGENA position statement on gastrointestinal endoscopy and the COVID-19 pandemic. Endoscopy 2020; doi: https://doi.org/10,1055/a-1155-6229. (Epub ahead of print)
16. Gupta S, Shadidi N, Gilroy N, et al. A proposal for the return to routine endoscopy during the COVID-19 pandemic. Gastrointestinal Endoscopy 2020. doi: https://doi.org/10.1016/j.gie.2020.04.050 (Journal pre-proof, Epub ahead of print)
17. An P, Huang X, Wan H, et al. ERCP during the pandemic of COVID-19 in Wuhan, China. Gastrointestinal Endoscopy 2020. doi: https://doi.org/10.1016/j.gie.2020.04.022. (Journal pre- proof, Epub ahead of print)
18. El-Kassas M, Al Shafie A, Abdel-Hameed AS, et al. Emergency endoscopic variceal band ligation in a COVID-19 patient presented with hematemesis while on mechanical ventilation. Dig Endosc 2020. doi: https://doi.org/10.1111/den.13694. (Epub ahead of print)
19. Ong J, Cross CB, Dan YY. Prevention of nosocomial SARS-CoV2 transmission in endoscopy: international recommendations and the need for a gold standard. Gut 2020; 69: 1145–1148.
20. Magro F, Abreu C, Rahier J-F. The daily impact of COVID-19 in gastroenterology. UEG Journal 2020. doi: https://doi.org/10.1177/205064020920157 (Epub ahead of print)
21. Wilson MP, Katiariowala P, Low G. Potential implications of novel coronavirus disease (COVID-19) related gastrointestinal symptoms for abdominal imaging. Radiography (London) 2020; doi: https://doi.org/10.1016/j.radi.2020.04.16. (Epub ahead of print)
22. Chandrapalan S, Persaud K, Arasaradnam RP. Breath diagnosis in the era of SARS-CoV-2 – clinical and research arena. J Breath Res 2020; doi: https://doi.org/10.1088/1752-7163/ab924a. Online ahead of print.
23. Zhang J, Wang S, Xue Y. Fecal specimen diagnosis 2019 novel
coronavirus-infected pneumonia. J Med Virol 2020. doi: https://doi.org/10.1002/jmv.25742
24. Weber S, Mayerle J, Irlbeck M, et al. Severe liver failure during SARS-CoV-2 infection. Gut 2020. doi: https://doi.org/10.1136/gutjnl-2020-321350.
25. Qiu H, Wander P, Bernstein D, et al. Acute on chronic liver failure from severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Liver Int 2020. doi: https://doi.org/10.1111/liv.14506. (Epub ahead of print)
26. Li J, Fan JG. Characteristics and mechanism of liver injury in 2019 coronavirus disease. J Clin Trans Hepatol 2020; 8: 13–17.
További irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.olo.hu weboldalon.
27. Boettler T, Newsome PN, Mondelli MU, et al. Care of patients with liver disease during the COVID-19 pandemic: EASL-ESCMID position paper. J Hep Reports 2020; 2: 1–8, doi: https://doi.org/10.1016/j,.jhepr.2020.100113.
28. Li M-Y, Li L, Zhang Y, et al. Expression of the SARS-CoV-2 cell receptor gene ACE-2 in a wide variety of human tissues. Infectious Disease of Poverty 2020; doi: https://doi.org/10.1186/s41249-020-00662.
29. Mönkemöller K, Fry LC, Rickes S. COVID-19, coronavirus, SARS-CoV-2 and the small bowel. Rev Esp Enferm Dig 2020; doi: https://doi.org/10.17235/reed.2020.7137/20201. (Epub ahead of print)
30. Strollo R, Pozzilli P. DPP4 inhibition: preventing SARS-Co-V2 infection and/or progression of COVID-19? Diabetes Metab Res Rev 2020; doi: https://doi.org/10.1002/dm44.3330. (Epub ahead of print)
31. Huang I, Lim MA, Prasnata R. Diabetes mellitus is associated with increased mortality and severity of disease in COVID-19 pneumonia. A systematic review, meta-analysis and metaregression, Diabetes Metab Syndr 2020; 17: 395–403. doi: https://doi.org/10.1016/j.dsx.2020.04.018. [Epub ahead of print]
32. Tian S, Xiong Y, Liu H, et al. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmortem core biopsies. Modern Pathol 2020. doi: https://doi.org/10.1038/s41379-020-0536-x. (Epub ahead of print)
33. King S, Glanville J, Sanders ME, et al. Effectiveness of probiotics on the duration of illness in healthy children and adults who develop common acute respiratory infectious conditions: a systematic review and meta-analysis. Br J Nutr 2014; 112: 41–54.
34. Hao Q, Dong BR, Wu T. Probiotics for preveting acute upper respiratory tract infections. Cochrane Database Syst Rev 2015; CD006895 (Abstract)
35. Morrow LE, Kollef MH, Casale TB. Probiotic prophylaxis of ventilator-associated pneumonia: a blinded, randomized, controlled trial. Am J Respir Crit Care Med 2010; 182: 1058–1064.
36. Zeng J, Wang CT, Zhang FS, et al. Effect of probiotics on the incidence of ventilator- associated pneumonia in critically ill patients: a randomized controlled multicenter trial.Intensive Care Med 2016; 42: 1018–1028.
37. Mak JWY, Chan FKL, Ng SC. Probiotics and COVID-19: one size does not fit all. Lancet Gastroenterol Hepatol 2020. doi: https://doi.org/10.1016/S2468-1253(20)30122-9.
38. Boldog P, Tekeli T, Vizi Zs, et al. Risk assessment of novel coronavirus COVIOD_19 outbreaks outside China. J Clin Med 2020; 9: 571. doi: https://doi.org/10.3390/jcm90220571.
39. Wynants L, Van Calster B, Bonton MMJ, et al. Prediction models for diagnosis and prognosis of covid-19 infection: systematic review and critical apprisal. BMJ 2020; 369: m1328. doi: https://doi.org/10/1136/bmj.m1328.
40. Mehra MR, Desai SS, Ruschitzka F, Patel AN. Hydroxychloriquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis. Lancet 2020; doi: https://doi.org/10.1016/S0140-6736(20)31180-6 https://doi.org/10.1053/j.gastro.2014.10.038
