Összefoglaló közlemények / Reviews
Hemostasis changes in liver cirrhosis
Summary
In liver cirrhosis, blood clotting is damaged at several points: the vast majority of patients develop thrombocytopenia; decreased levels of coagulation proteins l; levels of anticoagulants and factors involved in fibrinolysis are also decreased. In addition, increased coagulation provoked by a chronic inflammatory condition characteristic of cirrhosis should be considered. As a result of these changes, hemostasis shows a new, more labile equilibrium state that may shift toward a hypercoagulable or hypocoagulable state. Due to the complex changes, classical coagulation tests should not be used in patients with cirrhosis, instead complex coagulation tests are appropriate, which provide information on blood coagulation as a whole. Understanding the changes is important to select prophylaxis before interventions or in high risk thrombosis conditions and to define the optimal treatment for bleeding or thrombosis. Although severe cirrhosis has previously been clearly classified as acquired hemorrhage, it has recently become increasingly apparent that it is much more of a condition predisposing to thrombosis. In addition, more and more data suggest that the formation of small thrombi plays a role in the pathophysiology and progression of the disease, and prophylactic antithrombotic treatment improves the prognosis of the disease.
Májcirrózisban a véralvadás több ponton is sérül: gyakran csökken a thrombocytaszám, az alvadási fehérjék, az antikoagulánsok és a fibrinolízisben részt vevő faktorok szintje is. Emellett számolni kell a májzsugorban jellemző krónikus gyulladásos állapot provokálta fokozott alvadékonysággal. Ezen változások következtében a haemostasis egy új, a normálisnál labilisabb egyensúlyi állapotba kerül, amely eltolódhat a hiperkoagulábilis vagy hipokoagulábilis állapot irányába. Az összetett változások miatt a klasszikus alvadási vizsgálatok nem használhatóak cirrózisos betegben, helyettük a komplex alvadási vizsgálatokat kell választani.
A változások megértése fontos a beavatkozások előtti vagy a fokozott trombózisveszéllyel járó állapotok esetén alkalmazandó profilaxis megválasztásához, illetve a vérzések vagy trombózisok optimális kezelésének meghatározásához.
Bár a súlyos májzsugort korábban a szerzett vérzékenység csoportjába sorolták, az utóbbi időben egyre nyilvánvalóbbá vált, hogy sokkal inkább egy trombózisra hajlamosító állapotról van szó. Ráadásul egyre több adat utal arra, hogy a kialakuló kis thrombusoknak szerepük van a betegség patofiziológiájában, progressziójában, és a profilaktikusan alkalmazott antitrombotikus kezelés javítja a betegség prognózisát.
Bevezetés
A máj szövettani szerkezetének átalakulását, a portális hipertenzió kialakulását növekedését számos szerv funkciójának módosulása kíséri. Megváltozik a véralvadási rendszer működése is, amit korábban egyszerűen a máj működési zavara és a hypersplenia miatt kialakult hiányállapotnak tartottunk, de ma már tudjuk, hogy egy komplexebb eltérésről van szó, amely az alul- és túlműködések nem minden részletében könnyen érthető új egyensúlyának kialakulását jelenti.
A májzsugor
A krónikus májbetegség okozta szerkezeti átépülésnek és a kialakuló fibrózisnak két fontos következménye van. Az egyik a máj funkcióvesztése, valamint az intrahe-
patikus rezisztencia fokozódásának és a splanchnicus vazodilatációnak eredményeként kialakuló portanyomás emelkedése. Ezeknek további klinikai megnyilvánulásai észlelhetőek. Részben az előbbinek tulajdonítható az alvadási faktorok és az antikoagulánsok, valamint a fibrinolízis faktorainak az alacsonyabb szintje. Az utóbbi fontos következménye – más provo-
káló tényezők mellett – a bakteriális transzlokáció kóros fokozódása. Ezzel függ össze a cirrózis súlyosságával arányos mértékű gyulladásos állapot, amely számtalan patológiás folyamatot indukál, többek között aktiválja a véralvadási rendszert. Így a csökkent képződés mellett a véralvadási és fibrinolízisfaktorok consumptiójával is számolnunk kell.
A haemostasis és annak vizsgálata
A haemostasis jellemzésére többféle vizsgálómódszer létezik, amelyek közül a legtöbb a véralvadás egyes részletéről ad információt, de csak néhány olyan létezik, amely a teljes, vagy közel teljes haemostasist jellemezné. Fontos adat az abszolút thrombocytaszám és annak működése, de nehéz megmutatni a vérlemezkék esetleges kóros aktiválódását. Az INR (PI), APTI jelzik az alvadási faktorok szintjét, működését, de ezt csak akkor tekinthetjük egyértelmű irányú elváltozásnak, ha az alvadási rendszer minden más része optimálisan funkcionál. Az úgynevezett komplex, globális véralvadási vizsgálatok jóval informatívabbak a valós egyensúly tekintetében, mint a hagyományos véralvadási tesztek (PI, APTI, TI, thrombocytaszám stb).
Trombingenerációs teszt (TGA)
A trombin generációját és inaktiválódását, illetve ezek egyensúlyát jelzi, tehát a thrombus képződéséről nyújt információt. Az endogén trombinpotenciál a tesztplazma által generált nettó trombin mennyisége. Segítségével egyszerre kapunk képet a pro- és antikoagulánsok működéséről és a trombin termelésének kinetikájáról (1). A folyamat grafikusan ábrázolható (trombogram). A módszer a hipo- és hiperkoagulabilitás vizsgálatára is alkalmas (2) (1. ábra) (3).
1. ábra: Trombingenerációs teszt (TGA) (3)

Globális haemostasis tesztek (viszkoelasztikus tesztek)
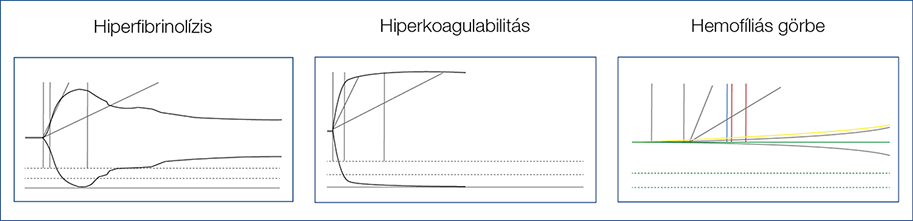
Tromboelasztográfia (TEG), tromboelasztometria (ROTEM) során egy elektromos (TEG) vagy egy optikai detektorral (ROTEM) érintkezve a rendszer a véralvadás egészére jellemző görbét rajzol. Lehetségessé válik a pro- és antikoaguláns rendszer működésének egyidejű vizsgálata, azonosítani lehet a hiperfibrinolízist és a korai koagulumfeloldódást is (4) (2. ábra) (5). Még ezek a vizsgálatok sem tökéletesek, hiszen in vivo jelentősége van az endothelium működésének és a véráramlásnak is (6).
2. ábra: Tromboelasztográfia (TEG), tromboelasztometria (ROTEM) (5)
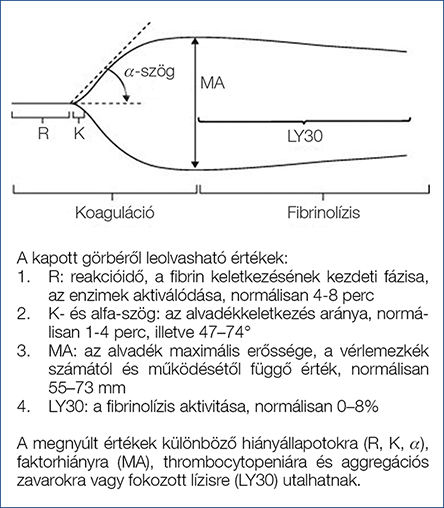
Sajnos ezek a vizsgálatok széles körben nem elérhetők, Magyarországon is csak egyes központokban állnak rendelkezésre (pl. Debrecenben van), azonban a konzekvensen felmerülő igénnyel valószínűleg gyorsítani lehetne ezek beállítását a mindennapi gyakorlatba.
Haemostasisváltozások májcirrózisban
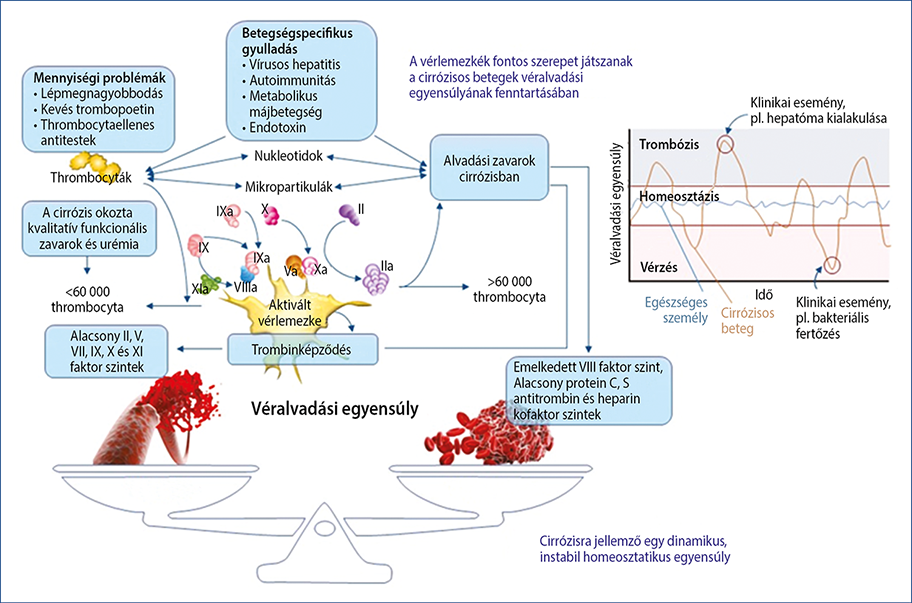
A normális haemostasist a thrombocytáknak, az endothel megfelelő működésének, a vérben található alvadási faktoroknak és a véralvadás inhibitorainak finom összjátéka biztosítja. Cirrózisban csökken a vérlemezkék száma, módosul a működésük, csökken a máj által termelt alvadási faktorok (a FVIII-t kivéve valamennyi ide tartozik) szintje, de csökken az ugyancsak a máj által termelt antikoagulánsok, valamint a fibrinolízis faktorainak koncentrációja is. A vérzési rizikót hagyományosan a véralvadáshoz szükséges elemek kóros szintjével jellemezzük (thrombocyta, INR, APTI, TI). Azonban májzsugoros betegekben a szintetikus funkció károsodása és a portális nyomásemelkedés miatt számolni kell valamennyi említett közreműködő csökkent funkciójával, ugyanakkor a tartós gyulladásos állapot miatt a tényezők fokozott aktiválódásával. Emiatt a haemostasis jellemzésére komplexebb vizsgálatok szükségesek (3. ábra).
3. ábra: A haemostasiseltérések értékelése (6)
A thrombocyták
Cirrózisban jellemzően alacsonyabb a thrombocytaszám. Az esetek 76%-ában értéke 140 G/l alatt, 13%-ban 50-75 G/l, és 1%-ában kevesebb mint 50 G/l. Azonban normálisan működő 50 G/l thrombocyta már elegendő a trombin- (FII) generációhoz, azaz a véralvadás beindításához. Cirrózisban kimutattak működésbeli eltéréseket is. Ugyanakkor a Von Willebrand-faktor szintje emelkedett, amely kompenzálhatja az alacsony vérlemezkeszámot. Ennek következtében a krónikus májbetegek vérlemezkeértékeit nem használhatjuk az alvadási egyensúly jellemzésére (7).
Thrombocytopenia
A vérlemezkeszám-csökkenést általában a megnagyobbodott lép túlműködésének, az úgynevezett hyperspleniának tulajdonítják, amely egy fontos tényező, azonban emellett számolni kell a vérlemezkék csökkent képződésével, és fokozott szétesésével, felhasználásával (consumptióval) is.
Hypersplenia
A portális nyomás emelkedésével párhuzamosan megnagyobbodik a lép, és kialakul a hypersplenia (a lép a normálisnál jelentősebb számban távolítja el a vérből az alakos elemeket, ami csökkent thrombocyta-, fehérvérsejt- és vörösvértestszámhoz vezet). A lép a legtöbb esetben megnagyobbodott, de a hypersplenia súlyossága nincs összefüggésben a splenomegalia fokával vagy a portális hipertenzió mértékével. (Normális méretű lép járhat hyperspleniával, ugyanakkor megnagyobbodott lép esetén is lehet normális a lép aktivitása, illetve a hemodinamikai eltérés korrigálása nem minden esetben javítja a lép túlműködését [8].)
Fokozott szétesés
Cirrózisos betegekben vérlemezkék ellen termelődött antitestek jelenhetnek meg, amelyek az immunthrombocytopeniához hasonló, de annál enyhébb mértékű thrombocytakárosodást okoznak, ez fokozza a thrombocyták kiszűrését, lebontását a lépben (9).
Csökkent képződés
A thrombocyták termelődését, érését a májban termelődő trombopoetin (TPO) szabályozza, amelynek mennyisége a májműködés hanyatlásával csökkenhet (8, 10).
Consumptio
Májzsugorban bizonyos jelek fokozott trombózishajlamot jeleznek. A máj szerkezeti változása és a keringés módosulása miatt kialakuló nagy nyíróerők provokálják a vérlemezke-aggregációt, illetve előidézik a vWF konformációváltozását, amely miatt az aktívabban kötődik a vérlemezkékhez, fokozva a trombotikus hajlamot.
A BT miatt a keringésben baktériumok, bakteriális termékek, endotoxinok jelennek meg, amelyek citokintermelést indukálnak (interleukin-1 és tumornekrózisfaktor-alfa), amelyek növelik az endothelsejtek szövetifaktor-elválasztását, csökkentik a trombomodulin-expressziót. Az endotoxaemia hatására nő az endothelsejtekben a vWF-szintézis, és valószínűleg felelős a magas VIII faktor szintért is (7). Az ADAMTS13 szintje és aktivitása csökken a magas gyulladásos citokinszint és az ellene termelt inhibitorok miatt (8). Mindezek fokozott vérlemezke-aktivációt idéznek elő (11).
A gyulladásos állapot tehát aktiválja a thrombocytákat és a véralvadási folyamatot, ami alacsony aktivitású disszeminált intravaszkuláris koaguláció (DIC) kialakulását és fenntartását eredményezi. Ez a véralvadási faktorok és a thrombocyták felhasználásával hozzájárul az alvadási idők megnyúlásához és a vérlemezkeszám csökkenéséhez (9). Előrehaladottabb májbetegség esetén általában súlyosabb a thrombocytopenia, amely összefügghet az ezekben a betegekben jellemző magasabb szintű gyulladásos állapottal (10). Emellett a TNF-alfa csökkenti a máj TPO-termelését, gátolja a megakaryocyták növekedését és differenciálódását, valamit indukálhatja a vérlemezkék apoptosisát (9). Az endotoxaemiának valószínűleg kiemelt szerepe van a portális trombózis kialakulásában is (7).
Az etiológia és a kezelés szerepe
A májzsugorhoz vezető különböző etiológiai tényezők hozzájárulhatnak a thrombocyták csökkent képződéséhez vagy a fokozott széteséséhez. Az alkohol, a vírusok, a kóros vasfelhalmozódás, de még a cirrózist indukáló tényezők kezelése is ronthatja a csontvelő működését, így csökkentheti a thrombocyták képződését. A hepatitis A-, B-, C-vírusok direkt módon gátolják a csontvelő progenitorsejtjeinek növekedését és differenciálódását in vitro. Leggyakrabban HCV-fertőzöttekben alakul ki thrombocytopenia, ami a kezelés hatására helyreáll. A vírus a thrombocyták membránján lévő receptorokhoz kapcsolódik, amelyhez anti-HCV antitestek kötődnek. Ez gyorsítja a vérlemezke eliminációját a keringésből (9). Gyógyszer okozta thrombocytopenia is hasonló mechanizmussal alakul ki.
Az alkohol csökkenti a vérlemezkék élettartamát, és ineffektív megakaryopoesishez vezethet. Csontvelő-depressziót okozhat az autoimmun hepatitis kezelése során alkalmazott azatiophrin, amely dózisfüggő módon okozhat csontvelő-elégtelenséget.
A thrombocyták funkcionális változása
Ahogy korábban említettük, cirrózisban a vWF a károsító hatások által aktivált endothelsejtekből szabadul fel. Megfelelő működéséhez a nagy multimer formák jelenléte szükséges (12). A máj csillagsejtjei által termelt ADAMTS13 metalloproteináz enzim a nagyméretű vWF-eket metszi és rövidíti, amivel fékezi az alvadási folyamatokat. A gyulladás hatása mellett a májműködés károsodása miatt is alacsony az ADAMTS13-szint, ami miatt az említett fékezőmechanizmus korlátozott (13). Ez szokatlanul nagy vWF-multimereket eredményez a plazmában, ami thrombocytakicsapódáshoz és a mikrocirkulációt zavaró thrombocytathrombus megjelenéséhez vezet (13).
Thrombocytaaggregációs zavarok
A májzsugorosokban a kollagénszerű peptid hatására adott GP IIb/IIIa receptor expressziós válasz alacsonyabb, és összefüggést mutat a májbetegség súlyosságával. Magasabb küszöbérték mellett azonban a thrombocytaaktiváció bekövetkezik (14). A háttérben a fokozott mennyiségben termelődő nitrogén-monoxid (NO) állhat (15).
A véralvadási fehérjék
A májban szintetizálódó alvadási fehérjék szintje előrehaladott májzsugorban csökken, és hasonlóan alacsonyabb lesz a szintje az ugyancsak a májban szintetizálódó protein-C-nek (PC) és protein-S-nek (PS) is. A változás egyrészt a funkcionális kapacitás csökkenésével magyarázható, másrészt azonban csökken a fehérjék féléletideje is. A fokozott lebomlást a károsodott máj nem képes kompenzálni (1).
Ezzel szemben az endothelből származó vWF és FVIII szintjét emelkedettnek találták, aminek fő oka az említett endothelsejt-aktiváció (12, 16). Számolni kell azonban a FVIII csökkent clearance-ével is (17; 18). A FVIII-nak erős prokoaguláns-aktivitása van, inhibitora a PC, amelynek szérumszintje májzsugorosokban csökkent (19). A pro- és antikoagulánsok aránya, működése befolyásolja, hogy vérzésre való hajlam, vagy inkább trombózishajlam van-e jelen az adott betegben (20, 21).
A fibrinogén a máj funkcionális kapacitásának csökkenésével kisebb mennyiségben termelődik, azonban ezt némileg ellensúlyozhatja a cirrózisra jellemző alacsonyszintű gyulladás fibrinogénképződést indukáló hatása és az inzulinszerű növekedésifaktor-kötő fehérje 1 (IGFBP-1) szintjének megduplázódása, amely komplexet képez a fibrinogénnel. A molekula oxidációra hajlamos. Cirrózisos betegekben fokozódik a karbonilizációja, megváltozik a szacharidoldalláncok glikolizációja, és sziálsavmaradékok is kapcsolódnak a fehérjéhez. Ez utóbbi miatt negatív töltésűvé váló protein Ca2+-t köt, ami elősegítheti az alvadékképződést. A módosítások következtében prokoaguláns-aktivitás fokozódik, azonban a termelődött alvadék mérete és minősége is elmarad a fiziológiástól (22).
Fibrinolízis
Minden fehérje, amely részt vesz a fibrinolízisben, a májban szintetizálódik, a szöveti típusú plazminogénaktivátort (tPA) és a plazminogénaktivátor-inhibitor-1-et
(PAI-1) kivéve. Ezért előrehaladott májzsugorban a szintjük csökken. A máj termeli a trombin aktiválta fibrinolízisinhibitort (TAFI) is. A tPA-szint a csökkent clearance-nek köszönhetően nő, amíg az inhibitora normál tartományban marad, vagy kissé emelkedik. Emelkedik a D-dimer, a protrombin fragment 1+2, a fibrindegradációs termékek, valamint plazmin-α2-antiplazmin komplexek szintje (23). Ezek alapján sokáig úgy tartották, hogy a cirrózisban fokozott a fibrinolízis, azonban Lisman és munkatársai véralvadéklízis-vizsgálat során ezt nem tudták igazolni (24). Úgy gondolják, hogy ennek oka a fokozott trombingeneráció miatt kialakuló jelentősebb TAFI-aktiváció lehet. Így nagyon valószínű, hogy a fibrinolízis esetén is egy új egyensúly kialakulásáról van szó. Ezt támogatja, hogy súlyos, fokozott fibrinolízissel összefüggő vérzés májzsugorban nem jellemző (4) (4. ábra).
4. ábra: A véralvadás új egyensúlyi állapota cirrózisban
A haemostasisvizsgálatok eredménye májzsugorban
Vérzési idő
A cirrózisos betegek kb. felében megnyúlt vérzési idő mérhető, azonban a vérzési idő és a thrombocytaszám között csak laza összefüggés van. Lehetséges megnyúlt vérzési idő 100 G/l feletti thrombocytaszám esetén, és thrombocytopeniásokban is lehet normális (25). A magyarázata valószínűleg az, hogy a vérlemezkeszám csökkenését és a kóros aggregációt a vWF emelkedett szintje ellensúlyozhatja. Valójában a vérzési idő sokkal szorosabb korrelációt mutat a májzsugor stádiumával (26). A thrombocytaszám rendezésének pozitív hatása a vérzési időre nem volt bizonyítható (27).
Ugyanakkor cirrózisos betegekben gyenge összefüggés van a vérzési idő és a vérzési rizikó között is. A dezmopresszin korrigálja a vérzési időt, azonban nem csökken a beavatkozásokkal kapcsolatos transzfúziós igény és a mortalitás sem (28). Franchis és munkatársai aktív varixvérzőkben gyakoribbnak találták az újravérzés kockázatát azokban, akik a terlipresszin mellett dezmopresszint is kaptak, mint akik nem (54% vs. 27%) (29).
PI és APTI
Cirrózisban a betegség súlyosságától függő mértékben csökken a prokoaguláns-faktorok (kivéve az FVIII és
a vWF) termelése, emiatt megnyúlik a PI és az APTI. Ezt a két tesztet évekig használták a vérzés rizikójának megbecsülésére. A küszöbértékek megadása önkényesen történt, amely alapján aztán a haemostasis korrekciójára irányuló döntések születtek. Mivel cirrózisban a prokoaguláns-faktorok mellett az antikoagulánsok szintje is alacsonyabb, a PI nem jelzi megbízhatóan a vérzékenységet ebben a betegcsoportban. A protrombinidő megnyúlása a máj szintetikus kapacitását tükrözi. Az INR-t a K-vitamin-antagonistát szedő betegek PI-eredményeinek harmonizálása céljából hozták létre, így más körülmények közt való alkalmazása kérdéses (30). Májcirrózisos betegek esetén pl. a különböző laboratóriumokban mért INR-érték jelentősen eltérhet, aminek oka, hogy a tromboplasztinok normalizációját nem végezték el májbetegekben. Ez pedig kérdésessé teszi a jelenleg használt INR-küszöbértékek májcirrózisos betegek véralvadásának jellemzésre történő alkalmazását (31). A PI mellett az APTI is megnyúlik, de ugyancsak kevéssé használható az alvadási egyensúly vizsgálatára (32).
Trombingeneráció
A klasszikus alvadási tesztek helyett jobban reprezentálja az új egyensúlyt az ún. trombingenerációs teszt. Cirrózisos betegekben ugyanannyi trombin termelődik, mint egészségesekben. A protein C aktivitását is figyelembe vevő technika alkalmazása esetén a cirrózisos plazma inkább hiperkoagulábilis, egészen a súlyos thrombocytopenia megjelenéséig (33). Ennek hátterében az állhat, hogy cirrózisos betegekben az antitrombin- és protombinszintek csökkenése mellett nő az alfa-2 makroglobulin szintje, így a kevesebb protrombin gyorsabban alakul át trombinná, és lassabban inaktiválódnak az átalakulásért felelős faktorok (34).
Viszkoelasztikus tesztek
A viszkoelasztikus tesztek eredményei is arra utalnak, hogy cholestaticus májbetegségekben, akut májelégtelenségben, és nem alkoholos steatohepatitisben (35, 36) sokkal inkább a hiperkoaguláció, mintsem a vérzékenység a jellemző. Nem tisztázott, hogy a viszkoelasztikus tesztek alapján igazolódott hiperkoagulációt kell-e, vagy hogyan kell kezelni, ugyanakkor a prokoaguláns és antifibrinolitikus szerek használata ezen betegekben különösen nagy körültekintést igényel.
A vérzékenység kialakulásában szerepet játszó egyéb tényezők
A hagyományos tesztek kóros értékénél jobban jelzi a vérzékenységre való hajlamot a veseelégtelenség az általa provokált thrombocytafunkció-romlás miatt.
Infekciók okozta endotoxaemia során aktiválódik a véralvadási rendszer, nő a trombózishajlam, amely egyik oldalról mikrovaszkuláris érelzáródás miatt szöveti károsodást okozhat, másrészt consumptio miatt fokozott vérzéshajlam is kialakulhat (37).
Terápiás lehetőségek
A vérlemezkeszám növelésére irányuló kezelési lehetőségek
A lép eltávolítása, megkisebbítése
Tekintettel arra, hogy a hypersplenia a thrombocytopenia jelentős oka, a lép teljes vagy részleges eltávolításától ennek javulását remélték. Számos próbálkozás történt a hypersplenia befolyásolására.
Sebészi kezelés: Cirrózis esetén splenectomiát korábban elsősorban a splenorenalis söntök kialakítása kapcsán végeztek. Műtéteket követően gyakran alakult ki portális és lépvénatrombózis (10-55%), de még ennél is gyakoribb volt a vérzéses szövődmény (10). Ma már nem alkalmazott eljárás.
Lépartéria-embolizáció: A totális embolizáció tályog kialakulásának fokozott kockázatával jár. A parciális embolizáció után megmaradó kis mennyiségű funkcióképes szövetmaradvány miatt csökken a lépeltávolítással járó fokozott infekciós fogékonyság, a szepszis kialakulásának esélye. 30% alatti szöveti embolizációval csak átmeneti vérlemezkeszám-emelkedést lehet elérni, viszont az 50% feletti embolizáció jelentősen emeli a szövődmények kockázatát (pl. pneumónia, peritonitis, léptályog és portálisvéna-trombózis) (10).
Rádiófrekvenciás abláció: A thrombocytaértékek tartós javulása a lép több mint 70%-os ablációja után várható. A legfőbb szövődmények a hemorrhagiás sokk és az intraabdominalis vérzés (10).
A porta nyomásának csökkentése (söntök)
Mivel a hypersplenia kialakulásának legfőbb okának a portális hipertenziót tartják, terápiás lehetőségként felmerült a portanyomás csökkentése. A portoszisztémás söntök hatására csökken a lépben uralkodó nyomás, de számottevően nem nő a thrombocytaszám. Manapság szinte kizárólag a transjugularis intrahepatikus portoszisztémás sönt (TIPS) használatos. A következményként előforduló komplikációk (hepatikus encephalopathia és májelégtelenség) és a thrombocytopeniára gyakorolt minimális hatékonyság miatt alacsony vérlemezkeszám korrekciója céljából nem javasolt az elvégzése (10).
Thrombocytapótlás
Invazív beavatkozások előtt thrombocytopeniás betegekben hagyományosan a vérlemezke-transzfúzió az elsődleges lépés. Használatát azonban limitálja a rövid ideig tartó hatása, a transzfúziós reakció kockázata és az alloimmunizáció okozta, vérlemezke elleni antitestek megjelenésének lehetősége (38).
Krónikus májbetegségre vonatkozó irányelvek nincsenek. Vitatott, hogy mely vérlemezkeszámnál indokolt a használata. Nem májbetegekben invazív beavatkozások előtt 20 G/l érték alatt adnak thrombocyta-transzfúziót. Azonban egy nagy betegszámú vizsgálat szerint még ez is szükségtelen és káros azokban, akik nincsenek vérzéses kockázatnak kitéve. Jelentős vérzéskockázat hiányában egyre inkább preferálják az érték 10 G/l-re történő módosítását, ami nagyon messze van a mindennapi gyakorlatban sokszor elvárt 50-100 G/l közötti transzfúziós célértéktől. Krónikus májbetegekben a javasolt thrombocytaszám függ a tervezett eljárástól is. Általában 50 G/l-t ajánlanak, de valójában nem határozható meg olyan küszöbérték, amely jól korrelálna a vérzéses szövődmények kialakulásának megnövekedett kockázatával műtét vagy invazív beavatkozás kapcsán (39). Egészen bizonyos, hogy a vérlemezke-transzfúziók egy része szükségtelen, és több kárral jár, mint haszonnal (38). A korábban javasolt 100 G/l thrombocytaszám legtöbbször nem érhető el. Egy tanulmányban
1 E adása után átlagosan 13 G/l-lel nőtt a vérlemezkeszám, miközben a trombingeneráció nem változott (40).
Trombopoetinreceptor-agonisták
A thrombocyta-transzfúziók mellékhatásai és nem megfelelő effektivitása miatt a vérlemezkeszám farmakológiai úton történő emelése látszott megoldásnak. A trombopoetinreceptor-agonisták (eltrombopag, romiplostim) képesek megemelni a vérlemezkeszámot, akár 100 g/l fölé is (8, 41). Hatásuk kifejlődéséhez idő kell, 10 nap, ezért alkalmazásuk elsősorban elektív műtét előtt merül fel. A kezdeti lelkesedés után azonban néhány adat alapján úgy tűnik, hogy a TPO fokozza a trombózishajlamot, különösen akkor, ha a thrombocytaszám 200 G/l fölé emelkedik (42).
Mivel bizonyos adatok arra utalnak, hogy kompenzált májzsugorban az alacsonyabb thrombocytaszám nem jelent fokozott vérzési rizikót (2), és mivel a trombingeneráció alacsony thrombocytaszám mellett is normális, továbbra is kérdés, kell-e a vérlemezkeszám emelésére törekedni, vagy mi legyen az a határérték, ahol ennek valóban van vérzést megelőző szerepe.
Thrombocytafunkció javítása
Dezmopresszin: A vazopresszinanalóg dezmopresszin az endothelsejteken és a vérlemezkéken lévő V2-receptorok révén emeli a keringő vWF, FVIII és a tPA szintjét. Hatékonyan alkalmazzák Von Willebrand-betegségben és A típusú hemofíliában, nagyobb műtéti beavatkozások előtt, valamint spontán vérzéses epizódok során. Az eredmény csökkent vérzési és alvadási idő, illetve emelkedett faktoraktivitás (FVIII, FXI, FXII), amely hatékonyan csökkentheti a vérzési rizikót ezekben a betegekben (43).
Annak ellenére, hogy cirrózisban a vWF-szint magas, egy randomizált kontrollvizsgálatban 10 µg/kg dezmopresszin intravénás adása után a cirrózisos betegekben is szignifikánsan megrövidült vérzési idő volt mérhető (44).
Egy másik vizsgálatban nem tudták bizonyítani ennek hátterében a vWF szintjének szignifikáns emelkedését. Ugyanakkor a vWF-propeptid emelkedése szignifikáns volt, de nem olyan jelentősen,
mint a párhuzamosan vizsgált hemofíliás betegekben. Az ADAMTS13-aktivitás nem változott (45).
Egyre inkább vitatják azonban a vérzési idő normalizálásának értelmét, mivel a vérzési idő és a vérzési rizikó között gyenge összefüggés van, korrekciója nem csökkenti az invazív beavatkozások során bekövetkező vérzések előfordulását.
A PI és az APTI korrekciója
Ha egyszerű faktorhiány (veleszületetten, vagy K-vitamin-antagonista-kezelés következtében) áll a megnyúlt PI és APTI hátterében, a faktorpótlás hatékonyan rendezi az eltérést. Májcirrózis esetén azonban nem ez a helyzet. A hagyományosan alkalmazott FFP- és faktorkoncentrátumok hatékonyságával kapcsolatban komoly kételyek merültek fel ebben a betegcsoportban.
Először is, a fent említett okok miatt az INR-érték meghatározása valójában bizonytalan, és az egyes laboratóriumokban eltérő lehet (42).
Másodszor az INR teljes mértékben általában nem korrigálható. Egy kisebb vizsgálatban (46) különböző típusú betegeken tanulmányozták az FFP hatását az enyhén emelkedett PI- és INR-értékekre. Az eredmények szerint a betegek 0,8%-ában érték el a normál értéket, valamint 15,9%-ban tapasztaltak 50%-os javulást. Bár a cikk nem tér ki rá, a spontán INR-megnyúlás valószínűleg májbetegekben fordult elő. Ezek az eredmények megerősítik a korábbi közléseket, miszerint az FFP hatása csak részleges és átmeneti javulást okoz, és sohasem teljes korrekciót, függetlenül az adott FFP-egységek számától. Az INR-ben tapasztalt javulás 1 egység FFP után 0,03–1,3 közötti lehet, ami miatt jelentős mennyiségű FFP-re volna szükség a PI teljes korrekciójához, ami az esetek 99%-ában egyáltalán nem volt elérhető.
A harmadik, és egyben legfontosabb szempont, hogy nincs összefüggés az INR-érték és a vérzési rizikó között. Az INR 3-as, 4-es értéke mellett is lehet trombózis irányú haemostasiseltolódás, és a normális INR sem zárja ki a vérzéshajlamot. FFP adása után csökkenhet az INR-érték, de a trombingeneráció változatlan marad (1).
A kérdéses effektivitás mellett komoly mellékhatással kell számolni. Zimmon és munkatársai egyenes arányosságot találtak a portális nyomás és a vérvolumen között cirrózisos betegekben: minden 100 ml volumennövekedés viszonylag rövid idő alatt 1,03 Hgmm portanyomás-emelkedést eredményez (47). Ha az INR értékét 2-4-ről 1,5-re szeretnénk korrigálni, a szükséges faktorpótlás mellett a portális nyomás 15,5-ről 25,8 Hgmm-re emelkedik, ami paradox módon növeli a vérzéses komplikációk esélyét (7).
A plazmatranszfúzióval kapcsolatos szvődmények miatt faktorkoncentrátumok adása is felmerült. Vizsgálatok történtek cryopraecipitatum (48) és különböző összetételű protrombinkomplex-koncentrátumok (PCC) adásával. Az utóbbiak 3 faktort (FII, FIX, FX) vagy 4 faktort (FII, FIX, FX és FVII), valamint protein C-t, protein S-t, antitrombin III-at és heparint (49) tartalmazó változatban is elérhetők. A faktorkoncentrátumok adása során nem kell számolni a megnövekedett vértérfogat negatív hatásaival, azonban profilaktikusan alkalmazva őket növelik a trombotikus események rizikóját és az FFP-hez hasonlóan nem javítják meggyőzően a protrombinidőt (50). Az FII és az FX felezési ideje hosszú (60 és 30 óra), és ismételt adás esetén akkumulálódhat (37).
Profilaktikusan a haemostasis-egyensúly pontos ismerete nélkül nem alkalmazható. Azonban még abban az esetben is, ha csökkent trombingeneráció mérhető, inkább thrombocytapótlást ajánlott alkalmazni, mivel hatékonyabban javítja a vérzéshajlamot, mint a faktorpótlás (7).
Aktív vérzés esetén adagolását a TEG eredményére kell alapozni (koaguláció <75 s) (51). Összességében valószínűleg értelmetlen a PI és APTI értékének profilaktikus korrekciójára törekedni, mert nincs összefüggés a jelzett értékek eltérései és a vérzési rizikó között (2).
Antifibrinolítikumok
Egy nem kontrollált tanulmányban az ε-aminokapronsavat hatékonynak és biztonságosnak találták májcirrózisos betegek esetén észlelt hiperfibrinolízis kezelésében, azonban, mivel helytelenül alkalmazva ez is fokozza a trombóziskészséget, megelőzően viszkoelasztikus teszt elvégzése javasolt. A mindennapi gyakorlatban rendszeresen használják olyan vérzések kapcsán is, ahol a fibrinolízis fokozott aktivitása nem bizonyítható, de további vizsgálatot tartanak szükségesnek a kockázat és a haszon megítélése céljából (52).
Vérzés és trombózis. Az antikoaguláns-kezelés előnyei és hátrányai.
Új típusú készítmények
Májcirrózisban tehát a véralvadási rendszer több ponton is érintett. Az egyes elemek szintje csökken vagy emelkedik, az esetek döntő többségében thrombocytopenia jelentkezik. Azonban összességében ezek az eltérések nem befolyásolják a trombingenerációt, amely kulcslépése a haemostasisnak. A változások következtében a véralvadásban egy új egyensúlyi állapot alakul ki, amely eltolódhat hipo- vagy hiperkoagulábilis irányba. A korábbi vélemények – amelyek szerint a májcirrózis alvadási zavarral és fokozott vérzékenységgel jár – megdőlni látszanak. Tapasztalatok szerint sok cirrózisos betegben alakul ki trombózis, főleg a portális vénákban (21). Ugyanakkor gyakoriak a vérzések is, amelyek leginkább invazív beavatkozásokhoz köthetőek. Nem egyszerű ezek kezelése és megelőzése.
Vérzés
Profilaxis invazív beavatkozások előtt
A faktorhiány miatt vérzékeny betegekkel kapcsolatos eredmények alapján invazív beavatkozások kapcsán az 1,5-es INR-értéket tartják biztonságosnak, azonban májzsugor esetén ennek semmilyen megfogható bizonyítéka nincsen. A tanulmányok szerint a vérzéskockázatot sokkal jobban befolyásolja a súlyos szisztémás gyulladás, pl. az infekció (ilyenkor heparinszerű anyagok termelődnek) és az akut vesekárosodás, amely a thrombocytafunkciót rontja (2).
A minimálinvazív beavatkozások után a vérzésveszély kockázata alacsony, pl. a paracentesis (0-3,3%) és a thoracocentesis (2%) (53). Schepis és munkatársai nagy számú betegben vizsgálták a vérzési rizikót cirrózisosokban gyakran végzett invazív beavatkozások (perkután májbiopszia, transjugularis májbiopszia, paracentesis, thoracocentesis, különböző intervenciós eljárások és endoszkópos beavatkozások) esetén. Figyelembe vették az INR-t és thrombocytaszámot, valamint vizsgálták az adott beavatkozás előtt alkalmazott vérlemezke- vagy FFP-transzfúzió hatásait. A vérzési rizikó többnyire 1% alatti volt, csak néhány esetben érte el a 10% körüli értéket (pl. centrális véna katéter behelyezése [12%], varixvérzések endoszkópos lekötése [7,3%] és az endoszkópos retrográd colangiopancreatographia [6,2%]). A profilaktikusan alkalmazott thrombocytapótlás vagy az FFP adásából nem származott mérhető előny (54).
A vérzéses szövődmények kialakulása minimálinvazív beavatkozások esetén nem mutat összefüggést sem a thrombocytaszámmal, sem pedig az INR-rel. Még májbiopszia után is csak 0,22–0,58%-ban fordult elő vérzés, amelynek halálozása 0,1% volt. Előrehaladott, fibrotikusan átépült májból vett biopszia esetén akkor nagyobb a vérzéses szövődmények aránya, ha a thrombocytaszám 60G/l alatti (55). Ilyen esetben célszerűbb a transjugularis májbiopszia elvégzése (56).
Major intervenciók, mint pl. májsebészeti beavatkozás esetén kialakult vérzés elsősorban a sebészeti műtéti technikával és a vérzéscsillapítás módjával mutatott összefüggést, nem pedig a haemostasis laboratóriumi paramétereivel (57). A haemostasis egyensúlya szempontjából az INR-értéknél fontosabbnak tartják az optimális fibrinogénszint-értéket (a normál érték 2-4,5 g/l). Vérzés vagy sebészeti beavatkozás esetén >1 g/l fibrinogénszint elérése ajánlott, amely az in vitro viszkoelasztikus tesztek során optimális idő alatt biztosítja a vérrögképződést (58). A véralvadás globális jellemzésére a viszkoelasztikus tesztek rutinszerű használatát javasolják sebészeti beavatkozások, májtranszplantáció során.
A gyakorlattal szemben minimálinvazív beavatkozások előtt FFP- és prokoagulánsinfúzió rutinszerű alkalmazása profilaktikus céllal nem javasolt megnyúlt PI és APTI esetén. Ugyancsak nem javasolt a thrombocytaszám növelésére szolgáló kezelés. Nagy beavatkozások előtt a globális tesztek nyújtanak segítséget. Ha ezek hiperkoagulációs állapotra utalnak, nem szükséges profilaxis. ROTEM-vizsgálat során, jelentős R- és K-idő megnyúlása esetén faktorpótlás, az MA rövidülése esetén thrombocytapótlás megfontolható. Azonban ezekben a helyzetekben is inkább a „várni és figyelni” elvet preferálják, és beavatkozás csak akkor indokolt, ha a vérzéses szövődmény valóban megjelent.
Vérzéscsillapítás aktív vérzés esetén
Májzsugor esetén az aktív vérzés leggyakrabban portális hipertenzív vagy traumás eredetű.
Portális hipertenzív vérzések (varixvérzés, gastropathia) esetén a vérzés súlyosságát, az újravérzés kockázatát elsősorban a porta nyomása határozza meg. Ezt egyéb körülmények, pl. az infekció befolyásolja. Ezért ellátása során a lokális ellátás mellett (varixligáció) a porta nyomásának csökkentésére kell koncentrálni (oktreotid, terlipresszin), illetve a vérzés diagnózisakor el kell indítani a profilaktikus vagy terápiás antibiotikumkezelést. Megnyúlt INR kapcsán sem javasolt FFP adása a nem megfelelő effektivitása és a kontrollálhatatlan volumenterhelés miatt, illetve nincs egyértelmű javaslat a faktorkoncentrátumok adására sem (59). Ez alól kivétel a masszív transzfúzió (több mint 10 E vörösvértest-koncentrátum igénye súlyos kivérzés esetén) (60).
Az alvadékképződéshez legoptimálisabbnak tartható értékek az American Gastroenterological Association (AGA) guideline-ja szerint a 0,25 feletti hematokrit, 50 G/l felett thrombocytaszám és az 1,2 g/l feletti fibrinogénérték. Ha a vérzéskontrollt az említett egyéb úton nem sikerül elérni, meg lehet próbálni ezek korrekcióját (61). Azonban nem volt bizonyítható pl. a thrombocyta-transzfúzió előnye varixvérzés során (29).
Az FFP-vel szemben a faktorkoncentrátumok adása előnyösebbnek tűnik. Masszív trauma esetén a tromboelasztometria eredményének megfelelően (megnyúlt K-idő) alkalmazott PCC mellett nagyobb eséllyel volt elkerülhető a vértranszfúzió és a thrombocytapótlás, mint vakon történő FFP alkalmazása esetén (6). Nem szűnő vérzés esetén megpróbálható még kis dózisú rekombináns aktivált FVII alkalmazása, amely javíthatja a kimenetelt, és csökkentheti a transzfúzió szükségességét traumatizált, koagulopathiás betegekben (62).
Ha a globális tesztek elérhetőek, ezek segítségével pontosabban meghatározható a teendő (3. ábra).
Aktív vérzés esetén természetesen gondolni kell arra, hogy a profilaktikus céllal alkalmazott antikoaguláns-kezelést el kell hagyni, ha mód van rá, a megfelelő antidótummal a hatásukat fel kell függeszteni. Nem sok adat van arra, hogy mi a teendő, ha a beteg thrombocytaaggregáció-gátló terápia mellett vérzik. Mivel előrehaladott májzsugorban ezek alkalmazása nem gyakori, így kellő tapasztalat ebben a betegcsoportban nincs. Az aszpirin és a clopidogrel irreverzibilis hatása miatt a gyógyszer elhagyása mellett a thrombocyta-transzfúzió adása merül fel. Azonban egyéb betegcsoportokban (pl. thrombocytaaggregáció-gátló szereket szedő intrakraniális vérző betegekben) sem egyértelműek az eredmények abban a vonatkozásban, hogy a vérlemezkepótlás javítja-e a vérzés kimenetelét vagy a túlélést, ugyanakkor a thrombocyta-transzfúzió szövődményeivel számolni kell (63). Nem csillapítható vérzés esetén, ha minden egyéb próbálkozás csődöt mond, utolsó lehetőségként megpróbálható.
Trombózis
Kockázat
A májbetegek körében a megnyúlt alvadási paraméterek és alacsony thrombocytaszám ellenére gyakoriak a vénás trombotikus események (4-15%, ami az átlagos populációban észlelthez viszonyítva 8-szor magasabb) (64), míg a pulmonalis embólia nem több, mint a nem májbetegek körében (62). A leggyakoribb klinikai manifesztációk a portális vénás trombózis és a perifériás vénás trombózis. Különböző tanulmányok szerint trombózisra hajlamosító tényező az előrehaladott májzsugor, az alacsony albuminszint (28,5 g/l alatt) és a társuló diabetes mellitus (38). Az ismert genetikai hajlamosító tényezők mellett – amelyek cirrózisosokban is trombózis kialakulásával járhatnak – ezekben a betegekben a vena portaeban jelenlévő lassú áramlás, illetve a hasűri gyulladások (spontán bakteriális peritonitis) is provokáló tényezők. Portatrombózis a betegek 10-25%-ában alakul ki, és ennek valószínűsége nő a májbetegség progressziójával. Lehet tünetmentes, de jelentkezhet súlyos gasztrointesztinális vérzéssel, ascites megjelenésével, vagy béliszkémiával, amely halálos lehet (65).
Ezek az adatok azt mutatják, hogy a cirrózisos betegek nem védettek trombózissal szemben, az INR megnyúlása ellenére sem. Nincs különbség a tromboembóliás rizikót tekintve a normális vagy emelkedett INR-rel bíró cirrózisos betegek között. Előfordul 1,6-2,2-es értékű INR mellett is (62). Egy vizsgálatban a betegek 6,3%-ában alakult ki trombózis INR>3 mellett, valamint a boncolás során az esetek több mint 50%-ában találtak vérrögképződést (62).
Ezek miatt az utóbbi években született guideline-ok májzsugoros betegek esetén is határozottan a profilaktikus antikoaguláns-terápia mellett foglalnak állást, ha magas trombózisrizikó áll fenn (65).
Trombózisprofilaxis
Megfelelő profilaxis mellett a trombóziskockázat 40-60%-kal csökkenthető (66). Azonban kevés az adat az alkalmazható gyógyszerek biztonságosságát és hatékonyságát illetően májzsugorban.
A heparin az antitrombin hatás erősítésén keresztül csökkenti a vér alvadékonyságát. Az antirtombinszint csökken májzsugorban, mégis egyes kutatók előrehaladott betegség esetén az LMWH (kis molekulasúlyú heparinok) fokozott klinikai hatásáról számoltak be (67). Vizsgálatok szerint LMWH-kezelés mellett tromboembóliás esemény nem fordult elő, azonban a javasolt anti-Xa-szintet a betegek 15%-a érte el. A vérzési rizikó nem volt magasabb, mint a nem antikoagulált betegekben (68). Varixruptura esetén nem volt rosszabb a vérzéscsillapítás sikeressége és a 6 hónapos túlélés LMWH alkalmazása mellett (69). Villa és munkatársai a tromboembóliás események megelőzése mellett a cirrózis akut dekompenzációjának előfordulását is ritkábbnak találták a gyógyszert kapók körében (11,7% vs. 59,4%), illetve nőtt a transzplantációmentes túlélés (70).
Pitvarfibrilláció miatt antikoagulált cirrózisos betegekben a K-vitamin-antagonisták (VKA) alkalmazása kompenzált májzsugorban biztonságos volt, de dekompenzált esetekben jelentős vérzési rizikóval (elsősorban varixvérzéssel) kellett számolni (71). A kezelés nehézségét jelenti, hogy spontán megnyúlt INR-érték esetén a VKA-terápia dózisának beállítása bizonytalan. Ha a kezelés előtt a betegnek normális vagy minimálisan emelkedett az INR-je, a terápiás célérték a nem májbetegekhez hasonlóan 2-3 (72).
Az új típusú orális antikoagulánsok (NOAC-ok: apixaban, rivaroxaban, edoxaban, betrixaban és dabigatran) előnye, hogy a vesefunkció figyelembevételével fix dózisban alkalmazhatók. Májzsugorban történő alkalmazáskor számolni kell a véralvadásra gyakorolt hatása mellett a metabolizmusuk esetleges változásával. A jelenleg használt NOAC-oknak nincs ismert májkárosító hatásuk (71), ugyanolyan hatékonyan előzik meg a trombotikus eseményeket, mint VKA-k, de alkalmazásuk során kevesebb a gasztrointesztinális vérzés.
Mindenképpen indokolt tehát a trombózisprofilaxis azokban a betegekben, akiknek ismerten fokozott trombózisrizikójuk van (pitvarfibrilláció, dilatatív cardiomyopathia, immobilizáció, társult tumoros betegség, lezajlott mélyvénás trombózis után stb., vagyis amikor nem májzsugoros beteg esetén elindítanánk az antikoaguláns-kezelést). Ha Child–Pugh-klasszifikáció szerinti 7-10 pont közötti a betegség súlyossága, célszerű megfontolni a vena portae trombózisának profilaxisát, amely céljából az LMWH tűnik optimálisnak (66).
Hagyományosan nem ajánlott a profilaxis elindítása, ha a trombózisrizikó alacsony, illetve súlyos thrombocytopenia esetén, és aktív vérzés idején sem. Újabb adatok szerint azonban még alacsony vérlemezkeszám esetén sem nő a vérzéses szövődmények száma (67).
Trombóziskezelés
Legalább ilyen kihívást jelent a diagnosztizált trombózisok kezelése. Az antikoaguláns-kezelés nem provokálja vérzések, pl. a varixvérzés kialakulását, azonban a terápia alatt megjelenő vérzés kontrollja nehézséget jelenthet. Emiatt, ha nem ismert, célszerű tisztázni a varixok méretét, és szükség esetén a ligációjukat elvégezni még a kezelés előtt, vagy azzal egy időben (73).
A májzsugorosok körében a vena portae trombózisának előfordulása gyakori. Állhat az akut dekompenzáció hátterében, de gyakran nem okoz tünetet, emiatt véletlen lelet lehet. Kezelésükkel és megelőzésükkel kapcsolatban nincs teljes konszenzus. A portatrombózis következtében fokozódik a varixvérzés rizikója, emiatt kifejezett az óvatosság a véralvadásgátlók alkalmazásával kapcsolatban. Azonban paradox módon az antikoagulált betegekben alacsonyabb a varixvérzés előfordulása (74). A rekanalizációban tapasztalható sikerességi ráta 40-90%, míg a kezeletlen esetekben 0%. Az antikoaguláció hatására bekövetkező rekanalizáció, amely jó eséllyel elérhető, csökkenti a porta nyomását, és ezzel mérsékli a következményes szövődmények megjelenését, súlyosbodását. A mellékhatások elhanyagolhatók (75). Úgy tűnik, hogy az antikoaguláns-terápiából azok a betegek profitálnak a leginkább, akikben a vena portae trombózisa kiterjedt, és mesenterialis érintettség is jelen van, ugyanakkor a vérzés kockázata szempontjából alacsony rizikójúnak tekinthetők (70). Az LMWH-t tartják a legbiztonságosabb választásnak. Hatására a betegek több mint 70%-ában parciális, 50%-ában teljes rekanalizáció jön létre (76). Hosszú távú terápiaként a NOAC-ok hasonló biztonsággal alkalmazhatóak, mint a tradicionális alvadásgátlók (heparin, warfarin, LMWH), a vérzéses komplikációk nem gyakoribbak. Jók a tapasztalatok portális vénatrombózis kezelése során is. Hatékonyak voltak a thrombusok részleges vagy teljes feloldásában (77).
A cirrózisban kialakuló PVT kezelésére tehát nincs még guideline. Általában LMWH-val indítunk a rekanalizáció és a progresszió megakadályozása érdekében. A terápiát 6 hónapig kell folytatni. Korábban történő gyógyszerelhagyás után az esetek 35%-ában a trombózis újra kialakul. A fenntartó terápia történhet LMWH folytatásával, kompenzált beteg esetén VKA-val vagy NOAC-cal. Az élethosszig tartó terápiát személyfüggően kell meghatározni (75). Van adat arra, hogy a VKA-kkal szemben a NOAC-ok előnyösebbek. Nagaoki és munkatársai szerint fenntartó edoxabanterápia esetén a betegek 70%-ában történt teljes thrombusfeloldódás, míg a warfarint kapó betegek között ez az arány csak 20% volt. Az edoxabancsoport 5%-ában fordult elő progresszió, míg a warfarincsoport 47%-ában történt állapotrosszabbodás (78). Egy másik tanulmányban hasonlóan jobb eredmény volt elérhető rivaroxaban alkalmazása esetén, és a warfarincsoportban itt is nagyobb valószínűséggel jelentek meg dekompenzációs tünetek (gasztrointesztinális vérzés, ascites, encephalopathia), és magasabb volt a halálozás is (77).
A trombózisképződés és a májzsugor progressziójának kapcsolata
Az utóbbi időben jelentős eredmények születtek a véralvadás és a cirrózisban jellemző fibrózisképződés összefüggésével kapcsolatban. A szöveti sérülés – amely többek között a máj károsodása során is jellemző – trombin- és fibrinképződést indukál. A kis mennyiségben termelődő trombin az endothel barrierfunkcióját javítja, nagy mennyiségű trombin azonban (részben a megjelenő mikrothrombusok okozta keringési változás miatt) aktiválja a gyulladásos citokineket. Mindez további szövetkárosodást okoz, újraindítva a kört. Emellett a trombin hatására a máj csillagsejtjei myofibroblasttá alakulva provokálják a kötőszövetes átalakulást. A folyamat valójában a sebgyógyulás folyamatához szükséges, azonban a máj krónikus gyulladása során a májzsugor progresszióját jelenti, mivel a fibrózis mértéke szoros összefüggést mutat a portális hipertenzió fokával (79). A véralvadásgátlás a nagyobb tromboembóliás események profilaxisán túl ezért képes javítani a cirrózis prognózisát is. Nagyon úgy tűnik, hogy a régóta keresett fibrózisgátló gyógyszerünk a heparin, illetve megfelelő tapasztalatok összegyűjtése után esetleg a NOAC-ok lesznek.
Konklúzió
Bár már csaknem 50 éve ismertek azok az eredmények, amelyek megkérdőjelezik a hagyományos alvadási tesztek értékét májzsugoros betegek vérzési rizikójának prognosztizálásában, mégis sok klinikus azóta is változatlanul ezekre alapozza az invazív beavatkozásokkal kapcsolatos döntéseit (80, 65).
Májzsugorban új, a normálisnál labilisabb haemostasis-egyensúly alakul ki, amely az esetek többségében a trombóziskészség fokozódásával, ritkábban vérzékenységgel jár. A vérzékenység jellemzésére általánosan használt mérési módszerek, amelyeket az antikoagulánsok feltételezetten normális szintjére alapozva dolgoztak ki, nem használhatóak a vérzésveszély megítélésére ebben a betegségben. Helyettük a jövőben a viszkoelasztikus teszteket kell használni a terápiás döntések meghozatalához. A fibrózis és a véralvadás szoros kapcsolata felveti, hogy ahelyett, hogy a vérzéstől félnénk ebben a betegcsoportban, megfelelő bizonyítékok összegyűjtése után a májzsugor a tartós véralvadásgátlás egyik indikációjává válhat.
https://doi.org/10.1373/clinchem.2015.248625.
2. Turco L, de Raucourt E, Valla DC, Villa E. Anticoagulation in the cirrhotic patient. JHEP Rep 2019 16; 1: 227–239.
https://doi.org/10.1016/j.jhepr.2019.02.006.
3. Kern A, Várnai K, Vásárhelyi B. Trombingenerációs vizsgálatok és klinikai alkalmazásuk [Thrombin generation assays and their clinical application]. Orv Hetil 2014; 155: 851–857. Hungarian.
https://doi.org/10.1556/OH.2014.29899.
4. Rijken DC, Kock EL, Guimarães AH et al. Evidence for an enhanced fibrinolytic capacity in cirrhosis as measured with two different global fibrinolysis tests. J Thromb Haemost 2012; 10: 2116–2122.
https://doi.org/10.1111/j.1538-7836.2012.04901.x.
5. https://www.google.hu/search?q=thromboelastography&client=opera&hs=QZC&sxsrf=ALeKk03lEKtXRcwhLK1u9GNgNDw6Z3hm5w:1585234453786&source=lnms&tbm=isch&sa=X&ved=2ahUKEwi_lYPEsrjoAhVtwIsKHd04BagQ_AUoAXoECBQQAw&biw=1496&bih=723#imgrc=TiEAOnzs5KPXVM
6. Othman M, Kaur H. Thromboelastography (TEG). Methods Mol Biol 2017; 1646: 533–543.
https://doi.org/10.1007/978-1-4939-7196-1_39.
7. Blasi A. Coagulopathy in liver disease: Lack of an assessment tool. World
J Gastroenterol 2015; 21: 10062–10071.
https://doi.org/10.3748/wjg.v21.i35.10062.
8. Boyer TD, Habib S. Big spleens and hypersplenism: fix it or forget it? Liver Int 2015 May; 35(5): 1492–8.
https://doi.org/10.1111/liv.12702. Epub 2014 Nov 7. PMID: 25312770.
9. Mitchell O, Feldman DM, Diakow M, Sigal SH. The pathophysiology of thrombocytopenia in chronic liver disease. Hepat Med 2016; 8: 39–50.
https://doi.org/ 10.2147/HMER.S74612. A további irodalom megtalálható a szerkesztőségben, valamint a https://www.gastronews.hu weboldalon.10. Gangireddy VG, Kanneganti PC, Sridhar S, Talla S, Coleman T. Management of thrombocytopenia in advanced liver disease. Can J Gastroenterol Hepatol 2014; 28: 558–564. https://doi.org/10.1155/2014/532191.
Epub 2014 Sep 15. PMID: 25222481; PMCID: PMC4234356.
11. Raparelli V, Basili S, Carnevale R et al. Low-grade endotoxemia and platelet activation in cirrhosis. Hepatology 2017; 65: 571–581. doi: https://doi.org/10.1002/hep.28853.
12. Moake JL. Thrombotic microangiopathies. N Engl J Med 2002; 347: 589–600.
https://doi.org/10.1056/NEJMra020528.
13. Uemura M, Fujimura Y, Ko S, Matsumoto M, Nakajima Y, Fukui H. Pivotal role of ADAMTS13 function in liver diseases. Int J Hematol 2010; 91: 20–29.
https://doi.org/10.1007/s12185-009-0481-4.
14. Vinholt PJ, Hvas AM, Nielsen et al. Reduced platelet activation and platelet aggregation in patients with alcoholic liver cirrhosis. Platelets 2018; 29: 520–527.
https://doi.org/10.1080/09537104.2017.1349308.
15. Annie-Jeyachristy S, Geetha A, Surendran R. Changes in the level of cytosolic calcium, nitric oxide and nitric oxide synthase activity during platelet aggregation: an in vitro study in platelets from normal subjects and those with cirrhosis. J Biosci 2008; 33: 45–53.
https://doi.org/10.1007/s12038-008-0020-0.
16. Carnevale R, Raparelli V, Nocella C et al. Gut-derived endotoxin stimulates factor VIII secretion from endothelial cells. Implications for hypercoagulability in cirrhosis. J Hepatol 2017; 67: 950–956.
https://doi.org/10.1016/j.jhep.2017.07.002.
17. Madeira CL, Layman ME, de Vera RE, Fontes PA, Ragni MV. Extrahepatic factor VIII production in transplant recipient of hemophilia donor liver. Blood 2009; 113: 5364–5365.
https://doi.org/10.1182/blood-2009-02-206979.
18. Hollestelle MJ, Geertzen HG, Straatsburg IH, van Gulik TM, van Mourik JA. Factor VIII expression in liver disease. Thromb Haemost 2004; 91: 267–75. https://doi.org/10.1160/TH03-05-0310.
19. Sinegre T, Duron C, Lecompte T et al. Increased factor VIII plays a significant role in plasma hypercoagulability phenotype of patients with cirrhosis. J Thromb Haemost 2018; 16: 1132–1140.
https://doi.org/10.1111/jth.14011.
20. Lebreton A, Sinegre T, Pereira B, Lamblin G, Duron C, Abergel A. Plasma hypercoagulability in the presence of thrombomodulin but not of activated protein C in patients with cirrhosis. J Gastroenterol Hepatol 2017; 32: 916–924. https://doi.org/10.1111/jgh.13493.
21. Baccouche H, Labidi A, Fekih M, Mahjoub S, Kaabi H, Hmida S, Filali A, Romdhane NB. Haemostatic balance in cirrhosis. Blood Coagul Fibrinolysis 2017; 28: 139–144. https://doi.org/10.1097/MBC.0000000000000561.
22. Gligorijević N, Minić S, Križáková M, Katrlík J, Nedić O. Structural changes of fibrinogen as a consequence of cirrhosis. Thromb Res 2018; 166: 43–49. https://doi.org/10.1016/j.thromres.2018.04.005.
23. Leebeek FW, Rijken DC. The Fibrinolytic Status in Liver Diseases. Semin Thromb Hemost 2015; 41: 474–480. https://doi.org/10.1055/s-0035-1550437.
24. Lisman T, Leebeek FW, Mosnier LO et al. Thrombin-activatable fibrinolysis inhibitor deficiency in cirrhosis is not associated with increased plasma fibrinolysis. Gastroenterology 2001; 121: 131–9. https://doi.org/10.1053/gast.2001.25481.
25. Blake JC, Sprengers D, Grech P, McCormick PA, McIntyre N, Burroughs AK. Bleeding time in patients with hepatic cirrhosis. BMJ 1990; 301: 12–15.
https://doi.org/10.1136/bmj.301.6742.12.
26. Violi F, Leo R, Vezza E, Basili S, Cordova C, Balsano F. Bleeding time in patients with cirrhosis: relation with degree of liver failure and clotting abnormalities. C.A.L.C. Group. Coagulation Abnormalities in Cirrhosis Study Group. J Hepatol 1994; 20: 531–536.
https://doi.org/10.1016/s0168-8278(05)80501-x.
27. Garcia-Tsao G, Bosch J, Groszmann RJ. Portal hypertension and variceal bleeding – unresolved issues. Summary of an American Association for the study of liver diseases and European Association for the study of the liver single-topic conference. Hepatology 2008; 47: 1764–72.
https://doi.org/10.1002/hep.22273.
28. Wong AY, Irwin MG, Hui TW, Fung SK, Fan ST, Ma ES. Desmopressin does not decrease blood loss and transfusion requirements in patients undergoing hepatectomy. Can J Anaesth 2003; 50: 14–20.
https://doi.org/10.1007/BF03020180.
29. de Franchis R, Arcidiacono PG, Carpinelli L et al. Randomized controlled trial of desmopressin plus terlipressin vs. terlipressin alone for the treatment of acute variceal hemorrhage in cirrhotic patients: a multicenter, double-blind study. New Italian Endoscopic Club. Hepatology 1993; 18: 1102–1107. https://doi.org/10.1016/0270-9139(93)90464-x.
30. Tripodi A. Liver Disease and Hemostatic (Dys)function. Semin Thromb Hemost 2015; 4: 462–467. https://doi.org/10.1055/s-0035-1550440.
31. Lisman T, van Leeuwen Y, Adelmeijer J, Pereboom IT, Haagsma EB, van den Berg AP, Porte RJ. Interlaboratory variability in assessment of the model of end-stage liver disease score. Liver Int 2008; 28: 1344–1351.
https://doi.org/10.1111/j.1478-3231.2008.01783.x.
32. Warnaar N, Lisman T, Porte RJ. The two tales of coagulation in liver transplantation. Curr Opin Organ Transplant 2008; 13: 298–303.
https://doi.org/10.1097/MOT.0b013e3282fce79d.
33. Tapper EB, Robson SC, Malik R. Coagulopathy in cirrhosis – the role of the platelet in hemostasis. J Hepatol 2013; 59: 889–890.
https://doi.org/10.1016/j.jhep.2013.03.040. 8.
34. Kremers RMW, Kleinegris MC, Ninivaggi M et al. Decreased prothrombin conversion and reduced thrombin inactivation explain rebalanced thrombin generation in liver cirrhosis. PLoS One 2017; 12: e0177020. https://doi.org/10.1371/journal.pone.0177020.
35. Krzanicki D, Sugavanam A, Mallett S. Intraoperative hypercoagulability during liver transplantation as demonstrated by thromboelastography. Liver Transpl 2013; 19: 852–861. https://doi.org/10.1002/lt.23668.
36. Ben-Ari Z, Panagou M, Patch D et al. Hypercoagulability in patients with primary biliary cirrhosis and primary sclerosing cholangitis evaluated by thrombelastography. J Hepatol 1997; 26: 554–549.
https://doi.org/10.1016/s0168-8278(97)80420-5.
37. Thalheimer U, Triantos CK, Samonakis DN, Patch D, Burroughs AK. Infection, coagulation, and variceal bleeding in cirrhosis. Gut 2005; 54: 556–563. https://doi.org/10.1136/gut.2004.048181.
38. Peck-Radosavljevic M. Thrombocytopenia in chronic liver disease. Liver Int 2017; 37: 778–793. https://doi.org/10.1111/liv.13317.
39. Nadim MK, Durand F, Kellum JA et al. Management of the critically ill patient with cirrhosis: A multidisciplinary perspective. J Hepatol 2016; 64: 717–735. https://doi.org/10.1016/j.jhep.2015.10.019.
40. Tripodi A, Primignani M, Chantarangkul V et al. Global hemostasis tests in patients with cirrhosis before and after prophylactic platelet transfusion. Liver Int 2013; 33: 362–367. https://doi.org/10.1111/liv.12038.
41. Kawaguchi T, Komori A, Seike M et al. Efficacy and safety of eltrombopag in Japanese patients with chronic liver disease and thrombocytopenia: a randomized, open-label, phase II study. J Gastroenterol 2012; 47: 1342–1351. https://doi.org/10.1007/s00535-012-0600-5.
42. Moulis G, Bagheri H, Sailler L et al. Are adverse drug reaction patterns different between romiplostim and eltrombopag? 2009–2013 French PharmacoVigilance assessment. Eur J Intern Med 2014; 25: 777–780.
https://doi.org/10.1016/j.ejim.2014.09.006.
43. Svensson PJ, Bergqvist PB, Juul KV, Berntorp E. Desmopressin in treatment of haematological disorders and in prevention of surgical bleeding. Blood Rev. 2014; 28: 95–102. https://doi.org/10.1016/j.blre.2014.03.001.
44. Mannucci PM, Vicente V, Vianello L et al. Controlled trial of desmopressin in liver cirrhosis and other conditions associated with a prolonged bleeding time. Blood 1986; 67: 1148–1453.
45. Arshad F, Stoof SC, Leebeek FW et al. Infusion of DDAVP does not improve primary hemostasis in patients with cirrhosis. Liver Int 2015; 35: 1809–1815. https://doi.org/10.1111/liv.12765.
46. Abdel-Wahab OI, Healy B, Dzik WH. Effect of fresh-frozen plasma transfusion on prothrombin time and bleeding in patients with mild coagulation abnormalities. Transfusion 2006; 46: 1279–1285. https://doi.org/10.1111/j.1537-2995.2006.00891.x.
47. Zimmon DS, Kessler RE. The portal pressure-blood volume relationship in cirrhosis. Gut 1974; 15: 99–101. https://doi.org/10.1136/gut.15.2.99.
48. Kujovich JL. Hemostatic defects in end stage liver disease. Crit Care Clin 2005; 21: 563–587. https://doi.org/10.1016/j.ccc.2005.03.002.
49. Hanke AA, Joch C, Görlinger K. Long-term safety and efficacy of a pasteurized nanofiltrated prothrombin complex concentrate (Beriplex P/N): a pharmacovigilance study. Br J Anaesth 2013; 110: 764–772. https://doi.org/10.1093/bja/aes501.
50. Tischendorf M, Fuchs A, Zeuzem S, Lange CM. Use of prothrombin complex concentrates in patients with decompensated liver cirrhosis is associated with thromboembolic events. J Hepatol 2019; 70: 800–801. doi: https://doi.org/10.1016/j.jhep.2018.11.019.
51. Saner FH, Kirchner C. Monitoring and Treatment of Coagulation Disorders in End-Stage Liver Disease. Visc Med 2016; 32: 241–248.
https://doi.org/10.1159/000446304.
52. Lisman T, Bernal W. Management of Hemostatic Disorders in Patients With Advanced Liver Disease Admitted to an Intensive Care Unit. Transfus Med Rev 2017 Oct; 31(4): 245–251.
https://doi.org/10.1016/j.tmrv.2017.06.002. Epub 2017 Jun 23. PMID: 28734547.
53. Castellote J, Xiol X, Cortés-Beut R, Tremosa G, Rodríguez E, Vázquez S. Complications of thoracentesis in cirrhotic patients with pleural effusion. Rev Esp Enferm Dig 2001; 93: 566–575. English, Spanish.
54. Schepis F, Turco L, Bianchini M, Villa E. Prevention and Management of Bleeding Risk Related to Invasive Procedures in Cirrhosis. Semin Liver Dis 2018; 38: 215–229. https://doi.org/10.1055/s-0038-1660523.
55. Seeff LB, Everson GT, Morgan TR et al. Complication rate of percutaneous liver biopsies among persons with advanced chronic liver disease in the HALT-C trial. Clin Gastroenterol Hepatol 2010; 8: 877–883.
https://doi.org/10.1016/j.cgh.2010.03.025.
56. Kalambokis G, Manousou P, Vibhakorn S et al. Transjugular liver biopsy – indications, adequacy, quality of specimens, and complications – a systematic review. J Hepatol 2007; 47: 284–94.
https://doi.org/10.1016/j.jhep.2007.05.001.
57. Wei AC, Tung-Ping Poon R, Fan ST, Wong J. Risk factors for perioperative morbidity and mortality after extended hepatectomy for hepatocellular carcinoma. Br J Surg 2003; 90: 33–41. doi: https://doi.org/10.1002/bjs.4018.
58. Levy JH, Welsby I, Goodnough LT. Fibrinogen as a therapeutic target for bleeding: a review of critical levels and replacement therapy. Transfusion 2014; 54: 1389–405; quiz 1388. https://doi.org/10.1111/trf.12431.
59. European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69: 406–460.
https://doi.org/10.1016/j.jhep.2018.03.024.
60. Országos Vérellátó Szolgálat Transzfúziós Szabályzat http://www.ovsz.hu/sites/ovsz.hu/files/kepzes/szakmai_anyagok/transzfuzios_szabalyzat_2._kiadas/transzf_szab_2.pdf
61. O’Leary JG, Greenberg CS, Patton HM, Caldwell SH. AGA Clinical Practice Update: Coagulation in Cirrhosis. Gastroenterology 2019; 157: 34–43.e1. https://doi.org/10.1053/j.gastro.2019.03.070.
62. Harrison MF. The Misunderstood Coagulopathy of Liver Disease: A Review for the Acute Setting. West J Emerg Med 2018; 19: 863–871.
https://doi.org/10.5811/westjem.2018.7.37893.
63. Frontera JA, Lewin JJ 3rd, Rabinstein AA et al. Guideline for Reversal of Antithrombotics in Intracranial Hemorrhage: A Statement for Healthcare Professionals from the Neurocritical Care Society and Society of Critical Care Medicine. Neurocrit Care. 2016; 24: 6–46.
https://doi.org/10.1007/s12028-015-0222-x.
64. Pincus KJ, Tata AL, Watson K. Risk of venous thromboembolism in patients with chronic liver disease and the utility of venous thromboembolism prophylaxis. Ann Pharmacother 2012; 46: 873–878. https://doi.org/10.1345/aph.1Q726.
65. Khoury T, Ayman AR, Cohen J, Daher S, Shmuel C, Mizrahi M. The Complex Role of Anticoagulation in Cirrhosis: An Updated Review of Where We Are and Where We Are Going. Digestion 2016; 93: 149–159. https://doi.org/10.1159/000442877.
66. Jaffer AK, Amin AN, Brotman DJ, Deitelzweig SB, McKean SC, Spyropoulos AC. Prevention of venous thromboembolism in the hospitalized medical patient. Cleve Clin J Med 2008; 75 Suppl 3: S7–16.
https://doi.org/10.3949/ccjm.75.suppl_3.s7.
67. Senzolo M, Rodriguez-Castro KI, Rossetto V et al. Increased anticoagulant response to low-molecular-weight heparin in plasma from patients with advanced cirrhosis. J Thromb Haemost 2012; 10: 1823–9.
https://doi.org/10.1111/j.1538-7836.2012.04824.x.
68. Northup PG, Intagliata NM. Anticoagulation in cirrhosis patients: what don’t we know? Liver Int 2011; 31: 4–6.
https://doi.org/10.1111/j.1478-3231.2010.02376.x.
69. Cerini F, Gonzalez JM, Torres F et al. Impact of anticoagulation on upper-gastrointestinal bleeding in cirrhosis. A retrospective multicenter study. Hepatology 2015; 62: 575–83. https://doi.org/10.1002/hep.27783.
70. Villa E, Cammà C, Marietta M et al. Enoxaparin prevents portal vein thrombosis and liver decompensation in patients with advanced cirrhosis. Gastroenterology 2012; 143: 1253–1260.e4.
https://doi.org/10.1053/j.gastro.2012.07.018.
71. Lee SJ, Uhm JS, Kim JY, Pak HN, Lee MH, Joung B. The safety and efficacy of vitamin K antagonist in patients with atrial fibrillation and liver cirrhosis. Int J Cardiol 2015 1; 180: 185–91.
https://doi.org/10.1016/j.ijcard.2014.11.183.
72. Elhosseiny S, Al Moussawi H, Chalhoub JM, Lafferty J, Deeb L. Direct Oral Anticoagulants in Cirrhotic Patients: Current Evidence and Clinical Observations. Can J Gastroenterol Hepatol 2019; 2019: 4383269. https://doi.org/10.1155/2019/4383269.
73. Sasso R, Rockey DC. Anticoagulation Therapy in Patients with Liver Cirrhosis is Associated With an Increased Risk of Variceal Hemorrhage. Am J Med 2019; 132: 758–766.
https://doi.org/10.1016/j.amjmed.2019.01.006.
74. Loffredo L, Pastori D, Farcomeni A, Violi F. Effects of Anticoagulants in Patients With Cirrhosis and Portal Vein Thrombosis: A Systematic Review and Meta-analysis. Gastroenterology 2017; 153: 480–487.e1. https://doi.org/10.1053/j.gastro.2017.04.042.
75. Leonardi F, Maria N, Villa E. Anticoagulation in cirrhosis: a new paradigm? Clin Mol Hepatol 2017; 23: 13–21. doi: https://doi.org/10.3350/cmh.2016.0110.
76. Giannelli V, Di Gregorio V, Iebba V et al. Microbiota and the gut-liver axis: bacterial translocation, inflammation and infection in cirrhosis. World J Gastroenterol 2014; 20: 16795–16810.
https://doi.org/10.3748/wjg.v20.i45.16795.
77. Weinberg EM, Palecki J, Reddy KR. Direct-Acting Oral Anticoagulants (DOACs) in Cirrhosis and Cirrhosis-Associated Portal Vein Thrombosis. Semin Liver Dis 2019; 39: 195–208.
https://doi.org/10.1055/s-0039-1679934.
78. Nagaoki Y, Aikata H, Daijyo K et al. Efficacy and safety of edoxaban for treatment of portal vein thrombosis following danaparoid sodium in patients with liver cirrhosis. Hepatol Res 2018; 48: 51–58. https://doi.org/10.1111/hepr.12895.
79. Bitto N, Liguori E, La Mura V. Coagulation, Microenvironment and Liver Fibrosis. Cells 2018; 7: 85. https://doi.org/10.3390/cells7080085.
PMID: 30042349; PMCID: PMC6115868.
80. Donaldson GW, Davies SH, Darg A, Richmond J. Coagulation factors in chronic liver disease. J Clin Pathol 1969; 22: 199–204.
https://doi.org/10.1136/jcp.22.2.199.
