New solution for an old problem: biliary obstruction solved by endoscopic ultrasound-guided bile duct drainage
Summary
To bypass malignant bile duct strictures are challenging for gastroenterologists. Endoscopic retrograde cholangio-pancreatography (ERCP), percutaneus transhepatic drainage (PTD) and surgical bypass were the gold standard methods for the management of bile passage this time. Endoscopic ultrasound-guided bile duct drainage (EUS-BD) is the latest method, which could be an alternative procedure in the management of malignant bile duct strictures.
A malignus epeúti szűkületek endoszkópos megoldása az egyik legnagyobb technikai kihívás a gasztroenterológusok számára. A gold standard endoszkópos retrográd cholangio-pancreatographia (ERCP) mellett, a perkután transzhepatikus drenázs (PTD), valamint a sebészi bypass volt eddig a választandó módszer az epeelfolyás biztosítására. Az endoszkópos ultrahang-vezérelt epeúti drenázs (EUH-ED) sikeres alkalmazásáról számos nemzetközi centrum beszámolt már, gyakorlott kezekben használata reális alternatívát jelenthet, az ERCP-vel nem megoldható epeúti szűkületet okozó malignus folyamatok palliációjában.
Bevezetés
Az endoszkópos technikák fejlődésével a malignus epeúti szűkületek megoldásában egyre nagyobb szerepe van a gasztroenterológusnak. Az epeelfolyás biztosítására klasszikusan az ERCP-vel egybekötött epeúti stentelést használjuk, ennek technikai kivitelezhetetlensége esetén alternatív megoldás lehet a PTD alkalmazása (1). Ascites esetén azonban, a PTD relatíve kontraindikált, illetve magasabb szövődményrátával lehet számolni. Sebészeti intervencióra sokszor nem alkalmasak a betegek elesett általános állapotuk miatt. Ilyen esetekben alternatív megoldásként EUH-ED végezhető, az epeelfolyás biztosítására (2–5).
Az EUH-ED-t először Giovannini és munkatársai közölték 2001-ben (6). Azóta több szisztémás összefoglaló tanulmány és metaanalízis is igazolta, hogy a vizsgálat gyakorlott kézben, centrumokban 90-92%-os sikerrátával végezhető. A beavatkozás leggyakoribb szövődményei: epecsorgás, pneumoperitoneum, stentmigráció, peritonitis, cholangitis, vérzés lehetnek (7).
EUH-ED technikái
AZ EUH-ED az anatómiai szituációtól, az epeúti obstrukció helyétől függően négyféle metódussal végezhető el.
Disztális epeúti szűkület esetén választandó az EUH-vezérelt choledocho-duodenostomia (extrahepatikus drenázs) (1. 2. ábra) (8). A duodenum bulbusából ábrázolhatók a tágult extrahepatikus epeutak. Miután Doppler UH-val kizártuk az érképletek jelenlétét, EUH-val vezérelve 19-gauge FNA-tűvel a duodenum falán át az extrahepatikus epeutakba jutunk. Cholangiogramot
készítünk, a létrehozott choledocho-duodenális fisztulajáratot feltágítjuk és a retrográd irányba vezetett vezetődróton műanyag, vagy fedett öntáguló fémstentet helyezünk a fisztulán át a tágult extrahepatikus epeútba. Másik lehetőség, hogy a vezetődrótot anterográd a szűkületen és a Vater-papillán átvezetjük a pars descendensbe és hagyományos ERCP-ként folytatjuk a vizsgálatot (randevútechnika) (9).
Míg az EUH-vezérelt choledocho-duodenosztómia elvégzéséhez átjárható pylorus és ép postbulbáris dudenum szükséges, addig proximális epeúti szűkület esetén az EUH-vezérelt hepatico-gastrostomia (intrahepatikus drenázs) (1. 1. ábra), ezek hiányában is kivitelezhető.
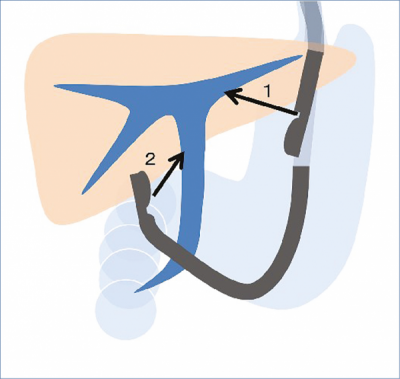
A vizsgálat a máj bal lebenyi epeúti tágulata esetén végezhető el. A beavatkozás során az echoendoszkópot a cardia, vagy a gyomor kisgörbületi oldalán stabilizáljuk, majd a máj bal lebenyének intrahepatikus epeútjait ábrázoljuk, mint ahogy eseteinkben is történt. Az echoendoszkóphoz legközelebb lévő tágult intrahepatikus epeutat a gyomor falán keresztül pungáljuk meg. Vezetődrótot juttatunk a tűn keresztül a bal lebeny intrahepatikus epeútjába, majd ezt egészen a májkapuig irányítjuk. Ha vezetődrótot anterográd irányban a szűkületen át tudjuk vezetni, akkor randevútechnikát alkalmazhatunk, vagy a szűkületet feltágítva, anterográd helyezzük be a stentet. Amennyiben a tumoros szűkületen nem sikerül átjutni, úgy a gyomor és az intrahepatikus epeút közötti fisztulajáratot feltágítjuk és műanyag vagy fémstentet helyezünk a gyomron keresztül az epeútba, hepatico-gastrostomiát képezve (10).
Esetismertetés
Két eseten keresztül szeretnénk bemutatni az EUH-ED-ben szerzett tapasztalatainkat.
1. eset
Első esetünkben, 67 éves nőbetegünknél, 2009-ben invazív ductalis adenocarcinoma miatt jobb oldali mastectomia történt, majd aromatáz-gátló kezelésben részesült. Páciensünk onkológiai gondozása, az emlődaganat nyomonkövetési protokolljának megfelelően zajlott.
Panaszmentessége ellenére, a 2013-ban rutinszerűen elvégzett hasi ultrahang- (UH) vizsgálat során, azonban a máj multiplex térfoglaló folyamatára derült fény. UH-vezérelt májbiopszia történt, a szövettani vizsgálat colorectalis tumor májmetasztázisát írta le. Ezt támasztotta alá az emlőtumorra jellemző CA15-3 normál szérumszintje (9 U/ml), valamint a karcinoembrionális protein emelkedett volta (44 ng/ml) is. Vastagbéltükrözés során az anustól 35 cm-re vérzékeny, kifekélyesedő, a szigmabél lumenét félholdszerűen szűkítő tumor igazolódott, a szövettani eredmény megegyezett a májáttétből nyert adenocarcinomáéval.
Staging vizsgálatok történtek, mellkasi komputertomográfia (CT) során a tüdőkben kóros eltérés nem igazolódott. Hasi mágneses magrezonancia (MR) vizsgálaton az UH-n is látott májmetasztázisok ábrázolódtak (2. ábra).
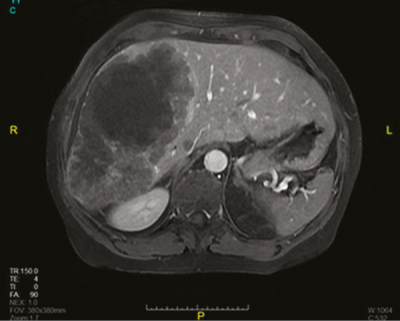
A máj jobb lebenyében és a IV. szegmentumában hatalmas inhomogén, centrálisan nekrotikus neoplázia ábrázolódott; az elváltozás szomszédságában több 1 cm-es szatellita képlettel; a II/III. szegmentumokban is 8 mm-es metasztázisok igazolódtak. Fenyegető ileus miatt, a széklet passzázs biztosítására laparoszkópos szigmabél-reszekció történt. Tekintettel az előrehaladott tumorstádiumra (T4a, N2a, M1) palliatív FOLFIRI + bevacizumab kemoterápia indult, azonban 29 ciklus kezelés után a mélyülő sárgaság kialakulása kontraindikálta a kezelés folytatását.
Ekkor jelentkezett a beteg gasztroenterológiai szakrendelésünkön. Hasi UH-n normál tágasságú extrahepatikus és tágabb intrahepatikus epeutak ábrázolódtak, a laborértékek pedig obstrukciós icterusnak megfelelően cholestasisra utaltak (GOT: 107 U/l, GPT: 100 U/l, AP: 979 U/l, GGT: 1131 U/l, bilirubin: 285 µmol/l, direkt bilirubin: 249 µmol/l).
A szakma szabályainak megfelelően ERCP-vizsgálatot végeztünk, amely során a máj jobb lebenyében szabályos tágasságú epeutak ábrázolódtak, míg a bal oldali ductus hepaticus a májvilla után 1 cm-rel teljesen abortálódott, a proximális epeutakban kontrasztanyag-telődés nem volt látható (3. ábra).

A vezetődrótot nem tudtuk a bal oldali ductus hepaticus tumoros elzáródás fölé juttatni, így az epeúti stentelés sikertelen volt. Az izolált bal oldali intrahepaticus epeúti tágulat, valamint a beteg nagy mennyiségű ascitese miatt PTD kontraindikált volt.
Ekkor döntöttünk az EUH-ED elvégzése mellett. Profilaktikus ceftriaxon adása után a beteget midazolammal és nalbuphinnal szedáltuk, a bélperisztaltikát buthylscopainnal gátoltuk. Lineáris echoendoszkópot (GF UCT 145, Olympus) vezettünk a gyomorba, amelyet a kisgörbülethez pozícionáltunk, majd 19 gauge-s tűvel (EZ-Shot, Olympus) a bal lebeny tágult intrahepatikus epeútját megpungáltuk (4. A ábra). Kolangiogram készítése során ábrázolódtak a bal lebeny tágult epeútjai és az elzáródásuk helye (4. B ábra).

Mivel antero-grád irányban a tumoros szűkületen a vezetődrótot (VisiGlide, Olympus) most sem tudtuk átjuttatni hepatico-gastrostomiát készítettünk: a fisztulajáratot 10 Fr-es cisztosztómmal (Cook Medical) feltágítottuk (4. C ábra), majd 100×8 mm-es félig fedett 8.5 Fr-es Giobor fémstentet (Taewong Medical) helyeztünk fel a tágult epeútba. A stent fedetlen
része a májban lehetővé teszi az epe elfolyását az oldalágakból is és rögzíti a stentet, míg a fedett rész a máj és a gyomor között megakadályozza az epecsorgást, míg a stent kiöblösödő vége a gyomorban a stent migrációjától véd (5. ábra).

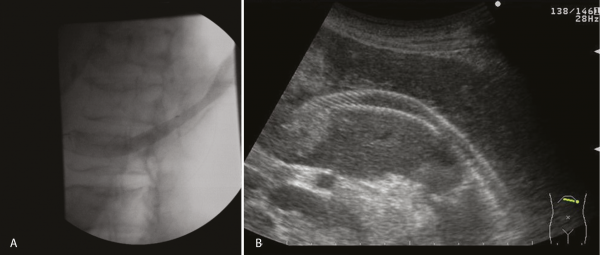
Mind képerősítővel, mind hasi UH-val meggyőződtünk (6. A és B ábra) a felhelyezett stent jó pozíciójáról, amit a folyamatos epeürülés is megerősített. A beavatkozás során betegünket folyamatosan oxigénszaturáció és pulzus mérésével monitoroztuk, szövődményt nem észleltünk. Páciensünk sárgasága csökkent, cholestasisa mérséklődött (GOT: 65 U/l, GPT: 40 U/l, AP: 313 U/l, GGT: 376 U/l, bilirubin: 130 µmol/l, direkt bilirubin: 119 µmol/l), majd alapbetegségéhez mérten kielégítő általános állapotban otthonába emittáltuk.
2. eset
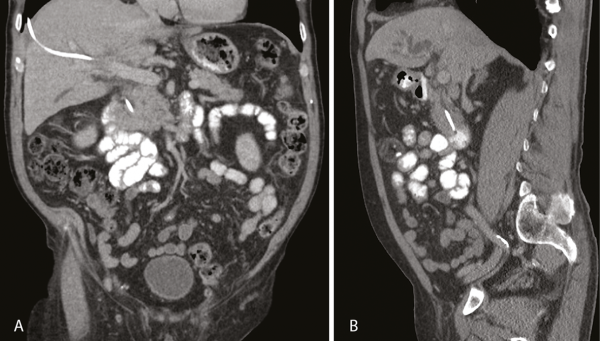
Második esetünkben, 80 éves férfi betegünket fájdalmatlanul kialakult obstrukciós icterus miatt észleltük. A hasi CT-vizsgálat az intrahepatikus epeutak kifejezett, a ductus choledochus mérsékelt fokú tágulatát mutatta, a pancreasfejben, a papilla szintjében 25×22 mm-es, lobulált kontúrú, szolid képlet ábrázolódott, paraaortikus lymphadenomegaliával (7. A és B ábra).
ERCP során, juxtapapilláris diverticulumok miatt, tűkés papillotomia végzése ellenére, ismételt vizsgálat során sem sikerült az epeutakat ábrázolni. PTD során a máj jobb lebeny tágult epeútjai ábrázolódtak, a ductus hepaticus communis, a villa magasságában elzáródott volt, a bal lebeny felé nem jutott kontrasztanyag. Perkután külső-belső jobblebenyi drenázs történt, majd ennek internalizálására, epeúti fémstent-implantációra került sor (8. A és B ábra).

EUH-vezérelt vékonytű-aspiráció történt a pancreasfejben lévő, a v. portae-hoz hozzáfekvő elváltozásból, amely adenocarcinomát igazolt. A magas epeúti szűkület hátterében pancreastumor okozta májkapui nyirokcsomó-metasztázisok álltak. Sebészeti konzílium történt, amely a beteg életkorát, általános állapotát, a tumorstádiumot (T3N1M0) is figyelembe véve, inoperábilisnak véleményezte az esetet. Az onkológus gemcitabin monoterápiát indított.
Az elkövetkező közel egy év során betegünknél több alkalommal is osztályos felvételre volt szükség a tumoros folyamat progressziója okozta fokozódó icterus, cholangiosepsis miatt. Utolsó alkalommal történt osztályos felvételkor végzett perkután transzhepatikus kolangiográfia során a máj jobb lebenyébe vezetett fémstent ugyan átjárható volt, azonban a bal lebenyi epeúti elzáródás folyamatos szeptikus állapotot tartott fent. A bal ductus hepaticus elzáródása sem PTD-vel, sem ERCP-vel nem volt technikailag megoldható (9. ábra).

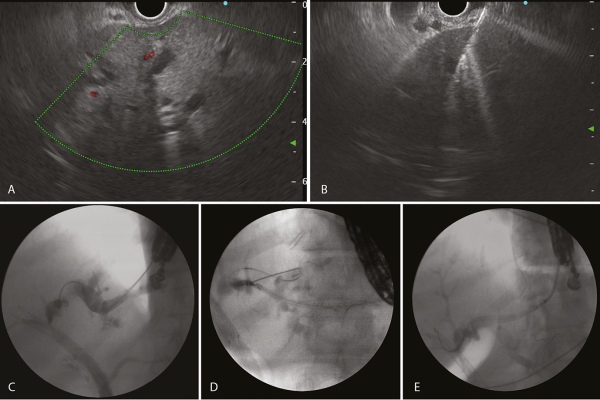
Sebészeti konzílium történt, amely tekintettel a nagy műtéti kockázatra az epeelfolyás biztosításának minimál invazív, endoszkópos megoldását javasolta. EUH-ED-t végeztünk, ahol az első esetünkben megegyező technikával hepatico-gastrostomiát hoztunk létre (10. A–E ábra). A beteg gyulladásos értékei fokozatosan csökkentek, valamint cholestasisa mérséklődött, súlyos alapbetegségéhez mérten kielégítő általános állapotban otthonába emittáltuk.
Megbeszélés
Malignus epeúti szűkületek esetén többféle palliatív epeelfolyást biztosító eljárás létezik. Elsőként választandó az ERCP-vel egybekötött transpapilláris epeúti stentelés. Amennyiben a Vater-papilla nem érhető el (az esetek kb. 3-12%-ában) tumorbenövés, anatómiai variáció, Billroth II gyomorreszekció, vagy egyéb okok miatt, más desicterisációs eljárást kell választani. A PTD szövődményrátája (vérzés, infekció) magas (20-30%), a külső epeúti drenázs sokszor lelki megterhelést jelent a betegeknek. Ascites jelenléte kontraindikálja a vizsgálatot, szelektív bal ductus hepaticus szűkület estén a PTD gyakran technikailag nem kivitelezhető (11–13).
Moole H. és munkatársai egy 2017-ben megjelent metaanalízisben 16 vizsgálat 528 beteg adatait elemezték, inoperábilis, malignus epeúti szűkületben, sikertelen ERCP esetén. A tanulmányban az EUH-ED sikerességét 90% felett találták, kb. 16-17%-os szövődményrátával. A metaanalízis 3 cikk bevonásával kitért az EUH-ED és a PTD összehasonlítására is, amely az esélyhányados számolásán alapult. Következtetésül levonták, hogy sikertelen ERCP esetén mindenképpen az EUH-ED az elsődleges választandó eljárás az epepasszázs biztosítására, mert nagyobb sikerrátával (~92% vs. 69%), kevesebb szövődménnyel végezhető (~17% vs. 63%), valamint a cikk szerzőjének hazájában számolt, aktuális árfolyamon nem elhanyagolhatóan olcsóbb (~5600 vs. 7500 $) eljárás a PTD-vel szemben. A beavatkozás limitációjaként az analízis az eszközpark, valamint az operatív endoszkópiában jártas gasztroenterológusok alacsony számát nevezte meg (14).
Khan MA. és munkatársai metaanalízisében a 2001–2015 között a témában megjelent cikkek adatait dolgozták fel. A cikk eredményei alapján, epeúti obstrukció miatt végzett, sikertelen ERCP esetén az EUH-ED 90% feletti sikerrátával végezhető, az adverz események előfordulása összesítve 17% volt (15).
Wang és munkatársai szisztémás összefoglalójában 42 vizsgálat 1192 betegét elemezték, olyan epeúti obstrukció esetén, ahol az ERCP nem volt kivitelezhető. Következtetésként levonták, hogy bár egyelőre az EUH-ED szövődményrátája jelentős (23%), azonban a beavatkozás a PTD alternatívája lehet, a magas technikai és klinikai sikerrátával (90% felett) (16).
Sharaiha és munkatársai metaanalízisében 9 közlemény 483 betegében hasonlította össze az EUH-ED és a PTD eredményességét, sikertelen ERCP után, epeúti szűkület esetén. A metaanalízisben esélyhányadost számoltak a különböző csoportok között, ez alapján a technikai sikerráta között nem volt különbség a PTD és az EUH-ED között, azonban az EUH-ED esetén szignifikánsabb magasabb volt a beavatkozás klinikai eredményessége (>90%), valamint alacsonyabb volt a szövődmény-
ráta és kevesebb volt a reintervenciót igénylő esetek száma (17).
Uemura RS és munkatársai 2018-ban 10 közlemény 434 beteganyagában hasonlították össze a hepatico-gastrostomia és a choledocho-duodenostomia eredményességét. Olyan eseteket vizsgáltak, ahol malignus epeúti szűkület esetén az ERCP kivitelezése sikertelen volt, így második választásként 208 esetben EUH-vezérelt hepatico-gastrostomiát, míg 226 esetben choledocho-duodenostomiát végeztek az epepasszázs biztosítására. 90% fölötti technikai, míg 85% feletti klinikai sikerrátát detektáltak mindkét eljárás tekintetében, míg a szövődmények terén nem volt szignifikáns különbség a két vizsgált csoport között. Következtetésként levonták a szerzők, hogy tapasztalt kézben mindkét metódus biztonságosan használható rescue eljárás sikertelen ERCP esetén (18).
Mindezek alapján amennyiben a technikai és a személyi feltételek adottak, úgy az ERCP sikertelensége esetén az EUH-ED a preferálandó a PTD-vel szemben, a magasabb sikerráta, valamint a szövődmények és az ismételt beavatkozások alacsonyabb száma miatt (19–24). Ezen kívül amennyiben technikailag kivitelezhető, úgy mindenképpen a randevú technika a preferálandó mind az intrahepatikus, mind az extrahepatikus transzmurális EUH-ED helyett, mivel kisebb a stentmigráció lehetősége, az epecsorgás és a cholangitis előfordulása (25).
Következtetések
A közelmúltban megjelent nagyobb átfogó közlemények, valamint esetismertetéseink alapján, amennyiben elérhető, az EUH-ED választandó eljárás a PTD-vel szemben, sikertelen ERCP-t követően, malignus epeúti szűkületek esetén.
Rövidítések: ERCP: endoszkópos retrográd cholangio-pancreatographia;
PTD: perkután transzhepatikus drenázs; EUH-ED: endoszkópos ultrahang-vezérelt epeúti drenázs; UH: ultrahang; CT: komputertomográfia; MR: mágneses magrezonancia; GOT: glutamát-oxálacetát-transzamináz; GPT: glutamát-piruvát-transzamináz; AP: alkalikus-foszfatáz; GGT: gamma-glutamil-transzferáz
Irodalom
2. Czakó L, Szepes Z, Szepes A. Diagnostic Endoscopic Ultrasonography in the Gastrointestinal Tract. Orv Hetil 2012; 22; 153(3): 93–101.
3. Giovannini M, Bories E. EUS-guided Biliary Drainage. Gastroenterol Res Pract 2012; 348719.
4. Irisawa A, Hikichi T, Shibukawa T, Tagaki T, Wakatsuki T, Takahashi Y, Imamura H, Sato A, Sato M, Ikeda T, Suzuki R, Obara K, Ohira H. Pancreatobiliary Drainage Using the EUS-FNA Technique: EUS-BD and EUS-PD. Hepatobiliary Pancreat Surg 2009; 16: 598–604.
5. Ogura T, Higuchi K. Does Endoscopic Ultrasound-guided Biliary Drainage Really Have Clinical Impact? World J Gastroenterol 2015; 28; 21(4): 1049–52.
6. Giovannini M, Moutardier V, Pesenti C, Bories E, Lelong B, Delpero JR. Endoscopic Ultrasound-guided Bilioduodenal Anastomosis: A New Technique for Biliary Drainage. Endoscopy 2001; 33(10): 898–900.
7. Giovannini M, Bories E, Téllez-Ávila FI. Endoscopic Ultrasound-guided Bilio-Pancreatic Drainage. Endosc Ultrasound 2012; 1(3): 119–29.
8. Ogura T, Higuchi K. Technical Tips of Endoscopic Ultrasound-guided Choledocho-duodenostomy. World J Gastroenterol 2015; 21: 820–8.
9. Isayama H, Nakai Y, Kawakubo K, Kawakami H, Itoi T, Yamamoto N, Kogure H, Koike K. The Endoscopic Ultrasonography-guided Rendezvous Technique for Biliary Cannulation: A Technical Review. J Hepatobiliary Pancreat Sci 2013; 20: 413–20.
10. Ogura T, Higuchi K. Technical Tips for Endoscopic Ultrasound-guided Hepatico-gastrostomy. World J Gastroenterol 2016; 22: 3945–51.
11. Sharaiha RZ, Kumta NA, Desai AP, DeFilippis EM, Gabr M, Sarkisian AM, Salgado S, Millman J, Benvenuto A, Cohen M, Tyberg A, Gaidhane M, Kahaleh M. Endoscopic Ultrasound-guided Biliary Drainage Versus Percutaneous Transhepatic Biliary Drainage: Predictors of Successful Outcome in Patients who Fail ERCP. SurgEndosc 2016; 30(12): 5500–5505.
12. Bories E, Caillol F, Pesenti C, Giovannini M. Short-term Results After Hepatico-gastrostomy Guided by Echo-endoscopy: Monocentric Retrospective Study. Endosc Ultrasound 2014; (Suppl 1): S14.
13. Godat S, Bories E, Caillol F, Pesenti C, Ratone JP, de Cassan C, Giovannini M. Efficacy and Safety in Case of Technical Success of Endoscopic Ultrasound-Guided Transhepatic Antegrade Biliary Drainage: A Report of a Monocentric Study. Endosc Ultrasound 2017; 6(3): 181–186.
14. Moole H, Bechtold ML, Forcione D, Puli SR. A Meta-analysis and Systematic Review: Success of Endoscopic Ultrasound-guided Biliary Stenting in Patients with in Operable Malignant Biliary Strictures and a Failed ERCP. Medicine 2017; 96(3): e5154.
15. Khan MA, Akbar A, Baron TH, Khan S, Kocak M, Alastal Y, Hammad T, Lee WM, Sofi A, Artifon EL, Nawras A, Ismail MK: Endoscopic Ultrasound-guided Biliary Drainage: A Systematic Review and Meta-Analysis. DigDisSci 2016; 61(3): 684–703.
16. Wang K, Zhu J, Xing L, Wang Y, Jin Z, Li Z. Assessment of Efficacy and Safety of EUS-guided Biliary Drainage: a Systematic Review. Gastrointest Endosc 2016; 83(6): 1218–27.
17. Sharaiha RZ, Khan MA, Kamal F, Tyberg A, Tombazzi CR, Ali B, Tombazzi C, Kahaleh M. Efficacy and Safety of EUS-guided Biliary Drainage in Comparison with Percutaneous Biliary Drainage when ERCP Fails: a Systematic Review and Meta-Analysis. Gastrointest Endosc 2017; 85(5): 904–914.
18. Uemura RS, Khan MA, Otoch JP, Kahaleh M, Montero EF, Artifon ELA. EUS-guided Choledocho-duodenostomy Versus Hepatico-gastrostomy: A Systematic Review and Meta-analyzis. J ClinGastroenterol 2018; 52: 123–130.
19. Itoi T. Sofuni A, Tsuchiya T, Ijima M, Iwashita T. Endoscopic Ultrasonography-guided Biliary Drainage. J Hepatobiliary Pancreat Sci 2010; 17: 611–16.
20. Hara K, Yamao K, Mizuno N, Hijoka S, Imaoka H, Tajika M, Tanaka T, Ishihara M, Okuno N, Hieda N, Yoshida T, Niwa Y. Endoscopic Ultrasonography-guided Biliary Drainage: Who, when, which, and how? World J Gastroenterol 2016; 22: 1297–303.
Minaga K, Kitano M. Recent Advances in Endoscopic Ultrasound-guided Biliary Drainage. Digestive Endoscopy 2018; 30: 38–47.
21. Nakai Y, Isayama H, Yamamoto N, Matsubara S, Kogure H, Mizuno S, Hamada T, Takahara N, Uchino R, Akiyama D, Takagi K, Watanabe T, Umefune G, Ishigaki K, Tada M, Koike K. Indications for Endoscopic Ultrasonography (EUS)-guided Biliary Intervention: Does EUS Always Come After Failed Endoscopic Retrograde Cholangio-pancreatography? DigEndosc 2017; 29(2): 218–225.
22. Iwashita T, Doi S, Yasuda I. Endoscopic Ultrasound-guided Biliary Drainage: a Review. Clin J Gastroenterol 2014; 7(2): 94–02.
23. Minaga K, Kitano M, Yoshikawa T, Omoto S, Kamata K, Yamao K, Kudo M. Hepatico-gastrostomy-guided by Real-Time Contrast-Enhanced Harmonic Endoscopic Ultrasonography: A Novel Technique. Endoscopy 2016; 48(Suppl 1): E228–9.
24. De Cassan C, Bories E, Pesenti C, Caillol F, Godat S, Ratone JP, Delpero JR, Ewald J, Giovannini M. Use of Partially Covered and Uncovered Metallic Prosthesis for Endoscopic Ultrasound-guided Hepatico-gastrostomy: Results of a Retrospective Monocentric Study. Endosc Ultrasound 2017; 6(5): 329–335.
25. Minaga K, Kitano M. Recent Advances in Endoscopic Ultrasound-guided Biliary Drainage. Digestive Endoscopy 2018; 30: 38–47.
