Difficulties of finding the source of gastrointestinal bleeding
Summary
Aorto-bifemoral bypass can cause gastrointestinal bleeding as a complication even years after the surgery. Aorto-enteral fistula can cause both pulsatile and shocking bleeding. Diagnosis is difficult in both cases. In 2017 during 4 months three patients were admitted to our department because of GI bleeding who had aorto-bifemoral bypass in their history. We should suspect that the cause of bleeding might be a fistula between the graft and the intestine in each patient who underwent aorto-bifemoral bypass surgery.
Az aortobifemoralis bypass műtét szövődményként évekkel az operációt követően is tápcsatornai vérzést okozhat. Az aortoenterális fistulák pulzatilis és fatális vérzést egyaránt okozhatnak, diagnosztikájuk mindkét esetben komoly nehézségbe ütközik. Osztályunkon 2017-ben 4 hónap alatt 3 olyan beteget vettünk fel tápcsatornai vérzés miatt, akiknek a kórelőzményében aortobifemoralis áthidaló műtét szerepelt. Minden aortobifemoralis bypass műtött betegnél gondolnunk kell arra, hogy a vérzésforrás hátterében a graft és a tápcsatorna közt kialakult fistula is állhat.
Bevezetés
A felső tápcsatornai (gasztrointesztinális – GI) vérzés az egyik leggyakoribb gasztroenterológiai sürgősségi kórkép. Legtöbbször gyomor- és nyombélfekélyek, emésztőszervi daganatok, valamint nyelőcső-varicositás áll a hátterében. Egy ritka, de klinikailag annál fontosabb lehetséges GI vérzésforrás az aorto-enterális fistula (AEF). A primer AEF legtöbbször a tápcsatornába betörő hasi aortaaneurizma következménye. A szekunder AEF a hasi aortát érintő érsebészeti műtétek, protézisek, graftok behelyezését követően, a műtét után akár évekkel megjelenő tápcsatornai vérzést okozó lehetséges súlyos szövődmény. A vérzés intenzitása lehet enyhe, de akár masszív sokkoló jellegű is.
Gasztroenterológiai Osztályunkon 2017-ben 4 hónap alatt 3 olyan beteget vettünk fel GI vérzés miatt, akiknek a kórelőzményében alsó végtagi verőérszűkület miatt szükségessé váló érsebészeti aorto-bifemoralis áthidaló műtét szerepelt. Az alábbiakban ezen három eset ismertetése következik, rövid irodalmi áttekintés kíséretében.
Esetismertetések
1. eset
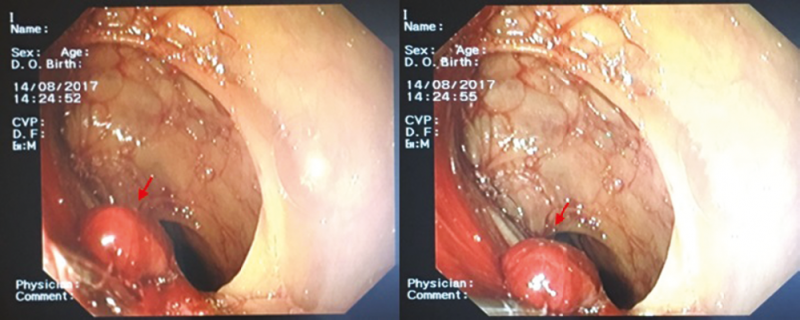
71 éves, clopidogrelt szedő, 23 éve bypass műtéten átesett nőbeteget vérhányás miatt három alkalommal is Gasztroenterológiai Osztályunkon kezeltünk. A kivizsgálások során az összesen 4 gasztroszkópia, 3 kolonoszkópia, 2 angio-CT és 1 kapszulaendoszkópia-vizsgálat sem talált aktív, egyértelmű vérzésforrást. Az ötödik gasztroszkópia igazolta az aortoduodenalis fistulajáratot (AEF), amelyet követően a beteget az Érsebészeti osztályon megoperálták (1–2. ábra).

aortoduodenalis fistulajárat
(nyíllal jelölve)

a graft fala mellett ábrázolódik (nyíllal jelölve)
2. eset
70 éves, aszpirint szedő, 5 éve bypass műtéten átesett férfi beteg vérhányás miatt került Gasztroenterológiai Osztályunkra, akinél urgens gasztroszkópiát terveztünk, de az EKG-n megjelenő szubendokardiális iszkémia, a progrediáló dyspnoe AMI lehetőségét vetette fel, a beteg így ITO-ra került, ahol ismételt vérhányás miatt Sengstaken–Blakemore-szonda lehelyezésre került sor, keringésmegállás miatt azonnali reanimációt végeztek, de a komplex újraélesztési kísérlet ellenére a beteg elhunyt. Postmortem igazolódott az aortoduodenalis fistula (AEF), amely a vérzéses sokkot okozta.
3. eset
Korábban bypass miatt műtött, 71 éves férfi beteg anémia, málnazselé széklet miatt került Gasztroenterológiai Osztályunkra. Az SBO-n és Gasztroenterológiai Osztályunkon megismételt gyomortükrözés a corpust kitöltő coagulumot írt le, aktív vérzést azonban nem azonosított. Néhány óra múlva sokkoló vérzés miatt a beteget megoperálták, vérzésforrást nem találtak, a gyomorban fellelt eróziókat aláöltötték. Az Intenzív Osztályon (ITO-n) néhány óra múlva masszív vérzés miatt újabb urgens gasztroszkópia történt, amely aktuálisan vérző aortoduodenalis fistulát (AEF-t) talált, amelyet klipfelhelyezés után érsebész bevonásával elvarrtak. Másnapra a bal láb keringése kritikussá vált, így axillofemoralis bypass műtétet végeztek, ennek ellenére a bal láb keringészavara fokozódott, végül a beteg keringés-összeomlásban elhunyt (3. ábra).
Megbeszélés
A szekunder AEF a bélrendszer és a károsodott graft–aorta anasztomózis között kialakuló kóros összeköttetés, amely az aortát érintő érsebészeti rekonstrukciós műtétek magas mortalitással járó lehetséges szövődménye. Leggyakoribb a hasi aortaaneurizma rekonstrukciós műtéteket követően (1), valamint aortoiliacalis elzáródást követő Y-graft implantációk után (2). Hátterében a graft környezetének fertőződése, a nem megfelelő műtéti technika következtében kialakuló bélfalsérülés, valamint a kitáguló érfal miatt a graft mellett megjelenő szivárgás állhat. Ezek az anasztomózis területén pszeudoaneurizma, perigraft hematoma képződéshez és a környező bélfal dekubitálódásához, erodálódásához vezethetnek.
A fistula kialakulásának leggyakoribb helye (az esetek 80%-ában) a duodenum leszálló és alsó vízszintes szára. A műtétet követően napokkal vagy akár évekkel később is kialakulhat (2 nap – 27 év) (3). A vezető tünet felső GI-vérzés haematemesis, melaena formájában. A súlyos vérzést gyakran mérséklődő, intermittáló formában folytatódó vérzés követi (4). További lehetséges tünetei közé tartoznak a szepszis, a hasi vagy hátfájdalom, valamint a tapintható pulzáló hasi terime (5, 6).
A kórházi felvételtől számítva a megfelelő diagnózis felállításáig átlagosan 4 nap (12 óra – 15 nap) telik el (2, 4). A GI-vérzés esetén az urgens felső tápcsatornai endoszkópia során csak az esetek 33,3%-ában sikerül az AEF azonosítása (4, 7). A CT-angiográfia rendszerint nagy segítséget nyújt a kórisme felállításában (8, 9). A vérzésforrás lokalizálása és a potenciális vérzésforrás kizárása céljából kolonoszkópia végezhető, bár ritkán (8%) vezet eredményre (6, 10).
Ha a fenti vizsgálatok során nem sikerül diagnózishoz jutni, és hemodinamikai instabilitással járó masszív vérzése van a betegnek, életmentő azonnali laparotomia és szükség esetén intraoperatív endoszkópia is indokolt lehet.
A másodlagos AEF ellátása kombinált széles spektrumú antibiotikum-védelemben érsebészeti műtéti eljárás keretében a sérült graft kimetszése, a környező fertőzött szövetek debridementje, a kisebb bélfalsérülések elvarrása, míg nagyobb léziók esetén bélreszekció és reanasztomózis képzése válhat szükségessé (4, 7).
A károsodott graft eltávolítását követően a hasi aorta folytonosságának helyreállítása extraanatómiás axillobifemoralis bypass kialakításával vagy in situ graftrekonstrukcióval történhet. Utóbbi esetben az aortarekonstrukciót új szintetikus grafttal, artériás vagy vena femoralis allografttal végzik. Az ezüsttel impregnált graftok alacsonyabb hosszú távú mortalitással, valamint csökkent újrafertőződési kockázattal járnak, főleg ha a graftot cseplesszel fedik (11–13). A műtétet követő korai posztoperatív mortalitás igen magas (30% körüli), míg a 2–5 éves hosszabb távú mortalitás eléri az 50%-ot is (2, 7). A műtéti eljárás mellett terjedőben vannak a különböző endovaszkuláris kezelési módszerek, amelyek alacsonyabb mortalitással járnak (14, 15).
Következtetések
A másodlagos AEF ritka, potenciálisan fatális szövődménye lehet a verőér-rekonstrukciós műtéteknek, mivel az AEF pulzatilis és fatális vérzést egyaránt okozhat. A nem specifikus klinikum, valamint az intermittáló vérzés esetén a vérzésmentes periódusok miatt az időben történő diagnosztikájuk nehézkes. Ezért nagyon fontos gondolni a graft és a tápcsatorna közt kialakult fistula lehetőségére azokban a betegekben, akiknek a kórelőzményében aortát érintő műtét szerepel.
A kórisme megállapításában gasztroduodenoszkópia és CT-angiográfia nyújtja a legnagyobb segítséget. Kezelése nyitott hasi műtéti eljárás keretében a graft excíziója, a kiterjedt debreidement, a bélfal folytonosságának helyreállítása, valamint a graft in situ cseréje. A korai posztoperatív mortalitás továbbra is rendkívül magas, ezért kiemelten fontos a prevenció. Mivel az AEF ritkán fordul elő, jelenleg még nincs széles körben elfogadott „aranystandard” irányelv az AEF diagnosztikájában és kezelésében, ezért minden esetben egyénre szabott megközelítésre, kezelésre van szükség.
2. Bergqvist D, Bjorck M. Secondary arterioenteric fistulation – a systematic literature analysis. Eur J Vasc Endovasc Surg 2009; 37: 31–42.
3. Geraci G, Pisello F, Volsi FL, et al. Secondary aortoduodenal fistula. World J Gastroenterol 2008; 14: 484–6.
4. Gnus J, Ferenc S, Kościelna M, et al. Aortoenteric Fistula After Abdominal Aortic Graft Implementation in Our Own Material. Adv Clin Exp Med 2016 Nov-Dec; 25(6): 1265–1271.
5. Sierra J, Kalangos A, Faidutti B. Aorto-enteric fistula is a serious complication to aortic surgery. Modern trends in diagnosis and therapy. Cardiovascular Surg 2003; 11: 185–188.
6. Leon Jr LR, Mills Sr JL, Psalms SB, et al. Aortic paraprosthetic-colonic fistulae: A review of the literature. Eur J Vasc Endovasc Surg 2007; 34: 682e–92.
7. Marolt U, Potrc S, Bergauer A, et al. Aortoduodenal fistula three years after aortobifemoral bypass: case report and literature review. Acta Clin Croat 2013; 52: 363–8.
8. Hagspiel KD, Turba UC, Bozlar U, et al. Diagnosis of aortoenteric fistulas with CT angiography. J Vasc Interv Radiol 2007; 18: 497–504.
9. Hughes FM, Kavanagh D, Barry M. Aortoenteric fistula: A diagnostics dilemma. Abdom Imaging 2007; 32: 398–402.
10. Perez R, Katayama F, Bresciani C. Aortoenteric fistula to the sigmoid colon – case report. Curr Surg 2005; 62: 49–54.
11. Xiromeritis K, Dalainas I, Stamatakos M, Filis K. Aortoenteric fistulae: present-day management.: Int Surg 2011 Jul-Sep; 96(3): 266–73.
12. Batt M, Jean-Baptiste E, O’Connor S. In-situ revascularisation for patients with aortic graft infection: A single centre experience with silver coated polyester grafts. Eur J Vasc Endovasc Surg 2008; 36: 182e–188.
13. Bíró G, Szabó G, Fehévári M, et al. Late outcome following open surgical management of secondary aortoenteric fistula. Langenbecks Arch Surg 2011; 396: 1221–9.
14. Partovi S, Trischman T, Sheth RA, et al. Imaging work-up and endovascular treatment options for aorto-enteric fistula. Cardiovasc Diagn Ther 2018; 8: S200–S207.
15. Kakkos SK, Bicknell CD, Tsolakis IA, et al. Editor’s Choice – Management of Secondary Aorto-enteric and Other Abdominal Arterio-enteric Fistulas: A Review and Pooled Data Analysis. Eur J Vasc Endovasc Surg 2016 Dec; 52(6): 770–786.
