Eradication of helicobacter pilory, review and experiences
Summary
Introduction: The success of Helicobacter pylori eradication is a challenge for every professional outpatient department. Recently, the success of eradication schemes that have previously been successful has decreased worldwide and in our institute as well. The problem led to new international consensus. We investigated the success of our eradication treatments at our hospital’s gastroenterology outpatient care between 2016–2017.
Method: the results of C14 breath tests –carried out 6 weeks later, after the eradication treatment- have been collected, and combined with appropriate eradication treatments registered in our hospital’s IT system. Results have been evaluated in percentages and controlled by chi-square test.
Results: a total of 247 Helicobacter pylori eradication treatment were made according to the control C14 breath tests (143/2016 and104/2017). The number of successful treatments was 104 (73%) in 2016, 82 (79%) in 2017 and unsuccessful treatments were 39 (27%) in 2016 and 21 (22%) in 2017, respectively. 7-day treatment in 2016 was 98 (69%), in 2017, 68 (65%), and their application dropped by 4% over the two years (p = 0.603). The success / failure rate was 73.5/26.5%, remained unchanged (p = 0.993). 10-day treatments were made in 44 cases (31%) in 2016, and 31 (30%) in 2017, their application rate did not change (p = 0.871). The success within 10-day treatment increased by 14%, and the failure decreased by the same (p = 0.135). The 14-day treatments in 2017 (N = 5) were all successful.
Summary: Our retrospective processing supports the importance of lifting eradication treatments from 7 to 10-14 days, as highlighted by the latest guidelines.
Bevezetés: A Helicobacter pylori eradikáció sikeressége kihívás minden szakambulancia számára. Az utóbbi időben a korábban sikeres eradikációs sémák eredményessége csökkent világszerte, és intézetünkben is. A probléma új nemzetközi konszenzusokhoz vezetett. Feldolgoztuk az eradikációs kezeléseket kórházunk Gasztroenterológiai Ambulanciáján 2016–2017. évben.
Módszer: Az eradikációt 6 héttel követő kontroll C14 kilégzési tesztek eredményét összesítettük, amit a kórházi informatikai rendszerünkben regisztrált eradikációs kezelésekkel vetettünk egybe. Eredményeinket százalékos összehasonlításban értékeltük, Khi-négyzet próbával ellenőriztük.
Eredmények: A kontroll C14 kilégzési tesztek alapján összesen 247, 2016-ban 143 és 2017-ben 104 eradikációt végeztünk. 2016-ban 104 (73%), 2017-ben 82 (79%) a sikeres és 2016-ban 39 (27%), 2017-ben 22 (21%) a sikertelen kezelések száma. Hétnapos kezelés 2016-ban 98 (69%), 2017-ben 68 (65%) alkalommal történt, alkalmazásuk a két év során 4% pontot csökkent (p=0,603). A sikeresség/sikertelenség aránya 73,5/26,5%, változatlan maradt (p=0,993). Tíznapos kezelés 2016-ban 44 (31%), 2017-ben 31 (30%) történt, alkalmazási arányuk nem változott (p=0,871). A 10 napos kezeléseken belül a sikeresség 14% ponttal nőtt, és a sikertelenség ugyanennyivel csökkent (p=0,135). A 14 napos kezelések 2017-ben (N=5) mind sikeresek voltak.
Következtetések: Retrospektív feldolgozásunk alátámasztja az eradikációs kezelések 7-ről 10-14 napra való emelésének fontosságát, amelyet a legújabb irányelvek is hangsúlyoznak.
Bevezetés
Talán az orvostudomány egyik legkiemelkedőbb felismerése, hogy egy adott lokalizációhoz köthető baktérium kolonizáció idült gyulladást provokálva az adott helyen sejtpusztulást, fekélyt, és regenerációs hibák sorának kialakulásával nyálkahártya-atrófiát okoz, majd hosszabb távon rosszindulatú betegség kialakulásához vezet. A 2005. évi orvosi-élettani Nobel-díjat Barry J. Marshall és J. Robin Warren ausztrál kutatók kapták megosztva a Helicobacter pylori (Hp) baktérium felfedezéséért, illetve annak megállapításáért, hogy a Helicobacter-fertőzés felelős a gyomor- és bélbetegségek egy részéért. A Nobel-díjas szerzők már 1983-ban a Lancet hasábjain hírt adtak a spirális baktérium és az aktív típusú krónikus gastritis kapcsolatáról (1). A kétkedés éveit Magyarországon Csiszár, Gyepes és Bujalka közleménye lendítette 1987-ben a Campylobacter pylori gyomorbiopsziás anyagból történt kimutatásával (2). A Hp Gram-negatív, mikroaerofil, általában 1-7 fejvégű ostorral rendelkező, enzimek termelésére képes baktérium, amelyek közül az ureáz enzim a nyákrétegen belüli kolonizációját teszi lehetővé, ily módon a patomechanizmus egyik meghatározó tényezője (3). A mikroorganizmus az emberiség közel 50%-ában jelen van (4). Az European Helicobacter Pylori Study Group (EHPSG) 1987-ben alapult Koppenhágában és az első konszenzus-ülésére 1996-ban Maastrichtban került sor. Erősen ajánlották a Hp-eradikációját valamennyi peptikus fekélybetegben, beleértve a szövődményeket is, MALT-lymphomában, atrófiás gastritisben és a gyomorrák reszekcióját követően (5). Hazánkban 1989. évi Magyar Gasztroenterológiai Társaság (MGT) Nagygyűlésen Simon László moderálta kerekasztal-megbeszélésen nyert polgárjogot a „Helicobacter pylori szemlélet” (6). A Helicobacter Pylori Munkacsoport (HPMCS) 1996-ban alakult meg, amelynek vezetőségébe Tamási Klára, Bajtai Attila, Papp János, Rácz István, Simon László és Tulassay Zsolt került, és később Buzás György csatlakozott, aki az első hazai Hp-monográfia szerzője (7). Az EHPSG 2. maastrichti konszenzus konferenciáját követően (8), 2000 és 2003-ban a magyar HPMCS konszenzus értekezleten alakult ki a Hp-eradikáció OEP által is elfogadott szakmai protokollja. Ez I. vonalban 2×PPI+2×1000 mg amoxicillin+2×500 mg klaritromicin kezelést minimum 7 napig, valamint II. vonalban 2×PPI+2×500 mg metronidasol+4×500 mg tetracyclin+4×120 mg bizmut-citrát ajánl minimum 7 napig. A gyakorlatban a 7 napos kezelések a 2000-es években eredményesek voltak, de az elmúlt 17 évben fokozatosan antibiotikum-rezisztenciák alakultak ki, elsősorban a klaritromicin, metronidasol és levofloxacinnal szemben (9).
A Hp-eradikáció sikeressége kihívássá vált minden szakambulancia számára. A korábban sikeres eradikációs sémák eredményessége csökkent világszerte, és intézetünkben is. A kétezres évektől a probléma több új nemzetközi konszenzushoz vezetett. Kórházunkban észlelve az eradikációs kezelések sikerének csökkenését, feldolgoztuk az eradikációs kezeléseket kórházunk Gasztroenterológiai Ambulanciáján 2016–2017. évben.
Célkitűzés
Megvizsgáltuk a feldolgozott két év vonatkozásában a Hp-readikáció sikeresség/sikertelenség arányait összességében és a kezelési időtartamok bontásában. Vizsgáltuk egyrészt a protonpumpa-gátló (PPI) hatóanyagok és egyes kiemelt PPI-gyógyszerek terápiás siker százalékban betöltött szerepét, standard I. és II. vonalbeli kezelések mellett.
Összehasonlítottuk e hatóanyagok, és egyes gyógyszerek sikerrátáját a terápiás időintervallumok különbsége szerint. Végül feltételeztük, hogy szakorvosaink a Magyarországon érvényben lévő ajánlások figyelembe vétele mellett eltérő eradikációs gyakorlatot folytatnak, amelyet külön is elemeztünk.
Módszer
Az értékeléshez az eradikációt követő kontroll C14 kilégzési tesztek eredményét összesítettük, amit a kórházi informatikai rendszerünkben regisztrált eradikációs kezelésekkel vetettünk egybe. Eredményeinket százalékos összehasonlításban értékeltük, Khi-négyzet próbával ellenőriztük.
A kilégzési vizsgálatot 6 héttel az eradikációt követően Heliprobe típusú készülékkel végeztük. A vizsgálat során a betegek alkalmanként 37 kBq szén-14 izotópot (C14) kaptak, amelynek az egésztestre vonatkozóan gyakorlatilag nincs mérhető sugárterhelése (0,00 mSV/egésztest).
Eredmények I.
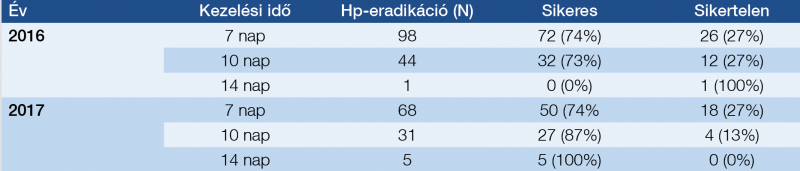
A két év alatt a 6 hetes C14 kilégzési kontrolleredmények alapján, összesen 247, 2016-ban 143 és 2017-ben 104 Hp-eradikációt végeztünk (1. a táblázat). A kezelések 2016-ban 104 (73%) és 2017-ben 82 (79%) alkalommal lettek sikeresek. Ugyanakkor 2016-ban 39 (27%) és 2017-ben 22 (21%) sikertelen kezelés történt.
Hétnapos kezelést 2016-ban 98 (69%), 2017-ben 68 (65%) alkalommal végeztünk. Gyakoriságuk a két év során csak 4% pontot csökkent (p=0,603). A 10 napos kezelések száma 2016-ban 44 (31%), 2017-ben 31 (30%) volt, a két évben arányuk nem változott (p=0,871).

Tizennégy napos kezelést 2016-ban 1 alkalommal (sikertelen szekvenciális) és 2017-ben összesen 5 alkalommal (5%) végeztünk. Ebből 4 alkalommal I. vonalbeli, és egyszer II. vonalbeli bizmut négyszeres terápiát alkalmaztunk.
Az összes sikeres kezeléshez viszonyítva 7 napos kezelés 2016-ban 72 (69%), 2017-ben 50 (61%) és az összes sikertelen kezeléshez viszonyítva 7 napos kezelés 2016-ban 26 (67%), 2017-ben 18 (82%) alkalommal történt. Az összes sikeres kezeléshez viszonyítva 10 napos kezelés 2016-ban 32 (31%), 2017-ben 27 (33%) és az összes sikertelen kezeléshez viszonyítva 10 napos kezelés 2016-ban 12 (31%), 2017-ben 4 (18%) alkalommal történt. Vizsgáltuk a sikeresség/sikertelenség arányait a kezelési időtartamok bontásában (1. b táblázat). A 7 napos kezeléseken belül a sikeres eradikációk aránya 73,5%, a sikertelenség aránya magas: 26,5%, a két év vonatkozásában nem változik (p=0,993). A két év hasonlításában a 10 napos kezeléseken belül a sikeresség 14% ponttal nőt, egyidejűleg a sikertelenség ugyanennyivel csökkent (p=0,135), míg az öt 14 napos kezelés 2017-ben mind sikeres volt.
Eredmények II.
Külön bontásban vizsgáltuk a PPI-hatóanyagok, illetve egyes frekventáltan használt PPI-gyógyszerek szerepét a terápia sikerességében. Eredményeinket az 1. ábrán mutatjuk be.
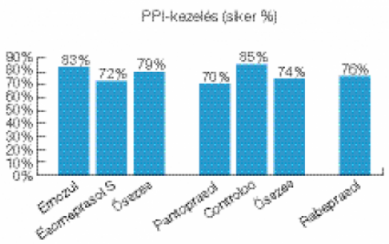
Látható, hogy az esomeprasol hatóanyagcsoportban hatékonyabb az Emozul (az esomeprasol KRKA generikuma, Szlovénia). A pantoprasol hatóanyagú csoportban az originális Controloc (Takeda, Japán) tartalmú eradikációk voltak a sikeresebbek. 76%, vagy az alatti eradikációs sikerrel járt az egyéb használt esomeprasol, pantoprasol, és rabeprasol generikum. Vizsgáltuk a PPI hatóanyag-csoportok és egyes frekventált PPI-gyógyszerek sikerességét a terápiás idők bontásában is (2. ábra).

A terápia időtartamának 7-ről 10-14 napra emelése mellett a terápiás sikerráta a pantoprasol szedése mellett 18% ponttal, ezen belül a Controloc mellett 39% ponttal javult, de az egyébként sikeresebb kezelést eredményező Emozulnál is javult a sikerráta 12% ponttal. Más PPI-generikum használata mellett az alacsony sikerráta esomeprasol esetén csak 4% ponttal, és pantoprasol esetén 14% ponttal javult, illetve rabeprasol esetén az alacsony sikerráta 25% ponttal csökkent. A Controloc 10-14 napos sikerszázalék növekedését az alacsony esetszám mellett az okozhatta, hogy a 8 eset fele 14 napos kezelés volt. A rabeprasolnál a 25% pontos csökkenés hátterében a nagyon alacsony 10 napos esetszám állhat.
Eredmények III.
Vizsgáltuk a szakorvosaink eradikációs kezelési gyakorlatát (2. táblázat). I. vonalban elsősorban PPI+Duomox+Fromilid, második vonalban PPI+metronidasol+Tetracyclin+/-Bizmut- citrát kezeléseket végeztünk a standard dózisokkal.
Az első eradikáló orvos (1) úgy ért el magasabb eradikációs sikert, hogy PPI-ként jórészt csak Emozult használt, és 10 napos kezeléseket alkalmazott. Esetében a két év összehasonlításában (2016/2017) az eradikációk száma 23/17, a sikerráta: 83/88%, a 10 napos kezelési arány 66/100%, a 7 napos kezelési arány 30/0%, PPI-használat: Emozul 100/94%, pantoprasol 4/6%, rabeprasol 0/0%. A kezelésekhez kiegészítő probiotikumot nem adott.
Ehhez jól hasonlítható a második eradikáló orvos (2), akinél a gyengébb eradikációs siker úgy alakult ki, hogy Emozul helyett inkább rabeprasol és pantoprasol generikumot használt, és a 7 napos kezelési aránya magas, ami 2017-re még tovább növekedett. Esetében a két év összehasonlításában: az eradikációk száma 43/33, a sikerráta: 72/79%, a 10 napos kezelési arány 49/24%, a 7 napos kezelési arány 51/76%, PPI-használat: Emozul 19/3%, pantoprasol 30/18%, rabeprasol 28/64%, probiotikum-használat 72/91%. Lehetséges, hogy a 7 napos kezelések arányának növekedése ellenére a megnövelt probiotikum-használat miatt javult a sikeresség.
A harmadik eradikáló orvos (3) elsővonalbeli sikeressége volt a legalacsonyabb, és itt kiemelendő a magas pantoprasol arány, és mindkét évben a nagyon magas 7 napos kezelési arány. Esetében a két év összehasonlításában: az eradikációk száma: 48/38, a sikerráta: 65/71%, a 10 napos kezelési arány 4/5%, a 7 napos kezelési arány 96/95%, PPI-használat: Emozul 16/5%, pantoprasol 58/47%, rabeprasol 4/11%. A több sikertelen kezelés miatt a II. vonalbeli, Bizmut komponensű kezelés száma magasabb 25/32% és e kezelés sikerrátája esetében 7 nap időtartamú kezelés mellett 73/80%.
A negyedik eradikáló orvos (4) kevesebb eradikáció mellett a legeredményesebb. Az eradikációk száma 11/7, a sikerráta 82/100%, ezt az általa 2017-ben hétből 5 alkalommal végzett sikeres 14 napos eradikáció emeli.
Az ötödik eradikáló orvos (5) eradikációs sikere javult a 10 napos elsővonalbeli kezelések növelésével. Esetében a két év összehasonlításában: az eradikációk száma 13/6, a sikerráta: 77/83%, a 10 napos kezelési arány 23/50%, a 7 napos kezelési arány 77/50%, PPI-használat: Emozul 31/17%, pantoprasol 62/83%.

Megbeszélés
A PPI-gyógyszerek szerepe a gasztrikus pH növelése által az antibiotikumok szükséges minimális gátló koncentrációjának csökkentése, a kémiai stabilitásuk növelése, valamint a gasztrikus koncentrációjuk fokozása (10, 11). A PPI-gyógyszerek savgátló hatását a gyógyszerek dózisa, és a beteg CYP2C19 gén polimorfizmusa is befolyásolja (12–14). A hatékonyabb és a CYP2C19 genotípusok által kevésbé befolyásolt metabolizmusú PPI javíthatja az eradikáció sikerét (15–17).
Az új kálium kompetitív savgátló vonoprazan még erősebb savgátló hatású, mint a PPI-gyógyszerek, bevezetése tovább javíthatja az eradikáció sikerét (18, 19). A bizmut+antibiotikumok kombinációjú eradikációs kezelésekkel évek óta barátkozik a szakma, ennek első nyilvánvaló jele volt már a Maastricht 2 konszenzuson első vonalban javasolt ranitidin bizmut-citrát (bár akkor még a PPI helyett ajánlva), de a PPI+antibiotikum hármas kombináció sikertelensége esetén 2. vonalban PPI+bizmut+2 antibiotikum négyes kombinációk váltak a legsikeresebbekké. A magunk megfigyelései is erre utalnak. Birinyi Péter gyógyszerész kollégánk engedélyeztetett és forgalomba hozott bizmut-citrát kapszuláját alkalmazzuk napi 4×120 mg dózisban a második vonalbeli bizmut négyes kombinációban. Figyelemre méltó a kutatása a legmegfelelőbb bizmut-só választásában. A három vegyértékű bizmut kation a Hp ostoraihoz képes kötődni, így gátolja a kórokozót a mozgásban, növeli az antibiotikumok baktericid hatását (3). A bizmut 30-40%-kal képes emelni az antibiotikumokra resisztens Hp-törzsek eradikációs ráta sikerét, és nem alakult ki vele szemben rezisztencia (20). A rövidtávú kezelés biztonságos (21). Idén jelent meg a gyógyszerpiacon a KRKA új bizmut-oxid készítménye az Ulcamed.
1 filmtabletta 120 mg bizmut-oxid hatóanyagot tartalmaz trikálium bizmut-dicitrát (bizmut-szubcitrát) formájában. Ez elősegíti a minél szélesebb körben első és másodvonalban való alkalmazást.
A minél sikeresebb I. vonalbeli eradikáció a Hp-prevalencia csökkentésének záloga (19). Az új Toronto konszenzusajánlások hangsúlyozták a még intenzívebb és hosszabb tartamú Hp-kezeléseket felnőtteknél. Bizmut négyes terápia (bizmut quadriple therapy, BQT) bekerült az I. vonali javasolt terápiák közé. A javasolt kezelések időtartama 14 napra hosszabbodott (19, 22, 23). A megjelent nemzetközi összefoglalók értékelték a Toronto konszenzus állításait (22), a Maastricht V/Florence (23), és az American College of Gastroenterology irányelveit (24), és megállapították, hogy a növekvő antibiotikum-rezisztenciák csökkentik az eddig bevált Hp-eradikációs kezelések hatékonyságát. A klaritromicin hármas terápia nem ajánlott, kivéve, ha a helyi klaritromicin-rezisztencia mértéke kevesebb, mint 15%. Kiemelendő, hogy a bizmut vagy az egyidejű antibiotikumok 14 napos négyszeres terápiája empirikus elsővonalbeli kezelésként ajánlott. A második vonalbeli kezelést a sikertelen elsővonalbeli terápia befolyásolja, amelyre négyszeres bizmut-alapú terápiát vagy levofloxacin-alapú terápiát javasoltak (25). A Helicobacter pylori fertőzés második vonalbeli kezelésére a protonpumpa-inhibitor (PPI)-amoxicillin-fluorokinolon hármas terápia ajánlott a Maastricht V/Florence Consensus Report jelentésében (23). Ugyanakkor e kombináció siker rátáját nem látva optimálisnak, Hsu PI és munkatársa 2017-ben közölt vizsgálatának célja az esomeprazol-bizmut-tetracyclin-levofloxacin négyes terápia (TL) és az esomeprazol-amoxicillin-levofloxacin hármas terápia (AL) hatásosságának összehasonlítása volt. A TL terápiában részesülő 50 közül 49 (98,0%) betegnél sikeres volt a Hp-eradikáció. Az AL hármas terápia 52-ből csak 36 betegnél volt sikeres (69,2%). Az intention to treat analízis kimutatta, hogy a TL-terápia szignifikánsan magasabb eradikációs arányt ért el, mint az AL-terápia (különbség: 28,8%, 95% konfidencia-intervallum: 15,7% és 41,9% között, P<0,001). A tíznapos PPI-bizmut-tetracyclin-levofloxacin négyes terápia jó megoldás a H. pylori fertőzés felszámolására a hagyományos tripla, vagy nem bizmutos négyes terápia meghiúsulása után (26). Egy másik vizsgálatban a bizmut kiegészítő terápia jelentősen emelte az agar tenyésztésen értékelt klaritromicin és metronidasol rezisztens törzsek eradikációs sikerét (27). Az antibiotikumokkal szembeni rezisztencia vizsgálata többszörös sikertelen kezelés után ajánlott. A jövőben a kezelési megközelítéseknek a helyi és individuális antibiotikum-rezisztenciákon kell alapulnia (19). Sajnos ezek még a világon (28) és így Magyarországon sem állnak rutinban rendelkezésre. További erőfeszítésekre van szükség a helyi antibiotikum-rezisztencia meghatározásához, hogy lehetővé váljon a regionálisan igazolt érzékenység-alapú kezelés (25).
Következtetések
Retrospektív tanulmányunkban a 2016 és 2017 év összehasonlításában a kontrollált Hp-eradikációk száma 39-cel csökkent. A sikeres kezelésekben 6% pont nem szignifikáns javulást észleltünk (p=0,271).
A 7 napos kezelések aránya a 2 év hasonlításában 4% ponttal csökkent (p=0,603). A 7 napos sikeres kezelések aránya 8% ponttal csökkentek, a sikertelen kezelések aránya 15% ponttal növekedtek. A sikeresség/sikertelenség aránya 73,5/26,5%, változatlan (p=0,993).
A 10 napos kezelések kétéves aránya nem változott (p=0,871). A 10 napos sikeres kezelések mintegy 14% ponttal nőttek, a sikertelenek ugyanennyivel csökkentek (p=0,135), 2017-ben az 5 alkalommal elvégzett 14 napos eradikációs kezelés mind sikeres volt.
A terápiás sikert a retrospektív tanulmányunk szerint a magas, 2×40 mg dózisú Emozul alkalmazása, és a terápia időtartamának növelése javította. Adott PPI-hatóanyagnál, vagy gyógyszernél a terápia időtartama a sikerességet befolyásolja.
Összefoglalva: Retrospektív feldolgozásunk alátámasztja az eradikációs kezelések 7-ről 10-14 napra való emelésének fontosságát, melyet a legújabb irányelvek hangsúlyoznak.
2. Csiszár K, Gyepes P, Bujalka R. Isolation of Campylobacter pyloridis from gastric biopsy material. Orv Hetil 1987; 128: 1419–21.
3. Birinyi P. Central European Journal of Gastroenterology and Hepatology 2016; 2(1): 180–183.
4. Malfertheiner P, Selgrad A. Helicobacter pylori. Curr Opin Gastroenterol 2014; 30: 589–95.
5. Malfertheiner P. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. European Helicobacter pylori Study Group. Gut 1997; 4: 8–13.
6. Rácz I, Simon L. 2005. évi orvosi-élettani Nobel-díj. A Helicobacter pylori-történet Magyarországon. LAM 2006; 16: 167–170.
7. Buzás Gy. Helicobacter pylori. Budapest: Medicina Könyvkiadó Zrt.; 1998.
8. Malfertheiner P, Mégraud F, O’Morain C, et al. Current concepts in the management of Helicobacter pylori infection – the Maastricht 2-2000 Consensus Report. Aliment Pharmacol Ther 2002; 16: 167–80.
9. Flores-Treviño S, Mendoza-Olazarán S, Bocanegra-Ibarias P, et al. Helicobacter pylori drug resistance: therapy changes and challenges. Expert Rev Gastroenterol Hepatol 2018 Jul 5. doi: 10.1080/17474124.2018.1496017. [Epub ahead of print]
10. Labenz J. Current role of acid suppressants in Helicobacter pylori eradication therapy. Best Pract Res Clin Gastroenterol 2001; 15: 413–431.
11. Gisbert JP. Potent gastric acid inhibition in Helicobacter pylori eradication. Drugs 2005; 65: 83–96.
12. Kuo CH, Lu CY, Shih HY, et al. CYP2C19 polymorphism influences Helicobacter pylori eradication. World J Gastroenterol 2014; 20: 16029–16036.
13. Uotani T, Miftahussurur M, Yamaoka Y. Effect of bacterial and host factors on Helicobacter pylori eradication therapy. Expert Opin Ther Targets 2015; 19: 1637–1650.
14. Sahara S, Sugimoto M, Uotani T, et al. Twice-daily dosing of esomeprazole effectively inhibits acid secretion in CYP2C19 rapid metabolisers compared with twice-daily omeprazole, rabeprazole or lansoprazole. Aliment Pharmacol Ther 2013; 38: 1129–1137.
15. Hong J, Shu X, Liu D. Antibiotic resistance and CYP2C19 polymorphisms affect the efficacy of concomitant therapies for Helicobacter pylori infection: an open- label, randomized, single-centre clinical trial. J Antimicrob Chemother 2016; 71: 2280–2285.
16. Anagnostopoulos GK, Tsiakos S, Margantinis G, et al. Esomeprazole versus omeprazole for the eradication of Helicobacter pylori infection: results of a randomized controlled study. J Clin Gastroenterol 2004; 38: 503–506.
17. McNicholl AG, Linares PM, Nyssen OP, et al. Meta-analysis: esomeprazole or rabeprazole vs. first- generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2012; 36: 414–425.
18. Akazawa Y, Fukuda D, Fukuda Y. Vonoprazan-based therapy for Helicobacter pylori eradication: experience and clinical evidence. Therap Adv Gastroenterol 2016; 9: 845–852.
19. Liu WZ, Xie Y, Lu H, et al. Chinese Society of Gastroenterology, Chinese Study Group on Helicobacter pylori and Peptic Ulcer. Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection. Helicobacter 2018; 23: e12475.
20. Dore MP, Lu H, Graham DY. Role of bismuth in improving Helicobacter pylori eradication with triple therapy. Gut 2016; 65: 870–878.
21. Ford AC, Malfertheiner P, Giguere M, et al. Adverse events with bismuth salts for Helicobacter pylori eradication: systematic review and meta- analysis. World J Gastroenterol 2008; 14: 7361–7370.
22. Fallone CA, Chiba N, van Zanten SV, et al. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology 2016; 151: 51–69.
23. Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut 2017; 66: 6–30.
24. Chey WD, Leontiadis GI, Howden CW, et al. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol 2017; 112: 212–239.
25. Bjorkman DJ, Steenblik M. Best Practice Recommendations for Diagnosis and Management of Helicobacter pylori-Synthesizing the Guidelines. Curr Treat Options Gastroenterol 2017; 15: 648–659.
26. Hsu PI, Tsai FW, Kao SS, et al. Quadruple Therapy Comprising Proton Pump Inhibitor, Bismuth, Tetracycline, and Levofloxacin is More Effective than Standard Levofloxacin Triple Therapy in the Second-Line Treatment of Helicobacter pylori Infection: A Randomized Controlled Trial. Am J Gastroenterol 2017; 112: 1374–1381.
27. Long X, Chen Q, Yu L, et al. Bismuth improves efficacy of proton-pump inhibitor clarithromycin, metronidazole triple Helicobacter pylori therapy despite a high prevalence of antimicrobial resistance. Helicobacter 2018; 23: e12485.
28. Zhang YX, Zhou LY, Song ZQ, et al. Primary antibiotic resistance of Helicobacter pylori strains isolated from patients with dyspeptic symptoms in Beijing: a prospective serial study. World J Gastroenterol 2015; 2: 2786–2792.
