Management of acute gastrointestinal bleedings – Practical overview
Summary
Management of acute gastrointestinal bleeding have remained one of the most important and exciting field of emergency medicine for the last 5 decades all over. The continuous development of drug treatment and endoscopic procedures, and also the improving conditions in Hungarian hospitals, as well as the increasing capacities of emergency ambulances makes it reasonable and useful to recover our knowledge on base of newer guidelines and scientific information in order to further improve everyday practice.
A tápcsatornai vérzések korszerű ellátása az elmúlt fél évszázad során változatlanul a gasztroenterológiai sürgősségi ellátás egyik legfontosabb területe. A gyógyszeres és endoszkópos ellátás lehetőségeinek folyamatos bővülése, fejlődése, valamint a hazai ellátórendszer modernizálódása szükségessé teszi a téma időnkénti áttekintését, az újabb irányelvek és ismeretek minél szélesebb körű megismertetését és a mindennapi gyakorlati ellátásba történő beépítését.
Bevezetés
Az akut tápcsatornai betegellátás – ideértve a vérzések ellátását is – három pilléren nyugszik:
- korszerű irányelvek megléte és ismerete,
- a konstruktív konzultáció intézményes alkalmazása,
- a „salus aegroti” elvének messzemenő figyelembe vétele.
Hazai viszonyok között több mint két évtizede indultak el az első lépések a tápcsatornai vérzőbetegek ellátásának hatékonyabbá és eredményesebbé tételére, az MGT 1994-es aligai nagygyűlésén, majd konkrétabb szervezeti keretek között Győrben, illetve Debrecenben. Azóta úgy az eszközös lehetőségek, mint a gyógyszeres modalitások fejlődtek, azonban a feladat fontossága és aktualitása mit sem változott. Elég például arra utalnunk, hogy látványosan növekszik az antikogulált betegek száma, egyre többen szednek rendszeresen trombocitaaggregáció-gátló készítményeket, és nem feledkezhetünk el az új típusú orális antikoaguláns készítményekről sem. A közelmúltban megjelent újabb európai és amerikai irányelvek (1–6) és a hazai realitások (7) közepette időszerűnek látszik egy áttekintés az aktuális lehetőségekről. Annál is inkább érdemes erről közösen gondolkodni, mert a szakmai fejlődés nálunk nem elsősorban a gasztroenterológiai szubintenzív ellátás irányában indult el, hanem a sürgősségi ellátás felé, ami mindenképpen árnyaltabbá teszi a kérdést. Erre vállalkozunk ebben az összefoglalóban.
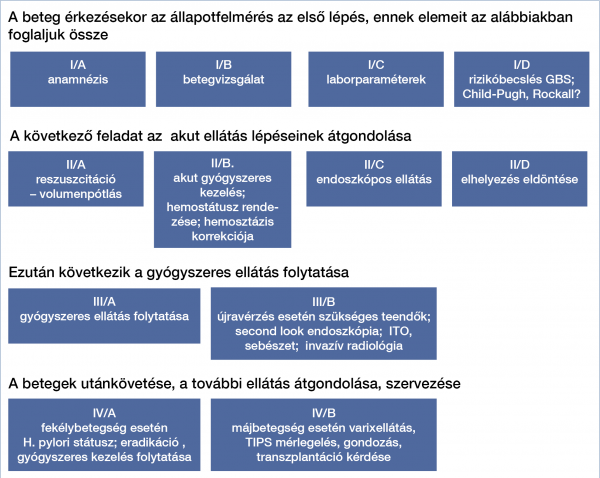
Évente 100 ezer lakosra kivetítve kb. 200-250 beteggel számolhatunk, ami országosan mintegy 20 ezer beteg ellátását jelenti, döntően nagyobb kórházakban és klinikákon (8). Éppen hazai eredetű nemzetközi közleményben sikerült néhány éve demonstrálnunk, hogy az ellátás nagyobb forgalmú centrumokban egyértelműen hatékonyabb, ezért is fontos, hogy jól követhető, gyakorlatilag is alkalmazható iránymutatás készüljön (9). A tápcsatornai vérzőbetegek ellátása 4 szintre bontható, ezeken belül további részfeladatok írhatók jól körül (1. ábra).
• A beteg érkezésekor az állapotfelmérés az első lépés.
• A következő feladat az akut ellátás lépéseinek átgondolása.
• Ezután következik a gyógyszeres ellátás folytatása.
• A betegek utánkövetése, a további ellátás átgondolása, szervezése.
Vegyük sorra a fenti egységeket.
Állapotfelmérés
Az anamnézis felvétele során részletesen tájékozódni kell a vérzés, vér megjelenésének idejéről, formájáról, intenzitásáról. A vérzés főbb formái a hematemesis, ezen belül fontos elkülöníteni a friss vér hányását a savhematinos gyomorbennék hányásától, a melaena, itt fontos a mennyiség és a konzisztencia; a hematochesia, vagyis a vérszékelés, ami nem emésztett, friss vér megjelenését jelenti, valamint az okkult vérvesztés igazolt kimutatása.
Fontosak a beteg által szedett gyógyszerek, különös tekintettel az alvadásgátló készítményekre (K-vitamin-antagonisták; újabb orális antikoagulánsok); a vérlemezke-aggregációt gátló készítményekre, úgymint clopidogrel, aszpirin stb., valamint a nem szteroid gyulladásgátlókra, amelyek népes családja már recept nélkül is beszerezhető. Szintén célszerű tisztázni a szteroid szedését is.
A kórelőzményben fontos a krónikus szervi betegségek tisztázása, veseelégtelenség, ismert májbetegség, hematológiai kórkép, vérzékenység, malignus betegségek; továbbá az időközeli endoszkópos beavatkozások (polypectomia, papillotomia, mucosectomia stb.). A kórelőzményhez tartozó fontos információ még a korábbi tápcsatornai vérzés, mint kockázati tényező, valamint az esetleges sebészi beavatkozások.
A betegvizsgálat során külön figyelmet érdemelnek a vérzékenység látványos jelei, az icterus, a hemodinamikai paraméterek, szapora pulzus, alacsonyabb vérnyomás, szapora légzés, instabilitás, kollapszus-hajlam, tudatállapot, orientáció, nyelvszárazság, EKG-lelet, a máj és lép mérete, kóros hasi terime felderítése, rectalis digitalis vizsgálat, szervi átáramlás akut zavarának jelei stb.
A legfontosabb, már a sürgősségi vizsgálat során felderíthető laborparaméterek között a vérkép, hematokrit, vérlemezke és fvs-szám mellett fontos az alap hemosztázis – az APTI (aktivált parciális tromboplasztin idő) jobban jellemzi a májbetegek hemosztázisát, mint az INR (nemzetközileg standardizált protrombin ráta), a fibrinogénszint ismerete is fontos lehet később – továbbá az urea, kreatinin, GFR (glomeruláris filtrációs ráta) meghatározása. Tudvalevő, hogy az urea prominensebb emelkedése a kreatininhez képest felső GI (gasztrointesztinális) vérzés jele lehet. Hasznos információt adhat az Astrup ellenőrzése, az esetleges acidózis vonatkozásában, továbbá a szokásos májparaméterek tisztázása.
Természetesen indokolt és kívánatos a vércsoport meghatározása is!
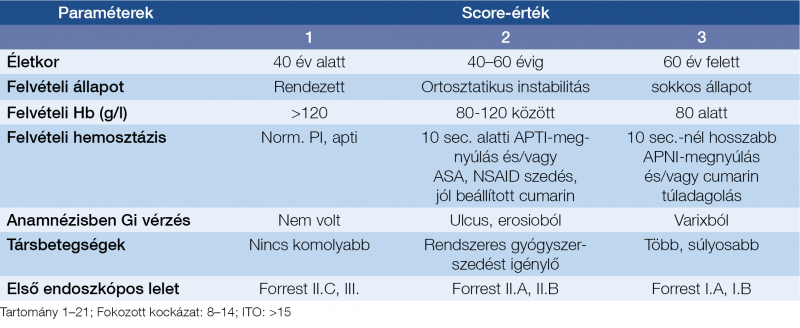
A nemzetközi gyakorlatban használatos guideline-ok mindegyike tartalmazza a kezdeti laboratóriumi és klinikai paraméterek alapján képzett rizikóbecslés javaslatát, ennek több és logikus célja van, egyrészt a beteg kórjóslatának megállapítása, ami lehetőséget ad az enyhébb esetek ambuláns megoldására, vagy éppen az intenzív osztályos elhelyezés indokoltságára, másik gyakorlati szempont lehet az endoszkópos vizsgálat időzítésének kérdése, amiben teljesen egységes álláspont nem is alakult ki. A rizikóbecslés egyik nem elhanyagolható vonatkozása a mortalitás előrejelzésén túl az ellátás költségeinek prognosztizálása is. Az elmúlt negyedszázad során számos ilyen score rendszer közlésére került sor, ezek között általában átfedések vannak, a legfontosabb különbség talán az 1996-ban közölt – 1998-ban általunk kiegészített (8) – Rockall score (10) vonatkozásában tehető (1. táblázat), amelynek komplett formája már tartalmazza az endoszkópos lelet eredményét is, az ajánlatok többsége azonban beéri ennél kevesebbel is.
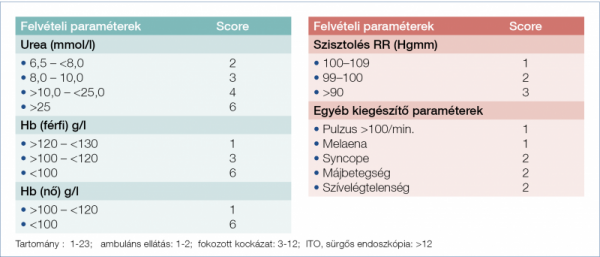
Ma a legelfogadottabb a 2000-ben publikált Glasgow–Blatchford-score használata (11), lásd a 2. ábrán; ennek kissé módosított, egyszerűsített formája is használatos pl. az USA-ban (6).
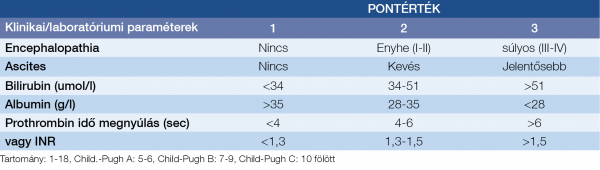
Az egyik, legújabb próbálkozás a 2011-ben közölt AIMS65-pontrendszer (12), ami minden eddiginél lényegesen egyszerűbb, hiszen mindössze 5 tényezőt (albumin <30; INR >1,5; Glasgow coma scale <14; szisztolés vérnyomás <90; életkor >65) vesz figyelembe 1-1 ponttal és a 3 tekinthető a súlyosabb kategória határértékének, leginkább a kórházon belüli vérzések mortalitásának prognosztizálására dolgozták ki. Ennek a szempontrendszernek a validálása és összevetése a korábbi kettővel aktuálisan is folyik (13–16). Májbetegek esetében célszerű és hatékony a Child–Pugh-score (2. táblázat) – esetleg a MELD-score – kiszámítása is (17)!
Az akut ellátás lépéseinek átgondolása
A frissen érkező beteg állapotának felmérése és az akut döntés felelőssége főként azokra hárul, akik a beteg adatainak ismeretén túl de facto meg is vizsgálják a beteget, és így módjuk nyílik a beteg állapotáról, kilátásairól, esélyeiről a legközvetlenebbül tájékozódni, ez lehet az általános gyakorlatban az SBO illetékes szakorvosa, munkaidőn túl az ügyeletes kolléga, komplexebb esetekben az odahívott ügyeletvezető, vagy adott esetben az intenzív osztály vezetője, ha őt is bevonják as döntéshozatal folyamatába.
A konstruktív konzultáció az ellátás során érintett, szakmailag tapasztaltabb kollegák – ügyeletvezető, intenzív osztályvezető, SBO-vezető – között közvetlenül folytatott szakmai egyeztetés, amelynek célja a beteg érdekében a legmegfelelőbb döntés kialakítása. Ez nem történhet üzengetés, áttételes utasítás stb. formájában, mert az már ellenőrizhetetlenné, követhetetlenné válhat, egyértelmű hibaforrás lehet, ennek mindig egyértelműnek, minden fél számára világosnak kell lennie! A konstruktív konzultáció során kialakított megállapodást feljegyzés formájában mindenképpen rögzíteni kell. Csak így válik utólag lehetővé az esetleges felelősség tisztázása is valamilyen lépések elmaradása, hibás intézkedések, helytelen döntések etc. esetén.
Reszuszcitáció, volumenpótlás
Az akut ellátás első lépése a volumenpótlás, reszuszcitáció kell legyen, ezt a mai felfogás szerint egyszerű fiziológiás sóoldattal, esetleg Ringer-Laktát oldattal kell kezdeni, ehhez szükséges megfelelő intravénás kanülök behelyezése, célszerű módon két kanül a jobb megoldás. Óránként 250-300 ml oldat bejuttatása kívánatos a beteg állapotának függvényében. Ezzel egyidejűleg kell elindítani a hemostátusz korrekcióját, a hemosztázis rendezését, valamint az akut gyógyszeres kezelést – ideértve a savgátló kezelést, varixvérzés esetén a zsigeri vérátáramlás csökkentésére szolgáló vazoaktív gyógyszereket, az antibiotikum adását –, továbbá mérlegelni az endoszkópos vizsgálat szükségességét és amennyiben erről döntés születik, esetleg iv. 250 mg erythromycin egyszeri adásával felgyorsítani a gyomor kiürítését a vizsgálat előtt.
Endoszkópos ellátás
Az endoszkópos ellátás időzítése alapvető fontosságú döntés, ugyanakkor az irodalomban nem teljesen egyértelműek az állásfoglalások. A nem varix eredetű felső vérzések esetén az irányelvek 24 órán belüli vizsgálatot tartanak szükségesnek (1, 3, 5), vannak azonban olyan adatok, amelyek szerint magasabb rizikójú betegek esetén a 12 órán belüli endoszkópos ellátás javítja a túlélést (18, 19). Ugyanakkor nem vitatható, hogy az akut nyelőcső varixvérzés, a nehezen uralható hemodinamikai instabilitást okozó folyamatos vérzés, illetve a megelőző endoszkópos beavatkozást – pl. papillotomiát – követően észlelt aktív vérzés esetén a mielőbbi endoszkópia indokolt, elsőbbséget kell kapjon. Természetesen számos olyan eset fordul elő, amikor kevés savhematinos hányás, minimális melaena észlelése és elfogadható vérkép, kielégítő általános állapot mellett a tükrözés várhat 6-12 órát, esetenként másnap reggel kerülhet rá sor. Ha irányelvek mentén és a hazai realitásokat is figyelembe véve akarunk útmutatást kidolgozni, legjobban a GBS alapján lehet az endoszkópia időzítését körvonalazni; részletesen lásd a 3. táblázatban!

GBS 1-2 esetén elektív endoszkópia indokolt, tehát 12 órán túlra, következő reggelre halasztható a vizsgálat; GBS 3-12 esetén korai elektív vizsgálatra van szűkség, 12 órán belül, 6-12 óra között történjen meg az endoszkópos vizsgálat; GBS>12 esetén valódi urgencia áll fenn, tehát az endoszkópos vizsgálatra 2-6 órán belül kerüljön sor.
Akut endoszkópos ellátás
Az akut endoszkópos ellátás eszközrendszere az elmúlt évek során számos új lehetőséggel bővült, például az endoszkópra szerelhető clip (OVESCO) (20), vagy a lokális ellátás új, hatékony formája a Hemospray (21), illetve ennek egyéb formái (Endoclot, Ankaferd), ugyanakkor régebbi metodikák (HPU etc.) alkalmazása visszaszorult. A varixvérzések ellátása során a gumigyűrű-ligatúra mindenképpen az első helyre került. A legújabb irányelvek szerint a nem varix eredetű vérzések ellátása során a higított tonogénnel történő infiltráció önmagában nem kellően hatékony, azt kombinációban kell alkalmazni (22, 23). A fekélyvérzések endoszkópos ellátásával kapcsolatban változatlanul a klasszikus Forrest-klasszifikációt kell és lehet alapul venni, és a leleten fel kell tüntetni a megfelelő besorolást (24)!
- Forrest I: látható aktív vérzés I/A artériás spriccelés I/B: szivárgó vérzés.
- Forrest II: nincs aktív vérzés, de bizonyosan volt: II/A látható ércsonk II/B tapadó koagulum II/C savhematinos beívódású fekélyfészek.
- Forrest III: fehér, fibrines lepedékkel fedett fekélyfészek (nem biztos, hogy volt vérzés).
Az ESGE-irányelvek és az elmúlt évtized fontosabb közlései szerint Forrest I/A, I/B és II/A besorolású fekélyvérzések ellátása során az endoszkópos ellátás hatékonysága nagyobb bármely gyógyszeres ellátásnál, ennek megfelelően törekedni kell az aktív endoszkópos vérzéscsillapításra. A Forrest II/B tapadó koagulum ellátása során erős vízsugárral történő lemosás célszerű, amennyiben az alvadék jól rögzült és nem távolítható el, akkor megindult a szervülés és vélhetően már nem fog vérezni, amennyiben még könnyen lemosható, akkor viszont törekedni kell az adekvát ellátásra (4).
Az alábbiakban röviden összefoglaljuk a legfontosabb vérzésformák esetén szóbajövő eljárásokat, a technikai részletek alaposabb ismertetése messze meghaladná a jelen tanulmány terjedelmi lehetőségeit, így ezzel kapcsolatban utalunk Szalai és Rácz doktorok kiváló, képekkel gazdagon illusztrált közlésére (25).
- Erozív és fekélyvérzések: tonogénes infiltráció + termokoaguláció/APC; hemoclip; hemospray.
- Mallory–Weiss-ruptura: tonogénes infiltráció + hemoclip.
- Mucosectomiát követő vérzés: APC; termokoaguláció; hemoclip.
- Polypectomiát követő vérzés: termokoaguláció, hemoclip, esetleg műanyag hurok; OVESCO?
- Nyelőcsővarix-vérzés: gumigyűrű ligatúra, szkleroterápia, Sengstaken-szonda lehelyezése.
- Gyomorvarix-vérzés: histoacryl + lipiodol 1:1-3 intravariceálisan; gumigyűrű ligatúra.
- Görögdinnye gyomor: APC, gumigyűrű ligatúra.
- Dieulafoy-lézió: hemoclip; hemospray, OVESCO?
- Duodenum-varix: histoacryl + lipiodol 1:1-3 intravericealisan.
- Felső tápcsatornai tumoros eredetű vérzés: APC; hemospray.
Hangsúlyozni kell, hogy az endoszkópos ellátást igénylő tápcsatornai vérzések esetén az ESGE-guideline egyértelmű állásfoglalása szerint 72 órás intézeti megfigyelés kívánatos (4)!
Az akut gyógyszeres ellátás
Az akut gyógyszeres ellátás egyik első lépése mindenképpen az iv. protonpumpa-gátló alkalmazása (pantoprazol) iv. bólus, majd 8 mg/óra infúziós pumpa formájában. Ennek legfőbb indoka, hogy a gyomor pH 6 fölött tartása optimalizálja a trombocita-aggregációt és az alvadékképződést (Green FW et al, Gastroenterology 1978; 74: 38–43.).
Irodalmi adatok szerint az iv. bólus adása már endoszkópia előtt is előnyös, javíthatja az endoszkópia során az aktív ellátás sikerességét, mindezt célszerű prokinetikus gyógyszerrel (hazai viszonyok között iv. metoclopramiddal) kiegészíteni (26, 27, 28). Az már irodalmi vita tárgya, hogy meddig kell iv. készítményt adnunk és mikor térhetünk át az orális adásra, régebben 2-5 napig alkalmaztuk az infúziós pumpát, ez a beteg általános állapota függvényében 2 napra csökkenthető, mert ha a gyomorban vér már nincs és a gyomor ürülése nem nehezített, akkor a szájon át adott PPI-készítmények hasznosulása jó (29). Általánosan elfogadott ugyanakkor, hogy az akut fekélyvérzés ellátásában sem a H2-receptor-antagonistáknak, sem a somatostatinnak nincs szerepe (4).
Gyógyszeres kezelés folytatása
Varixvérzés gyanúja esetén általánosan elfogadott a vazoaktív gyógyszeres kezelés (somatostatin, octreatid, terlipressin) azonnali elindítása (30), ez a választott, illetve rendelkezésre álló gyógyszer formájától függően eltérő adagolást jelent: octreotid 25-50 mg bólus után 25 mg/óra infúziós pumpa 48-72 órán át; somatostatin esetén 250 mg bólus után 250 mg/óra infúziós pumpa, 48-72 órán át; terlipressin 4-6 óránként 1-2 mg iv. bólus formájában alkalmazandó, szintén 2-3 napig, infuziós adásról van ugyan irodalmi adat, de ez a szerény számok miatt egyelőre nem meggyőző.
Krónikus májbetegek varixvérzése esetén szintén elfogadott az antibiotikum-kezelés azonnali elindítása, iv. napi 1-2 gram ceftriaxon formájában, általában 7 napig (30).
Fontos kérdés a hemostátusz korrekciója, az újabb irodalmi állásfoglalások (Villanueva et al, NEJM 2013; 368: 11–21.) szerint a kívánatos és elegendő a 70 és 90 g/l közötti hemoglobin-érték biztosítása, túlélés szempontjából nem előnyösebb a 90 g/l fölötti hemoglobin-érték forszírozása. Ez természetesen rugalmasan értelmezendő, például igazolt koronáriaszklerózis, mesenterialis iszkémia, vese keringési zavar esetén, amikor az anémiához társuló szöveti hypoxia végzetes lehet. Az alapvető álláspont tehát, hogy vvt-transzfuzió adása 70 g/l hemoglobin érték alatt mindenképpen indokolt (31)!
A másik, szintén gyakorlati jelentőségű kérdés a haemosztázis korrekciójának problémája. Ezt mindenképpen két részre kell bontani, nevezetesen külön kell foglalkozni a májbetegekkel. Az újabb guideline-ok szerint aktív tápcsatornai vérzés esetén, különösen ha tartós antikoaguláns készítményt szedő betegről van szó, és az INR magasabb az előírt, kívánatos értéknél, célszerű az INR értékét 2,5 alá csökkenteni, de a magasabb érték nem lehet akadálya az endoszkópos vizsgálatnak, amennyiben ez szükséges (4). Az INR korrekciójához iv. Konakion, friss fagyasztott plazma, vagy protrombin komplex koncentrátum adása jön szóba, ezek közül az utóbbi a leghatékonyabb és leggyorsabb. Fontos azonban hangsúlyozni, hogy például trombocitaaggregáció-gátlót (pl. clopidogrel) szedő betegnél trombocita-szuszpenzió adása segíthet, az újabb, orális antikoagulánsok közül a dabigatran esetén már létező antidotum az idarucizumab, amelynek iv. 5 g dózisa nagy hatékonysággal függeszti föl rövid idő alatt a dabigatran hatását (32). Természetesen tápcsatornai vérzés előfordulhat olyan betegben is, akiknek a megfelelő szintű antikoaguláns védelme rendkívül fontos, ide tartoznak a mechanikus műbillentyűvel rendelkező betegek, vagy a frissen koronáriastentet kapott betegek, ahol a hemosztázis bármilyen „korrekciója” különleges figyelmet igényel, ilyenkor a kardiológussal történő konzultáció is fontos lehet. Saját tapasztalataink szerint is, műbillentyűs betegek esetén az INR 1,5–2,0 közé történt óvatos csökkentése mellett billentyűkárosodást nem észleltünk, ekkor pedig elindítottuk az LMWH kisdózisú adását, miközben törekedtünk a vérzés megállítására. Szintén kardiológusokkal folytatott egyeztetés szerint frissen stentelt betegek esetén a kettős TAG-kezelésből a clopidogrelt semmiképpen sem szerencsés kihagyni, mert a stent okklúzió és a következményes szívizom-károsodás veszélye igen magas!
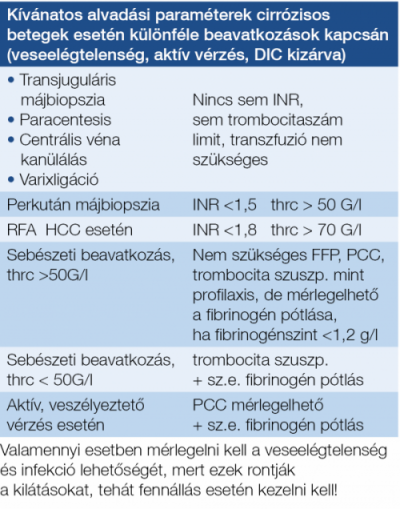
A krónikus májbetegségekről korábban azt gondoltuk, hogy a beteg vérzékenyebbé válik, ezt támogatják az alapvető hemosztázis paraméterek, tehát az emelkedett INR- és APTI-értékek is, azonban az utóbbi időben derült fény arra, hogy számos esetben inkább hiperkoagulabilitásról van szó, ezt támogatja többek között az a felismerés is, hogy cirrózis akut vaszkuláris dekompenzációja hátterében egyre gyakrabban derül fény parciális porta véna trombózisra is (33)! Ugyanakkor az is kiderült, hogy ezen betegek alvadásgátló kezelése nem növeli lényegesen a vérzésveszélyt, sőt a túlélést javíthatja. Viszont nem mindig könnyű eldönteni, hogy milyen antikoaguláns készítmény lenne a legjobb. Azt azonban egyértelműen elfogadja az irodalom, hogy cirrózis esetén is szükséges és lehetséges a trombózis-profilaxis alkalmazása, de fontos a varixvérzés gyógyszeres és endoszkópos megelőzésének korrekt mérlegelése. Életet veszélyeztető vérzés esetén PCC adható, hogy a faktorhiány helyre állhasson, anélkül, hogy fokozott volumenterheléssel fokoznánk a portális nyomást, éppen ezért dekompenzált cirrózisban FFP adása inkább ellenjavallt, másrészt ma már nem javasolják a rekombináns VIIa faktor adását sem. Vérlemezke-szuszpenzió adható, ha a trombocitaszám <50 G/l, főleg, ha trombocita működési zavar lehetősége felmerül, továbbá, amennyiben a fibrinogénszint <1,2 g/l, akkor ez pótlandó (34).
A legújabb összefoglalók szerint cirrózis esetén a vérzésveszély megítélésére:
- Nem teljesen megbízható: INR, protrombin idő, vérzési idő vizsgálata.
- Megbízható: vérlemezkeszám (~50 G/l); fibrinogénszint: >1,2 g/l.
- Ígéretes tesztek: trombin generációs assay; trombelasztográfia; fibrinolízis teszt a hiperfibrinolízis igazolására, azonban ezek nem mindenhol hozzáférhetők, speciális laboratóriumi feltételeket igényelnek!
A 4. táblázat krónikus májbetegek hemosztázis egyensúlyának paramétereit vázolja föl.
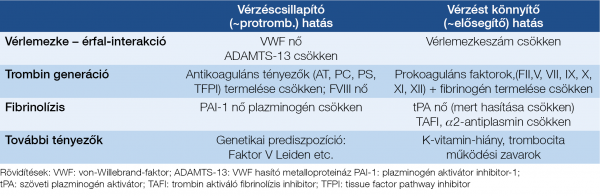
A kérdés komplexitásának demonstrálására álljon itt néhány gyakorlati példa a legújabb irodalmi állásfoglalásokból: pl. a Royal Free Hospital iránymutatása ebben a témában (35).
Teendők az akut vérzés ellátása után
A vérzés sikeres ellátását követően a gyógyszeres kezelést általában 5-7 napig folytatni kell, majd ezután kell dönteni a további teendőkről, ilyenkor az alapbetegség függvényében vagy a savgátló kezelés néhány hetes folytatása, vagy a Helicobacter pylori fertőzés lehetőségének korrekt tisztázása és az eradikáció mielőbbi elvégzése – majd a sikeresség ellenőrzése – az egyik legfontosabb feladat (4). Amennyiben a beteg tápcsatornai vérzésében aszpirin, NSAID típusú gyógyszerek és trombocitaaggregáció-gátló készítmények szedése is szerepet játszott, az mindenképpen átgondolást igényel! Nagyobb kockázatú peptikus vérzés (Forrest I-II) esetén a primer prevencióra adott aszpirin felfüggeszthető, ugyanakkor a koronáriabetegségek szekunder prevenciójára szedett aszpirint lehetőleg 3 nap után célszerű visszaadni, mert 30 napon túl szignifikánsan emelkedhet a kardiovaszkuláris események veszélye. Alacsonyabb kockázatú vérzés (Forrest IIc-III) esetén a primer és a szekunder prevenció céljából adott aszpirin felfüggesztése sem kötelező, csak gondoskodni kell a savgátlásról. Azt is tudni kell, hogy a clopidogrel önmagában adva sem teljesen veszélytelen a tápcsatornai vérzés szempontjából, még ha a kockázat csupán kb. negyede az aszpirin szedésekor tapasztaltnak (36).
Fontos azt is hangsúlyozni, hogy a tartósan NSAID gyógyszerre szoruló, például mozgásszervi, betegek esetén gondoskodni kell a gyomormucosa védelméről. Napjainkban, amikor növekvő irodalma van a protonpumpa-gátlók tartós szedésével kapcsolatba hozott esetleges kockázatoknak, különösen fontos, hogy józanul mérlegeljük, kinek milyen NSAID készítményt adjunk és ehhez milyen savgátló készítmény adása indokolt. Amennyiben csak a nyombélben voltak eróziók, akkor a kevésbé irritatív NSAID hatóanyagok – aceclofenac, naprosyn, ibuprofen és diclofenac – mellett H2-receptor-antagonista adása elégséges lehet, ha viszont a gyomornyálkahártyán voltak elváltozások, fekélyek, akkor protonpumpa-gátló készítmények tartós adása indokolt, különösen 60-65 év fölötti betegekben.
Az akut varixvérzés sikeres ellátását követő teendőket a VI. BAVENO konszenzus konferencia irányelvei szerint célszerű átgondolni (37). Egyrészt törekedni kell a portális nyomás csökkentésére, erre változatlanul a nem szelektív béta-blokkoló propranolol, illetve nadolol a legelterjedtebb, azonban ezzel egyenértékűnek tartják és egyre szélesebb körben alkalmazzák a carvedilolt is. A másik fontos feladat a szekunder varixvérzés megelőzés szempontjából a varixok eradikációja, ami gyakorlatilag jól felkészült endoszkópos szakemberek által végzett varix ligatúrával történhet. Ezen feladatok mellett szükséges még az ascites képződés csökkentésére megfelelő dózisú vízhajtó kezelés felépítése is. Az ascites megjelenése önmagában nem ellenjavallja a nem szelektív béta-blokkoló kezelés folytatását, de fokozott körültekintést igényel. Rezisztens ascites klinikai képe esetén Carvedilol nem adható és a propranolol dózisát is minimálisra kell csökkenteni, ugyanakkor fontos hangsúlyozni, hogy a rezisztens ascites képződés hátterében gyakran spontán bakteriális peritonitis állhat, ennek tisztázása (ascites próbapunkció, fvs: >0,25 G/l) és megfelelő antibiotikum-kezelése elengedhetetlen! Az NSBB felfüggesztése indokolt, ha kreatinin >1,5 mg/dl; ha RR <90 Hgmm, továbbá Na <130 mmol/l észlelése mellett, valamint ha katekolamin adására van szükség hepatorenális elégtelenség kezelése során! További fontos kérdés az encephalopathia lehetőségének mérlegelése és adekvát kezelése is! A klinikai állapot javulása, rendeződése esetén az óvatos NSBB visszaadás mérlegelendő.
Teendő a primer ellátás sikertelensége esetén
Abban az esetben, amikor a nem varixeredetű felső tápcsatornai vérzés ellátása eredménytelen marad, szükség lehet sebészeti konzíliumra, hiszen vannak olyan esetek, mintegy 5%-ban, amelyek csak sebészeti módszerrel láthatók el:
- I. endoszkópos vérzéscsillapítás makroszkóposan sikertelennek bizonyul és a beteg hemodinamikai instabilitást mutat.
- II. súlyos, uralhatatlan artériás vérzés.
- III. időskori óriásfekély, 3 cm-nél nagyobb átmérővel, aminek hatékony gyógyszeres rendezésére nagyon csekély az esély. A klinikum függvényében néhány napos várakozás lehetséges, újabb endoszkópiával, de ha nincs egyértelmű javulás, akkor sebészi konzílium célszerű.
- IV. felső tápcsatornai vérző malignus elváltozások.
- V. megelőző endoszkópos vizsgálatot, beavatkozást követően fellépő olyan fokú vérzés és instabilitás, amit endoszkópos ellenőrzés során nem tudunk technikailag uralni, illetve amikor perforációra kell gondolnunk.
A varixvérzések során, ha a kombinált gyógyszeres és endoszkópos ellátás ellenére változatlan a vérzés és a beteg instabil állapotban van, akkor ballon tamponád alkalmazására kell sort keríteni, nálunk a Sengstaken–Blakemore-szonda a leginkább használatos. Ennek lehelyezése az orron keresztül kell történjen, megelőzően a szondán lévő ballonok épségét felfújással ellenőrizni kell, majd az összepréselt tubust toljuk le a gyomorba, a beteget oldalfekvő helyzetben kell hozni, illetve tartani. Először az alsó, gyomorballon töltjük föl, célszerűen fiziológiás sóval – átlagosan 50-60 ml fér bele –, miután a folyadék sokkal jobban tartja a nyomást és ezért hatékonyabb, mint a levegő, ezután a feltöltött ballont óvatosan húzzuk a cardiáig, ahol az minimális húzás mellett rugalmasan felfekszik, ezt követően töltjük föl a nyelőcső-ballont – átlagosan 120-130 ml fér bele –, és rögzítjük kevés húzással (pl. 100 ml-es infúziós palack) a feltöltött ballont.
Rendkívül fontos annak ellenőrzése, hogy a beteg légzése a szonda mellett akadálytalan legyen! A feltöltött ballont legfeljebb 12 óráig szabad teljesen a helyén hagyni, mert a nyálkahártyát dekubitálni fogja. Stabil állapot esetén 8 óra után kell mérlegelni a szonda fokozatos és óvatos eltávolítását, óránként haladva, először a húzást megszüntetni, a nyelőcső ballont leengedni, a gyomor ballont leengedni majd a leeresztett szondát kihúzni. A fokozatosság azért is kívánatos, mert, ha közben újbóli vérzés indulna, még visszatölthető a szonda. Nagyon fontos, hogy a korrekt gyógyszeres ellátás a ballontamponád mellett is folyamatosan történjen.
Másik megoldás lehet majd a jövőben az öntáguló fémstent időleges alkalmazása, ebben az esetben 1-2 hét után kerülhetne sor a stent kivételére, ez a megoldás azonban egyelőre még nem terjedt el szélesebb körben. Az 5. táblázatban és a 3. ábrán a vérző betegek ellátásának vázlatos összegzését láthatjuk, a 6. táblázatban az intenzív osztályos elhelyezés feltételrendszerét tüntettük föl.



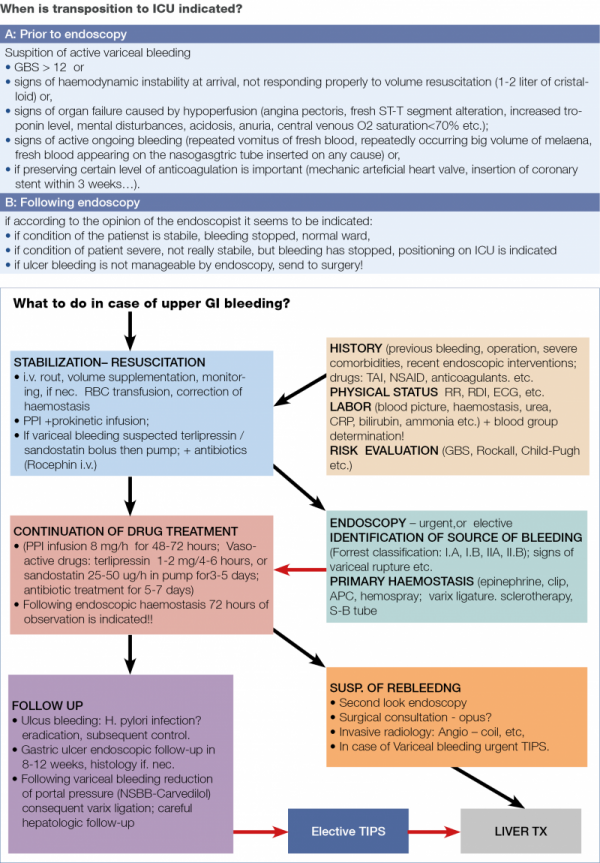
A következő fontos kérdéskör az újravérzés esete!
A korszerű elvek szerint ebben az esetben indokolt valójában a második endoszkópos vizsgálat (az ún. second look endoszkópia) elvégzése, és ennek során törekedni kell a vérzésforrás felismerésére és a sikeres vérzéscsillapításra (4). Amennyiben ez nem kivitelezhető, akkor további diagnosztikus lépések lehetnek szükségesek, például az angiográfia, ennek során mód nyílhat embolizációra, ehhez természetesen invazív radiológusra van szükség, vagy pedig sebészeti konzultációra, esetleg áthelyezésre és endoszkóposan nem kezelhető vérzés esetén annak sebészeti ellátására. Mindez természetesen abban az esetben (~5%) is így van, ha az elsődleges ellátás során nem sikerül a beteg állapotát rendeznünk.
Amennyiben krónikus májbetegség áll fenn és a varixvérzés ismétlődik rövid időn belül, akkor az irodalom egyértelmű állásfoglalása szerint az ún. urgens TIPS behelyezése lenne kívánatos, amire azonban sajnos csak korlátozottan van lehetőség (38, 39). Ez természetesen nem jelenti azt, hogy viszonylag rövid időn belüli TIPS behelyezésére ne törekedjünk idehaza is. A májcirrózisban szenvedő, varixvérzésen már túljutott betegek gondozásának és ennek során a logikus következő lépésként szóbajövő májátültetés szervezésének tárgyalása meghaladja jelen áttekintés kereteit, azt azonban hangsúlyozni kell, hogy ez a leghatékonyabban megfelelő centrumokban végzendő.
2. Scottish Intercollegiate Guidelines Network (SIGN). Guideline 105: Management of acute upper and lower gastrointestinal bleeding. September 2008. ISBN 978 1 905813 37 7.
3. Barkun AN, Bardou M, Kuipers EJ, et al. International consensus recommendations on the management of patients with nonvariceal upper gastrointestinal bleeding. Ann Intern Med 2010; 152: 101–13.
4. Gralnak Ian M, et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE). Guideline Endoscopy 2015; 47: 1–46.
5. The role of endoscopy in the management of acute non-variceal upper GI bleeding. ASGE Guideline Gastrointestinal Endoscopy 2012; 75: 1132–1138.
6. Acute Upper Gastrointestinal (UGI) Bleeding in Adults: Triage and Management The OHIO State University, Wexner Medical Center Authors: Eldika S, Groce R, Adkins E, Eiferman D, McCarthy S, Besecker B. Guideline approved: August 30. 2017, fifth edition
7. Altorjay I. A nem varixeredetű felső tápcsatornai vérzések korszerű ellátásának irányelvei. LAM 2010; 20: 375–381.
8. Altorjay I, Palatka K, Győrffy Á, et al. Felső tápcsatornai vérzések korszerű ellátása erre specializált gastrointestinalis részlegen. Orv Hetil 1998; 139: 2121–26.
9. Rácz I, Kárász T, et al. Management of Peptic Ulcer Bleeding in Different Case Volume Workplaces: Result of a Nationwide Inquiry in Hungary. Gastroenterol Research and Practice 201; 956434. DOI: 10.1155/2012/956434
10. Rockall TA, Logan RF, Devlin HB, Northfield TC. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996; 38: 316–321.
11. Blatchford O, Murray WR, Blatchford M. A risk score to predict need for treatment for upper gastrointestinal haemorrhage. Lancet 2000; 356: 1318–21.
12. Saltzman JR, Tabak YP, Hyett BH, Sun X, Travis AC, Johannes RS. A simple risk score accurately predicts in-hospital mortality, length of stay, and cost in acute upper GI bleeding. Gastrointest Endosc 2011; 74: 1215–1224.
13. Palmer AJ, Moroni F, Mcleish S, et al. Risk assessment in acute nonvariceal upper GI bleeding: the AIMS65 score in comparison with the Glasgow–Blatchford score in a Scottish population. Frontline Gastroenterology 2016; 7: 90–96. doi:10.1136/flgastro-2015-100594
14. Alexandrino G, Carvalho R, Reis J. Comparison of the AIMS65 Score with Other Risk Stratification Scores in Upper Variceal and Nonvariceal Gastrointestinal Bleeding Gut and Liver 2018; 12: 111–113.
15. Stanley AJ, Dalton HR, Blatchford O, et al. Multicentre comparison of the Glasgow Blatchford and Rockall scores in the prediction of clinical end-points after upper gastrointestinal haemorrhage. Aliment Pharmacol Ther 2011; 34: 470–5.
16. Robertson M, Majumdar A, Boyapati R, et al. 155 risk stratification in acute upper gastrointestinal bleeding: AIMS65 is superior to Glasgow-Blatchford and Rockall scoring systems in predicting inpatient mortality. Gastrointest Endosc 2015; 79: AB112.
17. Child CG, Turcotte JG. The liver and portal hypertension. In: Child CG, editor. Surgery and Portal Hypertension 1964; 1: 1–85.
18. Lim L.G, Ho K, Chan Y, et al. Urgent endoscopy is associated with lower mortality in high-risk but not in low-risk nonvariceal upper gastrointestinal bleeding. Endoscopy 2011; 43: 300–306.
19. Spiegel BMR, Vakil NB, Ofman JJ. Endoscopy for acute nonvariceal upper gastrointestinal tract hemorrhage: is sooner better? A systematic review. Arch Intern Med 2001; 161: 1393–404.
20. Manta R, Galloro G, Mangiavillano B, et al. Over-the-scope clip (OTSC) represents an effective endoscopic treatment for acute GI bleeding after failure of conventional techniques. Surg Endosc 2013; 27: 3162–3164.
21. Sung JJ, Luo D, Wu JC, et al. Early clinical experience of the safety and effectiveness of Hemospray in achieving hemostasis in patients with acute peptic ulcer bleeding. Endoscopy 2011; 43: 291–295.
22. Laine L, McQuaid KR. Endoscopic therapy for bleeding ulcers: an evidence-based approach based on meta-analyses of randomized controlled trials. Clin Gastroenterol Hepatol 2009; 7: 33–47.
23. Barkun AN, Martel M, Toubouti Y, et al. Endoscopic hemostasis in peptic ulcer bleeding for patients with high-risk lesions: a series of meta-analyses. Gastrointest Endosc 2009; 69: 786–799.
24. Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet 1974; 2: 394–397.
25. Szalai M, Rácz I. A nem varixeredetű felső gyomor-bélrendszeri vérzések endoszkópos kezelése. Magy Belorv Arch 2014; 67: 234–244.
26. Leontiadis G I, Sharma V K, Howden C W. Proton pump inhibitor therapy for peptic ulcer bleeding: Cochrane collaboration meta-analysis of randomized controlled trials. Mayo Clin Proc 2007; 82: 286–296.
27. Lau JY, Leung WK, Wu JCY, et al. Omeprazol before Endoscopy in Patients with Gastrointestinal Bleeding. N Engl J Med 2007; 356: 1631–40.
28. Sreedharan A, Martin J, Leontiadis GI, et al. Proton pump inhibitor treatment initiated prior to endoscopic diagnosis in upper gastrointestinal bleeding. Cochrane Database Syst Rev 2010; CD005415.
29. Sung JJ, Lau JY, et al. Effects of intravenous and oral esomeprazole in the prevention of recurrent bleeding from peptic ulcers after endoscopic therapy. Am J Gastroenterol 2014; 109: 1005–10.
30. Garcia-Tsao G, et al. Portal hypertensive bleeding in cirrhosis; AASLD guidance. Hepatology 2017; 65: 310–335.
31. Villanueva C, Colomo A, Bosch A, et al. Transfusion Strategies for Acute Upper Gastrointestinal Bleeding. N Engl J Med 2013; 368; 11–21.
32. Pollack CV, Reilly PA, van Ryn J, et al. Idarucizumab for Dabigatran Reversal – Full Cohort Analysis. N Engl J Med 2017; 377: 431–41.
33. Tripodi A Primignani M, Mannucci PM, Caldwell SH. Changing Concepts of Cirrhotic Coagulopathy. Am J Gastroenterol 2017; 112: 274–281.
34. Khoury T, Ayman AR, Cohen J, et al. The Complex Role of Anticoagulation in Cirrhosis: An Updated Review of Where We Are and Where We Are Going. Digestion 2016; 93: 149–159.
35. Zakeri I N, Tsochatzis EA. Bleeding Risk with Invasive Procedures in Patients with Cirrhosis and Coagulopathy Curr Gastroenterol Rep 2017; 19: 45.
36. Chan FK, Lau JY, Chung SC, et al. Clopidogrel versus aspirin and esomeprazole to prevent recurrent ulcer bleeding. N Eng J Med 2005; 352: 238–44.
37. de Franchis R, Baveno V. Faculty. Expanding consensus in portal hypertension. Report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63:743–752.
38. Garcia-Pagan JC, Caca K, Bureau C, Laleman W, Appenrodt B, Luca A, et al. Early TIPS (Transjugular Intrahepatic Portosystemic Shunt) Cooperative Study Group. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362: 2370–2379.
39. Garcia-Pagan JC, Di Pascoli M, Caca K, Laleman W, Bureau C, Appenrodt B, et al. Use of early-TIPS for high-risk variceal bleeding: results of a post-RCT surveillance study. J Hepatol 2013; 58: 45–50.
