Hepatitis C-vírus fertőzés szűrése, diagnosztikája, antivirális terápiája, kezelés utáni gondozása
Summary
Hepatitis C viral (HCV) infection became curable by Today. Eradication of the virus is beneficial and essential from both individual as well as from social aspects. Treatment depends on availability and reimbursement of approved drugs in Hungary, and is based on a national consensus guideline, updated six-monthly. If no contraindication, demonstration of viral replication qualifies as indication of therapy. IFN-free treatments are recommended and available for most of diagnosed patients. Pegylated IFN (PegIFN) plus ribavirin (RBV) therapy is restricted to exceptional situations only. Sequence of treatment initiation is determined by stage of fibrosis and by other – including epidemiological – factors, according to a priority scoring system.
A hepatitis C-vírus (HCV) fertőzés napjainkra gyógyíthatóvá vált. A fertőzöttség megszüntetése egyéni és társadalmi szempontból egyaránt előnyös és szükséges. A kezelés hazánkban a rendelkezésre álló gyógyszereken és finanszírozási lehetőségeken alapuló, félévenként megújított konszenzusajánlás szerint történik. Az aktualizált ajánlás szerint a kezelés indikációja (ellenjavallat hiányában) a vírusszaporodás kimutatásán alapul. A kezelés a korszerű interferon (IFN)-mentes kombinációk valamelyikével végzendő, amelyek 2018-ra a diagnosztizált betegek döntő többsége számára elérhetővé váltak. A korábban használt pegilált-interferon (PegIFN) plusz ribavirin (RBV) kombináció csak kivételesen alkalmazható. A kezelésbevonás sorrendjét a fibrosis stádiumán és egyéb – köztük epidemiológiai – szempontokon alapuló prioritási pontrendszer határozza meg.
1. Bevezetés
Magyarországon 50 000-re becsülhető a fertőzőképes HCV RNS-pozitív egyének száma. Legtöbben 1993 előtti transzfúzióval, vagy más egészségügyi beavatkozással fertőződtek meg (1), de napjainkban a kábítószerek használata és egyes szexuális magatartások tekinthetők fő átviteli útnak (2). Hazánkban a vírus 1-es genotípusa (GT) dominál (90-95%), de várható a 3-as genotípus előretörése (3).
A beteg számára a fertőzés időben történő felfedezése és meggyógyítása az életminőség javulását, a munkaképesség megőrzését, a májzsugor, a májrák, és egyéb szövődmények megelőzését, ezzel a betegségmentes és teljes várható élettartam meghosszabbodását jelenti. Egyúttal megszűnik a fertőzés átadásának veszélye, és egyszeri, definiált ideig tartó kezeléssel jelentősen csökkenthető a későbbi súlyos májbetegségekből adódó egészségügyi ráfordításigény (4). Ennek alapján az Egészségügyi Világszervezet (WHO) célul tűzte ki az új fertőzések számának 90%-os, a betegséghez társuló halálozás 60%-os csökkentését 2030-ig (5).
A kivizsgálást és a kezelést a készítmények alkalmazási előírásain (6–18) és nemzetközi ajánlásokon (19–20) alapuló, félévenként megújított szakmai konszenzusajánlás szerint Hepatológiai Centrumokban nevesített gasztroenterológus, gyermek gasztroenterológus, infektológus és trópusi betegségek szakorvosai végzik (21). A fertőzöttek regisztrálása, a kezelések kérvényezése és elbírálása, azok követése, a kezelésre használt gyógyszerek allokációja országosan egységesen, a Hepatitis Regiszter (HepReg) nevű országos adatbázison keresztül történik (www.hepreg.hu).
A HCV kezelésére hazánkban elérhető, vagy várhatóan elérhetővé váló készítményeket az 1. táblázat mutatja be. A 2003. (PegIFN+RBV), illetve 2011. (boceprevir, telaprevir, simeprevir) óta rendelkezésre álló kezelések eredményessége (SVR) – különösen a hazánkban domináló G1-genotípus esetén – alacsony. Ráadásul számos, esetenként súlyos mellékhatással járnak. Ezért 2013-tól fokozatosan felváltják őket az IFN-mentes (NS3/4A proteáz-gátló, NS5B polimeráz-gátló, és/vagy NS5A replikációs komplex-gátló) kombinációk. Ezen új ajánlás szerint a PegIFN+RBV kombináció Magyarországon csak kivételesen, megfelelő IFN-mentes kezelési lehetőség hiányában alkalmazható, a PegIFN+RBV+proteáz-gátló terápiákat pedig ma már nem alkalmazzuk. Nem szerepelnek ebben az ajánlásban a hazánkban nem forgalmazott és/vagy a NEAK által nem támogatott DAA-készítmények, és kombinációk sem (asunaprevir, boceprevir, daclatasvir, feldaprevir, simeprevir, telaprevir, monokomponensű sofosbuvir) (1. táblázat).

Ez az ajánlás a legutóbbi, 2018-ban megjelent változat (22) 2018. március 24-én szakmai konszenzussal elfogadott módosítása, a kezelésben résztvevő kollégák javaslatai és többségi véleménye, az új kezelési lehetőségekről elérhető legfrissebb információk, nemzetközi ajánlások, alkalmazási előírások, és a finanszírozási korlátok figyelembevételével. Az ajánlás közzétételével egy időben indokolt az érvényben lévő finanszírozási eljárásrend módosítása is (23).
A szakmai ajánlásban az alkalmazási előírásoktól és/vagy nemzetközi ajánlásoktól eltérő, vagy ezeket kiegészítő esetekben tüntetjük fel a hivatkozásokat. Az itt leírtak nem mentesítik a kezelőorvosokat az érvényes alkalmazási előírásokban foglaltak betartása alól!
2. Definíciók
Cirrhosis
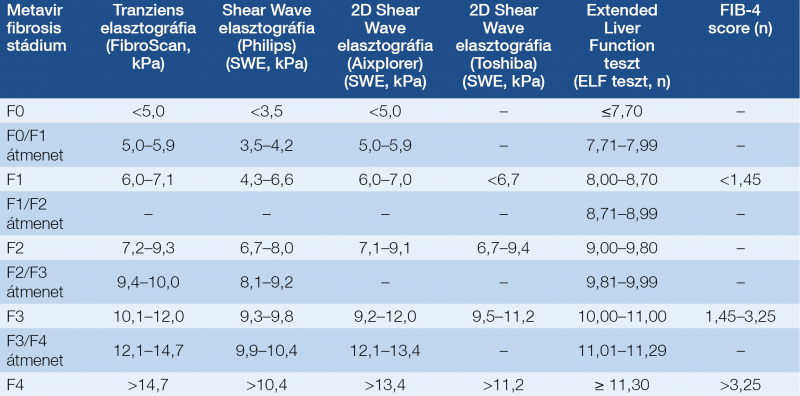
Az ajánlás szempontjából cirrhosisosnak tekintjük, és ennek megfelelően kezeljük valamint követjük mindazokat, akiknél a 1) szövettani vizsgálat Metavir vagy Knodell F3-F4, vagy Ishak F4-F5-F6 stádiumot, vagy 2) bármely nem inavzív vizsgáló módszer (4. táblázat) ezekkel ekvivalens stádiumot igazol, vagy 3) dekompenzált krónikus májbetegség állapítható meg (Child-Pugh B vagy C).
Dekompenzált májcirrhosis
A Child-Pugh osztályozás szerinti B vagy C stádiumú májcirrhosis. A kezelésre jogosultság szempontjából K-vitamin-antagonistát szedő beteg esetében az INR, Gilbert-kór vagy hemolízis esetén a bilirubin érték – a tényleges érték megadása és ezen körülmény jelzése mellett – 1-nek minősül.
Direkt ható antivirális szerek (DAA: direct acting antivirals)
A HCV szaporodásának egyes fázisaira ható vegyületek. Az ajánlásban szereplő DAA csoportok: proteáz-gátlók (PI, NS3/4A), replikációs komplex-gátlók (NS5A), polimeráz-gátlók (NS5B).
HCV-RNS detekciós küszöbérték
A HCV-RNS kimutathatóságának határértéke. A HCV kezelése során elvárás a 15 NE/ml-nél nem magasabb detekciós küszöbértékű real-time polimeráz láncreakció (rt-PCR) módszer alkalmazása.
Hepatitis Regiszter (HepReg, www.hepreg.hu)
A szakmai szervezetek által létrehozott, a NEAK gyógyszer-allokációját is támogató, a HCV (és az IFN kezelésben részesülő hepatitis B-vírussal) fertőzött betegek és kezelésük országosan egységes és átlátható nyilvántartására, engedélyezésére, és követésére létrehozott internet alapú adatbázis. Az adatbázist a Hepatitis Terápiás Bizottság működteti. A HepReg-ben tárolt adatok tulajdonosa a Magyar Gasztroenterológiai Társaság Hepatológiai Szekciója.
Hepatitis Terápiás Bizottság (Bizottság)
A krónikus vírushepatitises betegek ellátásában érintett szakmai szervezetek által létrehozott, a szervezetek által delegált tagokból álló testület. Működését és összetételét külön dokumentum szabályozza.
Krónikus C-vírus hepatitis (CHC: chronic hepatitis C)
A hepatitis C-vírus fertőzés talaján kialakult idült májgyulladás. A diagnózis felállításnak feltételei:
- feltételezetten vagy igazoltan 6 hónapnál régebben fennálló HCV-fertőzés,
- kimutatható HCV-RNS,
- májkárosodás igazolása emelkedett GPT (ALT) és/vagy májbiopszia és/vagy nem invazív vizsgáló módszer és vagy hepaticus dekompenzáció alapján.
PegIFN+RBV±PI kezeléssel sikertelenül kezelt (PI-failure) beteg
Mindazok, akik PegIFN+RBV±PI kezelés hatására nem váltak véglegesen vírusmentessé, vagy súlyos mellékhatás miatt a kezelés felfüggesztése vált szükségessé.
Prioritási Index (PIX)
A májfibrosis mértékén alapuló, a májkárosodás súlyosságát és szövődményeit, a betegség aktivitását, progresszióját, az átvitel veszélyét, és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-fertőzött betegek kezelésbe vonásának szakmailag elfogadott sorrendjét meghatározó numerikus érték.
Relabáló beteg
A kezelés befejezésekor a HCV-RNS nem detektálható, de a kezelés befejezése után ismét kimutathatóvá válik.
Tartós vírusválasz (SVR: sustained virologic response)
A kezelés befejezését követően legalább 12 héttel a HCV-RNS nem mutatható ki (SVR12). Finanszírozási okokból jelenleg az SVR a terápia befejezését követően 24 héttel vizsgálandó/finanszírozott (SVR24).
Terápia-naív beteg
Mindazok, akik soha nem részesültek HCV elleni kezelésben.
Vírusáttörés (BT: breakthrough)
A kezelés során
- a HCV-RNS kimutathatatlanná válik, de később, még a kezelés során ismét kimutatható lesz, vagy
- mennyisége a korábbihoz képest legalább 1 log10 mértékben nő.
Vírusrezisztencia (VR), rezisztencia-asszociált
vírusvariáns (RAV), rezisztencia-asszociált szubsztitúció (RAS)
A DAA-ra nem érzékeny HCV-törzsek >10%-os gyakoriságú kimutathatósága a kezelés megkezdése előtt (kiinduló rezisztencia), vagy kimutathatóvá válása a DAA-kezelés alatt/után (terápia-asszociált rezisztencia).
3. Az ajánlás kiemelt pontjai
A1. Ez az ajánlás a HCV-pozitív betegek kezelésére fordítható, maximált terápiás keret optimális felhasználását, a legsúlyosabb állapotú betegek mielőbbi kezelését, és a lehető legnagyobb számú beteg tartós vírusmentességének elérését célozza.
A2. Májbetegeknél és/vagy HCV-fertőzöttség szempontjából magas kockázatú személyeknél (2. táblázat) a HCV-fertőzöttség vizsgálata szükséges. Amennyiben a szűrt személy anti-HCV vizsgálata pozitív vagy kétes eredményű, és a fertőzés igazolódása esetén a beteg antivirális kezelése lehetséges, és/vagy az aktív fertőzés igazolása epidemiológiai szempontból szükséges, HCV-RNS-vizsgálat végzése indokolt.
A3. Minden HCV-RNS-pozitív beteg kezelési lehetőségeit mérlegelni szükséges, beleértve a korábbi kezelésekre esetleg alkalmatlan, illetve azokra nem reagáló betegeket is. Amennyiben nem ellenjavallt, és azt a beteg vállalja, HCV-RNS-vizsgálattal igazolt fertőzöttség esetén antivirális kezelés indokolt.
A4. A HCV-kezelés megkezdése előtt vagy alatt, valamint kezelés hiányában is a hepatitis A és a hepatitis B
fogékonyság tisztázása, a fogékonyak vakcinálása indokolt.
A5. A HCV-fertőzöttség megszüntetése egyéni és társadalmi szempontból egyaránt szükséges, a rendelkezésre álló IFN-mentes kombinációk valamelyikével történik. Az alacsonyabb hatékonyságú, és alkalmanként súlyos mellékhatásokkal járó PegIFN+RBV kombináció csak kivételesen alkalmazható, míg a PegIFN+RBV+PI kombinációk használata szakmai és gazdasági szempontból is indokolatlan.
A6. A gyógyszer-ártámogatási keret terhére végzett kezelések engedélyhez kötöttek. A kezelések szakmai véleményezését és felügyeletét a szakmai szervezetek által delegált Hepatitis Terápiás Bizottság (továbbiakban: Bizottság, összetételét, működését külön dokumentum szabályozza) végzi, míg a kezelésre a NEAK adja meg az engedélyt.
A7. A kezelések kérvényezése, nyilvántartása, és engedélyezése az erre a célra létrehozott HepReg internetalapú rendszerben történik (www.hepreg.hu). A kezelés regisztrálása a HepReg-ben csakúgy, mint az ajánlásban szereplő egyéb szempontok betartása a nem gyógyszer-ártámogatási keret terhére végzett kezelések esetében is indokolt.
A8. A kezelés megkezdése előtt a fibrosis megítélése szükséges, validált nem invazív vizsgáló módszerrel (4. táblázat), vagy májbiopsziával, de az aktivitás és/vagy fibrosis jelenléte a kezelés indikációjának nem feltétele. Emellett indokolt az aktivitás, valamint az esetleges extrahepaticus manifesztációk és társbetegségek vizsgálata is.
A9. Minden olyan beteg esetében, akinél ez nem ismert, a kezelés megkezdése előtt a vírus genotípusának és altípusának meghatározása szükséges.
A10. Az engedélyezhető kombinációkra vonatkozó algoritmusokat az SVR eléréséhez szükséges gyógyszerköltségek – beleértve a sikertelen kezelés esetén várható további antivirális kezelés(ek) költségeit is – figyelembevételével a Bizottság a NEAK-kal együttműködve határozza meg, és a www.hepreg.hu honlapon hozza nyilvánosságra. Ezek változásáról a Bizottság a kezelőorvosokat és az illetékes hatóságokat elektronikus levél útján értesíti.
A11. A NEAK által a HCV kezelésére elkülönített gyógyszer-ártámogatási keretből a készítmények egy adott beteg számára csak a mindenkor érvényes finanszírozási eljárásrend szerint engedélyezhetők és rendelhetők. Az engedélyezett kezeléstől eltérni csak szakmailag megalapozott olyan esetben lehet, amikor a rendelni kívánt készítmények ártöbblete, vagy a kezelés teljes költsége a NEAK kereten kívüli forrásból biztosítható. A szakma javaslata, hogy ilyen esetben a NEAK az eljárásrend szerint engedélyezhető készítmények költségének megfelelő összegű ártámogatást biztosítson a beteg számára.
A12. Több rendelkezésre álló kezelési alternatíva esetén a költséghatékonysági és biztonságossági szempontok figyelembevételével előnyben részesítendők az IFN-mentes, a RBV-mentes és/vagy a rövidebb időtartamú kombinációk.
A13. Kevert genotípusú HCV-fertőzés esetén valamennyi genotípusban hatékony kombináció alkalmazandó, a kezelés a hosszabb idejű/több komponensből álló terápiát igénylő genotípusnak megfelelően történik.
A14. Szakmai konszenzus alapján az IFN-mentes terápiára jogosultak kezelésbe vonásának sorrendjét az ún. Prioritási Index (PIX) határozza meg. Amíg ez finanszírozási szempontok miatt szükséges, az IFN-mentes kezelésre váró betegek nyilvántartása a beteg és a kezelőorvosa által azonosítható módon a PIX-en alapuló kezelési várólistán történik, a várólistákra vonatkozó rendeletnek megfelelően. Elérhető a www.hepreg.hu honlapon.
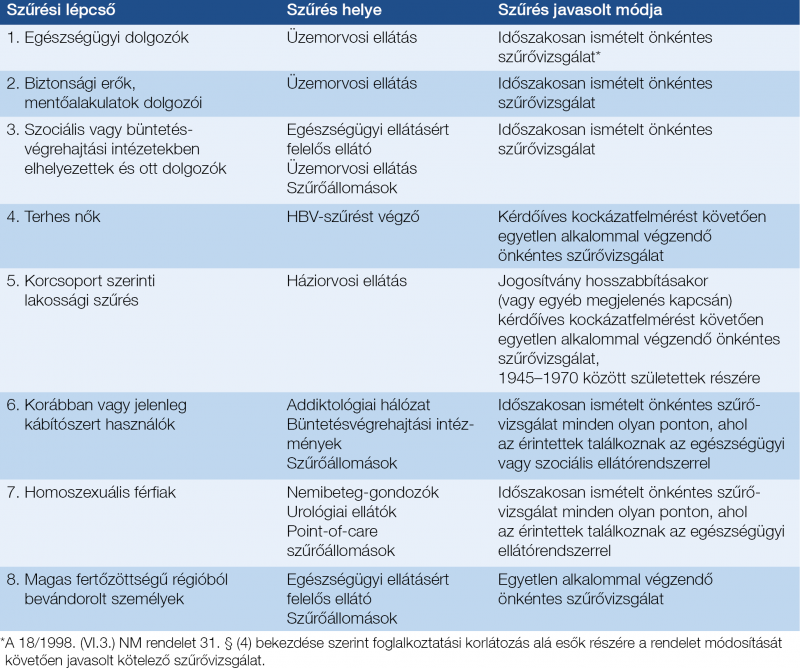
A15. A kezelés során HCV-RNS negatívvá vált, vagy feltételezhetően negatívvá vált betegek esetében a tartós vírusmentesség (SVR) megállapítására a kezelést követően legalább 12 héttel HCV-RNS-vizsgálat szükséges. Amennyiben ekkor a HCV-RNS nem detektálható, a beteg a HCV-fertőzésből gyógyultnak tekinthető (SVR), amiről írásos szakvélemény kiállítása szükséges. Amennyiben a kezelés befejezését követően legalább 12 héttel a HCV-RNS mennyisége a detekciós limit érték alatti (általában <15 IU/ml), de nem negatív, 12 hét múlva ismételt HCV-RNS-vizsgálat végzendő az SVR megítélésére. A16. A HCV-fertőzésből igazoltan gyógyultaknál újabb HCV-RNS-vizsgálat csak recidívára utaló laboratóriumi vagy klinikai jel, illetve speciális epidemiológiai indok esetén szükséges. A17. Az egyes készítmények alkalmazását a kezelőorvos az alkalmazási előírásokban leírtak szerint köteles végezni. Jelen ajánlás a gyakorlati megvalósítást segítő kiemeléseket, és – az indikációs kör és néhány speciális szempont vonatkozásában – kiegészítéseket tartalmaz. 4. Szűrés, diagnosztika, a kezelés indikációja 4.1. Szűrés, rizikócsoportok Májbetegség esetén és/vagy HCV szempontjából magas kockázatúnak tekinthető személyeknél HCV-fertőzés irányában szűrés szükséges. A szűrés célcsoportjait az 2. táblázat, míg a javasolt szűrési program lépcsőit a 3. táblázat mutatja be (24). Májbetegeknél a fertőzöttség első vizsgálata az anti-HCV-ellenanyag kimutatásával végzendő. Amennyiben májbetegség nem ismert, a HCV-fertőzöttség kockázatának felmérésére validált kérdőív használata javasolt. Szűrőprogramok keretében az anti-HCV szerológiai vizsgálata mellett más, >95% szenzitivitású és specificitású diagnosztikai módszer is alkalmazható, illetve a validált kérdőíven alapuló kockázatbecsléssel kombinálható. Pozitív vagy kétes anti-HCV-eredmény esetén HCV-RNS-vizsgálat végzése indokolt.

4.2. Diagnózis, indikáció
Minden HCV-RNS-pozitív beteg kezelési lehetőségeit mérlegelni szükséges, beleértve a korábbi kezelésekre esetleg alkalmatlan, illetve azokra nem reagáló betegeket is. Amennyiben nem ellenjavallt, és azt a beteg vállalja, HCV-RNS-vizsgálattal igazolt fertőzöttség esetén antivirális kezelés indokolt.
Magyarországon az alkalmazási előírásokban szereplőkön kívül a kezelés ellenjavallatának tekintendő a feltételezhető vagy bizonyított adherencia-képtelenség a kezelőorvos vagy az adott szakterület szakorvosa szerint (pl. aktív kábítószer-használat/függőség, nem kontrollálható mentális zavar), valamint, ha a várható élettartam nem májeredetű okból <1 év a HCV esetleges eradikálása esetén is (pl. rosszindulatú betegség, más kontrollálhatatlan végstádiumú betegség terápiás lehetőség nélkül).
4.2.1. Májbetegség igazolása
• Igazolt HCV-fertőzés esetén a kezelés megkezdése előtt a fibrosis megítélése szükséges, validált nem invazív vizsgáló módszerrel (4. táblázat), vagy májbiopsziával (25–29). Emellett indokolt az aktivitás, az esetleges extrahepaticus manifesztációk és társbetegségek vizsgálata is. Ugyanakkor az aktivitás és/vagy fibrosis és/vagy extrahepaticus manifesztációk jelenléte a kezelés indikációjának nem feltétele.
– Az aktivitás megítélése a GPT/ALT meghatározásán vagy a máj szövettani vizsgálatán alapul.
– A kezelőorvos megítélése szerint májbiopszia lehet indokolt a máj nekroinflammációjának és/vagy a fibrosis stádiumának meghatározására, differenciáldiagnosztikai vagy prognosztikus céllal, vagy a kezelésre vonatkozó döntéshez.
• A májbetegség és a kezelési lehetőségek pontosabb megítéléséhez teljes vérkép, GOT/AST, GGT, ALP, szérum albumin, bilirubin, protrombin, vesefunkciók (kreatinin, eGFR) és hasi ultrahang (UH) vizsgálat (és amennyiben ez alapján vagy emelkedett AFP-érték alapján gócos májbetegség/HCC gyanúja merül fel, CT- vagy MR-vizsgálat) is szükséges (30).
• Differenciáldiagnosztikai és egyéb laboratóriumi vizsgálatok:
– HIV-, HAV-, HBV-vizsgálat (pozitív HBsAg esetén anti-HDV is).
– Kísérőbetegségek vizsgálata klinikai tünetek és laboratóriumi eredmények alapján: hipertónia, diabetes mellitus (vércukor), pajzsmirigyműködés-zavar (TSH), autoimmun betegségek (ANA, dsDNA, AMA), kardiorespiratorikus státusz (EKG), immunszuppresszió, cryoglobulinaemia, vasháztartás, hyperuricaemia, alkoholizmus, obesitas, steatosis megítélése.
4.2.2. Molekuláris diagnosztika
4.2.2.1. HCV-RNS-vizsgálat
• Diagnosztikus HCV-RNS-vizsgálat indokolt:
– akiknél az anti-HCV-teszt pozitív, és antivirális kezelést tervezünk, vagy az infektivitás ismerete epidemiológiai okból fontos,
– akiknél bizonytalan, vagy a klinikumnak ellentmondó az anti-HCV-vizsgálat eredménye,
– negatív anti-HCV eredmény esetén is
- immunszuppresszált egyéneknél HCV-fertőzés gyanúja esetén,
- akut HCV-fertőzés gyanújakor (abban az esetben is, amennyiben az anti-HCV-eredmény negatív); alapos gyanú esetén negatív HCV-RNS-vizsgálat megismétlése szükséges 3 hónap elteltével.
• Terápiához kapcsolódó HCV-RNS-vizsgálat:
– A HCV kezelésének megkezdése előtt (legfeljebb 6 hónapon belül) szenzitív kvantitatív HCV-RNS-vizsgálat szükséges:
- Olyan cirrhosisban nem szenvedő terápia-naív betegek esetében, akiknél a korábbi HCV-RNS-vizsgálat eredménye nem ismert vagy <6 millió NE/ml volt, a SOF+LDV-kezelés megkezdése előtt 2 héten belül HCV-RNS-vizsgálat szükséges (kivéve a szerv-transzplantáltakat).
- Kezelési engedély 6 hónapnál régebbi HCV-RNS-eredmény alapján is kérhető, amennyiben a HCV-fertőzöttség a kérvény benyújtása alapjául szolgáló HCV-RNS-vizsgálatot megelőzően legalább 3 hónappal igazolást nyert, vagy ismert expozíciós idő alapján ez feltételezhető.
– Amennyiben a kezelés során vírusáttörés gyanúja merül fel, soron kívüli HCV-RNS-vizsgálat szükséges. Igazolt vírusáttörés (gyógyszer-rezisztencia kialakulása) esetén a zajló kezelés (valamennyi készítmény) leállítandó, DAA-készítményt (is) tartalmazó kezelés esetén RAV/RAS-azonosítás javasolt (amennyiben arra lehetőség van).
– A HCV miatt foglalkozásától jogszabályban eltiltott személynél az IFN-mentes kezelés alatti 4. héten (amennyiben ez pozitív, a kezelés befejezésekor is) HCV-RNS-vizsgálat szükséges. Amennyiben a HCV RNS a kezelés alatt vagy után bármely időpontban a kvantifikációs limit alatti, szakmai szempontból az érintett személy fertőzőképessége megszűntnek tekinthető, vele szemben a foglalkozási korlátozás feloldható.
– A kezelés során HCV-RNS negatívvá vált, vagy feltételezhetően negatívvá vált betegek esetében a tartós vírusmentesség (SVR) megállapítására a kiemelt ajánlások A15. pontja szerint a kezelést követően legalább 12 héttel HCV-RNS-vizsgálat szükséges.
– A terápiához kapcsolódó HCV-RNS-vizsgálatokat valós idejű PCR-technikával, CE-IVD minősítésű, kellő érzékenységű tesztekkel az alábbi módszertani és minőségi feltételeknek megfelelően szükséges végezni:
- alacsony detekciós limit (≤15 NE/ml ±5%) valamennyi genotípus esetén,
- lineáris kvantifikációs tartomány legalább 15 NE/ml – 108 NE/ml között.
- Olyan anti-HCV-pozitív beteg esetében, akinél antivirális kezelés biztosan nem szükséges vagy nem végezhető (pl. a kezelés kontraindikált, vagy azt a beteg dokumentáltan nem vállalja), a HCV-RNS és a genotípus meghatározása csak kivételesen, pl. epidemiológiai okból lehet indokolt.
4.2.2.2. HCV-genotípus vizsgálat
• Amennyiben nem ismert, a kezelés megkezdése előtt a genotípus és altípus meghatározása szükséges (beleértve a PegIFN+RBV kettős kezeléseket is).
• Amennyiben kezelésre nincs lehetőség, úgy a genotípus meghatározásától el lehet tekinteni.
4.2.2.3. RAV/RAS-vizsgálat
• Bár a terápia előtti RAV/RAS-ok ismerete hasznos lehet, vizsgálata nem kötelező. Amennyiben RAV/RAS-meghatározás történik, ennek javasolt módszere az új generációs „mély” szekvenálás (deep sequencing analysis) az NS5A (és indokolt esetben az NS3/4A) HCV RNS-régióban, 10%-os cut-off határértékkel. Amennyiben a RAV/RAS-vizsgálat eredménye rendelkezésre áll, a Bizottság a kezelés módját ennek alapján módosíthatja, vagy – a kezelésre jogosultság megszűnése esetén – az engedélyt visszavonhatja.
• A terápia során kialakuló RAV/RAS-ok felelősek az IFN-mentes kezelések során kialakuló vírusáttörésért vagy relapszusért. Újabb IFN-mentes kezelés előtt meghatározásuk szakmailag indokolt, de financiális megfontolások miatt nem kötelező.
4.2.2.4. IL28B polimorfizmus vizsgálata
• Az IL28B polimorfizmus vizsgálata a klinikai gyakorlatban felesleges, mert a kezelés indikációját és menetét nem befolyásolja.
4.2.3. A diagnosztika szempontjai speciális esetekben/betegcsoportokban
• Icterus, vagy ismert dátumú expozíció: 2 hét után érzékeny HCV-RNS-vizsgálat végzendő; ha pozitív, 8-12 hét múlva kontrollja szükséges. Utóbbi pozitivitása esetén a HCV-fertőzés krónikussá válásának valószínűsége nagy, korai kezelése javasolt.
• Vesebetegek: dializált vesebetegek esetében a HCV-fertőzés felismerésére félévenként HCV-RNS-vizsgálat szükséges, ez poolozott módszerrel is végezhető.
• Gyermekek: HCV-fertőzés gyanúja esetén a diagnózis megállapítása a felnőttekével azonos módon történik.
• Anti-HCV-pozitív anya gyermeke: 18 hónapos korban anti-HCV-vizsgálat végzendő (erre az életkorra az anyai ellenanyag kiürül a gyermek szervezetéből). Pozitív eredmény esetén a beteget gyermek hepatológushoz szükséges irányítani és HCV-RNS-vizsgálatot kell végezni. Ennek pozitivitása a gyermek fertőzöttségét igazolja. Amennyiben a korai diagnózisnak jelentősége van, a gyermek 1-2 hónapos korában szűrésként HCV-RNS végezhető.
• Májtranszplantáltak: HCV-pozitív recipiens májtranszplantációja után HCV-RNS-vizsgálat és májbiopszia végzendő. Pozitív HCV-RNS és igazolt rekurrens fertőzés esetében az antivirális kezelés mielőbbi megkezdése indokolt.
• HIV-fertőzöttek: anti-HCV-vizsgálat szükséges. Azoknál a HIV-fertőzötteknél, akik anti-HCV-pozitívak, vagy akik negatívak, de nem magyarázható májbetegségük van, HCV-RNS-vizsgálat végezendő, és pozitivitása esetén a HCV kezelése mérlegelendő.
• HBV-fertőzöttek: anti-HCV-vizsgálat szükséges. Azoknál a HBV-fertőzötteknél, akik anti-HCV-pozitívak, HCV-RNS-vizsgálat végezendő, és pozitivitása esetén a HCV kezelése mérlegelendő.
5. Kezelési allokáció, kezelési jogosultság
5.1. Hepatitis Regiszter funkciói
• a potenciálisan kezelésre szoruló HCV-fertőzöttek országos nyilvántartása,
• a kezelés iránti kérelmek fogadása,
– a kezelésről megalapozott döntés csak korrekten kitöltött kérvény alapján lehetséges (!)
– az elbírált kérvény nem módosítható, de új kérvény benyújtására sor kerülhet (!)
• PIX kiszámítása a kezelés engedélyezéséhez (ld. később),
• engedélyezett kezelések nyilvántartása,
• a kezelések lefolytatásával kapcsolatos adminisztráció,
– kérvények/engedélyek visszavonása/visszaadása,
– PCR-vizsgálatok rendelése, nyilvántartása,
– gyógyszerek rendelése,
– kezelések megkezdése,
– kezelések befejezése, leállítása,
• kezelési várólista nyilvántartása,
• kezelési ajánlás közzététele,
• finanszírozási algoritmus közzététele.
5.2. Hepatitis Terápiás Bizottság főbb feladatai:
• Véleményt ad arról, hogy a kezelés indokolt, és nincs ellenjavallata.
• Ellenjavallat esetén a kezelési kérelmet elutasítja.
• A kezelőorvos által kért terápia lehetőség szerinti preferálásával javaslatot tesz a NEAK részére a kezelés engedélyezésére és módjára.
• Tájékoztatást ad a szakmai és/vagy finanszírozási környezet változásairól, és – amennyiben az indokolt – intézkedik a változások érvényesítésének módjáról (egyebek mellett a benyújtott vagy elbírált kérvények vagy a terápia módosításának lehetőségéről).
• Együttműködik az illetékes hatóságokkal és szervezetekkel a finanszírozási korlátok optimális érvényesítésében, beleértve, hogy a mindenkori finanszírozási lehetőségek figyelembevételével javaslatot dolgoz ki az egyes betegcsoportokban a HCV kezelésére allokált keretből engedélyezhető kezelési alternatívák meghatározásához.
• Amennyiben az a betegek számára nem jelent hátrányt, a konszenzus konferenciák közötti időszakokban az újabb információk és a készítmények elérhetőségének figyelembevételével a NEAK-kal egyeztetve jogosult a kezelési stratégiák/elvek/algoritmusok módosítására.
• Javaslatot tesz a Hepatológiai Centrumok/kezelőorvosok működésének engedélyezésére.
• A Bizottságnak ugyanakkor nem tartozik hatáskörébe a kezelések ellenőrzése.
5.3. Kezelési kérelem
• A NEAK által engedélyezett és közfinanszírozott kezelés feltétele a megfelelően kitöltött, a HepReg rendszeren keresztül benyújtott kérelem.
• A kérelemben a betegazonosításhoz, az indikáció és az esetleges kontraindikációk megítéléséhez, valamint a kezelés módjának meghatározásához szükséges adatmezők kitöltése kötelező; ezek kitöltése nélkül a kérvény a rendszerben elmenthető, de nem nyújtható be, nem bírálható el, és nem engedélyezhető.
• Néhány adat esetében az azt alátámasztó dokumentum csatolása is szükséges.
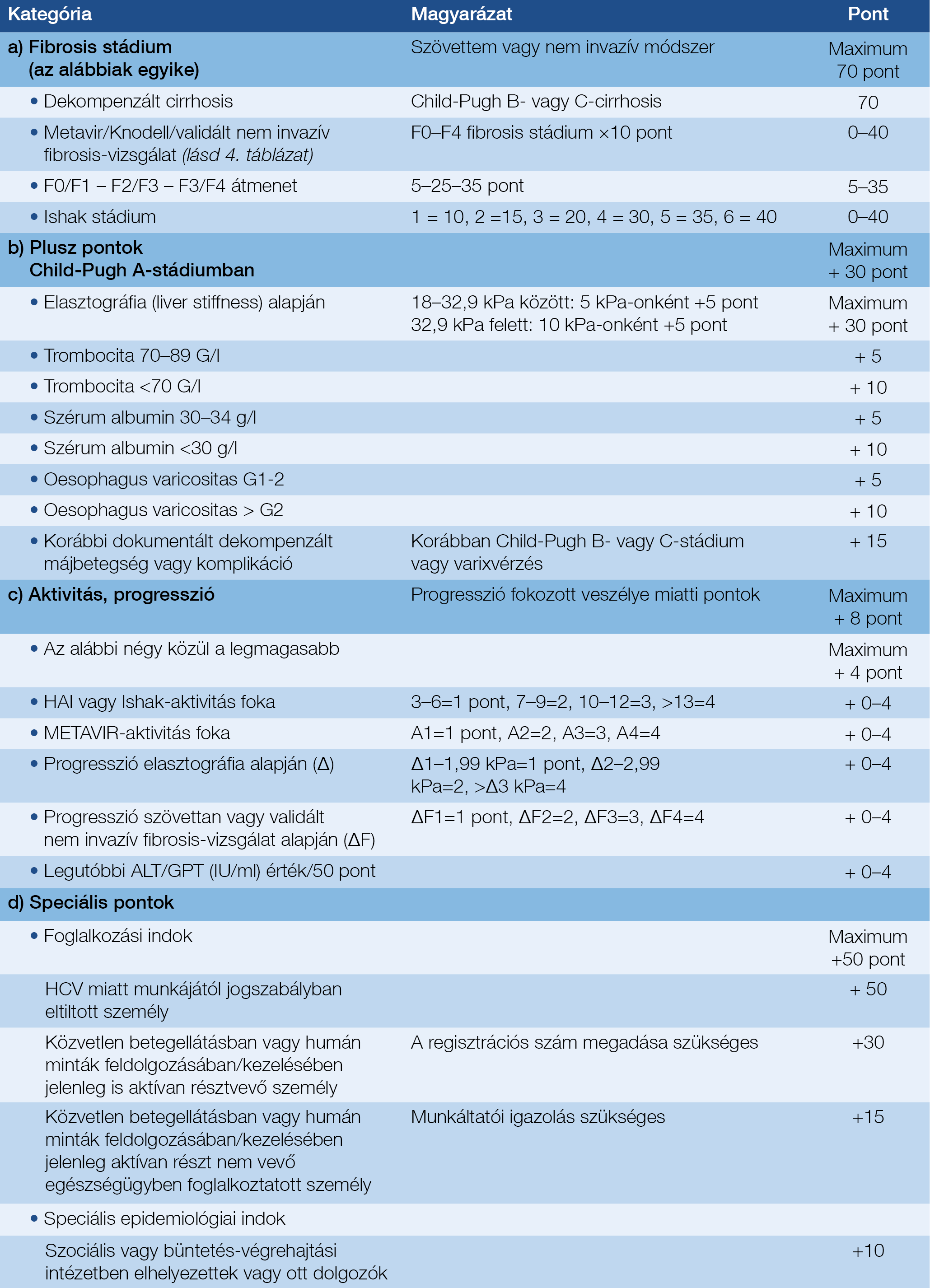
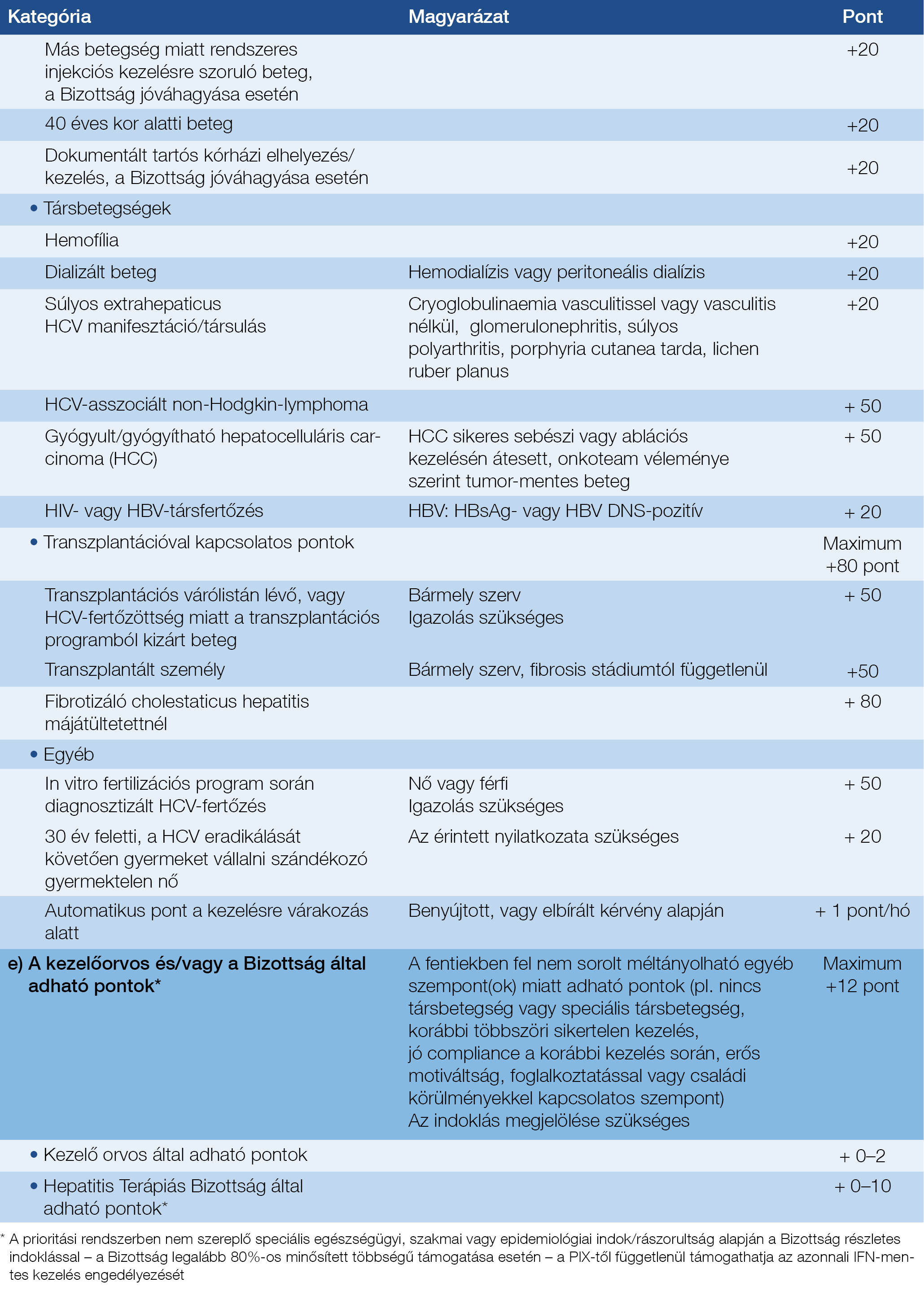
5.4. Prioritási Index, kezelésbevonás sürgőssége
• A PIX (lásd definíciók) értéke az 5. táblázat a) – e) pontjaihoz tartozó pontszámok összege.
• Elsősorban a Prioritási Index figyelembevételével, de speciális esetekben attól függetlenül is rendkívüli sürgősséggel kérhető kezelési engedély – egyéb okok között különösen májtranszplantált betegek, rendelet alapján foglalkozási korlátozás alá esők részére, valamint azok számára, akiknél a kezelés megkezdésének néhány hónapos késlekedése jelentős kárt/károsodást és/vagy életveszélyes helyzetet eredményezhet. A rendkívüli sürgősség kérése a HepReg rendszerben az erre szolgáló pontban jelölendő, és indoklása kötelezően rögzítendő. A rendkívüli sürgősségi kérelem elbírálására és – indokolt esetben – a kezelési engedély kiadására soron kívül kerül sor.
6. Kezelési lehetőségek
A hazai ajánlás szerint javasolt/elérhető kombinációkat és genotípus szerinti alkalmazhatóságukat az 1. táblázat tartalmazza. Az egyes kezelési lehetőségek ismertetésének sorrendje nem jelenti a kezelések választhatóságának sorrendjét.
6.1. IFN-alapú kezelések
6.1.1. PegIFN+RBV: 3-as genotípus, korábban nem kezelt, nem cirrhosisos beteg
• A már zajló PegIFN+RBV-kezelések a korábbi ajánlásban leírtak szerint fejezendők be (22).
• Új PegIFN+RBV-kezelés csak terápia-naív, nem cirrhosisos, HCV 3-as genotípussal fertőzött betegnél kezdhető, megfelelő IFN-mentes kezelési lehetőség hiányában. A kezelés a korábbi ajánlásban leírtak szerint végzendő (22).
6.2. IFN-mentes kezelések
• Amennyiben a kezeléshez a megfelelő készítmény rendelkezésre áll, valamennyi HCV-fertőzött beteg kezelése IFN-mentes kombinációval végzendő.
• RBV bármely IFN-mentes séma mellé rendelhető, amennyiben az alkalmazási előírás ezt írja elő, vagy több olyan tényező áll fenn, ami kedvezőtlen kezelési esélyt jelenthet (pl. cirrhosis, korábbi null-reagáló, immunszuppresszív kezelésben részesülő beteg, korábbi DAA-kezelés). Ilyen esetekben a kezelési idő meghosszabbítása is szükséges lehet (pl. 12 hétről 16 hétre vagy 24 hétre).
• Az IFN-mentes kombinációk használatakor az étel-DAA és gyógyszer-DAA interakciók fokozott figyelmet igényelnek, az alkalmazási előírásokban és/vagy internetes adatbázisokban tájékozódást tesznek szükségessé (www.hep-druginteractions.org).
• A foglalkozási korlátozás alá esők kivételével az IFN-mentes kezelések során a HCV-RNS-szint monitorozása a kezelés alatt nem szükséges (speciális esetekben indokolt lehet).
6.2.1. ABT2D/ABT3D±RBV: HCV G4 vagy G1
• Az ABT2D±RBV a G4-genotípussal, az ABT3D±RBV-kombináció a G1-genotípussal fertőzött kompenzált stádiumú cirrhosisos vagy nem cirrhosisos, terápia-naív vagy PegIFN±RBV±PI-kezeléssel sikertelenül kezelt betegek esetében alkalmazható, beleértve a HIV-társfertőzötteket, a végstádiumú vesebetegeket és a dializáltakat is (eGFR <30 ml/min).
• HCV G1b-genotípussal fertőzött terápia-naív vagy PegIFN+RBV-terápiával sikertelenül kezelt betegek.
– Nem cirrhosisos, terápia-naív beteg: 8 hetes ABT3D-kezelés.
– Szervátültetett: 24 hetes ABT3D+RBV-kezelés.
– Minden más eset: 12 hetes ABT3D-kezelés.
• HCV G1b-genotípussal fertőzött korábban PegIFN+ RBV+PI-kezelésben részesült kompenzált cirrhosisos vagy nem cirrhosisos betegek: 12 hetes ABT3D+RBV-kezelés (31–33).
• HCV G1a-genotípussal, vagy ismeretlen G1-altípussal, vagy G1a+G1b-altípussal fertőzött terápia-naív vagy PegIFN+RBV-terápiával sikertelenül kezelt betegek: ABT3D+RBV-kezelés.
– Korábbi PegIFN+RBV kezelésre null-reagáló cirrhosisos beteg: 24 hetes kezelés.
– Minden egyéb eset: 12 hetes ABT3D+RBV-kezelés.
• HCV G4 genotípussal fertőzött terápia-naív vagy PegIFN+RBV terápiával sikertelenül kezelt kompenzált cirrhosisos vagy nem cirrhosisos beteg: 12 hetes ABT2D+RBV kezelés.
6.2.3. GLE/PIB: Bármely HCV-genotípus
• A GLE/PIB kombináció (RBV nélkül) bármely genotípussal fertőzött kompenzált stádiumú cirrhosisos vagy nem cirrhosisos, terápia-naív vagy PegIFN+RBV±SOF-kezeléssel vagy SOF+RBV-kombinációval sikertelenül kezelt betegek esetében az alkalmazási előírásban feltüntetettek szerint alkalmazható, beleértve a HIV-társfertőzötteket, a végstádiumú vesebetegeket és a dializáltakat is (eGFR <30 ml/min). Ugyanakkor klinikai tapasztalatok hiányában nem ajánlott olyan betegek ismételt kezelésére, akiket korábban sikertelenül kezeltek NS5A-inhibitorral.
• Az elérhetőség és a költséghatékonyság függvényében G2- vagy G3-genotípussal fertőzött betegeknél elsők között választható IFN-mentes kezelés.
• A kezelés időtartama nem cirrhosisos betegeknél bármely genotípus esetén 8 hét, minden más esetben 12 hét.
6.2.4. GZR/EBR±RBV: HCV G1 vagy G4
• A GZR/EBR±RBV-kombináció G1- vagy G4-genotípussal fertőzött kompenzált stádiumú cirrhosisos vagy nem cirrhosisos, terápia-naív vagy PegIFN+RBV±PI-kezeléssel sikertelenül kezeltek esetében alkalmazható, beleértve a HIV-társfertőzötteket, a végstádiumú vesebetegeket és a dializáltakat is (eGFR < 30 ml/min). Általában 12 hetes GZR/EBR-kezelés (RBV nélkül), az alábbiak kivételével:
– amennyiben az finanszírozási előnyt jelent, HCV G1b-genotípussal fertőzött, terápia-naív, F0-F2 fibrosis stádiumú betegeknél 8 hetes GZR/EBR-kezelés, kivéve: szervátültetett, vagy HBV- vagy HIV-társfertőzés, vagy előrehaladott vesebeteg (eGFR <30 ml/min vagy dialízis) (34).
– Korábbi PI-failure beteg, G1b-fertőzés esetében: 12 hetes GZR/EBR+RBV-kezelés.
– G1a- vagy G4-fertőzés: 16 hetes GZR/EBR+RBV-kezelés (RAV/RAS-vizsgálat nélkül).
6.2.5. SOF/LDV±RBV: HCV G1, (G2, G3),
G4–G6
• Cirrhosisban nem szenvedő nem G3-genotípussal fertőzött beteg: 12 hetes SOF/LDV-kezelés, kivéve:
– 8 hetes kezelés G1-genotípussal fertőzött olyan terápia-naív betegek esetében, akiknél 6 millió NE/ml alatti a kiinduló vírusszám (kivéve a szervtranszplantáltakat).
• Kompenzált vagy dekompenzált cirrhosisban szenvedő nem G3-genotípussal fertőzött beteg: 12 hetes SOF/LDV+RBV-kezelés, kivéve:
– RBV ellenjavallata vagy intolerancia esetén: 24 hetes SOF/LDV-kezelés.
• Az elérhetőség és a költséghatékonyság függvényében G2-genotípussal fertőzött betegnél elsőként választható IFN-mentes kezelés.
• HCV G3-genotípus esetén hatékonysága mérsékelt, csak egyéb kezelési alternatíva hiányában javasolható.
– Nem cirrotikus, korábban kezelésben nem részesült betegek: 12 hetes SOF/LDV+RBV-kezelés.
– Minden egyéb eset 24 hetes SOF/LDV+RBV-kezelés.
• Korábbi NS5A komponensű IFN-mentes kezelés sikertelensége után akkor adható, ha hatékonyabb kombináció nem áll rendelkezésre.
– Korábbi sikertelen ABT2D/ABT3D-kezelés után: 12 hetes SOF/LDV+RBV-kezelés.
– Korábbi sikertelen 12-hetes SOF/LDV±RBV-kezelés után: 24 hetes SOF/LDV+RBV-kezelés.
• A SOF/LDV kombináció 12 éves kortól adható.
• Súlyos vesekárosodásban (becsült glomeruláris filtrációs ráta [eGFR] <30 ml/perc/1,73 m2) vagy dialízisre szoruló, végstádiumú vesebetegségben szenvedő betegek esetében a SOF/LDV biztonságosságát nem vizsgálták, de más kombináció ellenjavallata vagy elérhetetlensége esetén adása mérlegelhető.
6.2.6. SOF/VEL±RBV: HCV G1-G6
• A SOF/VEL±RBV-kombináció GT3-fertőzés és egyidejű ismert Y93H-mutáció kivételével bármely genotípussal fertőzött, nem cirrhosisos, kompenzált vagy dekompenzált cirrhosisos (Child–Pugh A-C), terápia-naív vagy PegIFN+RBV±PI-val sikertelenül kezelt beteg esetében alkalmazható, beleértve a HIV-társfertőzötteket.
• Az elérhetőség és a költséghatékonyság függvényében G2- vagy G3-genotípussal fertőzött betegnél elsőként választható IFN-mentes kezelés.
• Az alábbi esetek kivételével 12 hetes SOF/VEL-kezelés (RBV többszörös negatív prediktor esetén mérlegelhető):
– amennyiben hatékonyabb kombináció nem áll rendelkezésre, G3 és/vagy dekompenzált májcirrhosis és/vagy korábbi sikertelen NS5A-tartalmú kezelés esetén 12 hetes SOF/VEL+RBV-kezelés.
6.2.7. SOF/VEL/VOX: HCV G1–G6
• A SOF/VEL/VOX-kombináció bármely genotípussal fertőzött, nem cirrhosisos, vagy kompenzált cirrhosisos (Child–Pugh A) stádiumú betegeknél, az alkalmazási előírásban feltüntetettek szerint:
– DAA-naív betegek cirrhosis nélkül: 8 hetes SOF/VEL/VOX-kezelés.
– DAA-naív betegek kompenzált cirrhosissal: 12 hetes SOF/VEL/VOX-kezelés (8 hetes időtartam megfontolható G3-genotípussal fertőzött betegek esetében).
– DAA-ban már részesült betegek: 12 hetes SOF/VEL/VOX-kezelés. A klinikai vizsgálatok olyan betegekre is kiterjedtek, akik megelőzően daclatasvir, dasabuvir, elbasvir, grazoprevir, ledipasvir, ombitasvir, paritaprevir, sofosbuvir, velpatasvir, voxilaprevir (12 hétnél rövidebb ideig, sofosbuvirral és velpatasvirral kombinálva) kezelésben részesültek.
• Az elérhetőség és a költséghatékonyság függvényében G3-genotípussal fertőzött betegnél elsőként választható IFN-mentes kezelés.
• Alkalmazása nem ajánlott CPT B- vagy C-stádiumú dekompenzált májcirrhosisban.
• Biztonságosságát és hatásosságát nem vizsgálták súlyos vesekárosodásban szenvedő betegeknél (eGFR <30 ml/perc, vagy hemodialízis).
6.2.7. NS5A komponenst tartalmazó IFN-mentes kezeléssel vírusmentessé nem vált betegek ismételt kezelése
• A nem egy forgalmazótól származó készítményeket tartalmazó többszörös kombinációk (pl. GZR/EBR+SOF+ RBV vagy SOF/LDV+SIM+RBV vagy SOF+ABT3D±RBV) használatára Magyarországon technikailag nincsen mód (19).
• NS5A-komponensű kombinációval sikertelenül kezelt betegeknél a hazánkban elérhető (finanszírozott) készítmények hatékonyságára vonatkozóan korlátozottan állnak rendelkezésre adatok. Fentiek miatt valamennyi olyan beteg esetében, akinél a kezelés egyéves halasztása nem jelent közvetlen veszélyt, a kezelés elhalasztása javasolt az igazoltan hatékony készítmények (elsősorban SOF/VEL/VOX) elérhetővé válásáig.
• Az ABT2D/3D±RBV vagy SOF/LDV±RBV-kombinációval sikertelenül kezelt betegeknél az egyetlen igazoltan hatékony kombináció: 12 hetes SOF/VEL/VOX-kezelés.
• Amennyiben a SOF/VEL/VOX-kezelés nem áll rendelkezésre, és a beteg kezelése nem tűr halasztást, az alábbi kombinációk javasolhatók:
– 12 hetes (nem GT3-genotípus) vagy 24 hetes (GT3-genotípus) SOF/VEL+RBV-kezelés, az alábbi elméleti meggondolások alapján (35):
- Az NS5B SOF-hatóanyaggal szemben valódi rezisztencia nem ismert.
- A második generációs NS5A VEL-t tartalmazó SOF/VEL-kombináció olyan betegeknél is hatékonynak bizonyult, akiknél a kezelés megkezdése előtt az első generációs NS5A-készítmények csökkent hatékonyságát eredményező kiinduló RAS-ok voltak kimutathatók.
– Amennyiben a SOF/VEL+RBV-kezelés sem elérhető, SOF/LDV+RBV-kezelés mérlegelhető (36, 37):
- korábbi sikertelen ABT2D/ABT3D-kezelés után: 12 hetes SOF/LDV+RBV-kezelés.
- Korábbi sikertelen 12-hetes SOF/LDV±RBV-kezelés után: 24 hetes SOF/LDV+RBV-kezelés.
• Az ismételt kezelés előtt az NS5A-polimorfizmus vizsgálat nem kötelező, de amennyiben ilyen vizsgálat történt, az eredmény figyelembevétele javasolt.
6.3. Speciális betegcsoportok
6.3.1. HCV korai kezelése
• Megelőző icterus vagy ismert stádiumú expozíció után 8-12 hét múlva is perzisztáló HCV-RNS-pozitivitás esetén korai antivirális kezelés indokolt.
• A kezelés formája megegyezik a krónikus infekció kezelésével.
6.3.2. HCV-fertőzött várandósok és kismamák
• HCV-fertőzött várandósok és kismamák kezelése a terhesség és szoptatás utánra halasztandó.
• HCV-fertőzött anyáknál az elektív császármetszés nem véd a HCV-fertőzés átvitele ellen, ezért preventív császármetszés nem indokolt.
• Szoptatással történő transzmisszióra nincs evidencia, ezért a HCV-fertőzött kismama szoptathat. Ugyanakkor a szoptatás felfüggesztése megfontolandó, ha a mellbimbó bereped, illetve vérzik.
• HCV-fertőzött anya gyermekénél a szűrés 18 hónapos korban javasolt.
6.3.3. Gyermekek
• A gyermekkori HCV hepatitis diagnosztikájára és kezelésére vonatkozóan 2012-ben nemzetközi ajánlás jelent meg. Hároméves kor felett gyermekgyógyász és hepatológus együttes javaslata alapján 48 hetes PegIFN+RBV kettős kezelés javasolható. Dozírozás az alkalmazási előírás szerint.
• A DAA-készítmények közül a SOF/LDV-kombináció 12 éves kortól alkalmazható. Tizennyolc éves kor alatt más DAA-készítménnyel nincs tapasztalat.
6.3.4. Extrahepaticus manifesztációk
• Az extrahepaticus manifesztációk közül egyértelmű kezelési prioritást élvez a kevert cryoglobulinaemia vasculitissel vagy vasculitis nélkül, a glomerulonephritis, a súlyos polyarthritis, a porphyria cutanea tarda, a lichen ruber planus, és a non-Hodgkin-lymphoma (NHL). A cryoglobulinaemia típusa a HepReg kérvényen feltüntetendő.
• NHL esetén hematológus és hepatológus együttes véleménye alapján dönthető el, hogy melyik betegség kezelése történjen elsőként. A kezelés megfelel az előzőekben leírtaknak.
6.3.5. Pozitív addiktológiai anamnézisű és pszichiátriai betegek
• A kábítószer-használók körében világszerte növekszik a HCV-fertőzöttek száma. Felkutatásuk és eredményes kezelésük egyéni és társadalmi (epidemiológiai) szempontból egyaránt fontos.
• Kábítószert jelenleg vagy a közelmúltban használó személy esetén az addiktológus véleményét figyelembe véve mérlegelhető kezelés.
• A DAA-készítmények megválasztásakor a gyógyszer-interakciók figyelembevétele szükséges.
• IFN-alapú kezelés megkezdése előtt a manifeszt pszichiátriai zavar (különös tekintettel a depresszióra és a szorongásos kórképekre) kizárása szükséges, pszichiátriai javaslattal, szoros pszichiátriai ellenőrzés mellett kezdhető meg a kezelés.
6.3.6. HBV-társfertőzés
• A HCV kezelése alatt vagy után a HBV-infekció fellángolhat, emiatt több éves szoros monitorozás indokolt.
• A HBV-társfertőzött CHC-s betegeket a HCV-mono-
infekció szabályai szerint kell kezelni. A HBV kezelése az erre vonatkozó szakmai ajánlás szerint végzendő (38).
• DAA-kezelés előtt a HBsAg, anti-HBc és anti-HBs titer meghatározása szükséges. HBsAg-pozitív, vagy HBsAg-negatív de HBV DNS-pozitív beteg esetében a HBV miatt egyidejű nukleozid/nukleotid analóg kezelés javasolt, HCV kezelésének befejezése után még legalább 24 hétig.
6.3.7. HIV-társfertőzés
• IFN-alapú kezelés nem javasolt.
• Az IFN-mentes kezelés a HIV-társfertőzés nélküli CHC-nek megfelelően végezhető.
• DAA-készítmények alkalmazásakor a gyógyszerkölcsönhatásokra fokozott figyelmet kell fordítani.
• Aktív retrovirális kezelés, illetve <200/µl CD4 sejtszám esetén fokozott ellenőrzés indokolt a tejsav-acidózis, illetve a cytopenia lehetősége miatt.
6.3.8. Hemoglobinopathiák
• A kezelés indikációja megegyezik a hemoglobinopathiában nem szenvedő HCV-fertőzöttekével. A jelentős anemizálódási hajlam miatt az IFN- és RBV-mentes kezelések előnyben részesítendők.
6.3.9. Örökletes vérzékenységben szenvedő betegek
• Az örökletes súlyos vérzékenységben szenvedő betegek IFN-mentes terápiával kezelendők. A kivizsgálás és a kezelés a vérzékenységben nem szenvedőknek megfelelően történik.
6.3.10. Krónikus veseelégtelenség
• Krónikus vesebetegek esetében (CKD) a kezelési mód megválasztása a szérum kreatininszinttől és/vagy a kreatinin clearance-től és/vagy a becsült glomeruláris filtrá-ciós rátától (eGFR) függ.
– Enyhe és középsúlyos veseelégtelenségben (CKD1-CKD3) bármely készítmény adható.
• Végstádiumú vesebetegek esetében (CKD4, CKD5, beleértve a dializáltakat) az ABT2D/ABT3D±RBV, a GZR/EBR±RBV, vagy GLE/PIB-kombináció rendelhető. Amennyiben ezek a kombinációk nem elérhetők, hatástalanok, és/vagy ellenjavalltak, és a kezelés nem várhat, a SOF/LDV±RBV vagy a SOF/VEL±RBV, vagy a SOF/VEL/VOX-kombináció mérlegelhető.
• Az RBV dózisa – amennyiben szükséges – az alkalmazási előírás szerint csökkentendő; dializáltaknál napi 1×200 mg vagy heti 3×200 mg adható. Kifejezett óvatosságra van szükség.
6.3.11. Cirrhosisos betegek
• A kompenzált májcirrhosisos betegek a korábban felsorolt kombinációk bármelyikével kezelhetők, nem minősülnek speciális betegcsoportnak.
• Child-Pugh B- vagy C-stádiumú dekompenzált HCV cirrhosisos betegek kezelése prioritást élvez, az alábbi kombinációk valamelyikével végezhető.
– HCV G1-fertőzött beteg: 12 hetes SOF/LDV+RBV vagy SOF/VEL+RBV-kezelés. RBV ellenjavallat esetén 24 hetes SOF/LDV vagy SOF/VEL-kezelés jön szóba.
– Child-Pugh C-stádiumú HCV cirrhosisos beteg antivirális kezelése egyénileg mérlegelendő.
6.3.12. Szervtranszplantáció speciális szempontjai
• Kontraindikáció hiányában anti-HCV-pozitív donorból származó szolid szerv (beleértve máj) a recipiens felvilágosítása és írásos beleegyezése után anti-HCV-pozitív recipiensbe beültethető.
• Szervtranszplantáltak kezelése mindenképpen indokolt és prioritást élvez.
• Az esetleges gyógyszer-interakciók körültekintő értékelésével egyedi mérlegelés szükséges. SOF, LDV vagy DCV esetén sem a tacrolimus, sem a cyclosporin A adagjának módosítása nem szükséges. SIM és cyclosporin A együtt adása nem javasolható.
• Szervtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet.
6.3.13. Májtranszplantáció speciális szempontjai
6.3.13.1. Májtranszplantációs várólistán lévő betegek
• Májtranszplantációs várólistán lévő Child-Pugh A- vagy B-stádiumú, HCV-pozitív betegek antivirális kezelése indokolt, függetlenül a májátültetés indikációjától.
• Child-Pugh C-stádiumban a HCV elleni kezelés időzítését illetően egyéni mérlegelés szükséges.
• Minden olyan kezelési mód, ami kompenzált vagy dekompenzált májcirrhosis esetén szóba jön, figyelembe vehető és veendő.
6.3.13.2. HCV-pozitív donorból történő májtranszplantáció
• HCV-pozitív donorból történő májtranszplantáció esetén a donor máj szövettani vizsgálata szükséges. A donáció F0-F1 stádiumban végezhető el. A donor HCV-PCR (pozitivitás esetén genotípus) vizsgálatát elegendő elvégezni a transzplantációt követően.
6.3.13.3. Májtranszplantáció utáni HCV-rekurrencia
• Rekurrencia esetén a klinikailag stabil állapotban lévő recipienst a rejekció lehetőségének kizárását követően a transzplantáltakra vonatkozó szabályoknak megfelelően, mielőbbi DAA-val javasolt kezelni, az immunszuppresszív kezelésben jártas, a gyógyszerszint ellenőrzését végző központban.
• Májtranszplantáció esetén a donor máj szövettani vizsgálata szükséges és a donáció F0-F1 stádiumú donormáj esetén végezhető el.
• A donor HCV-PCR (pozitivitás esetén genotípus) vizsgálatát elegendő a transzplantációt követően elvégezni.
6.3.14. Hepatocelluláris carcinoma
• Májrák sikeres kezelése után onkológus, onko-team véleménye alapján tumormentessé vált, valamint HCC miatt májátültetésre váró betegek esetében a HCV kezelése indokolt, és prioritást élvez.
• Mind sikeres, mind sikertelen antivirális kezelés esetén recidíva irányában fokozott ellenőrzés szükséges, az első évben 3 havonta, majd azt követően 6 havonta hasi UH-vizsgálattal.
7. Antivirális kezelés utáni gondozás
• A hematológiai paraméterek és az esetleges egyéb iatrogén mellékhatások (pl. autoimmun thyreoiditis) követését azok rendeződéséig a szakellátást végző kezelőorvos végzi.
• A gondozás a hepatitis C-fertőzött betegek specifikus gondozási feladatait jelenti, az okozott krónikus májbetegség általános ellátása más szakmai ajánlások szerint végzendők.
• Hepatológiai kontroll a szakellátást végző kezelőorvos megítélése szerinti gyakorisággal és esetekben, vagy a háziorvos kérésére szakellátást, esetleg intézeti felvételt igénylő állapotromlás (pl. dekompenzált májcirrhosis) vagy HCC gyanú esetén szükséges.
• HCV-ből IFN-alapú kezeléssel gyógyult, vagy meg nem gyógyult, előrehaladott májfibrosisos/cirrhosisos betegek esetében (F3-F4-stádium) gócos májelváltozás (HCC) megjelenésének korai felismerésére félévente hasi ultrahangvizsgálat javasolt (30).
• HCV-ből IFN-mentes kezeléssel gyógyult vagy nem gyógyult, előrehaladott stádiumú (F3-F4) vagy korábban HCC-ből sikeresen gyógyított betegek esetében HCC irányában az első évben 3 havonta, majd azt követően 6 havonta hasi UH-vizsgálat szükséges.
• Dekompenzáció vagy szövődmény megjelenése esetén a májátültetés lehetőségének mérlegelése szükséges.
7.1. A kezelést sikeresen befejező, tartósan vírusmentessé váló betegek követése
• A kezelés befejezését követő időszakot követően a sikeres antivirális kezelés utáni további gondozás a szakellátás irányításával háziorvosi ellátásban is végezhető.
• A tartós vírusválaszt elérő betegekben a HCV-RNS későbbi követése nem szükséges, újabb HCV-RNS-vizsgálat relapszus gyanúja esetén (emelkedett GPT/ALT) lehet indokolt.
• Hepatológiai ellenőrzés a szakellátást végző kezelőorvos megítélése szerinti gyakorisággal és esetekben, vagy a háziorvos kérésére rekurrencia gyanúja, szakellátást/intézeti felvételt igénylő állapotromlás (pl. dekompenzált májcirrhosis) vagy HCC gyanú esetén szükséges.
7.2. Követés sikertelen kezelés után
• Sikertelen kezelés után és kezelésben nem részesülő beteg esetében a követés és az esetleges ismételt kezelés mérlegelése a szakellátást végző feladata.
• Hathavonta májenzimek, vérkép és a máj szintetikus funkcióját jelző laboratóriumi vizsgálatok javasoltak.
• A fibrosis követésére évenként validált nem invazív fibrosis vizsgáló eljárás javasolt (4. táblázat).
• Amennyiben képalkotó vagy más vizsgálat portális hipertenzió gyanúját veti fel, nyelőcsővarixok megítélésére gasztroszkópia javasolt. Nyelőcső-varicositás esetén az endoszkópos vizsgálatot évenként ismételni indokolt.
• Új, bizonyítottan hatékonyabb készítmény(ek), kombináció(k) elérhetővé válása esetén a korábbi kezeléssel tartós vírusmentességet el nem érő betegek számára ismételt kezelés mérlegelése, vagy – amennyiben ilyen elérhető – klinikai vizsgálatba történő bevonásuk indokolt.
• A vírusszám meghatározása csak esetleges ismételt kezelés előtt közvetlenül szükséges.
8. Szakmai prioritások, javaslatok a támogatási rendszer kialakításához
8.1. Betegérdekek és szakmai prioritások
Betegérdekek és szakmai szempontok alapján valamennyi HCV-fertőzött beteg felkutatása, majd a leghatékonyabb és legbiztonságosabb IFN-mentes kombinációk egyikével történő kezelése indokolt. A finanszírozási lehetőségeket is figyelembe véve az alábbi minimális szakmai célok fogalmazhatók meg:
• a lehető legnagyobb számú HCV-fertőzött beteg megtalálása,
• a legsúlyosabb állapotú betegek haladéktalan antivirális kezelése,
• a zárt keret észszerű felhasználásával a lehető legnagyobb számú beteg vírusmentessé tétele,
• minden korábban kezelt vagy nem kezelt, arra alkalmas beteg számára vírusmentessé válás esélyének biztosítása,
• az évenként újonnan megfertőzötteknél nagyobb számú beteg vírusmentessé tételével a fertőzöttek számának csökkentése,
• átlátható, egyenlő elbíráláson alapuló ellátási rend kialakítása,
• 2030-ig a HCV-fertőzés, mint jelentős egészségügyi probléma eliminálása Magyarországon (5).
A HCV kezelésére rendelkezésre bocsátott keret hatékony felhasználása érdekében az engedélyezett kezeléshez szükséges gyógyszerek 30 napon belül megrendelendők, és a kezelések 60 napon belül megkezdendők. Ezek teljesülésének hiányában az engedély visszavonásra kerül, és a beteg visszakerül a várólistára (ennek ismétlődése esetén a beteg lekerül a várólistáról).
6.2. Javaslatok a támogatási rendszer kialakításához
A. Az egyes betegcsoportokban (beleértve a terápia-naívnak minősülő betegeket) a kezelési alternatívákat a szakmai szempontok határozzák meg, de az SVR eléréséhez szükséges átlagos gyógyszerköltségek (költséghatékonyság: költség/SVR) is befolyásolhatják.
• A költség/SVR számításakor figyelembe kell venni az adott betegcsoportban a várható gyógyhajlamot, az idő előtt leállított kezelések várható arányát, illetve az addig felhasznált, és a várhatóan felhasználásra nem kerülő készítmények költségét, a válaszfüggő kezelés lehetőségét és arányát, valamint a sikertelen kezeléseket követő további kezelések várható költségvonzatát. Egyéb költségekkel nem szükséges számolni.
• Sikerességen alapuló finanszírozás esetén csak a tartós vírusmentességet elérő betegek kezelésére felhasznált gyógyszerek ára, és a sikertelen kezeléseket követő további kezelések várható költségvonzata számítandó be a költség/SVR kalkulációba.
B Azonos költséghatékonyságúnak tekintendők mindazon kezelési formák, amelyek esetében az SVR eléréshez szükséges átlagos terápiás költség különbsége az A-pont szerint számítva nem jelentős.
C Egyenlő költséghatékonyság mellett az IFN-mentes kezelések részesítendők előnyben, ez racionális költség/SVR különbözetet tesz indokolttá az IFN-alapú kezelésekhez képest.
D Egyenlő költséghatékonyság mellett a rövidebb időtartamú kezelés részesítendő előnyben, ez további költség/SVR különbözetet tesz indokolttá.
E Az egyes betegcsoportokban választható kombinációkat a Hepatitis Terápiás Bizottság a NEAK-kal együttműködve állapítja meg és a www.hepreg.hu honlapon teszi közzé. A szakmailag indokolható kezelések társfinanszírozással is végezhetők.
Következtetések
A HCV kezelésében az elmúlt években forradalmi változás következett be: a fertőzés a korábbi IFN-alapú kezeléseknél lényegesen hatékonyabb és biztonságosabb IFN-mentes kezelésekkel gyógyíthatóvá vált. A vírus eliminálása hosszú távon bármely stádiumú májbetegség esetén kedvező mind az egyén (szövődmények elkerülése, várható élettartam növekedése, munkavégző-képesség és életminőség javulása), mind a társadalom számára (további fertőzés átvitelének megelőzése, a szövődmények kezelésére fordítandó későbbi költségek elkerülése). Ezek az előnyök a legelőrehaladottabb stádiumú betegek esetében azonban nem minden esetben érvényesülnek. Ezért a fertőzöttség korai felismerése és kezelése indokolt.
Az új készítmények széles körű elérhetővé válásával a WHO által kitűzött cél, a HCV-fertőzés 2030-ig történő visszaszorítása (eliminálása) érdekében az egészségügyi kormányzat által szervezett szűrő- és terápiás programok (nemzeti stratégai) bevezetése, és megvalósítása szükséges – olyan társadalmi csoportokban is, amelyekben a fertőzöttségi kockázat magas, és a kezelés szociális, morális és/vagy technikai okból nem, vagy nehezen kivitelezhető (pl. intravénás kábítószer-használók, homoszexuális férfiak, szexiparban foglalkoztatottak). Az ellátásban érintett valamennyi szereplő (ellátandók, ellátók, finanszírozók, döntéshozók) közös szándéka és elhatározása esetén az akadályok nem tűnnek legyőzhetetlennek!
Rövidítések:
ALT=GPT: alanin-aminotranszferáz; ALP: alkalikus foszfatáz; AST=GOT: aszpartát-aminotranszferáz; EBR: elbasvir; GGT: gamma-glutamil-transzpeptidáz; GZR: grazoprevir; HCV: hepatitis C-vírus; anti-HCV: hepatitis C-vírus elleni antitest; G1-G7: hepatitis C-vírus genotípusok; HepReg: Hepatitis Regiszter adatbázis; HCC: hepatocelluláris carcinoma; IFN: interferon; CHC: chronic hepatitis C, krónikus C-vírus hepatitis; GLE: glecaprevir; LDV: ledipasvir; LS: liver stiffness, májtömöttség; ABT2D: ombitasvir/paritaprevir/ritonavir; ABT3D: ombitasvir/paritaprevir/ritonavir + dasabuvir; NEAK: Nemzeti Egészségügyi Alapkezelő; PegIFN: pegilált interferon; PIB: pibrentasvir; NS5B: polimeráz; PCR: polymerase chain reaction, polimeráz láncreakció; PIX: prioritási index; NS3/4A: proteáz; PI: protease-inhibitor, proteáz-gátló; NS5A: replikációs komplex; RBV: ribavirin; SOF: sofosbuvir; SVR: sustained virologic response, tartós vírusválasz; VEL: velpatasvir; VOX: voxilaprevir;
2. National Center for Epidemilogy. Prevalences of HIV and HCV infections in Hungary related to intravenous drug abuse in 2014. (Országos Epidemiológiai Központ: Az intravénás kábítószer-használattal összefüggő hazai HIV-, illetve HCV-prevalencia 2014-ben.) EPINFO 2015; 22(18): 189–194. (Hungarian)
3. Gervain J, Simon G Jr, Papp I, Szabóné BK. Analysing the type and subtype of hepatitis virus C of chronic viral hepatitis patients in Hungary. (A magyarországi krónikus C vírushepatitises betegek vírustípus- és szubtípus-meghatározása.) Orv Hetil 2001; 142(25): 1315–1319. (Hungarian)
4. van der Meer AJ, Veldt BJ, Feld JJ, Wedemeyer H, Dufour JF, Lammert F, Duarte-Rojo A, Heathcote EJ, Manns MP, Kuske L, Zeuzem S, Hofmann WP, de Knegt RJ, Hansen BE, Janssen HL. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA 2012; 308(24): 2584–2593.
5. World Health Organization. Global health sector strategy on viral hepatitis 2016–2021. June 2016. http://apps.who.int/iris/bitstream/10665/246177/1/WHO-HIV-2016.06-eng.pdf?ua=1
6. European Medicines Agency. Pegasys. Instructions for use. (Pegasys. Alkalmazási előírás.) 18/10/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/000395/WC500039195.pdf (Hungarian)
7. National Institute of Pharmacy and Nutrition. Copegus. Instructions for use. (Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet: Copegus alkalmazási előírás.) 12/02/2015 https://www.ogyei.gov.hu/kiseroirat/ah/ah_0000021420_20150212104652.doc (Hungarian)
8. National Institute of Pharmacy and Nutrition. Moderiba. Instructions for use. (Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet: Moderiba alkalmazási előírás.) 03/12/2015.
https://www.ogyei.gov.hu/kiseroirat/ah/ah_0000082001_20151203153744.doc (Hungarian)
9. European Medicines Agency. Rebetol. Instructions for use. (Rebetol alkalmazási előírás.) 29/03/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/000246/WC500048210.pdf (Hungarian)
10. European Medicines Agency. Ribavirin Teva Pharma B.V. Instructions for use. (Ribavirin Teva Pharma B. V. alkalmazási előírás.) 28/11/2016. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/001018/WC500056547.pdf (Hungarian)
11. European Medicines Agency. Epclusa. Instructions for use. (Epclusa alkalmazási előírás.) 21/06/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/004210/WC500211151.pdf (Hungarian)
12. European Medicines Agency. Exviera. Instructions for use. (Exviera. Alkalmazási előírás.) 17/10/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/003837/WC500182233.pdf (Hungarian)
13. European Medicines Agency. Harvoni. Instructions for use. (Harvoni. Alkalmazási előírás.) 05/09/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/003850/WC500177995.pdf (Hungarian)
14. European Medicines Agency. Maviret. Instructions for use. (Maviret. Alkalmazási előírás.) 17/08/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/004430/WC500233677.pdf (Hungarian)
15. European Medicines Agency. Sovaldi. Instructions for use. (Sovaldi. Alkalmazási előírás.) 18/10/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/002798/WC500160597.pdf (Hungarian)
16. European Medicines Agency. Viekirax. Instructions for use. (Viekirax. Alkalmazási előírás.) 16/10/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/003839/WC500183997.pdf (Hungarian)
17. European Medicines Agency. Vosevi. Instructions for use. (Vosevi. Alkalmazási előírás.) 22/09/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/004350/WC500235373.pdf (Hungarian)
18. European Medicines Agency. Zepatier. Instructions for use. (Zepatier. Alkalmazási előírás.) 17/05/2017. http://www.ema.europa.eu/docs/hu_HU/document_library/EPAR_-_Product_Information/human/004126/WC500211235.pdf (Hungarian)
19.) European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. http://www.easl.eu/medias/cpg/HCV2016/English-report.pdf
20. The American Association for the Study of Liver Diseases, Infectious Diseases Society of America. HCV guidance: recommendations for testing, managing, and treating hepatitis C. Accessed: 29/03/2018. http://hcvguidelines.org
21. Makara M, Horváth G, Szalay F, Tornai I, Hunyady B. Organizational characteristics of treatment for chronic hepatitis in Hungary: Hepatitis Registry and Priority Index. (A krónikus vírushepatitisek hazai ellátási rendszerének sajátosságai: Hepatitis Regiszter és a Prioritási Index.) Orv Hetil 2013; 154(29): 1151–1155. (Hungarian)
22. Hunyady B, Gerlei Z, Gervain J, Horváth G, Lengyel G, Pár A, Péter Z, Rókusz L, Schneider F, Szalay F, Tornai I, Werling K, Makara M. Screening, diagnosis, treatment, and follow up of hepatitis C virus related liver disease. National consensus guideline in Hungary from 22 September 2017. (A hepatitis C-vírus-fertőzés szűrése, diagnosztikája, antivirális terápiája, kezelés utáni gondozása. Magyar konszenzusajánlás. Érvényes: 2017. szeptember 22-től) Orv Hetil 2018; 159(Suppl 1): 3–23. (Hungarian)
23. Ministry of Human Resources. Financing procedure for the diagnosis and treatment of chronic hepatitis caused by hepatitis C virus. Supplement 7 to decree 9/2017. (V. 31.) of EMMI, „Supplement 17 of decree 31/2010 of EüM. (V. 13.)”. (Emberi Erőforrások Minisztériuma. A hepatitis C-vírus okozta krónikus májgyulladás diagnosztikájának és kezelésének finanszírozási eljárásrendje. 7. melléklet a 9/2017. (V. 31.) EMMI rendelethez, „17. melléklet a 31/2010. (V. 13.) EüM rendelethez”. Magyar Közlöny 2017. évi 78. szám 7997–8010. http://www.kozlonyok.hu/nkonline/MKPDF/hiteles/MK17078.pdf (Hungarian)
24. Hunyady B, Gervain J, Gógl Á, Horváth G, Makara M, Schaff Zs, Újhelyi E, Vályi-Nagy I, Werling K. National strategy to prepare eradication of hepatitis C virus infection in Hungary. (Nemzeti program a hepatitis C vírus fertőzés magyarországi felszámolásának előkészítésére.) MedicalOnline 2015. november 06. http://www.medicalonline.hu/cikk/nemzeti_program_a_hepatitis_c_virus_fertozes_magyarorszagi_felszamolasanak_elokeszitesere. (Hungarian)
25. Horváth G. New non-invasive tool for assessment of liver fibrosis: transient elastography. (A májfibrosis meghatározásának új, noninvazív módszere: tranziens elasztográfia (FibroScan)). Orv Hetil 2011; 152(22): 860–865. (Hungarian)
26. Ferraioli G, Tinelli C, Lissandrin R, Zicchetti M, Dal Bello B, Filice G, Filice C. Point shear wave elastography method for assessing liver stiffness. World J Gastroenterol 2014; 20(16): 4787–4796.
27. Dietrich CF, Dong Y. Shear wave elastography with a new reliability indicator. J Ultrason 2016; 16(66): 281–287.
28. Xie Q, Zhou X, Huang P, Wei J, Wang W, Zheng S. The performance of enhanced liver fibrosis (ELF) test for the staging of liver fibrosis: a meta-analysis. PLoS ONE 2014; 9(4): e92772.
29. Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, Sulkowski M, Torriani FJ, Dieterich DT, Thomas DL, Messinger D, Nelson M; APRICOT Clinical Investigators. Development of a simple noninvasive index to predict significant fibrosis patients with HIV/HCV co-infection. Hepatology 2006; 43 (6): 1317–1325.
30. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. ASL–EORTC clinical practice guidelines: Management of hepatocellular carcinoma. J Hepatol 2012; 56(4): 908–943.
31. Welzel TM, Hinrichsen H, Sarrazin C, Buggisch P, Baumgarten A, Christensen S, Berg T, Mauss S, Teuber G, Stein K, Deterding K, van Bömmel F, Heyne R, John C, Zimmermann T, Lutz T, Schott E, Hettinger J, Kleine H, König B, Hüppe D, Wedemeyer H. Real-world experience with the all-oral, interferon-free regimen of ombitasvir/paritaprevir/ritonavir and dasabuvir for the treatment of chronic hepatitis C virus infection in the German Hepatitis C Registry. J Viral Hepat 2017; 24(10): 840–849.
32. Flisiak R, Janczewska E, Wawrzynowicz-Syczewska M, Jaroszewicz J, Zarębska-Michaluk D, Nazzal K, Bolewska B, Bialkowska J, Berak H, Fleischer-Stępniewska K, Tomasiewicz K, Karwowska K, Rostkowska K, Piekarska A, Tronina O, Madej G, Garlicki A, Lucejko M, Pisula A, Karpińska E, Kryczka W, Wiercińska-Drapało A, Mozer-Lisewska I, Jabłkowski M, Horban A, Knysz B, Tudrujek M, Halota W, Simon K. Real-world effectiveness and safety of ombitasvir/paritaprevir/ritonavir ± dasabuvir ± ribavirin in hepatitis C: AMBER study. Aliment Pharmacol Ther 2016; 44(9): 946–956.
33. Hunyady B, Abonyi M, Gervain J, Horváth G, Jancsik V, Gerlei Zs, Lengyel G, Makkai E, Pár A, Péter Z, Pusztay M, Ribiczey P, Rókusz L, Sarrazin C, Schneider F, Schneider F, Szalay F, Tornai I, Tusnádi A, Újhelyi E, Werling K, Makara M. Ombitasvir/paritaprevir/ritonavir + dasabuvir + ribavirin (3DAA + RBV) treatment of hepatitis C (HCV) genotype 1 (GT1) infected patients after failure to previous first generation protease-inhibitor (PI) therapy. Interim analysis. J Hepatol 2016; 64(Suppl 2): S750.
34. Abergel A, Loustaud-Ratti V, Di Martino V, et al. High efficacy and safety of the combination HCV regimen grazoprevir and elbasvir for 8 weeks in treatment-naïve, non-severe fibrosis HCV GT1b-infected patients: interim results of the STREAGER study. The Liver Meeting. Hepatology 2017; 66(S1): LB5.
35. Gane EJ, Shiffman ML, Etzkorn K, Morelli G, Stedman CAM, Davis MN, Hinestrosa F, Dvory-Sobol H, Huang KC, Osinusi A, McNally J, Brainard DM, McHutchison JG, Thompson AJ, Sulkowski MS; GS-US-342-1553 Investigators. Sofosbuvir-velpatasvir with ribavirin for 24 weeks in hepatitis C virus patients previously treated with a direct-acting antiviral regimen. Hepatology 2017; 66(4): 1083–1089.
36. Wyles D, Pockros P, Morelli G, Younes Z, Svarovskaia E, Yang JC, Pang PS, Zhu Y, McHutchison JG, Flamm S, Lawitz E. Ledipasvir-sofosbuvir plus ribavirin for patients with genotype 1 hepatitis C virus previously treated in clinical trials of sofosbuvir regimens. Hepatology 2015; 61(6): 1793–1797.
37. Wilson EM, Kattakuzhy S, Sidharthan S, Sims Z, Tang L, McLaughlin M, Price A, Nelson A, Silk R, Gross C, Akoth E, Mo H, Subramanian GM, Pang PS, McHutchison JG, Osinusi A, Masur H, Kohli A, Kottilil S. Successful retreatment of chronic HCV genotype-1 infection with ledipasvir and sofosbuvir after initial short course therapy with direct-acting antiviral regimens. Clin Infect Dis 2016; 62(3): 280–288.
38. Horváth G, Gerlei Z, Gervain J, Lengyel G, Makara M, Pár A, Rókusz L, Szalay F, Tornai I, Werling K, Hunyady B. Diagnosis and treatment of chronic hepatitis B and D. National consensus guideline in Hungary from 22 September 2017. (A hepatitis B- és D-vírus-fertőzés diagnosztikája, antivirális kezelése. Magyar konszenzusajánlás. Érvényes: 2017. szeptember 22-től.) Orv Hetil 2018; 159(Suppl 1): 24–37. (Hungarian)
