Laboratory diagnosis of liver diseases
Summary
The assessment of abnormal liver chemistries is an everyday challenge in the clinical practice. Hepatocellular injury is defined as disproportionate elevation of aminotransferases compared with ALP levels, while in cholestasis the elevation of ALP is a characteristic feature. The elevation of conjugated bilirubin may result from hepato-cellular injury or from cholestasis. Recent studies have shown that the true healthy normal ALT level ranges from 29 to 33 IU/l for males, 19 to 25 IU/l in females. The elevation of aminotransferases requires testing for viral hepatitis, alcohol- and drug abuse, autoimmune hepatitis, non-alcoholic fatty liver disease, Wilson-disease, hemochromatosis, alfa-1 antitrypsin deficiency. The causes of ALP elevation can be biliary obstruction, primary biliary cholangitis and primary sclerosing cholangitis. Liver biopsy may be necessary when serologic and biochemical tests and imaging fail to establish a diagnosis. The fibrosis stage which determines the prognosis can be assessed by liver biopsy, as well as by non-invasive fibrosis markers and elastographies.
A klinikai gyakorlatban mindennapos feladat a kóros májpróbák értékelése. Hepatocelluláris károsodásra utal, ha a transzaminázok emelkedése aránytalan az ALP-hez képest, cholestasis esetén a magas ALP dominál. Emelkedett konjugált bilirubinszint májsejtkárosodásra vagy cholestasisra, epeúti obstrukcióra utal. Számos tanulmány szerint a valóban egészséges szérum GPT-szint férfiakban 29-33 IU/l, nőkben 19-25 IU/l. Kóros GPT-értékek esetén vizsgálandó a májkárosodás etiológiája, ami vírus, alkohol, nem alkoholos zsírmáj, autoimmun hepatitis, hemochromatosis, Wilson-kór, alfa-1-antitriszin-hiány, vagy gyógyszertoxicitás lehet. ALP-emelkedés esetén a cholestasis oka, leginkább epeúti elzáródás, primer biliáris cholangitis, primer szklerotizáló cholangitis jön szóba. Májbiopszia akkor szükséges, ha a szerológiai és biokémiai tesztek és képalkotó eljárások nem adnak diagnózist. A betegség prognózisát jelző fibrosis megítélésére a májbiopszián kívül a nem invazív fibrosis markerek és elasztográfiák is alkalmasak.
Bevezetés
A májbetegségek diagnosztikája során a laboratóriumi próbák indikálásához és értékeléséhez a kiindulópontot a kórelőzmény és a fizikális vizsgálat szolgáltatja. Ez kell, hogy megelőzzön minden egyéb diagnosztikai tevékenységet. A diagnosztika további eszközei a képalkotó eljárások és a májbiopszia. Ezek révén juthatunk a korrekt kórisméhez, amelynek alapján megtervezhető az egyénre szabott, oki terápia.
A májbetegségek laboratóriumi diagnosztikájával kapcsolatban megkülönböztetjük a májsejtkárosodásra utaló nekrózis- és exkréciós enzimeket, valamint a máj funkcióit (bilirubin, albumin, protrombin) jelző biokémiai paramétereket, összefoglaló néven májpróbákat (1–4).
Az igazi funkciós próbák bizonyos szubsztrátok májbeli felvételét, metabolizmusát és kiválasztását vizsgálják, ilyen pl. indocianin zöld clearance, a galaktóz-elimináció vagy a sulfadimidin kinetika vizsgálata.
A hepatocelluláris károsodás mutatói (nekrózis-enzimek)
Az alanin-aminotranszferáz (ALT) (glutaminsav-piroszőlősav-transzamináz/GPT): viszonylag májspecifikus enzim, a periportalis (1. zóna) hepatocytákból szabadul fel májkárosodáskor, steatosisban, vírus- vagy autoimmun hepatitisben, epeúti gyulladásokban, coeliakiában, Wilson-kórban. Obesitásban a testsúlycsökkenéssel párhuzamosan csökken a GPT-érték. Krónikus cholestasisban alig emelkedett, de akut epeúti obstrukcióban 1000 IU/l-ig emelkedhet, majd gyorsan normalizálódhat. Gyógyszeres májkárosodásban rossz prognózist jelent a tartós bilirubin- és transzamináz-emelkedés. Ugyanakkor a normális GPT-érték nem zárja ki a májbetegséget (3, 4). A GPT kóros lehet hepatocelluláris károsodás nélkül is pl. myopathiákban.
Az utolsó másfél évtizedben került a figyelem előterébe, hogy a laboratóriumokban „normális” tartománynak megadott 40-60 IU/l GPT nem tükrözi az „egészséges” értékeket, mert azoknál magasabb. Az ok a tünetmentes referenciapopulációban gyakran előforduló obesitás és steatosis, ami a magasabb GPT-értékekhez vezet. Ezért az igazi normális GPT meghatározásához javasolják kizárni a zsírmáj kockázati tényezőivel bíró egyéneket, s így a normális értékek alacsonyabbak és különböznek nemenként is (3).
Először Prati és munkatársai 6835 vírus-negatív (BMI 24,9 kg/m2) véradó vizsgálata kapcsán közölték, hogy a GPT normális határértéke férfiakban 30 IU/l, illetve nőkben 19 IU/l (5). Később Lee és munkatársai Koreából 1105 normális májbiopsziájú potenciális donor esetén férfiakban 33 IU/l, nőkben 25 IU/l normális felső határértékeket állapítottak meg (6). A National Health and Nutrition Examination Study kizárta a referenciapopulációból a vírushepatitises, alkoholos, diabéteszes >25 kg/m2 BMI-s eseteket, s az így megállapított „maximum correct classification” szerint a GPT felső határa féfiakban 29 IU/l, nőkben 22 IU/l volt (7).
Ma a valódi egészséges (kockázatmentes) populációban normál GPT-tartományként férfiakban 29-33 IU/l, nőkben 19-25 IU/l értékekben javasolják elfogadni. A fenti határértékeket meghaladó GPT esetén fokozott a májeredetű mortalitás (3, 8, 9).
Az aszpartát-aminotranszferáz, AST (glutaminsav-oxálecetsav-transzamináz/GOT): kevésbé májspecifikus: a centrális (3. zóna) májsejtjeiből, de a harántcsíkolt- és a szívizomzatból, veséből, agyból is származhat. A GOT emelkedése GPT-emelkedés nélkül: szív- vagy vázizom eredetre utal, ekkor a CK is kóros (4). Főleg iszkémia, sokk, Budd–Chiari-szindróma, rhabdomyolisis, toxikus ártalom (paracetamol) okozta fulmináns hepatitis esetén fordulhatnak elő magas (10 000 IU) GOT-értékek. Alkohol hatására, myopathiában, pajzsmirigybetegségekben, megerőltető fizikai terhelésre, hemolízisben is lehet emelkedett a GOT-aktivitás. A fibrosis progressziójával a GPT-hez viszonyítva emelkedik a GOT, nő a de Ritis (GOT/GPT) hányados (10, 11). Alkoholos májbetegségben >2,0, fulmináns hepatitisben >1,5, cirrózisban >1,0, vírushepatitisben <1,0 a de Ritis-hányados. Tünetmentes GOT-emelkedést az enzim-clearance defektusa miatt is leírtak (3) (1. táblázat, 1. ábra). A laktát-dehidrogenáz (LDH) is a sejtnekrózist jelzi, pl. daganatos betegségekben, iszkémiában, hemolízisben, anaemia perniciosában.

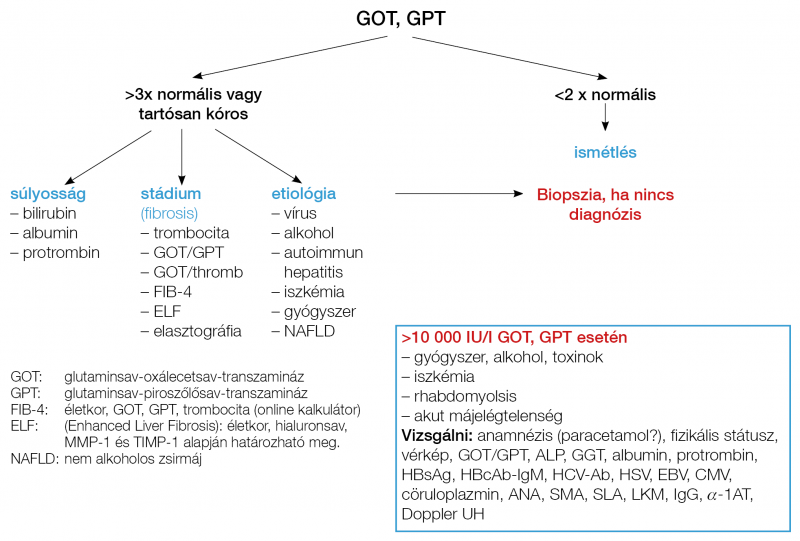
A cholestasis markerei (exkréciós enzimek)
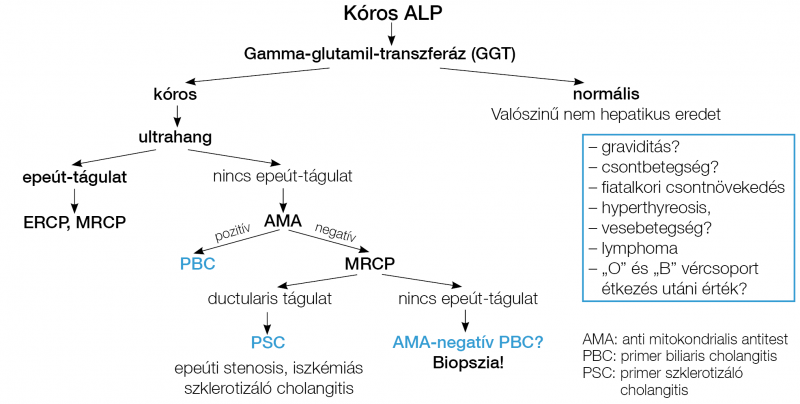
Az alkalikus foszfatáz (ALP) a hepatocyták canalicularis membránjában, csontban, placentában, bélben, vesében található. Különösen magas cholestasis, primer biliaris cholangitis (PBC), primer szklerotizáló cholangitis, tumor, epeúti striktúra, illetve obstrukció esetén. Az egyidejű GGT-emelkedés megerősíti a máj eredetet. Fiatalokban a gyors csontnövéssel, 50–60 év feletti nőkben szintén csont-turnoverrel kapcsolatban is emelkedett lehet. Graviditásban a placentából származó ALP okozhat magas értéket (2, 3). Zsíros étel fogyasztása után a „0” és „B” vércsoportú egyénekben emelkedhet az enzimszint, ami az intesztinális ALP-ből származik (12). Alacsony ALP-érték jellemző Wilson-kórra (2. táblázat, 2. ábra).

A gamma-glutamil-transzferáz (GGT) máj, vese, bél, prosztata és pancreas eredetű is lehet. A cholestasisra kevésbé specifikus, mint az ALP, de emelkedése ALP mellett támogatja a cholestasist. GGT-emelkedés jellemző alkoholos májbetegségben, nem alkoholos zsírmájban (NAFLD), gyógyszeres májkárosodásban, hemochromatosisban. Alkoholizmusban jellemző extrém magas GGT-érték az absztinenciával jelentősen csökkenhet. A GGT-emelkedés NAFLD-ben a kardiovaszkuláris mortalitás prediktora (4). A „májfunkció” mutatói Bilirubin A nem konjugált (indirekt) bilirubinemelkedés hemolízisre utal (normális GPT, ALP, magas retikulocitaszám, szérum vas, kálium, LDH-emelkedés, alacsony haptoglobin-szinttel). Az indirekt hyperbilirubinaemiával járó Gilbert-szindróma a populáció 5%-ában észlelhető. Az uridin-5-difoszfát-glukuronil-transzferáz ezimdefektus súlyos formája az újszülöttben jelentkező Crigler–Najjar-kór (13). A konjugált (direkt) bilirubin emelkedése cholestasis, epeúti obstrukció, hepatocelluláris károsodás (alkohol, gyógyszer, vírus, autoimmun) jele. Cirrózisban a tartós mély icterus és protrombinszint-csökkenés rossz prognózisra utal. Ártalmatlan herediter funkcionális direkt hyperbilirubinaemia a Dubin–Johnson-szindróma (MDR kanalikuláris enzimdefektus) és a Rotor-szindróma (defektív bilirubinraktározás a májsejtben) (2, 3, 13). Albumin 35 g/l alatti szérum albuminszint több mint 3 héten át súlyos májkárosodásra (cirrózisra) utal (3). Alacsony albuminszint előfordul még protein-malnutrició, proteinvesztő enteropathia, nephrosis szindróma és krónikus fertőzés esetén is (2). Protrombin-idő A máj szintézis funkciójának érzékenyebb jelzője, mint az albumin (3). Mivel K-vitamin-függő, ezért K-vitamin-hiányban, cholestasisban, zsír-malabszorpcióban, pancreas- és vékonybélbetegségekben, warfarin szedés, heparin bolus, DIC vagy hypotermia esetében is alacsony a protrombin-aktivitás. Parenterális K-vitaminra nem javuló >5 sec. protrombin-idő megnyúlás rossz prognózist jelent (2).
A pszeudokolinészteráz (CE)
Ún. szintézis-enzim: alacsony az értéke cirrózisban és előrehaladott parenchymakárosodásra utal, párhuzamosan a protrombin-idővel és az albuminszinttel.
Egyéb vérkémiai paramérerek
– A szérum globulinok a májban zajló gyulladást jelezhetik, a magas IgA alkoholos májbetegségben, az IgG-emelkedés autoimmun hepatitisben, magas IgM PBC-ben észlelhető.
– Az alfa-fötoprotein (AFP) emelkedése nemcsak hepatocelluláris karcinómában (HCC), de egyéb daganatokban is, és a cirrózisban zajló regenerációs folyamatokban is előfordul. Az AFP-érték azonban HCC-ben normális is lehet, szűrővizsgálatra nem alkalmas. Magas AFP-szint (200-400 ng/ml) azonban HCC-re utal.
– A plazma ammónia hepatikus encephalopathiában és az aminosav-anyagcsere (ureaciklus) örökletes zavaraiban lehet emelkedett.
– A szérum vas, a ferritin és a transzferrin szaturáció magas értékei a haemochromatosis, míg a magas 24 órás gyűjtött vizelet réz és az alacsony cöruloplazmin szint a Wilson-kór jellemzői.
– A koleszterin magas szérumszintje cholestasis, PBC gyanúját keltheti.
A májfibrosis diagnosztikája
A fibrosis stádium ismerete fontos a diagnosztikában és a prognózis előrejelzésében. Napjainkban a májbiopszia helyett előtérbe kerültek egymást kiegészítő vérkémiai mutatókon alapuló „biológiai”(szérum biomarkerek) és a „fizikai” megközelítésen (a májtömöttség mérésén) alapuló nem invazív módszerek (14–17) (3. ábra).

A fibrosis szérum biomarkerei közül az ún. direkt mutatók az extracelluláris mátrix lerakódását és eltávolítását tükrözik pl. hialuronsav, a laminin, prokollagén-III. peptid és IV. típusú kollagén, mátrix metalloproteáz-3 (MMP-3), metalloproteáz-1 szöveti inhibitora (TIMP-1). Az indirekt markerek rutin próbák, pl. protrombin, trombocitaszám, AST/ALT arány, a parenchymafunkciót vagy a nekrózis súlyosságát tükrözik, de közvetve utalnak a stádiumra is (14–17). Az alacsony (<100–140 000 G/l) trombocitaszám és a splenomegalia együtt cirrózist valószínűsít. A fibrosis diagnosztikában a direkt és indirekt markerek kombinációjával képzett indexek is alkalmazhatók. A legegyszerűbb GOT/trombocita hányados index (APRI score): amely a GOT/GOT normálértéke ×100 és a trombocita (G/l) érték hányadosa. Szignifikáns fibrosist (F≥2) jelent a 0,5-1,5 és cirrózist a >1,5 APRI-érték (18). A WHO az APRI score-t krónikus HCV-infekcióban elsővonalú fibrosis szűrőnek tartja, olyan területeken, ahol az elasztográfia (TE) nem elérhető (19). Fibrosis-4 (FIB-4) score (életkor, GOT/trombocita hányados és GPT alapján) online kalkulátorral kiszámítható (20), míg az Enhanced Liver Fibrosis score (ELF) az életkor, hialuronsav, MMP-3- és a TIMP-1-szint alapján határozható meg (21). NAFLD fibrosis score életkor, hyperglykaemia, BMI, trombocitaszám, albumin és GOT/GPT hányados alapján online kalkulátorral számolható (22). A szérum biomarkerek előnye, hogy hozzáférhetők, jól reprodukálhatók. Hátrányuk a májspecificitás hiánya, számos komorbid állapot befolyásolja az értékeket.
A májtömöttség (liver stiffness, LS) mérése a vibráció kontrollált tranziens elasztográfia (TE) ma általánosan elfogadott eljárás (15, 16, 23, 24). A FibroScan készülék a májszövetben alacsony frekvenciájú elasztikus hullámokat kelt, és a lökéshullám terjedési sebességét méri. A májtömöttség értékét kilopascalban kapjuk. A 7,1 kPa és 9,5 kPa közötti LS jelzi a szignifikáns (F≥2) fibrosist, 14,8 kPa felett a cirrózist (14). A TE az esetek 16-20%-ában nem értékelhető, eredményt befolyásolja a gyulladás, a cholestasis, a máj infiltratív folyamatai, a májpangás és az étkezés is (15, 16). Emellett hagyományos ultrahangkészülékhez integrálható acoustic radiation force impulse (ARFI) technika, supresonic shear imaging (SSI), mágneses rezonancia (MR) elasztográfia is alkalmas májfibrosis stádiummeghatározásra (25, 26).
Laboratóriumi próbák egyes speciális májbetegségekben
Vírushepatitisek
A májbetegség vírusetiológiájára utalhatnak a különböző virális antigének és antitestek, direkt bizonyítékot szolgáltatnak vírus nukleinsavak.
– Hepatitis A-vírus (HAV): az anti-HAV IgM akut, az anti-HAV-IgG lezajlott fertőzést, vagy sikeres HAV-vakcinációt igazol (27).
– Hepatitis B-vírus (HBV): HBsAg pozitív egyének esetén HBV DNS, HBeAg, HBe-antitest, esetleg HBV-genotípus meghatározás szükséges (28). A HBsAg a HBV-fertőzés szűrésre alkalmas markere, az anti-HBs lezajlott infekcióra, vagy a korábbi vakcinációra utal. Az anti-HBc-IgM akut, vagy aktív krónikus HBV-fertőzést, az anti-HBs + anti-HBc együtt korábbi infekciót jelez. A vírus jelenlétét a PCR-rel kimutatható HBV DNS bizonyítja.
– Hepatitis Delta ágens (HDV): HBV-vel együtt fordul elő, az anti-HDV, illetve a HDV RNS kimutatása igazolja a fertőzést (28).
– Hepatitis C-vírus (HCV): Az anti-HCV-IgM akut C-hepatitisben észlelhető, anti-HCV-IgG lezajlott vagy krónikus HCV-infekciót igazol. A fertőzés szűrésére az anti-HCV 92-97%-os érzékenységű, a kockázati csoportokban csak 5%-ban álpozitív. Anti-HCV pozitivitás esetén HCV RNS és HCV-genotípus meghatározása szükséges. A HCV RNS a kórokozó jelenlétére utal. Az anti-HCV az expozíció után 6-8 héttel, a HCV RNS 2 héten belül lesz pozitív. Az akut HCV-infekció 80%-ban nem jár sárgasággal (3, 4, 19).
– Hepatitis E-vírus (HEV): Immunszupprimált egyénekben krónikus HEV-fertőzés alakulhat ki. A HEV-infekció igazolása anti-HEV ellenanyag, HEV RNS kimutatásán alapul (29).
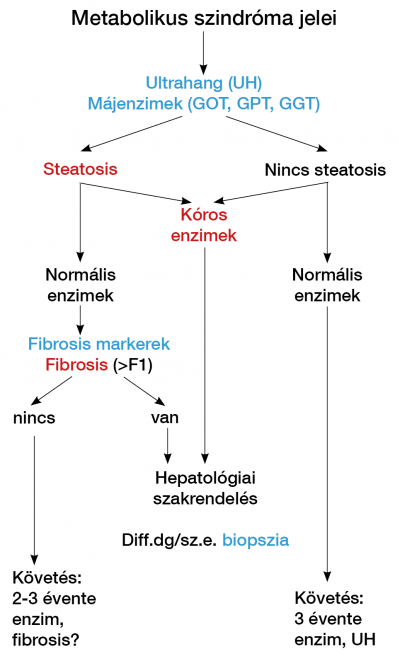
Nem alkoholos zsírmáj (NAFLD)
A NAFLD metabolikus szindróma komponenseivel társul (diabétesz, dyslipidaemia, obesitas, hipertónia). Kóros GPT vagy GOT esetén gondolni kell rá, a GPT>GOT (de <300 IU/l). A steatosist az ultrahang csak 25-30% feletti elzsírosodás esetén mutatja, a mágneses rezonancia spektroszkópia már 5% felett. A nem alkoholos steatohepatitis (NASH) nekro-inflammációval, fibrosissal jár, gyakrabban kíséri kóros GPT, de a diagnózist csak a májbiopszia bizonyíthatja. A fibrosis stádiumának fontos prognosztikai szerepe van, ebben hasznosak a fibrosis markerek és elasztográfiák (3, 4, 30) (4. ábra).
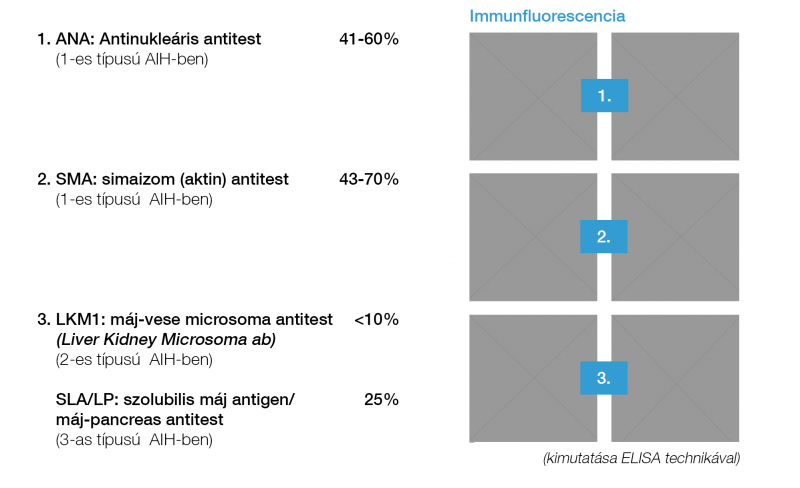
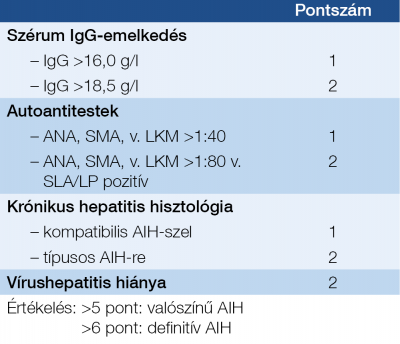
Alkoholos májbetegség A máj UH és hisztológiai képe hasonló, mint NAFLD esetén, de a GOT/GPT arány 2:1. A fibrosis progesszióval tovább nő a GOT-érték. A kóros GGT támogathatja az alkoholos eredetet, de önmagában nem bizonyít, a magas MCV, triglicerid és IgA-szint is gyanút keltő (31). Autoimmun hepatitis (AIH) Női dominancia, társuló immunbetegségek, transzamináz-emelkedés, autoantitestek (antinukleáris antitest, ANA; simaizom ellenes antitest, SMA; máj-vese mikroszóma ellenes antitest, LKM; és szolubilis májantigén elleni antitest, SLA;), magas IgG-szint, limfo-plazmasejtes interface hepatitis, genetikai predispozíció, cirrózisba történtő progresszió és az immunszuppresszióra bekövetkező remisszió jellemzi. Autoantitest mintázat alapján 3 kórforma különböztethető meg. – Az AIH 1. típus: („Lupoid hepatitis”) bármilyen életkorban, 70%-ban nőkben fordul elő, ANA, LE-sejt, SMA-pozitivitás jellemzi. – A 2. típus: gyermekekben gyakori, ANA-negatív, LKM-pozitivitás, IgA-hiány, vitiligó, diabétesz, gyors cirrózis progresszió, – a 3. típust: ANA és SMA-negativitás, SLA-pozitivitás, súlyos lefolyás jellemzi (32, 33) (5. ábra, 3. táblázat). Genetikai/anyagcsere-betegségek Hemochromatosis Örökletes vasraktározási betegség ahol a HFE-génben a C282Y-mutáció (1:250) bizonyítja a genetikai hátteret. Diagnózisban a magas szérum vas, transzferrin szaturáció, (>45%) és ferritin jelentős. A C282/H63D kettős (compound) heterozigóta állapot ritkán okoz manifeszt májbetegséget (3, 4).
Wilson-kór
Ritka (1:30 000) réztárolási betegség. ATP7B-gén több mint 300 mutációja lehetséges, alacsony szérum coeruloplasmin, penicillamin-terhelés mellett a kiindulási érték tízszeresét meghaladó, fokozott vizelet rézürítés jellemzi (34).
Alfa-1-antitripszin-hiány
(1:2500) alfa-1-antitripszin-hiány mellett, genotipizálással a PiZZ-mutáció (súlyos), a PiMz heterozigótaforma lehetséges (35).
Cholestasisos májbetegségek
– PBC (primer biliaris cholangitis): ALP-emelkedés, magas koleszterinszint, anti-mitokondriális antitest (AMA), emelkedett IgM-szint, antinukleáris antitest (ANA, Sp100, gp120) pozitivitás jellemzi (36).
– PSC (primer szklerotizáló cholangitis) (6. ábra): ALP-emelkedés, anti-neutrofil citoplazma antitest (ANCA), antineutrofil nukleáris antitest (ANNA) pozitivitással. Epeutak vizualizálására MRCP javasolt, kolonoszkópia fontos colitis ulcerosa diagnosztika és colorectalis rák fokozott kockázata miatt szükséges (37, 38).
– Cholestasis egyéb okait a 2. táblázat sorolja fel.

Gyógyszeres májkárosodások
Idioszinkrázián (metabolikus eltérésen vagy immun-allergián), vagy direkt (intrinszik) toxicitáson alapuló gyógyszer-okozta májkárosodásokra gondolni kell minden tisztázatlan kóros májpróba esetén. (Példák: halothan, INH, methotrexat, aszpirin, IFN, alfa-metildopa, nitrofurantoin, amiodaron, tamoxifen, infliximab, tetrán, valproat, ösztrogének, anabolikus szteroidok, hydralazin, carbamazepin, szulfonamidok, amoxicillin-klavulánsav, papaverin). A statinok szedésével kapcsolatos GPT-emelkedés reverzibilis lehet, és nem jelent májkárosodást, ha az enzimérték a normális 3-szorosát nem haladja meg. A paracetamol túladagolás súlyos fulmináns májelégtelenséggel és >10 000 IU/l GPT-értékkel járhat. A Hymann–Zimmerman-törvény („Hy-s rule”) szerint gyógyszeres májkárosodásban a kóros GPT + elhúzódó icterus mindig rossz prognózist, >10% mortalitáskockázatot jelent (2–4, 39).
Következtetések
1. Kóros májpróba esetén a részletes kivizsgálást megelőzően, meg kell ismételni az adott vizsgálatot és gondosan elemezni kell a kórelőzményt.
Májbetegség gyanújakor az alapvető laboratóriumi próbák a vérkép, a bilirubin, a transzaminázok, az ALP, a GGT, az albumin és a protrombin meghatározása és a hasi ultrahang jelentik. A normális GPT-tartomány felső határának tekinthető férfiakban a 29–33 IU/l, nőkben a 19–25 IU/l határérték(5, 40)
2. A legfontosabb etiológiai tényezők kóros GPT esetén: vírushepatitisek, alkohol, NAFLD, autoimmun hepatitis, Wilson-kór, hemochromastosis, alfa-1-antitripszin-hiány és gyógyszer-okozta májkárosodások. A >10 000 IU/l (>15 × norm) transzamináz-érték esetén gyakran paracetamol intoxikáció, illetve iszkémiás hepatitis van a háttérben.
3. Az ALP-emelkedés máj eredetét a kóros GGT-érték támogathatja, de önmagában az izolált GGT-emelkedés normális májpróbák esetén nem feltétlenül jelent májbetegséget.
4. A májbetegség súlyosságára a szérum bilirubin, albumin, protrombin és az említett extrém magas transzamináz utalhat.
5. Májbiopszia akkor szükséges, ha a szerológiai és biokémiai próbák nem vezetnek diagnózishoz. A fibrosis stádium meghatározására a biopszián kívül a nem invazív eljárások (fibrosis markerek és elasztográfiák) is alkalmasak.
6. A súlyos akut hepatitis elhúzódó mély icterussal, kóros protrombinnal és hepatikus encephalopathiával intézeti felvételt indokol (2–4).
2. Kasarala G, Tillmann HL. Standard liver tests. Clinical Liver Disease 2016; 8: 13–18.
3. Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of abnormal liver chemistries. Amer J Gastroenterol 2017; 112: 18–35.
4. Newsome PN, Cramb R, Davison SM, Dillon JF, Foulerton M, Godfrey EM, Hall R, Harrower U, Hudson M, Langford A, Mackie A, Mitchell-Thain R, Sennet K, Sheron NC, Verne J, Walmsley M, Yeoman A. Guidelines on the management of abnormal liver blood tests. Gut Published Online First: November 9, 2017. doi:10.1136/gutjnl-2017-314924.
5. Prati D, Taioli E, Zanella A, Della Tore E, Butelli S, Del Vecchio E, Vianello L, Zanuso F, Mozzi F, Milani S, Conte D, Colombo M, Sirchia G. Updated definitions of healthy ranges for serum alanine aminotransferase levels. Ann Intern Med 2002; 137: 1–10.
6. Lee JK, Shim JH, Lee HC, Lee SH, Kim KM, Lim YS, Chung YH, Lee YS, Suh DJ. Estimation of the healthy upper limits for serum alanine aminotransferase in Asian populations with normal liver histology. Hepatology 2010; 51: 1577–83.
7. Ruhl CE, Everhart JE. Upper limits of normal for alanine aminotransferase activity in the Unites States population. Hepatology 2012; 55: 447–454.
8. Ruhl CE, Everhart JE. Elevated serum alanine aminotransferase and gamma-glutamyltransferase and mortality in the Unites States population. Gastroenterology 2009; 136: 477–85.
9. Kim HC, Nam CM, Jee SH, Han KH, Oh DK, Suh IL. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ 2004; 328: 983–989.
10. De Ritis F, Coltorti M, Giusti G. An enzymic test for the diagnosis of viral hepatitis. J Infect Dis 1957; 101: 219–223.
11. Botros M, Sikaris KA, Lu ZX, McNeil A. The short term prognostic usefulness of the De Ritis ratio. Clin Biochem Rev 2013; 34: S18.
12. Matsushita M, Komoda T. Relationship between the effect of a high fat meal and blood group in determination of alkaline phosphatase activity. Rinsho Byori 2011; 59: 923–929.
13. Erlinger S, Arias IM, Dhumeaux D. Inherited disorders of bilirubin transport and conjugation: new insight into molecular mechanisms and consequences. Gastroenterology 2014; 146: 1625–38.
14. Castera L. Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012; 142: 1293–1302.
15. European Association for Study of the Liver, Association Latino-americana para Estudio del Hidago. EASL-ALEH Clinical practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63: 237–264.
16. Pár A, Vincze Á, Pár G. Nem invaziv fibrosis diagnosztika HCV infekcióban: szerepe a kezelés indikációjában, követésében és a prognózis megitélésében. Orv Hetil 2015; 156: 855–861.
17. Egresi A, Lengyel G, Hajmási K. A májfibrosis nem invaziv jellemzésének lehetőségei a klinikai adatok tükrében. Orv Hetil 2015; 156: 43–52.
18. Wai CT, Greenson JK, Fontana RJ. A simple non-invasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38: 518–526.
19. World Health Organization: Guidenlines for the screening, care and treatment persons with Hepatitis C infection. April 2014. pp. 1–122.
20. Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, Sulkowski M, Torriani FJ, Dieterich DT, Thomas DL, Messinger D, Nelson M; APRICOT Clinical Inverstigators: Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology 2006; 43: 1317–1325.
21. Parkes J, Roderick P, Harris S, Day C, Mutimer D, Collier J, Lombard M, Alexander G, Ramage J, Dusheiko G, Wheatley M, Giugh C, Burt A, Rosenberg W. Enhanced liver fibrosis test can predict clinical outcomes in patients with chronic liver disease. Gut 2013; 59: 1245–1251.
22. Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell, GC, Enders F, Saksena S, Burt AD, Bida JP, Lindor K, Sanderson SO, Lenzi M, Adams LA, Kench J, Therneau TM, Day CP. The NAFLD fibrosis score: A noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45: 846–854.
23. Tapper EB, Castera L, Afhdal NH. FibroScan (vibration controlled transient elastography): where does it stand in the United States practice? Clin Gastroenterol Hepatol 2015; 13: 27–36.
24. Pavlov CS, Casazza G, Nikolova D, Tsochatzis E, Gluud C. Systematic review with meta-analysis: diagnostic accuracy of transient elastography for staging of fibrosis in people with alcoholic liver disease. Aliment Pharmacol Ther 2016; 43: 575–585.
25. Sporea I, Bota S, Jurchis, A. Sirli R, Gradinaru-Tascao O, Popescu A, Ratiu I, Szilaski M. Acoustic force impulse and supersonic shear imaging versus transient elastography for liver fibrosis assessement. Ultrasound in Medicine and Biol 2013; 39: 1933–1941.
26. Huwart L, Sempoux C, Vicaut E, Salameh N, Annet L, Danse E, Peeters F, Beek LC, Rahier J, Sinkus R, Horsmans Y, Van Beers BE. Magnetic resonance elastography for the noninvasive staging of liver fibrosis. Gastroenterology 2008; 135: 32–40.
27. Nainan OV, Xia G, Vaughan G, Margolis HS. Diagnosis of Hepatitis A virus infection: a molecular approach. Clin Microbiol Rev 2006; 19: 63–79.
28. European Association for the Study of the Liver: EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017; 67: 370–398.
29. Ayres de Alencar Arrais Guerra J, Kampa KC, Morsoletto DGB, Junior AP, Ivantes CAP, Hepatitis E. A literature Review. J Clinical and Translational Hepatology 2017; 5: 376–383.
30. European Association for the Study of the Liver: Clinical practice guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64: 1388–1402.
31. Nyblom H, Berggren U, Balldin J, Olsson R. High AST/ALT ratio may indices advanced alcoholic liver disease rather than heavy drinking. Alcohol Alcoholism 2004; 39: 336–339.
32. Vierling JM. Autoimmune hepatitis and and overlap syndromes. Clin Gastroenterol Hepatol 2015; 13: 2088– 2108.
33. European Association for the Study of the Liver: EASL Clinical Practice Guidelines: Autoimmune hepatitis. J. Hepatol 2015; 63: 971–1004.
34. Roberts LA, Schilsky ML. A practice guideline on Wilson disease. Hepatology 2003; 37: 1475–1493.
35. Fairbanks KD, Tavill AS. Liver disease in alpha-1 antitrypsin deficiency. A review. Am J Gastroenterol 2008; 103: 2136–2141.
36. European Association for the Study of the Liver: EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis. J Hepatol 2017; 67: 145–172.
37. European Association for the Study of the Liver: EASL Clinical Practice Guidelines: Management of cholestatic liver diseases. J Hepatol 2009; 51: 237–267.
38. Lindor KD, Kowdley KV(2), Harrison ME. ACG Clinical Guideline: Primary Sclerosing Cholangitis.Am J Gastroenterol 2015; 110: 646–59.
39. Chalasani NP, Hayashi PH, Bonkovsky HL, Navarro VJ, Lee WM, Fontana RJ; Practice Parameters Committee of the American College of Gastroenterology. ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury. Am J Gastroenterol 2014; 109: 950–66.
40. Takyar V, Nath A, Beri A, Gharib AM, Rotman Y. How healthy are the “Healthy volunteers”? Penetrance of NAFLD in the biomedical research volunteer pool. Hepatology 2017; 66: 825–833.
