What should we know about viral hepatitis E infection?
Summary
Hepatitis E viral infection is the most common cause of acute viral hepatitis worldwide. Usually the infection resolves within weeks, but sometimes it causes acute liver failure, which may be fatal. The virus has at least 4 different human genotypes, genotypes 1 and 2 have been found only in humans, genotype 3 and 4 viruses circulate in several animals, and occasionally infect humans. Genotype 1 and 2 caused disease is common in developing countries where the disease occurs both as outbreaks and as sporadic cases after the consumption of contaminated water. Genotype 3 and 4 caused diseases is a zoonotic disease, humans are infected generally through consumption of undercooked animal meat. Genotype 3 and 4 viruses can cause chronic infection in the immuncompromised (HIV infected, organ transplant patients). Until now effective vaccine is available against gen. 1.
A hepatitis E-vírusinfekció az akut vírushepatitisek leggyakoribb oka a világon. A betegség rendszerint hetek alatt spontán gyógyul, ritkán akut májelégtelenséghez vezet, ami halálos lefolyású lehet. A vírusnak 4 genotípusa ismert, a genotípus 1 és 2 csak embereket fertőz, míg a genotípus 3 és 4 számos állatban megtalálható és csak ritkán fertőzi meg az embert. Az 1. 2. genotípus által okozott betegség a fejlődő országokban gyakori, ahol sporadikus és járványos előfordulása is ismert, a fertőzés forrása rendszerint a fertőzött víz fogyasztása. A 3., 4. genotípus által okozott fertőzés zoonózis, az ember nem kellően hőkezelt fertőzött állati termék fogyasztása során betegszik meg. A 3., 4. genotípusok immundeficiensekben (HIV-fertőzöttek, szervtranszplantáltak) krónikus májgyulladást okozhatnak. Hatékony vakcina a vírus 1. genotípusával szemben ismeretes.
Bevezetés
1963 és 1989 között öt világszerte előforduló hepatotrop vírust izoláltak; a hepatitis A-vírust (HAV), a hepatitis B-vírust (HBV), a hepatitis C-vírust (HCV), a hepatitis D-vírust (HDV) és a hepatitis E-vírust (HEV). 1990 és 2013 között a hepatitis A-E által okozott új megbetegedések előfordulása világszerte szignifikánsan csökkent, azonban az általuk okozott kórképek (májelégtelenség, krónikus májgyulladás, cirrózis, hepatocellularis karcinóma) diagnosztikája és kezelése lényegesen nagyobb egészségügyi és szociális terhet jelent (1). Az elkövetkező évek feladata, hogy hatékonyabb prevenció segítségével csökkentsük az új fertőzések előfordulását, illetve a hatékonyabb antivirális szerek alkalmazásával eradikáljuk a hepatitist okozó vírusokat, csökkentsük a krónikus kórképekkel kapcsolatos halálozást.
A hepatitis E története
1978-ban az indiai Kashmir körzetében non-A non-B (NANB) hepatitis járvány zajlott, amelynek során 600 000 lakosból 52 000 icterussal járó megbetegedést és 1700 beteg halálát tapasztalták. Terhes nőkben a májgyulladás súlyosabb volt és magasabb volt körükben a mortalitás, de a magzati és a perinatális halálozás is jelentős volt. A járvány főleg fiatalokat érintett 15–45 év között (2). A betegségek után nem tapasztaltak krónikus viraemiát, krónikus hepatitist és cirrózist (3). 14 éves nyomonkövetés során az IgG-ellenanyag a betegek felének szervezetéből eltűnt (4).
Az RNS-vírust 1997-ben sertésből izolálták, a Hepevírus genus Hepeviridae családjába sorolták, majd 4 humán genotípust határoztak meg. A HEV1 és 2 genotípusok (GT1, GT2) csak embert betegítenek meg, míg a GT3 és GT4 genotípus emlősöket és embereket egyaránt. A GT3 és GT4 sertésekben gyakori, az állatok klinikailag tünetmentesek, a májsejtekben mikroszkópos elváltozások azonban találhatók. Vaddisznókban és más állatokban további avián genotípusok is megtalálhatók (pl. vaddisznó, szarvas, nyúl), a tevékből izolált GT7 genotípus külön elnevezést is kapott (DcHEV), miután egy májtranszplantáción átesett beteg, aki gyakran fogyasztott tevehúst és ivott teve tejet hepatitis E-vírusfertőzésben betegedett meg (5). Az állati HEV-fertőzések nukleotid szekvenciája 50-60%-os hasonlóságot mutat a humán, illetve sertés HEV-fertőzésével (6, 7, 8, 9).
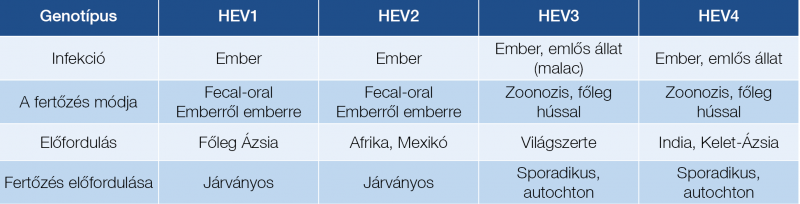
A humán HEV-genotípusok összehasonlítását az 1. táblázat mutatja.
A 1. táblázatból látható, hogy az epidemiológiai adatok, a betegség lefolyása, kimenetele, előfordulása genotípusok szerint különbözik. Míg a GT1, valamint GT2 járványos előfordulású, fekális-orális terjedésű betegséget okoz, addig a GT3 és GT4 valójában zoonózis, előfordulása sporadikus, az ember rendszerint nem kellően hőkezelt állati termékek fogyasztása révén fertőződik meg.
Epidemiológia
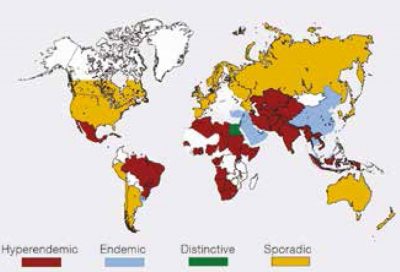
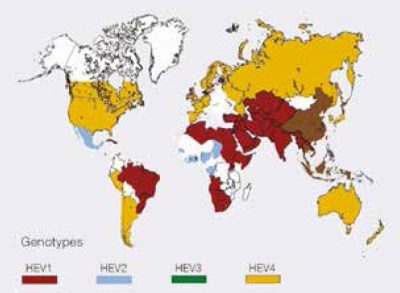
Az 1. ábra a hepatitis E-vírusinfekció előfordulását, a 2. ábra a hepatitis E-vírus genotípusok megoszlását mutatja (10).
A két ábrán látható, hogy vannak a világon hiperendémiás zónák – Dél-, Kelet- és Közép-Ázsia területén, valamint Észak-, Kelet-, Nyugat-Afrikában és néhány észak-amerikai országban (Mexikó). Ezekben az országokban rendszerint a GT1 okoz megbetegedéseket, Mexikóban és néhány afrikai országban inkább a GT2 által okozott infekció a jellemző. Endémiás zóna Közép-Kelet számos országa, Délkelet-Ázsia és Dél-Amerika néhány területe. Egyiptomban a GT1 eltérő szubtípusa fertőz,
a betegség terhesekben sem súlyosabb, az infekció
enyhe lefolyású, vagy tünetmentes, ld. a térképen a zöld mezőt (10).
A GT3 és GT4 a fejlett országokban sporadikus, autochthon előfordulású. Elsősorban idősekben elhúzódó lefolyású lehet magasra emelkedő szérum bilirubinszinttel, többezres transzamináz aktivitással (GOT, GPT), megnyúlt INR-értékkel. Gyakran gyógyszer által okozott toxikus hepatitisnek diagnosztizálják. A GT3 vírus krónikus hepatitist is okozhat immundeficiensekben.
Előfordulás
A HEV-infekció a világ lakosságának egyharmadát érinti. Kétarcú betegség, ami másként zajlik a fejlődő, valamint a fejlett országokban. A WHO adatai szerint jelenleg évente 20 millió infekció fordul elő világszerte, ebből 3,3 millió emberben tüneteket is okoz és megközelítőleg 40-60 ezer ember hal meg a betegségben (6, 10).
A fejlődő országokban 2005-ben végeztek vizsgálatokat, akkor ennél több, hozzávetőleg 70 000 ember halt meg GT1-, GT2-vírussal történt fertőzés miatt, 3000 koraszülést okozott az infekció (11). Az alacsony higiénés- és rossz gazdasági viszonyok, a rendszerint szennyezett ivóvíz miatt gyakoriak az ismételt járványok, Kashmirban az 1978-as járványt négy év alatt további három követte. A protektív, IgG-antitest ráadásul a fertőzöttek jelentős részében idővel eltűnik a szervezetből, emiatt HEV reinfekciókat is közöltek immundeficiens egyénekben (12). Terhes nőkben nyolcszor gyakoribb a GT1-, GT2-vírussal történő megbetegedés, az akut májelégtelenség terhességben tizenháromszor gyakrabban fordul elő. Az akut májelégtelenség 40%-ban a késői terhességben, a harmadik trimeszterben lép fel. Nemcsak a terhességi, de a fötális és a perinatális mortalitás is jelentős, számos vizsgálat szerint a vírus átmegy a placentán, sőt abban szaporodik is (13, 14). A GT1 és GT2 által okozott betegség cirrózisban, krónikus májbetegségekben is súlyos és magas mortalitású (15, 16, 17). Az akut GT1- és GT2-infekció sosem okoz krónikus hepatitist (6).
A fejlett országokban a GT3 és GT4 autochthon infekciókat okoz, ami idősekben súlyos lefolyású lehet. Az idősek 8-11%-ában fordul elő akut májelégtelenség és számos hepatikus és extrahepatikus komplikációval is kell körükben számolni (18, 19). Újabb vizsgálatok szerint a GT3 immundeficiens betegben elhúzódó viraemiát okozhat, ami 2-3 év alatt gyors progresszióval krónikus hepatitishez, cirrózishoz vezethet. Elsőként HIV-fertőzöttekben, majd szervtranszplantáltakban észlelték ezt a rapid lefolyást, de előfordul hematológiai daganatos betegekben is (20, 21). Három hónapig, vagy annál tovább tartó viraemia előrevetíti a krónikus lefolyást. Természetesen immundeficiens betegekben sem mindig ilyen súlyos a kórkép, az esetek döntő többségében bennük is tünetmentes, vagy enyhe az infekció. A lefolyást számos faktor befolyásolja, így súlyosbító tényező, pl. az alacsony CD4 sejtszám (HIV fertőzés), tacrolismus alkalmazása, vagy a thrombocytopenia.
A GT3 és GT4 által okozott hepatitis E-vírusfertőzés terhesekben nem gyakoribb és nem is súlyosabb lefolyású.
Extrahepatikus manifesztációk
A HEV elsősorban hepatotrop vírus, azonban extrahepatikusan is szaporodik, mégpedig a vesékben, a vékonybélben, a gyomorban, a lépben, a placentában és az idegszövetben. Akut pancreatitist, cryoglobulinaemiát, glomerulonephritist, bőrexanthemákat és számos neurológiai manifesztációt leírtak, így Bell-paralízist, encephalitist, perifériás neuropathiát, Guillain–Barre-szindrómát, neuralgiás amyotrophiát (22, 23, 24, 25, 26). Idegrendszeri tünetek a HEV-fertőzések 5%-ában találhatóak, ezek kimenetele változó.
Az extrahepatikus HEV-tünetek patogenezise nem ismert pontosan. Lehet az extrahepatikusan szaporodó HEV-fertőzés direkt citopatikus szövetkárosító hatásának, vagy immun mediált tényezőknek a következménye. A HEV-infekcióra adott immunválasznak van szerepe a neurológiai formákban, mégpedig a gangliozid antitestek molekuláris mimikrije következtében (24, 25). A HEV-fertőzés oki szerepe pancreatitis, glomerulonephritis, neurológiai manifesztációk esetében valószínű, a többi esetben véletlenszerű (24, 25, 26, 27, 28, 29, 30, 31).
A fertőzés módjai
Az alacsony fejlettségű országokban a GT1, GT2 szennyezett víz fogyasztásával okoz járványokat, ez különösen monszun idején, vagy árvizeket követően gyakori. Az emberről emberre történő átvitel sporadikus fertőzésekben valószínű. Indiában a GT1 mellett a GT4 is jelen van sertésekben, így ott zoonózis formájában sporadikus fertőzés is előfordul.
A fejlett országokban a GT3 és GT4 zoonózis, leginkább vaddisznó, szarvas, sertés HEV-fertőzése terjeszti, illetve ezek nem kellően hőkezelt húsának, májának fogyasztása révén fertőződik az ember. A májból készült korzikai Figatelli kolbász gyakran fertőzött HEV-vel (5).
Transzfúzióval történő átvitel is előfordul. HEV-viraemiát egészséges donorokban számos fejlődő és fejlett országból közöltek. Vér-vérkészítmény alkalmazására általában súlyos állapotban van szükség, terhességben-, májbetegekben a GT1 és GT2, szervtranszplantáltakban, HIV-betegekben, hematológiai daganatokban a GT3 transzfúzióval történő átvitele súlyos következményekkel járhat, fulmináns hepatitishez, krónikus hepatitishez, cirrózishoz vezethet. A donorok HEV-szűrése kívánatos lenne a magas HEV előfordulású országokban (27).
A fertőzött anyáról újszülöttre történő transzmisszió újszülöttkori betegséget, az újszülöttekben májelégtelenséget, korábbi fertőződés abortuszt, koraszülést okoz. Az anya és a foetus, az anya és az újszülött betegségének a súlyossága egymás tükörképei, ahogy az terhességi zsírmáj esetén is tapasztalható (5).
Klinikai tünetek
A lappangási idő 2-10 hétig terjed, átlagban 5-6 hét. A fertőződést követően a vírus a széklettel ürül 1-2 nappal a tünetek megjelenése előtt és 3-4 héttel azt követően. A tünetek 5-6 hétig tartanak. A fertőződés gyakran tünetmentes.
Amennyiben tüneteket okoz, azok nem különíthetőek el az egyéb vírusok által okozott májgyulladáséitól. Étvágytalanság, hányinger, émelygés, tompa jobb bordaív alatti fájdalom, hepatomegalia a legjellemzőbbek. A laboratóriumban gyakran látunk igen magasra emelkedő szérum bilirubin és többezres transzamináz értékeket megnyúlt INR-rel. Ezek az eltérések azután rendszerint gyorsan csökkennek, majd fokozatosan normalizálódnak.
Diagnózis
Immunokompetens egyénekben az IgM típusú HEV-antitestek kimutatása támasztja alá az akut HEV-fertőzést. A fertőződést követően 2 hét múlva detektálható és körülbelül öt hónapig mutatható ki. Immundeficiens egyénekben nem biztos, hogy az IgM-antitest megjelenik, ezért vérből HEV RNS-vizsgálata is szükséges negatív esetben, alapos gyanú esetén.
Az IgG típusú HEV-antitest kimutatása korábbi fertőzöttség után a védettséget igazolja, hasznos a HEV-vakcina hatékonyságának az ellenőrzésére is. A vakcinálás után 2,5 WHO unit/ml IgG-titer a védettséget jelzi (5).
Terápia
Immunkompetens egyénekben az akut HEV-fertőzés kezelése általában tüneti. Ribavirin kezelés súlyos esetekben alkalmazható, hatékony szer. A ribavirin teratogén, terhességben nem adható (24).
Immundeficiens egyénekben a prevenció lehetőségeire kell felhívni a figyelmet. Transzplantált egyének GT3-mal történt fertőzésekor segíthet az immunszuppresszió mértékének a csökkentése, amennyiben lehetséges. A kalcineurin-inhibitorok (cyclosporin, tacrolismus) és az mTOR-inhibitorok fokozzák a HEV-replikációt, krónikus viraemiát, krónikus HEV-fertőzést okozhatnak. Ezzel ellentétben a mycophenolsav gátolja a HEV-replikációt és segítheti a vírus clearencet. Perzisztáló viraemia esetén ribavirin adható, pegilált interferon mellékhatásai miatt csak annak hatástalansága esetén indikált, májtranszplantáció után adható, egyéb szervtranszplantáció után nem. A sofosbuvir, a krónikus hepatitis C-fertőzés gyógyításában hatásos nukleotid inhibitor alkalmazhatóságáról további vizsgálatok szükségesek (21, 24).
A 2. táblázat a szervtranszplantáltakban alkalmazott immunszuppresszív szerek hatását összegzi a HEV replikációjára (5).
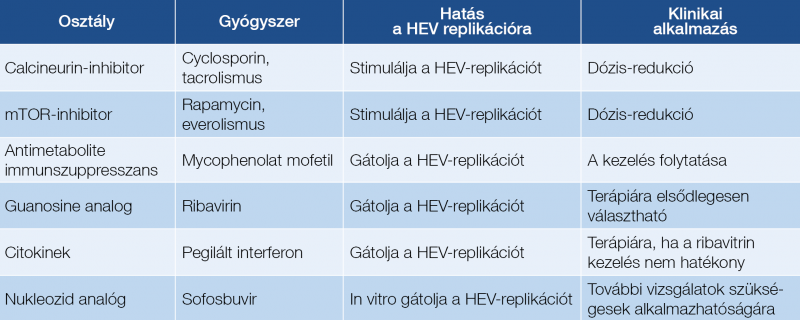
a HEV-vírus replikációjára (5)
Prevenció
A HEV-fertőzéssel szemben általában az a megfelelő védekezés, ha kellően hőkezelt ételeket és endémiás vidéken palackozott italokat fogyasztunk, ügyelünk a személyi higiénére. Specifikus védekezésre jelenleg Kínában van lehetőség, a HEV-239 vakcina a GT1-gyel szemben 4,5 évvel a vakcina beadása után 86,8%-os védettséget biztosít (5, 32). A HEV-239 vakcina a GT4-genotípussal szemben is hatásosnak bizonyult (32). Fél év alatt három vakcinát adnak (0, 1. és 6. hónapban). Alkalmazhatósága gyermekekben, idősekben, terhesekben, krónikus májbetegekben és immundeficiensekben még további vizsgálatokat igényel.
Következtetés
A HEV-infekció napjainkban az „emerging” betegségek közé sorolható. Az akut vírushepatitisek egyharmadát okozza, ami különösen súlyos lehet idősekben, terhesekben, fötális károsodást, perinatális mortalitást is okozhat, a GT3 és GT4 immundeficiensekben gyors progressziójú krónikus hepatitist idézhet elő cirrózissal, annak valamennyi szövődményével. A WHO 2016 májusában stratégiát dolgozott ki annak érdekében, hogy 2030-ra a vírushepatitisek által okozott egészségügyi, társadalmi terhet csökkentse. A célkitűzés szerint 2030-ra az új fertőzések előfordulását 90%-kal, a krónikus hepatitisek által okozott mortalitást 65%-kal kell csökkenteni. A stratégia elsősorban a hepatitis B- és C-infekciókra irányul, de valamennyi hepatitisvírust érinti. A célkitűzés hatékonyabb prevencióval, a terápiás lehetőségek jobb kihasználásával valósulhat meg.
2. Purcell RH, Emerson SU, Hepatitis E. the enterically transmitted non-A, non-B hepatitis. Indian J Gastroenterol1991; 10: 96–100.
3. Khuroo MS, Saleem M, Teli MR, Sofi MA. Failure to detect chronic liver disease after epidemic non-A, non-B hepatitis. Lancet 1980; 2: 97–98.
4. Khuro MS, Kamili S, Dar MY, Moecklii R, Jameel S. Hepatitis E and long-term antibody status. Lancet 1993; 341: 13–55.
5. Khuroo MS, Khuroo NS: Hepatitis E. Discovery, global impact, control and cure. World J Gastroenterol 2016; 22(31): 7030–7045.
6. Rein DB, Stevens GA, Theaker J, Wittenborn JS, Wiersma ST. The global burden of hepatitis E virus genotypes 1 and 2 in 2005. Hepatology 2012; 55: 988–997.
7. Pavio N, Meng XJ, Renou C. Zoonotic hepatitis E: animal reservoirs and emerging risk. Vet Res 2010; 41: 46.
8. Huang F, Li Y, Yu W, Jing S, Wang J, Long F, et al. Excretion of infectious hepatitis E virus into milk in cows imposes high risks of zoonosis. Hepatology 2016; 64: 350–359.
9. Lee GH, Tan BH, Chi-Yuan Teo E, Lim SG, Dan YY, Wee A, et al. Chronic infection with camelid hepatitis E virus in a liver transplant recipient who regularly consumes camel meat and milk. Gastroenterology 2016; 150: 355–357.
10. WHO: Hepatitis E http://www.who.int/mediacentre/factsheets/factsheets/fs280/en.
11. Teshale EH, HU DJ, Holmberg SD. The two faces of hepatitis E vírus. Clin Infect Dis 2010; 51: 328–334.
12. Khuroo MS, Kamili S, Dar MY, et al. Hepatitis E and long term antibody status. Lancet 1993; 341: 355.
13. Khuroo MS, Kamili S, Jameel S. Vertical transmission of hepatitis E virus. Lancet 1995; 345: 1025–1026.
14. Kumar RM, Uduman S, Rana S, et al. Sero-prevalence and mother-to-infant transmission of hepatitis E virus among pregnant women in the United Arab Emirates. Eur J Obstet Gynecol Reprod Biol 2001; 100: 9–15.
15. Ramachandran J, Eapen CE, Kang G, et al. Hepatitis E superinfection produces severe decompenzation in patients with chronic liver disease. J Gastroenterol Hepatolog 2004; 19: 134–138.
16. Hamid SS, Atiq M, Shehzad F, et al. Hepatitis E virus superinfection in patients with chronic liver disease. Hepatology 2002; 36: 474–478.
17. Péron JM, Bureau C, Poirson H, et al. Fulminant liver failure from acut autochthonous hepatitis E in France:description of seven patients with acut hepatitis E and encephalopathy. J Viral Hepat 2007; 14: 298–303.
18. Fujirwara S, Yokokawa Y, Morino K, et al. Chronic hepatitis E:a review of the literature. J Viral Hepat 2014; 21: 78–89.
19. Behrendt P, Steinmann E, Manns MP, et al. The impact of hepatitis E in the liver transplant setting. J Hepatol 2014; 61: 1418–1429.
20. Pas SD, de Man RA, Mulders C, Balk AH, van Hal PT, Weimar W, et al. Hepatitis E virus infection among solid organ transplant recipients, the Netherlands. Emerg Infect Dis 2012; 18: 869–872.
21. Kamar N, Izopet J, Tripon S, Bismuth M, Hillaire S, Dumortier J, et al. Ribavirin for chronic hepatitis E virus infection in transplant recipients.N Engl J Med 2014; 370: 1111–1120.
22. Drave SA, Debing Y, Walter S, Todt D, Engelmann M, Friesland M, et al. Extra-hepatic replication and infection of hepatitis E virus in neuronal-derived cells. J Viral Hepat 2016; 23: 512–521.
23. Shi R, Soomro MH, She R, Yang Y, Wang T, Wu Q, et al. Evidence of hepatitis E virus breaking through the blood-brain barrier and replicating in the central nervous system. J Viral Hepat 2016; 23: 930–939.
24. Sven Pischke, Johannes Hartl, Suzan D. Pas, et al. Hepatitis E virus:Infection beyond the liver? Journal of Hepatology 2017; 88: 1082–1085.
25. Perrin HB, Cintas P, Abravanel F, Gerolami R, d’Alteroche L, Raynal JN, et al. Neurologic disorders in immunocompetent patients with autochthonous acute hepatitis E. Emerg Infect Dis 2015; 21–28.
26. Woolson KL, Forbes A, Vine L, et al. Extra-hepatic manifestations of autochthonous hepatitis E infection. Aliment Pharmacol Ther 2014; 40: 1282–1291.
27. Hewitt PE, Ijaz S, Brailsford SR, et al. Hepatitis E virus in blood components: a prevalence and transmission study in southeast England. Lancet 2014; 384: 1766–1773.
28. Cheung MC, Magiure J, Carey I, et al. Review of neurological manifestations of hepatitis E infection. Ann Hepatol 2012; 11: 618–622.
29. Kamar N, Abravanel F, Lhomme S, et al. Hepatitis E virus:chronic infection,extra-hepatic manifestations, and treatment. Clin Res Hepatol Gastroenterol 2015; 39: 20–27.
30. Scharn N, Ganzenmueller T, Wenzel JJ, et al. Guillain-Barré syndrome associated with autochthonus infection by hepatitis E virus subgenotype 3c. Infection 2014; 42: 171–173.
31. Dalton FR, Jergen JJ, van EIK Pascal Cintas, et al. Hepatitis E virus infection and acute non-traumatic neurological injury: A prospective multicentre study. J Hepatol 2017; 67: 925–932.
32. Hepatitis E vaccine: WHO position paper, May 2015 Wkly Epideiol Rec. 2015 May 1; 90 (18): 185–200.
