Összefoglaló közlemények / Reviews
Autoimmune pancreatitis: diagnosis and therapy in real life
Summary
Autoimmune pancreatitis (AIP) is a rare form of chronic pancreatitis characterized clinically by frequent presentation with obstructive jaundice, with or without a pancreatic mass; histologically by a lymphoplasmacytic infiltrate and fibrosis; and therapeutically by a dramatic response to glucocorticoids. International Consensus Diagnostic Criteria divided AIP into type 1 and type 2. Type 1 AIP, also called lymphoplasmacytic sclerosing pancreatitis (LPSP), is part of IgG4-related disease called IgG4-related pancreatitis and other organs such as salivary glands and thyroid along with retroperitoneal fibrosis are usually involved. Type 2 AIP, also called idiopathic duct-centric pancreatitis (IDCP), is more localized to pancreas and is characterized by absence of elevated IgG4 levels and presence of granulocytic epithelial lesions although it can also be associated with ulcerative colitis. In this review, we discuss the current knowledge and recent advances relating to the diagnosis and therapy of AIP.
Az autoimmun pancreatitis (AIP) a krónikus pancreatitis ritka formája, amely gyakran elzáródásos sárgaság formájában jelentkezik a pancreasban térfoglaló terimével vagy anélkül; szövettanilag lymphocytás-plazmasejtes beszűrődés és fibrózis mutatható ki; valamint a szteroidra adott gyors terápiás válasz jellemzi. Az International Consensus Diagnostic Criteria az AIP-t 1-es és 2-es típusra osztotta. Az 1-es típus (más néven lymphocytás-plasmocytás szklerotizáló pancreatitis [LPSP]) az immunglobulin G4-gyel (IgG4) társult szisztémás szklerotizáló betegség hasnyálmirigy-megjelenési formája, amelyet több szervet (nyálmirigy, pajzsmirigy, retroperitoneum) érintő, szteroidra érzékeny gyulladás és fibrózis jellemez. A 2-es típus (más néven idiopátiás ductuscentrikus pancreatitis [IDCP] vagy granulocytás epithelsejt-károsodással [GEL] járó AIP) hasnyálmirigyre specifikus kórkép, de gyakran társulhat colitis ulcerosával. Hiányzik az IgG4-szint-emelkedés, és szövettanilag a GEL jellemzi. Jelen összefoglaló célja az elmúlt időszakban megjelent irodalmak áttekintése segítségével az AIP korszerű diagnózisának és kezelésének a bemutatása.
Kórforma
Az AIP az idült hasnyálmirigy-gyulladás egy különleges formája, amelyet klinikailag leggyakrabban elzáródásos sárgaság, a hasnyálmirigyben tumorszerű massza, szövettanilag lymphoplasmocytás beszűrődés és fibrózis, szteroidokra adott gyors javulás jellemez. Az AIP-nek a két fő típusa a szövettani jellegzetességeik alapján különíthető el (1. táblázat). Az 1-es típus, lymphocytás-plasmocytás szklerotizáló pancreatitis (LPSP) az immunglobulin G4-gyel (IgG4) társult szisztémás szklerotizáló betegség hasnyálmirigy-megjelenési formája, amelyet több szervet érintő, szteroidra érzékeny gyulladás és fibrózis jellemez. A 2-es típus (más néven idiopátiás ductuscentrikus pancreatitis [IDCP] vagy granulocytás epithelsejt-károsodással [GEL] járó AIP) hasnyálmirigyre specifikus kórkép. Szövettani jellemzője: a közepes és a kisméretű vezetékek epithelsejtjeit neutrophil granulocyták árasztják el, károsítják a hámsejteket, és eltömeszelik a vezeték lumenét. Az utóbbi években írták le a 3-as típusú AIP-t, amely a tumorok kezelésében alkalmazott immunellenőrzőpont-gátlók (immune checkpoint inhibitorok) mellékhatásaként kialakuló kórkép.
A kórkép ritka, prevalenciája 100 000 lakosból 1 (Európa), illetve 4 (Japán). Az 1-es típus lényegesen gyakrabban fordul elő, és elsősorban az idősebbeket érinti (1. táblázat).
Klinikai tünetek
Az 1-es típusú AIP aktív fázisában a leggyakoribb klinikai tünet a fájdalmatlanul kialakult elzáródásos sárgaság, hasi fájdalom, mérsékelt fogyás. Máskor a pancreas kiszélesedését véletlenül fedezik fel. A késői fázisban – többszörös recidíva után, vagy ha az akut fázisban a betegséget nem ismerik fel – a hasnyálmirigy állománya már atrofizál, és az előrehaladott, fájdalommal már nem járó idült pancreatitishez hasonlóan meszesedés, kőképződés, tágult vezeték figyelhető meg, valamint az exokrin és endokrin elégtelenség következtében malabszorpció és cukorbetegség alakul ki. 1-es típusú AIP-re jellegzetesek a hasnyálmirigyen kívüli tünetek: szklerotizáló cholangitis (előfordulás 88%), szklerotizáló sialoadenitis (Mikulicz-betegség, Küttner-tumor) (70%), szklerotizáló dacryoadenitis (70%), tubulointerstitialis nephritis (14%), retroperitonealis fibrózis (20%), thyreoiditis, prostatitis (10%), hilusi lymphadenopathia (30%), interstitialis pneumonitis (10%), hypophysitis, hepatitis. Ezek az elváltozások hasonló mechanizmussal alakulnak ki, mint az intrapancreaticusak, szövettani vizsgálattal itt is megtalálhatók az IgG4-pozitív plazmasejtek.
2-es típusú AIP-ben a hasi fájdalom és az akut pancreatitis a leggyakoribb tünet. Elzáródásos sárgaság jelentkezése előfordul, de nem olyan gyakori, mint az 1-es típusban. Extrapancreaticus manifesztáció nem fordul elő, kivéve a gyulladásos bélbetegséget. Ezért colitis ulcerosás betegben kialakuló pancreatitis esetén mindig gondoljunk az AIP lehetőségére.
3-as típusú AIP-re a tünetmentes amiláz-, lipázemelkedés vagy klinikai akut pancreatitis kialakulása a jellemző.
Kórisme
Mivel nem áll rendelkezésre egyetlen ideális teszt, az AIP kórisméje 5 jellegzetes kritérium segítségével állítható fel. Ezek a jellegzetes pancreasmorfológia, a szerológiai eltérések, az egyéb szervi érintettség, a szövettani vizsgálat és a szteroidkezelés sikeressége.
1-es típusú autoimmun pancreatitis
Hasnyálmirigy-morfológia
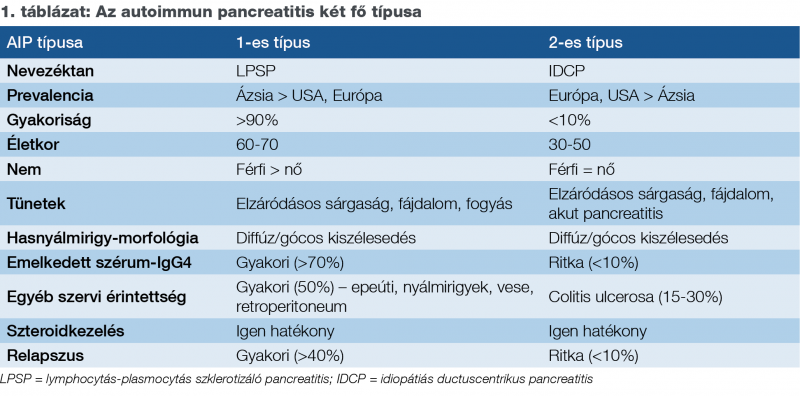
Képalkotó vizsgálatokkal típusos esetben a hasnyálmirigy diffúz kiszélesedése, megnagyobbodása látható, a hasnyálmirigy kolbászszerű (diffúz forma) (1A ábra). A peripancreaticus zsírszövet fibrózisa miatt a hasnyálmirigyet kis denzitású, tokszerű szegély (1C ábra) veszi körül, amely az AIP-re specifikus. UH-on a hasnyálmirigy echoszegény, CT-vel és MRI-vel a kontraszthalmozás elhúzódó. A kórképben a hasnyálmirigy körülírtan megnagyobbodhat (fokális forma), amely térszűkítő folyamatot utánozhat (mass-forming pancreatitis) (1B ábra).
1. ábra: A hasnyálmirigy éles kontúrú, diffúz (A), illetve körülírt (B) megnagyobbodását okozó autoimmun pancreatitis CT-felvétele. A pancreast tokszerű szegély veszi körül az MRI-felvételen (C)
A pancreasfejben kialakult és az epevezetéket is szűkítő folyamat elkülönítése a pancreasfejcarcinomától nehéz. A betegség késői szakaszában a parenchyma atrophiája és meszesedése is előfordulhat, ezért nehéz elkülöníteni az egyéb kóreredetű idült pancreatitistől.
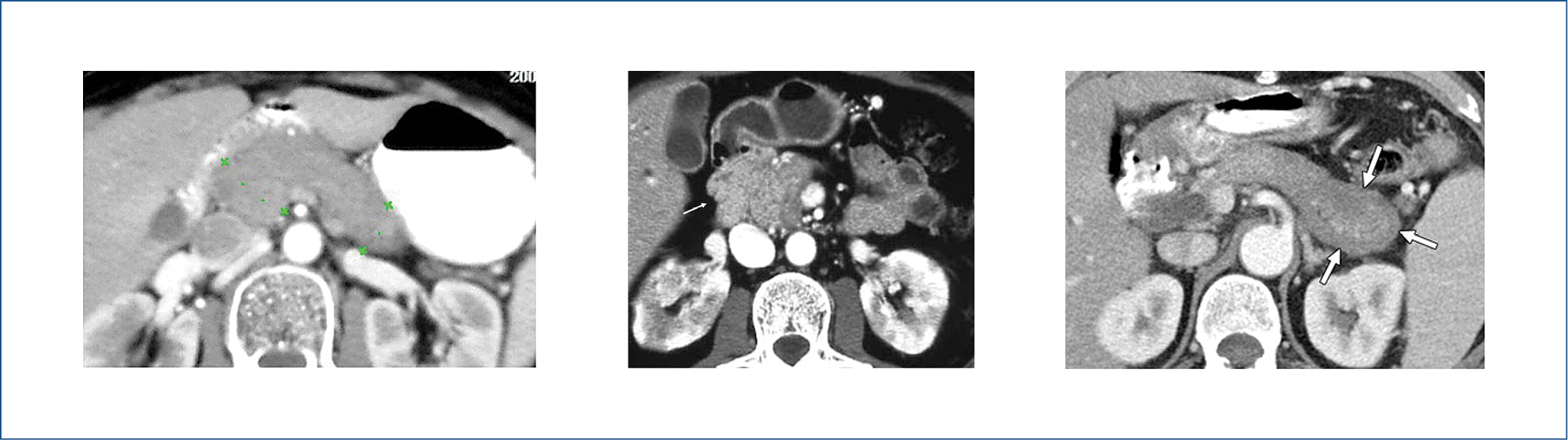
Az ERCP (endoszkópos retrográd cholangiopancreatographia) a Wirsung-vezeték hosszanti (a vezeték egyharmadát meghaladó) vagy többszörös, éles kontúrú, szegmentális szűkületét mutatja, jelentős praestenoticus vezetéktágulat nélkül. Ezt a radiológiai eltérést a gyulladásos beszűrődés és a fibrózis heterogén megoszlása okozza, és élesen különbözik a hasnyálmirigyrákkal összefüggő vezetékszűkülettől, ahol az ép hasnyálmirigyszövetben jelentős, szűkület előtti tágulat alakul ki (2. ábra). Gyakori az intrapancreaticus choledochus szakasz szűkülete (2. ábra), amelyet a pancreasvezeték distalis szakaszainak szűkülete kísér (kettős csatorna jel).
2. ábra: A Wirsung-vezeték hosszanti szűkülete (telt nyilak) praestenoticus
tágulat nélkül és a ductus choledochus intrapancreaticus szakaszának szűkülete (üres nyíl)
Ez a morfológiai jel hasnyálmirigyrákra is kórjelző. Az invazív ERCP ugyan nem az elsődleges vizsgálómódszer AIP-ben, de a Wirsung-vezeték tágulat nélküli szűkületeit az MRCP nem tudja megbízhatóan igazolni.
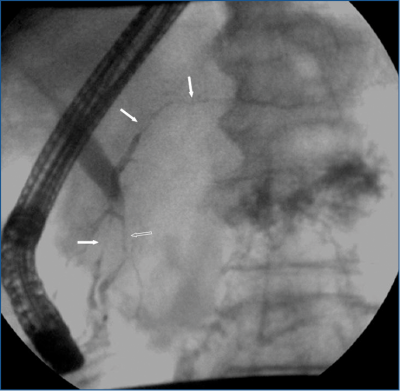
Jellegzetes az intra- és az extrapancreaticus epeutak primer szklerotizáló cholangitishez (PSC) hasonló, szklerotizáló szűkülete (3. ábra).
3. ábra: A primer szklerotizáló cholangitis és az IgG4-gyel társult szklerotizáló
cholangitis cholangiogramjának vázlata
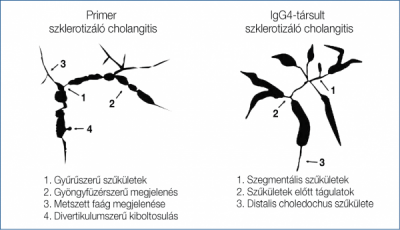
A PSC inkább a fiatalok betegsége, míg az IgG4-társult szklerotizáló cholangitis inkább idősekben jelentkezik. PSC-vel szemben az epeúti elváltozások szklerotizáló cholangitisben szteroidra javulnak, amely a kialakulás eltérő módjára utal.
Duodenoszkópiával főleg a pancreasfejre lokalizálódó AIP-ben a Vater-papilla megnagyobbodott, és szövettani vizsgálatkor sok IgG4-pozitív plazmasejt látható.
Az endoszkópos ultrahang (EUH) kiemelt vizsgálóeljárás az AIP és a hasnyálmirigyrák elkülönítésében. A diffúzan vagy körülírtan kiszélesedett, echoszegény hasnyálmirigy echodús interlobuláris sövényekkel, lebenyezettséggel, a pancreas körüli echoszegény sáv az AIP-re jellemző eltérések (4. ábra). Az EUH-vezérelt mintavétel lehetővé teszi az AIP szövettani kórisméjét és a pancreasrák kizárását. Az AIP diagnózisához szükséges immunhisztokémiai vizsgálathoz a szöveti szerkezetet megőrző henger (ún. core) mintára van szükség, amely EUH-vékonytű-biopsziával (EUH-FNB) biztosítható.
4. ábra: Autoimmun pancreatitis endoszkópos UH-képe. Kiszélesedett,
echoszegény pancreas echodús sövényekkel, lebenyezettséggel
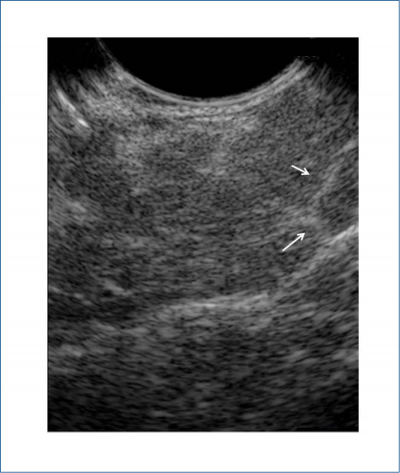
Az EUH elősegíti a szklerotizáló cholangitis diagnózisát is: az epevezeték és az epehólyag falának szimmetrikus, körkörös, hármas rétegű megvastagodása kórjelző értékű. Az elkülönítő kórismét nehezítő cholangiocarcinomában körülírt, egyenetlen kontúrú falmegvastagodás látható.
Szerológia
A szérumban az IgG4 szintje a betegek 70-90%-ában növekedett. A normális érték (<140 mg/dl) kétszeresét meghaladó emelkedés kórjelző értékű. Az IgG4 értéke szorosan összefügg a betegség aktivitásával, és a visszaesés valószínűségét is előre jelzi. Segítheti az AIP elkülönítését a hasnyálmirigyráktól, azonban a betegségre nem specifikus, mivel más benignus (asthma bronchiale, atópiás dermatitis, pemphigus, krónikus pancreatitis, primer szklerotizáló cholangitis) és malignus (pancreascarcinoma, cholangiocarcinoma) betegségekben is előfordul szérum-IgG4-emelkedés. A betegek egy részében a szérumamiláz, a szérumlipáz, illetve a CA 19-9 mérsékelten emelkedett, amely nem specifikus eltérés.
Hasnyálmirigyen kívüli megjelenés Az IgG4-társult betegség bármely szervben jelentkezhet, a kórisméhez használt feltételrendszerben csak a szklerotizáló cholangitis, szklerotizáló sialoadenitis, tubulointerstitialis nephritis és a retroperitonealis fibrózis kimutatása kórjelző értékű. Egyéb szervi érintettségben (hilusi lymphadenomegalia, interstitialis pneumonitis, autoimmun hepatitis, hypothyreosis) a képalkotó vizsgálat eredménye nem specifikus, és nem teszik lehetővé az AIP és a pancreasrák megbízható elkülönítését. A hasnyálmirigyen kívüli megjelenés megelőzheti az AIP kialakulását, és ezért tévesen az érintett szerv elsődleges betegségeként értelmezzük. Az IgG4-társult betegség az érintett szervek körülírt vagy diffúz megnagyobbodását okozza a pancreasban megfigyelt jellegzetes szövettani elváltozásokkal, és itt is jellemző a szteroidra bekövetkező gyors javulás. Hasnyálmirigy szövettani vizsgálata A szövettani vizsgálat az arany standardja az AIP definitív diagnózisának. Jellegzetes szövettani eltérések az interstitialis örvénylő fibrózis, a periductalis elhelyezkedésű lymphocytás-plazmasejtes beszűrődés (LPSP) és az elzáródásos phlebitis (5A–5C ábra). A gyulladásos beszűrődés inhomogén, megkímélt területek váltakozhatnak éles határral a súlyos morfológiai eltérésű régiókkal (skipped laesio). A gyulladás körbefogja a vezetéket, és szűkíti a lument. Immunhisztokémiai vizsgálattal IgG4-pozitív plazmasejtek mutathatók ki nagy számban (>10 sejt/nagy látótér).
5. ábra: Az autoimmun pancreatitis szövettani jellegzetessége az örvénylő fibrózis (A) és a periductalis lymphocytás-plazmasejtes beszűrődés (HE-festés, 250-szeres nagyítás) (B). Kórjelző az IgG4-pozitív plazmasejtek immunhisztokémiai kimutatása (HE-festés, 400-szoros nagyítás) (C)
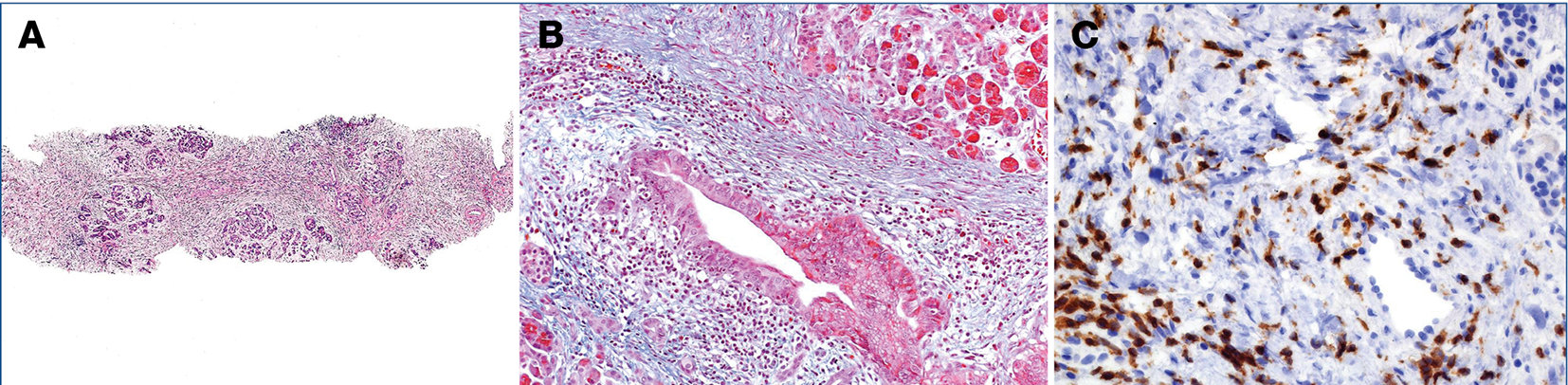
Szteroidkezelés sikeressége
A kórjelző szteroidteszt alkalmazása feltételekhez kötött: AIP gyanújakor, a hasnyálmirigyrák kizárása után használható, és megkívánja a regresszió objektív kimutatását. A szteroidkezelés sikerét 2 héttel később állapíthatjuk meg a képalkotó vizsgálatok, a szérum-IgG4 és CA 19-9 szintje alapján. A szteroid csökkenti az emelkedett IgG4- és CA 19-9 szintet, a morfológiai eltérések visszafejlődnek. Az AIP kórisme helytelen, ha a CA 19-9 szintje emelkedik, és a morfológiai eltérések nem fejlődnek vissza. Szteroidterápia mellett gyakori a tüneti javulás még hasnyálmirigyrák esetén is, így ezt nem szabad figyelembe venni a terápiás válasz megítélésekor.
2-es típusú autoimmun pancreatitis
A 2-es típus morfológiája az 1-es típuséval egyező. A szérum-IgG4-emelkedés hiányzik, és az IBD kivételével nincs hasnyálmirigyen kívüli szervi megjelenése sem, azaz az IDCP nem szisztémás, hanem hasnyálmirigy-specifikus betegsége. A kórisméhez szövettani vizsgálat szükséges.
2-es típusú AIP-ben interstitialis örvénylő fibrózis és a periductalis lymphocytás-plazmasejtes beszűrődés látható. IgG4-pozitív plazmasejtek nem, vagy csak kis számban láthatók, és hiányzik az elzáródásos phlebitis is. Jellegzetes eltérés a GEL: a közepes és a kis vezetékek epithelsejtjeit, valamint az acinusokat neutrophil granulocyták árasztják el, károsítják a sejteket, és eltömeszelik a vezetéket. A 2011-ben bevezetett diagnosztikus kritériumrendszer alapján (International Consensus Diagnostic Criteria) az AIP kórisméje a rendelkezésre álló eltérések alapján lehet egyértelmű vagy valószínű.
Kezelés
A kezelés javallata a tünetek (elzáródásos sárgaság, hasi fájdalom, extrapancreaticus szervek érintettsége) megléte vagy tünetmentes betegnél a tartósan kóros májfunkciós értékek. A kortikoszteroid-kezelés hosszú távon kivédheti a fibrózis, az epeúti szűkületek, az endokrin és exokrin hasnyálmirigy-elégtelenség kialakulását és a visszaeséseket.
AIP-ben 0,6 mg/kg/nap prednisolonnal gyors remisszió érhető el, ami megerősíti az AIP kórisméjét. Az indukciós dózis 1 hónapig adandó, majd az adag ezt követően 1-2 hetente 5 mg-mal csökkentendő. Ha a szteroid kontraindikált, a CD20-antitest rituximabbal (375 mg/testfelület m2 iv./hét 4 hétig) érhetünk el remissziót.
Visszaesés az 1-es típusú AIP 40-50%-ban fordul elő, leggyakrabban a szteroid abbahagyásakor. Proximális szklerotizáló cholangitis, a felső határánál négyszer magasabb kiindulási szérum-IgG4-szint, a hasnyálmirigy diffúz kiszélesedése, több extrapancreaticus szerv érintettsége és a szteroidkezelés után perzisztálóan magas szérum-IgG4-szint esetén gyakoribb a visszaesés. A fenntartó kezelés célja a relapszus megelőzése, ami kis adag (5–7,5 mg/nap) szteroid 6-24 hónapig történő alkalmazásával érhető el.
1-es típusú AIP visszaesésekor három lehetőség jön szóba:
- Újabb, hosszabb ideig tartó indukciós szteroidkezelés, lassabb dóziscsökkentés és fenntartó szteroidkezelés.
- Újabb indukciós szteroidkezelés és immunmodulátor (2 mg/kg/nap azatioprin; vagy 1 mg/kg/nap 6-mercaptopurin; vagy 2×750–1000 mg/nap mikofenolát-mofetil) alkalmazása, majd a szteroid fokozatos elhagyása mellett fenntartó immunmodulátor-kezelés.
- Rituximabterápia (az indukciós adag ismétlése 2-3 havonta 24 hónapig).
2-es típusú autoimmun pancreatitisben az indukciós szteroidkezelésre a remissziós arány nagy, és a szteroid elhagyásakor nem kell relapszussal számolni.
Kórjóslat
Szteroidkezelésre az AIP remissziója 98%-ban kialakul. Többszörös relapszus esetén jelentős fibrózis, hasnyálmirigy-meszesedés és kőképződés figyelhető meg az esetek 7-40%-ában. Úgy tűnik, hogy az AIP a krónikus pancreatitishez hasonlóan fokozza a pancreascarcinoma kialakulásának a kockázatát.
A közlemény megírását a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (K128222) és a Szegedi Tudományegyetem, Általános Orvostudományi Kar, Hetényi Géza pályázatai (5S 259) támogatták.
https://doi.org/10.1177/2050640620934911
2. Uchida K, Okazaki K. Current status of type 1 (IgG4-related) autoimmune pancreatitis. J Gastroenterol 2022; 57(10): 695–708.
https://doi.org/10.1007/s00535-022-01891-7.
3. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T and The Autoimmune Pancreatitis International Cooperative Study Group. APICS: Histopathologic and Clinical Subtypes of Autoimmune Pancreatitis: The Honolulu Consensus Document. Pancreas 2010; 39: 549–554.
https://doi.org/10.1097/MPA.0b013e3181e4d9e5.
4. Okazaki K, Kawa S, Kamisawa T, et al. Amendment of the Japanese consensus guidelines for autoimmune pancreatitis, 2020. J Gastroenterol 2022; 57(4): 225–245.
https://doi.org/10.1007/s00535-022-01857-9.
5. Sayed Ahmed A, Abreo M, Thomas A, Chari ST. Type 3 autoimmune pancreatitis (immune checkpoint inhibitor-induced pancreatitis). Curr Opin Gastroenterol 2022 Sep 1; 38(5): 516–520.
https://doi.org/10.1097/MOG.0000000000000873
6. Nagpal SJS, Sharma A, Chari ST. Autoimmune Pancreatitis. Am J Gastroenterol 2018; 113(9): 1301.
https://doi.org/10.1038/s41395-018-0146-0.
7. Qureshi A, Ghobrial Y, De Castro J, Siami-Namini K, Newman KA. Autoimmune pancreatitis – What we know and what do we have to know? Autoimmun Rev 2021; 20(10): 102912.
https://doi.org/10.1016/j.autrev.2021.102912.
8. Czakó L, Gyökeres T, Topa L, Sahin P, Takács T, Dubravcsik Zs, Szepes A, Pap A, Földesi I, Terzin V, Tiszlavicz L, Wittmann T. Autoimmune pancreatitis in Hungary. A Multicenter Nationwide Study. Pancreatology 2011; 11(2): 261–267.
https://doi.org/10.1159/000327092
9. Hart PA, Kamisawa T, Brugge WR, et al. Long-term outcomes of autoimmune pancreatitis: a multicentre, international analysis. Gut 2013; 62(12): 1771–6.
https://doi.org/10.1136/gutjnl-2012-303617
10. Dubravcsik Z, Farkas G, Hegyi P, et al. Hungarian Pancreatic Study Group. Autoimmune pancreatitis. Evidence based management guidelines of the Hungarian Pancreatic Study Group. Orv Hetil 2015; 156(8): 292–307.
https://doi.org/10.1556/OH.2015.30061
11. Terzin V, Dobra M, Góg Cs, et al. Pancreatic cancer or autoimmune pancreatitis: Endosonography as a diagnostic reviser. Case Reports in Internal Medicine 2014; 1(2): 126–134.
https://doi.org/10.1556/oh.2013.29513
12. Czakó L. Autoimmun pancreatitis: Aluldiagnosztizált kórkép? LAM 2006; 16: 505–510.
