Összefoglaló közlemények / Reviews
Good practice for anticoagulant and antiplatelet treatment in gastrointestinal bleeding
Summary
Antithrombotic treatment significantly increases the risk of bleeding in the gastrointestinal tract. The associated mortality is partly due to circulatory stasis, shock, ischemia owing to hemorrhage and partly due to thromboembolic complications resulting from the interruption of antithrombotic therapy for the reason of hemorrhage. Timing of early endoscopy is an important aspect of treatment. In severe, life-threatening bleeding, it may be necessary to suspend anticoagulation. In the case of vitamin K antagonists, it is recommended to give prothrombin complex concentrate, fresh frozen plasma should be used only in the absence of this. For direct acting oral anticoagulants, specific antidotes or, if these are not available, also prothrombin complex concentrate is proposed. Acetyl-salicylic acid should not be omitted in controlled bleeding, nor in the case of dual antiplatelet therapy, but the second agent should be suspended for a while. The prevention of thromboembolism is also essential in gastrointestinal bleeding, and therefore the reintroduction of anticoagulation is justified after the bleeding has stopped. If the risk of rebleeding is high, it is recommended to restart anticoagulants after day 7, and within 4-7 days in case of low risk.
Az antitrombotikus kezelés jelentősen megnöveli a tápcsatornai vérzések kockázatát. Az ehhez társuló mortalitás hátterében részben a vérzés miatti keringésmegingás, sokk, iszkémia, részben éppen a vérzés miatt felfüggesztett antitrombotikus kezelés következtében fellépő tromboembóliás szövődmények állnak. A kezelés során lényeges szempont a korai endoszkópia időzítése. Súlyos, életet veszélyeztető vérzés esetén szükséges lehet az antikoaguláns szerek hatásának felfüggesztése. K-vitamin-antagonisták esetén protrombinkomplex-koncentrátum adása javasolt, friss, fagyasztott plazma csak ennek hiányában alkalmazandó. Direkt hatású orális antikoaguláns szerek esetében specifikus antidótumok, vagy ha ezek nem elérhetők, szintén protrombinkomplex-koncentrátum adása javasolt. Az acetil-szalicilsavat kontrollálható vérzésben nem szükséges kihagyni, kettős thrombocytaaggregáció-gátlás esetén a második szer adását azonban célszerű ideiglenesen felfüggeszteni. A tromboembólia megelőzése gasztrointesztinális vérzés esetén is létfontosságú, ezért a vérzés megszűnése után az antikoaguláns-kezelés korai újraindítása indokolt. Ha az újravérzés rizikója magas, a véralvadásgátlók 7. nap utáni, alacsony kockázat esetén 4-7 napon belüli újrakezdése javasolt.
Bevezetés
Az antitrombotikus terápia során alkalmazott véralvadásgátló-kezelés és thrombocytaaggregáció-gátlás (TAG) jelentősen megnövelik a tápcsatornai vérzések kockázatát. A gyakran alkalmazott acetil-szalicilsav (ASA) vagy clopidogrel szedésekor a felső gasztrointesztinális traktus (gastrointestinal tract, GIT) vérzésének esélye 2-4-szer nagyobb a kontrollcsoporthoz képest (1). Az antikoagulánst szedők körében a vérzés rizikója megkétszereződik a TAG-ban részesülő betegekhez viszonyítva (relatív kockázat, relative risk, RR: 4,2 vs. 2,1) (2). A rizikót fokozza az antikoaguláns szerek és a TAG kombinálása, valamint nem szteroid gyulladáscsökkentő párhuzamos szedése.
Súlyos GIT-vérzésről a klinikai tünetek alapján akkor beszélünk, ha a beteg nagy mennyiségű friss vért hány (haematemesis) vagy ürít (haematochesia), ha szurokszéklet (melaena), hemodinamikai instabilitás vagy sokk észlelhető, ha a vérzés >3 napig tart, vagy egy héten belül jelentős újravérzés jelentkezik. Laboratóriumi paraméterek alapján pedig akkor, ha a hemoglobinszint hirtelen ≤60 g/l-re csökken, legalább 4 egység vöröstértest-szuszpenzió transzfúziójára van szükség. Ha az endoszkópia során aktív, szivárgó vagy pulzáló vérzést, ércsonkot vagy tapadó koagulumot találunk (Forrest I/a–II/b fekély), az szintén súlyos GIT-vérzésnek számít (3).
A felső tápcsatornai vérzés mortalitása az emiatt kórházi kezelésre felvett betegek esetén hozzávetőlegesen 10%, az alsó tápcsatornai vérzésnél 2-4% körüli. Azonban, ha a hospitalizáció alatt bekövetkező vérzéseket is beleszámítjuk, az általános halálozás elérheti a 30%-ot is (4, 5). Mindezt súlyosbítja az idősödő társadalom számos potenciális társbetegsége. A halálozásban részben a vérzés okozta hemodinamikai megingás, sokk, következményes iszkémia, miokardiális infarktus is szerepet játszik, másrészt a tromboembóliának (TE) a vérzés miatt felfüggesztett antitrombotikus terápia következtében fellépő szövődményei is hozzájárulnak.
A hangsúly a GIT-vérzés endoszkópos ellátásán van, de már az endoszkópia előtt meg kell kezdeni a beteg stabilizálását folyadékpótlással, szükség esetén transzfúzióval, mérlegelnünk kell az antikoaguláns hatás felfüggesztését, és meg kell határoznunk az endoszkópia biztonságos elvégzésének időpontját. A vizsgálat után a vérzéscsillapítás eredményességének, az újravérzés és a TE kockázatának figyelembevételével döntenünk kell az antitrombotikus kezelés folytatásáról (6).
A gasztrointesztinális vérzés kockázata antikoaguláns-kezelés során
A GIT-vérzés előfordulása véralvadásgátló-kezelés mellett évente mintegy 1,5-5%-ra tehető (7). A leggyakrabban alkalmazott K-vitamin-antagonista (vitamin K antagonist, VKA) warfarin háromszoros kockázatot jelent GIT-vérzés tekintetében az átlagos populációhoz viszonyítva (8). A direkt hatású orális antikoagulánsok (direct acting oral anticoagulant, DOAC) a warfarinhoz képest nagyobb eséllyel okoznak súlyos GIT-vérzést pitvarfibrillációban (PF) (RR: 1,25) (9). A dabigatran 150 mg-os napi dózisa 50%-kal emelte a súlyos GIT-vérzés relatív rizikóját (10). Rivaroxaban szedése mellett a betegek 3,15%-ában alakult ki súlyos vérzés, míg a warfarint szedőkben csak 2,16%-ban (p<0,001) (11). Edoxaban mellett szintén több vérzést észleltek, mint a warfarin esetében, igaz, csak a nagyobbik, 60 mg-os dózis szedésénél (12). A képet árnyalja Abraham és munkatársai tanulmánya, amelyben a 65 év alatti betegeknél kisebb, a 65 év felettieknél magasabb GIT-vérzés-rizikót tapasztaltak DOAC-szedésnél a warfarinhoz viszonyítva. 65 év alatt a kockázati arány (hazard ratio, HR) 0,79 (dabigatran) és 0,93 (rivaroxaban) volt, míg 65 év felett 2,49 (dabigatran), 2,91 (rivaroxabanszedés PF-ben), illetve 4,58 (rivaroxabanszedés PF nélkül) volt (13). Egyedül az apixaban mellett volt kevesebb GIT-vérzés a warfarinhoz és az összes többi DOAC-hoz képest is (14, 15). DOAC szedésekor magasabb hatóanyagszinttel és így fokozott vérzésrizikóval kell számolni krónikus vesebetegségben (GFR 2,5. A legtöbb irányelv protrombinkomplex-koncentrátum (prothrombin complex concentrate, PCC) adását javasolja első helyen, és csak másodvonalban friss, fagyasztott plazma (fresh frozen plasma, FFP) és/vagy K-vitamin alkalmazását. A PCC gyorsan bevethető, 30 percen belüli a hatáskezdete, állandó a faktorkoncentrációja, és nem okoz volumenterhelést, ellentétben az FFP-vel. Ajánlott dózisa INR-től függően 25-50 E/testsúlykilogramm. A betegek nagyobb hányadában értek el PCC-vel hatékony vérzéscsillapítást az FFP-hez képest (72,4% vs. 65,4%), hamarabb jutott a beteg a terápiához (17,5 óra vs. 23,9 óra), rövidebb infúziós idővel (16 perc vs. 210 perc) és kisebb volumenterheléssel (103 vs. 870 ml) (20, 21). Karaca tanulmányában magasabb INR-értékről indulva (13,2 vs. 9,97) gyorsabban normalizálódott az INR PCC adása után, mint FFP adásakor (p=0,000), továbbá az endoszkópia során szignifikánsan kevesebb aktív vérzést észleltek (p=0,008) (22). A K-vitamin fokozza a K-vitamin-dependens véralvadási (II., VII., IX., X.) faktorok termelődését, de intravénásan adva is csak 4-6 óra múlva kezd el hatni. A maximális hatáskifejtés akár 36 órába is telhet, ezért súlyos vérzésben PCC vagy FFP adása javasolt elsősorban. Kiegészítő terápiaként számos szakmai szervezet javasolja, ugyanakkor adásakor figyelembe kell venni, hogy az ismételt warfarinterápia beállítását megnehezíti és a kórházi tartózkodás idejét megnyújthatja (23). Az Amerikai Gasztroenterológiai Kollégium (American College of Gastroenterology, ACG) éppen ezért csak akkor javasolja K-vitamin adását VKA okozta GIT-vérzésben, ha hosszabb időre, legalább 2-4 hétre fel akarják függeszteni a warfarin hatását, vagy eleve el akarják hagyni (24).
Az antikoaguláns-kezelés felfüggesztése DOAC esetén
A VKA-kal ellentétben DOAC-ok esetén az antikoaguláns hatás ellenőrzése nehézkes. Az INR mérése helyett a direkt X. faktor-inhibitor meghatározása vagy a rotációs tromboelasztometria (ROTEM vagy ClotPro) vizsgálat jön szóba, de ezek kevés helyen elérhetőek. GIT-vérzés esetén elégséges lehet a DOAC-kezelés megszakítása, mivel (a fentebb említett veszélyeztető állapotok hiányában) elhagyásuk után 12-24 órán belül megszűnik a hatásuk, így hatássemlegesítés valószínűleg nem szükséges. Ha maximum 2-3 óra telt el az utolsó dózis bevétele után, aktív szén bevétele csökkentheti a maximális antikoaguláns hatás kialakulását. Súlyos, életet veszélyeztető vérzésben azonban specifikus antidótumok (dabigatran, apixaban, rivaroxaban esetében elérhetőek), vagy ezek hiányában PCC adása indokolt lehet. Utóbbi javasolt dózisa DOAC-ok esetén 50 E/testsúlykilogramm. Edoxaban esetén nincs antidótum, itt csak PCC adása jöhet szóba. Az Amerikai Hematológiai Társaság és az Amerikai Kardiológiai Társaság is 5 g idarucizumab intravénás adását javasolja a dabigatran hatásának felfüggesztésére, illetve andexanet alkalmazását rivaroxaban és apixaban okozta súlyos GIT-vérzésben. Utóbbi dózisa függ a DOAC dózisától és az utolsó dózis bevétele óta eltelt időtől is. A specifikus DOAC-ellenszerek hozzáférhetőségét, alkalmazását akadályozza a magas áruk. Jelenleg a Magyarországon is kapható idarucizumab beadandó dózisának ára kb. 750 ezer Ft (szabadáras), a nálunk nem elérhető andexanet dózistól függően kb. 9,7-19,4 millió Ft (!), bár egy tanulmány szerint az átlagos költség betegenként „csak” 8,5 millió forintnyi dollárba kerül. Folyamatban van és a II. fázisban tart egy általános DOAC-antidótum, a ciraparantag kifejlesztése (23).
A ReverseAD-tanulmányban az 5 g idarucizumab intravénás adása 100%-ban felfüggesztette a dabigatran hatását az ecarinalvadási idő és a hígított trombinidő alapján. Ahol mérni tudták, a vérzés átlagosan 2,5 óra alatt állt el (25). Az ANNEXA-4-vizsgálatban az andexanet a X. faktor elleni aktivitást 92%-kal csökkentette az apixaban és a rivaroxaban esetében is. A betegek 82%-ában észleltek jó vagy kiváló haemostasist (26).
A PCC hatását DOAC esetén jóval kevesebben vizsgálták a VKA-hoz képest. PCC-kezelés után a szövődményeket illetően többnyire nem találtak különbséget a warfarin és a DOAC okozta vérzés ellátása során (TE, mortalitás, kórházi tartózkodás ideje), kivéve az újravérzést, ahol az egyik vizsgálat a DOAC esetében szignifikánsan több GIT-vérzést észlelt (18,9%, míg VKA-kezeltekben 8,8%) (27, 28).
Az FFP-t a DOAC hatásának felfüggesztésére egyáltalán nem javasolják, ázsiai, európai és amerikai irányelvek
sem tartalmazzák mint választható lehetőséget. A PCC faktortartalma többszöröse a plazmáénak, 17-25 percen belül beadható, az infúzió beadása hétszer gyorsabb, és volumenterhelést sem okoz (23).
A TAG felfüggesztése gasztrointesztinális vérzésben
Az ASA-szedés felfüggesztését nem javasolják GIT-vérzésben, különösen alacsony újravérzés- és magas TE-rizikó esetén a mortalitás megnövekedett kockázata miatt (24). Az ASA hatása ugyanis annak kihagyása után is érvényesül az első 1-2 napon (a tromboxánszintézis 7-10 nap múlva normalizálódik teljesen, de már 3 nap múlva 70%-os thrombocytafunkció mérhető). Ha a vérzés ellátása után azonnal újraindítják az ASA-t, a hatása már akkor érvényesül, mielőtt a felfüggesztés következtében az eredeti ASA-hatás elmúlt volna, így a szer kihagyásának nincs különösebb hatása a vérzésre. Más a helyzet, ha a vérzésforrás nem azonosítható, az újravérzés rizikója fokozott, vagy nem ASA típusú TAG-ot alkalmaznak. Ilyenkor a TAG felfüggesztése javasolt 3-7 napig (5).
Az ASA-szedés folytatása a vérzés megszüntetése után több előnnyel jár, mint hátránnyal: az összmortalitás csökken (HR: 0,2), az újravérzés aránya nem magas (HR: 1,9) és a vérzés nem súlyos az ASA-t szedők között, míg a kezelést abbahagyók között a kardiovaszkuláris eredetű halálozás jelentősen nő (HR: 6,8) (29, 30).
Megfontolandó a clopidogrel és az újabb P2Y12-inhibitorok átváltása ASA-ra, vagy az ASA dózisának csökkentése. Fokozott a TE rizikója gyógyszerkibocsátó stent vagy fém koronáriasztent behelyezése után 12, illetve 1 hónapon belül. Ilyenkor kettős TAG alkalmazása meghatározott ideig mindenképpen indokolt. Kettős TAG melletti GIT-vérzés esetén az ASA szedésének folytatása javasolt, a második gyógyszer szedését azonban átmenetileg fel kell függeszteni. Korai endoszkópos vérzéscsillapítás után kardiológiai konzultáció szükséges az antitrombotikus kezelés folytatásáról (pl. a kettős TAG helyett csak ASA adása, esetleg ticagrelor/prasugrel lecserélése clopidogrelre) (1. ábra). Protonpumpagátló (proton pump inhibitor, PPI) szedése is javasolt, amely a TAG melletti GIT-vérzés rizikóját jelentősen csökkenti (2).
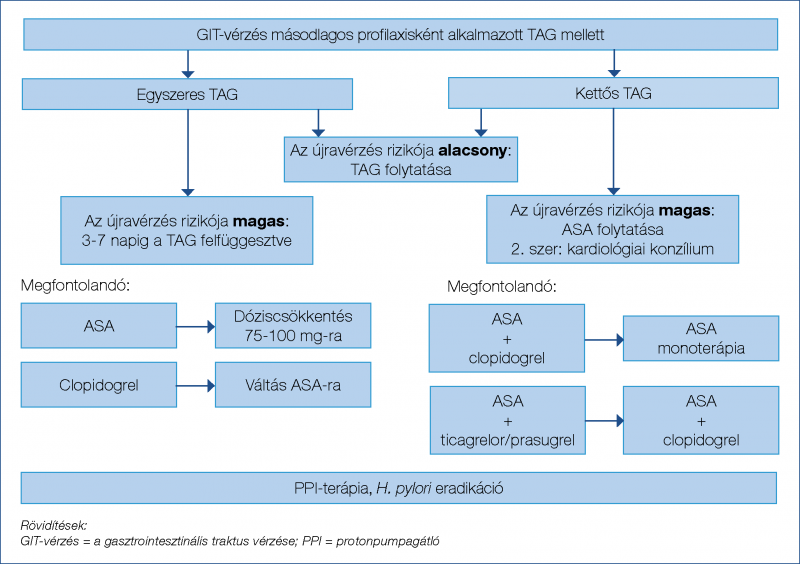
A thrombocytaaggregáció-gátlás melletti súlyos GIT-vérzés esetén a korábbi irányelvek a szer szedésének abbahagyásán kívül még thrombocytatranszfúziót is tartalmaztak, azonban a TE és a mortalitás fokozott rizikója (OR: 1,35, illetve 5,57) miatt ezt már nem javasolják normál thrombocytaszám esetén (31).
Az endoszkópia időzítése gasztrointesztinális vérzésben
Az Amerikai Gasztrointesztinális Endoszkópia Társaság (American Society of Gastrointestinal Endoscopy, ASGE) és az ACG VKA-hoz társult GIT-vérzésben haladéktalan endoszkópos vérzéscsillapítást javasol INR <2,5 esetén, míg 2,5 feletti INR-nél a warfarin hatásának felfüggesztését, akár már az endoszkópia előtt megkezdve (32, 33). A legtöbb szakmai társaság a 24 órán belüli endoszkópiát javasolja felső és alsó, súlyos GIT-vérzésben egyaránt. Lau és munkatársai vizsgálata alapján a hat órán belüli sürgős felső tápcsatornai endoszkópiának nincs előnye a 6-24 órán belüli korai beavatkozáshoz képest a 30 napon belüli mortalitás (8,9% a sürgős, 6,6% a korai csoportban) és újravérzés tekintetében (sürgős endoszkópia után: 10,9%, korai endoszkópia után: 7,8%) súlyos, Glasgow–Blatchford Score (GBS) 12 pont feletti GIT-vérzésben (34). Kevesebb vérző fekélyt vagy ércsonkot találtak (korai: 47,8%, sürgős: 66,4%), és kevesebb vérzéscsillapításra volt szükség a korai endoszkópia során a 6 órán belül elvégzett vizsgálathoz képest (korai: 48,4%, sürgős: 60,1%). Mivel a tanulmányban a kezdeti terápiára nem reagáló, hipotenziós sokkos betegeket (<5%) kizárták, az ACG 2021-es irányelve az ilyen betegek részére továbbra is sürgős endoszkópos vagy radiológiai intervenciót javasol (35). Általános elvként javasolható, hogy a sürgős endoszkópia előtt kezdődjön meg a beteg állapotának stabilizálása, szükség esetén az antikoaguláns szer hatásának felfüggesztése és a beteg transzfundálása.
Az antikoaguláns-kezelés folytatása vérzéscsillapítás után
A GIT-vérzés endoszkópos vérzéscsillapítása után az antitrombotikus kezelés visszaállításának dilemmája kiváló alkalom a TAG- vagy antikoaguláns-kezelés indikációjának felülbírálatára, esetleges elhagyásuk megfontolására, például paroxizmális PF, posztoperatív profilaktikus antikoaguláció, akut szívizominfarktus utáni antikoaguláns-kezelés (bal kamrai thrombus nélkül) esetén (23). Felső GIT-vérzés után a primer profilaxisként alkalmazott ASA szedését nem javasolják. Ha mindenképpen folytatni kell az antitrombotikus kezelés valamelyik formáját, együttesen kell mérlegelnünk a TE (1. táblázat) és az újravérzés kockázatát (5).
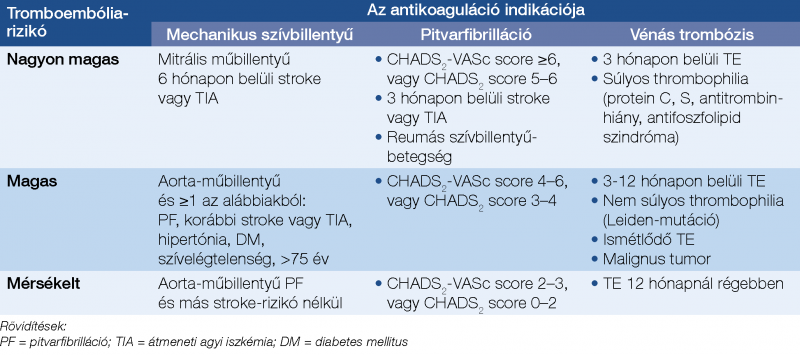
A PF-fel kapcsolatos TE-rizikó felméréséhez a CHADS2 vagy CHADS2-VASc score-t használjuk (2. táblázat) (36).
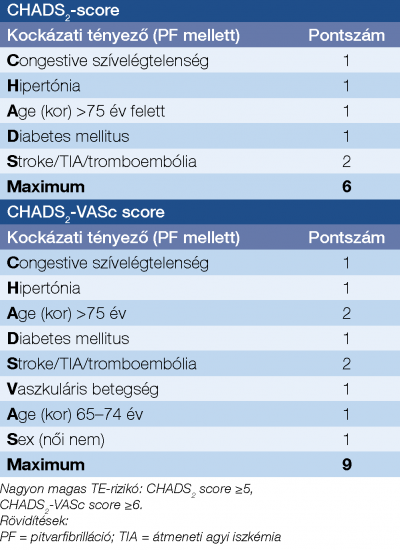
Utóbbi az életkort két részre bontva tartalmazza, illetve belekerült az érbetegség és a női nem mint önálló rizikótényező. A vérzés kockázatát PF-ben a HAS-BLED score alapján becsüljük meg, függetlenül az antikoaguláns szer típusától (VKA vagy DOAC), bár labilis INR-rel elősorban VKA-terápia során számolhatunk (3. táblázat) (37).
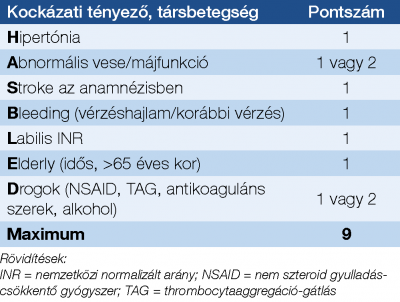
kockázatának felmérése pitvarfibrillációban
(HAS-BLED score) (37)
Az újravérzés rizikója magas ≥3 pont esetén.
A három hónapon belül ismétlődő GIT-vérzés kockázata kétszeres ≥3 pont esetén, ilyenkor az egy éven belüli mortalitás is jelentősen magasabb (5). Általánosabb, és a felső GIT-vérzés ellátása során végzett endoszkópia eredményét is figyelembe veszi a Rockall-pontrendszer. Legalább 5 pont esetén mind az újravérzés, mind a mortalitás aránya jelentősen megnő, további pontszámoknál meredeken emelkedik (4. táblázat) (38).
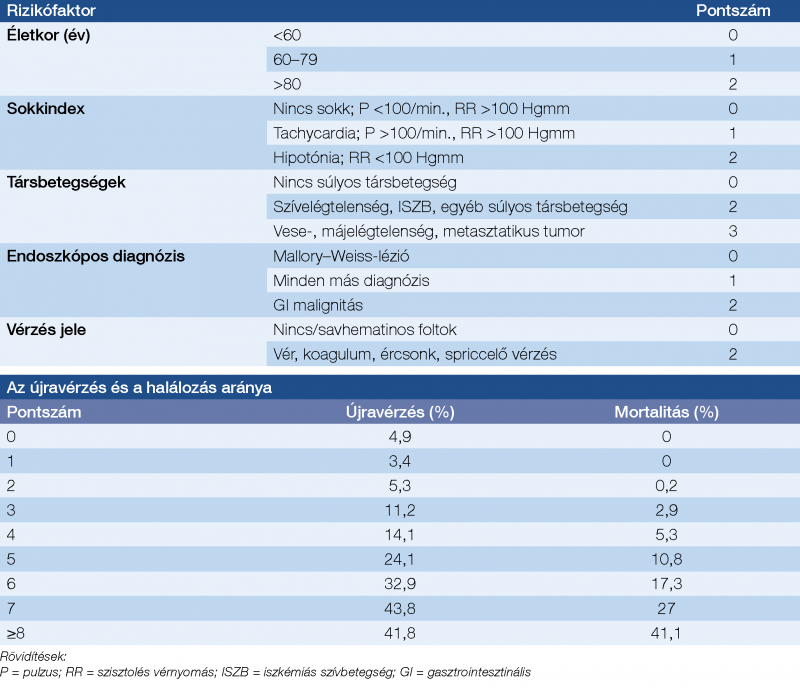
Vérző, ércsonkot vagy koagulumot tartalmazó (Forrest I/a–II/b) fekélyek esetén az újravérzés esélye nagyobb, ezek az endoszkópos vérzéscsillapítás után is fokozott obszervációt igényelnek, nagy dózisú PPI intravénás adása mellett.
Qureshi és munkatársai tanulmánya, de más vizsgálatok eredményei alapján is úgy tűnik, hogy a GIT-vérzés megszűnése utáni antikoaguláns-kezelés folytatása jelentősen csökkenti mind a TE (HR: 0,71), mind a mortalitás rizikóját (HR: 0,67), ugyanakkor az ismételt GIT-vérzés kockázata csak minimálisan növekszik (HR: 1,18). A halálozás a warfarin nélküli csoportban négyszeres volt (TE következtében), míg a warfarint újra szedő betegek közül csak egy halt meg (GIT-vérzés miatt) (39). A warfarint 7 napon belül visszaadva észlelték a legalacsonyabb mortalitást, de az újravérzés aránya ekkor kétszeres volt azokkal összehasonlítva, akik a 7. nap után kapták vissza a warfarint. Ezt tapasztalták Witt és munkatársai is, amikor a warfarint a vérzés után egy héten belül adták vissza a betegeknek, az ismétlődő GIT-vérzés aránya kétszeres volt azokhoz képest, akik később kezdték újra szedni az antikoagulánst (12,4% vs. 6,23%; p=0,03) (40). A TE-re és a mortalitásra gyakorolt jótékony hatást a TAG egyedüli vagy antikoagulánssal kombinált alkalmazásával, illetve a DOAC-okkal kapcsolatban is igazolták (41, 42).
Mivel a véralvadásgátlás korai, 7 napon belüli visszaállítása kétszeres GIT-vérzés rizikóval jár, és a TE események többnyire 7 nap után fordulnak elő, az antikoaguláns terápia visszaállítása a vérzés megszűnte utáni hetedik naptól javasolható (5). Nagyon magas TE-rizikó esetén a vérzés ellátása után 2-3 napon belül profilaktikus, majd terápiás dózisú alacsony molekulasúlyú heparin (low molecular weight heparin, LMWH) adása megfontolandó (2. ábra) (5).
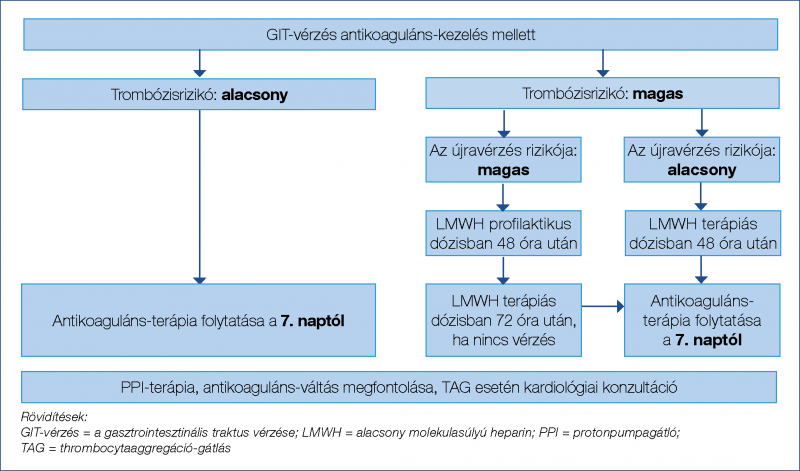
Amerikai kardiológus- és gasztroenterológus-társaságok alacsony vérzésrizikó esetén mind a warfarin, mind a DOAC-ok esetében a koraibb, 4-7 napon belüli, sőt stabil állapotú betegben nagyon magas TE-rizikó esetén akár a vérzéscsillapítás utáni, azonnali visszaállítást szorgalmazzák (23). Warfarin mellett bekövetkező GIT-vérzés esetén szorosabb INR-ellenőrzésre kell törekednünk, vagy megfontolhatjuk az apixabanra váltást, amely mellett a leg-
alacsonyabb a GIT-vérzés kialakulásának kockázata. Direkt hatású orális antikoagulánsok szedése mellett kialakuló GIT-vérzés esetén válthatunk warfarinra vagy szintén apixabanra. Ha a vérzés apixabanterápia alatt alakul ki, warfarinra váltás jön szóba szoros INR-ellenőrzéssel, vagy csökkenthetjük az apixaban dózisát 2×2,5 mg-ra (5). Egyidejű TAG esetén konzultáljunk kardiológussal a kettős antitrombotikus kezelés szükségességéről. Helicobacter pylori pozitivitás esetén eradikáció, illetve ettől függetlenül is savcsökkentő kezelés (PPI) adása indokolt.
Összefoglalás
Az antitrombotikus (antikoaguláns és TAG) terápia mellett bekövetkező GIT-vérzés ellátása a kezelésben részesülő betegek egyre növekvő száma, az idős betegek arányának emelkedése, a lehetséges súlyos kísérőbetegségek jelenléte miatt egyre fokozódó egészségügyi és anyagi terhet jelent. A kezelésben lényeges szempont a korai endoszkópia időzítése (6-24 órán belül). Súlyos, életet veszélyeztető vérzésben szükséges lehet az antikoaguláns szerek hatásának felfüggesztése. A VKA esetében PCC, másodvonalban FFP javasolt, DOAC esetében specifikus antidótum, vagy ennek hiányában szintén PCC javasolható. Az ASA-t kontrollálható vérzésben nem szükséges kihagyni, de primer profilaxisként adása a továbbiakban nem javasolt. Kettős TAG és kellő indikáció fennállása esetén az ASA-t nem célszerű elhagyni, míg a második aggregációgátló adását ideiglenesen fel kell függeszteni. Az antikoaguláns- és a TAG-kezelés a TE megelőzésében GIT-vérzés esetén is létfontosságú, annak megszűnése után újraindításuk indokolt. Az ismételt vérzés fokozott kockázata miatt azonban az időzítés kérdése szintén kiemelt jelentőségű. A mérlegelésnél figyelembe kell venni a TE és az újravérzés kockázatát, meg kell győződni a sikeres vérzéscsillapításról (akár ismételt endoszkópiával), a beteg stabil hemodinamikai állapotáról. A legtöbb szakmai irányelv a véralvadásgátlók 4-7 napon belüli újrakezdését javasolja alacsony vérzésrizikó, míg 7 nap után magas kockázat esetén (43).
https://doi.org/10.1111/j.1365-2036.2006.02759.x
2. Lanas A, Lasfuentes PC, Arguedas Y, et al. Risk of upper and lower gastrointestinal bleeding in patients taking nonsteroidal anti-inflammatory drugs, antiplatelet agents, or anticoagulants. Clin Gastroenterol Hepatol 2015; 13: 906–912.
https://doi.org/10.1016/j.cgh.2014.11.007
3. Sadeghi A, Zali MR, Shalmani HM, et al. An algorithmic approach to gastrointestinal bleeding in patients receiving antithrombotic agents. Gastroenterol Hepatol Bed Bench 2020; 13: S8–S17.
4. Pipilis A, Makrygiannis S, Chrisanthopoulou E, et al. Gastrointestinal bleeding in patients receiving antiplatelet and anticoagulant therapy: practical guidance for restarting therapy and avoiding recurrences. Hellenic J Cardiol 2014; 55: 499–509.
5. Scott MJ, Veitch A, Thachil J. Reintroduction of anti-thrombotic therapy after a gastrointestinal haemorrhage: if and when? Br J Haematol 2017; 177: 185–197.
https://doi.org/10.1111/bjh.14599
6. Kyaw MH, Chan FKL. Managing Antithrombotic Agents in the Setting of Acute Gastrointestinal Bleeding. Gastrointest Endosc Clin N Am 2018; 28: 351–361.
https://doi.org/10.1016/j.giec.2018.02.007
7. Deutsch D, Boustiere C, Ferrari E, et al. Direct oral anticoagulants and digestive bleeding: therapeutic management and preventive measures. Ther Adv Gastroenterol 2017; 10: 495–505.
https://doi.org/10.1177/1756283X17702092
8. Radaelli F, Dentali F, Repici A, et al. Management of anticoagulation in patients with acute gastrointestinal bleeding. Dig Liver Dis 2015; 47: 621–627.
https://doi.org/10.1016/j.dld.2015.03.029.
9. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014; 383: 955–962. https://doi.org/10.1016/S0140-6736(13)62343-0.
10. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139–1151. https://doi.org/10.1056/NEJMoa0905561.
11. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in non-valvular atrial fibrillation. N Engl J Med 2011; 365: 883–891. https://doi.org/10.1056/NEJMoa1009638.
12. Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369: 2093–2104. https://doi.org/10.1056/NEJMoa1310907.
13. Abraham NS, Singh S, Alexander GC, et al. Comparative risk of gastrointestinal bleeding with dabigatran, rivaroxaban, and warfarin: population based cohort study. BMJ 2015; 350: h1857. https://doi.org/10.1136/bmj.h1857.
14. Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981–992. https://doi.org/10.1056/NEJMoa1107039.
15. Ray WA, Chung CP, Murray KT, et al. Association of oral anticoagulants and proton pump inhibitor cotherapy with hospitalization for upper gastrointestinal tract bleeding. JAMA 2018; 320: 2221–2230. https://doi.org/10.1001/jama.2018.17242.
16. McQuaid KR, Laine L. Systematic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. Am J Med 2006; 119: 624–638. https://doi.org/10.1016/j.amjmed.2005.10.039.
17. Alli O, Smith C, Hoffman M, et al. Incidence, predictors, and outcomes of gastrointestinal bleeding in patients on dual antiplatelet therapy with aspirin and clopidogrel. J Clin Gastroenterol 2011; 45: 410–414. https://doi.org/10.1097/MCG.0b013e3181faec3c.
18. Wiviott SD, Braunwald E, McCabe CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 1893–1902.
19. Wallentin L, Becker RC, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045–1057. https://doi.org/10.1056/NEJMoa0904327.
20. Sarode R, Milling TJ Jr, Refaai MA, et al. Efficacy and safety of a 4-factor prothrombin complex concentrate in patients on vitamin K antagonists presenting with major bleeding: a randomized, plasma-controlled, phase IIIb study. Circulation 2013; 128: 1234–1243. https://doi.org/10.1161/CIRCULATIONAHA.113.002283.
21. Refaai MA, Kothari TH, Straub S, et al. Four-factor prothrombin complex concentrate reduces time to procedure in vitamin K antagonist-treated patients experiencing gastrointestinal bleeding: a post hoc analysis of two randomized controlled trials. Emerg Med Int 2017; 2017: 8024356. https://doi.org/10.1155/2017/8024356.
22. Karaca MA, Erbil B, Ozmen MM. Use and effectiveness of prothrombin complex concentrates vs. fresh frozen plasma in gastrointestinal hemorrhage due to warfarin usage in the ED. Am J Emerg Med 2014; 32: 660–664. https://doi.org/10.1016/j.ajem.2014.02.016.
23. Milling TJ, Refaai MA, Sengupta N. Anticoagulant Reversal in Gastrointestinal Bleeding: Review of Treatment Guidelines. Dig Dis Sci 2021; 66: 3698–3714. https://doi.org/10.1007/s10620-020-06728-y.
24. Abraham NS, Barkun AN, Sauer BG, et al. American College of Gastroenterology-Canadian Association of Gastroenterology Clinical Practice Guideline: Management of Anticoagulants and Antiplatelets During Acute Gastrointestinal Bleeding and the Periendoscopic Period. J Can Assoc Gastroenterol 2022; 5: 100–101. https://doi.org/10.1093/jcag/gwac010.
25. Pollack CV Jr, Reilly PA, van Ryn J, et al. Idarucizumab for dabigatran reversal – full cohort analysis. N Engl J Med 2017; 377: 431–441. https://doi.org/10.1056/NEJMoa1707278.
26. Connolly SJ, Crowther M, Eikelboom JW, et al. Full study report of andexanet alfa for bleeding associated with factor Xa inhibitors. N Engl J Med 2019; 380: 1326–1335. https://doi.org/10.1056/NEJMoa1814051.
27. Arachchillage DRJ, Alavian S, Grifn J, et al. Efficacy and safety of prothrombin complex concentrate in patients treated with rivaroxaban or apixaban compared to warfarin presenting with major bleeding. Br J Haematol 2018; 184: 808–816. https://doi.org/10.1111/bjh.15705.
28. Muller M, Eastline J, Nagler M, et al. Application of prothrombin complex concentrate for reversal of direct oral anticoagulants in clinical practice: indications, patient characteristics and clinical outcomes compared to reversal of vitamin K antagonists. Scand J Trauma Resusc Emerg Med 2019; 27: 48. https://doi.org/10.1186/s13049-019-0625-3.
29. Sung JJY, Lau JYW, Ching JYL, et al. Continuation of low-dose aspirin therapy in peptic ulcer bleeding: a randomized trial. Ann Intern Med 2010; 152: 1–9. https://doi.org/10.7326/0003-4819-152-1-201001050-00179.
30. Derogar M, Sandblom G, Lundell L, et al. Discontinuation of low-dose aspirin therapy after peptic ulcer bleeding increases risk of death and acute cardiovascular events. Clin Gastroenterol and Hepatol 2013; 11: 38–42. https://doi.org/10.1016/j.cgh.2012.08.034.
31. Zakko L, Rustagi T, Douglas M, et al. No Benefit From Platelet Transfusion for Gastrointestinal Bleeding in Patients Taking Antiplatelet Agents. Clin Gastroenterol Hepatol 2017; 15: 46–52. https://doi.org/10.1016/j.cgh.2016.07.017.
32. Acosta RD, Abraham NS, Chandrasekhara V, et al. ASGE Standards of Practice Committee: the management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc 2016; 83: 3–16. https://doi.org/10.1016/j.gie.2015.09.035.
33. Strate LL, Gralnek IM. ACG clinical guideline: management of patients with acute lower gastrointestinal bleeding. Am J Gastroenterol 2016; 111: 755. https://doi.org/10.1038/ajg.2016.155.
34. Lau JYW, Yu Y, Tang RSY, et al. Timing of endoscopy for acute upper gastrointestinal bleeding. N Engl J Med 2020; 382: 1299–1308. https://doi.org/10.1056/NEJMoa1912484.
35. Laine L, Barkun AN, Saltzman JR, et al. ACG Clinical Guideline: Upper Gastrointestinal and Ulcer Bleeding. Am J Gastroenterol 2021; 116: 899–917. https://doi.org/10.14309/ajg.0000000000001245.
36. Csanádi Z. Risk of thromboembolism in atrial fibrillation. Orv Hetil 2016; 157: 1511–1515.
37. Pisters R, Lane DA, Nieuwlaat R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138: 1093–100. https://doi.org/10.1378/chest.10-0134.
38. Rockall TA, Logan RF, Devlin HB, et al. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996; 38: 316–21. https://doi.org/10.1136/gut.38.3.316.
39. Qureshi W, Mittal C, Patsias I, et al. Restarting anticoagulation and outcomes after major gastrointestinal bleeding in atrial fibrillation. Am J Cardiol 2014; 113: 662–668. https://doi.org/10.1016/j.amjcard.2013.10.044.
40. Witt DM, Delate T, Garcia DA, et al. Risk of thromboembolism, recurrent hemorrhage, and death after warfarin therapy interruption for gastrointestinal tract bleeding. Arch Intern Med 2012; 172: 1484–1491. https://doi.org/10.1001/archinternmed.2012.4261.
41. Staerk L, Lip GYH, Olesen JB, et al. Stroke and recurrent haemorrhage associated with antithrombotic treatment after gastrointestinal bleeding in patients with atrial fibrillation: nationwide cohort study. BMJ 2015; 351: h5876. https://doi.org/10.1136/bmj.h5876.
42. Sengupta N, Feuerstein JD, Patwardhan VR, et al. The risks of thromboembolism vs. recurrent gastrointestinal bleeding after interruption of systemic anticoagulation in hospitalized inpatients with gastrointestinal bleeding: a prospective study. Am J Gastroenterol 2015; 110: 328–335. https://doi.org/10.1038/ajg.2014.398.
43. Gralnek IM, Stanley AJ, Morris AJ, et al. Endoscopic diagnosis and management of nonvariceal upper gastrointestinal hemorrhage (NVUGIH): European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2021. Endoscopy 2021; 53: 300–332. https://doi.org/10.1055/a-1369-5274.
