Reviews
Hepatic encephalopathy
Summary
This is a review article on hepatic encephalopathy, a frequent complication of advanced chronic liver disease, summarizing several clinical, diagnostic and management issues. The spectrum of this potentially reversible central nervous system disturbance extends from subclinical malfunctions to hepatic coma and may present in neurological and/or psychiatric manifestations. It is associated with a reduced quality of life, life-expectancy, and a huge personal and societal burden for the individuals, their relatives and for the healthcare system. Several reviews and recommendations have been published on different aspects of its pathology and management. The pathology is not completely explored, no complete agreement on the classification and diagnosis, and the prevention and therapy are not completely solved. However, there is a wide consensus regarding its negative prognostic value as well as regarding importance of early recognition and early effective treatment of overt manifestations and precipitating conditions.
Ez az összefoglaló közlemény a krónikus májbetegségek előrehaladott stádiumában gyakran fellépő egyik súlyos komplikáció, a hepaticus encephalopathia klinikai jellemzőivel, diagnosztikájával, ellátásával foglalkozik. A potenciálisan reverzibilis állapot az érdemi klinikai tünettel nem járó működészavartól a májkómáig terjedő, széles skálán mozgó központi idegrendszeri működészavart jelent, a legkülönbözőbb neurológiai és/vagy pszichiátriai manifesztációkkal. Jelentősen rontja az életminőséget és az életkilátásokat, és mind az érintettek, mind a környezetükben élők, mind pedig az ellátórendszerek számára jelentős terhet jelent. A kórképpel és ellátásával kapcsolatban több szempontot megjelenítő összefoglalók és ajánlások láttak napvilágot. Patológiája nem teljesen ismert, nevezéktana és diagnosztikája nem teljesen egységes, megelőzése és terápiája nem teljesen megoldott. Abban viszont teljes a szakmai egyetértés, hogy megjelenése kedvezőtlen prognosztikai jel, fontos a korai felimerése, és elengedhetetlen a tünetekkel járó megjelenési formák és a kiváltó okok mielőbbi hatékony kezelése.
Bevezetés
A hepaticus encephalopathia (HE) leggyakrabban előrehaladott májbetegség eredményeként alakul ki, a májelégtelenség egyik, gyakran első megjelenési formája. Kialakulhat mind akut májkárosodás során, mind a májcirrózis végstádiumában. Ritkábban elsődleges májbetegség nélkül, egyéb okból (v. porta trombózisa, tumoros elzáródása) kialakuló portoszisztémás söntkeringés (PSSK) és portális hipertenzió (PHT) a kiváltó tényező. Bármelyik forma súlyosan rontja az egyén életminőségét, életkilátásait. Egyúttal jelentős terhet jelent a beteg számára, a beteg környezetében élőkre csakúgy, mint az ellátórendszerre. A problémakörrel kapcsolatban 2014-ben jelent meg átfogó európai és amerikai szakmai ajánlás, de az azóta felmerült új szempontok beépítésével az elmúlt három évben újabb nemzetközi ajánlások láttak napvilágot (1–10). Az interneten elérhető adatbázisokban 2004-ben jelent meg utoljára magyar nyelvű áttekintő közlemény HE témakörben (11). Ebben a közleményben csak az
EASL-ajánlásokat kiegészítő vagy azokban nem szereplő megállapításokra vonatkozó hivatkozásokat tüntették fel. A szerzők a közleményt nem szakmai ajánlásnak, hanem szakmai áttekintésnek szánják.
A kórkép rövid leírása
A hepaticus encephalopathia (HE) akut vagy krónikus májelégtelenség és/vagy portocavalis söntkeringés (PSK) talaján kialakuló, potenciálisan reverzibilis agyi működészavar a szubklinikustól a kómáig terjedő neurológiai és/vagy pszichiátriai megnyilvánulásokkal (3, 4, 10). Az Európai Májkutatási Társaság (EASL) legújabb ajánlása a nemzetközi delíriumajánlásra hivatkozva a definícióban az agyi működészavar (brain failure) kifejezés helyett az akut encephalopathia kifejezés használatát ajánlja (7). Ez utóbbi ajánlás szerint viszont az akut encephalopathia elnevezés acute-on-chronic májelégtelenségben (ACLF) nem javasolt a HE szinonimájaként, mert ilyen betegeknél a HE lehetősége mellett egyéb faktorok társulhatnak a tudatzavar kialakulásához. Ez a megállapítás persze alapvetően valamennyi májelégtelenségben kialakuló tudatzavarra igaz, és magunk – ha az állapot egyetlen oka az előrehaladott májelégtelenség – továbbra is a HE elnevezés általános használatát tartjuk észszerűnek.
Epidemiológia
A nyilvánvaló klinikai tünetekkel járó manifeszt HE prevalenciája a cirrózis, illetve a dekompenzált cirrózis első diagnózisa idején 10-15%, illetve 15–25% lehet, és a cirrózissal diagnosztizáltak 30-40%-ában alakul ki a betegség fennállása során. Gyakorisága különösen magas a májcirrózis egyes szövődményeinek fellépésekor (varixvérzés, spontán bakteriális peritonitis, szepszis). A nyilvánvaló tünetekkel nem járó, rejtett HE incidenciája és prevalenciája értelemszerűen csak becsülhető, egyes szerzők szerint cirrózisos betegek körében elérheti a 20-80%-ot.
Patomechanizmus
Számos patogenetikai faktor lehetősége merült fel, de a kórkép patofiziológiája továbbra sem pontosan tisztázott (12). Központi szerepe van az astrocyták károsodásának (swelling) és károsodott funkciójának, ami neuronális funkciózavarhoz vezet. A folyamatban igazoltan szerepük van a májsejtkárosodásban és a májban zajló gyulladásos folyamatokban részt vevő citokineknek, valamint a csökkent hepaticus detoxifikációnak, a különböző toxikus anyagok felszaporodásának. Hasonlóképpen igazolt a PHT miatt kialakuló kollaterálisok, a portocavalis söntök (PCSK) szerepe. Fontos patofiziológiai tényező a megváltozott bélfali permeabilitás és a megváltozott bélbaktérium-flóra (mikrobiom) is, amelyek hatására növekszik a toxikus és proinflammatorikus anyagok kínálata és keringésbe jutása egyaránt. Szintén igazolt az ammónia, a glutamin és más nitrogéntermékek metabolizmusának károsodása, az oxidatív/nitrozatív stressz, a mangánszint emelkedése a vérben és a mangán lerakódása az idegrendszerben, az inhibitoros neurotranszmitterek akkumulációja. Mindezek, és egyéb tényezők aktuális szerepének mértéke és aránya változhat – egyebek között a precipitáló tényezők függvényében.
Diagnózis
A HE diagnosztizálásához elkerülhetetlen a májműködés komplex felmérése részletes laboratóriumi (vérkép, hepatocelluláris és cholestaticus májenzimek, bilirubin, szintetikus májfunkciók, vesefunkciók, véralvadás, CH-háztartás, lipidek), képalkotó (UH, CT, MRI) és egyéb vizsgálatokkal (elasztográfia, nem invazív fibrózisvizsgálatok). Indokolt továbbá a májbetegség etiológiáját célzó vizsgálatok elvégzése is. Mindezek részletes ismertetése meghaladja a közlemény kereteit.
A klinikai tünetekkel járó (manifeszt, overt) HE diagnózisa részben az előrehaladott májbetegség és/vagy a söntkeringés kimutatásán, részben a potenciálisan hasonló tüneteket okozó egyéb betegségek kizárásán alapul (1. táblázat).
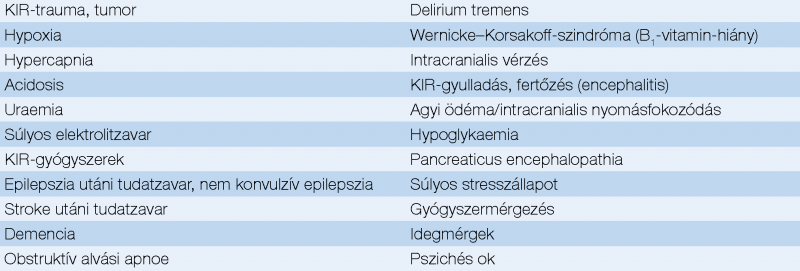
A kérdésben azonban az ajánlások nem egységesek. A legújabb francia ajánlás egyértelmű májelégtelenséget jelző klinikum és laboratóriumi eltérések esetén, a tudatzavar más kóreredetére utaló körülmény hiányában, a HE diagnózisának felállítása céljából nem tarja feltétlenül szükségesnek széles körű eszközös diagnosztika (EEG, MRI stb.) végzését, különösen ismételt epizód esetén (8). Ezek a vizsgálatok elsősorban egyéb okok kizárását szolgálják, és célirányosan elvégzendők nem típusos klinikai kép, más kóreredetre utaló anamnézis, vagy fizikális-laboratóriumi-eszközös vizsgálati eredmények, főként pedig normális ammóniaszint esetén. A magas ammóniaszint önmagában nem jelent HE-t, önmagában nem diagnosztikus, illetve az emelkedés mértéke nem jelzi a HE súlyosságát és várható kimenetelét sem. Ha azonban az értéke normális, a HE diagnózisa megkérdőjelezendő. Szükség lehet továbbá kiterjedt vizsgálatokra, ha a HE szokásos kezelése nem eredményez javulást. A neurológiai tünetek értékelésében esetenként neurológiai konzílium lehet indokolt – amelyre azonban a legtöbb esetben nincsen szükség.
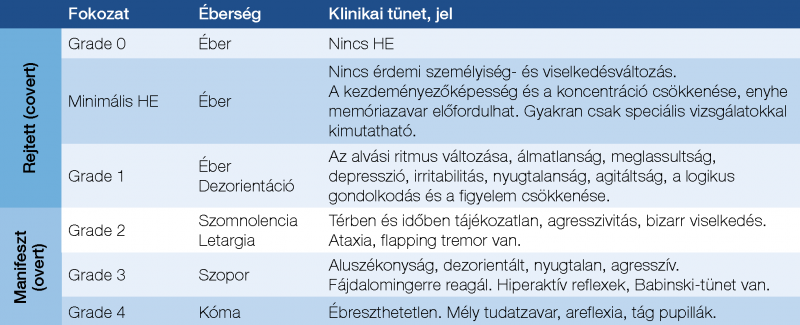
A manifeszt HE (WHK II–IV.) 2. táblázatban felsorolt nyilvánvaló jeleinek hiányában a rejtett HE felismeréséhez a pszichomotoros meglassultságra, az álmatlanságra, az alvás-ébrenlét ritmus megváltozására, az átmeneti dezorientációra, a beszédnehezítettségre vonatkozó célzott kérdések és vizsgálatok javasolhatók.
Utóbbiak közé tartozik a számösszekötési teszt A vagy B, a vonalkövetési teszt, a számjegy-szimbólum helyettesítési teszt, a szériapontozásos teszt, illetve az ezek kombinálásán alapuló pontrendszer. Hasznos, napjaink modern informatikai lehetőségein alapuló módszer az okostelefonokra letölthető Stroop teszt (EncephalApp, https://encephalapp.com/). A kórházi ágy mellett gyorsan és egyszerűen elvégezhető új, javasolt módszer az állatmegnevezési teszt. Az érintettnek egy perc alatt a lehető legtöbb állatfajtát kell felsorolnia. Az elvárás 15-20 állatfaj megnevezése. Speciális eszközt igényel, de megbízható módszer a kritikus felvillanási/fúziós frekvenciavizsgálat. Javasolt küszöbérték: 38 Hz. Terápiás tesztként laktulóz vagy rifaximin adható a szokásos terápiás dózisban és ideig. Nem alkalmasak a rejtett HE igazolására a különböző morfológiai vizsgálatok (CT, MRI), és nem tekinthető rutinnak az EEG-vizsgálat sem.
Osztályozás
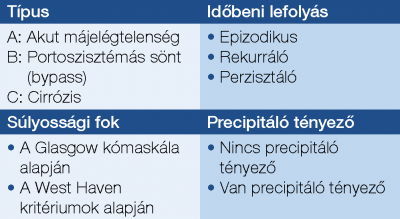
Az osztályozás négy fő szempont szerint történik: típus, súlyossági fok, időbeni lefolyás, és hogy precipitáló tényező jelen van vagy nincs (3. táblázat).
Típus
A: Akut májelégtelenséghez társuló HE. B: Portoszisztémás söntkeringés (bypass) miatt kialakuló HE. C: Cirrózis talaján kialakuló HE. A legújabb ajánlások nem tartják szükségesnek a májbetegség etiológiai tényezőjének megkülönböztetését HE esetén. Ugyanakkor az etiológia felderítése mind a kezelés, mind a megelőzés szempontjából indokolt.
Súlyosság
A HE súlyosságának osztályozására a West Haven kritériumok (WHK) (2. táblázat), míg a tudatállapot felmérésére általánosságban a Glasgow kómaskála (GCS) alkalmazandó. Utóbbi a szemnyitáson, a verbális válaszkészségen és a motoros válaszkészségen alapul. Kiterjedten alkalmazzák a tudatállapot megítélésére bármely eredetű kórképben, így alkalmazása indokolt WHK ≥2 HE-fokozatokban is.
Időbeni lefolyás
Epizodikus HE: elsőként vagy a rekurrens HE gyakoriságát el nem érő ismétlődéssel jelentkező, tehát ritkán fellépő, spontán vagy terápia hatására rendeződő HE. Rekurrens HE: ≥2 epizód jelentkezik 6 hónapon belül. Perzisztens HE: egy akut epizód után nem tér vissza az epizód előtti állapot, a betegnél a HE tünetei tartósan fennálnak.
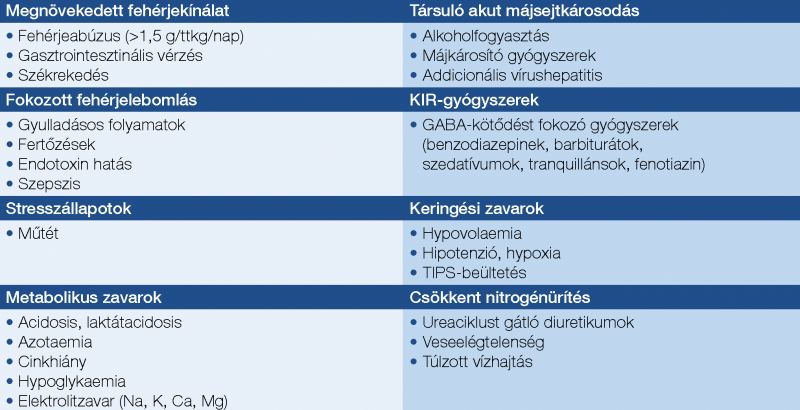
Precipitáló tényezők (4. táblázat)
A HE kialakulásához, manifesztálódásához, súlyosbodásához, rekurrálásához és perzisztálásához egyaránt hozzájárulhatnak. Ezért kutatásuk és kezelésük mind a prevenció, mind a terápia szempontjából fontos.
Megelőzés
Optimális a májbetegség kialakulásának megelőzése lenne, ha ez nem sikerül, a májkárosodás korai felismerése, annak oki kezelése, amellyel megelőzhetjük a súlyos májkárosodás, a májcirrózis kialakulását. Az oki terápia már kialakult májcirrózis esetén is alapvető fontosságú, megakadályozhatja a további progressziót, a szövődmények – így a HE – kialakulását is, sőt számos esetben – egyebek mellett például krónikus hepatitis-B- vagy -C-vírus-fertőzés esetén – a májműködés javulását, akár a kifejezett fibrózis regresszióját is eredményezheti.
Kiemelten fontos a HE hajlamosító tényezőinek (4. táblázat) megelőzése, adekvát kezelése, mivel a HE-esetek közel 90%-a rendezhető a kiváltó ok megszüntetésével. Kifejezetten ajánlott a benzodiazepinek és a protonpumpagátlók kerülése májcirrózisos betegeknél (8).
Primer profilaxis
A HE primer gyógyszeres profilaxisa általánosságban nem indokolt. Ez alól kivétel a gasztrointesztinális vérzés. A tápcsatornába került vér mielőbbi eltávolítására laktulóz, vagy más ozmotikus laxatívum, mint a mannitol vagy a polietilén-glikol lehet alkalmas (14, 15). Felvethető továbbá a primer gyógyszeres profilaxis indokoltsága olyan előrehaladott (dekompenzált) stádiumú májcirrózisos betegeknél is, akiknél a HE kialakulására egyéb, nem kellően kontrollálható hajlamosító tényező áll fenn (jelentős PHT-söntök, tartós elektrolitzavar, magas dózisú vízhajtóigény, visszatérő infekciók, jelentős sarcopenia, TIPS), de ezekre vonatkozóan nem állnak rendelkezésre egyértelmű evidenciák.
Szekunder profilaxis
Manifeszt HE epizód után a szekunder profilaxis kétségkívül szükséges. Elsőként ajánlott készítmény a laktulóz, amely szükség esetén rifaximinnel kombinálható (14, 15). A primer vagy szekunder gyógyszeres HE-profilaxis alatt álló betegeknél a májműködés javulása esetén egyénileg mérlegelendő annak esetleges csökkentése/elhagyása.
Kezelés
A kezelés részét képezi a megfelelő étrend és életmód kialakítása, valamint a gyógyszeres és nem gyógyszeres terápiás lehetőségek.
Étrend, életmód
A májcirrózisban, HE-ben ajánlott „túlzott fehérjebevitel kerülése”, nem azonos a fehérjeszegény étrenddel. Az alultáplálás, a következményes sarcopenia rossz prognosztikai faktor, növeli a szövődmények (fertőzések, vaszkuláris dekompenzáció, HE) kialakulásának kockázatát, és csökkenti a transzplantáció-mentes túlélést is. A májcirrózis katabolikus állapot, a máj glikogénraktárai csökkennek, az energiafelhasználásban a glükóz helyett a zsírsavak szerepe nő, a glükoneogenezishez szükséges aminosavak (fehérjék) – elsősorban az izmokból – mobilizálódnak, aminek izomtömegvesztés, funkcióromlás (sarcopenia) a következménye. A jelentős fehérjemegszorítás ezért kifejezetten hátrányos. Kivétel a súlyos HE-epizód, illetve a gasztrointesztinális vérzés utáni állapot, de ilyenkor is csak rövid ideig indokolt a korlátozás. Az ajánlott napi fehérjebevitel 1,2–1,5 g/ttkg (ascitesmentes testtömegre számolva), de egyes tanulmányokban napi 1,8 g/ttkg sem fokozta a HE kialakulásának a kockázatát. Kerülendők azonban az ennél is magasabb fehérjetartalmú, „abúzus” jellegű, extrém nagy étkezések.
Bár HE-ben a növényi eredetű fehérjék preferálása elméletileg előnyös, ugyanakkor az erre vonatkozó viszonylag kevés klinikai vizsgálat eredménye nem egyértelmű. Ráadásul problémát okozhat, hogy számos beteg nem kedveli és/vagy nem, vagy rosszul tolerálja a növényifehérje-tartalmú ételeket, ez pedig fehérje- és kalóriahiányos táplálkozáshoz vezethet. A vörös húsoknál kedvezőbb lehet a fehér húsok fogyasztása (baromfi, halak és más vízi állatok).
Figyelni kell a megfelelő kalóriabevitelre is, ez napi 35-40 kcal/ttkg legyen. Az éhezés kerülendő, napi többszöri (5-6-szori) étkezés, az éhomi periódusok lerövidítése javasolt. Célszerű a főétkezések között és elalvás előtt kisebb étkezések beiktatása.
Fontos a megfelelő mennyiségű folyadékbevitel. Nem ritka, hogy a beteg a vízretenció kialakulásától vagy annak fokozódásától tartva kevés folyadékot fogyaszt, ami hypovolaemiát, elektrolitzavarokat okozhat, vagy legalábbis hozzájárulhat ezek kialakulásához (15, 16).
Javasolt a vitaminok, ásványi anyagok, mikrotápanyagok hiányállapotainak felmérése, hiány esetén a pótlásuk.
Kifejezetten előnyös a megfelelő (nem extrém) rendszeres fizikai aktivitás és az erőnlét fenntartása.
Manifeszt HE epizódon átesetteknél és rejtett HE fennállása esetén egyaránt fontos a beteg (és a vele egy háztartásban élők) tájékoztatása a vezetéssel, balesetveszélyes tevékenységekkel/foglalkozással kapcsolatos kockázatokról. Az EASL azt ajánlja továbbá, hogy az ilyen állapotú egyéneknél történjen hivatalos, formális gépjárművezetői alkalmassági vizsgálat.
Gyógyszeres terápia
Mind a tünetekkel járó (manifeszt), mind a tünetekkel nem járó (rejtett) HE gyógyszeres kezelést tesz szükségessé. Ennek része a precipitáló faktorok keresése, hatékony kezelése is. Tekintettel az aspiráció és következményeinek kockázatára, a súlyos fokozatú (WHK ≥3) HE-ben szenvedő beteg kezelését kiemelt fekvőbeteg-ellátó egységben, preferáltan intenzív terápiás osztályon indokolt végezni (respiráció szükségessége esetén ez értelemszerű).
Nem felszívódó diszacharidok (laktulóz, laktit)
A laktulóz csökkenti a bél pH-ját, alacsonyabb pH-n az NH3-NH4 arány az utóbbi irányába tolódik el, amely nem jut át a bélfalon. Szintén csökkenti az ammónia felszívódását, és következményesen a vérszintjét az, hogy a laktulóz laxatív hatása révén csökkenti a béltranzitidőt. Ezzel nő a nitrogénürítés a székletben. Növeli továbbá a bélbaktériumok ammóniafelvételét, valamint csökkenti az ammóniumszintézisben szerepet játszó, ureáztermelő bélbaktériumok számát is. Magyarországon a laktulózt használjuk elősorban. A szájon át alkalmazható szirup dózisa egyéni toleranciától függ: napi 1-3-szor 1-3 evőkanál. A cél a napi két-háromszori laza széklet elérése. A relatív gyakori gasztrointesztinális mellékhatások (puffadás, hasmenés, hányinger, flatulentia) lehetnek alkalmazásának korlátai. Ha a beteg szájon át nem tudja bevenni, nasogastricus szondán keresztül vagy beöntés formájában is adható (1-3 liter 20%-os oldat formájában) (14, 15, 16).
Antibiotikumok
A nem felszívódó antibiotikumok az ureáztermelő bélbaktériumok számának csökkentése révén hatnak. A rifaximin széles spektrumú antibiotikum, minimális mennyiségben szívódik csak fel, mellékhatása alig van. A dózisa napi 2×550 mg vagy napi 3×400 mg (16, 17). A laktulóz-monoterápia nem kellő effektusa esetén azzal kombinálva, laktulózintolerancia esetén monoterápiában alkalmazható. A HE kezelésében a laktulóz + rifaximin kombináció a laktulóz-monoterápiánál hatékonyabbnak bizonyult, a kombinált kezelésben részesülők között csökkent a szepszissel kapcsolatba hozható halálozás is. A neomycin (Magyarországon nem forgalmazzák), a vancomycin és a metronidazol mellékhatásaik és toxicitásuk miatt csak alternatívaként jönnek szóba, hosszú távú kezelésre nem alkalmasak (14, 15, 16, 17). A májcirrózis kapcsán spontán bakteriális peritonitisepizód utáni rekurrencia megelőzésére a norfloxacin vagy trimetoprim/szulfametoxazol szekunder prevenciót használják. HE-prevenció vonatkozásában ezek nem szerepelnek az ajánlásokban.
L-ornithine L-aspartate (LOLA)
Májcirrózisban a glutamin-szintetáz és a karbomil-foszfát-szintetáz enzim működése is csökkent. A LOLA mindkét enzim működését serkenti, fokozza a glutaminszintézist a perivenosus hepatocytákban, a vázizmokban és a központi idegrendszerben, stimulálja az ureaszintézist a periportalis hepatocytákban, így csökkenti az ammóniaszintet, javítja a klinikai tüneteket és a pszichometriai paramétereket. Leírták a LOLA vázizomzatra gyakorolt kedvező hatását is. Hétnapos parenterális LOLA-kezelés után javult az izomanyagcsere, az izomműködés, és csökkent a katabolizmus (18). Megfigyelték a LOLA hepatoprotektív hatását is, amelynek magyarázata lehet az L-ornithine transzaminációjával képződő glutamát antioxidáns hatása, valamint az, hogy az L-ornithine-ből az ureaciklusban képződő, nagyobb mennyiségű L-arginine (amely a nitrogén-oxid-szintetáz [NOS] obligát szubsztrátja) a fokozott nitrogén-oxid- (NO-) termelődés révén javítja a mikroperfúziót a májban (19). A HE kezelésében a LOLA hatékonyabbnak bizonyult, mint a placebo, és hasonló hatékonyságú volt, mint a laktulóz vagy a rifaximin. A per os LOLA-kezelés különösen hatékonynak bizonyult MHE-ben. A LOLA biztonságos, hatékony és jól tolerálható kezelés, világszerte rutinszerűen alkalmazzák (az USA-t kivéve). Dózisa napi 3-4×5 gramm per os. A parenterális gyógyszerforma Magyarországon nincs forgalomban (14, 16, 18, 20, 21).
Albumin
A parenterális albuminpótlást régóta, széles körben alkalmazzák a májcirrózis és szövődményeinek kezelésében. Növeli a plazmavolument, javítja a mikrocirkulációt, megköti és így csökkenti az epesavak, számos citokin és egyéb toxikus anyagok vérszintjét. Egy vizsgálatban összehasonlították az albumin- (1,5 g/tskg/nap) és laktulózkezelés hatékonyságát a laktulóz-monoterápiával HE-ben. A kombinált kezelésben részesülők között szignifikánsan alacsonyabb volt a mortalitás, és csökkent a kórházi ápolás napok száma is (22). Egy 2019-ben publikált metaanalízis eredményei szerint a parenterális albuminkezelés (a különböző vizsgálatokban az albumin dózisa napi 5-250 g, medián 30-40 g/nap között változott) májcirrózisos betegekben csökkentette a HE incidenciáját, illetve csökkentette a HE-epizódok súlyosságát, javította a tüneteket. Az albuminkezelés – a HE kialakulásától függetlenül – csökkentette a cirrózisos betegek kórházi mortalitását is (23). Májcirrózisos betegekben a parenterális albuminkezelés hatékony a HE megelőzésére és kezelésére (14, 15, 22, 23).
A polietilén-glikol 3550 (PEG)
A PEG ismert, biztonságos, ozmotikus hashajtó készítmény. Klinikai vizsgálatokban a hatása gyorsabb volt, és a kórházi kezelés hossza is rövidebb volt, mint a laktulózzal kezelt kontrollcsoport esetében, de ezek az eredmények még megerősítésre szorulnak (14, 15).
Elágazó láncú aminosavak (branched-chain amino acids, BCAA)
Az elágazó láncú aminosavak (BCAA) terápiás alkalmazásának elméleti alapja, hogy májcirrózisban az elágazó láncú (BCAA) és az aromás (AAA) aminosavak egyensúlya megbomlik, az utóbbiak kerülnek túlsúlyba. Ezek pedig az agyi monoamin ingerületátvivő anyagok prekurzorai. Így felmerül, hogy ez az eltérés hozzájárulhat a HE kialakulásához. Ezentúl a csökkent BCAA-szint miatt csökkenhet a vázizmokban az ammónia-glutamin átalakulás. Klinikai vizsgálatokban azonban a BCAA-kezelés nem bizonyult hatékonyabbnak a laktulóznál, illetve a neomycinnél. Egy nemrég publikált prospektív multicentrikus klinikai vizsgálatban dekompenzált májcirrózisos betegeket kezeltek tartósan per os BCAA-kal. A betegek MELD- és Child–Pough-pontszáma javult, kevesebb HE-epizód fordult elő, mint a kontrollcsoportban, továbbá a kezelés előtt hypalbuminaemiás betegek albuminszintje nőtt. A BCCA-k alternatívát jelenthetnek a megfelelő fehérjebevitel biztosítására, különösen növényifehérje-diétán levő betegek esetében, azonban a kellemetlen íze problémát jelenthet (14, 15, 16).
Cink
A cink az ammóniadetoxifikációban részt vevő ureaciklus enzimeinek kofaktora, így felmerült, hogy a májcirrózisban gyakran észlelt cinkhiánynak szerepe lehet a HE kialakulásában. A cinkpótlás hatékonyságát azonban – eddig – igazolni nem sikerült.
Nem gyógyszeres terápia
Probiotikumok
A probiotikumok a bélflóra kedvező irányú megváltoztatása révén lehetnének alkalmasak a HE kezelésére. A klinikai vizsgálatok eddig egyértelműen nem igazolták hatékonyságukat (15, 16, 17).
Széklettranszplantáció
Az elmúlt 2-3 évtizedben ugrásszerűen nőttek az ismereteink a mikrobiom szerepéről, jelentőségéről a homeosztázisban. Számos kórállapotban írták le a mikrobiom változását, de az esetek jelentős részében a mai napig nem világos, hogy okról vagy következményről van-e szó. A bélmikrobióta változása, ennek patogenetikai szerepe májcirrózisban, HE-ben jól ismert, a bélflóra összetételének, funkciójának megváltoztatása a HE kezelésének egyik jelentős célpontja is. Egy klinikai vizsgálatban antibiotikum-előkezelés után végzett széklettranszplantáció javította a kognitív funkciókat, csökkentette a kórházi ápolás idejét és a relapszusok számát is (24). Jelenleg nem áll rendelkezésre a széklettranszplantáció rutinszerű végzését alátámasztó egyértelmű evidencia, ezért nem ajánlott. További vizsgálatok szükségesek az eljárás klinikai alkalmazhatóságának megítéléséhez (15, 16).
Portocavalis söntök obliterációja
Ha erre lehetőség van, stabil állapotú májcirrózisos betegeknél az adekvát gyógyszeres terápia ellenére rekurráló vagy perzisztáló HE kezelésére MELD score <11 esetén a portocavalis söntök obliterációja egyénileg mérlegelendő (8).
Májpótló kezelés
Más kezelésre nem reagáló HE esetében MARS (Molecular Absorbent Recirculating System), PROMETHEUS vagy terápiás apheresis kezelés jön szóba. Magyarországon jelenleg néhány intézményben lehetőség van az utóbbi végzésére. A hazai szakmai gyakorlatban elsősorban „bridging”-ként alkalmazzuk olyan akut májelégtelenség esetén, amikor az egyéb terápiák nem kellően hatásosak, és az eljárás alkalmazásával várhatóan idő nyerhető az akut májátültetés lebonyolításához, vagy a spontán javuláshoz. Mindhárom kezelési forma magas költségigényű, speciális felszereltséget, szaktudást és gyakorlatot igényel (16).
Májtranszplantáció
Előrehaladott krónikus májbetegség esetén ismételten fellépő, vagy a kezelésre nem megfelelően reagáló HE esetében – ha nincs ellenjavallata – minden esetben májtranszplantáció mérlegelendő (EASL 2022). Ennek megítélésében és lebonyolításában a beavatkozást végző intézmény specialistái nyújtanak segítséget (jelenleg: Semmelweis Egyetem Sebészeti, Transzplantációs és Gasztroenterológiai Klinika, Budapest, https://semmelweis.hu/sebeszet/).
A megelőzés és a kezelés általános szempontjait az 5. táblázat foglalja össze.

https://doi.org/10.1016/j.jhep.2014.05.042
2. Vilstrup H, Amodio P, Bajaj J, et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the liver. Hepatology 2014 Aug; 60(2): 715–35.
https://doi.org/10.1002/hep.27210
3. European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69: 406–460.
https://doi.org/10.1016/j.jhep.2018.03.024
4. European Association for the Study of the Liver. Corrigendum to “EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis”. (J Hepatol 2018; 69: 406–460.) J Hepatol 2018 Nov;
69(5): 1207.
https://doi.org/10.1016/j.jhep.2018.08.009.
5. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol 2019 Jan; 70(1): 172–193.
https://doi.org/10.1016/j.jhep.2018.06.024.
6. Bajaj JS, Lauridsen M, Tapper EB, et al. Important unresolved questions in the Management of Hepatic Encephalopathy: an ISHEN consensus. Am J Gastroenterol 2020 Jul; 115(7): 989–1002.
https://doi.org/10.14309/ajg.0000000000000603
7. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of hepatic encephalopathy. J Hepatol 2022 Sep; 77(3): 807–824.
https://doi.org/10.1016/j.jhep.2022.06.001.
8. Thabut D, Bouzbib C, Meunier L, et al. Diagnosis and management of hepatic encephalopathy: The French recommendations. Liver Int. 2023 Apr; 43(4): 750–762.
https://doi.org/10.1111/liv.15510.
9. Nardelli S, Gioia S, Faccioli J, Riggio O, Ridola L. Hepatic encephalopathy – recent advances in treatment and diagnosis. Expert Rev Gastroenterol Hepatol 2023 Mar; 17(3): 225–235.
https://doi.org/10.1080/17474124.2023.2183386.
10. Weissenborn K. Hepatic Encephalopathy: Definition, Clinical Grading and Diagnostic Principles. Drugs 2019; 79(Suppl 1): S5–S9.
https://doi.org/10.1007/s40265-018-1018-z.
11. Szalay L. (Update treatment of hepatic encephalopathy) Orv Hetil 2004 Aug 22; 145(34): 1747–52.
12. Lu K. Cellular Pathogenesis of Hepatic Encephalopathy: An Update. Biomolecules 2023; 13(2): 396.
https://doi.org/10.3390/biom13020396
13. Prakash R, Mullen KD. Mechanisms, diagnosis and management of hepatic encephalopathy. Nat Rev Gastroent Hepatol 2010 Sep; 7(9):
515–525.
https://doi.org/10.1038/nrgastro.2010.116.
14. Mangini C, Montagnese S. New therapies of liver diseases: hepatic encephalopathy. J Clin Med 2021 Sep 7; 10(18): 4050.
https://doi.org/10.3390/jcm10184050.
15. Rose CF, Amodio P, Bajaj JS, et al. Hepatic encephalopathy: Novel insights into classification, pathophysiology and therapy. J Hepatol 2020 Dec; 73(6): 1526–1547.
https://doi.org/10.1016/j.jhep.2020.07.013
16. Hoilat GJ, Suhail FK, Adhami T, John S. Evidence-based approach to management of hepatic encephalopathy in adults World J Hepatol 2022 April 27; 14(4): 670–681.
https://doi.org/10.4254/wjh.v14.i4.670
17. Hudson M, Schuchmann M. Long-term management of hepatic encephalopathy with lactulose and/or rifaximin: a review of the evidence. Eur J Gastroenterol Hepatol 2019 Apr; 31(4): 434–450.
https://doi.org/10.1097/MEG.0000000000001311.
18. Butterworth RF. (2019a) L-Ornithine L-Aspartate for the Treatment of Sarcopenia in Chronic Liver Disease: The Taming of a Vicious Cycle. Can J Gastroenterol Hepatol 2019 Apr 28; 2019: 8182195.
https://doi.org/10.1155/2019/8182195
19. Butterworth RF. Hepatic Encephalopathy in Cirrhosis: Pathology and Pathophysiology. Drugs 2019 Feb; 79(Suppl 1): 17–21.
https://doi.org/10.1038/nrgastro.2010.116.
20. Butterworth RF, Kircheis G, Hilger N, McPhail MJW. Efficacy of l-Ornithine l-Aspartate for the Treatment of Hepatic Encephalopathy and Hyperammonemia in Cirrhosis: Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Clin Exp Hepatol 2018 Sep; 8(3): 301–313.
https://doi.org/10.1016/j.jceh.2018.05.004
21. Kircheis G, Lüth S. Pharmacokinetic and Pharmacodynamic Properties of L-Ornithine L-Aspartate (LOLA) in Hepatic Encephalopathy. Drugs 2019 Feb; 79(Suppl 1): 23–29.
https://doi.org/10.1007/s40265-018-1023-2.
22. Sharma BJ, Singh J, Srivastava S, et al. Randomized controlled trial comparing lactulose plus albumin versus lactulose alone for treatment of hepatic encephalopathy. J Gastroenterol Hepatol 2017 Jun; 32(6): 1234–1239.
https://doi.org/10.1111/jgh.13666.
23. Bai Z, Bernardi M, Yoshida EM, et al. Albumin infusion may decrease the incidence and severity of overt hepatic encephalopathy in liver cirrhosis. Aging (Albany NY) 2019 Oct 8; 11(19): 8502–8525.
https://doi.org/10.18632/aging.102335.
24. Bajaj JS, Fagan A, Gavis EA, et al. Long-term Outcomes of Fecal Microbiota Transplantation in Patients With Cirrhosis. Gastroenterology 2019 May; 156(6): 1921–1923.e3.
https://doi.org/10.1053/j.gastro.2019.01.033.
