Original paper
The current situation on fecal transplantation in Hungary
Summary
The procedure of treating chronic diarrhoea, which has been used in the fourth century, has recently come back into focus. Fecal Microbiota Transplantation (FMT) has become known as an alternative and effective treatment for refractory Clostridioides difficile infections. Due to the complex composition of the stool, it is difficult to examine and is not in line with precision medicine so popular today. Despite this, we have more and more data available about its effectiveness and the development and gain ground of more and more quality management systems compatible technologies are becoming known. In this paper, we briefly summarize the current developments and directions in fecal transplantation in Hungary.
Az elhúzódó hasmenéses kórképek gyógyítására már a negyedik században is alkalmazott eljárás az utóbbi időben került ismét a figyelem központjába, ami a refrakter Clostridioides difficile fertőzések alternatív, hatékony kezelési lehetőségeként vált ismertté. A széklet komplex összetétele miatt nehezen vizsgálható, és nincs összhangban a napjainkban divatos precíziós medicinával. Ennek ellenére egyre több adat áll rendelkezésünkre a hatékonyságáról, és egyre több, a minőségirányitási rendszerrel kompatibilis technológiák kifejlesztése és elterjedése válik ismertté. Közleményünkben röviden összefoglaljuk a jelen hazai fejlesztéseket, irányokat a széklettranszplantációban.
Bevezetés
A széklettranszplantáció alatt az egészséges donor székletpreparátumának átültetését érjük a sérült mikroflórával rendelkező recipiens tápcsatornájába azzal a céllal, hogy helyreállítsuk a normál homeosztázist biztosító bélflórát. Több elnevezéssel is találkozhatunk a világirodalomban. A leg-
gyakrabban használt terminus technicus a székletmikrobióta-transzplantáció (fecal microbiota transplantation, FMT), de transzfaunáció vagy székletmikrobióta-transzfer névvel is találkozhatunk. Ugyan a kezelés nincs összhangban az utóbbi években teret nyerő precíziós medicinával, mégis több mint 416 regisztrált klinikai vizsgálat zajlik világszerte a transzplantáció hatékonyságának felmérése céljából. A transzplantáció is eltér a megszokott transzplantációs kritériumoktól, ezért szerencsésebb lenne mikrobióta-transzferről beszélni. A transzplantáció során nincs szükség HLA-identikus vagy rokon donort kiválasztani, azonban itt is előfordulhatnak infekciók és kilökődésre utaló immunfolyamatok (1). Az FMT egy agresszív terápiás beavatkozást jelent a mikrobiom megváltoztatására, ezért körültekintéssel kell alkalmaznunk (2). Használatával kapcsolatosan számos aggály merült fel már korábban is, mint például az eljárás kellemetlen volta, bizonyos esetekben az invazív adagolás szükségessége, a fertőzés átvitelének kockázata, valamint a megfelelő donor kiválasztásának nehézsége (3).
Az FDA is felhívta a figyelmet a lehetséges súlyos kockázatokra, mint a multirezisztens kórokozók lehetséges átvitelére (4). A fertőzés átvitelének kockázata csökkenthető a donorok megfelelő szűrésével, a preparátum székletbankban történő tárolásával (fagyasztva, liofilezve) a donor újraszűrésének idejéig, így elkerülve a kórokozók ablakperiódusban való átvitelét. Lehetőség van a baktériummentes szűrletek létrehozására, ami a multirezisztens kórokozók átvitelének kockázatát jelentősen minimalizálja (5, 6). Ez utóbbi módszerrel azonban a vírusok és fágok átvitelét nem tudjuk megakadályozni. A körültekintőbb donorszűrésre az alapot a SARS-CoV-2 megjelenése és a kialakult világjárvány jelentette, ugyanis a vírus a gasztrointesztinális nyálkahártyához is kötődik, és a széklettel hosszú ideig ürül. Ugyan a vírus RNS-e akár a fertőződés utáni 45. napon is kimutatható, azonban a jelenlétének klinikai relevanciája nem ismert, mivel az RNS kimutatása nem egyenértékű a fertőzőképes, viabilis vírus jelenlétével (7).
Az FMT a fent részletezett nehézségek ellenére bizonyította hatékonyságát, és magas evidenciaszinten (Ia) javasolt és elfogadott eljárás a rekurrens vagy refrakter Clostridioides difficile fertőzések kezelésére, amit randomizált klinikai vizsgálatok is alátámasztottak. A vezető nemzetközi gasztroenterológiai és infektológiai irányelvek mellett az Emmi és az OEK (Országos Epidemiológiai Központ) módszertani levele is a hatásos terápiás lehetőségek egyikeként javasolja a használatát. Az FDA 2022 novemberében engedélyezte az első fecalis mikrobióta-termék forgalmazását a visszatérő C. difficile fertőzések kezelésére (8). IBD vagy IBS esetében még hiányoznak a hatékonyságot megfelelően alátámasztó, nagy esetszámú randomizált, kontrollált vizsgálatok. Kis esetszámon végzett vizsgálatok bizonyos esetekben hatékonynak bizonyultak, de a hatékonyságát alátámasztó mechanizmusok nem teljesen ismertek (9).
Az FMT célja
Az FMT célja helyreállítani az egészséges bélökoszisztémát, a mikrobiomhoz köthető funkcionális hálózatot és anyagcsere-állapotot, ezzel elérve a tartós gyógyulást vagy a tünetek megszűnését. Jellegzetes mikrobiális változások, lenyomatok figyelhetők meg a különböző anyagcsere, immunológiai, mentális betegségek kialakulása során. Habár nem ismert még, hogy a mikrobiom összetételének változása eredményezte-e az adott betegség kialakulását, de a mikrobiom ökoszisztémájának, összetételének helyreállítása ezen betegeségek tüneteinek jelentős javulását eredményezi (10). A mikrobiom és a betegségek kapcsolatáról – annak ellenére, hogy rengeteg adat áll rendelkezésünkre – a kapcsolatok sokszintű összefonódása és bonyolultsága miatt mégis keveset tudunk. A megfelelő donor kiválasztásának többek között ez is a hátránya. Ugyanakkor a mikrobiom összetevőinek részletes vizsgálata is nehézségekbe ütközik. Ennek ellenére rendelkezünk használható protokollokkal, kritériumokkal, amelyek betartása mellett elérhetjük, hogy a recipienst rövid és hosszú távon a legkevesebb veszélynek tegyük ki.
A donor szűrésének kritériumai
A donor megválasztása során arra kell törekedni, hogy a szűrés során az ismert átvihető fertőző betegségek kórokozóit kiszűrjük, nem veszélyeztetve a recipiens életét. Tekintettel arra, hogy a transzplantáció során átvitt mikrobiom közössége átveszi a helyét, a rezidens flórának a donáció előtt a következő feltételeknek kell megfelelnie. A donornak rendezett legyen a széklethabitusa, és ne szenvedjen daganatos vagy krónikus anyagcsere-betegségben. A donor szűrését egy állapotfelmérés (előző fél évben történő gyógyszerszedés, utazás, életvitel, krónikus betegség, széklethabitus) után általános vérvétel és a széklettel is átvihető fertőző ágensek jelenlétének kizárása követ. Szűrni kell HAV, HBV, HCV, HEV, EBV, CMV, HIV, SARS-CoV-2, lues, toxoplazma, székletparazita, baktérium és C. difficile toxin és antigén irányában. MDR-kolonizáló baktériumok kizárására ánusztörletet vagy széklettenyésztést szükséges vizsgálni. A széklettenyésztés során azonban külön jelezni szükséges a vizsgálat célját, mivel a rutintenyésztéskor nem biztos, hogy az alkalmazott szelektív táptalajokon identifikálható a kérdéses mikroba, vagy elvégzik annak antibiotikumérzékenységi vizsgálatát (pl. Enterococcus, E. coli). Egyes protokollok ezen kívül előírják a norovírus, az adenovírus és a rotavírus RNS-vizsgálatát is (3, 11). A SARS-CoV-2 vírus átvitelének megelőzésére és szűrésére több protokoll is rendelkezésünkre áll (12, 13). Ha lehetőség van rá, akkor célszerű a donor székletét fagyasztva tárolni, és karanténba helyezni, majd 14–21 nappal később ismételt negatív szűrővizsgálatok után alkalmazni (14). A széklettranszplantációval foglalkozók szerint a donor szűrésének összetettsége és a szűrés költségei jelentik a módszer elterjedésének fő akadályát (15).
Az FMT formái
Az elmúlt időszakban a donorszéklet recipiensbe juttatására számos módszert kipróbáltak. Minden módszernek megvannak az előnyei és hátrányai egyaránt. Az egyes preparátumok hatékonyságát összehasonlították, és nem találtak szignifikáns különbséget a preparátum típusai között (1, 16, 17, 18, 19, 20).
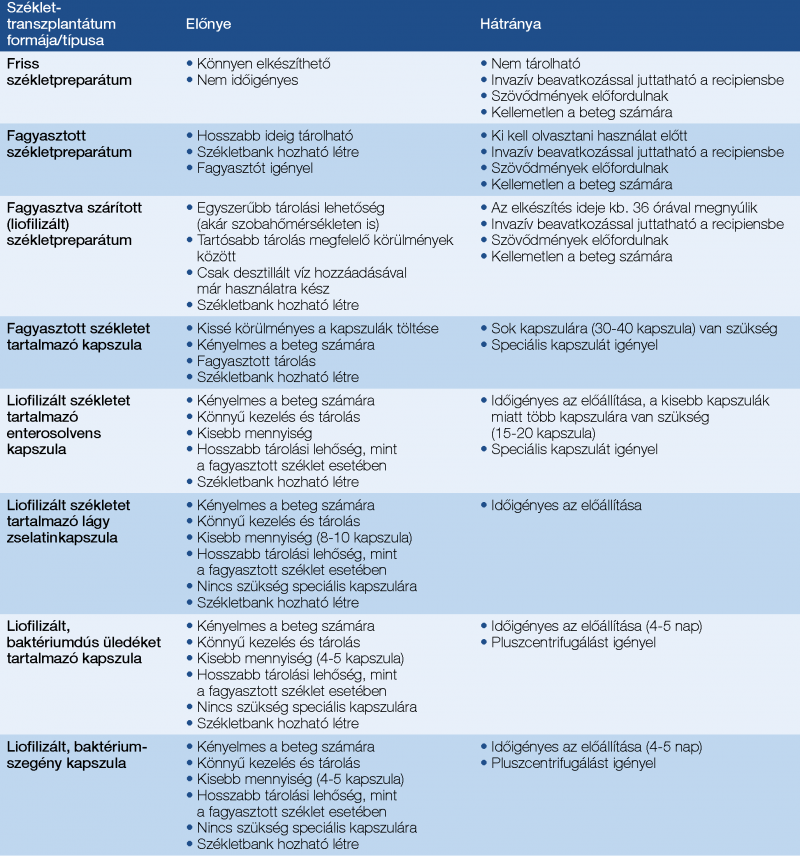
A friss széklethomogenizátumot 6 órán belül fel kell használni. Előnye, hogy nem kell a mikrobiom megváltozásával számolni, de tárolni nem lehet. A preparált széklethomogenizátum −80 Celsius-fokra fagyasztható, és kb. 6 hónapig megőrzi minőségét és hatékonyságát. A fagyasztás során bekövetkező mikrobakárosodások kivédése céljából krioprotektív anyag hozzáadását javasolják. A −20 Celsius-fokon való fagyasztás és tárolás során bizonyos enzimrendszerek aktívak maradhatnak, ami a bélflóra eltolódásához vezethet (21).
A liofilizálás vagy fagyasztva szárítás során megfelelő körülmények mellett (pára- és oxigénmentes környezet) elméletileg a székletpreparátum akár korlátlan ideig is eltartható (6, 22).
Az FMT hazai helyzete
Hazánkban nincs egységes eljárás és követelményrendszer a transzplantáció kivitelezését illetően. Ugyan létezik transzplantációs protokoll, de abban a székletpreparátum előállítási kritériumai szabad kezet adnak a beavatkozást végzőnek az általa preferált technika alkalmazására. Nincs egységes minőségi kritériumrendszer sem.
A transzplantációt végző centrumok többsége friss székletet vagy fagyasztott székletpreparátumot alkalmaz. Ez a legkevésbé időigényes és műszerigényes eljárás. Az FMT hazai elterjesztésében elsősorban országos és egyetemi központok járnak az élen (16, 17, 23, 24). Regiszter hiányában azonban pontos adatokkal nem rendelkezünk az elvégzett beavatkozások számát és a kimeneteli eredményeket illetően.
Budapesten a Dél-pesti Centrumkórház Infektológiai Osztályán végeznek nagy számban széklettranszplantációt. A székletpreparátumok elkészítésére és a transzplantáció kivitelezésére a hagyományos technológiát alkalmazva friss vagy fagyasztott székletpreparátumokat nasogastricus szondán keresztül alkalmazzák. Budapesten több magánrendelőben van lehetőség széklettranszplantátumhoz jutni.
A Debreceni Egyetemen, ahol korábban részletes egyetemi módszertani ajánlás is született (25), Nagy és munkatársai egy technológiai fejlesztés során automatizálták a donorszéklet feldolgozását és transzfúziós zacskóba helyezését, amit később −80 Celsius-fokon működő fagyasztóban bankolnak. A technológia alkalmas minőségirányítási környezet létrehozására és a beadott széklet mennyiségének pontos meghatározására.
A Pécsi Egyetemen Péterfi és munkatársai egy másik fejlesztési úton indultak el. A friss és fagyasztott székletpreparátumok mellett fagyasztva szárított (liofilizált) preparátumokkal is végeztek transzplantációt, vizsgálatokat, majd később a széklet kapszulázásával, a baktériumtartalmú és a baktériumszegény szűrlettel értek el technológiai fejlesztést és jó eredményeket (6, 16, 17, 22, 23, 26).
A módszer szintén alkalmas minőségirányítási környezet létrehozására, a beadott széklet minőségi megítélésére és mennyiségének pontos meghatározására. Székletbank könnyen létrehozható. A C. difficile fertőzések kezelésére bevezették a baktériumszegény székletkapszulák alkalmazását, ami mellett a klinikai siker ugyanolyan jónak mutatkozott, mint a teljes széklettel végzett beavatkozás. Ezzel szemben a csak baktériumot tartalmazó kapszulákkal végzett transzplantáció sikere ezen eredményektől lényegesen elmaradt.
A Szegedi Egyetem I. sz. Belgyógyászati Klinikáján elsősorban gyulladásos bélbetegségek kezelésére, de C. difficile fertőzések kezelésére is alkalmaznak széklettranszplantációt.
Néhány esetben az ország több kórházában terápiarezisztens, recidiváló C. difficile infekció kezelésére FMT-t végeztek. Az észak-magyarországi és észak-alföldi régió vezető centrumkórházi intézetei egymás közötti együttműködésében mikrobióta-készítmények átadásával oldják meg, hogy a betegek hozzájussanak a terápiás lehetőséghez.
Saját vizsgálataink eredménye: a baktériumok túlélési ideje nagyban függ a tárolási hőmérséklettől, szobahőmérsékleten vagy hűtőhőmérsékleten. Ahogy az megjósolható, max. 30 napig várható életképes baktériumtúlélés. A fagyasztott tárolás (−20 vagy −80 Celsius-fok) esetén 90 nap után kezd csökkenni a baktériumok csíraszáma.
A liofilizálás során a rövid szénláncú zsírsavak (SCFA) aránya és mennyisége érdemben nem változik, és a sikeres transzplantáció után a recipiensekben a donoréhoz hasonló mértékben megnövekszik a butirát mennyisége. A székletfehérje mikrocsip-gélelektroforézises vizsgálata azt mutatta, hogy a liofilizálás nem változtatja meg a fehérjeprofilt, de a tárolás során az egyik be nem azonosított fehérje mennyisége, ami a transzplantáció sikerének egyik mutatója is, idővel bomlik, a mennyisége csökken. A metagenomikai vizsgálatok azt mutatták, hogy függetlenül attól, hogy a recipiens baktériumszegény székletkapszulával vagy baktériumtartalmú kapszulával volt transzplantálva, a recipiens székletének biodiverzitása jelentősen javult. A készítmények valós összetétele azok komplexitása és vizsgálatának nehézségei miatt sajnos nem ismert. A transzplantáció során „OO” lágy zselatinkapszulákat alkalmaztunk. A kapszulák előnye, hogy könnyen tölthetők, a méréseink szerint a gyomorból kiürülve oldódnak, és a béltranzitidő függvényében a béltraktus különböző szakaszain indul el a szaporodásuk (6, 22).
Az egyes alkalmazási módszerek összehasonlító tulajdonságait az 1. táblázatban tüntettük fel.
További megoldásra váró feladat az FMT finanszírozása. Jelenleg nem finanszírozott a beavatkozás, ezért a donorszűrés és a transzplantátum előállítása, a transzplantáció kivitelezésének költségeit a transzplantációt végző intézetnek kell előteremtenie. A közfinanszírozás megszerzésére tett erőfeszítések reményeink szerint hamarosan meghozzák az eredményt. A finanszírozás megoldása elősegíthetné az FMT szélesebb körben való alkalmazását és a jobb, kényelmesebb technikák meghonosodását.
Összefoglalás
Az FMT szabályozása és osztályozása az idők folyamán sokat fejlődött. A széklettranszplantációt érintő kutatás területén való aktív részvétel az országok és régiók között is nagy változatosságot mutat. 2014-ben az Európai Bizottság javaslata az volt, hogy a széklettranszplantációt egy „összetett anyagnak” – amely emberi és nem emberi összetevőket tartalmazó anyag – minősítsék. Az FMT aktív összetevői valószínűleg kapcsolódnak a nem emberi összetevőkhöz, ami az Európai Szövetek és Sejtek Direktíváján (European Tissues and Cells Directive) kívül esik, ezért helyi/nemzeti szinten javasolták a transzplantáció szabályozását (27, 28).
Az FMT egyelőre csak a recidív vagy refrakter C. difficile fertőzések kezelésére jóváhagyott és a legmagasabb evidenciaszinten javasolt terápiás lehetőség. A legutóbbi években megjelent összefoglalók és metaanalízisek egyre több adattal szolgálnak az FMT biztonságos és hatékony használatáról. Hatékonyságát jelenleg is intenzíven tanulmányozzák és finomítják több emésztőrendszeri és nem emésztőrendszeri betegség kezelésére is. Az aktív colitis ulcerosa kimenetelét jótékonyan befolyásolja, de májbetegségekben, metabolikus szindrómában, obesitasban, neurológiai és pszichiátriai kórképek és antibiotikumrezisztens kórokozók esetében is komoly érdeklődés mutatkozik az FMT iránt. A beavatkozás az eddigi vizsgálatok alapján biztonságosnak mutatkozik, és szövődménnyel is alig lehet találkozni (29).
A transzplantátum előállításának standardizálása, a minőségirányitási rendszernek megfelelő módszerek, ellenőrzések kidolgozása, valamint a transzplantáció finanszírozásának bevezetése egyszerűbbé és könnyebben kivitelezhetővé teheti a széklettranszplantációt. A klinikai vizsgálatok adatai a közeljövőben nemcsak a C. difficile infekció kezelése, hanem más betegségek előtt is megnyithatják a kapukat.
Az FMT további fejlődését illetően a jövő kifejezetten a kapszulás transzplantáció irányába mutat, mivel ez egy nem invazív, jobban tolerálható és csaknem mellékhatásmentes beavatkozás.
https://doi.org10.3389/fcimb.2022.826114
2. Zhang S, Deng F, Chen J, et al. Fecal microbiota transplantation treatment of autoimmune-mediated type 1 diabetes: A systematic review. Front Cell Infect Microbiol 2022; 12: 1075201.
https://doi.org10.3389/fcimb.2022.1075201.
3. Bálint A, Born A, Fried K et al. Az Emberi Erőforrások Minisztériuma egészségügyi szakmai irányelve a hagyományos széklettranszplantációs eljárás kivitelezéséről. Egészségügyi Közlöny 2020; 70(12): 1658–1681.
4. FDA report: Fecal Microbiota for Transplantation: Safety Alert – Risk of Serious Adverse Events Likely Due to Transmission of Pathogenic Organisms 2020. 07. 04.
https://www.fda.gov/safety/medical-product-safety-information/fecal-microbiota-transplantation-safety-alert-risk-serious-adverse-events-
likely-due-transmission
5. Ott SJ, Waetzig GH, Rehman A, et al. Efficacy of Sterile Fecal Filtrate Transfer for Treating Patients With Clostridium difficile Infection. Gastroenterology 2017; 152(4): 799–811.e7.
https://doi.org10.1053/j.gastro.2016.11.010
A további irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.hu weboldalon.
6. Varga A, Kocsis B, Sipos D, et al. How to Apply FMT More Effectively, Conveniently and Flexible – A Comparison of FMT Methods. Front Cell Infect Microbiol 2021; 11: 657320.
https://doi.org10.3389/fcimb.2021.657320.
7. Gupta S, Parker J, Smits S, et al. Persistent viral shedding of SARS-CoV-2 in faeces – a rapid review. Colorectal Dis 2020; 22(6): 611–620.
https://doi.org10.1111/codi.15138
8. FDA News Release: FDA Approves First Fecal Microbiota Product. Rebyota Approved for the Prevention of Recurrence of Clostridioides difficile Infection in Adults 2022, November 30.
https://www.fda.gov/news-events/press-announcements/fda-approves-first-fecal-microbiota-product
9. Péterfi Z, Vincze Á. Széklettranszplantáció hatékonysága és feltételezhető hatásmechanizmusai. Central European Journal of Gastroenterology and Hepatology 2020; 6(4): 187–191.
https://doi.org10.33570/CEUJGH.6.4.187
10. Antushevich H. Fecal microbiota transplantation in disease therapy. Clin Chim Acta 2020; 503: 90–98.
https://doi.org10.1016/j.cca.2019.12.010.
11. Cammarota G, Ianiro G, Tilg H, et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut 2017; 66(4): 569–580.
https://doi.org10.1136/gutjnl-2016-313017
12. Ianiro G, Mullish BH, Kelly CR, et al. Reorganisation of faecal microbiota transplant services during the COVID-19 pandemic. Gut 2020; 0: 1–9.
https://doi.org10.1136/gutjnl-2020-321829
13. Nagy GG, Tudlik Z, Gergely L et al. A székletmikrobiota-transzplantáció technológiájának és minőségirányítási hátterének újragondolása a SARS-CoV-2 víruspandémia kapcsán. Orv Hetil 2020; 161(44): 1858–1871.
https://doi.org10.1556/650.2020.32023.
14. Li T, Garcia-Gutierrez E, Yara DA, et al. An optimised protocol for detection of SARS-CoV-2 in stool. BMC Microbiol 2021; 21(1): 242.
https://doi.org10.1186/s12866-021-02297-w.
15. Bakken JS, Polgreen PM, Beekmann SE, et al. Treatment approaches including fecal microbiota transplantation for recurrent Clostridium difficile infection (RCDI) among infectious disease physicians. Anaerobe 2013; 24: 20–24.
16. Vigvari Sz, Sipos D, Solt J, et al. Faecal microbiota transplantation for Clostridium difficile infection using a lyophilized inoculum from non-related donors: A case series involving 19 patients, Acta Microbiol Immunol Hung 2019; 66(1): 69–78.
https://doi.org10.1556/030.64.2017.042
17. Vigvári Sz, Vincze Á, Solt J, et al. Experiences with fecal microbiota transplantation in Clostridium difficile infections via upper gastrointestinal tract Acta Microbiol Immunol Hung 2019; 66(2): 179–188.
https://doi.org10.1556/030.65.2018.051
18. Youngster I, Sauk J, Pindar C, et al. Fecal microbiota transplant for relapsing Clostridium difficile infection using a frozen inoculum from unrelated donors: a randomized, open-label, controlled pilot study. Clin Infect Dis 2014; 58(11): 1515–1522.
https://doi.org10.1093/cid/ciu135
19. Youngster I, Russell GH, Pindar C, et al. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection. JAMA 2014; 312(17): 1772–1778.
https://doi.org10.1001/jama.2014.13875
20. Fang H, Fu L, Wang J. Protocol for Fecal Microbiota Transplantation in Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. Biomed Res Int 2018; 2018: 8941340.
https://doi.org10.1155/2018/8941340
21. Bahl MI, Bergström A, Licht TR. Freezing fecal samples prior to DNA extraction affects the Firmicutes to Bacteroidetes ratio determined by downstream quantitative PCR analysis. FEMS Microbiol Lett 2012; 329: 193–197.
https://doi.org10.1111/j.1574-6968.2012.02523.x
22. Varga A, Makszin L, Bufa A, et al. Efficacy of Lyophilised Bacteria-Rich Faecal Sediment and Supernatant with Reduced Bacterial Count for Treating Patients with Clostridioides difficile Infection – a Novel Method for Capsule Faecal Microbiota Transfer (FMT). Front Cell Infect Microbiol 2023; 13.
https://doi.org10.3389/fcimb.2023.1041384
23. Vigvári Sz, Nemes Zs, Vincze Á, et al. Experience with fecal microbiota transplantation in the treatment of Clostridium difficile infection. (Clostridium difficile fertőzések széklettranszplantációval való kezelése során nyert tapasztalataink.) Orv Hetil 2014; 155: 1758–1762. (Hungarian)
https://doi.org10.1556/OH.2014.30020
24. Nagy GGy, Várvölgyi Cs, Paragh G. Successful treatment of life-threatening, treatment resistant Clostridium difficile infection associated pseudomembranous colitis with faecal transplantation. (Életet veszélyeztető, terápiarefrakter Clostridium difficile fertőzés okozta pseudomembranosus colitis sikeres kezelése széklettranszplantációval. Orv Hetil 2012; 153: 2077–2083. (Hungarian)
https://doi.org10.1556/OH.2012.29509
25. Nagy GGy, Várvölgyi Cs, Balogh Z, et al. Detailed methodological recommendations for the treatment of Clostridium difficile-associated diarrhea with faecal transplantation. (Módszertani ajánlás a Clostridium difficile fertőzéshez asszociált hasmenés széklettranszplantációval történő kezeléséhez.) Orv Hetil 2013; 154: 10–19. (Hungarian)
https://doi.org10.1556/OH.2013.29514
