Reviews
Role and importance of pancreatic stents in the prevention of post-ERCP pancreatitis
Summary
The most frequent complication of endoscopic retrograde cholangiopancreatography is post-ERCP pancreatitis. Several risk factors and a few prophylactic measures have become evident over the past three decades. The most effective preventive method among high-risk patients is the insertion of a small caliber pancreatic stent, the so-called prophylactic pancreatic stent (PPS), although their usage requires appropriate endoscopic practice. In this publication we summarize the relevant knowledge related to PPSs.
Összefoglalás
Az endoszkópos retrográd cholangiopancreatographia (ERCP) leggyakoribb szövődménye a poszt-ERCP pancreatitis, amelynek számos kockázati tényezője és megelőzésének lehetőségei is ismertté váltak az elmúlt bő három évtizedben. A magas rizikójú betegcsoportban a kis kaliberű, ún. profilaktikus pancreassztentek (PPS) bizonyulnak a leghatékonyabb megelőző eljárásnak, bár használatukhoz megfelelő endoszkópos gyakorlat szükséges. Jelen publikációban a PPS-ekkel kapcsolatos ismeretanyagot foglaltuk össze.
Bevezetés
Több mint 50 éve elérhető az epeutak és a hasnyálmirigy-vezetékrendszer vizsgálatára és bizonyos betegségeinek endoszkópos kezelésére az endoszkópos retrográd cholangiopancreatographia (ERCP) (1). A módszer egyre szélesebb körű használata során az 1980-as évektől váltak egyre ismertebbé az ERCP során fellépő szövődmények, amelyek közül a figyelem középpontjába elsősorban a heveny hasnyálmirigy-gyulladás, azaz a poszt-ERCP pancreatitis (PEP) került. A különböző szakemberek, kutatók a PEP előfordulását egyre gyakrabban észlelték, azonban eltérően értékelték. A kórkép jobb megértése, a kockázati tényezők, illetve megelőzési lehetőségek feltárása, valamint a kórlefolyás tanulmányozása érdekében egységes definícióra és súlyossági besorolásra volt szükség. Ezt először az 1991-ben publikált, 25 szakértő bevonásával készült konszenzusajánlás, az első szerző után elnevezett ún. Cotton-féle kritériumrendszer fogalmazta meg, amely az elkövetkező 30 évben általánosan elfogadottá vált (2). A folyamat tanulmányozása során a PEP kialakulásához vezető egyre több kockázati tényező vált ismertté, és számos erőfeszítés is történt, hogy ez a szövődmény minél inkább kivédhetővé, megelőzhetővé váljon (3). A jelenleg mindkét nagy endoszkópos társaság, azaz mind az amerikai (American Society for Gastrointestinal Endoscopy, ASGE), mind az európai társaság (European Society of Gastrointestinal Endoscopy, ESGE) által elfogadott preventív módszerek egyrészt az ERCP előtt legalább fél órával adott 100 mg indomethacin/diclofenac kúp, másrészt a magas kockázatú betegekben a profilaktikus/preventív pancreassztent (PPS) használata, harmadrészt a megfelelő periprocedurális hidrálás (4, 5). Jelen összefoglalóban a PPS szerepéről és jelentőségéről írunk.
A PEP definíciója és klasszifikációja
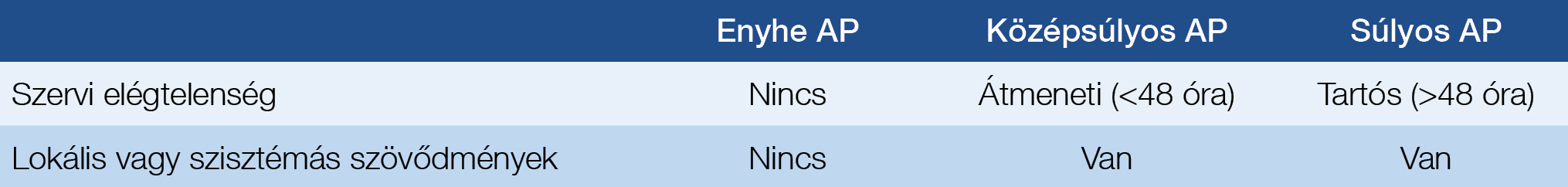
Ahogy az imént említettük, a PEP fogalmának első meghatározását és súlyossági osztályozását az 1991-es Cotton-féle konszenzusajánlás tartalmazza (2). Ez a PEP-et úgy fogalmazza meg, mint az ERCP-t követő új vagy súlyosbodó hasi fájdalom, ahol a vizsgálat után legalább 24 órával mért szérumamiláz- vagy -lipázszint a normálérték felső határának háromszorosát meghaladja, és kórházi felvételt vagy a tervezett hospitalizáció meghosszabbítását eredményezi. Súlyosság tekintetében pedig a kórházi tartózkodás hosszát, illetve a PEP következtében kialakuló szövődményeket veszi alapul. A folyamat enyhének tekinthető, ha a PEP miatt 2-3 napos kórházi kezelés szükséges, középsúlyosnak, ha 4-10 napig tart a hospitalizáció, illetve súlyosnak, ha több mint 10 napig kell kezelni a beteget, vagy haemorrhagiás pancreatitis, phlegmone vagy pseudocysta alakul ki, illetve (perkután vagy sebészi) intervenció válik szükségessé. Addig, amíg a szövődmények kialakulása objektív mutató, a kórházi tartózkodás hossza nem minden esetben az, hiszen azt egyéb tényezők is befolyásolhatják. Egy néhány éve publikált tanulmány rámutatott, hogy az esetek harmadában nem a PEP súlyossága, hanem más betegségek (pl. cholangitis, perforáció, egyéb gyulladások [ld. pneumónia], posztoperatív epecsorgás, poszt-ERCP vérzés, cholecystitis, veseelégtelenség), vagy egyéb okok (pl. függőben levő cholecystectomia, egyéb betegségek vagy logisztikai okok) magyarázzák (6). Ennek ellenére közel 30 évig ez volt az általánosan elfogadott, kifejezetten a PEP-re kifejlesztett, széles körű konszenzuson alapuló klasszifikációs rendszer.
2012-ben született meg a heveny pancreatitis módosított Atlanta-klasszifikációja, amely a betegség súlyosságát illetően a szervi elégtelenséget tekinti irányadónak (1. táblázat) (7). Ennek a klasszifikációnak a használatát minden esetben javasolják, függetlenül a pancreatitis etiológiájától, így a PEP esetén is. A 2020-as ESGE-irányelvben már ezt ajánlják a Cotton-féle súlyossági besorolás helyett (5). Az előbb említett tanulmány, amelyben több nemzetközi centrum vett részt, 5 év alatt (2012–2017) elvégzett 13 384 ERCP vizsgálatának adatait elemezte retrospektíven (6). Kimutatták, hogy a módosított Atlanta-klasszifikáció pontosabb, mint a Cotton-féle konszenzus a PEP súlyossági besorolását illetően (szenzitivitás, specificitás, pozitív és negatív prediktív értékek sorrendben: Atlanta: 100-98-58-100%, Cotton: 55-72-5-98%) (6).
1. táblázat: Akut pancreatitis (AP) súlyossági besorolása a módosított Atlanta-klasszifikáció alapján (6)
A PEP kockázati tényezői, a magas kockázatú betegek
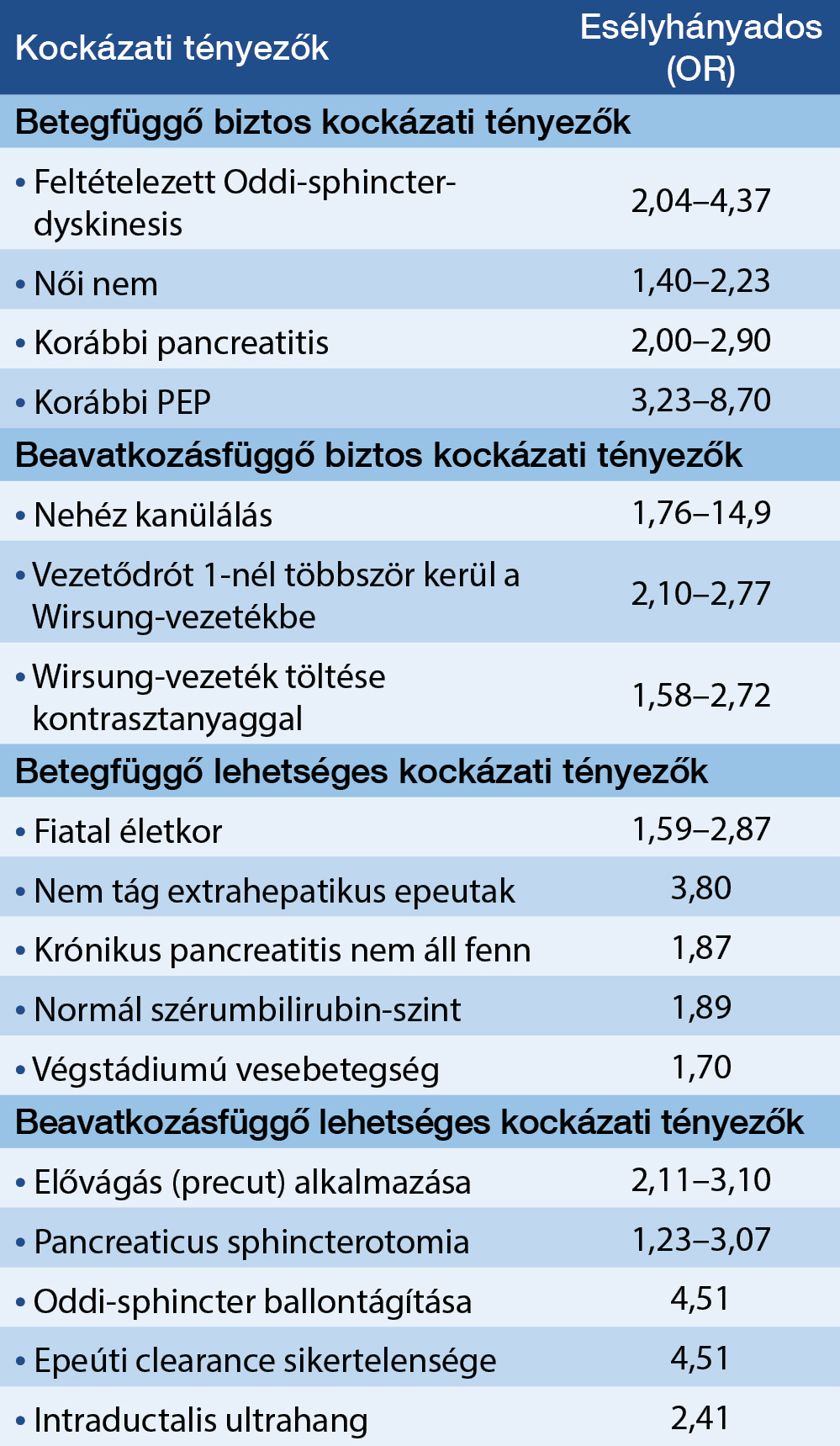
Már a kezdetektől fogva igyekeztek kiszűrni azt a populációt, akiknél fokozott kockázat áll fenn a PEP kialakulását illetően. Számos rizikótényező vált ismertté, amelyek egy része az ERCP vizsgálat sajátosságai miatt (beavatkozásfüggő rizikófaktorok), egy részük viszont a beteg tulajdonságai miatt (betegfüggő rizikófaktorok) lehetnek jelen. A legfrissebb ESGE-irányelv ezeken belül is megkülönböztet biztos és lehetséges kockázati tényezőket (2. táblázat) (5).
2. táblázat: A poszt-ERCP pancreatitis (PEP) kockázati tényezői a 2020-as ESGE-ajánlás
alapján (5)
Az általuk hordozott kockázat összeadódik, így többszörös rizikó fennállása esetén a PEP kialakulásának az esélye a sokszorosára növekszik. A Freeman munkacsoport klasszikus cikkében a rizikó nélkül férfi betegek PEP-incidenciája 1,1% volt, míg normál bilirubinnal, Oddi-sphincter dyskinesisszel ERCP-zett nőknél, ahol a kanülálás nehéz volt, 42,1%-ban fordult elő PEP (8).
Az ESGE-ajánlás alapján akkor tekintünk egy beteget a PEP kialakulása szempontjából magas kockázatúnak, ha a korábban említett biztos rizikófaktorok közül legalább egy, vagy a lehetséges rizikófaktorok közül legalább kettő jelen van (gyenge ajánlás, alacsony fokú evidenciaszint) (5).
A PEP epidemiológiája
Egy friss metaanalízis eredményei alapján a PEP incidenciája átlagosan 10,2%, a magas kockázatú betegcsoportban pedig 14,1% (9). A mortalitás mindkét betegcsoportban 0,2%.
A PEP előfordulása enyhe, középsúlyos és súlyos kategóriák szerint átlagosan 6,6%, 2,6% és 0,5%, a magas kockázatú csoportban pedig 8,8%, 3,3% és 0,8% volt. Ha a pancreatitises esetek eloszlását nézzük, akkor azt láthatjuk, hogy ezek nagy része, azaz körülbelül 2/3-a enyhe formában zajlik (átlagos kockázatú csoportban az esetek 68%-a, magas kockázatú csoportban 68,2%-a). Csak nagyon kis részük, durván minden huszadik eset lesz súlyos lefolyású (átlagos kockázat esetén 5,2%-uk, magas kockázatnál 6,2%-uk). Középsúlyossá az esetek negyedében válik (átlagos kockázat esetén 26,8%-uk, magas kockázatnál 25,6%-uk) (9).
Saját, prospektív módon gyűjtött adatbázisunkban, ahol magas kockázatú betegek esetén használtunk PPS-t a PEP megelőzése céljából, a sztentelt betegek között a PEP megoszlása a következőképpen alakult: 82,8% enyhe, 13,8% középsúlyos, 3,4% súlyos (10).
PPS használata a PEP megelőzésében
Az ERCP története során először (1980-as évek) az epeúti eltérések terápiájára összpontosítottak, de az 1990-es évektől már a hasnyálmirigy-betegségek is felkerültek a terápiás palettára (pl. idült hasnyálmirigy-gyulladás, pseudocysták), sőt az évtized végétől a PEP kivédésében is egyre gyakrabban kezdték használni a pancreassztenteket (1).
Az első publikáció, ahol PPS-t használtak a PEP megelőzésére, 1993-ból származik. Itt 48 magas kockázatú betegben kísérelték meg a PPS-implantációt, ami 43 esetben volt sikeres (11). Ebben a randomizált vizsgálatban a kontrollcsoport 50 nem sztentelt betegből állt. A sztentelt csoport eredményei mind a PEP előfordulása, mind a súlyossága, mind pedig a kórházi tartózkodás hossza szempontjából jobbak voltak, bár az alacsony esetszám miatt a szignifikancia szintjét nem érték el. Az 1999 után végzett vizsgálatokban azonban már minden esetben szignifikáns eredményeket igazoltak a PPS javára (12).
Később több metaanalízis is született, amelyek alátámasztották, hogy a PPS alkalmazása csökkenti a PEP esélyét (OR=0,32), illetve szignifikánsan kisebb lesz a súlyos lefolyás kialakulásának valószínűsége (OR=0,24) (13). Egy másik metaanalízis nemcsak azt igazolta, hogy a PPS szignifikánsan csökkenti mind az enyhe-középsúlyos (RR=0,45), mind a súlyos PEP esélyét (RR=0,26), hanem hogy ez nemcsak a magas kockázatú (RR=0,41), de a válogatás nélküli betegcsoportban is igazolható (RR=0,23) (14). Az ESGE-irányelv magas rizikójú betegek esetén egyértelműen javasolja a használatát (OR=0,22–0,39; súlyos PEP vonatkozásában az OR=0,22–0,26) (5). Ahhoz, hogy egy betegben megelőzzük a PEP kialakulását, 7-8 beteget kell PPS-sel kezelnünk (azaz a number needed-to-treat [NNT] = 7-8).
Saját prospektív adatbázisunk elemzése során igazoltuk, hogy a PPS használatával az ismert beteg- és beavatkozásfüggő rizikófaktorok által hordozott kockázat szignifikánsan csökkenthető (15). A sikeresen sztentelt magas kockázatú betegeknél a rizikófaktorok előfordulási arányaiban (az Oddi-sphincter dyskinesis kivételével) nem volt szignifikáns különbség azoknál a betegeknél, ahol PEP alakult ki, és ahol nem, vagyis a PPS kivédi a rizikótényezők károsító hatását.
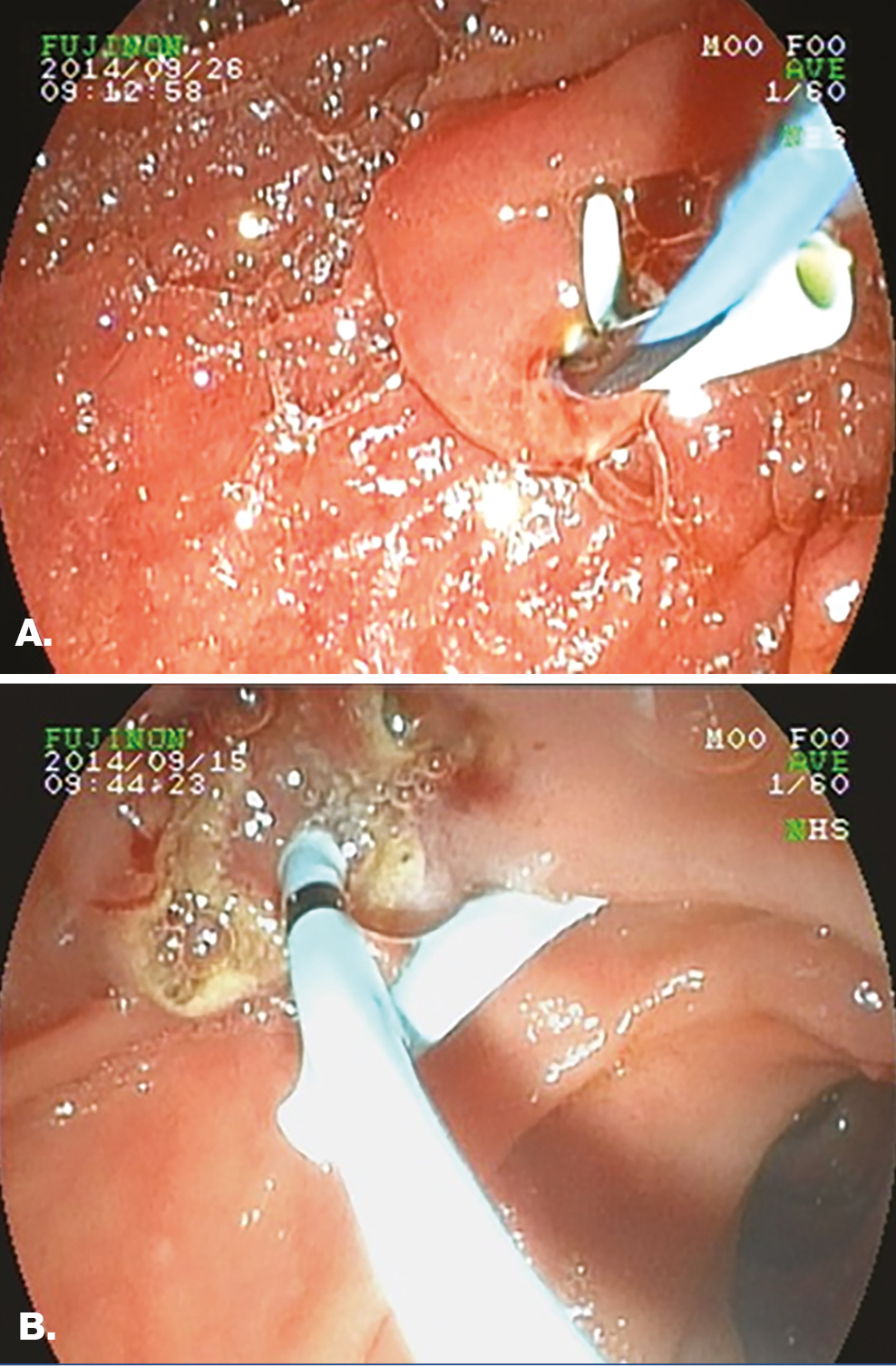
A preventív céllal használt pancreassztentek behelyezése történhet papillotomia nélkül, ha például a vezetődrót a Wirsung-vezetékbe jut, vagy azt követően is a Wirsung-vezeték nyílását a metszlapon (többnyire az epeúti orificiumhoz képest jobbra, lentebb) felkeresve (1. ábra).
1. ábra: PPS behelyezése papillotomia előtt, illetve után
A: Papillotomia nélküli implantáció: a PPS a Wirsung-vezetékben, a kék-fekete csíkos vezetődrót a d. choledochusban látható
B: PPS-implantáció papillotomia után: a PPS a Wirsung-vezetékben látható, a papillotomiás szélek jól azonosíthatók (sárgásfehér vonal mutatja a koagulációs nekrózist)
Magas kockázatú betegek esetén bizonyos szerzők már akkor is javasolják a PPS behelyezését, ha az első kanülálási kísérlet során a vezetődrót a Wirsung-vezetékbe jut, míg átlagos kockázat esetén sztentimplantáció nélkül folytatják az epeút felkeresését (16).
Különböző méretű és kialakítású PPS-ek érhetők el a kereskedelmi forgalomban. Ezek többnyire 3-5 Fr átmérőjűek, a hosszuk pedig 2-10 cm között változik, anyaguk műanyag. A sztentek többsége egyenes, a külső, azaz a duodenum felé eső végén egy-két, becsúszást megakadályozó füllel rendelkezik, míg a belső, Wirsung-vezetékben levő vége lehet belső fül nélküli, vagy itt is tartalmazhat kis fület. Népszerűek a külső pigtail végű, ún. Freeman típusú sztentek is. Ezeknek a belső végükön legfeljebb egy fül található, ami az idő előtti kiesést gátolja meg. Ezek eltávolítása gasztroszkópia során idegentest-fogóval vagy kis hurokkal egyszerűen elvégezhető, viszont a beteg számára ez egy újabb endoszkópos vizsgálatot jelent. Ennek elkerülése érdekében, illetve a spontán kiesés reményében hagyják el nagyon gyakran ezt a belső fület a gyártók (2. ábra).
2. ábra: Különböző típusú PPS-ek a Cook® Medical cég kínálatából
(forrás: www.cookmedical.com)
A: Belső fül nélküli preventív pancreassztent: jól megfigyelhető a duodenum felé eső külső végén a két darab, becsúszást megakadályozó fül, ugyanakkor a Wirsung-vezetékbe szánt belső végén nincs ilyen
B: Belső füles preventív pancreassztent: a sztent mindkét végén láthatunk 2-2 db, kimozdulást akadályozó fület (a duodenum felé eső vég a kép bal oldalán látható)
C: Külső pigtail véggel és belső füllel rendelkező preventív pancreassztent: a duodenumban levő külső végén láthatjuk a malacfarokra emlékeztető pigtailt, míg a belső végén egyetlen, idő előtti kicsúszást akadályozó füle van

Tekintve, hogy a pancreasvezeték kis átmérőjű, a sztent okozta sérülések elkerülése érdekében számos szakember előnyben részesíti a vékony, 3 Fr-es PPS-eket, azonban ezek csak 0,018-0,021 inches vezetődróton juttathatók be, amelyekkel viszont sokkal nehezebb dolgozni, így nagyobb a sikertelen behelyezések aránya (17). Egy randomizált vizsgálatban rövid (2-3 cm) 5 Fr-es sztenteket hasonlítottak össze hosszú (8-10 cm) 3 Fr-es PPS-ekkel (18). Egyrészt a PPS behelyezése többször volt sikertelen (9% vs. 0%), másrészt a két héten belüli spontán sztenttávozás kevesebb volt (88% vs. 98%), harmadrészt a PEP incidenciája magasabb volt (14% vs. 9%) a 3 Fr-es hosszú sztentek használatakor. Egy network-metaanalízisben is összehasonlították a 3 és 5 Fr átmérőjű pancreassztenteket, ahol szintén az 5 Fr-es PPS-ek bizonyultak jobbnak a PEP megelőzésében, függetlenül attól, hogy van-e belső fülük, vagy sem (19). Az 5 Fr átmérőjű sztentek között pedig egy japán randomizált vizsgálat során szignifikánsan alacsonyabb PEP-et figyeltek meg, ha azok nem hosszúak (5 cm), hanem rövidek (3 cm) voltak (20). A 4-6 cm hosszúságú sztentekkel kapcsolatos aggodalom, hogy a genu magasságáig érnek fel, és itt a vezetékrendszert károsíthatják (16). Éppen ezért a legtöbbet használt vékony, 3 Fr-es sztentek többnyire hosszabbak (8-10 cm), míg az 5 Fr-esek inkább rövidebbek (2-3 cm). Újabban japán szerzők 4 Fr-es sztentekkel hasonló eredményeket értek el, mint az 5 Fr-esekkel, és ezek 0,025-ös vezetődróton is behelyezhetők (21).
Gyakorlati kérdésként merül fel, hogy mennyi ideig kell a PPS-eket a Wirsung-vezetékben tartani, illetve mikor lehet/kell őket eltávolítani. Egy amerikai randomizált vizsgálatban a tűkéses elővágást PPS behelyezésével segítették elő (22). A betegek egy részénél ezt a sztentet a precut után, de még az ERCP befejezése előtt eltávolították, egy másik részüknél pedig másnapig bent hagyták. A kontrollcsoportot azok alkották, akiknél sztent nélkül végezték el az elővágást. A három csoport közül a legtöbb PEP azoknál alakult ki, akiknél csak a tűkés idejére tettek be PPS-t (21,3%), míg a legkevesebb a sztentelt csoportban volt (4,3%). A kontrollcsoport betegei (13,8%) az átlagos PEP-incidenciát mutatták. Ugyanerre a következtetésre jutott egy másik munkacsoport is, akiknél a vezetődrót véletlenszerűen jutott a Wirsung-vezetékbe, és a kizárólag az ERCP idejére behelyezett PPS nem védte ki a PEP-et (23). A korábban említett vizsgálatban az is kimutatható volt, hogy minden betegben, akiknél a PPS 24 órán belül spontán kiesett, PEP alakult ki (18). Úgy tűnik azonban, hogy a PPS-eket nem kell túl sokáig bent tartani. A két hétnél tovább bent maradt sztentek mellett heveny pancreatitis kialakulását figyelték meg (18). Érdekes kérdés tehát az is, hogy a behelyezett sztentek mennyi idő alatt esnek ki. Az 5 Fr, 2-3 cm-es, egyetlen belső füllel rendelkező PPS-ek esetén a spontán távozás aránya 1 nap után 50%, 1 hétnél 91%, 2 hétnél 98% egy vizsgálatban (18). Egy másik munkacsoport az 5 Fr, 3 cm-es sztentek esetén 2 hétnél viszont csak 43%-os spontán távozási arányt látott egyetlen belső fül esetén, illetve 84%-ot, ha nem volt belső füle a PPS-nek (25). A vékonyabb (3 Fr), de hosszabb (8-10 cm) PPS-ek esetén kissé alacsonyabb, 1 nap után 13%, 1 hétnél 63%, 2 hétnél 88% volt a spontán kiesés aránya (18).
Az endoszkópos társaságok (ESGE, ASGE) a fentiek alapján, illetve szakértői véleményekre támaszkodva javasolják, hogy a behelyezett PPS-ek minimum 12-24 órán át, de maximum 5-10 napig legyenek bent, valamint hogy a kiesésüket, spontán távozásukat ellenőrizni kell, és ha ez nem történik meg, akkor endoszkópos úton el kell távolítani őket (4, 5).
PPS-ekkel kapcsolatos szövődmények
A PPS-ekkel kapcsolatos szövődmények szerencsére ritkák, de az irodalomban néhány igen érdekes, erre a beavatkozásra jellemző komplikációt írtak le. A leggyakrabban emlegetett és a legrettegettebb adverz esemény a megkísérelt, de sikertelen PPS-behelyezési kísérlet. Freemanék klasszikus, gyakran citált cikkében 3 ilyen betegből 2-ben alakult ki PEP, így az incidencia 66,7%-nak adódott (26). Saját, lényegesen nagyobb anyagunkban 29 sikertelenül sztentelt betegből 12-nél észleltük PEP kialakulását, amely 41,3%-os előfordulási arányt jelent (10). Ez egyébként nem különbözött szignifikánsan a sztent nélkül kezelt, hasonlóan magas kockázatú, de még a PPS-használat előtti ERCP-s beteganyagunk incidenciaadataitól (31,4%). Aki ilyen sztenteket használ, annak ezekkel tisztában kell lennie. Az irodalmi adatok alapján egyébként a PPS implantáció sikertelenségi aránya 4-10% között van, a legfrissebb amerikai ajánlásban 3% volt (4, 24). A PPS-implantáció némi gyakorlatot igényel még azok számára is, akik egyébként rutinosak az epeúti sztentelésben, ugyanis a pancreas vezetékrendszere a d. choledochushoz képest kisebb átmérőjű, kanyargósabb, elágazó és sérülékenyebb, valamint az itt használt tartozékok is kisebbek, puhábbak, így az endoszkópos szakemberek részéről speciális hozzáállást és gyakorlatot igényel (12, 24).
A sikertelen sztentelési kísérleten túl a sztent okozta ductalis és parenchymaeltérések és vezetéksérülések, továbbá a sztent vezetékrendszeren belüli fragmentálódása, illetve különböző irányú migrációja, valamint a bent hagyott sztent eltávolítása kapcsán észlelt PEP szerepel az irodalomban (24).
A Wirsung-vezeték sérülése, átfúródása, perforációja az esetek 0,1%-ában fordul elő. Ez létrejöhet egyrészt egy erőltetett sztentelési kísérletnél, amikor a PPS vége okozza a sérülést, vagy másrészt a már behelyezett sztent az anyagának „rugalmatlansága” folytán kiegyenesedik, és ez okozza a perforációt, vagy akár úgy is, hogy kijjebb csúszik, és egy oldalágba beakadva feszülhet neki a vezeték falának (24). Továbbá ahogy korábban említettük, a 4-6 cm hosszú sztentek többnyire a genu magasságáig érnek, de a pancreasvezetéken itt található kanyart nem érik át, és a végük nekifeszülhet a vezeték falának. Ezen túlmenően, a sztent okozta passzív hatás mind a vezetékrendszerben, mind a parenchymában krónikus pancreatitisre emlékeztető eltéréseket is ki tud alakítani. Ez leginkább akkor figyelhető meg, amikor a sztent átmérője kissé nagyobb, mint a vezeték tágassága (többnyire ≥5 Fr-es sztenteknél látható), vagy ha túl hosszúak, és okkludálják az oldalágakat, vagy ha túl sokáig maradnak bent (24). Az így kialakuló vezetékszűkületek spontán oldódhatnak is, de tartósak is maradhatnak, amelyek viszont nagyon gyakran az endoszkópos tágításokra sem nagyon reagálnak, és akár pancreasreszekciós műtétet is szükségessé tehetnek. A sztentek fragmentálódása is előfordulhat, ha túl sokáig maradnak bent.
A PPS-ek migrációja történhet kifelé, a duodenumba, illetve befelé, a Wirsung-vezetékbe. A spontán kifelé irányuló kimozdulás csak abban az esetben jelent gondot, ha túl korán következik be. Általános tapasztalat, hogy ha a sztent idő előtt, vagyis túl korán csúszik ki, akkor ún. késői kezdetű PEP-hez vezet, ami sztent nélküli, illetve a megfelelő ideig sztentelt esetekben nem fordul elő (10, 20, 23, 24). Ilyenkor az ERCP után egy átmeneti, néhány órás panaszmentes időszakot követően indul a beteg hasi fájdalma, és alakul ki a PEP. Saját anyagunkban 1,7%-ban észleltünk korai kicsúszást, amire az ERCP után 8-12 órával induló PEP hívta fel a figyelmet (10). A belső fül nélküli rövid sztentek, vagy valamilyen szövődmény (pl. posztpapillotomiás vérzés) hajlamosít erre. Sokkal nagyobb gondot okoz azonban a befelé irányuló, ún. proximális migráció. Ilyenkor a sztent felcsúszik a Wirsung-vezetékbe, és a külső vége sem látható a papilla nyílásában. Saját anyagunkban 1%-ban regisztráltunk ilyen szövődményt. Hajlamosító tényezők a kettős belső fülű, illetve a hosszú, egyenes sztentek, továbbá az Oddi-sphincter-dyskinesis, valamint a túl sokáig bent hagyott sztentek (10, 26). A becsúszott PPS-ek eltávolítása endoszkópos úton nagyon nehéz (pancreaticus sphincterotomia után kell a vékony, elágazó vezetékrendszerben manipulálni kisméretű idegentest-fogóval vagy hurokkal, esetleg Dormia-kosárral), de olykor sikertelen is lehet, amely hosszú távon károsítja a pancreas vezetékrendszerét és a mirigyállományt is, és hosszú távon akár pancreasreszekciós műtétet is igényelhet. A sztentek kialakítása közül a külső pigtail vég tűnik hatékonynak a proximális migráció megelőzésében.
Végül, egy kanadai munkacsoport a PPS-ek eltávolításakor az esetek 3%-ában enyhe és középsúlyos PEP kialakulását írta le (27). Hajlamosító tényezőként az 5 Fr-es átmérő, a belső fül jelenléte és a kezdeti ERCP után kialakult PEP szerepelt, ezeken túl pedig nem szignifikáns trendként a hosszabb ideig bent hagyott sztent érdemelt említést. A publikált adatok elemzésekor megállapítottuk, hogy az esetek nagy részében azok a sztentek, amelyeknél ezt a szövődményt észlelték, két hétnél tovább voltak bent és hosszúak (>5 cm) voltak (28).
Saját gyakorlatunkban a legoptimálisabban használhatónak az egyetlen belső füllel és külső pigtail véggel bíró 5 Fr, 3 cm hosszú sztenteket találtuk (10).
PPS-ekkel kapcsolatos különleges megfontolások
Látva a PPS-ek hatékonyságával kapcsolatos eredményeket, ugyanakkor ismerve a szövődményeit is, felmerülhet a kérdés, hogy a PPS-implantáció egyáltalán költséghatékony-e. Egy régebbi és egy közelmúltban megjelent számítás szerint is, ha magas kockázatú betegcsoportban alkalmazzuk, akkor költséghatékony beavatkozás (29, 30). Mind az ASGE, mind az ESGE ajánlja használatukat ebben a betegcsoportban (4, 5).
Érdekes kérdés, hogy az egyértelmű ajánlások mennyire érhetők tetten a napi gyakorlatban, vagyis a javasolt profilaktikus módszereket mennyire használjuk a mindennapi ellátásban. Erről több elemzés is született. Egy amerikai munkacsoport a központi egészségügyi jelentő rendszer adatbázisát vizsgálta a 2014–2019 közötti időszakban, és ekkor a betegeknek csak 33,8%-a részesült valamilyen PEP-profilaxisban (31). Ezzel szemben a holland munkacsoport 2013-ban és 2020-ban végzett kérdőíves felméréssel megállapította, hogy az indomethacin/diclofenac kúp a leggyakrabban használt módszer, de a PPS használata a válaszadók között emelkedett, 62%-ról 78%-ra a két vizsgálati évben (32). Az Egyesült Államokból származó kérdőíves felmérésben viszont csak 54% volt a PPS-használat (33). Azok, akik nem használják, 80%-ban jelentették, hogy ennek oka az indomethacin kúp alkalmazása volt. Saját tapasztalatunk és eredményeink azonban arra utalnak, hogy a NSAID-kúppal szemben a PPS lényegesen hatékonyabb a súlyos egészségkárosodás veszélyét is magában hordozó középsúlyos-súlyos PEP megelőzésében (34). Az amerikai egészségügyi adatbázisból származó 2009–2018 közötti adatokat elemezte egy felmérés, amely szintén a profilaktikus módszerek nem kielégítő mértékű használatát igazolta (35). Megállapítható volt, hogy bár 2012–2018 között az indomethacin kúp használata folyamatosan emelkedett, még így sem érte el az 50%-ot (46,3%), illetve hogy a magas kockázatú esetekben 2013 előtt 40% körül alkalmazták a PPS-t, viszont ez a gyakorlat 2013–2014 között drasztikusan csökkent, majd 2015-től 3-4% közötti értéken stabilizálódott. A szerzők a további oktatás, felvilágosítás szükségességét emelik ki, ami azért sem elhanyagolható, mert az adatbázisokból az is kitűnik, hogy a PEP miatti kórházi felvételek száma 2011 és 2017 között 15,3%-kal nőtt, illetve a PEP betegek összmortalitása másfélszeresére, 2,8%-ról 4,4%-ra nőtt (36). A megfelelő PEP-profilaxis ajánlások szerinti alkalmazása lényeges, átlagos kockázatú betegekben kontraindikáció hiányában az ERCP előtt adott indomethacin/diclofenac kúp, magas kockázatú betegekben PPS-implantáció formájában (4, 5). Ahogy említettük, magas rizikójú betegekben a PPS-implantáció szignifikánsan hatékonyabban előzi meg a középsúlyos-súlyos PEP kialakulását, mint az indomethacin kúp (34). Súlyos PEP egyetlen esetben sem fordult elő a publikált randomizált vizsgálatokban a PPS-sel kezelt betegek között (4, 34).
Gyakorlati kérdés lehet, hogy mennyire kell/szabad erőltetni a PPS-ek behelyezését. Erre vonatkozó ajánlások nincsenek. Praktikus tanácsként egyrészt javasoljuk a beteg PEP rizikójának a felmérését, átgondolását még az ERCP vizsgálat előtt, mivel vizsgálataink szerint a betegfüggő rizikótényezők igen meghatározóak a sztentelés ellenére kialakuló PEP-ben (10), továbbá a magas kockázatú betegekben, ha a vezetődrót a Wirsung-vezetékbe megy elsőre, akkor ide PPS-t implantáljunk, és ezután folytassuk az epeúti intervenciót (vagy alkalmazzunk kétvezetős technikát a végén PPS behelyezéssel). Amikor azonban az ERCP végén kívánjuk berakni a PPS-t, akkor a túlzott erőltetéstől érdemes tartózkodni, mivel ez fokozza a PEP esélyét, és alternatív profilaktikus technikákat alkalmazzunk. Saját gyakorlatunkban többnyire két kísérletet teszünk, de a döntést a beteg és a beavatkozás sajátosságait figyelembe véve individuálisan hozzuk meg. Az amerikai ajánlás is hasonló elveket fogalmaz meg, miszerint PPS-implantáció olyan betegekben javasolt, ahol a drót ismét a pancreasvezetékbe megy (a beteg kockázati csoportjától függetlenül is), továbbá magas kockázatú betegekben minden esetben (beleértve a nehéz epeúti kanülálást, az anamnesztikus PEP-et, illetve a precut sphincterotomiát), ahol a Wirsung-vezeték könnyen felkereshető (4). Saját gyakorlatunkban azon magas kockázatú betegekben nem erőltetjük a PPS implantációt, ahol egy gyors, első kísérletre sikeres szelektív epeúti kanülálás és rövid vizsgálat történik.
A PPS-ekkel kapcsolatos javaslatokat és gyakorlati megjegyzéseket és tanácsokat a 3. táblázatban foglaltuk össze.
Végül a PPS-ek különleges alkalmazásáról, azaz a zajló PEP igen korai szakaszában végzett sztentbehelyezésről teszünk említést. Ennek a figyelemreméltó módszernek az első alkalmazása magyar szerzőkhöz köthető (37). Megfigyelték, hogy ha az ERCP után kialakuló erős hasi fájdalom, kifejezett szérumamiláz-emelkedés, illetve szisztémás gyulladásos válaszreakció jelei alapján súlyos PEP indulását véleményezték, és az első vizsgálat után 8-20 órával egy újabb, ún. „rescue ERCP” során PPS-implantációt végeztek, akkor a beteg fájdalma azonnal enyhült, majd 24 órán belül megszűnt, illetve az enzimszintek néhány nap alatt normalizálódtak, és szövődmény sem alakult ki. Később a módszer hatékonyságát egy amerikai munkacsoport is igazolta, illetve azt is bizonyították, hogy az idő előtti PPS-kicsúszás eseteiben, az ún. késői kezdetű PEP korai szakában alkalmazva is hatékony (38). Mivel jelenleg csak ez a két esetszéria áll rendelkezésre, az ESGE-irányelv ennek használatát az egyértelmű evidenciák hiányában nem javasolja.
Összefoglalás
Az ERCP vizsgálat leggyakoribb, nem elhanyagolható arányú szövődménye a PEP, amely olykor súlyos formában zajlik, és tartós betegségállapotot, hospitalizációt igényel, vagy akár (az egyéb eredetű heveny pancreatitisekhez hasonlóan) szövődmények is kialakulhatnak, de az esetek két ezrelékében halálhoz is vezethetnek. Az elmúlt bő három évtizedben számos kockázati tényező vált ismertté, valamint erőfeszítések történtek a szövődmény megelőzése, a fennálló rizikó csökkentése és a kedvezőbb kimenetel elérése érdekében. A jelenleg elfogadott profilaktikus módszerek közé a megfelelő betegszelekció, a megfelelő ERCP-s technika alkalmazása, valamint a nem szteroid gyulladáscsökkentő (NSAID) kúpok, a periprocedurális hidrálás és a magas kockázatú betegek esetén a PPS alkalmazása tartoznak. Jelen összefoglalónkban ez utóbbi módszerrel kapcsolatos ismereteket foglaltuk össze. Kitértünk a hatékonyságára, miszerint legalább 2/3-ával csökkenti a PEP kialakulásának az esélyét. Elemeztük a rendelkezésre álló technikai részleteket, a legoptimálisabban az 5 Fr-es rövid, 3 cm-es külső pigtail véggel és egy belső füllel rendelkező PPS-ek használhatók, azonban ezek minimum 12-24 óráig, de maximum 5-10 napig lehetnek bent. Megemlítettük, hogy a PPS behelyezése némi gyakorlatot igényel, mivel az epeutakkal összehasonlítva más anatómiai körülmények között, kissé más tartozékokkal dolgozunk. Nagyon fontos, hogy a sztentek távozását minden esetben ellenőrizzük, illetve a behelyezett PPS-eket (ha nem távoztak spontán) 5-10 napon belül vegyük ki. Részletesen összefoglaltuk a sztentekkel kapcsolatos szövődményeket, amelyek közül a megkísérelt, de sikertelen sztentbehelyezés által hordozott magas PEP-rizikó, a korai, idő előtti kicsúszás által okozott ún. késői kezdetű PEP, valamint a nehéz eltávolítást jelentő proximális migráció érdemel külön is említést. Mindezek ellenére a magas kockázatú betegek esetén a beavatkozás költséghatékony, és bár a nagy társaságok ajánlásai egyértelműek, a mindennapi gyakorlatban mégsem használjuk megfelelő mértékben. Ennek nemcsak a sikertelen sztentbehelyezéstől, valamint a szövődményektől való félelem lehet az oka, hanem a NSAID-kúpokba vetett hit is, holott ebben a betegcsoportban a PPS-ek hatékonyságához kétség sem férhet.
Irodalom
https://doi.org/10.1016/B978-0-323-48109-0.00001-8
2. Cotton PB, Lehman G, Vennes J, Geenen JE, Russell RC, Meyers WC, et al. Endoscopic sphincterotomy complications and their management: an attempt at consensus. Gastrointest Endosc 1991; 37(3): 383393.
https://doi.org/10.1016/S0016-5107(91)70740-2
3. Freeman ML, Guda NM. Prevention of post-ERCP pancreatitis: a comprehensive review. Gastrointest Endosc 2004; 59(7): 845–864.
https://doi.org/10.1016/s0016-5107(04)00353-0
4. Buxbaum JL, Freeman M, Amateau SK, Chalhoub JM, Coelho-Prabhu N, Desai M, et al.; (ASGE Standards of Practice Committee Chair). American Society for Gastrointestinal Endoscopy guideline on post-ERCP pancreatitis prevention strategies: summary and recommendations. Gastrointest Endosc 2023; 97(2): 153–162.
https://doi.org/10.1016/j.gie.2022.10.005
5. Dumonceau JM, Kapral C, Aabakken L, Papanikolaou IS, Tringali A, Vanbiervliet G, et al. ERCP-related adverse events: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2020; 52(2): 127–149.
https://doi.org/10.1055/a-1075-4080
6. Smeets X, Bouhouch N, Buxbaum J, Zhang H, Cho J, Verdonk RC, et al. The revised Atlanta criteria more accurately reflect severity of post-ERCP pancreatitis compared to the consensus criteria. United European Gastroenterol J 2019; 7(4): 557–564.
https://doi.org/10.1177/2050640619834839
7. Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, et al.; Acute Pancreatitis Classification Working Group. Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62(1): 102–111.
https://doi.org/10.1136/gutjnl-2012-302779
8. Freeman ML, DiSario JA, Nelson DB, Fennerty MB, Lee JG, Bjorkman DJ, et al. Risk factors for post-ERCP pancreatitis: a prospective, multicenter study. Gastrointest Endosc 2001; 54(4): 425–434.
https://doi.org/10.1067/mge.2001.117550
9. Akshintala VS, Kanthasamy K, Bhullar FA, Sperna Weiland CJ, Kamal A, Kochar B, et al. Incidence, severity, and mortality of post-ERCP pancreatitis: an updated systematic review and meta-analysis of 145 randomized controlled trials. Gastrointest Endosc 2023; 98(1): 1–6.e12.
https://doi.org/10.1016/j.gie
10. Dubravcsik Z, Hritz I, Szepes A, Madácsy L. Profilaktikus sztentek alkalmazása az endoszkópos retrográd cholangiopancreatographiát követő pancreatitis megelőzésében. Orv Hetil 2021; 162: 31–38.
http://doi.org/10.1556/650.2021.31934
11. Smithline A, Silverman W, Rogers D, Nisi R, Wiersema M, Jamidar P, et al. Effect of prophylactic main pancreatic duct stenting on the incidence of biliary endoscopic sphincterotomy-induced pancreatitis in high-risk patients. Gastrointest Endosc 1993; 39(5): 652–657.
https://doi.org/10.1016/s0016-5107(93)70217-5
12. Freeman ML. Pancreatic stents for prevention of post-ERCP pancreatitis: for everyday practice or for experts only? Gastrointest Endosc 2010; 71(6): 940–944.
https://doi.org/10.1016/j.gie.2009.12.043
13. Sugimoto M, Takagi T, Suzuki R, Konno N, Asama H, Sato Y, et al. Pancreatic stents to prevent post-endoscopic retrograde cholangiopancreatography pancreatitis: A meta-analysis. World J Meta-Anal 2019; 7(5): 249–258.
https://doi.org/10.13105/wjma.v7.i5.249
14. Mazaki T, Mado K, Masuda H, Shiono M. Prophylactic pancreatic stent placement and post-ERCP pancreatitis: an updated meta-analysis. J Gastroenterol 2014; 49(2): 343–355.
https://doi.org/10.1007/s00535-013-0806-1
15. Dubravcsik Z, Hritz I, Szepes A, Madácsy L. Risk factors of post-ERCP pancreatitis in high-risk patients despite prevention with prophylactic pancreatic stents. Scand J Gastroenterol 2020; 55(1): 95–99.
https://doi.org/10.1080/00365521.2019.1701069
16. Conrad CC, Ellrichmann M. Stent placement in pancreatic disease, when, which and why? – A current perspective. Front Gastroenterol 2023; 1: 1039649.
https://doi.org/10.3389/fgstr.2022.1039649
17. Freeman ML. Current Status of Endoscopic Stenting of the Pancreatic Duct as Prophylaxis Against Post-ERCP Pancreatitis. Gastroenterol Hepatol (NY) 2012; 8(9): 618–620. PMID: 23983649; PMCID: PMC3752002.
18. Chahal P, Tarnasky PR, Petersen BT, Topazian MD, Levy MJ, Gostout CJ, Baron TH. Short 5Fr vs long 3Fr pancreatic stents in patients at risk for post-endoscopic retrograde cholangiopancreatography pancreatitis. Clin Gastroenterol Hepatol 2009; 7(8): 834–839.
https://doi.org/10.1016/j.cgh.2009.05.002
19. Afghani E, Akshintala VS, Khashab MA, Law JK, Hutfless SM, Kim KJ, et al. 5-Fr vs. 3-Fr pancreatic stents for the prevention of post-ERCP pancreatitis in high-risk patients: a systematic review and network meta-analysis. Endoscopy 2014; 46(7): 573–380.
https://doi.org10.1055/s-0034-1365701
20. Fujisawa T, Kagawa K, Ochiai K, Hisatomi K, Kubota K, Sato H, et al. Prophylactic Efficacy of 3- or 5-cm Pancreatic Stents for Preventing Post-ERCP Pancreatitis: A Prospective, Randomized Trial. J Clin Gastroenterol 2016; 50(3): e30–4.
https://doi.org/10.1097/MCG.0000000000000397
21. Nagai K, Sofuni A, Tsuchiya T, Ishii K, Tanaka R, Tonozuka R, et al. The feasibility of pancreatic duct stenting using a novel 4-Fr plastic stent with a 0.025-in. guidewire. Sci Rep 2021; 11(1): 14285.
https://doi.org/10.1038/s41598-021-92811-x
22. Cha SW, Leung WD, Lehman GA, Watkins JL, McHenry L, Fogel EL, Sherman S. Does leaving a main pancreatic duct stent in place reduce the incidence of precut biliary sphincterotomy-associated pancreatitis? A randomized, prospective study. Gastrointest Endosc 2013; 77(2): 209–216.
https://doi.org/10.1016/j.gie.2012.08.022
23. Conigliaro R, Manta R, Bertani H, Manno M, Barbera C, Caruso A, et al. Pancreatic duct stenting for the duration of ERCP only does not prevent pancreatitis after accidental pancreatic duct cannulation: a prospective randomized trial. Surg Endosc 2013; 27(2): 569–574.
https://doi.org/10.1007/s00464-012-2487-x
24. Freeman ML. Pancreatic stents for prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis. Clin Gastroenterol Hepatol 2007; 5(11): 1354–1365.
https://doi.org/10.1016/j.cgh.2007.09.007
25. He Q, Wang L, Peng C, Zou X, Zhan Q, Xu Y, et al. Modified prophylactic 5-fr pancreatic duct stent enhances the rate of spontaneous dislodgement: A multicenter randomized controlled trial. United European Gastroenterol J 2018; 6(10): 1519–1526.
https://doi.org/10.1177/2050640618804729
26. Freeman ML, Overby C, Qi D. Pancreatic stent insertion: consequences of failure and results of a modified technique to maximize success. Gastrointest Endosc 2004; 59(1): 8–14.
https://doi.org/10.1016/s0016-5107(03)02530-6
27. Moffatt DC, Coté GA, Fogel EL, Watkins JL, McHenry L, Lehman GA, Sherman S. Acute pancreatitis after removal of retained prophylactic pancreatic stents. Gastrointest Endosc 2011; 73(5): 980–986.
https://doi.org/10.1016/j.gie.2011.01.012
28. Hritz I, Dubravcsik Z, Szepes A, Madácsy L. Does removal of prophylactic pancreatic stents induce acute pancreatitis? Gastrointest Endosc 2011; 74(6): 1429–1430.
https://doi.org/10.1016/j.gie.2011.07.047
29. Das A, Singh P, Sivak MV Jr, Chak A. Pancreatic-stent placement for prevention of post-ERCP pancreatitis: a cost-effectiveness analysis. Gastrointest Endosc 2007; 65(7): 960–968.
https://doi.org/10.1016/j.gie.2006.07.031
30. Thiruvengadam NR, Saumoy M, Schneider Y, Attala S, Triggs J, Lee P, Kochman ML. A Cost-Effectiveness Analysis for Post-Endoscopic Retrograde Cholangiopancreatography Pancreatitis Prophylaxis in the United States. Clin Gastroenterol Hepatol 2022; 20(1): 216–226.e42.
https://doi.org/10.1016/j.cgh.2021.08.050
31. Issak A, Elangovan A, Ferguson RD, Waghray N, Sandhu DS. Underutilization of prophylactic rectal indomethacin and pancreatic duct stent for prevention of post-ERCP Pancreatitis. Endosc Int Open 2021; 9(7): E979–E985.
https://doi.org/10.1055/a-1460-7776
