Összefoglaló közlemények / Reviews
Intestinal failure: diagnosis and treatment
Summary
Intestinal failure (IF) is defined as the reduction of gut function below the minimum necessary for the absorption of macronutrients and/or water and electrolytes, such that intravenous supplementation is required to maintain health and/or growth. Short bowel syndrome (SBS) is the main pathophysiologic cause of chronic IF (CIF). Intravenous supplementation of nutrients, provided at the patient's home by home parenteral nutrition (HPN) programs, is the primary and life‐saving treatment for CIF. With time and proper management, CIF can be reversible in some patients, such that they can be weaned off HPN. The classification, causes and treatment of CIF and RBS is discussed in this review to facilitate communication and cooperation among professionals in clinical practice, organization, management, and research.
Összefoglalás
Bélelégtelenségről beszélünk, amikor a bél felszívó működése és emiatt a táplálékok, és/vagy a folyadék és elektrolitok felszívódása olyan mértékű zavart szenved, hogy az egészség és/vagy a növekedés fenntartásához parenterális pótlásuk szükséges. A leggyakoribb kóroki tényező a rövidbél-szindróma (RBS). A tápanyagok parenterális pótlása az otthoni parenterális táplálás (OPT) során a bélelégtelen betegek szervpótló, életmentő kezelése. Adekvát kezelés mellett a béladaptáció révén a bélelégtelenség reverzibilis lehet, ekkor a betegek leszoktathatók az OPT-ről. Jelen összefoglaló a bélelégtelenség és az RBS klasszifikációját, okait és kezelését taglalja, elősegítendő a klinikusok, az ellátásszervezők és a finanszírozó közti hatékony kommunikációt és kooperációt.
A bélelégtelenség típusai, diagnózis
Bélelégtelenségről beszélünk, amikor a bél felszívó működése és emiatt a táplálékok, és/vagy a folyadék és elektrolitok felszívódása olyan mértékű zavart szenved, hogy az egészség és/vagy a növekedés fenntartásához parenterális pótlásuk szükséges (1, 2). A kórkép gyakoriságát a benignus eredetű krónikus bélelégtelenség (CIF) miatt otthoni parenterális táplálást (OPT) kapó betegek száma alapján becsülik, Európában kb. 5–80 eset/millió lakos (3). Hazánkban az OPT-t kapó betegek száma ettől lényegesen elmarad: 10,2/millió lakos (a Magyar Mesterséges Táplálási Társaság adata). Ezzel szemben, ha a bélből történő felszívódás károsodása nem olyan mértékű, hogy parenterális kiegészítés szükségeltetik, akkor ezt a bélfelszívódás károsodásának nevezzük.
Alapvetően öt különböző patomechanizmus okozhatja: rövidbél-szindróma, bélfisztula, a vékonybél-nyálkahártya kiterjedt működési zavara, bélmotilitási zavar vagy mechanikus obstrukció. A leggyakoribb kóroki tényező a rövidbél-szindróma (RBS), amely felnőttekben az esetek 2/3-áért felel. Bélelégtelenség alakul ki, ha a visszamaradt folytonos vékonybél hossza a Treitz-szalagtól számítva kevesebb mint 200 cm (1, 4). Az RBS leggyakoribb okai a Crohn-betegség, a mesenterialis iszkémia, az intraabdominalis adhéziók, a posztoperatív szövődmények és a radiációs enteritis. Az RBS megfelelő osztályozása elősegíti a kommunikációt a mindennapi klinikai gyakorlatban és a klinikai vizsgálatokban (5). Az eltávolított bélszakasz típusa és hossza határozza meg a tüneteket. Ez alapján három különböző típusú rövidbél-szindrómát különböztetünk meg (1. ábra).
1. ábra: A rövidbél-szindróma anatómiai felosztása.
I. típus: végjejunostomia (A); II. típus: jejunocolicus anastomosis (B); III. típus: jejunoileocolicus anastomosis (C)
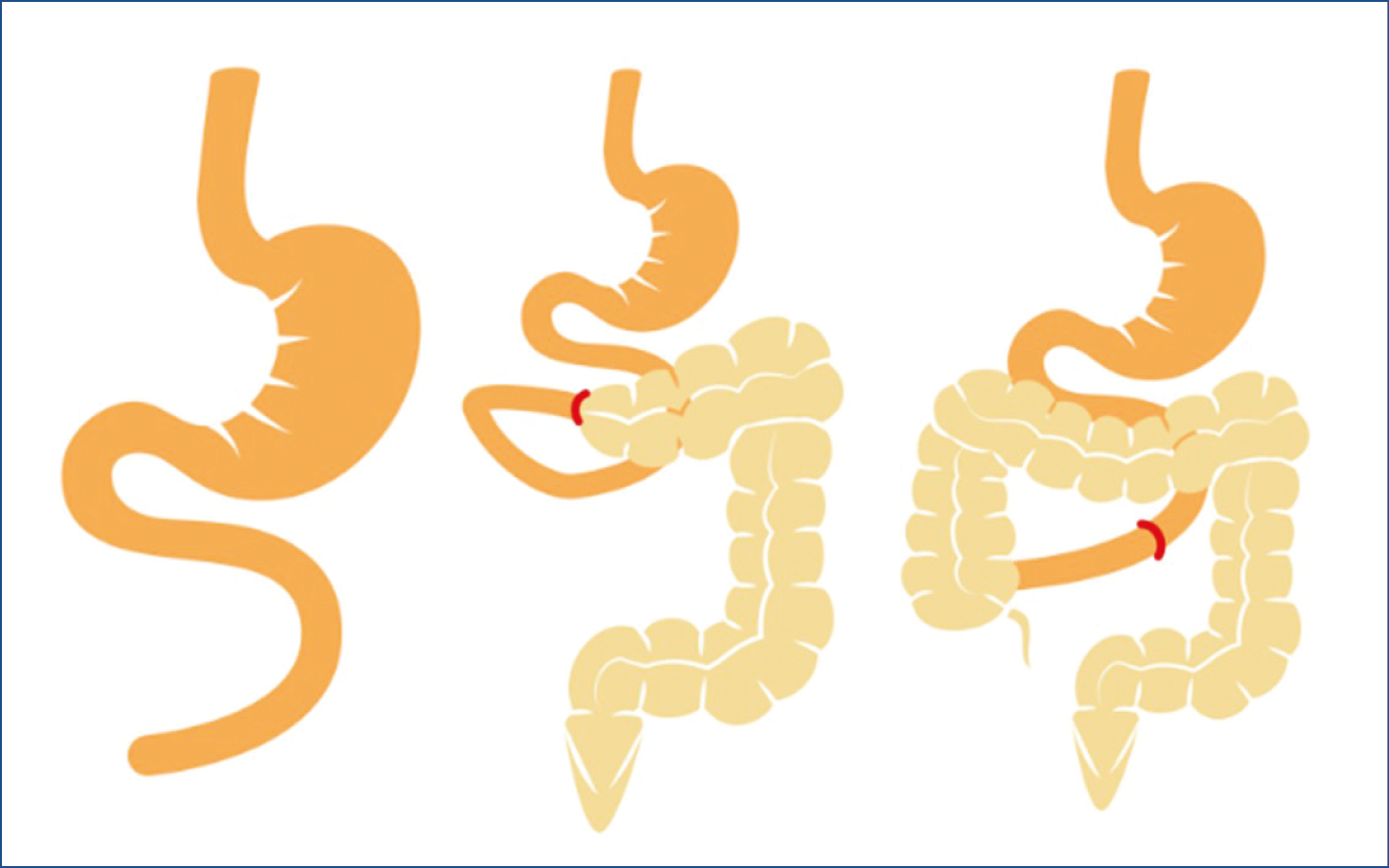
I. típus a végjejunostomia az ileum és a colon eltávolítása után; II. típus, ahol distalis vékonybélcsonkolás után a megmaradt jejunumot a bal colonfélbe szájaztatják; III. típus, ahol a proximális vékonybelet csonkolják, az ileocoecalis billentyű és a colon pedig megmarad. Az I. típus a leggyakoribb (60%), míg a II. és a III. típus ritkább (31, illetve 9%) (6).
Patofiziológiai alapon az RBS két típusát különböztetjük meg: ahol a vékonybél és a vastagbél folytonossága megtartott (II. és III. típus) és ahol ez hiányzik (I. típus). A két típusban alapvetően különbözik a visszamaradt bél alábbi három funkciója: 1) a víz- és a nátrium-visszaszívás; 2) a gasztrointesztinális hormonok szekréciója; 3) a vastagbél-mikrobiom funkciója a rövid láncú zsírsavak termelésében (2). Az RBS posztoperatív kifejlődése alapján megkülönböztetünk korai, rehabilitációs és fennmaradó fázist. A korai fázis a bélreszekció után kezdődik, 3-4 hétig tart, és az akut bélelégtelenség jellemzi. A betegek metabolikusan instabilak, jelentős mennyiségű az elvesztett béltartalom. Nagy a dehidráció, az akut veseelégtelenség, az elektrolit- és sav-bázis egyensúlyzavar veszélye. A rehabilitációs fázis 1-3 évig tart, és a spontán béladaptáció jellemzi. A megmaradt bélszakasz a bélnyálkahártya-hyperplasia, a béltranzit lassítása és az SCFA (short-chain fatty acids, rövid láncú zsírsavak) fokozott termelése révén a felszívódás fokozásával, a folyadék- és tápanyagveszteség csökkentésével optimalizálja a működését. Végjejunostomia (I. típus) esetén a kieső gasztrointesztinális hormonok miatt minimális, vagy el is marad a béladaptáció (7). Klinikailag az RBS járhat bélelégtelenséggel vagy csak a bélfelszívódás károsodásával. A bélelégtelenség súlyossága az alkalmazott parenterális szupplementáció típusával és mennyiségével jellemezhető (1, 2, 5, 8).
A bélelégtelenség klasszikus tünetei a malabszorpció, a hasmenés, a zsíros széklet, a dehidráció és a malnutríció. A bélelégtelenség kórisméje a kórelőzmény és a klinikai tünetek alapján felállítható. A megmaradt bél hosszának megállapításában a műtéti leírás adhat segítséget, illetve MR-enteroklízis végezhető. A citrullin aminosavat az enterocyták szintetizálják, nem veszi fel a máj, nem épül be fehérjékbe, hanem a vesében metabolizálódik. Plazmakoncentrációja jelzi az aktív enterocyták mennyiségét. 20 μmol/l alatti koncentrációja 92%-os szenzitivitással és 95%-os specificitással elkülöníti a reverzibilis és irreverzibilis CIF-et (9). A módszer sajnos csak néhány OPT-centrumban érhető el. Ennek bővítése a Magyar Mesterséges Táplálási Társaság OPT-szekció egyik elsődleges feladata.
Bélelégtelenség terápiája
Dietoterápia
A bélelégtelen betegek számára javasolt étrend számos tényezőtől függ, beleértve az alapbetegséget, a fennálló társbetegségeket, a tápláltsági állapotot, a testösszetételt és a reziduális bélszakasz hosszát. Az étrend meghatározása minden beteg esetében egyéni dietetikai tanácsadást igényel.
Kardinális kérdés a folyadékbevitel mennyisége és összetétele, hiszen az elégtelen felszívódás okán könnyen kialakulhat dehidráció, exsiccosis. A reziduális bélszakasztól, valamint a sztóma típusától függően, 1,5-2 liter folyadékbevitel javasolható. Hipo- vagy hiperozmoláris folyadékok (víz, tea, kávé, gyümölcslevek) a napi folyadékbevitel kevesebb mint 50%-át tehetik ki, azaz legfeljebb 500-1000 ml/nap mennyiségben fogyaszthatók. A fennmaradó folyadékszükséglet pótlására a kedvezőbb felszívódású izotóniás italok (pl. Gatorade, ISO Isotonic Drink) vagy orális rehidráló folyadékok (pl. St. Mark’s oldat, BioGaia ORS) javasolhatóak. Fontos, hogy a folyadékot az étkezések között igya a beteg, hiszen az étkezés alatt, illetve étkezés előtt/után fél órával elfogyasztott folyadék a tápanyagok rosszabb hatékonyságú felszívódását okozza.
Az érintett páciensek számára a napi többszöri, egyszerre kis volumenű étkezés javasolt. Az étrend összetételét számos tényező befolyásolja, de általánosságban elmondható, hogy a malnutríció és sarcopenia rizikó megelőzése/korrekciója érdekében az étrend energia- és fehérjebő. Az energia- és fehérjeigény fedezése érdekében szükség lehet az étrend kiegészítésére per os fogyasztható speciális, gyógyászati célra szánt élelmiszerekkel (tápszerekkel). Az elterjedt tévhittel ellentétben nem szükséges elementáris tápszer alkalmazása, sőt magasabb ozmolaritásuk lévén kerülendők. Előnyben kell részesíteni a por vagy puding állagú tápszereket, tápanyagmodulokat, az adagolásukat pedig minden esetben egyénre kell szabni. Az étrend megtervezése során a zsírbevitel összetételére is figyelmet kell fordítani. Az optimális felszívódás érdekében előnyös lehet a közepes szénláncú zsírsavak (MCT) arányának növelése az étrendben. Fontos megkülönböztetni a vízben oldódó és vízben nem oldódó rostokat, hiszen míg utóbbi mennyiségét korlátozni kell (főleg a posztoperatív időszakban, de IBD alapbetegség esetén a későbbiekben is), addig a vízben oldódó rostok (forrásai pl. alma, sárgarépa, sütőtök, útifűmaghéj, zabpehely) segítenek a széklet állagának optimalizálásában. A natív cukrok gyorsítják a bélmotilitást, ezért a hozzáadott cukrot tartalmazó élelmiszereket kerülni kell, illetve szükség lehet laktózmentes étrendre is. Indokolt lehet a sóbevitel növelése is, különösen teljes kolektómia után (10, 11).
Gyógyszeres kezelés
A gyomorsav-hiperszekréció különösen az IF akut fázisában gyakori, ami a folyadékterhelés révén elárasztja a felső béltraktust, másrészt a pancreasenzimek inaktiválásával további malabszorpciót okoz. Ezért az első 6 hónapban minden betegnek emelt dózisú protonpumpagátló- (PPI-) terápia adandó. Ezután a PPI elhagyása javasolható, mert fokozza a kontaminált vékonybél szindróma (SIBO) kialakulásának a rizikóját az arra eleve hajlamosabb betegcsoportban. A bélreszekció miatt kialakuló hasnyálmirigy-elégtelenség miatt a hasnyálmirigyenzim pótlása javasolt.
A folyadékveszteség és a motilitás csökkentésére első lépésben loperamid adandó, amelynek dózisa 4 × 2–16 mg étkezések előtt 30 perccel és lefekvés előtt. Hatástalanság esetén a terápia codeinnel (4 × 15–60 mg) egészíthető ki. A cholestyramin adása inkább kerülendő. Bélelégtelenségben, különösen a terminális ileum reszekciója esetén a betegeknél epesavhiány alakul ki, amelyet a cholestyramin csak fokoz, ezáltal rontja a zsírok felszívódását, és ez pedig fokozza a hasmenést. Nagy volumenű jejunostomia esetén, ha a folyadék- és elektrolit-háztartás rendezése a korai fázisban nehézkes, octreotid adása javasolt. Azonban az octreotid hosszú távú adása nem javasolt, mert kedvezőtlenül befolyásolja a béladaptációt (11, 12).
Antibiotikum csak bizonyított SIBO esetén javasolt.
Szelektált betegekben glükagonszerű peptid-2 (GLP-2-) analóg alkalmazható. A GLP-2 enteroendokrin hormon, amely a vékony- és a vastagbél enterocytáiban fokozza a növekedést és a sejtproliferációt, ezáltal elősegíti a béladaptációt és a parenterálistáplálás-mentesség elérését bélelégtelenségben. A plazma citrullinszintjének változása jól alkalmazható a GLP-2-analóg-terápia hatékonyságának monitorizálására (9). A teduglutid dózisa napi egyszer 0,05 mg/ttkg szubkután, élethosszig alkalmazandó. A főhatás magyarázza a GLP-2-analógok mellékhatását: a megnövekedett sejtproliferáció miatt fokozott a megmaradt vastagbélben a polip- és a karcinómaképződés rizikója. Ezért a GLP-2-analóg-terápia alkalmazásakor kiemelt szerepe van a kolorektális rákszűrésnek. A kezelés előtt szűrő kolonoszkópia javasolt, majd a terápia elkezdése után 1 évvel, majd 5 évente ellenőrző kolonoszkópia (13, 14). Jelenleg már a hosszú hatású GLP-2-analógok (glepaglutid, apraglutid) is elérhetők (15).
Otthoni parenterális táplálás
Indikációk
Az otthoni parenterális táplálás (OPT) a bélelégtelen betegek esetében indikált. Malignus alapbetegséggel is gyakran kapnak táplálásterápia során OPT-t a bélelégtelen betegek (16). A betegek prognózisát alapvetően az onkológiai alapbetegség stádiuma határozza meg, így
az OPT indikációja egyéni mérlegelés eredménye. A tumoros betegek OPT-kezelése a legújabb irányelv alapján azonban mind palliatív, mind kuratív onkológiai kezelés esetén indokolt. Olyankor is lehet alkalmazni, ha a beteg visszautasítja az enterális táplálást (1). Abban az esetben indikált OPT, ha a túlélés várhatóan 1-3 hónapnál hosszabb, és van remény onkológiai kezelésre is (17).
Kivitelezés
Az OPT egy komplex, életmentő terápia, amely súlyos károkat okozhat, ha nem megfelelően indikálják, készítik elő és adják be. Az OPT-programnak személyre szabott, biztonságos, hatékony és megfelelő táplálkozási támogatási tervet kell biztosítania a kórházból való hazabocsátáskor. A programot ezután az OPT-centrum táplálási teamjének OPT-beteg ellátásában jártas orvosainak és szakértő egészségügyi szakembereinek rendszeresen felügyelniük és értékelniük kell (18, 19).
Az OPT-centrum teendői:
- El kell dönteni, hogy a beteg és családja, a beteg otthoni környezete alkalmas-e az OPT kivitelezéséhez.
- Ideális, ha a beteg az OPT-centrumhoz közel lakik, mert a beteg és családja szállítja haza az iható és parenterális tápoldatok, amelyek tömege sok esetben több tíz kg-ra tehető. Rendszeresen kontrollra kell bejárnia.
- Az OPT-centrum ellenőrzi, hogy a beteg táplálásterápia és alapbetegség szempontjából egyensúlyban van-e. Ezután centrális kanült biztosít, és megkezdi az egy-két hetes edukációs programot. (Edukációs videó megtekinthető az mmtt.hu honlapján.) Az ismereteket a betegnek és/vagy hozzátartozójának el kell sajátítania, és ezután vizsgán kell erről számot adnia.
- A vizsgát követően a beteg egyensúlyi állapotban kerül haza. Erről a háziorvosát és a házi betegellátó szolgálatot értesíteni szükséges.
- A beteg rendszeres gondozása 1-3 havonta a centrumokban történik (1. és 2. táblázat).
1. táblázat: Hazai OPT-centrumok
(https://www.mmtt.hu/opt-szekcio/)

2. táblázat: Otthonukban parenterálisan táplált betegek gondozása
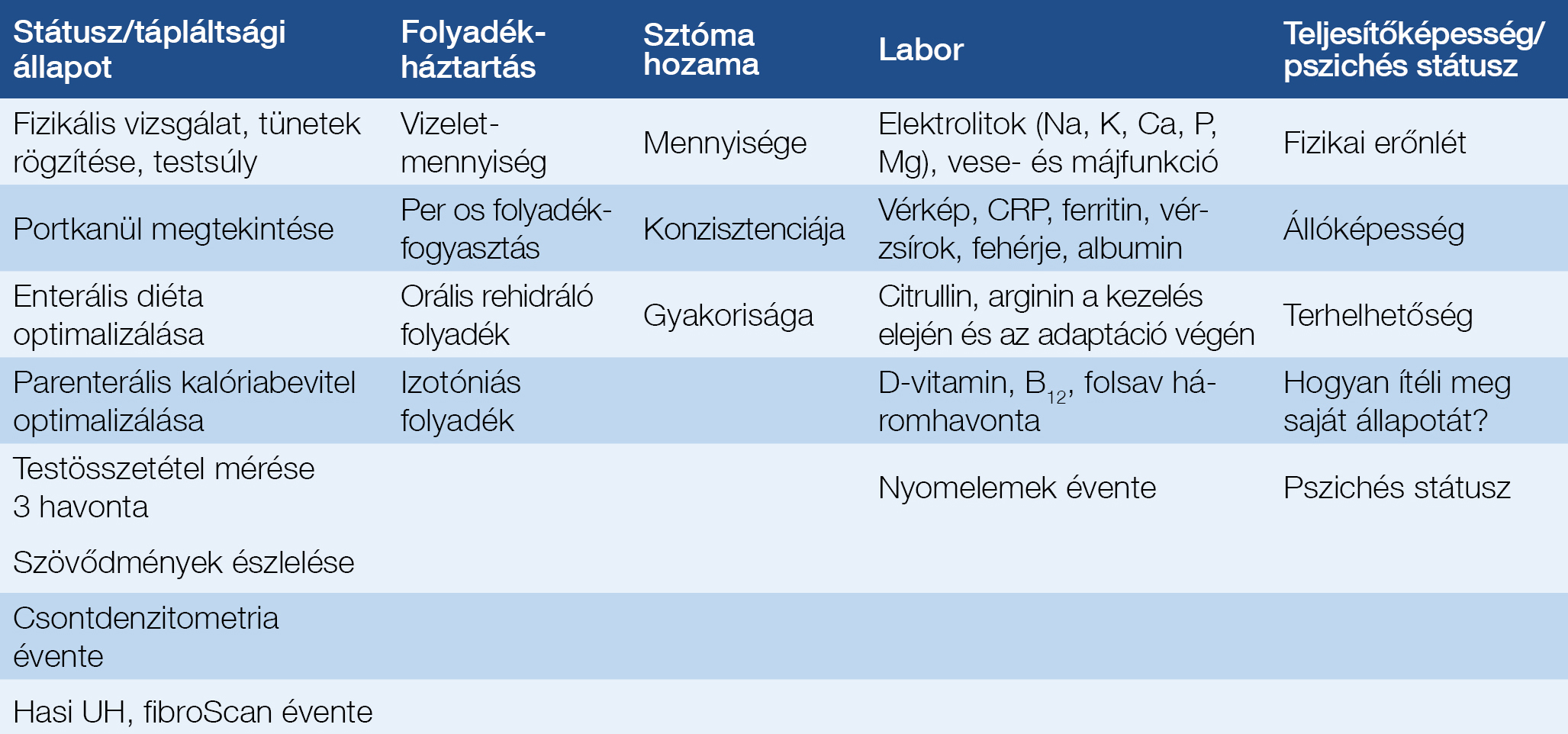
A szövődmények megelőzése
A biztonságos és hatékony OPT-kezelés miatt a terápia eredményessége mellett a kapcsolódó kockázatok minimalizálása fontos. Ennek érdekében a bélelégtelenséget korán kell diagnosztizálni, és hatékonyan kell kezelni. Telefonos kapcsolatot kell biztosítani a gondozáshoz, valamint a logisztikai tervezéshez és szállításhoz. A betegnek tudnia kell önállóan élni, vagy megfelelő ellátást és támogatást kell kapnia. Olyan otthoni környezettel kell rendelkeznie, amely tiszta teret biztosít a steril kiegészítésekhez, az OPT beállításához és a centrális kanülhöz való csatlakozáshoz. Szükség esetén hozzáférhet egy dedikált hűtőszekrényhez a parenterális tápoldatok és kiegészítők tárolására (18). Általános szabály az, hogy az OPT-centrumoknak világos, írásba foglalt betegúttal és protokollal kell rendelkezniük az OPT-vel kapcsolatos szövődmények ellátásában. Betegoktatási programot kell kidolgozni, és a beteget és hozzátartozóját írásban kell tájékoztatni a szövődmények felismeréséről és első ellátásáról.
Szövődmények
- A kanüllel összefüggő fertőzések megelőzése, diagnózisa és kezelése.
• A centrális vénát biztosító eszköz kiválasztását és a kilépési helyét tapasztalt, OPT-ben jártas táplálási teamnek, valamint a páciensnek kell megválasztania.
• Az eszköz kilépési helyének könnyen láthatónak és elérhetőnek kell lennie az öngondoskodó betegek számára.
• Hosszú távú OPT esetén alagúttal ellátott vagy teljesen beültetett centrális kanült kell használni.
• A vena cava superior elérése legyen az első választás a centrális kanül elhelyezéséhez, a v. jugularison vagy v. subclavián keresztül.
• A jobb oldali hozzáférést előnyben kell részesíteni a bal oldalival szemben, a trombózis kockázatának csökkentése érdekében.
• A centrális kanül csúcsát a jobb pitvar–vena cava superior junctio szintjén kell elhelyezni.
• Perifériásan behelyezett centrális vénás katéterek (PICC-line) akkor használhatók, ha az OPT időtartama becslések szerint kevesebb, mint hat hónap.
• PICC-line-t varratbehelyezés nélkül kell használni a fertőzés kockázatának csökkentése érdekében.
• A közép- és hosszú távú PICC-line (>1 hónap) biztosítására szubkután rögzített stabilizáló eszköz használható a migráció megelőzésére és a kötszercsere során időmegtakarításra.
• A hordozható pumpa javíthatja a páciens életminőségét az álló pumpákkal összehasonlítva.
• A centrális kanül kilépési helyét steril gézzel vagy steril, átlátszó, félig áteresztő kötszerrel kell lefedni.
• Ha átlátszó kötszert használnak centrális kanülkilépési helyeken, akkor azok legfeljebb hetente egyszer cserélhetők (kivéve, ha a kötszer szennyezett vagy laza).
• Egy alagúttal ellátott centrális kanül esetén, jól begyógyult kilépési hellyel, előfordulhat, hogy nem kell kötözni az elmozdulás megelőzése érdekében.
• Az OPT beadására szolgáló infúziós szerelékeket az infúzió megkezdését követő 24 órán belül ki kell cserélni.
• Szigorú aszeptikus technikát kell fenntartani az otthoni centrális kanül gondozásában.
• Kézi antiszepszist és aszeptikus, érintésmentes technikát kell alkalmazni a kötszer cseréjekor a centrális kanülökön.
• 0,5-2%-os alkoholos klórhexidinoldatot kell használni a kötéscsere és a bőrantiszepszis során. Ha a klórhexidin-ellenjavallat áll fenn, akkor jódtinktúrát, jódforost vagy 70%-os alkoholt kell használni alternatívaként.
• A kézfertőtlenítést, akár szappannal és vízzel, de lehetőleg alkoholos kézdörzsöléssel végezzük el közvetlenül a centrális kanülhoz való hozzáérés előtt, és a procedúra végén is.
• Tű nélküli csatlakozót kell használni az infúziós szerelékekhez való csatlakozáskor.
• Az osztott szeleppel rendelkező, tű nélküli rendszereket előnyben részesíthetik egyes mechanikus szelepekkel szemben a mechanikus szelepekkel való fertőzés fokozott kockázata miatt.
• A szennyeződés kockázatát minimalizálni kell a tű nélküli csatlakozókkal, a megfelelő fertőtlenítőszerrel (alkoholos klórhexidin-készítmény vagy alkohol 70%) dörzsöléssel, és csak steril eszközökkel szabad hozzáférni.
• A hub-csatlakozók (tű nélküli eszközök) passzív fertőtlenítéséhez antiszeptikus zárókupakokat kell használni.
• Ha az OPT-t intravénás porton keresztül juttatják be, a hozzáférési portokhoz vezető tűket hetente legalább egyszer ki kell cserélni.
• A centrális kanült vagy azt a területet nem szabad védelem nélkül víz alá meríteni.
• Heparin helyett 0,9%-os nátrium-kloridot kell használni a hosszú távú centrális kanül zárására.
• A katéterrel kapcsolatos véráramfertőzés (CRBSI) megelőzésének további stratégiájaként taurolidinzárást kell alkalmazni kedvező biztonsági és költségprofilja miatt.
• A többlumenű katéterekben külön lument kell használni a PT-infúzióhoz.
• A centrális kanülből a rendszeres vérmintavételt lehetőleg kerülni kell a szövődmények fokozott kockázata miatt.
Minden 100 OPT-s betegből 8 kanülszepszis miatt hal meg. Előfordulási gyakorisága az OPT fontos minőségi mutatója, 0,14–1,09/1000 táplálási nap.
A kanülszepszis diagnózisa: láz, hidegrázás, pozitív hemokultúrák, UH-val észlelt vegetációk jelenléte. Ne távolítsuk el a CVC-ket vagy a PICC-ket pusztán láz alapján, ha a fertőzés eredete máshol mutatható ki, vagy ha a láz nem fertőző okának gyanúja merül fel (20).
2. Kanültrombózis. A katéterelzáródás előfordulási gyakorisága OPT-betegeknél 0,07 epizód/katéter/év (0,059–0,083) (18). Az OPT-vel kezelt 100 beteg közül 2 beteg ebben a szövődményben hal meg, ezért fontos az időben történő felismerésük és kezelésük. Az urokinázzal, sztreptokinázzal vagy szöveti plazminogén aktivátorral végzett trombolízist sikeresen alkalmazták az eltömődött centrális kanül elzáródásának feloldására.
3. Bélelégtelenséggel összefüggő májbetegség (IFALD).
Előfordulása 0-50%, a mortalitás 0-22% közötti. Az IFALD prevalenciája 13-40% cholestasis, 27-90% steatosis, 2-5% fibrózis és 8–75% „nem osztályozott”, a választott diagnosztikai kritériumoktól függően (18).
Megelőzése és kezelése:
• a szepszis megelőzése vagy kezelése, ha van;
• a vékonybél hosszának megőrzése és a vastagbél megtartása/helyreállítása a vékonybéllel való folyamatosságban;
• az orális/enterális bevitel fenntartása;
• parenterális táplálás volumenpumpával, és ciklusosan szükséges beadni;
• a túltáplálás elkerülése;
• a szójababolaj-alapú lipid dózisának 1 g/kg/nap alá történő korlátozása;
• a hepatotoxikus inzultusok kerülése.
Ha 1 g/ttkg/nap-nál nagyobb dózisú lipidemulziók beadása szükséges, alternatív lipidemulziókat javasolt használni, amelyek a szójababolajat olívaolajjal, MCT-vel és/vagy halolajjal helyettesítik (18).
4. Cholecystolithiasis, choledocholithiasis esetén egyéni mérlegeléssel cholecystectomia indokolt. Prevalenciája 31%. Kialakulásának oka lehet a koplalás miatt az epehólyagot rendszerint kiürítő kolecisztokinin hormon hiánya miatt kialakult epepangás.
5. Bélelégtelenséggel összefüggő veseelégtelenség és kövesség. Előfordulási gyakorisága: 24%. A metabolikus acidózis korrekciója, valamint a citrát- és magnéziumkiegészítés megakadályozhatja a kőképződést.
6. A bélelégtelenséggel összefüggő metabolikus csontbetegség. Előfordulási gyakoriságuk az irodalomban változó, de osteopeniában megközelítőleg 25%, osteoporosisban pedig 28%. A betegeket rutinszerűen ellenőrizni kell a betegség szempontjából csontdenzitometriás vizsgálattal, biokémiával (2. táblázat). Kezelésük megegyezik a nem bélelégtelenséggel összefüggő csontbetegséggel.
Sebészi kezelés
A sebészi kezelés a gasztrointesztinális rekonstrukciós műtéteket és a béltranszplantációt foglalja magában. A rekonstrukciós műtétek (bélhosszabbító, tranzitidőt növelő műtétek, enteroplasztikák) során a visszamaradt bélszakasz manipulálásával maximalizálják a bél abszorpciós kapacitását, és ezáltal minimalizálják a folyadékveszteséget. Válogatott esetekben, specializált centrumokban végezhető (11, 12, 21).
Végső megoldási lehetőség CIF esetén a vékonybél-transzplantáció, amely a következő esetekben indikált: 1) OPT irreverzibilis komplikációi, mint az ismétlődő centrális vénatrombózis, gyakori centrálisvéna-infekció okozta szepszis, kialakuló krónikus májbetegség és gyakori dehidráció; 2) magas mortalitással járó alapbetegség, mint az invazív intraabdominalis desmoid tumor, veleszületett nyálkahártya-betegség és az ultrarövid (<10 cm vékonybél) bél szindróma; 3) magas morbiditással járó CIF; 4 OPT elutasítása (11, 12, 22).
Prognózis
A prognózist számos tényező befolyásolja: a beteg kora, alap- és társbetegségei, a maradék vékonybél hossza, az ileum, az ileocaecalis billentyű és a colon megtartottsága, valamint a tartós parenterális táplálás során kialakuló szövődmények. Az III. típus a legjobb, a I. típus a legrosszabb kórjóslatú. A OPT-re szoruló betegek 5 éves túlélése 64%. Az OPT-s betegek 35%-nál a CIF reverzibilis, azaz a parenterális táplálás leépíthető, mégpedig az esetek 80%-ban az első évben. Az I. típusban 20%, a II. és a III. típusban 40%, illetve 80% az OPT-ről leszoktatás sikeressége. A CIF reverzibilitása összefügg a megmaradt bélszakasz hosszával és az utolsó bélreszekció óta eltelt idővel. Így az OPT-ről való leszoktatásra I. típusban 100 cm-nél hosszabb visszamaradt jejunum és a reszekciótól számított 1 éven belül van esély. A II. típusban >65 cm vékonybél és a vastagbél >50%-ának megmaradása esetén a műtéttől számított 2-3 éven belül, míg a III. típusban >30 cm vékonybél visszamaradása esetén a műtéttől számított 3-5 évig van esély az OPT-ről leszoktatásra (2, 23–25).
A betegek túlélését, morbiditását és a bél rehabilitációját alapvetően befolyásolja a táplálási team szakértelme (2).
Támogatás
A közlemény megírását a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (K128222) és a Szegedi Tudományegyetem, Általános Orvostudományi Kar, Hetényi Géza pályázatai (5S 259) támogatták.
2. Pironi L. Definition, classification, and causes of short bowel syndrome. Nutr Clin Pract 2023; 38 Suppl 1: S9–S16. https://doi.org/10.1002/ncp.10955
3. Winkler M, Tappenden K. Epidemiology, survival, costs, and quality of life in adults with short bowel syndrome. Nutr Clin Pract 2023; 38 Suppl 1: S17–S26. https://doi.org/10.1002/ncp.10964
4. Bajor J. Rövidbél-szindróma. Magy Belorv Arch 2021; 74: 201–205.
5. Matarese LE, Jeppesen PB, O’Keefe SJD. Short bowel syndrome in adults: the need for an interdisciplinary approach and coordinated care. JPEN J Parenter Enteral Nutr 2014; 38(suppl 1): 60S–64S.
https://doi.org/10.1177/0148607113518946
6. Pironi L, Steiger E, Joly F, et al. Characteristics of adult patients with chronic intestinal failure due to short bowel syndrome: an international multicenter survey. Clin Nutr ESPEN 2021; 45: 433–441.
https://doi.org/10.1016/j.clnesp.2021.07.004
7. Tappenden KA. Intestinal adaptation following resection. JPEN J Parenter Enteral Nutr 2014; 38(1 suppl): 23S–31S.
https://doi.org/10.1177/0148607114525210
8. Salazar JA, Carey AN, Duggan CP. Nutritional and medical approaches to intestinal failure. Curr Opin Clin Nutr Metab Care 2023 May 1; 26(3): 201–209. https://doi.org/10.1097/MCO.0000000000000918
9. Crenn P, Messing B, Cynober L. Citrulline as a biomarker of intestinal failure due to enterocyte mass reduction. Clin Nutr 2008; 27(3): 328–339. https://doi.org/10.1016/j.clnu.2008.02.005
10. Nightingale JMD. How to manage a high-output stoma. Frontline Gastroenterology 2022; 13: 140–151.
https://doi.org/10.1136/flgastro-2018-101108
11. Cuerda C, Pironi L, Arends J, et al. ESPEN practical guideline: Clinical nutrition in chronic intestinal failure. Clin Nutr 2021; 40(9): 5196–5220. https://doi.org/10.1016/j.clnu.2021.07.002
12. Radetic M, Kamel A, Lahey M, Brown M, Sharma A. Management of short bowel syndrome (SBS) and intestinal failure. Dig Dis Sci 2023; 68(1): 29–37. https://doi.org/10.1007/s10620-022-07760-w
13. Jeppesen PB, Gilroy R, Pertkiewicz M, Allard JP, Messing B, O’Keefe SJ. Randomised placebo-controlled trial of teduglutide in reducing parenteral nutrition and/or intravenous fluid requirements in patients with short bowel syndrome. Gut 2011; 60: 902–914. https://doi.org/10.1136/gut.2010.218271
14. Hill S. Use of GLP-2 may herald a new era of improved outcome of short bowel syndrome-associated intestinal failure. J Pediatr Gastroenterol Nutr 2020; 71(6): 697–698. https://doi.org/10.1097/MPG.0000000000002924
15. Naimi RM, Hvistendahl M, Enevoldsen LH, et al. Glepaglutide, a novel long-acting glucagon-like peptide-2 analogue, for patients with short bowel syndrome: a randomised phase 2 trial. Lancet Gastroenterol Hepatol 2019; 4: 354–363. https://doi.org/10.1016/S2468-1253(19)30077-9
16. Sowerbutts AT. Home parenteral nutrition for people with inoperable malignant bowel obstruction. Cohren database of Systematic Review 2018; 8: Art. No.: CD012812. https://doi.org/10.1002/14651858.CD012812.pub2
17. A Nemzeti Erőforrás Minisztériuma szakmai protokollja a bélelégtelen betegek otthoni és kórházi parenterális táplálásáról.
https://www.mmtt.hu/wp-content/uploads/2019/11/opt-protokoll.pdf
18. Pironi L, Cuerda C, Jeppesen PB, et al. ESPEN guideline on chronic intestinal failure in adults Update 2023. Clin Nutr 2023; 42(10): 1940–2021. https://doi.org/10.1016/j.clnu.2023.07.019
19. Sahin P, Molnár A, Varga M et al. Klinikai táplálásterápia rövidbél-szindrómában a személyre szabott orvoslás elvei szerint. Orv Hetil 2014; 155: 2054–2062.
20. O’Grady NP, Alexander M, Burns LA, et al. Guidelines for the prevention of intravascular catheter-related infections. Clin Infect Dis 2011; 52(9): e162–93. https://doi.org/10.1093/cid/cir257
21. Urban D, Konig R, Cserni T. A rövidbél-szindróma korszerű sebészi kezelése: autológ rekonstrukció és intestinalis rehabilitáció. Orv Hetil 2020; 161(7): 243–251. https://doi.org/10.1556/650.2020.31655
22. Pironi L, Sasdelli AS. New insights into the indications for intestinal transplantation. Curr Opin Organ Transplant 2021; 26(2): 186–191.
https://doi.org/10.1097/MOT.0000000000000846
23. Lloyd DA, Vega R, Bassett P, Forbes A, Gabe SM. Survival and dependence on home parenteral nutrition: experience over a 25-year period in a UK referral centre. Aliment Pharmacol Ther 2006; 24: 1231e40.
https://doi.org/10.1111/j.1365-2036.2006.03106.x
24. Joly F, Baxter J, Staun M, et al. Five-year survival and causes of death in patients on home parenteral nutrition for severe chronic and benign intestinal failure. ESPEN HAN CIF group. Clin Nutr 2018; 37(4): 1415–1422. https://doi.org/10.1016/j.clnu.2017.06.016
25. Amiot A, Messing B, Corcos O, Panis Y, Joly F. Determinants of home parenteral nutrition dependence and survival of 268 patients with non-malignant short bowel syndrome. Clin Nutr 2013; 32(3): 368–374.
https://doi.org/10.1016/j.clnu.2012.08.007
