Összefoglaló közlemények / Reviews
The role of artificial intelligence in colonoscopy
Summary
AI is now undoubtedly present in colonoscopy diagnostics as well. Its application in the field of quality indicators and polyp detection seems promising, but so far convincing research results have only been obtained for diminutive lesions. AI polyp diagnostics is in an even less developed phase, the separation of neoplastic and non-neoplastic lesions was mostly resolved. In the future AI may create new quality indicators, such as withdrawal speed and decision tools which help to arbitrate of referring a polyp to endoscopic or surgical treatment. Synchronous use of polyp detection and diagnosis will also enable the automatic determination of the adenoma detection rate. The tasks of the near future will be the establishment of appropriate regulations and the coordination of financing with insurance companies. From an ethical point of view, of course, it would not be right for AI to decide independently in the future, so it should remain as a decision support tool.
Összefoglalás
Az AI mára kétségtelenül jelen van a kolonoszkópos diagnosztikában is. Alkalmazása a minőségi indikátorok és a polipészlelés területén ígéretesnek tűnik, de meggyőző kutatási eredmények eddig csak a diminutive léziók tekintetében vannak. A polipdiagnosztika még kevésbé fejlett fázisban van, leginkább a neoplasztikus és a nonneoplasztikus léziók elkülönítése megoldott.
A jövőben a mesterséges intelligencia új minőségi mutatókat hozhat létre, mint például a visszahúzási sebesség, valamint döntési eszközöket, amelyek segítenek eldönteni, hogy egy polip endoszkópos vagy sebészeti kezelésre kerüljön. A polipészlelés és -diagnosztika szinkron használata az adenomadetekciós ráta automatikus meghatározását is lehetővé teszi majd. A közeljövő feladatai a megfelelő szabályozás kialakítása és a finanszírozás biztosítókkal történő egyeztetése. Etikai szempontból természetesen nem lenne helyes, ha az AI önállóan döntene a jövőben, tehát meg kell maradnia döntéstámogató eszközként.
Bevezetés
Corley és munkatársai igazolták, hogy az adenomadetekciós ráta (adenoma detection rate, ADR) 1%-os emelkedése 3%-kal csökkenti a posztkolonoszópos kolorektális karcinóma előfordulását (1). Ez az adat és a hasonló tudományos eredmények rámutattak a polipészlelés növelésének (polyp detection rate, PDR) és az ezt követő azonosítás (neoplasztikus vagy nonneoplasztikus) jelentőségére. Számos eszköztől független gyakorlati ajánlást publikáltak, amely a technikai lehetőségektől függetlenül javíthatja az eredményességet (2, 3, 4). A technikai oldalon is követhetők az ezirányú fejlesztések. A standard kolonoszkópok látószöge maximálisan a 170°-ot érte el, ezért a vakfoltok vizualizálására számos további fejlesztés indult. A kolonoszkóp végére applikálható eszközök (cap, endocuff, endoring, G-EYE) nem hoztak áttörést. A „harmadik szem” (third eye retroscope, TER) egy a munkacsatornán át kivezethető, vékony eszköz volt optikával, amely retroflexióban nézve látta a vak területeket, azonban hátrány volt a két kép figyelésének nehézsége és a hosszabb vizsgálati idő, valamint a csökkent szívóerő és az állandó csere kényszere (pl. biopszia végzésekor) a munkacsatorna elfoglalása miatt (5). A további fejlesztések is a látószög növelésére törekedtek. A FUSE (full spectrum endoscopy) kolonoszkóp látószögét 330°-ra növelték. Gralnek és Kudo munkacsoportjai vizsgálták az adenomatévesztés (adenoma miss rate, AMR) változását, mindkét studyban (tandem – minden beteget egymás után mindkét módszerrel vizsgálták) szignifikáns AMR-csökkenés volt (6, 7). Ennél a fejlesztésnél a nagy látószöget 3 monitorral lehetett belátni, ami a gyakorlatban szintén kényelmetlennek bizonyult. Később folytatódott a széles látószögű kolonoszkópok fejlesztése. Az EWAVC (Extra Wide Angle View Colonoscope) az Olympus projektje volt. Uraoka és munkatársai vizsgálatában az adenomák 57,1%-a volt oldal-hátra nézetben, és a randomizált studyban nem volt különbség az EWAVC és a konvencionális eszköz (high definition-white light, HD-WL) ADR-je között. Itt is hátrány volt a szokatlan képi megjelenés (8). Ennek az eszköznek a további fejlesztése jelenleg is folyik.
A technikai és optikai fejlesztések mellett a polipészlelés javítása területén felmerült az emberi hibaforrás számítógép segítségével történő kiküszöbölése, illetve a polip szövettanának predikciója. A mesterséges intelligencia (artificial intelligence, AI) kialakulását a komputerek (processzorok) fejlődése tette lehetővé. Az első lépés a gépi tanulás (machine learning) volt, amikor a szoftver az adathalmaz felhasználásával, gyakorlással már képes volt az algoritmus kezdeti tudásának fejlesztésére, de ez meglehetősen limitált volt. A további fejlődést a mélytanuló (deep learning, DCNNs [deep convolutional neural networks], az emberi agy neurális hálózatának működését utánozza) algoritmusok jelentették, amelyek az emberi agy működéséhez hasonlóan már effektív tanulásra is képesek voltak. Ezeket megfelelő tananyaggal (pl. expertek által hitelesített endoszkópos képekkel) táplálva, a tanulási fázis végére képesek elérni a „tanítók” szintjét. Ezután a teljesítményüket nem rontja külső tényező (fáradtság, kiégés), ami még az expertek esetén is előfordulhat. Az AI a kolonoszkópos diagnosztikában először a polipészlelés területén (computer aided detection, CADe), majd a polipdiagnosztikában (computer aided diagnosis, CADx) jelent meg. Párhuzamosan az előkészítés minőségét, valamint a kolonoszkópia egyéb minőségi indikátorait értékelő AI-alkalmazások is megjelentek (computer aided quality, CAQ).
Komputerasszisztált polipészlelés (CADe)
Az automatikus polipészlelés kutatása már az ezredfordulón elkezdődött. Különböző módon próbálták a polipokat a róluk készült képek elemzésével azonosítani, az alak- és a szöveti struktúra jellemzőitől egészen az energiatérképig. Azonban az adenomadetekciós rátát (ADR) nem tudták 90% fölé vinni. Ezek a módszerek azonban csak a lézió morfológiájára koncentráltak. A helyzet az ezred második évtizedében változott a deep learning belépésével. Ez a klinikai relevanciától függetlenül minden poliprészletet kinyert a képekből egy algoritmus segítségével. Ennek eredményeképpen a komplex polipkarakterisztika összeállt, amelyet a polipészlelésben (megkülönbözteti a polipot a háttérben levő mucosától) és a szövettan predikciójában (neoplasztikus vagy nonneoplasztikus) egyaránt használni tudott ez az öntanuló rendszer. Misawa és Urban munkacsoportjainak munkája indította el a real-time polipészlelés lehetőségét. Itt már videók és statikus képek tanították a programokat (9, 10). Ezzel elindult a komputerasszisztált polipészlelés (CADe) máig tartó fejlődése. Az elmúlt évtizedben már számos tanulmány született, de ezek retrospektív jellegűek voltak, videókat-képeket használtak (11). Mivel ígéretesek voltak, az elmúlt néhány évben elindultak a prospektív klinikai vizsgálatok, amelyek már élőben, valós időben vizsgálták az AI-alapú rendszerek eredményességét a polipészlelés alakulásában (leginkább az ADR, AMR mérésével).
Repici és munkatársai randomizált, kontrollált vizsgálatban mutatták be a korábban már validált GI Geniust. Az ADR 30%-os növekedést mutatott a CADe-csoportban a hagyományos kolonoszkópiával szemben. Az előny a legkisebb, úgynevezett diminutive polipok (1–5 mm) esetén volt jól látható, és a bal colonfélben (prominens redők, amelyek miatt itt a legnehezebb a redő mögötti polip észlelése). Az APC (adenoma per colonoscopy) szignifikánsan magasabb a CADe-csoportban. Nem volt szignifikáns előny az advanced adenomák (1 cm-nél nagyobb, villosus szerkezet és/vagy high-grade dysplasia) és a serrated (fogazott szövettani szerkezetet mutató) léziók esetében (12). Hasonló felépítésű vizsgálatban az ENDO-AID szignifikánsan növelte az ADR/APC értékét, különösen a diminutive (kicsiny, 1–5 mm) és a flat (lapos) adenomák esetében (13). Az EndoScreener prospektív, multicentrikus, randomizált tandem studyja (CADeT-CS Trial) az USA-ban zajlott, 223 beteget bevonva (szűrő és ellenőrző kolonoszkópia). Az elsődleges végpont az AMR volt, amely a first CADe csoportban szignifikánsan csökkent. Másodlagos végpontként a sessilis serrated lézió (SSL) miss rate (MR) értéke szignifikánsan csökkent, az APC szignifikánsan magasabb volt a first CADe csoportban (14). A SCOUT multicentrikus, randomizált vizsgálata szintén hasonló volt, ott az APC 27%-os emelkedését igazolták (15). Olyan vizsgálatokat is közöltek, amelyek szerint a CADe-rendszerek nem hoznak érdemi javulást.
Levy és munkatársai nagy forgalmú centrumukban összehasonlították az AI (GI Genius) használata előtti és utáni 6 hónapos periódust. Az ADR és a PDR alacsonyabb volt az AI-periódusban, mint a pre-AI időszakban (30,3% vs. 35,2%; p<0,001; 36,5% vs. 40,9%; p=0,004). A vizsgálati idő azonban szignifikánsan rövidebb volt az AI használata alatt. A szerzők szerint az AI bevezetése nem javította a teljesítményt a napi rutinmunkában (16).
A Stanford Egyetem friss közleménye szintén komolyan megingatja az eddigi eredményeket. 3 hónapos periódust elemeztek retrospektív vizsgálatukban. A vizsgálóknak nem kellett paramétereket rögzíteniük, a hipotézist sem ismerték, és az eredményeket az intézeten belüli kontrollvizsgálati helyekkel hasonlították össze (CADe site vs. non-CADe site). Az ADR/APC tekintetében nem volt szignifikáns különbség. A szerzők megállapították, hogy a vizsgálók viszonylagos függetlensége hitelessé teszi az eredményt (17).
Komputerasszisztált polipdiagnózis (CADx)
A CADe-rendszerektől eltérően a CADx különböző modalitásokat – NBI, LCI, BLI, továbbá autofluoreszcens képalkotás, konfokális lézerrel végzett endoszkópia stb. – alkalmaz különböző nagyítással, egészen 500-szorosig. A kromoendoszkópia használatával megalkotott, a mirigyek végkamráinak mintázatára (pit pattern) épülő beosztások indították el – 2010–12 között már megjelentek cikkek. 2016-ban már validált rendszerek, a deep learning segítségével a szöveti karakterisztika numerikus transzformációja felgyorsult. A fő cél a neoplasztikus vs. nonneoplasztikus elkülönítése, majd a submucosalis invázió jeleinek észlelése volt (18, 19).
Az első CADx-rendszer az EndoBRAIN volt, amely az észlelt diminutive polipokat valós időben vizsgálta 520-szoros nagyítással, endocitoszkópia módszerével. Az eredmény elérte az expertek szintjét a neoplasztikus vs. nonneoplasztikus lézió elkülönítésében, és megfelelt a „diagnosis and leave” (diagnosztizáld, és ha nem neoplasztikus polip, akkor hagyd ott) stratégiának (20). A CAD-EYE kombinált, valós idejű (CADe-CADx), AI-alapú rendszer, amely több mint 90%-os diagnosztikus pontosságot ért el az első vizsgálatban (21). Rondonotti és munkatársai nemrég megjelent vizsgálatában a CAD-EYE a rectosigma területi diminutive polipok adenomapredikicióját vetették össze a szövettani diagnózissal. A CAD-EYE esetében az NPV (negative predictive value) 91,0%, az experteknél 91,9% és a non-expert résztvevők esetében 82,3% volt. Tehát a CAD-EYE megfelel az ESGE-elvárásoknak, és leginkább a kevésbé gyakorlott vizsgálókat segíti (22). A GI Genius CADx-rendszere sima fehér fénnyel használható, vizsgálata egyébként hasonló eredményt hozott (23).
A COMBO-CAD studyban a CAD-EYE és a GI Genius CADx-rendszerét hasonlította össze (NPV, diagnosztikus pontosság), és nem talált szignifikáns különbséget (24). Hazai munkacsoport is dolgozik diagnosztikus platform kidolgozásán. A PolypBrain első eredményeiről 2020-ban számoltak be. AI-programjuk betanítását kromoendoszkópos (BLI módban), 50-szeres nagyítással készült képekkel végezték, majd 90% fölötti szenzitivitást és specificitást értek el. A klinikai tesztelés során 31 adenomatosus és 30 hiperplasztikus polipról készült képek értékelését vetették össze három kategóriában: expert, kezdő non-expert és PolypBrain. Az expertek és non-expertek között szignifikáns különbség volt a pontosság, szenzitivitás, specificitás, a PPV (positive predictive value) és az NPV (negative predictive value) tekintetében: 93,03% vs. 72,95%; 92,74% vs. 58,07%; 93,34% vs. 88,34%; 93,85% vs. 83,49% és 93,09% vs. 67,82%. Az expertek és a PolypBrain között nem volt szignifikáns különbség (25).
Rácz és munkatársai a munkacsoportjuk által fejlesztett AIPHP (Artificial Intelligence-based Polyp Histology Prediction) szoftver pontosságát vizsgálták a szövettani predikció tekintetében a NICE klasszifikációval (NBI International Colorectal Endoscopic classification) összehasonlítva. A vizsgálatokat (279 beteg, 373 polip) HD kolonoszkóppal, nagyítás (max. 65-szörös, optimálisra állítva) és kromoendoszkópia (NBI) alkalmazásával végezték. Minden polipot eltávolítottak és szövettanilag feldolgoztak. Az AIPHP a diminutive polipos csoportban (1–5 mm) szignifikánsan gyengébben teljesített, mint a 6–10 mm-es polipok esetében (82,1% vs. 92,2%; p=0,0032), míg a NICE klasszifikáció alkalmazásakor markánsan jobb eredmények születtek mindkét csoportban (95,2% és 99,4%). A hiperplasztikus polipok szövettani predikciója tekintetében A NICE szignifikánsan pontosabb volt (95,2% vs. 82,1%; p50% és nagy gyakorlat az endoszkópos képek értékelésében). Ezután a rendszer és az expertek által képzett score (pontszám) összehasonlítását végezték el 80 kolonoszkópos videó segítségével, és nagyfokú egybeesést igazoltak (Spearman-korreláció). Végül élőben a vizsgálatok során értékelték a használhatóságát, amelyet jónak találtak, és tervezik a rendszer jelzéseinek és a vizsgálati minőség javulásának további vizsgálatát (28).
A Duloy és munkatársai által kidolgozott FEQ-score 0-5 között (gyenge/elfogadható/jó/nagyon jó/kitűnő) pontoz, aszerint, hogy a redők mögé milyen arányban tekintett a vizsgáló, és ez milyen vizualizációt biztosított (29).
Liu és munkatársai munkájukban a GINets nevű, AI-alapú rendszer fejlesztését és klinikai alkalmazását mutatják be. A GINets két elemből áll, az első (DCNN1) az informatív képeket, a második (DCNN2) a lument, illetve a falat ábrázoló képeket szelektálja kvadránsonként és az összes kép arányában. A klinikai vizsgálat során a három expert és a GINets 103 videó és kép alapján értékelte 11 vizsgáló anyagát (FEQ-score 5 szegmensben). Az expertek és a GINets átlagos FEQ-score értéke szignifikáns korrelációt mutatott (Pearson-korreláció). A vizsgálók ADR alapján képzett két csoportjában fejenként további 6 vizsgálatot végeztek el, felerészben a GINets asszisztálásával. A GINets értékelése alapján a magas ADR-es csoportban szignifikánsan magasabb volt a FEQ-score. Az alacsony ADR-es csoportban az AI-asszisztencia szignifikánsan növelte a FEQ-score értékét (mind a GINets, mind az expertek értékelése szerint), a magas ADR-es csoportban viszont nem volt szignifikáns az emelkedés. Mindez azt igazolja, hogy azok a vizsgálók, akik jobb minőségben (alaposabban, akkurátusan több redő mögé nézve) vizsgálnak, azok magas adenomaészlelési arányt érnek el (30).
Összefoglalás
Az AI előnye a kolonoszkópiában több szempontból értelmezhető. A minőségi vizsgálat értékelése és biztosítása eddig vizsgálófüggő volt, az AI kiküszöböli az emberi szempontokat (fáradtság, kiégés) még az expertek esetén is. Az AI a minőség fenntartását könnyen, gyorsan és hatékonyan végzi, nincs szükség hozzá infrastruktúrára, állandó szervezésre és tréningekre. A CADe térnyerése egyértelmű, de előnye egyelőre csak a diminutive (kicsiny, 1–5 mm) polipoknál látható – csak egy vizsgálatban számoltak be az 5–9 mm-es kategóriában szignifikáns eredményről. A vizsgálatok döntően nem Európában zajlottak, az ázsiaiak egy munkahelyen végzett vizsgálataiban más betegek és más szakértők vettek részt, és valószínűleg más volt az alap-ADR is. További vizsgálatok szükségesek, minél több polipdetektálás és világszerte prospektív-multicentrikus vizsgálatok kellenek, hogy ez csökkenti-e a PCCRC- (post colonoscopos colorectalis carcinoma) mortalitást. A CADx már eléri a neoplasztikus és nonneoplasztikus elkülönítés szintjét, de vannak korlátok: a lapos fogazott adenomát (sessilis serrated adenoma, SSA) és a hiperplasztikus polipot egyformának látja, kell ilyen study is. A submucosalis invázió jelzésében is fejleszteni kell → mélység, majd nyirokcsomó-metastasis predikciója (31).
Az endoszkópgyártók várhatóan beépítik saját platformjukat az általuk gyártott eszközökbe. A jelenleg elérhető platformok listája folyamatosan bővül (1. táblázat).
1. táblázat: Elérhető és engedélyezett AI-modalitások a kolonoszkópiában
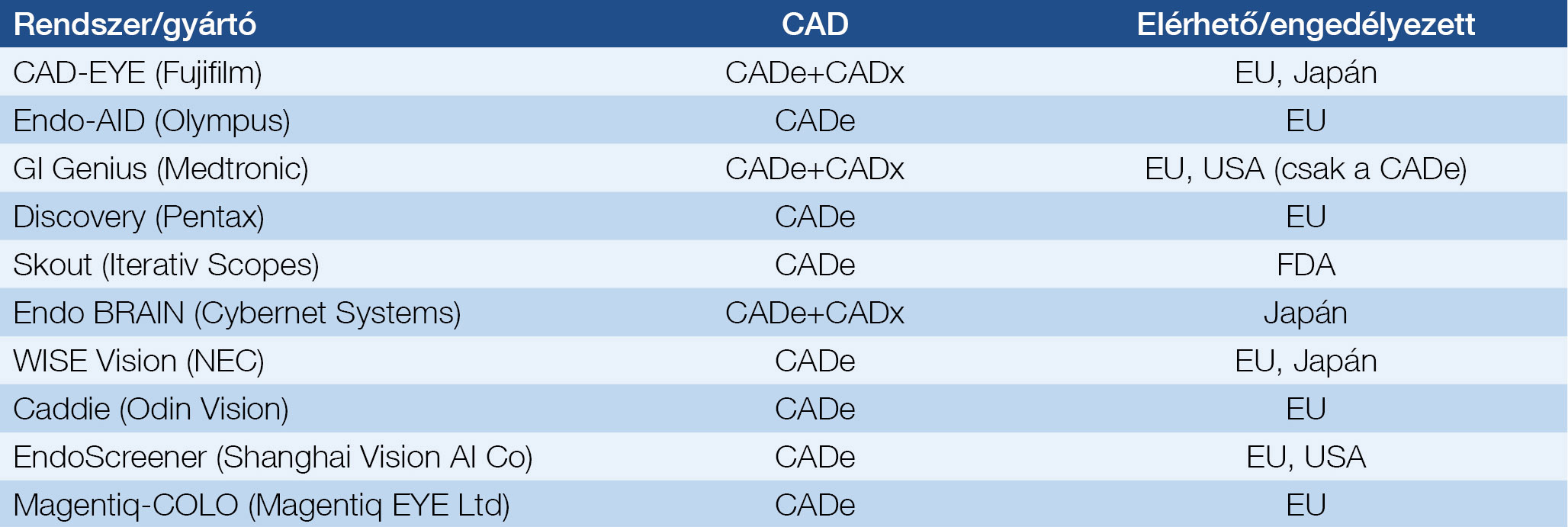
Az ESGE (European Society of Gastrointestinal Endoscopy) az AI alkalmazásával kapcsolatosan állásfoglalást adott ki (32). Eszerint a különböző alkalmazások akkor elfogadhatók és alkalmazhatók a klinikai gyakorlatban, ha igazoltan elérik a gyakorlott endoszkópos szintjét, a fals pozitív arány nem növeli szignifikánsan a visszahúzási időt (CADe), a diminutive polipok optikai diagnózisában (CADx) elérik a live-in-situ (hagyd bent) és a resect-and-discard (vágd le és dobd el – nem kell kiemelni szövettanra) stratégia standardját. Az utóbbi kettőt akkor, ha az optikai diagnózis biztosan pontos (simple optical diagnosis accurasy, SODA), és a polip nem neoplasztikus, valamint a rectum-sigma területén található. Elvárás továbbá, hogy a nagyobb polipok (≥6 mm) optikai diagnózisakor (CADx) el kell érni a tapasztalt expertek szintjét az endoszkóposan eltávolítható polipok kiválasztásában (33).
Az AI rövidesen képes lesz a leletek standardizálására és automatizálására, valamint validálására, beleértve a fotódokumentációt és a minőségi indikátorokat. A CADe-CADx szinkron használata lehetővé teszi majd az automatikus ADR-meghatározást. A további jövő a nyert adatok összefüggéseinek azonosítása és azok klinikai felhasználása (34). Rövidesen lehetéséges lesz a talált elváltozások lokalizációjának azonosítása is (35).

2. Cadoni S. Practical and low-cost strategies to increase the adenoma detection rate. Endoscopy 2020; 52: 249–250.
3. Neilson LJ, et al. Sustained colonoscopy quality improvement using a simple intervention bundle Endoscopy 2020; 52: 285–292.
4. Kaminski MF, Thomas-Gibson S, Bugajski M, Bretthauer M, Rees CJ, et al. Performance measures for lower gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2017; 49: 378–397.
5. Leufkens AM, Demarco DC, Rastogi A, Akerman PA, Azzouzi K, et al. Effect of a retrograde-viewing device on adenoma detection rate during colonoscopy: The TERRACE study. Gastrointest Endosc 2011; 73: 480–489.
6. Gralnek IM, Siersema PD, Halpern Z, Segol O, Melhem A, et al. Standard forward-viewing colonoscopy versus full-spectrum endoscopy: An international, multicentre, randomised, tandem colonoscopy trial. Lancet Oncol 2014; 15: 353–60.
7. Kudo T, Saito Y, Ikematsu H, Hotta K, Takeuchi Y, et al. New-generation full-spectrum endoscopy versus standard forward-viewing colonoscopy: A multicenter, randomized, tandem colonoscopy trial (J-FUSE Study). Gastrointest Endosc 2018; 88: 854–64.
8. Uraoka T, Tanaka S, Oka S, Matsuda T, Saito Y, et al. Feasibility of a novel colonoscope with extra-wide angle of view: A clinical study. Endoscopy 2015; 47: 444–448.
9. Mishawa M, Kudo S, Mori Y, Cho T, Kataoka S, et al. Artificial Intelligence-Assisted Polyp Detection for Colonoscopy: Initial Experience. Gastroenterology 2018; 154: 2027–2029.
10. Urban G, Tripathi P, Alkayali T, Mittal M, Jalali F, et al. Deep Learning Localizes and Identifies Polyps in Real Time With 96% Accuracy in Screening Colonoscopy. Gastroenterology 2018; 155: 1069–1078.
11. Wang P, Xiao X, Glissen Brown JR, et al. Development and validation of a deep-learning algorithm for the detection of polyps during colonoscopy. Nat Biomed Eng 2018; 2: 741–748.
12. Repici A, Badalamenti M, Maselli R, Correale L, Radaelli F, et al. Efficacy of real-time computer-aided detection of colorectal neoplasia in a randomized trial. Gastroenterology 2020; 159: 512–520.
13. Gimeno-Garcia AZ, Negrin DH, Hernández A, Nicolás-Pérez D, Rodríguez E, et al. Usefulness of a novel computer-aided detection system for colorectal neoplasia: a randomized controlled trial. Gastrointest Endosc 2023; 97: 528–536.
14. Brown JRG, Mansour NM, Wang P, Chucchuca M, Michenberg SB, et al. Deep Learning Computer-aided Polyp Detection Reduces Adenoma Miss Rate: A United States Multi-center Randomized Tandem Colonoscopy Study (CADeT-CS Trial). Clinical Gastroenterology and Hepatology 2022; 20: 1499–1507.
15. Shaukat A, Lichtenstein DR, Somers SC, Chung DC, Perdue DG, et al. Computer-Aided Detection Improves Adenomas per Colonoscopy for Screening and Surveillance Colonoscopy: A Randomized Trial. Gastroenterology 2022; 163: 732–741.
16. Levy I, Bruckmayer L, Klang E, Ben-Horin S, Kopylov U. Artificial Intelligence-Aided Colonoscopy Does Not Increase Adenoma Detection Rate in Routine Clinical Practice. Am J Gastroenterol 2022; 117(11): 1871–1873.
17. Ladabaum U, Shepard J, Desai YWM, Singer SJ, Mannalithara A. Computer-aided Detection of Polyps Does Not Improve Colonoscopist Performance in a Pragmatic Implementation Trial. Gastroenterology 2023; 164: 481–483.
18. Kamitani Y, Nonaka K, Isomoto H. Current Status and Future Perspectives of Artificial Intelligence in Colonoscopy. J Clin Med 2022; 11: 2923.
19. Horiuchi H, Tamai N, Kamba S, Inomata H, Ohya TR, Sumiyama K. Real-time computer-aided diagnosis of diminutive rectosigmoid polyps using an autofluorescence imaging system and novel color intensity analysis software. Scand J Gastroenterol 2019; 54: 800–805.
20. Mori Y, Kudo SE, Misawa M, Saito Y, Ikematsu H, et al. Real-time use of artificial intelligence in identification of diminutive polyps during colonoscopy: A prospective study. Ann Intern Med 2018; 169: 357–366.
21. Weigt J, Repici A, Antonelli G, Afifi A, Kliegis L, et al. Performance of a new integrated computer-assisted system (CADe/CADx) for detection and characterization of colorectal neoplasia. Endoscopy 2022; 54: 180–184.
22. Rondonotti E, Hassan C, Tamanini G, Antonelli G, Andrisani G, et al. Artificial intelligence-assisted optical diagnosis for the resect-and-discard strategy in clinical practice: the Artificial intelligence BLI Characterization (ABC) study. Endoscopy 2023; 55: 14–22.
23. Biffi C, Salvagnini P, Dinh NN, Hassan C, Sharma P, et al. A novel AI device for real-time optical characterization of colorectal polyps. NPJ Digit Med 2022; 5(1): 84.
24. Hassan C, Sharma P, Mori Y, Bretthauer M, Rex DK, et al. Comparative performance of artificial intelligence optical diagnosis systems for leaving in situ colorectal polyps. Gastroenterology 2023; 164: 467–469.
25. Lovász BD, Finta Á, Zsobrák K, Szalai M, Bajor J et al. Mesterséges intelligencia alkalmazásának lehetőségei a gasztroenterológiában és az endoszkópiában. Gasztroenterológiai és Hepatológiai Szemle 2020;
6: 2–9.
26. Racz I, Horvath A, Kranitz N, et al. Artificial intelligence-based colorectal polyp histology prediction by using narrow-band image-magnifying colonoscopy. Clin Endosc 2022; 55: 113–121.
27. Zhou W, Yao L, Wu H, Zheng B, Hu S, et al. Multi-step validation of a deep learning-based system for the quantification of bowel preparation: a prospective, observational study. Lancet Digit Health 2021; 3(11): e697–e706.
28. Thakkar S, Carleton NM, Rao B, Syed A. Use of Artificial Intelligence-Based Analytics From Live Colonoscopies to Optimize the Quality of the Colonoscopy Examination in Real Time: Proof of Concept. Gastroenterology 2020; 158: 1219–1221.
29. Duloy A, Yadlapati RH, Benson M, Gavron AJ, et al. Video-based
assessments of colonoscopy inspection quality correlate with quality metrics and highlight areas for improvement. Clin Gastroenterol Hepatol 2019; 17: 691–700.
30. Liu W, Wu Y, Yuan X, Zhang J, Zhou Y, et al. Artificial intelligence-
based assessments of colonoscopic withdrawal technique: a new method for measuring and enhancing the quality of fold examination. Endoscopy 2022; 54: 972–979.
31. Kudo S-E, Ichimasa K, Villard B, Mori Y, Misawa M, et al. Artificial Intelligence System to Determine Risk of T1 Colorectal Cancer Metastasis to Lymph Node. Gastroenterology 2021; 160: 1075–1084.
32. Messmann H, Bisschops R, Antonelli G, Libanio D, Sinonquel P, et al. Expected value of artificial intelligence in gastrointestinal endoscopy: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2022; 54: 1211–1231.
33. Houwen BBSL, Hassan C, Coupé VMH, Greuter MJE, Hazewinkel Y, et al. Definition of competence standards for optical diagnosis of diminutive colorectal polyps: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2022; 54: 88–99.
34. Hassan C, Repici A, Sharma P. Incorporating Artificial Intelligence Into Gastroenterology Practices 2023; 21(7): 1687–1689.
35. Mori Y, Kudo S, Misawa M. Can artificial intelligence standardise colonoscopy quality? Lancet Gastroenterol Hepatol 2020; 5: 331–332.
