Reviews
Functions and heterogeneity of gastrointestinal eosinophil cells
Summary
Eosinophilia is a major hallmark of many chronic inflammatory conditions of the gastrointestinal tract. The prevalence of many of these diseases is increasing dramatically in industrialized countries. This review summarizes the knowledge about gastrointestinal eosinophils, their effector functions, their roles in the regulation of mucosal integrity and in the modulation of intestinal immune responses. Their subtypes that differ in tissue localization and function, and the main differences revealed by animal models and human studies are also discussed.
Összefoglalás
Az eozinofília a gasztrointesztinális traktus számos krónikus gyulladásos állapotának egyik fő jellemzője. Ezen betegségek közül soknak az előfordulási gyakorisága drámai mértékben növekszik az iparosodott országokban. Ez az áttekintés összefoglalja a gasztrointesztinális eozinofilekkel, a sejtek effektor funkcióival, a nyálkahártya integritásának szabályozásában és a bélrendszeri immunválaszok modulálásában betöltött szerepükkel kapcsolatos ismereteket. A szöveti lokalizációban és funkcióban eltérő altípusaikat, valamint az állatmodellek és humán vizsgálatok által feltárt legfontosabb különbségeket is tárgyalja.
Bevezetés
Az eozinofil sejtek a csontvelői közös granulocyta/monocyta progenitorokból származnak, kialakulásukban az IL-5, az IL-3 és a GM-CSF citokinek meghatározó szerepet játszanak. Az IL-5 nemcsak a progenitorok növekedéséhez és éréséhez szükséges, hanem támogatja az eozinofilek toborzását, túlélését és aktiválódását is a szövetekben (1). A csontvelőből kilépő érett eozinofil sejtek csak korlátozott időt töltenek a keringésben, az életidejük 3 és 24 óra között változik (2). A keringésből a szövetekbe történő vándorlásukat fertőzés vagy allergénexpozíció után specifikus kemoattraktánsok, például a CCR3 kemokinreceptorukhoz kötődő eotaxinok irányítják. A szövetekbe jutás után – IL-5, IL-3, GM-CSF és más, túlélést elősegítő citokinek jelenlétében – akár több napig is életben maradhatnak (3). Kisszámú eozinofil sejt nem gyulladásos körülmények között is jelen van számos perifériás szövetben, így a tüdőben, a csecsemőmirigyben, a zsírszövetben, a méhben és az emlőmirigyben is (4). A legnagyobb eozinofilpopuláció azonban a gasztrointesztinális traktus nyálkahártyájában található, ahol a teljes leukocytafrakció 5-25%-át teszik ki. Fontos megjegyezni, hogy kivételnek számít a nyelőcső nyálkahártyája, ahol normál körülmények között eozinofilek nincsenek jelen (5). A szöveti rezidens eozinofil sejtek beépülése a gyomor- és a bélnyálkahártya lamina propriájába már a magzati fejlődés során megkezdődik. Születés után a számukat számos tényező, például a cirkadián ritmus és a kalóriabevitel is befolyásolja. A ciklikus változások finomhangolását a 2-es típusú veleszületett limfoid sejtek (ILC2) által termelt IL-5 végzi (6).
Az eozinofilekre sokáig csak úgy tekintettek, mint speciális effektor sejtekre, amelyek parazitás fertőzésekkel és 2-es típusú gyulladásos betegségekkel állnak kapcsolatban (7). Az aktivált eozinofilek által kibocsátott citotoxikus fehérjék, reaktív oxigéngyökök, citokinek és lipidmediátorok bár hozzájárulnak a paraziták elpusztításához, helyi gyulladás és szövetkárosodás kialakulásához is vezethetnek. A szövetkárosodást okozó képességük és a gyulladásos váladékokban való jelenlétük miatt az eozinofileket hosszú ideig kifejezetten káros immunsejteknek minősítették. Egyre több megfigyelés utal azonban arra, hogy az eozinofilek – a gyulladást elősegítő effektor funkcióik mellett – fontos szerepet játszanak az immun-, a metabolikus és a szöveti homeosztázisban is. Ez a látszólagos ellentmondás a legszembetűnőbben a gasztrointesztinális traktusban figyelhető meg, ahol az eozinofilek normál körülmények között is nagy sűrűségben találhatók meg, a citokinkörnyezet kivételesen hosszú élettartamot biztosít számukra, és ahol hozzájárulnak az immun- és szöveti homeosztázis fenntartásához. Ugyanakkor gyulladásos eozinofilek gasztrointesztinális betegségeket (például eosinophil oesophagitis, eosinophil gastritis, eosinophil enteritis, eosinophil colitis) is képesek kiváltani, és más gasztrointesztinális betegségek (ételallergia, gyulladásos bélbetegség [IBD], Crohn-betegség, colitis ulcerosa) patogenezisében is részt vehetnek (8). Az alábbi alfejezetek áttekintést adnak az eozinofilek komplex működéséről és altípusairól a gasztrointesztinális traktusban.
Az eozinofilek effektor funkciói
Az aktiválódott eozinofilek a citoplazmatikus granulumaikból preformált kationos fehérjéket (fő bázikus protein [MBP], eozinofil peroxidáz [EPO], eozinofil kationos protein [ECP], eozinofileredetű neurotoxin [EDN]) bocsátanak ki. Az MBP membránkárosító hatása révén elpusztítja a parazitákat és a baktériumokat, de toxikus lehet a humán sejtekre is. Az EPO enzim aktivitása reaktív oxigéngyökök képződését eredményezi, amelyek szintén toxikusak a parazitákra, különböző mikrobákra és a saját sejtekre is. Az ECP és az EDN a ribonukleáz A enzim szupercsalád tagjai. Az ECP szintén erősen citotoxikus hatású – a ribonukleáz aktivitásától függetlenül –, az EDN általános sejtölő képessége azonban mérsékelt, elsősorban az RNS-vírusokkal szemben hatékony. Az aktivált eozinofilek Charcot–Leyden-kristály fehérjéket (galectin-10) is kibocsátanak a környezetükbe. A galectin-10 a kationos ribonukleázok hordozójaként működik, így az ECP és az EDN vezikuláris transzportját segíti. Az eozinofilek egyik jellegzetessége, hogy granulumaik nagy mennyiségben raktároznak korábban megtermelt citokineket is. A bazofilek és a hízósejtek aktivációjuk után de novo szintetizálják ezeket a mediátorokat, míg az eozinofilek a megfelelő stimuláció után azonnal kibocsátják a preformált citokineket. A humán eozinofil sejtek granulumaiban jelentékeny mennyiségű, a Th2- (IL-4, IL-5, IL-13) és a Th1- (IL-12, TNF-α, IFN-γ) válaszokkal asszociált citokinek detektálhatók. Az eozinofilek aktiválódása természetesen ezeknek és más citokineknek a de novo szintézisét is kiválthatja. Az eozinofilek citoplazmájában különböző szubsztrátokat és enzimeket tartalmazó lipidtestek is megfigyelhetők, a sejtek aktivációja után itt termelődnek a különböző lipidmediátorok (prosztaglandinok [PGE1, PGE2], leukotriének [LTC4, LTD4, LTE4] és a vérlemezke-aktiváló faktor [PAF]) (9).
Az aktiválódó eozinofilek többféle mechanizmussal is kibocsáthatják granulumaik tartalmát. A klasszikus exocitózis során az egyes granulumok egyesével fuzionálnak a citoplazmamembránnal, és teljes tartalmuk az extracelluláris térbe ürül. Az ilyen „minden vagy semmi” típusú degranuláció inkább a hízósejtekre és a bazofilekre jellemző. Az eozinofileknél exocytosissal történő degranulációt csak akkor figyeltek meg, amikor a sejtek többsejtű paraziták felületére kötődtek. A szakaszos („piecemeal”) degranulációnak az a lényege, hogy a citoplazmatikus granulumok mediátor molekulái szelektív módon, szekréciós vezikulákba csomagolódnak be, és speciális, tubulovezikuláris struktúrákon keresztül érik el a sejtfelszínt. Ez a gyakran megfigyelhető mechanizmus teszi lehetővé, hogy az egyidejű, masszív felszabadulás helyett a mediátorok pontosan szabályozott módon, kisebb adagokban jussanak az extracelluláris térbe. A granulumok tartalmának eddig ismertetett kiürítési módjai nem okozzák az eozinofilek pusztulását, a sejtek megőrzik működőképességüket, és válaszolni tudnak további ingerekre is (4). Ezzel szemben a citolitikus degranuláció akkor valósul meg, amikor az eozinofil sejtek a sejthalál egy specifikus formájában, az ún. ETosisban (extracellular trap cell death) pusztulnak el (10). Ez a fajta sejthalál morfológiailag különbözik mind az apoptosistól, mind a nekrózistól, és magában foglalja a sejtmag membránjának szétesését, valamint a genomi DNS fellazulását a citoplazmamembrán felnyílása előtt. A sejtekből kiszabaduló granulumok ilyenkor intakt formában maradnak, külső felületükön citokin- és leukotriénreceptorok azonosíthatók. A ligandumok kötődése ezekhez a receptorokhoz jelátviteli folyamatokat indít el, ami a granulumok tartalmának szabályozott szekrécióját eredményezi. Az aktivált eozinofilek egy másik módon is képesek
DNS-t kibocsátani a környezetükbe. Bizonyos stimulusok hatására mitokondriális DNS-ből és a granulumokból származó fehérjékből álló, hálószerű struktúra (eozinofil extracelluláris csapda [EET]) ürül a sejtekből, amely antimikrobiális és gyulladáskeltő hatású. A mitokondriális DNS kibocsátása másodpercek alatt, katapultszerű módon történik, és nem okozza az eozinofil sejt pusztulását (11). Nem tisztázott még, hogy milyen aktív mechanizmus teszi lehetővé a mitokondriális genom kilövellését az élő sejtekből.
Az eozinofilek szerepe az intesztinális barrierfunkció szabályozásában
Bár a szöveti rezidens eozinofilek funkcióit in vivo humán vizsgálatokban nehéz feltárni, az in vitro és preklinikai modellekből származó adatok arra utalnak, hogy ezek a sejtek jelentős hatást gyakorolnak a nyálkahártya barrierfunkciójára. A barrier működése szoros összefüggést mutat az eozinofil sejtek számával a bélnyálkahártyában (12). Az eozinofilek teljes hiánya a bélhám permeabilitásának fokozódásával jár, amint azt kísérletileg kimutatták magas zsírtartalmú táppal etetett egerekben (13). Fordított jelenség figyelhető meg a nyelőcsőben, ahol a megnövekedett sejtszám okozza a barrier működésének zavarát eosinophil oesophagitis esetén (14). Az eozinofilek és a bélhámsejtek közelsége megkönnyíti a két sejttípus közötti kétirányú kommunikációt. Számos tanulmány kimutatta, hogy a légutak hámsejtjeihez hasonlóan a bélhámsejtek is termelnek olyan immunmoduláló citokineket, kemokineket és növekedési faktorokat, amelyek nagymértékben befolyásolják az eozinofilek toborzását, túlélését és aktiválódását (5, 15). Az eozinofilek viszont szabályozzák a nyálka termelődését, hozzájárulva ezzel a bélhám fertőzések elleni védelmének megerősítéséhez. Eozinofilhiányos egerekben szignifikánsan kevesebb számú nyálkatermelő kehelysejt mutatható ki a vékonybélben (16). Ezen túlmenően az eozinofilek által kibocsátott mitokondriális EET a hámsejtréteg alatt egy második fizikai gátat hoz létre, amely korlátozza a bakteriális inváziót (17). A nagy mennyiségű EET-k azonban káros hatással is lehetnek a bélhám integritására. Az EET-k számos komponense ugyanis DAMP-ként (damage-associated molecular pattern) hatva képes aktiválni a veleszületett és az adaptív immunrendszert is, így hozzájárulhat a krónikus gyulladások kialakulásához (18). Az EET-k jelenlétét kimutatták ex vivo vizsgálatokban Crohn-betegekből (17) és eosinophil oesophagitisben szenvedő betegekből származó szöveti biopsziákban (19). Az eozinofil sejtek által kibocsátott reaktív oxigéngyökök, leukotriének és citokinek szintén csökkenthetik a bélhám integritását (20). Eosinophil oesophagitisben az IL-13 leszabályozza az intercelluláris adhéziós molekula, a dezmoglein-1 kifejeződését, ami fokozza a hám átjárhatóságát, és elősegíti a gyulladásos válaszok kialakulását (21). A hámsejtekre gyakorolt közvetlen hatáson túlmenően az eozinofilek azáltal is hozzájárulnak a barrierfunkciók szabályozásához, hogy kiválthatnak szöveti károsodást, de támogathatják a szöveti átépülést/regenerációt is a bélnyálkahártyában. Az eozinofilekből felszabaduló IL-1β és TGF-β elősegítik a fibroblastok aktivációját és proliferációját, segítve ezzel a fibrózis kialakulását (22). Az MBP erős heparanázinhibitor, ami arra utal, hogy az eozinofilek részt vehetnek a proteoglikán lebomlásának megelőzésében, és ezáltal hozzájárulhatnak a proteoglikán felhalmozódásához a fibrotikus szövetekben (23). Szöveti regeneráció során az eozinofilek VEGF (vaszkuláris endothelialis növekedési faktor) termelésével járulnak hozzá az angiogenezishez (24).
Az intesztinális eozinofilek immunmoduláló szerepe
A bélnyálkahártya lamina propriájában egy nagy sejtsűrűségű, speciális immunrendszer működik, amelyben a veleszületett és az adaptív immunitás sejtjei a hám- és stromasejtekkel összhangban hoznak létre hatékony effektor immunválaszokat a kórokozókkal szemben, anélkül, hogy károsítanák a kommenzális és szimbióta mikrobákat (25). Ez a dinamikus együttműködés biztosítja az immunrendszer és a mikrobióta kölcsönösen előnyös kapcsolatát (26). Az eozinofilek számos módon hozzájárulhatnak a bél immunhomeosztázisának fenntartásához, ugyanis mind a veleszületett, mind az adaptív immunitás sejtjeinek működését képesek befolyásolni. Az MBP, az ECP és az EPO képes közvetlenül aktiválni a hízósejteket, ami hisztamin felszabadulását eredményezi (27). Az EDN elősegíti a dendritikus sejtek (DC-k) érését és aktivációját, valamint fokozza a DC-k Th2-polarizáló képességét. Egy ételallergia-modellben az eozinofilek EPO-kibocsátással segítették a Th2-immunitás kialakulását, azáltal, hogy fokozták a CD103+ DC-k aktivációját és migrációját a nyirokcsomókba (28). Az aktivált eozinofil sejtek MHC-II molekulákat és CD86 kostimulátor molekulákat is kifejeznek a felszínükön. Ennek eredményeként részt vehetnek az intesztinális traktusba vándorló Th-sejtek effektor funkcióinak kiváltásában, valamint ha bejutnak a másodlagos nyirokszervekbe/szövetekbe, ott elindíthatják a naiv, még el nem kötelezett Th-sejtek polarizációját. Egyre több bizonyíték áll rendelkezésre arról, hogy az eozinofilek a Th-sejtek által közvetített lokális immunválaszokat is képesek szabályozni. Az eozinofilek csökkentik a Th17-sejtek számát a vékonybélben az IL-1-receptor-antagonista (IL-1Ra) termelésével, amely az IL-1β természetes inhibitora (29). Az IL-1β ugyanis kulcsfontosságú a Th17-sejtek differenciálódásában és fenntartásában. Az aktivált eozinofilek indolamin-2,3-dioxigenáz (IDO) enzimet expresszálnak, ami a triptofán aminosavat kinureninné alakítja át. A kinurenin a Th1-sejtek számára toxikus, azok apoptosisához vezet. Ez a mechanizmus az immunválaszok Th1/Th2 egyensúlyát a Th2 irányába polarizálja (30). Ezzel összhangban, a Th1-sejtek gyakorisága jelentősen nagyobb az eozinofilhiányos egerek gasztrointesztinális traktusában (31). Egy másik vizsgálat eredményei szerint az intesztinális eozinofilek gátolják a Th2-immunválaszokat a Peyer-plakkokban a fonálférgek által okozott bélfertőzés során (32). Ezek a vizsgálatok arra utalnak, hogy az eozinofilek korlátozhatják a nem megfelelő T-sejt-válaszokat a bélnyálkahártya homeosztázisának elősegítése érdekében, de funkciójuk nagymértékben kontextusfüggő lehet. Az eozinofilek hiánya a bélnyálkahártya szekretoros IgA-termelésének csökkenését, és ezen keresztül a bél mikrobiomjának megváltozását eredményezi (16). Az eozinofilhiányos egerekben az intesztinális traktushoz asszociált lymphoid szövetben is elváltozások mutathatók ki. A Peyer-plakkok kisebbek és kevesebb sejtet tartalmaznak, valamint a lamina propriában is kevesebb T-lymphocyta és DC van jelen (16).
Az eozinofilek közvetetten is befolyásolhatják az effektor T-sejtek válaszait, elősegítve a regulátor T-sejtek (Treg-sejtek) differenciálódását. Eozinofilhiányos egerekben a bél Foxp3+ Treg-sejtjeinek gyakorisága jelentősen alacsonyabb, ami korrelál a TGF-β csökkent termelődésével (33). Egy in vitro vizsgálat igazolta, hogy az intesztinális eozinofilek képesek a naiv T-sejtek Foxp3+ Treg-sejtekké történő differenciálódását indukálni TGF-β1 és retinsav termelésével (34). Nemrégiben egy elkülönülő, a mikrobióta által indukált Treg-alcsoport létezését írták le, amely expresszálja a RORγt nukleáris hormonreceptort, és szabályozza a gyulladásos folyamatokat a bélben (35, 36). Normál körülmények között, bakteriális fertőzést vagy allergénexpozíció után a neuropilin–RORγt+Foxp3+ intesztinális Treg-sejtek nem fejlődnek ki eozinofil sejtek, illetve az eozinofil sejtek által termelt TGF-β hiányában (37).
Az intesztinális eozinofilek altípusai
Az eozinofilek dinamikus szerepe a gyulladásos gasztrointesztinális betegségekben – ahol mind gyulladást fokozó, mind protektív hatást kifejthetnek –, valamint a féregfertőzésekben megfigyelt változatos válaszaik funkcionálisan eltérő eozinofil szubpopulációk létezésére utalnak. Valóban kimutatták, hogy az intesztinális eozinofilek két fenotípusosan és térben különálló csoportként léteznek: az egyik a lamina propriában található, és konstitutívan kifejezi az antigénprezentációban szerepet játszó MHC-II és CD86 molekulákat, a másik pedig az intraepithelialis kompartmentben található, és fokozottan expresszálja a CD11c, CD11b és a Siglec-F molekulákat (38). Egy másik kísérletben az intesztinális eozinofilek egysejtes transzkriptom analízisét végezték el (39). Azonosították az intesztinális eozinofilek aktív és bazális szubpopulációját, amelyeknek különböző a transzkriptoma, felszíni proteomja és a térbeli lokalizációja (39). Kimutatták, hogy az IL-33 és az IFN-γ indukálja az aktív eozinofilek felhalmozódását a gyulladt vastagbélben. Az aktív eozinofilek baktericid és T-sejt-szabályozó aktivitással rendelkeznek, és kifejezik a CD80 és PD-L1 molekulákat. Az aktív eozinofilek a gyulladásos bélbetegségben szenvedő betegekben a lamina propriában dúsulnak fel, és szorosan kapcsolódnak a CD4+ T-sejtekhez. A megfigyelések alapján ennek a sejttípusnak meghatározó szerepe lehet a bél homeosztázisában, az immunszabályozásban és az antibakteriális védekezésben (39).
„Egerek és emberek”
Az IL-5 központi szerepet játszik az eozinofil sejtek kialakulásában és effektor feladatainak támogatásában, ezért az IL-5 elleni biológiai terápiák hatékonyak lehetnek az eozinofil sejtek által mediált betegségekben. Jelenleg kétféle anti-IL-5 monoklonális ellenanyag érhető el, a mepolizumab és a reslizumab (1. táblázat). Mindkét ellenanyag úgy hat, hogy az IL-5-höz kapcsolódva megakadályozza annak az IL-5 receptorhoz való kötődését. Egy másik stratégia is létezik az IL-5 hatásának gátlására, az IL-5-receptor blokkolása. A benralizumab az IL-5-receptor α alegységéhez (IL-5Rα) kötődik (1. táblázat).
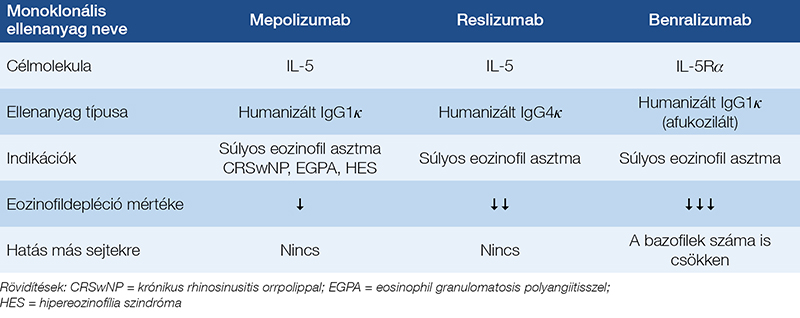
A sejtek felszínére kötődő ellenanyagok az antitestfüggő, sejtközvetített citotoxicitás (ADCC) aktiválásával az eozinofilek NK sejtek vagy makrofágok általi elpusztítását váltják ki (40). Ilyen mechanizmussal működik a még engedélyezés alatt álló lirentelimab (AK002) is, amely az érett eozinofil sejtek felszínén kifejeződő Singlec-8 molekulához kapcsolódik (41). Az egereken végzett kísérletek eredményei jelentős mértékben hozzájárultak ezeknek a biológiai terápiáknak a kifejlesztéséhez. Az eozinofilek homeosztatikus működését szintén elsősorban egérmodellekből ismerjük. Az egészséges, normál szövetekben tapasztalt összetett funkcióik miatt bizonyos fokú félelem volt azzal kapcsolatban, hogy az eozinofil sejteket célzó terápiák esetleg nemkívánt mellékhatásokat okozhatnak. Ezek az aggodalmak különösen a fertőzésekkel szembeni csökkent védekezés és a károsodott anyagcsere elméleti lehetőségével voltak kapcsolatosak. Azonban ezek a félelmek az eddigi tapasztalatok alapján szerencsére nem igazolódtak. Az IL-5-öt és az IL-5Rα-t célzó terápiák számos eozinofil sejtekkel asszociált betegség kezelésében hatásosak, és jó biztonsági profillal rendelkeznek (41). Csakúgy, mint az egereknél, az eozinofileknek az IL-5-től való függése az emberekben sem teljes mértékű, ami részben magyarázatot ad a mepolizumab és a reslizumab csökkent képességére, hogy depletálja az eozinofil sejteket. Fontos megjegyezni, hogy a benralizumab és a lirentelimab, amelyek a sejtfelszíni IL-5Rα-hoz, illetve a Siglec-8-hoz kötődnek, elpusztítják az eozinofileket, ezáltal közel teljes eozinofilhiányt okoznak. Ezeknek a biologikumoknak a használata segíthet megérteni az eozinofilek szerepét az emberi szervezetben, különös tekintettel arra, hogy szükség van-e ezekre a sejtekre a normál szöveti működésekhez, illetve milyen mértékben járulnak hozzá a különböző betegségek patogeneziséhez. A vizsgálatok eredményei bebizonyították, hogy a humán eozinofileknek betegségokozó szerepük van számos gyakori és ritka kórképben, például a súlyos asztmában és a hipereozinofil szindrómában (41). Az eddigi megfigyelések viszont cáfolják, hogy a humán eozinofileknek kulcsfontosságú szerepük lenne a fiziológiás folyamatokban, mivel az eozinofilhiányos embereknél nem alakul ki nyilvánvaló betegségre való hajlam. Az eozinofil sejteket elimináló kezelések hosszú távú hatása azonban még nem ismert, ezért további vizsgálatokra van szükség. A mellékhatások elmaradásával kapcsolatos jogos észrevétel, hogy a klinikai vizsgálatokat és a forgalomba hozatal utáni követéses vizsgálatokat többnyire szelektált betegpopuláción (magasabb társadalmi-gazdasági státuszú, egészségbiztosítással rendelkező betegeken) végzik. Ezért nem biztos, hogy a következtetések általános érvényűek, és így nem feltétlenül alkalmazhatók más betegségekben szenvedő és/vagy eltérő parazitafertőzöttségű populációkra (41).
https://doi.org/10.1093/intimm/dxp102
2. Farahi N, et al. Use of 111-Indium-labeled autologous eosinophils to establish the in vivo kinetics of human eosinophils in healthy subjects. Blood 2012; 120(19): 4068–71. https://doi.org/10.1182/blood-2012-07-443424
3. Park YM, Bochner BS. Eosinophil survival and apoptosis in health and disease. Allergy Asthma Immunol Res 2010; 2(2): 87–101.
https://doi.org/10.4168/aair.2010.2.2.87
4. Weller PF, Spencer LA. Functions of tissue-resident eosinophils. Nat Rev Immunol 2017; 17(12): 746–760. https://doi.org/10.1038/nri.2017.95
5. Mishra A, et al. Fundamental signals that regulate eosinophil homing to the gastrointestinal tract. J Clin Invest 1999; 103(12): 1719–27.
https://doi.org/10.1172/JCI6560
6. Nussbaum JC, et al. Type 2 innate lymphoid cells control eosinophil homeostasis. Nature 2013; 502(7470): 245–8.
https://doi.org/10.1038/nature12526
7. Rothenberg ME, Hogan SP. The eosinophil. Annu Rev Immunol 2006; 24: 147–74. https://doi.org/10.1146/annurev.immunol.24.021605.090720
8. Redd WD, Dellon ES. Eosinophilic Gastrointestinal Diseases Beyond the Esophagus: An Evolving Field and Nomenclature. Gastroenterol Hepatol (NY) 2022; 18(9): 522–528.
9. Kanda A, et al. Multiple Biological Aspects of Eosinophils in Host Defense, Eosinophil-Associated Diseases, Immunoregulation, and Homeostasis: Is Their Role Beneficial, Detrimental, Regulator, or Bystander? Biol Pharm Bull 2020; 43(1): 20–30. https://doi.org/10.1248/bpb.b19-00892
10. Ueki S, et al. Eosinophil ETosis and DNA Traps: a New Look at Eosinophilic Inflammation. Curr Allergy Asthma Rep 2016; 16(8): 54.
https://doi.org/10.1007/s11882-016-0634-5
11. Coakley G, Wang H, Harris NL. Intestinal eosinophils: multifaceted
roles in tissue homeostasis and disease. Semin Immunopathol 2021; 43(3): 307–317. https://doi.org/10.1007/s00281-021-00851-2
12. Furuta GT, et al. Eosinophils alter colonic epithelial barrier function: role for major basic protein. Am J Physiol Gastrointest Liver Physiol 2005; 289(5): G890–7. https://doi.org/10.1152/ajpgi.00015.2005
13. Johnson AM, et al. High fat diet causes depletion of intestinal eosinophils associated with intestinal permeability. PLoS One 2015; 10(4): e0122195. https://doi.org/10.1371/journal.pone.0122195
14. Furuta GT, Katzka DA. Eosinophilic Esophagitis. N Engl J Med 2015; 373(17): 1640–8. https://doi.org/10.1056/NEJMra1502863
15. Carlens J, et al. Common gamma-chain-dependent signals confer selective survival of eosinophils in the murine small intestine. J Immunol 2009; 183(9): 5600–7. https://doi.org/10.4049/jimmunol.0801581
16. Jung Y, et al, IL-1-beta in eosinophil-mediated small intestinal homeostasis and IgA production. Mucosal Immunol 2015; 8(4): 930–42.
https://doi.org/10.1038/mi.2014.123
17. Yousefi S, et al. Catapult-like release of mitochondrial DNA by eosinophils contributes to antibacterial defense. Nat Med 2008; 14(9): 949–53. https://doi.org/10.1038/nm.1855
18. Mukherjee M, Lacy P, Ueki S. Eosinophil Extracellular Traps and Inflammatory Pathologies-Untangling the Web! Front Immunol 2018; 9: 2763. https://doi.org/10.3389/fimmu.2018.02763
19. Simon D, et al. Active eosinophilic esophagitis is characterized by epithelial barrier defects and eosinophil extracellular trap formation. Allergy 2015; 70(4): 443–52. https://doi.org/10.1111/all.12570
20. Honda K, Chihara J. Eosinophil activation by eotaxin – Eotaxin primes the production of reactive oxygen species from eosinophils. Allergy 1999; 54(12): 1262–9. https://doi.org/10.1034/j.1398-9995.1999.00170.x
21. Davis BP, et al. Eosinophilic esophagitis-linked calpain 14 is an IL-13-induced protease that mediates esophageal epithelial barrier impairment. JCI Insight 2016; 1(4): e86355. https://doi.org/10.1172/jci.insight.86355
22. Gomes I, et al. Eosinophil-fibroblast interactions induce fibroblast IL-6 secretion and extracellular matrix gene expression: implications in fibrogenesis. J Allergy Clin Immunol 2005; 116(4): 796–804.
https://doi.org/10.1016/j.jaci.2005.06.031
23. Temkin V, et al. Eosinophil major basic protein: first identified natural heparanase-inhibiting protein. J Allergy Clin Immunol 2004; 113(4): 703–9. https://doi.org/10.1016/j.jaci.2003.11.038
24. Nissim Ben Efraim AH, Eliashar R, Levi-Schaffer F. Hypoxia modulates human eosinophil function. Clin Mol Allergy 2010; 8: 10.
https://doi.org/10.1186/1476-7961-8-10
25. Gurtner A, Crepaz D, Arnold IC. Emerging functions of tissue-resident eosinophils. J Exp Med 2023; 220(7). https://doi.org/10.1084/jem.20221435
26. Gurtner A, Gonzalez-Perez I, Arnold IC. Intestinal eosinophils, homeostasis and response to bacterial intrusion. Semin Immunopathol 2021; 43(3): 295–306. https://doi.org/10.1007/s00281-021-00856-x
27. Rosenberg HF, Dyer KD, Foster PS. Eosinophils: changing perspectives in health and disease. Nat Rev Immunol 2013; 13(1): 9–22.
https://doi.org/10.1038/nri3341
28. Chu DK, et al. Indigenous enteric eosinophils control DCs to initiate a primary Th2 immune response in vivo. J Exp Med 2014; 211(8): 1657–72. https://doi.org/10.1084/jem.20131800
29. Sugawara R, et al. Small intestinal eosinophils regulate Th17 cells by producing IL-1 receptor antagonist. J Exp Med 2016; 213(4): 555–67. https://doi.org/10.1084/jem.20141388
30. Long H, et al. A Player and Coordinator: The Versatile Roles of Eosinophils in the Immune System. Transfus Med Hemother 2016; 43(2): 96–108. https://doi.org/10.1159/000445215
31. Arnold IC, et al. Eosinophils suppress Th1 responses and restrict bacterially induced gastrointestinal inflammation. J Exp Med 2018; 215(8): 2055–2072. https://doi.org/10.1084/jem.20172049
32. Strandmark J, et al. Eosinophils are required to suppress Th2 responses in Peyer’s patches during intestinal infection by nematodes. Mucosal Immunol 2017; 10(3): 661–672. https://doi.org/10.1038/mi.2016.93
33. Chu VT, et al. Eosinophils promote generation and maintenance of immunoglobulin-A-expressing plasma cells and contribute to gut immune homeostasis. Immunity 2014; 40(4): 582–93.
https://doi.org/10.1016/j.immuni.2014.02.014
34. Chen HH, et al. Eosinophils from Murine Lamina Propria Induce Differentiation of Naive T Cells into Regulatory T Cells via TGF-beta1 and Retinoic Acid. PLoS One 2015; 10(11): e0142881.
https://doi.org/10.1371/journal.pone.0142881
35. Sefik E, et al. Mucosal Immunology. Individual intestinal symbionts induce a distinct population of RORgamma(+) regulatory T cells. Science 2015; 349(6251): 993–7. https://doi.org/10.1126/science.aaa9420
36. Ohnmacht C, et al. Mucosal Immunology. The microbiota regulates type 2 immunity through RORgammat(+) T cells. Science 2015; 349(6251): 989–93. https://doi.org/10.1126/science.aac4263
37. Fallegger A, et al. TGF-beta production by eosinophils drives the expansion of peripherally induced neuropilin(−) RORgammat(+) regulatory T-cells during bacterial and allergen challenge. Mucosal Immunol 2022; 15(3): 504–514. https://doi.org/10.1038/s41385-022-00484-0
38. Xenakis JJ, et al. Resident intestinal eosinophils constitutively express antigen presentation markers and include two phenotypically distinct subsets of eosinophils. Immunology 2018; 154(2): 298–308.
https://doi.org/10.1111/imm.12885
39. Gurtner A, et al. Active eosinophils regulate host defence and immune responses in colitis. Nature 2023; 615(7950): 151–157.
https://doi.org/10.1038/s41586-022-05628-7
40. Masterson JC, et al. Heterogeneity of Intestinal Tissue Eosinophils: Potential Considerations for Next-Generation Eosinophil-Targeting Strategies. Cells 2021; 10(2): 426. https://doi.org/10.3390/cells10020426
41. Jacobsen EA, et al. Eosinophil Knockout Humans: Uncovering the Role of Eosinophils Through Eosinophil-Directed Biological Therapies. Annu Rev Immunol 2021; 39: 719–757. Https://doi.org/10.1146/annurev-immunol-093019-12591
