Reviews
Etiopathology, diagnosis, and management of anaemia in inflammatory bowel disease
Summary
Anaemia is one of the most common comorbidities in inflammatory bowel disease (IBD), most often due to disturbed iron metabolism. Although the prevalence of anaemia is markedly high and it has a significant impact on quality of life, both the exact aetiology and treatment are often overlooked in IBD. The aim of this present review article is to present the epidemiology of anaemia, to help clarify the etiopathology of existing anaemia and thereby to assist in the choice of appropriate therapy for the resolution of anaemia and iron deficiency.
Összefoglalás
Az anémia az egyik leggyakoribb komorbiditás gyulladásos bélbetegeknél (IBD), amelynek a hátterében leggyakrabban a vasháztartás zavara áll. Bár az anémia prevalenciája kifejezetten magas, és az életminőséget is jelentősen rontja, a pontos etiológia tisztázása és a kezelés is gyakran elmarad IBD-ben. Jelen összefoglaló közlemény célja, hogy bemutassa az anémia epidemiológiai adatait, segítse a fennálló vérszegénység etiopatológiai tisztázását, és ezáltal segítse a megfelelő terápia választását az anémia és a vasháztartás rendezésére.
A gyulladásos bélbetegségek (IBD; Crohn-betegség [CD], colitis ulcerosa [UC]) az emésztőtraktus intermittáló-krónikus gyulladásával járó betegségei, amelyekben a fellángolások és a tünetmentes időszakok váltakoznak. Az IBD jelentős terhet jelent a betegeknek (1. ábra), és a számos életminőséget csökkentő tünete mellett egyéb komorbiditásokkal, emésztőtraktuson kívüli tünetekkel is együtt járhat. Az egyik leggyakoribb kísérőbetegség az anémia (1, 2).
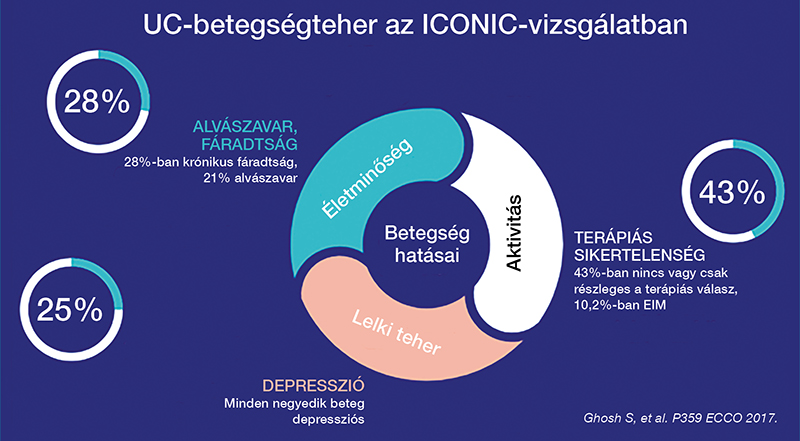
Egy szisztematikus áttekintés és metaanalízis alapján az anémia prevalenciája betegpopulációtól függően kb. 8,8% és 73,7% között változik, amelynek hátterében leggyakrabban a vasháztartás zavara áll (3). Egy keresztmetszeti vizsgálat alapján a vérszegénység prevalenciája magasabb gyermekkori IBD esetén (70%) a felnőtt betegekhez képest (40%) (4).
Az vashiányos anémia (IDA) az alapbetegség mellett szintén hozzájárul az életminőség csökkenéséhez, a gyakran panaszolt krónikus fáradtságérzéshez, ennek ellenére azonban gyakran marad kezeletlen az IBD-s betegek körében (4). Az anémia gyakran lehet tünetmentes, de gyakori panasz lehet a fáradtság, gyengeség, figyelemzavar, alvászavarok, palpitációérzés, szédülés (6–8). Az életminőség csökkenése mellett a vasháztartás zavarával járó anémiának szerepe van a betegség monitorizálásában is, hiszen a remisszióban jelentkező vashiány vagy silent aktivitást, vagy súlyos krónikus bélkárosodást jelezhet klinikai és biokémiai aktivitás objektív hiányában is. Fontos azonban megkülönböztetni a vasháztartás zavarával járó anémiákat etiológiájuk és patomechanizmusuk ismeretében (9, 10).
Az anémia diagnózisa és etiopatológiája IBD-ben
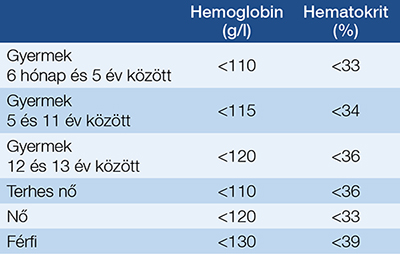
A WHO definíciója alapján felnőtt férfiak esetében <130 g/l, míg nők esetében <120 g/l, és terhes nők esetében <110 g/l hemoglobin esetében beszélünk anémiáról (11) (1. táblázat).
Tekintettel arra, hogy krónikus gyulladásos kórképekben a vashiány lehet valódi, kevert vagy funkcionális, az etiológia tisztázásához kiterjesztett laborvizsgálat szükséges. Szükség van a teljes vérkép mellett (a hemoglobin, a hematokrit, a vörösvértestek átlagos térfogata [MCV], a vörösvértestek átlagos hemoglobintartalma [MCH] és koncentrációja [MCHC], a vörösvértestek eloszlási szélessége [RDW], a fehérvérsejtszám) a C-reaktív protein (CRP), a szérumferritin, a transzferrinszaturáció, a szolúbilis transzferrinreceptor, a laktát-dehidrogenáz (LDH), valamint a kreatinin- és az ureaszintek meghatározására. Ha felmerül egyéb ok az anémia hátterében, úgy szükség lehet a folsav- és reticulocytaszint, valamint a B12-vitamin-koncentráció meghatározására is (9).
A vasháztartás zavarával járó anémiák
IBD esetén valódi vashiányról beszélünk, ha a klinikai, biokémiai – valamint endoszkópos – aktivitás hiányában a ferritinszint <30 µg/l. Emellett a valódi vashiány miatt kialakult anémiára (a továbbiakban: vashiányos anémia [IDA]) jellemző a csökkent reticulocytaszám és transzferrinszaturáció (TSAT). A szolúbilis transzferrinreceptor szintje is differenciáldiagnosztikai szereppel bírhat, mivel valódi vashiány esetén a szintje megnőhet, míg a krónikus gyulladás miatt kialakult funkcionális vashiánynál nem változik (12, 13, 14). Krónikus gyulladás okozta funkcionális vashiánnyal járó vérszegénység (anaemia of chronic disease [ACD]) esetén klinikai és biokémiai aktivitás mellett a szérumferritin >100 µg/l és a TSAT <20%. Amíg az IDA-t a microcyter anémia jellemzi, úgy ACD esetén az MCV-szint normális is lehet (9, 10).
Klinikai és biokémiai aktivitás esetén, ha a ferritin <100 µg/l, de nagyobb, mint 30 µg/l, úgy IDA és ACD által okozott, kevert eredetű anémia valószínűsíthető (9, 15, 16).
Azért fontos az IDA és az ACD megkülönböztetése, mert – tekintettel az eltérő etiopatológiára – az adekvát kezelési stratégia is eltérő. IBD-ben, IDA esetén az anémia hátterében krónikus vérvesztés, malnutríció és csökkent vasfelvétel állhat, addig ACD esetén a gyulladás okozta emelkedett hepcidinszint által okozott vasretenció, csökkent vasfelszívódás és a gyulladást promotáló citokinek által eredményezett, csökkent erythropoiesis állhat fent. Tekintettel az ACD-ben jelen lévő funkcionális, és nem valódi vashiányra, a vaspótlás csökkent hatékonyságú az IDA-hoz képest, ráadásul a szérumvas csökkenti az IFN-γ-mediált útvonalakat, ezáltal deprimálja az immunrendszer működését, valamint hozzájárul a tumoros sejtek és mikroorganizmusok proliferációjához (17, 18).
Vaspótlás IBD-ben
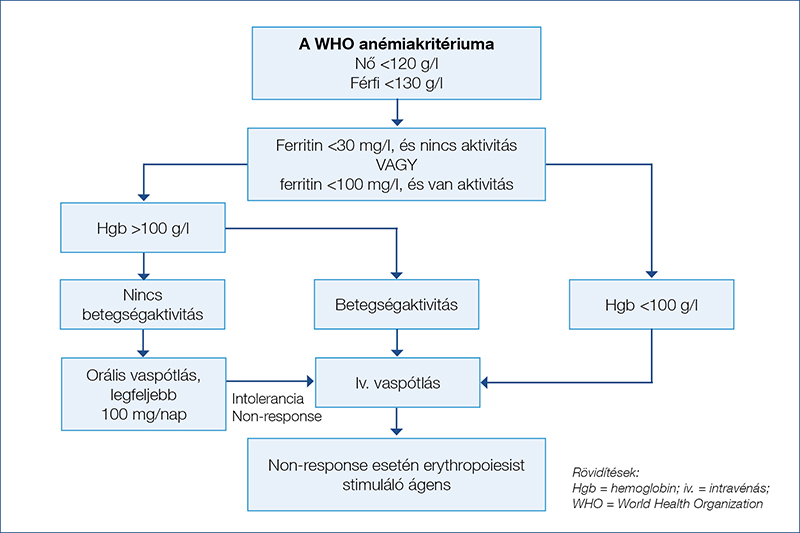
Az Európai Crohn és Colitis Társaság (ECCO) ajánlása alapján valódi vashiánnyal járó anémiás betegeknél minden esetben szükséges a vaspótló terápia, amelynek célja a vasháztartás és a hemoglobinszint rendezése. A hemoglobinszint 20 g/l növekedése 4 hét alatt elfogadható terápiás válasz. Fontos megjegyezni, hogy az anémia rendezése a klinikai aktivitástól függetlenül is javítja a betegek életminőségét (9, 19, 20). A vashiány rendezésére egyértelmű ajánlás nincs, ha anémia nem áll fent. A vaspótlás protokollját IBD-ben a 2. ábra foglalja össze, az orális és a vénás vaspótlás előnyeit és hátrányait pedig a 2. táblázat.

Az étrend változtatásával is segíthetünk a vasháztartás rendezésében mind a hem (állati eredetű forrásból származó, magas biohasznosulású), mind a nem hem típusú vasban (növényi eredetű élelmiszerekben, alacsony biohasznosulású) gazdag ételek fogyasztásával. Bár az állati eredetű, pl. vörös húsokban található hemvas jobb felszívódású és kedvezőbb biohasznosulású, hangsúlyozandó a növényi eredetű források fogyasztása is (pl. csicseriborsó, zöldborsó, lencse), mert a legtöbb ember számára a nem hem típusú vas a táplálékkal bevitt vas fő forrása. Emellett a vasfelszívódást serkentő (C-vitaminban gazdag gyümölcsök és zöldségek) és gátló (koffein, polifenolok, fitátok, kalcium) ételek befolyásolhatják a vastartalmú ételek és készítmények hasznosulását (21).
Orális vaspótlás
Az ECCO ajánlása alapján orális vaspótlás javasolt azoknál az IBD-s betegeknél, akiknél nincs, vagy enyhe klinikai aktivitás áll fenn, és korábban nem jelentkezett intolerancia a per os vaspótló készítményekkel szemben. Azonban hangsúlyozandó, hogy az orális vaspótlás számos gasztrointesztinális mellékhatást okozhat, mint például hasmenés, konstipáció, hasi diszkomfort, hányinger, hányás, diszbiózis (22, 23). Emellett a hatékonysága alacsonyabb, a felszívódás a betegség kiterjedésétől és aktivitásól függően változékony lehet. IBD-ben a betegek az előzőek alapján kevésbé tolerálják az orális készítményeket a vénás vaspótláshoz képest, valamint IBD-s állatmodelleken az orális vaspótlás a bélbetegség exacerbációjához vezethetett (24, 25, 26, 27, 28, 29, 30). Mindemellett két korábbi randomizált, kontrollált vizsgálatban csökkent tolerabilitás mellett az orális vaspótlás a vénás kezeléshez hasonló hatékonyságot mutatott remisszióban lévő IBD-s betegekben (31, 32).
Legfeljebb napi 100 mg orális vaspótlás javasolt IBD-ben, hiszen ez a dózis is effektív az anémia korrekciójában, viszont az ennél magasabb dózis több mellékhatással jár (16).
Orális vaspótló készítmények
Az orális vaspótló készítményeknek savas környezetre van szükségük az optimális felszívódáshoz, emellett kiemelendő polivalens kation szerkezete, amely miatt számos egyéb gyógyszerrel léphet kölcsönhatásba (2, 33). Az orális vaskészítmények ferro (Fe2+) és ferri (Fe3+) formában érhetőek el szénhidrát-komplexekkel vagy fehérjeszukcinátokkal (34, 35, 36, 37).
A ferro vas készítményeket – vas(II)-szulfát, vas(II)-glükonát, vas(II)-fumarát – a magasabb biohasznosulásuk miatt szélesebb körben használják, azonban ezeknek a készítményeknek is csupán 10-25%-a szívódik fel (35, 36, 37). Ha tolerálható, a betegeknek javasolt éhgyomorra szedni a készítményeket, vagy 250 mg C-vitaminnal együtt a felszívódás javítása érdekében (38).
A vas(III)-hidroxid-polimaltóz-készítménynél a ferri vas (Fe3+) szabályozottan szabadul fel, így biztosítva a nagyon alacsony toxicitást és a kedvező tolerabilitást (39). Tekintettel a kontrollált felszívódásra az enterocytákon keresztül, nem emeli gyorsan a szérumvas- és TSAT-szinteket, ezáltal nem vezet a nem transzferrinhez kötött vas szintjének emelkedéséhez, így alacsonyabb toxicitást eredményez (40, 41, 42). A vas(III)-trimaltóz-készítmények a ferri vas és a trimaltóz stabil komplexe, amely biztonságosabb, és kevesebb mellékhatással jár a ferro vas készítményekkel szemben. Ezt az újabb készítményt Európában 2016 óta alkalmazzák, és hatékonynak bizonyult IBD-ben mind remisszióban, mind nem súlyos betegségaktivitás esetén korábbi ferro vas készítmények sikertelensége esetén (16, 37).
A szukroszomiális vas kettős foszfolipidrétegbe burkolt vas, ezáltal megkerülve a ferroportin gátló hatását, áthalad a gyomron, így a vékonybélben könnyebben szívódik fel. A biohasznosulása nagyobb, és alacsonyabb dózisra van szükség a vas(II)-szulfáthoz képest (43). Mivel a ferri vas nem érintkezik közvetlenül a mucosával, így kedvezőbb a gasztrointesztinális mellékhatásprofilja, és alacsonyabb az adverz események száma (44).
Vénás vaspótlás
Intravénás vaspótlás javasolt azoknál az IBD-s betegeknél első vonalban, akiknél (9):
- aktív az alapbetegség,
- korábban intolerancia volt orális vaspótló készítményekkel szemben,
- a hemoglobinszint <100 g/l,
- azoknál a betegeknél, akik erythropoetin-stimuláló ágenssel végzett terápiára szorulnak.
A vénás vaspótlás az orális vaspótláshoz képest effektívebb, gyorsabb terápiást választ eredményez, és jobban tolerálható az IBD-s betegek körében (20, 31, 45, 46 47). Dózisát a nem, a hemoglobinszint és a testtömeg alapján kell megválasztani a 3. táblázat alapján.

A séma limitációja, hogy 70 g/l hemoglobin alatti szintnél nem fogalmaz meg ajánlást, azonban ebben az esetben további 500 mg vénás vas javasolt (45, 48). Ha a hemoglobinszint 4 hét alatt kevesebb mint 20 g/l-rel emelkedik az optimalizált IBD-terápia mellett, úgy javasolt erythropoetin-stimuláló faktor adása (9).
A FERGIcor-tanulmány igazolta ennek az újfajta és egyszerűbb stratégiának a jobb effektivitását a korábban alkalmazott Ganzoni-formulához képest (testtömeg [kg] × [célhemoglobin − jelenlegi hemoglobin g/dl-ben] × 0,24 + 500 mg) (31, 49, 50).
Parenterális vaspótló készítmények
A vénás vaskészítmények egy Fe3+-maggal rendelkeznek, és egy szénhidrátréteggel. A különböző készítmények mellékhatása és tolerabilitása a mag nagyságától és a szénhidrátréteg minőségétől függ (8, 51, 52).
A vas-dextrán-készítményeknél a szénhidrátréteg dextrán, méretük és tömegük alapján pedig el kell különíteni a high-molecular weight iron dextran (HMWID) és a low-molecular weight iron dextran (LMWID) készítményeket. Tekintettel a HMWID nagyobb tömegére, az LMWID kevesebb mellékhatással bír, és ritkábbak az anafilaxiás reakciók (47, 52, 53, 54, 55, 56).
A később megjelent vas(II)-glükonát (FG) esetén már kevesebb mellékhatás jelentkezett, ritkább lett az anafilaxiás reakció előfordulási aránya is, azonban a kevésbé stabil komplex révén labilis vas kerül a véráramba, fokozva az oxidatív stresszt és a szabadgyökképződést. A 2000-ben megjelent vas(III)-hidroxid-szacharóz (IS) komplex kissé stabilabb, mint az FG, a mellékhatásprofilja szintén kedvező, és ezáltal felváltották a korábbi vas-dextrán-készítményeket. Azonban az FG és az IS hátránya, hogy nem lehet egyszerre nagyobb dózisban alkalmazni (<500 mg) a szabad vas felszabadulása miatt, és IS esetén 1 hét alatt is legfeljebb 600 mg készítmény adható (52). A vas(III)-karboximaltóz (FCM) egy új vaspótló készítmény, amely több, eltérő etiológiájú krónikus állapotban is alkalmas magas dózisban a vasraktárak gyors korrekciójára (47). Az FCM egy stabil komplex, nagyon alacsony immunogén hatással, emiatt az anafilaxiás reakció kifejezetten ritka, és nagyon kedvező a mellékhatásprofilja is. A készítmény tulajdonságai lehetővé teszik egyszerre 1000 mg adását is (15 perc alatt), anélkül, hogy tesztdózisra szükség lenne (31, 57, 58, 59). Ha ennél nagyobb dózisú korrekcióra van szükség, úgy legalább 1 hetet kell várni a következő dózissal. IBD-ben bizonyított a gyors és nagy dózisú vaspótlás prioritása, így az FCM hatékonyabbnak bizonyul egyéb vaspótló terápiáknál (20). Az IDA rekurrenciája A vasháztartás és az anémia rendezése után a betegek közel felénél alakul ki újfent IDA, ezért vaspótlást követően javasolt 3 havonta monitorozni a betegeket az első évben, majd 6-12 havonta a második évtől (31, 45). Az IDA rekurrenciája a betegségaktivitás mellett a vaspótlást követő ferritinszinttel korrelál (60). A 400 µg/l feletti ferritinszint szignifikánsan csökkentette a rekurrencia arányát, ezért a ferritincélértéket javasolt e felett meghatározni a vaspótlás hosszú távú effektivitásának mérőszámaként (31). Újbóli vaspótlás javasolt, ha a ferritin 100 µg/l alá esik, vagy a beteg újfent vérszegény lesz (9). Konklúzió Összességében elmondható, hogy az anémia és a vashiány kifejezetten gyakran fordulnak elő IBD-ben, azonban a betegek nagy része vaspótló terápia nélkül marad. Az etiopatológiájukat tekintve meg kell különböztetni az anémiatípusokat az adekvát vaspótló kezelés megválasztásának érdekében. IDA esetén minden esetben javasolt a vaspótló terápia. Ha a betegség remisszióban van, a hemoglobinszint >100 g/l, és korábban nem állt fenn intolerancia az orális vaspótló készítményekkel, úgy javasolt szájon áti vaspótlás, míg ha a hemoglobin <100 g/l, aktív a betegség, vagy korábban intolerancia jelentkezett a per os vaspótló készítményekkel szemben, úgy vénás vaspótlás javasolt. A vénás vaspótló készítmények közül IBD-ben az FCM bizonyul a legbiztonságosabbnak és leghatékonyabbnak, amely alkalmas a vasháztartás és az anémia gyors korrekciójára. Eredményesnek kell tekinteni a terápiát, ha a hemoglobinszint 20 g/l-t emelkedik 4 héttel a kezelés után. Javasolt a ferritin 400 µg/l célértéket megválasztani a vaspótlás során az IDA-rekurrencia elkerülése végett, és a vasháztartást és anémiát első évben 3 havonta, a második évtől 6-12 havonta kontrollálni. Ha újfent anémia alakulna ki, vagy a ferritin 100 µg/l alá süllyed, javasolt újbóli vaspótló terápia mellett a klinikailag rejtett aktivitás tisztázására endoszkópia és/vagy képalkotó vizsgálatok végzése, majd az eredmények függvényében az IBD terápiájának optimalizálása.
Irodalom
https://doi.org/10.1056/NEJMra2002697
2. Jimenez KM, Gasche C. Management of Iron Deficiency Anaemia in Inflammatory Bowel Disease. Acta Haematol 2019; 142(1): 30–36.
https://doi.org/10.1159/000496728
3. Wilson A, Reyes E, Ofman J. Prevalence and outcomes of anemia in inflammatory bowel disease: a systematic review of the literature. Am J Med 2004; 116(Suppl 7A): 44S–49S. https://doi.org/10.1016/j.amjmed.2003.12.011
4. Goodhand JR, Kamperidis N, Rao A, et al. Prevalence and management of anemia in children, adolescents, and adults with inflammatory bowel disease: Inflammatory Bowel Diseases 2012; 18(3): 513–519.
https://doi.org/10.1002/ibd.21740
5. Ghosh S, Peyrin-Biroulet L, Sensky T, Casellas F, O’Shea C, Pappalardo B. P359 Correlation between physician and patient disease assessments in ulcerative colitis: baseline data from the ICONIC study of 1816 patients in 33 countries. Journal of Crohn’s and Colitis 2017; 11(suppl. 1): S259–S260.
https://doi.org/10.1093/ecco-jcc/jjx002.484
6. Bruner AB, Joffe A, Duggan AK, Casella JF, Brandt J. Randomised study of cognitive effects of iron supplementation in non-anaemic iron-deficient adolescent girls. Lancet 1996; 348(9033): 992–996. https://doi.org/10.1016/S0140-6736(96)02341-0
7. Chavarro JE, Rich-Edwards JW, Rosner BA, Willett WC. Iron intake and risk of ovulatory infertility. Obstet Gynecol 2006; 108(5): 1145–1152. https://doi.org/10.1097/01.AOG.0000238333.37423.ab
8. Resál T, Farkas K, Molnár T. Iron Deficiency Anemia in Inflammatory Bowel Disease: What Do We Know? Frontiers in Medicine 2021; 8. Accessed January 24, 2024. https://www.frontiersin.org/articles/10.3389/fmed.2021.686778
9. Dignass AU, Gasche C, Bettenworth D, et al. European Consensus on the Diagnosis and Management of Iron Deficiency and Anaemia in Inflammatory Bowel Diseases. Journal of Crohn’s and Colitis 2015; 9(3): 211–222. https://doi.org/10.1093/ecco-jcc/jju009
10. Bartels U, Pedersen NS, Jarnum S. Iron absorption and serum ferritin in chronic inflammatory bowel disease. Scand J Gastroenterol 1978; 13(6): 649–656. https://doi.org/10.3109/00365527809181777
11. Nutritional anaemias. Report of a WHO scientific group. World Health Organ Tech Rep Ser 1968; 405: 5–37.
12. Beguin Y. Soluble transferrin receptor for the evaluation of erythropoiesis and iron status. Clin Chim Acta 2003; 329(1–2): 9–22. https://doi.org/10.1016/s0009-8981(03)00005-6
13. Infusino I, Braga F, Dolci A, Panteghini M. Soluble Transferrin Receptor (sTfR) and sTfR/log Ferritin Index for the Diagnosis of Iron-Deficiency Anemia A Meta-Analysis. American Journal of Clinical Pathology 2012; 138(5): 642–649. https://doi.org/10.1309/AJCP16NTXZLZFAIB
14. Oustamanolakis P, Koutroubakis IE. Soluble transferrin receptor-ferritin index is the most efficient marker for the diagnosis of iron deficiency anemia in patients with IBD. Inflammatory Bowel Diseases 2011; 17(12): E158–E159. https://doi.org/10.1002/ibd.21881
15. Weiss G, Goodnough LT. Anemia of Chronic Disease. New England Journal of Medicine 2005; 352(10): 1011–1023. https://doi.org/10.1056/NEJMra041809
16. Gasche C, Ahmad T, Tulassay Z, et al. Ferric maltol is effective in correcting iron deficiency anemia in patients with inflammatory bowel disease: results from a phase-3 clinical trial program. Inflamm Bowel Dis 2015; 21(3): 579–588. https://doi.org/10.1097/MIB.0000000000000314
17. Madu AJ, Ughasoro MD. Anaemia of Chronic Disease: An In-Depth Review. Med Princ Pract 2017; 26(1): 1–9. https://doi.org/10.1159/000452104
18. Ali M, Rigolosi R, Fayemi AO, Braun EV, Frascino J, Singer R. Failure of serum ferritin levels to predict bone-marrow iron content after intravenous iron-dextran therapy. Lancet 1982; 1(8273): 652–655. https://doi.org/10.1016/s0140-6736(82)92204-8
19. Wells CW, Lewis S, Barton JR, Corbett S. Effects of changes in hemoglobin level on quality of life and cognitive function in inflammatory bowel disease patients. Inflamm Bowel Dis 2006; 12(2): 123–130. https://doi.org/10.1097/01.MIB.0000196646.64615.db
20. Evstatiev R, Marteau P, Iqbal T, et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterology 2011; 141(3): 846–853.e1-2. https://doi.org/10.1053/j.gastro.2011.06.005
21. Simon P. European Crohn´s and Colitis Organisation – ECCO – Nutritional Management of Iron Deficiency. Accessed March 3, 2024. https://www.ecco-ibd.eu/publications/ecco-news/item/nutritional-management-of-iron-deficiency.html
22. De Silva AD, Tsironi E, Feakins RM, Rampton DS. Efficacy and tolerability of oral iron therapy in inflammatory bowel disease: a prospective, comparative trial. Alimentary Pharmacology & Therapeutics 2005; 22(11–12): 1097–1105. https://doi.org/10.1111/j.1365-2036.2005.02700.x
23. Kerr DS, Davidson S. Gastrointestinal intolerance to oral iron preparations. The Lancet 1958; 272(7045): 489–492. https://doi.org/10.1016/S0140-6736(58)91282-0
24. Reifen R, Matas Z, Zeidel L, Berkovitch Z, Bujanover Y. Iron supplementation may aggravate inflammatory status of colitis in a rat model. Dig Dis Sci 2000; 45(2): 394–397. https://doi.org/10.1023/a:1005437331967
25. Carrier J, Aghdassi E, Platt I, Cullen J, Allard JP. Effect of oral iron supplementation on oxidative stress and colonic inflammation in rats with induced colitis. Aliment Pharmacol Ther 2001; 15(12): 1989–1999. https://doi.org/10.1046/j.1365-2036.2001.01113.x
26. Carrier J, Aghdassi E, Cullen J, Allard JP. Iron supplementation increases disease activity and vitamin E ameliorates the effect in rats with dextran sulfate sodium-induced colitis. J Nutr 2002; 132(10): 3146–3150. https://doi.org/10.1093/jn/131.10.3146
27. Oldenburg B, Van Berge Henegouwen GP, Rennick D, Van Asbeck BS, Koningsberger JC. Iron supplementation affects the production of pro-inflammatory cytokines in IL-10 deficient mice. Eur J Clin Invest 2000; 30(6): 505–510. https://doi.org/10.1046/j.1365-2362.2000.00650.x
28. Seril DN, Liao J, Ho KLK, Warsi A, Yang CS, Yang GY. Dietary iron supplementation enhances DSS-induced colitis and associated colorectal carcinoma development in mice. Dig Dis Sci 2002; 47(6): 1266–1278. https://doi.org/10.1023/a:1015362228659
29. Kumar A, Brookes MJ. Iron Therapy in Inflammatory Bowel Disease. Nutrients 2020; 12(11): 3478. https://doi.org/10.3390/nu12113478
30. Lee TW, Kolber MR, Fedorak RN, Van Zanten SV. Iron replacement therapy in inflammatory bowel disease patients with iron deficiency anemia: a systematic review and meta-analysis. J Crohns Colitis 2012; 6(3): 267–275. https://doi.org/10.1016/j.crohns.2011.09.010
31. Kulnigg S, Stoinov S, Simanenkov V, et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial. Am J Gastroenterol 2008; 103(5): 1182–1192. https://doi.org/10.1111/j.1572-0241.2007.01744.x
32. Schröder O, Mickisch O, Seidler U, et al. Intravenous iron sucrose versus oral iron supplementation for the treatment of iron deficiency anemia in patients with inflammatory bowel disease – A randomized, controlled, open-label, multicenter study. Am J Gastroenterol 2005; 100(11): 2503–2509. https://doi.org/10.1111/j.1572-0241.2005.00250.x
33. Bhandari S, Pereira DIA, Chappell HF, Drakesmith H. Intravenous Irons: From Basic Science to Clinical Practice. Pharmaceuticals (Basel) 2018; 11(3): 82. https://doi.org/10.3390/ph11030082
34. Cancelo-Hidalgo MJ, Castelo-Branco C, Palacios S, et al. Tolerability of different oral iron supplements: a systematic review. Curr Med Res Opin 2013; 29(4): 291–303. https://doi.org/10.1185/03007995.2012.761599
35. Santiago P. Ferrous versus ferric oral iron formulations for the treatment of iron deficiency: a clinical overview. Scientific World Journal 2012; 2012: 846824. https://doi.org/10.1100/2012/846824
36. Nielsen OH, Soendergaard C, Vikner ME, Weiss G. Rational Management of Iron-Deficiency Anaemia in Inflammatory Bowel Disease. Nutrients 2018; 10(1): 82. https://doi.org/10.3390/nu10010082
37. Bohm N. Diagnosis and management of iron deficiency anemia in inflammatory bowel disease. Am J Manag Care 2021; 27(11 Suppl): S211–S218. https://doi.org/10.37765/ajmc.2021.88714
38. Stoffel NU, Cercamondi CI, Brittenham G, et al. Iron absorption from oral iron supplements given on consecutive versus alternate days and as single morning doses versus twice-daily split dosing in iron-depleted women: two open-label, randomised controlled trials. Lancet Haematol 2017; 4(11): e524–e533. https://doi.org/10.1016/S2352-3026(17)30182-5
39. Geisser P. Safety and efficacy of iron(III)-hydroxide polymaltose complex / a review of over 25 years experience. Arzneimittelforschung 2007; 57(6A): 439–452. https://doi.org/10.1055/s-0031-1296693
40. Schümann K, Kroll S, Romero-Abal ME, et al. Impact of oral iron challenges on circulating non-transferrin-bound iron in healthy Guatemalan males. Ann Nutr Metab 2012; 60(2): 98–107. https://doi.org/10.1159/000336177
41. Schümann K, Solomons NW, Romero-Abal ME, Orozco M, Weiss G, Marx J. Oral administration of ferrous sulfate, but not of iron polymaltose or sodium iron ethylenediaminetetraacetic acid (NaFeEDTA), results in a substantial increase of non-transferrin-bound iron in healthy iron-adequate men. Food Nutr Bull 2012; 33(2): 128–136. https://doi.org/10.1177/156482651203300206
42. Dresow B, Petersen D, Fischer R, Nielsen P. Non-transferrin-bound iron in plasma following administration of oral iron drugs. Biometals 2008; 21(3): 273–276. https://doi.org/10.1007/s10534-007-9116-5
43. Riccio E, Sabbatini M, Capuano I, Pellegrino AM, Petruzzelli LA, Pisani A. Oral Sucrosomial® iron versus intravenous iron for recovering iron deficiency anaemia in ND-CKD patients: a cost-minimization analysis. BMC Nephrol 2020; 21(1): 57. https://doi.org/10.1186/s12882-020-01716-w
44. Lee T, Clavel T, Smirnov K, et al. Oral versus intravenous iron replacement therapy distinctly alters the gut microbiota and metabolome in patients with IBD. Gut 2017; 66(5): 863–871. https://doi.org/10.1136/gutjnl-2015-309940
45. Evstatiev R, Alexeeva O, Bokemeyer B, et al. Ferric Carboxymaltose Prevents Recurrence of Anemia in Patients With Inflammatory Bowel Disease. Clinical Gastroenterology and Hepatology 2013; 11(3): 269–277. https://doi.org/10.1016/j.cgh.2012.10.013
46. Onken JE, Bregman DB, Harrington RA, et al. A multicenter, randomized, active-controlled study to investigate the efficacy and safety of intravenous ferric carboxymaltose in patients with iron deficiency anemia. Transfusion 2014; 54(2): 306–315. https://doi.org/10.1111/trf.12289
47. Lyseng-Williamson KA, Keating GM. Ferric carboxymaltose: a review of its use in iron-deficiency anaemia. Drugs 2009; 69(6): 739–757.
48. Favrat B, Balck K, Breymann C, et al. Evaluation of a single dose of ferric carboxymaltose in fatigued, iron-deficient women – PREFER a randomized, placebo-controlled study. PLoS One 2014; 9(4): e94217. https://doi.org/10.1371/journal.pone.0094217
49. Ganzoni AM. Intravenous iron-dextran: therapeutic and experimental possibilities. Schweiz Med Wochenschr 1970; 100(7): 301–303.
50. Reinisch W, Staun M, Tandon RK, et al. A randomized, open-label, non-inferiority study of intravenous iron isomaltoside 1,000 (Monofer) compared with oral iron for treatment of anemia in IBD (PROCEED). Am J Gastroenterol 2013; 108(12): 1877–1888. https://doi.org/10.1038/ajg.2013.335
51. Biggar P, Hahn KM. Importance of the different i.v. iron generations for everyday medical practice. MMW Fortschr Med 2013; 155(Suppl 1): 18–24.
52. Cançado RD, Muñoz M. Intravenous iron therapy: how far have we come? Rev Bras Hematol Hemoter 2011; 33(6): 461–469. https://doi.org/10.5581/1516-8484.20110123
53. Auerbach M, Ballard H. Clinical use of intravenous iron: administration, efficacy, and safety. Hematology Am Soc Hematol Educ Program 2010; 2010: 338–347. https://doi.org/10.1182/asheducation-2010.1.338
54. Baird IM, Podmore DA. Intramuscular iron therapy in iron-deficiency anaemia. Lancet 1954; 267(6845): 942–946. https://doi.org/10.1016/s0140-6736(54)92555-6
55. Fishbane S, Ungureanu VD, Maesaka JK, Kaupke CJ, Lim V, Wish J. The safety of intravenous iron dextran in hemodialysis patients. Am J Kidney Dis 1996; 28(4): 529–534. https://doi.org/10.1016/s0272-6386(96)90463-1
56. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmén J. Update on adverse drug events associated with parenteral iron. Nephrology Dialysis Transplantation 2006; 21(2): 378–382. https://doi.org/10.1093/ndt/gfi253
57. Anker SD, Comin Colet J, Filippatos G, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361(25): 2436–2448. https://doi.org/10.1056/NEJMoa0908355
58. Van Wyck DB, Mangione A, Morrison J, Hadley PE, Jehle JA, Goodnough LT. Large-dose intravenous ferric carboxymaltose injection for iron deficiency anemia in heavy uterine bleeding: a randomized, controlled trial. Transfusion 2009; 49(12): 2719–2728. https://doi.org/10.1111/j.1537-2995.2009.02327.x
59. Covic A, Mircescu G. The safety and efficacy of intravenous ferric carboxymaltose in anaemic patients undergoing haemodialysis: a multi-centre, open-label, clinical study. Nephrol Dial Transplant 2010; 25(8): 2722–2730. https://doi.org/10.1093/ndt/gfq069
60. Cronin CC, Shanahan F. Anemia in patients with chronic inflammatory bowel disease. Am J Gastroenterol 2001; 96(8): 2296–2298. https://doi.org/10.1111/j.1572-0241.2001.04032.x
