Original publication
Liver transplantation in Hungary
Summary
The results of liver transplantation in Hungary are no different from international ones, but the transplant profession suffers from the same donor shortage that causes difficulties in the rest of the world. Joining the Eurotransplant organ exchange program 10 years ago was a milestone in Hungarian organ transplantation, the number of liver transplants practically doubled. However, many domestic initiatives played at least as much role in this background, which led decisively to an increase in domestic donation activity. Unfortunately, during the COVID-19 pandemic, due to the workload of intensive care units, the number of donations decreased by more than 33% and since then it has not been possible to fulfil the pre-2020 activity. This, of course, also affects the number of liver transplants. The use of partial grafts (living donor, "split") can only be considered in sporadic cases; therefore no sharp improvement can be expected from this. The solution would be to report and care for a higher proportion of brain dead as donors as a base source for transplants, as well as filling the waiting list and higher organ acceptance rates. The former would require professional consultation with the associated professions due to a change in the indication area, as other diseases have come to the fore due to the results achieved in the treatment of HCV and HBV. PSC is currently the most common indication in Hungary, but there is a need for more widespread use of liver transplantation in the field of cancer diseases as well. The acceptance of organs basically depends on their quality, but in Hungary, as everywhere in the world, the proportion of extended criteria donors (ECD) is constantly increasing. These grafts are inferior in quality to standard grafts, so their use may also result in worse outcomes. Organ quality could be improved by using various machine perfusion techniques, but in Hungary we are more than 20 years behind in technology due to lack of funding. With the availability of machine perfusion, organ acceptance rates would certainly increase. Another special form of ECD and another possibility of increasing the number of donors is the use of organs from donation after circulatory death (DCD), in Hungary professional discussions are ongoing regarding its introduction. However, in the case of DCD, machine perfusion is essential during liver transplantation. KEYWORDS: liver transplantation, waiting list, organ donation
Összefoglalás
A magyarországi májtranszplantáció eredményei nem különböznek a nemzetközi eredményektől, de ugyanazzal a donorhiánnyal küzd a transzplantációs szakma, mint amely a világ többi részén is nehézséget jelent. Az Eurotransplant szervcsereprogramhoz való 10 évvel ezelőtti csatlakozás mérföldkő volt a hazai szervátültetésben, a májátültetések száma megkétszereződött. Ennek hátterében azonban sok hazai kezdeményezés is legalább ennyire szerepet játszott, amelyek döntően a hazai donációs aktivitás megemelkedéséhez vezettek. Sajnos a COVID-19-pandémia idején az intenzív osztályok leterheltsége miatt a donációk száma több mint 33%-kal csökkent, és azóta sem sikerült a 2020 előtti aktivitást teljesíteni. Ez természetesen a májátültetések számára is kihat. A parciális graftok (élő donor, „split”) alkalmazása csak sporadikus esetekben jöhet szóba, ezért ettől alapvetően nem várható ugrásszerű javulás. Megoldást egyrészt a transzplantációk bázisforrásának tekinthető agyhalottak nagyobb arányának donorként való lejelentése és gondozása jelentene, másrészt pedig a várólista feltöltése és a szervek nagyobb elfogadási aránya. Előbbi az indikációs terület megváltozása miatt igényelne szakmai egyeztetést a társszakmákkal, ugyanis a HCV és HBV kezelésében elért eredmények miatt más betegségek kerültek előtérbe. Hazánkban jelenleg a PSC a leggyakoribb indikáció, de a daganatos betegségek területén is szükség lenne a májátültetés szélesebb körű alkalmazására. A szervek elfogadása pedig alapvetően azok minőségétől függ, de hazánkban is, mint mindenütt a világban, a kiterjesztett kritériumú donorok (ECD) aránya folyamatosan növekszik. Az ezekből származó graftok minőségükben elmaradnak a standard graftoktól, így alkalmazásukkal az eredmények is rosszabbak lehetnek. A szervminőség javítható lenne a különböző gépi perfúziós technikák alkalmazásával, azonban Magyarországon ezek finanszírozási hiánya miatt több mint 20 éves technológiai lemaradásban vagyunk. A gépi perfúzió rendelkezésre állásával a szervelfogadási arány is minden bizonnyal emelkedne. További speciális formája az ECD-nek és a donorszám növelésének újabb lehetősége a keringésmegállást követő donációból (DCD) származó szervek felhasználása; Magyarországon ennek bevezetésével kapcsolatban szakmai egyeztetések folynak. DCD esetében azonban májtranszplantáció során a gépi perfúzió elengedhetetlen.
Bevezetés
A maga kudarcokkal és sikerekkel teli történetével a szervátültetés a huszadik század egyik legnagyobb orvosi eredménye. Thomas Starzl, a májátültetés atyja szerint „Az egész kezdetben nem volt más, mint egyfajta vad science fiction, de ugyanolyan valóságos álom is, mint az, hogy embert juttassunk a Hold felszínére. Egyik sem tűnt túl racionálisnak, de mint kiderült, mindkettő nagyjából ugyanabban az időben vált valóra.”
A veseátültetés már jóval a májátültetés előtt sikeres beavatkozás volt. Az 1950-es években a vesetranszplantáció jól bevált sebészeti eljárássá vált, de a graft kilökődése még gyakori volt, és ennek oka akkoriban a megbízható immunszuppresszív terápia hiánya volt. 1954-ben a szervátültetés mint beavatkozás létjogosultságát bizonyította az első sikeres veseátültetés, amelynél az immunológiai problémát az küszöbölte ki, hogy az átültetést egypetéjű ikerpár donor és recipiens között végezték el. Ez a siker aztán fokozott érdeklődést váltott ki más szolid szervek átültetése iránt is. Thomas Starzl 1963-ban kísérelte meg az első májátültetést a Coloradói Egyetemen, de sikertelen volt. A következő két ilyen műtét szintén kudarcba fulladt (1). Az első hosszú távú eredményt csak 1967-ben érték el, amikor egy 19 hónapos, hepatocelluláris karcinómában szenvedő lány több mint egy évig túlélt a májátültetést követően (2). Ugyanebben az időben májtranszplantációs programokat hoztak létre más országokban is. 1968-ban Sir Roy Calne sebész és Roger Williams hepatológus elindította az első európai májtranszplantációs programot Cambridge-ben, és már öt sikeres esetről számoltak be (3). 1970-ig közel 60 májátültetés történt az Egyesült Államokban (Starzl) és 28 az Egyesült Királyságban (Calne). Viszonylag rövid idő alatt 35 aktív transzplantációs program létesült szerte a világon.
A szervátültetésben elért haladás nem lett volna lehetséges az immunológia területén az 1940-es és 1950-es években elért áttörések, valamint Medawarnak és Burnetnek a szerzett immuntolerancia jelenségének felfedezéséhez vezető munkássága nélkül. Az elmúlt 60 évben számos immunszuppresszáns szert vezettek be a klinikai gyakorlatba. A ciklosporin, majd a tacrolimus bevezetésével szignifikánsan javultak a transzplantációk eredményei (4, 5).
A szervek hatékony konzerválása, a prezerváció kifejlesztése ugyanilyen fontos lépés volt. A különböző prezervációs oldatok közül a májtranszplantáció vonatkozásában kiemelendő a Wisconsini Egyetem 1987-ben klinikai alkalmazásra kerülő University of Wisconsin (UW) oldata és a szintén az 1980-as években kifejlesztett másik népszerű oldat, a hisztidin-triptofán-ketoglutarát (HTK), más néven Bretschneider-oldat (6, 7). Kifejlesztésük jelentős változásokat hozott a transzplantációs gyakorlatban, ma is ezeket alkalmazzuk a graftok perfúziójára, valamint szállítás közbeni hypothermiás tárolására.
A májátültetés hazai fejlődése
Az első májátültetést 1983-ban Szécsény Andor professzor végezte a Semmelweis Orvostudományi Egyetem I. sz. Sebészeti Klinikáján, de a sikeres műtét után a 63. posztoperatív napon befolyásolhatatlan rejekció és szepszis vezetett a beteg halálához, hátterében a tüdő súlyos cytomegalovirus- (CMV-) infiltrációja állt. Akkoriban CMV elleni készítmény még nem állt rendelkezésre (8). Ebben az intézetben még volt 4 sikertelen májátültetési kísérlet, és Szegeden Karácsonyi Sándor májátültetése sem hozott eredményt. (9). Magyarországon 1994-ben indult el a szervezett májtranszplantációs program a Perner Ferenc vezette, egy évvel korábban újonnan megnyílt Baross Utcai Transzplantációs és Sebészeti Klinikán, és 1995-ben megtörtént ennek a programnak a keretében az első hosszú távon is sikeres májátültetés (10). Azóta több mint 1200 májtranszplantáció történt hazánkban (1. ábra). Az alábbiakban leírt magyarországi májtranszplantációs tapasztalatok kizárólag a Semmelweis Egyetem Transzplantációs és Sebészeti Klinikájáról, illetve jogutódjáról, a Semmelweis Egyetem Sebészeti, Transzplantációs és Gasztroenterológiai Klinikájáról származnak.
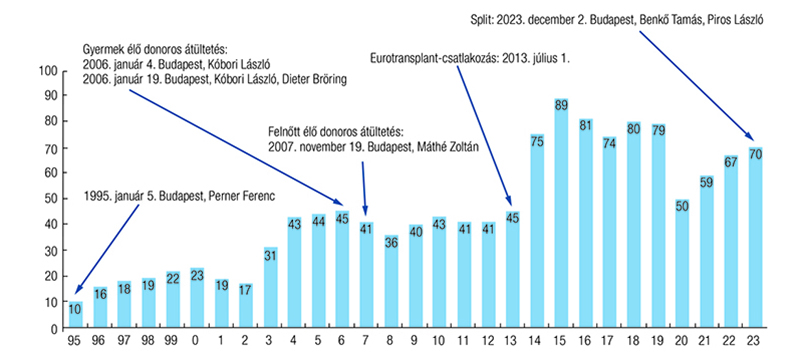
Minden átültethető szerv transzplantációjának folyamatos fejlődése ellenére a májátültetés továbbra is az egyik legnagyobb kihívást jelentő területe a medicinának. A végstádiumú és az akut májelégtelenségben szenvedő betegek kezelése nehézségekbe ütközik már csak azért is, mert transzplantáció nélküli gyógyulás csak az esetek kis százalékában lehetséges, és a transzplantáció megtörténtéig áthidaló („brigding”) megoldásként alkalmazott májpótló kezelések sem adnak tartós megoldást. Az elmúlt évtizedekben a műtéti technika, a perioperatív kezelés és az immunszuppresszív terápia fejlődése kiváló graft- és betegtúlélési eredményeket hozott. A legtöbb májtranszplantációs központ 1 éves betegtúlélési aránya közel 90%, a 3 éves túlélési arány pedig meghaladja a 80%-ot (11). A European Liver Transplant Registry (ELTR) adatai szerint Európában a májátültetés 2018-ra 86%-os egy-, és 74%-os ötéves teljes túlélést ért el (12, 13).
Magyarországon az eredmények hasonlóak. Jelenleg hazánkban a Semmelweis Egyetem Sebészeti, Transzplantációs és Gasztroenterológiai Klinikájának van kizárólagos jogosultsága máj kivételére és beültetésére, tehát egy centrum látja el az országos programot. A Nemzeti Szervdonációs és Transzplantációs Utánkövetési Regiszter Recipiens-utánkövetési moduljának adatbázisában jelenleg a 2013–2022 időintervallumban végzett szervátültetések beteg-, illetve grafttúlélési eredményei érhetőek el. Ezek alapján májátültetés esetén 88,7% az 1 éves, 86,5% a 3 éves, és 81,6% az 5 éves betegtúlélés hazánkban. A vezető halálokok a korai posztoperatív időszakban a szepszis (~1-3%) és az ezzel együtt járó sokszervi elégtelenség (MOF), majd hosszú távon a kardiovaszkuláris történés, a tüdőgyulladás és a malignus betegégek voltak. Az országos adatok alapján 87,2% az 1 éves, 84,4% a 3 éves, és 79,1% az 5 éves – halálesettel cenzorált – grafttúlélés májátültetés esetén. A korai okok a graft elsődleges működésképtelensége (primary non-function, PNF) (~0,9%) és a graft trombózisa (általában az arteria hepatica trombózisa, HAT) (~0,5%) voltak, amelyek retranszplantációt tettek szükségessé, később pedig inkább az alapbetegség rekurrenciája (~0,3%) (14).
Ahhoz, hogy ezek az eredmények valóra válhattak, több fontos további lépésre volt szükség. A májátültetés nemcsak egy nagy hasi műtét, hanem egy nagyon komplex eljárás. Nemcsak a sebészet, de az anesztézia területén is speciális képzésre van szükség.
A transzplantációs aneszteziológia területén sok kutatás foglalkozik a perioperatív kezelés optimalizálásával és az anesztézia standardizálásával a májátültetés különböző szakaszaiban. Az anhepatikus és reperfúziós fázisban jelentkező hipotónia és a reperfúzió után észlelhető hyperkalaemia, amelyet májtranszplantáció-specifikus posztreperfúziós szindrómának (PRS) is nevezünk, kezelés nélkül rosszabb posztoperatív eredményekkel jár (15, 16). Fel kell készülni aritmiára, fibrinolízisre, tartós hemodinamikai instabilitásra és hosszan tartó vazopresszor támogatásra is. A májátültetés során fellépő hemodinamikai instabilitás kezelésére vonatkozó, konszenzuson alapuló irányelvet tett közzé három nagy nemzetközi társaság (ILTS, LICAGE, SATA) (17). A májtranszplantációk számának növekedésével az aneszteziológusok rájöttek, hogy a standard laboratóriumi véralvadási tesztek nem tükrözik pontosan a végstádiumú májbetegségben (end stage liver disease, ESLD) szenvedő betegek véralvadási státuszát. A betegek véralvadásának viszkoelasztikus vizsgálatokon alapuló kezelése csökkent transzfúziós szükséglettel és így jelentős költségmegtakarítással is jár. A fibrinolízis számos antifibrinolitikus szerrel történő kezelését eredetileg májátültetésre fejlesztették ki, és a viszkoelasztikus vizsgálatokról kimutatták, hogy jelentősen segítenek optimalizálni az antifibrinolitikus szerek alkalmazását, beleértve a trombotikus szövődmények elkerülését is (18). A tromboelasztogram (TEG) mára standard véralvadási monitorrá vált a májtranszplantációs programok többségében, irányelvek a koaguláció kezelésével kapcsolatban is megjelentek (19). Mindazonáltal az anesztézia és intenzív terápia specialitásai kiterjednek a preoperatív kivizsgáláson és az intraoperatív anesztézián át a posztoperatív intenzív osztályos kezelésig (20).
A kezdeti lépések után a hazai program fejlődése is követte a nemzetközi trendeket (21, 22). A sebészeti technika is fejlődött, a vena cava teljes kirekesztése korábban veno-venosus biopumpa alkalmazása mellett történt, a „piggy back” műtéttechnika mellett erre már nem volt szükség (23). A műtéttechnika abban különbözik, hogy a recipiensnél a vena cava inferiort (VCI) megőrizzük, vagy sem. A piggy back technika során megőrizzük a natív VCI-t. A donor szuprahepatikus VCI-jét a recipiens májvénáinak közös szájadékával, illetve VCI-jével anasztomizáljuk. Ehhez csak részleges vena cava kirekesztésre van szükség, így az anhepatikus fázisban is nagyobb hemodinamikai stabilitással jár. Amikor a recipiens VCI-jét nem tudjuk megőrizni, akkor a hagyományos „cross-clamp” technika során vég a véghez anastomosisokat készítünk a donor VCI-szegmense és a recipiens szupra-, illetve infrahepatikus VCI-je között, ezt azonban csak teljes vena cava kirekesztéssel lehet végezni. A modern transzplantációs anesztézia mellett azonban már itt sincs szükség biopumpára a hatékony hemodinamikai menedzsment miatt. Emellett megfelelő körülmények között akár még vérkészítménymentesen is elvégezhető a májátültetés (24, 25). Mindez kiváló példája annak, hogy a transzplantáció igazi csapatmunka a különböző diszciplínák között, a műtét alatt a sebészet és az anesztézia folyamatos kommunikációja elengedhetetlen. Ugyanilyen szükség van – a teljesség igénye nélkül – a megfelelő patológiai és radiológiai háttérre is (26). Utóbbinál kiemelten fontos és nélkülözhetetlen az intervenciós radiológia szerepe, nemcsak a szövődmények kezelésében, de a várólistán levő betegek „bridging”, illetve tumoros betegség esetén akár „downstaging” kezelésében (TIPS, TACE, RFA) is (27, 28, 29, 30, 31).
Az 1990-es években vezették be a támogatott műtét utáni felépülési program (enhanced recovery after surgery, ERAS) első protokolljait, kifejezetten a májrecipiensek számára kidolgozva. A kezdeti cél a transzplantáció utáni korai extubáció volt. Az ERAS-protokoll alkalmazása rövidebb intenzív osztályos kezeléssel, valamint a transzfúzió csökkenésével jár (32). Legfrissebb fejlemény az ILTS kezdeményezésére az ERAS4OLT.org nevű munkacsoport 80 ajánlást megfogalmazó irányelve (33). Az ERAS alkalmazásával az eredmények további javulása várható a hazai környezetben is, ehhez azonban az ajánlásoknak megfelelően gépi perfúzió bevezetésére is szükség van.
A szervhiány
A transzplantációs programok legnagyobb korlátja világszerte a különböző donorszervek hiánya, a rendelkezésre álló graftoknak az igényekhez képest relatíve alacsony száma. Ez a májtranszplantáció esetében is így van, hazánkban is (34). A probléma csak részben orvosolható parciális graftokkal, mint például a májgraftok kettéválasztása („splitting”) vagy az élő donoros májátültetés (living donor liver transplantation, LDLT). A kiterjesztett kritériumú donorokból (extended criteria donor, ECD) származó graftok alkalmazásával tovább növelhető a kadáverdonorgraftok száma. Ezek a korábban marginálisnak nevezett graftok beültetésre alkalmatlannak voltak ítélve. Számos donoreredetű faktor rizikótényezőt jelent a csökkent posztoperatív graftfunkció, rosszabb beteg- és grafttúlélés szempontjából. Ilyen kockázati tényező az idős, az elhízott donor, a donorgondozás során alkalmazott intenzív inotróp terápia, az elhúzódó hipotenziós epizód, a magas szérumnátrium-, transzamináz- és bilirubinértékek, de ide tartozhatnak a HBV/HCV szeropozitív donorok is (35). Ezekkel a donorparaméterekkel egyre gyakrabban találkozunk, mára már szinte a donorok többsége ebbe a kategóriába tartozik, szemben az „ideális” vagy standard donorokkal (24, 36). Ahhoz, hogy ezekkel a graftokkal ugyanolyan jó eredményeket érjünk el, a kritériumokat észszerűen kell kiterjesztenünk. Az állandó patológiai háttér a graftminőség elbírálásához (pl. a steatosis mértéke) éppen ezért elengedhetetlen (22, 37). Így is a magas rizikótényezőkkel bíró graftok aránya közel 25%. Természetesen ECD esetében valamelyest rosszabb eredményekkel számolhatunk, de körültekintő donor-recipiens párosítással a kockázat-haszon arány az utóbbi irányába terelhető, akut életmentés esetében pedig az egyetlen túlélési lehetőséget biztosíthatja egy adott ECD-szerv.
További speciális formája az ECD-nek, valamint donorszám növelésének újabb lehetősége a keringésmegállást követő donációból (donation after circulatory death, DCD) származó szervek felhasználása. A Maastrichti Klasszifikáció szerint kétfajta csoportra lehet osztani a potenciális donorokat: nem kontrollált (I. kórházba érkezéskor halott, II. sikertelen újraélesztés) és kontrollált (III. életfenntartó kezelés tervezett visszavonása, IV. hirtelen keringés-összeomlás agyhalál megállapítása után, de még szervkivétel előtt, V. aktív eutanázia) (38). Európa 18 országában van DCD-donáció, ebből 8 országban mindkét csoport, de van, ahol csak kontrollált, és van, ahol csak nem kontrollált DCD végezhető. A legtöbb szerv a kontrollált donorokból nyerhető, ahol a kezelés visszavonását egy jogszabályban rögzített, országonként változó hosszúságú (5-30 perc) várakozás, ún. „no-touch” periódus kell hogy kövesse, de az agónia még tovább is elhúzódhat. Ez idő alatt a szervek perfúziója és oxigénellátása is folyamatosan romlik, SpO2 <80% MAP <60 Hgmm értékektől funkcionális meleg iszkémiával (functional donor warm ischaemia time, fDWIT) kell számolni. A DCD alacsonyabb donációs potenciálja nagyrészt ennek, a kezelés visszavonása és a hideg perfúzió elindítása közötti időszakban elszenvedett meleg iszkémiának a következménye, amire a máj és különösen az epeutak érzékenyek. A túlzott iszkémiás májkárosodás következményei súlyosak lehetnek, magasabb a graft elégtelenség, a posztoperatív morbiditás és az iszkémiás cholangiopathia előfordulási gyakorisága. Az irányelvek szerint, ha a fDWIT meghaladja a 30 percet, a graftvesztés magasabb kockázatával kell számolni. Azok a DCD-májgraftok, amelyeknél a fDWIT >30 perc, és posztmortem normothermiás regionális gépi perfúzióval (NRP) kezeltek, potenciálisan transzplantálhatók, feltéve, hogy a releváns paraméterek változása az NRP során megfelelő (39, 40). Magyarországon a DCD donáció még nem elérhető.
Az ECD szervek minél jobb minőségben és minél nagyobb arányban történő beültetését többek között a gépi perfúziós technika fejlődése is elősegítette. Gépi perfúzió által nemcsak a szervek konzerválása optimalizálható, de különböző diagnosztikus és terápiás eljárásokra is lehetőség van (41). A dinamikus gépi perfúzión belül megkülönböztetjük a fent említett in vivo/in situ módszert, vagy más néven abdominalis regionális perfúziót (NRP), amelynek leginkább DCD esetén van jelentősége, illetve az ex vivo/ex situ módszereket. Ex vivo gépi perfúziónál az eltávolított szervet kanüláljuk, majd a perfúziós oldatot folyamatos áramlásban tartó pumpához csatlakoztatjuk, amelynek része lehet még egy hőszabályozó, illetve egy oxigénadagoló is. Ez alapján megkülönböztetünk hypothermiás (hypothermic machine perfusion, HMP), subnormothermiás (subnormothermic machine perfusion, SNMP) és normothermiás (normothermic machine perfusion, NMP) gépi perfúziót. A gépi perfúzió idejétől függően pedig a leggyakrabban használt módszerek a preimplantációs (vagy más néven végiszkémiás; SCS után, a beültetés előtt) és a folyamatos (szervkivételtől szállításra is alkalmas géppel a beültetésig) gépi perfúzió. A HMP-nek ECD- és DCD-vesék esetén nyilvánvaló az előnye az elhúzódó graftfunkció (delayed graft function, DGF) arányának csökkentésében. A gépi perfúzió oxigén adásával is kiegészíthető, máj esetében a HOPE (hypothermic oxygenated perfusion) alkalmazása a beültetés előtt
1 óráig prekondicionálja a graftot, és ezáltal védi az epeutakat (42). Az oxigenizált donorvérrel történő normothermiás gépi perfúzióval pedig hosszabb tárolás érhető el, steatoticus májgraftok esetében különböző zsírtalanító „koktélokkal” 24 óra alatt a macrosteatosis akár 18%-kal csökkenthető, de alkalmazható mesenchymalis őssejtkezelés, immunológiai modifikáció és génterápia is, sőt splitting is végezhető (43, 44). Magyarországon jelenleg gépi perfúzió egyetlen szerv esetében sem áll rendelkezésre finanszírozás hiányában.
Bizonyos esetekben parciális májgraftokat használunk beültetésre. Az ún. split májátültetés vagy splitting a máj két részre történő osztását jelenti, és technikája függ attól, hogy kik a leendő recipiensek. Ha a grafton egy felnőtt és egy gyermek osztozik, a májat egy – a IV. szegmentumot is magába foglaló – kiterjesztett jobb lebenyre és egy – a II. és III. szegmentumból álló – parciális bal (bal lateralis) graftra osztjuk. Ha pedig két felnőtt között osztjuk meg a májat, akkor a két rész egy teljes jobb lebeny (V–VIII. szegmentum) és egy teljes bal lebeny (I–IV. szegmentum). Kettéosztani azonban csak a szigorú kritériumoknak megfelelő, ideális szerveket lehet, tehát nem alkalmas rá minden donormáj.
Gyermekrecipiensek esetében a kisméretű donorszervek hiányának megoldására egy másik alternatív út az egy felnőtt élő donorból (általában szülőből) származó bal lateralis graft átültetése. Gyermekek esetében az élő donáció a várólista-mortalitást érzékelhetően csökkentette. Felnőttek esetén, az élő donáció során általában a donor jobb lebenyét használjuk fel, a graft minimális mérete legalább a recipiens testtömegének 0,8%-a kell, hogy legyen. A donorműtét technikai nehézségei mellett a műtét morbiditása is jelentős, ami a donorok 38%-át érinti, a mortalitási rátát pedig körülbelül 0,18%-ra becsülik. Ezen túl a szerv beültetése is kihívást jelent, leginkább az anastomosisok mérete miatt. Összességében, annak ellenére, hogy a donormortalitás igen kicsi, az az elképzelés, miszerint egy egészséges ember meghalhat szervátültetés következtében, határozottan befolyásolja a nyugati kultúrák gondolkodását. Az élő donoros májátültetés kulcsfontosságú a világ egyes részein, például Japánban és Dél-Koreában, ahol egészen a közelmúltig kulturális és jogi akadályok miatt nem végeztek elhunyt donoros májátültetést (45).
Magyarországon a donorszervek számának növelése érdekében tett, az eddigi talán legfontosabb momentum hazánk csatlakozása Ausztria, Belgium, Hollandia, Horvátország, Luxemburg, Németország és Szlovénia mellé az Eurotransplant Nemzetközi Szervcsere Szervezetbe (14, 36, 46, 47, 48). Magyarország 2012. január 1-jén előzetes együttműködési megállapodást kötött az Eurotransplanttal, amelynek keretei között három speciális csoport magyar betegeit helyeztük a közösségi várólistára: ezek olyan betegek, akiknek sürgető szükségük van vese, szív- vagy májátültetésre, magas ellenanyagszinttel rendelkező, érzékenyített vesebetegek és szervátültetésre váró gyermekek. Mivel az előzetes együttműködés mind Magyarország, mind az Eurotransplant számára sikeresnek és előnyösnek bizonyult, szakmai konszenzuson alapuló egészségpolitikai döntés született hazánk teljes jogú Eurotransplant tagságáról. A teljes jogú tagság 2013. július 1-jén lépett életbe, ezzel az Eurotransplant által kiszolgált terület lakossága több mint 134 millió főre duzzadt.
Sajnos a SARS-CoV-2-világjárvány terjedése drasztikus változásokat okozott a mindennapi betegellátásban. Magyarországon 2020-ban jelentősen, 38,33%-kal csökkent az agyhalott szervdonorok száma, míg az Eurotransplantban átlagosan 8,64%-kal, és 23 európai országban 17,55%-kal (49). Természetesen így a szervdonációs, és következményesen a transzplantációs aktivitás is jelentősen csökkent, 2019-ben még 180, 2020-ban már csak 111 megvalósult szervdonáció volt. A hazai májtranszplantációk száma is kb. 37%-kal csökkent (1. ábra). A legtöbb európai országban átmeneti és kisebb mértékű szervdonációs csökkenést regisztráltak, a magyar helyzet azonban ennél rosszabb, 2023-ban még mindig csak 131 megvalósult donáció volt. A hazai szervátültetési program mindemellett biztonságos: donoreredetű SARS-CoV-2-átvitel nem történt hazánkban.
Változások a májtranszplantáció indikációiban
Májátültetés indokolt krónikus végstádiumú májbetegségben, a májat vagy ezáltal egyéb szervet érintő anyagcsere-betegségben, hepatocelluláris karcinóma (HCC) korai stádiumában, hepatikus epithelioid haemangioendothelioma (HEHE), továbbá neuroendokrin tumorok (NET) májmetasztázisainak meghatározott eseteiben és akut májelégtelenségben (acute liver failure, ALF). A leggyakoribb májtranszplantációs indikáció felnőtteknél a májcirrózis. A májműködés dekompenzálódása, illetve a cirrózis szövődményeinek kialakulása – mint a klinikailag szignifikáns portalis hypertensio, nyelőcső-visszérvérzés, ascites, hepatorenalis szindróma, encephalopathia, hepatopulmonalis szindróma, portopulmonalis hypertensio, továbbá elviselhetetlen pruritus – esetén a beteg referálása javasolt a májvárólista-bizottságnak (50).
A várólistán a prioritást a várakozási idő és a májbetegség súlyossága határozza meg. Utóbbi meghatározásához korábban a Child–Pugh–Turcotte-klasszifikációt, majd 2002-től az objektív méréseken – kreatinin, bilirubin és INR – alapuló MELD (Model of End-stage Liver Disease) score-rendszert használjuk (51). A MELD azonban nem mindig reprezentálja a betegség súlyosságát (pl. varixvérzés), de a várólistasorrend meghatározásra jól alkalmazható. Számos MELD-kivétel (exceptional MELD) van, mint a cirrózis pulmonális szövődményei, a hepatikus encephalopathia, amyloidosis, elsődleges hyperoxaluria stb. Ezekben az esetekben további prioritási pontokat kaphat a beteg (52). Egy másik kivétel a HCC, ilyenkor tumorpontok adhatók hozzá a laboratóriumi MELD-hez, hogy elsőbbséget kapjanak a HCC-s betegek, hiszen a várólistán töltött idő alatt a daganat progrediál, még ha a májbetegsége kompenzált is. Magyarországon erre vonatkozóan jelenleg természetesen az Eurotransplant szabályrendszere az irányadó (53).
Az elmúlt évtizedben a májvárólista összetétele és a májátültetés indikációi jelentősen megváltoztak Európában és világszerte a hatékony vírusellenes gyógyszerek kifejlesztése, valamint az életmód és a táplálkozási magatartás változásai miatt. Általában eddig az alapbetegségtől függetlenül a cirrózis volt az LT leggyakoribb indikációja (50%), ezt követik az elsődleges májdaganatok (17%) és a cholestaticus májbetegségek (10%). A cirrózis elsősorban a vírusfertőzéssel és az alkoholfogyasztással volt összefüggésben (54–56). Ez az indikáció az elmúlt években csökkent, főként a hepatitis C-vírussal (HCV) kapcsolatos cirrózis csökkenése miatt. A közvetlen hatású vírusellenes (direct-acting antivirals, DAA) gyógyszerek bevezetése óta a HCV-vel összefüggő májbetegség miatt végzett májátültetések aránya jelentősen csökkent, beleértve a HCV-vel összefüggő HCC-t is (57). Ugyanakkor a májrák (főként HCC) miatt végzett átültetések számának a legnagyobb a növekedése. Az Egyesült Államokban a nem alkoholos eredetű zsírmáj és a nem alkoholos steatohepatitis (NALFD/NASH) lett a májtranszplantáció második leggyakoribb indikációja, de most már Európában is egyre gyakrabban végeznek májátültetést NALFD/NASH esetében (58).
Magyarországon némiképp más a májvárólista összetétele (2. ábra), ugyan a HCV más országokhoz hasonlóan visszaszorult. Hazánkban jelenleg a leggyakoribb indikációt a primer szklerotizáló cholangitis (PSC) jelenti, amelyet az alkoholos májcirrózis (ALD) követ, a NALFD/NASH és HCC aránya kisebb (59).
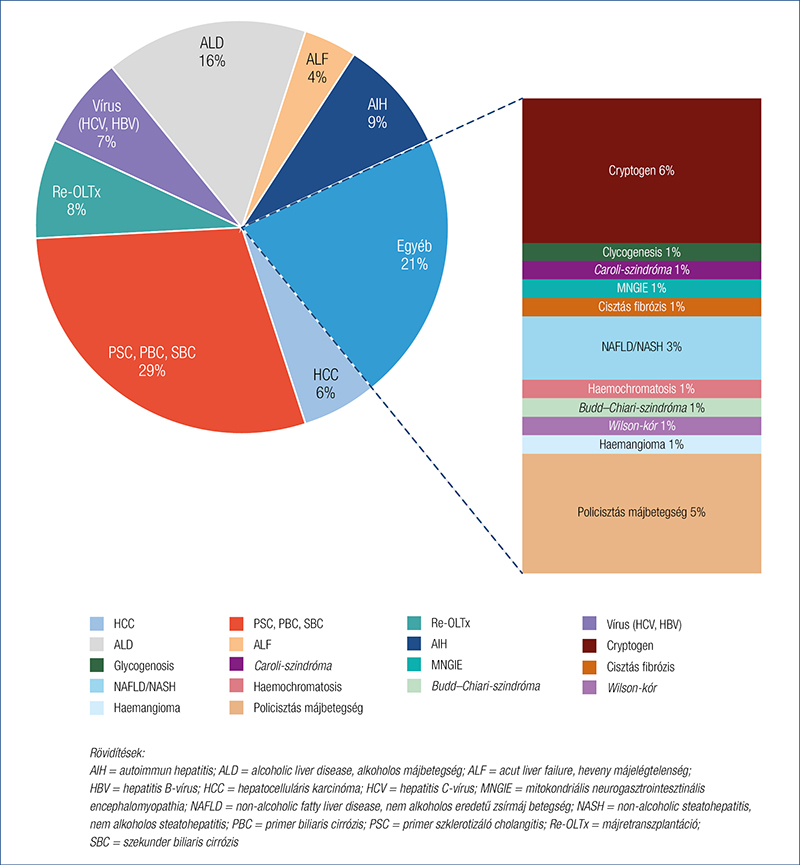
A vírusos májbetegségek kezelésében a DAA-kal elért áttörő eredményeknek köszönhetően nemcsak a várólistán találkozunk alacsonyabb számban HCV-, HBV-infektált betegekkel, hanem kikezelt állapotban, szinte csak a „visszamaradt” cirrózissal kell transzplantálnunk őket, a korábban rendszeres problémát okozó, a transzplantált graftban előforduló vírusrekurrencia pedig szinte eltűnt. Ugyanakkor hazánkban a NALFD/NASH még nem ért el akkora gyakoriságot, mint a nyugati világban, bár kétségkívül emelkedőben van a számuk. Az ALD ugyan nem lett listavezető, de ez nem jelenti azt, hogy ne ez lenne Magyarországon a leggyakoribb oka a májcirrózisnak. A májtranszplantációhoz szükséges 1 éves kötelező absztinencia azonban sokakat kizár ebből a gyógymódból, és az alapbetegség rekurrenciája, illetve annak előrejelzése továbbra is nehézséget jelent (60).
Jelenleg a várólistánkon első helyen álló PSC esetén májtranszplantációs indikációt jelent a hosszú ideje fennálló súlyos sárgaság, ismétlődő, antibiotikummal kontrollálhatatlan epeúti gyulladásos epizódok, másodlagos biliaris cirrózissal együtt járó szövődményes portalis hipertónia és/vagy dekompenzált májelégtelenség. Ugyanakkor a PSC a cholangiocellularis karcinóma (CCC) kialakulásának kockázati tényezője is, sőt PSC és colitis ulcerosa fennállása esetén a vastagbélrák kialakulásának is magasabb a kockázata. A CCC kialakulásának prevalenciája több mint 10-15% 10 éves betegségfennállás során (61). Egyes esetekben a CCC-t csak a műtét során ismerik fel, más esetekben a cholestasis progressziója és megnövekedett szintű CA 19-9 miatt lesz nagyon erős a gyanú, ha műtét során nem is található meg. Irodalmi adatok szerint a PSC miatt végzett májátültetés során az explantátum szövettani vizsgálatával igazolt, de előre nem gyanított CCC előfordulása 10-20%. Sokszor igen nehéz a CCC diagnózisa PSC-ben transzplantáció előtt. A PSC talaján kialakult CCC gyanúja lehet májtranszplantációs indikáció, ellenben kontraindikáció is előrehaladott stádiumban. A transzplantációt megelőzően nem gyanított CCC-vel transzpantált betegeknél a CCC-rekurrencia kockázata magas, és a hosszú távú prognózis rossz (62). Krónikus gyulladásos bélbetegség (IBD), colitis ulcerosa gyakran jár PSC-vel, és önmagában nem transzplantációs kontraindikáció. De májtranszplantáció előtt és után is az aktív IBD-t kezelni és kontrollálni kell. Colitis ulcerosa fennállása esetén vastagbélrák szűrése szükséges, ilyenkor malignitás esetén transzplantáció nem végezhető (63). Növekvő PSC-s beteganyagunkban jelenleg a problémát az okozza, hogy a malignitás előfordulása is növekszik, ráadásul fiatalabb korban. Ezért még „jó állapotú”, fiatal betegeket is sokszor kénytelenek vagyunk a transzplantáció potenciális szövődményeinek kitenni a rák megelőzése céljából. Ugyanakkor azt észleljük, hogy a kicsiny, korai stádiumú, csak az explantált máj szövettani vizsgálatával felfedezett CCC utáni eredmények jók, sajnos ezzel szemben radiomorfológiai jeleket preoperatíve nem mutató, előrehaladottabb malignitás prognózisa rendkívül rossz.
HCC esetében általában a Milánói Kritériumokat (szoliter HCC átmérője <5 cm, vagy legfeljebb 3 góc esetén az egyes gócok átmérője <3 cm) teljesítő betegeknél a májátültetés kiváló eredményt hoz (64). Több egyéb kiterjesztett kritériumrendszer létezik, de akkor elfogadható, ha azzal a milánóihoz hasonló rekurrenciamentes túlélést lehet elérni, mint például a UCSF-kritériumok (65). Az extrahepatikus propagáció és a makrovaszkuláris invázió (tumorthrombus) abszolút kontraindikációt jelent. Az intervenciós radiológia fejlődése lehetővé tette a várólistán levő, HCC-ben szenvedő betegek transzplantációig való eljuttatását („bridging”) a tumoros gócok ablációjával vagy embolizációjával, sőt akár a kritériumokat túllépő daganatok alacsonyabb stádiumba kerülését („downstaging”) (66).
HCC-vel szerzett tapasztalatainkat több alkalommal leközöltük, azonban annak ellenére, hogy incidenciája folyamatosan növekszik, és biztosan több hazai beteg kerülhetne várólistára, mégis kevés beteg jut el a referálásig (67, 68, 69). Ennek okát pontosan nem tudjuk, de feltételezzük a magyar lakosság általánosan rosszabb egészségi állapotának és a vélhetően már a transzplantációs kritériumokból kicsúszó, késői stádiumban felfedezett esetek nagyobb arányát.
Májátültetés alkalmazható fibrolamelláris karcinóma és epithelioid haemangioendothelioma (HEHE), valamint gyermekeknél hepatoblastoma meghatározott eseteiben, amely indikációkkal sikeres transzplantációkat végeztünk (70).
A májátültetés indikációja epeúti rák (CCC) esetén a rekurrencia magas kockázata miatt továbbra is vitatott. Irreszekábilis perihiláris CCC-nél alkalmaztak először egy olyan protokollt, amelyben neoadjuváns kemoirradiációt követett májtranszplantáció, ezzel a kombinációval 65%-os rekurrenciamentes 5 éves túlélést lehet elérni szigorúan szelektált betegcsoportban. Ennek ellenére CCC esetében a kezelési protokollok még nem terjedtek el (71, 72, 73, 74). Ilyen indikációval még nem végzünk májátültetést, de a PSC-vel fent említett tapasztalataink és a nemzetközi irodalom alapján ennek protokollján dolgozunk, ugyanakkor igen szelektált betegek jönnek csak számításba.
Klasszikusan a máj metasztatikus daganatai gyenge transzplantációs indikációnak tekinthetők, bár neuroendokrin tumorok (NET) esetében májátültetés végezhető, és szigorú kritériumok mellett tapasztalataink szerint is jó eredmények érhetők el (75). A májtranszplantáció szerepe a colorectalis rák irreszekábilis metasztázisainak (CRLM) kezelésében még mindig vitatott. Norvégiából származó tanulmányok eredményei biztatóak (akár 70-100% 5 éves túlélés), és a palliatív kemoterápiához képest jobbak, a recipiensek többségének azért rekurrens betegsége van (76, 77, 78). Ezért ezeket az eredményeket még óvatosan kell kezelni, ezen túlmenően a donorhiány időszakában e tekintetben a szervhasználat etikai kérdéseket is felvet. Ez utóbbi miatt a RAPID study májreszekció és parciális májátültetés (II–III. szegmentum), majd második lépésben hepatectomia stratégiát alkalmaz (79). A Semmelweis Egyetemen klinikai vizsgálat keretében elindítottunk egy ezen az elven alapuló, Európában máshol is alkalmazott protokollt, amelyben élő donorból származó parciális grafttal történhet meg a kétlépcsős beavatkozás (APOLT-ALPPS), jelenleg a betegek bevonása, kivizsgálása folyik (80).
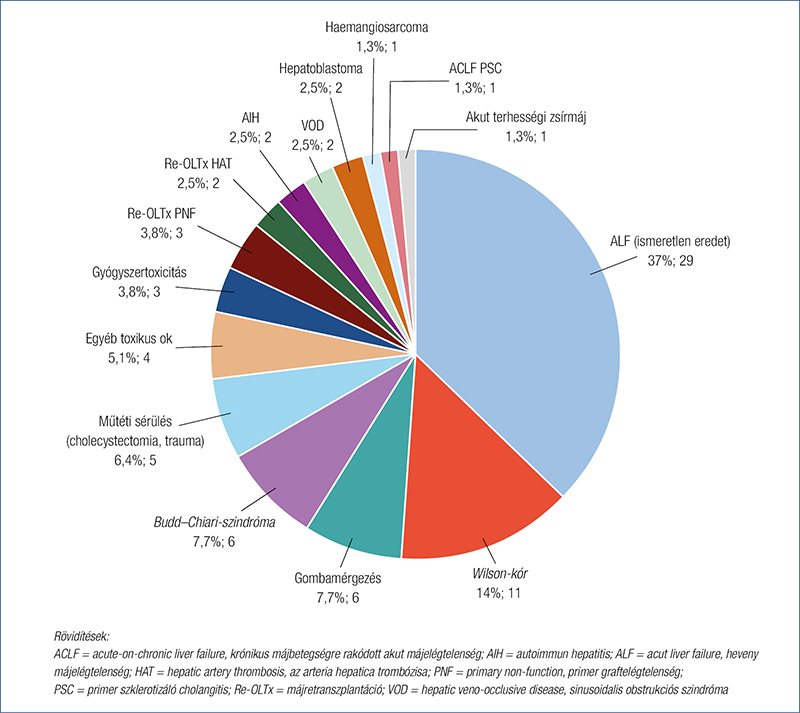
Az akut májelégtelenséget (acute liver failure, ALF) egy korábban egészséges máj masszív akut károsodása jelenti encephalopathia kialakulásával, amely magas rövid távú mortalitással jár. A prognózist lényegében a neurológiai állapot határozza meg, de nagymértékben befolyásolja a többi szerv érintettsége is. A májátültetés nagymértékben javította az ALF kimenetelét a túlélés 10-20%-os (összes ok együttesen) szintjének 1 éves 75-80%-os, és 5 éves 70%-os szintre emelésével, de így is elmarad a standard listáról történő transzplantációk eredményeihez képest. Ismeretlen etiológia esetén azonban 50%-ra is csökkenhet a sikeres szervátültetés aránya. Ezeknek a betegeknek a sürgős listára (high urgency, HU) való helyezése alapvetően vagy a King’s College, vagy a Clichy kritériumain alapul, továbbá esetünkben az Eurotransplant szabályzata alapján döntenek az auditorok (53). Az ALF etiológiája leggyakrabban gyógyszertoxicitás (pl. paracetamol, amely hazánkban kevésbé terjedt el, mint például Nagy-Britanniában), gombamérgezés, vírussal összefüggő vagy ismeretlen májelégtelenség, ritkábban gyorsan progrediáló Wilson-kór vagy Budd–Chiari-szindróma. Az ET szabályzata szerint csak utóbbi két esetben lehet „acute-on-chronic” májelégtelenség (AoCLF) esetén HU-listára helyezni beteget, egyéb okból standard listára tudjuk csak helyezni őket. HU-listára helyezhetők viszont irreszekábilis hepatoblastomában szenvedő gyermekek a megfelelő kritériumok esetén, kemoterápia után. Akut retranszplantáció is indokolt lehet szövődményes májátültetés után, például az arteria hepatica trombózisa vagy elsődleges graftelégtelenség (primary non-function, PNF) következtében. A hazai akut májtranszplantációs indikációk megoszlását a 3. ábra mutatja.
A hazai májtranszplantáció jelen helyzetének értékelése
Az Eurotransplanthoz csatlakozás a hazai szervátültetés egyik fontos mérföldköve volt. Az ún. „donorpool” jelentősen megnövekedett mérete miatt jobb allokációs egyezések lehetnek, vese esetében ez jobb immunológiai egyezést jelent, máj esetében ez leginkább a méret és a minőség, de a nagyobb populáció miatt több a gyermek- vagy kisméretű donor is. Így nagyobb az egészségnyereség is, valamint kevésbé vesznek el donorszervek. Ha nincs az adott donormájhoz megfelelő recipiens a várólistán, de más tagállamban beültetik, akkor ez beleszámít az országok közötti szervelosztás egyensúlyába, azaz később kompenzálva lesz.
Az ET-n belül Németország mint a legnagyobb tagország „májelszívó” hatása köztudott. Ennek ellenére a csatlakozás óta a májátültetések száma megduplázódott Magyarországon, ehhez a donációs aktivitásnak is növekednie kellett (1. ábra). Hazánkban az elhunytból történő többszervi donációk számának emelkedése nemcsak a 2012–2013-as csatlakozásnak tudható be, hanem legalább annyira egyéb párhuzamos hazai kezdeményezésnek is. Ezek közül csak néhányat említve: a kórházi koordináció minőségbiztosítási program keretében, a szervdonációs célú szállítási feladatok centralizálása, a 2010/53/EU Irányelv hazai implementációja, szervdonációs útmutató a donorkórházak részére, a Nemzeti Szervdonációs Regiszter, a hazai donorsebészeti képzés és a transzplantációs donorkoordinátori hálózat fejlesztése.
A pandémia előtt a 2019-es évet tekintve az utilizált szervdonorok száma vonatkozásában az Eurotransplant-tagállamok között nem álltunk rosszul. Amíg a magyarországi lakosságszámra számított utilizált donorszám az ET-átlag 1,24-szorosa volt, addig például Németországban ez az átlag alatt volt, és van ma is egyébként. Sajnos a COVID-19-pandémia okozta donációs visszaesésből még nem sikerült talpra állnia a hazai donációs aktivitásnak.
Az ET másik nagy előnye, hogy akut fulmináns májelégtelenségben, primer májátültetést követően kialakult PNF (primary non-function) vagy akár májreszekció után kialakult PHLF-ben (post hepatectomy liver failure) is HU-listára helyezésre lehet szükség. Ha a recipiens teljesíti a kritériumokat, és az auditorok elfogadják a kérelmet, akkor akár egy órán belül a sürgős listára kerülhet, és folyamatosan kap szervfelajánlásokat a beteg. Majd minden esetben néhány napon belül kap alkalmas szervet is, leginkább mérettől és kortól függően. Élő donoros májátültetés vagy splitprogram HU-háttér nélkül nem tud eredményesen működni, hiszen a parciális májátültetés esetében nemcsak a májparenchyma kisebb volumene, hanem a kisebb vaszkuláris és biliaris képletek miatt a graftelégtelenség előfordulási aránya nagyobb a teljes szerv átültetéséhez képest. Természetesen, ha másik tagországban van HU-listán beteg, akkor az potenciálisan magyar szerv „exportját” is jelentheti. A legnagyobb Németországban értelemszerűen a populációval arányosan magasabb a potenciális HU-recipiensjelöltek száma. Ugyanakkor 27 májcentrum van 83 millió lakosra, míg Magyarországon 1 darab 9,7 millió lakosra. Ez az egy májcentrum ugyanakkor sok egyéb más feladatot is végez. Felszereltsége, lehetőségei elmaradnak a német, holland, belga stb. centrumokétól. Például egy marginális, erősen steatoticus vagy idős májat ezekben a centrumokban perfúziós gépre tesznek, míg Magyarországon semmilyen gépi perfúziós berendezés nem áll rendelkezésre (semmilyen szervhez), technológiában sajnos évtizedekkel vagyunk elmaradva. Mindezek mellett a várólistán levő magyar betegek átlagos várakozási ideje 2023. december 31-én 1,17 év, míg a 2023-ban transzplantált betegek átlagos várakozási ideje 0,87 év volt.
Amíg Magyarországon eddig összesen csak 3 alkalommal történt élő donoros májátültetés, addig halott donorból származó parciális grafttal több alkalommal is. Ezek azonban vagy csak redukált graftok voltak, vagy más ET-centrumban képzett split májgraftok (22, 81). 2023 decemberében elvégeztük az első olyan split májátültetést, ahol magyar donorból származó máj kettéválasztását magunk végeztük, mindkét parciális graftot egy-egy magyar recipiensnek ültetve be; 2024 januárjában ismét történt egy hasonló kettős átültetés. Reálisan azonban nem várható, hogy a májátültetések száma a parciális graftoktól ugrásszerűen megnő. Alapvetően akkor van szükség igazán split vagy élő donoros májátültetésre, ha kisméretű gyermek vár sürgősen májra, megvalósulni pedig akkor tud, ha erre alkalmas donorszerv is rendelkezésre áll. Ez a konstelláció viszonylag ritkán áll fenn. Az egészen kicsi, 10 kg alatti magyar gyermekek és csecsemők májátültetése (pl. biliaris atresia, hepatoblastoma miatt) pedig jelenleg Hamburgban történik, ugyanis ehhez Magyarországon nincsenek meg a technikai és humánerőforrás-beli feltételek.
Mindezek tükrében az ET-tagság előnyei jobban kihasználhatóak lennének a fenti problémák orvoslása után. Bár DCD egyelőre nem végezhető hazánkban, a hazai agyhalottak donorként való lejelentésében is sokkal több a potenciál. A várólista feltöltése és a donációs aktivitás fokozása növelhetné elfogadható mértékben a májtranszplantációk számát.
Irodalom
2. Starzl TE, Groth CG, Brettschneider L, Penn I, Fulginiti VA, Moon JB, Blanchard H, Martin AJ Jr, Porter KA. Orthotopic homotransplantation of the human liver. Ann Surg 1968 Sep; 168(3): 392–415.
https://doi.org/10.1097/00000658-196809000-00009. PMID: 4877589;
PMCID: PMC1387344.
3. Calne RY, Williams R. Liver transplantation in man. I. Observations on technique and organization in five cases. Br Med J 1968 Nov 30; 4(5630): 535–40. https://doi.org/10.1136/bmj.4.5630.535. PMID: 4881063;
PMCID: PMC1912414.
4. Wiesner RH, Goldstein RM, Donovan JP, Miller CM, Lake JR, Lucey MR. The impact of cyclosporine dose and level on acute rejection and patient and graft survival in liver transplant recipients. Liver Transpl Surg 1998 Jan; 4(1): 34–41. https://doi.org/10.1002/lt.500040105 PMID: 9457965.
5. Haddad EM, McAlister VC, Renouf E, Malthaner R, Kjaer MS, Gluud LL. Cyclosporin versus tacrolimus for liver transplanted patients. Cochrane Database Syst Rev 2006 Oct 18; 2006(4): CD005161.
https://doi.org/10.1002/14651858.CD005161.pub2 PMID: 17054241;
PMCID: PMC8865611.
6. Yu WM, Coddington D, Bitter-Suermann H. Rat liver preservation. I. The components of UW solution that are essential to its success. Transplantation 1990 Jun; 49(6): 1060–6.
https://doi.org/10.1097/00007890-199006000-00007 PMID: 2360249.
7. Bretschneider HJ. Myocardial protection. Thorac Cardiovasc Surg 1980 Oct; 28(5): 295–302. https://doi.org/10.1055/s-2007-1022099 PMID: 6161427.
8. Kupcsulik P, Darvas K. 40 éve történt az első májátültetés Magyarországon (The first liver transplantation in Hungary was performed 40 years ago). Orv Hetil 2023 Jun 11; 164(23): 919–920. Hungarian.
https://doi.org/10.1556/650.2023.HO2759 PMID: 37302127.
9. Petri A, Hőhn J, Géczi T, Libor L, Lázár G. A májsebészet története a Szegedi Tudományegyetem Sebészeti Klinikáján (Short history of liver surgery in the Department of Surgery of University of Szeged). Magy Seb 2022 Jun 20; 75(2): 179–181. Hungarian.
https://doi.org/10.1556/1046.2022.20013 PMID: 35895540.
10. Perner F. Májtranszplantáció Magyarországon (Liver transplantation in Hungary). Orv Hetil 1996 Oct 20; 137(42 Suppl 1): 2358–62. Hungarian. PMID: 9045114.
11. Kim WR, Lake JR, Smith JM, Schladt DP, Skeans MA, Harper AM, Wainright JL, Snyder JJ, Israni AK, Kasiske BL. OPTN/SRTR 2016 Annual Data Report: Liver. Am J Transplant 2018 Jan; 18 Suppl 1: 172–253.
https://doi.org/10.1111/ajt.14559 PMID: 29292603.
12. Müller PC, Kabacam G, Vibert E, Germani G, Petrowsky H. Current status of liver transplantation in Europe. Int J Surg 2020 Oct; 82S: 22–29.
https://doi.org/10.1016/j.ijsu.2020.05.062 Epub 2020 May 23.
PMID: 32454252.
13. Adam R, Karam V, Cailliez V, O Grady JG, Mirza D, Cherqui D, et al.; all the other 126 contributing centers (www.eltr.org) and the European Liver and Intestine Transplant Association (ELITA). 2018 Annual Report of the European Liver Transplant Registry (ELTR) – 50-year evolution of liver transplantation. Transpl Int 2018 Dec; 31(12): 1293–1317.
https://doi.org/10.1111/tri.13358 PMID: 30259574.
14. Országos Vérellátó Szolgálat Szakmai beszámoló, 2022.
https://www.ovsz.hu/hu/hirek/szakmai-beszamolo-2022
15. Aggarwal S, Kang Y, Freeman JA, Fortunato FL, Pinsky MR. Postreperfusion syndrome: cardiovascular collapse following hepatic reperfusion during liver transplantation. Transplant Proc 1987 Aug; 19(4 Suppl 3): 54–5. PMID: 3303534.
16. Paugam-Burtz C, Kavafyan J, Merckx P, Dahmani S, Sommacale D, Ramsay M, Belghiti J, Mantz J. Postreperfusion syndrome during liver transplantation for cirrhosis: outcome and predictors. Liver Transpl 2009 May; 15(5): 522–9. https://doi.org/10.1002/lt.21730 PMID: 19399736.
17. Bezinover D, Mukhtar A, Wagener G, Wray C, Blasi A, Kronish K, Zerillo J, Tomescu D, Pustavoitau A, Gitman M, Singh A, Saner FH. Hemodynamic Instability During Liver Transplantation in Patients With End-stage Liver Disease: A Consensus Document from ILTS, LICAGE, and SATA. Transplantation 2021 Oct 1; 105(10): 2184–2200.
https://doi.org/10.1097/TP.0000000000003642 PMID: 33534523.
18. Mallett SV. Clinical Utility of Viscoelastic Tests of Coagulation (TEG/ROTEM) in Patients with Liver Disease and during Liver Transplantation. Semin Thromb Hemost 2015 Jul; 41(5): 527–37.
https://doi.org/10.1055/s-0035-1550434 Epub 2015 Jun 6. PMID: 26049072.
19. Bezinover D, Dirkmann D, Findlay J, Guta C, Hartmann M, Nicolau-Raducu R, Mukhtar AM, Moguilevitch M, Pivalizza E, Rosenfeld D, Saner F, Wray C, Wagener G, West J. Perioperative Coagulation Management in Liver Transplant Recipients. Transplantation 2018 Apr; 102(4): 578–592. https://doi.org/10.1097/TP.0000000000002092 PMID: 29337842.
20. Fazakas J, Smudla A. A májátültetés aneszteziológiai-intenzív terápiás vonatkozásai (Anesthetics and intensive therapeutic aspects of liver transplantation). Orv Hetil 2018 Nov; 159(46): 1891–1897. Hungarian.
https://doi.org/10.1556/650.2018.31280 PMID: 30450933.
21. Járay J, Halmos O, Görög D, Máthé Z, Dabóczy A, Telegdy L, Ibrányi E, Nagy E, Szalay F, Szalay L, Göndöcs C, Perner F. Tapasztalatok a májátültetéssel gyógyítható betegek első csoportjának szervezésével. (Experience gained from the organization of the first group of patients who benefited from liver transplantation). Orv Hetil 1996 Oct 20; 137(42 Suppl 1): 2368–70. Hungarian. PMID: 9045117.
22. Kóbori L, Görög D, Fehérvári I, Nemes B, Fazakas J, Sárváry E, Varga M, Gerlei Z, Doros A, Monostory K, Perner F. A hazai májátültetési program fejlődése (Progress of the liver transplantation programme in Hungary). Orv Hetil 2013 Jun 2; 154(22): 858–62. Hungarian.
https://doi.org/10.1556/OH.2013.29636 PMID: 23708986.
23. Nemes B, Kóbori L, Fehérvári I, Fazakas J, Gerlei Z, Ther G, Görög D, Perner F, Doros A, Sárváry E, Járay J. Hagyományos, “crossclamp” és “piggyback” technikával végzett májátültetések eredményeinek összehasonlítása (Comparison of the results of conventional, crossclamp and piggyback technique in liver transplantation). Magy Seb 2005 Jun; 58(3): 155–61. Hungarian. PMID: 16167468.
24. Wettstein D, Tóth SJ, Máthé Z. A májtranszplantáció új kihívásai (New challenges of liver transplantation). Orv Hetil 2019 Jul; 160(29): 1127–1135. Hungarian. https://doi.org/10.1556/650.2019.31465 PMID: 31303016.
25. Rengeiné Kiss T, Smudla A, Dinya E, Kóbori L, Piros L, Szabó J, Máthé Z, Illés S, Mándli T, Szabó T, Szabó M, Tóth S, Tőzsér G, Túri C, Füle B, Kanizsai P, Fazakas J. Térfogatalapú haemostasistartalékok vérmentes májtranszplantációk során (Volume-based haemostasis reserves in blood product free liver transplantations). Orv Hetil 2020 Feb; 161(7): 252–262. Hungarian. https://doi.org/10.1556/650.2020.31652 PMID: 32037866.
26. Patonai A, Nemes B, Görög D, Kóbori L, Sótonyi P Jr, Fehérvári I, Weszelits V, et al. A hazai májtranszplantációk értékelése patológiai szempontból (Pathologic evaluation of orthotopic liver transplantation in Hungary). Orv Hetil 2001 Mar 4; 142(9): 435–41. Hungarian. PMID: 11301902.
27. Bibok A, Deák PÁ, Doros A. Az intervenciós radiológia szerepe a hasi szervek átültetésében (Role of interventional radiology in the transplantation of abdominal solid organs). Orv Hetil 2018 Nov; 159(46): 1940–1947. Hungarian. https://doi.org/10.1556/650.2018.31293 PMID: 30450929.
28. Nemes B, Zádori G, Hartmann E, Németh A, Fehérvári I, Görög D, Máthé Z, Dávid A, Jakab K, Sárváry E, Piros L, Tóth S, Fazakas J, Gerlei Z, Járay J, Doros A. Epeúti szövődmények májtranszplantáció után (Biliary complications following orthotopic liver transplantation. The Hungarian experience). Orv Hetil 2008 May 25; 149(21): 963–73. Hungarian.
https://doi.org/10.1556/OH.2008.28363 PMID: 18487111.
29. Nemes B, Gámán G, Doros A. Biliary complications after liver transplantation. Expert Rev Gastroenterol Hepatol 2015 Apr; 9(4): 447–66.
https://doi.org/10.1586/17474124.2015.967761 Epub 2014 Oct 21.
PMID: 25331256.
30. Gámán G, Gelley F, Doros A, Zádori G, Görög D, Fehérvári I, Kóbori L, Nemes B. Biliary complications after orthotopic liver transplantation: the Hungarian experience. Transplant Proc 2013; 45(10): 3695–7. https://doi.org/10.1016/j.transproceed.2013.10.009 PMID: 24315000.
31. Korda D, Deák PÁ, Kiss G, Gerlei Z, Kóbori L, Görög D, Fehérvári I, Piros L, Máthé Z, Doros A. Management of Portal Hypertension After Liver Transplantation. Transplant Proc 2017 Sep; 49(7): 1530–1534. https://doi.org/10.1016/j.transproceed.2017.06.015 PMID: 28838434.
32. King AB, Kensinger CD, Shi Y, Shotwell MS, Karp SJ, Pandharipande PP, Wright JK, Weavind LM. Intensive Care Unit Enhanced Recovery Pathway for Patients Undergoing Orthotopic Liver Transplants Recipients: A Prospective, Observational Study. Anesth Analg 2018 May; 126(5): 1495–1503. https://doi.org/10.1213/ANE.0000000000002851 PMID: 29438158.
33. Pollok JM, Tinguely P, Berenguer M, Niemann CU, Raptis DA, Spiro M; ERAS4OLT.org collaborative. Enhanced recovery for liver transplantation: recommendations from the 2022 International Liver Transplantation Society consensus conference. Lancet Gastroenterol Hepatol 2023 Jan; 8(1): 81–94. https://doi.org/10.1016/S2468-1253(22)00268-0 Erratum in: Lancet Gastroenterol Hepatol 2023 Feb; 8(2): 117. PMID: 36495912.
34. Görög D, Dabóczi A, Tóth A, Máthé Z, Járay J, Alföldy F, Perner F. Cadaver donorból származó máj elérhetősége Magyarországon (Availability of livers from cadaver donors in Hungary). Orv Hetil 1996 Oct 20; 137(42 Suppl 1): 2371–3. Hungarian. PMID: 9045118.
35. Nemes B, Gelley F, Zádori G, Görög D, Fehérvári I, Jakab K, Fazakas J, Mándli T, Gerlei Z, Sárváry E, Doros A, Kóbori L. Marginális donorok szerepe a magyar májátültetési programban (The role of marginal donors in liver transplantation. The Hungarian experience). Orv Hetil 2009 Dec 6; 150(49): 2228–36. Hungarian. https://doi.org/10.1556/OH.2009.28743 PMID: 19939784.
36. Statistics Report Library. Eurotransplant, Leiden. Available from: statistics.eurotransplant.org (accessed: January 20, 2019).
37. Bihari L, Piros L, Szabó J, Gerlei Zs, Sandil A, Rózsa B, Mándli T, Fazakas J, Doros A, Kóbori L. Májátültetés (Liver transplantation). Central European Journal Of Gastroenterology And Hepatology/Gasztroenterológiai És Hepatológiai Szemle 2021; 7(1): 43–46. Hungarian. doi: 10.33570/CEUJGH.7.1.43
38. Thuong M, Ruiz A, Evrard P, Kuiper M, Boffa C, Akhtar MZ, Neuberger J, Ploeg R. New classification of donation after circulatory death donors definitions and terminology. Transpl Int 2016 Jul; 29(7): 749–59. https://doi.org/10.1111/tri.12776 Epub 2016 May 4. PMID: 26991858.
39. Kalisvaart M, Croome KP, Hernandez-Alejandro R, Pirenne J, Cortés-Cerisuelo M, Miñambres E, Abt PL. Donor Warm Ischemia Time in DCD Liver Transplantation-Working Group Report From the ILTS DCD, Liver Preservation, and Machine Perfusion Consensus Conference. Transplantation 2021 Jun 1; 105(6): 1156–1164. https://doi.org/10.1097/TP.0000000000003819 PMID: 34048418.
40. Hessheimer AJ, Polak W, Antoine C, Dondero Pozzo F, Maluf D, Monbaliu D, Oniscu G. Regulations and Procurement Surgery in DCD Liver Transplantation: Expert Consensus Guidance From the International Liver Transplantation Society. Transplantation 2021 May 1; 105(5): 945–951. https://doi.org/10.1097/TP.0000000000003729 PMID: 33675315.
41. Wettstein D, Hamar M, Cseprekál O, et al. Machine perfusion: new opportunities in abdominal organ transplantation. (Szervkonzerválás gépi perfúzióval: új lehetőségek a hasi szervek transzplantációjában.) Orv Hetil 2018; 159: 1882–1890. Hungarian. https://doi.org/10.1556/650.2018.31282
42. Hoyer DP, Mathé Z, Gallinat A, Canbay AC, Treckmann JW, Rauen U, Paul A, Minor T. Controlled Oxygenated Rewarming of Cold Stored Livers Prior to Transplantation: First Clinical Application of a New Concept. Transplantation 2016 Jan; 100(1): 147–52. https://doi.org/10.1097/TP.0000000000000915 PMID: 26479280.
43. Goumard C, Turco C, Sakka M, Aoudjehane L, Lesnik P, Savier E, Conti F, Scatton O. Ex-Vivo Pharmacological Defatting of the Liver: A Review. J Clin Med 2021 Mar 18; 10(6): 1253. https://doi.org/10.3390/jcm10061253 PMID: 33803539; PMCID: PMC8002874.
44. Stephenson BTF, Bonney GK, Laing RW, Bhogal RH, Marcon F, Neil DAH, Perera MTPR, Afford SC, Mergental H, Mirza DF. Proof of concept: liver splitting during normothermic machine perfusion. J Surg Case Rep 2018 Mar 28; 2018(3): rjx218. https://doi.org/10.1093/jscr/rjx218 PMID: 29644030; PMCID: PMC5887957.
45. Sugawara Y, Makuuchi M. Advances in adult living donor liver transplantation: a review based on reports from the 10th anniversary of the adult-to-adult living donor liver transplantation meeting in Tokyo. Liver Transpl 2004 Jun; 10(6): 715–20. https://doi.org/10.1002/lt.20179 PMID: 15162463.
46. Mihály S, Smudla A, Ablonczy L, Kóbori L, Nemes B, Rényi-Vámos F, Szabolcs Z, Szakály P, Kalmár Nagy K, Szederkényi E, Auer B, Deme O, Egyed-Varga A, Holtzinger E, Vida-Mező A, Nacsa J, Szilvási A, Merkely B. The First 5 Years of the Newest Eurotransplant Member State: Hungarian Results of International Organ Exchange From 2014 to 2018. Transplant Proc 2021 Jun; 53(5): 1394–1401. https://doi.org/10.1016/j.transproceed.2021.01.042 Epub 2021 Feb 25. PMID: 33640165.
47. Nemes B, Szederkényi E, Nagy KK, Hartyánszky I, Ablonczy L, Vámos FR, Mihály S, Máthé Z. A Summary of Transplantation Activity in Hungary. Transplant Proc 2019 May; 51(4): 1202–1208. https://doi.org/10.1016/j.transproceed.2019.04.006 PMID: 31101199.
48. Langer R. Az Eurotransplant-csatlakozás első öt éve Magyarországon (The first five years of Hungary’s Eurotransplant membership). Orv Hetil 2018 Oct; 159(42): 1695–1699. Hungarian. https://doi.org/10.1556/650.2018.31230 PMID: 30334486.
49. Mihály S, Egyed-Varga A, Trnka-Szántay K, Deme O, Holtzinger E, Nacsa J, Piros L. A COVID-19-járvány hatása a szervadományozásra és -átültetésre Magyarországon 2020-ban (The impact of the COVID-19 pandemic on organ donation and transplantation in Hungary in 2020). Orv Hetil 2021 Jun 6; 162(23): 890–896. Hungarian. https://doi.org/10.1556/650.2021.32268 PMID: 34091437.
50. A Belügyminisztérium egészségügyi szakmai irányelve a májátültetés indikációs köréről, a várólistára kerüléshez szükséges kivizsgálásról, a májátültetés műtéti, és gyógyszeres kezelési gyakorlatáról, valamint a májtranszplantált betegek gondozásáról, és rehabilitációjáról. Egészségügyi Közlöny 2022; július 19.; 72(11): 1781–1870.
51. Wiesner R, Edwards E, Freeman R, Harper A. Kim R, Kamath P, et al. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology 2003; 124: 91–96. https://doi.org/10.1053/gast.2003.50016
52. Freeman jr. RB, Gish RG, Harper A. Davis GL, Vierling J, Lieblein L, et al. Model for end-stage liver disease (MELD) exception guidelines: results and recommendations from the MELD Exception Study Group and Conference (MESSAGE) for the approval of patients who need liver transplantation with diseases not considered by the standard MELD formula. Liver Transpl 2006; 12(12 Suppl 3):S128-36. https://doi.org/10.1002/lt.20979
53. Eurotransplant Manual, Chapter 5, ET Liver Allocation System (ELAS), https: //www.eurotransplant.org/wp-content/uploads/2024/01/H5-ELAS-MELD-January-2024.pdf
54. Nemes B. A magyar májátültetési program eredményeit befolyásoló egyes tényezők, különös tekintettel a hepatitis C-vírusra (Some factors, with an impact on the outcome of the Hungarian Liver Transplant Program, with special consideration of the hepatitis C virus). Magy Seb 2008 Feb; 61(1): 42–7. Hungarian. https://doi.org/10.1556/MaSeb.61.2008.1.9 PMID: 18296285.
55. Nemes B, Sárváry E, Gerlei Z, Fazakas J, Doros A, Németh A, Görög D, Fehérvári I, Máthé Z, Gálffy Z, Pár A, Schuller J, Telegdy L, Fehér J, Lotz G, Schaff Z, Nagy P, Járay J, Lengyel G. Hepatitis C-vírus kiújulása májátültetés után (The recurrence of hepatitis C virus after liver transplantation). Orv Hetil 2007 Oct 21; 148(42): 1971–9. Hungarian. https://doi.org/10.1556/OH.2007.28176 PMID: 17932003.
56. Nemes B, Gelley F, Zádori G, Kiss A, Nagy P, Gerlei Z, Lengyel G, Sárváry E. Predictive factors of sustained virological response for recurrent hepatitis C virus after liver transplantation: the Hungarian experience. Transplant Proc 2012 Sep; 44(7): 2162–3. https://doi.org/10.1016/j.transproceed.2012.07.099 PMID: 22974942.
57. Hunyady B, Gerlei Z, Gervain J, Horváth G, Kiss A, Lengyel G, et al. A hepatitis C-vírus-fertőzés szűrése, diagnosztikája, antivirális terápiája, kezelés utáni gondozása. Magyar konszenzusajánlás. Érvényes: 2020. szeptember 23-ától. Central European Journal of Gastroenterology and Hepatology. Hungarian. 2021; 7(1): 7–21. ISSN 2415-9107. https://doi.org/10.33570/CEUJGH.7.1.7
58. Ferrarese A, Germani G, Gambato M, Russo FP, Senzolo M, Zanetto A, Shalaby S, Cillo U, Zanus G, Angeli P, Burra P. Hepatitis C virus related cirrhosis decreased as indication to liver transplantation since the introduction of direct-acting antivirals: A single-center study. World J Gastroenterol 2018 Oct 14; 24(38): 4403–4411. https://doi.org/10.3748/wjg.v24.i38.4403 PMID: 30344424; PMCID: PMC6189844.
59. Görög D, Gerlei Z, Schuller J, Dezsőfi A, Hartmann E, Piros L, Sandil A, Szabó J, Fehérvári I, Fazakas J, Doros A, Kóbori L. Májvárólista 1995–2019: a hazai adatok nemzetközi összehasonlítása (Evolution of liver transplant waiting list in Hungary between 1995 and 2019). Orv Hetil 2022 Feb 20; 163(8): 301–311. Hungarian. https://doi.org/10.1556/650.2022.32356 PMID: 35184050.
60. Boberg KM, Lind GE. Primary sclerosing cholangitis and malignancy. Best Pract Res Clin Gastroenterol 2011; 25: 753–764. https://doi.org/10.1016/j.bpg.2011.10.002
61. Ringe B, Weimann A, Lamesch P, Nashan B, Pichlmayr R. Liver transplantation as an option in patients with cholangiocellular and bile duct carcinoma. Cancer Treat Res 1994; 69: 259–275. https://doi.org/10.1007/978-1-4615-2604-9_21
62. Singh S, Loftus jr. EV, Talwalkar JA. InfIammatory bowel disease after liver transplantation for primary sclerosing cholangitis. Am J Gastroenterol 2013; 108: 1417–1425. https://doi.org/10.1038/ajg.2013.163
63. Mathurin P, Lucey MR. Alcohol, liver disease and transplantation: Shifting attitudes and new understanding leads to changes in practice. Curr Opin Organ Transplant 2018; 23: 175–179. https://doi.org/10.1097/MOT.0000000000000517
64. Mazzaferro V, Regalia E, Doci R, Andreola S, Pulvirenti A, Bozzetti F, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334: 693–699. https://doi.org/10.1056/NEJM199603143341104
65. Yao FY, Ferrell L, Bass NM, Watson JJ, Bacchetti P, Venook A, et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology 2001; 33: 1394–1403. https://doi.org/10.1053/jhep.2001.24563
66. Clavien PA, Lesurtel M, Bossuyt PM, Gores GJ, Langer B, Perrier A. Recommendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report. Lancet Oncol 2012; 13: ell–e22. https://doi.org/10.1016/S1470-2045(11)70175-9
67. Nemes B, Gelley F, Piros L, Zádori G, Görög D, Fehérvári I, Kóbori L, Sárváry E, Nagy P, Kiss A, Doros A. The impact of Milan criteria on liver transplantation for hepatocellular carcinoma: first 15 years’ experience of the Hungarian Liver Transplant Program. Transplant Proc 2011 May; 43(4): 1272–4. https://doi.org/10.1016/j.transproceed.2011.03.077 PMID: 21620108.
68. Piros L, Fehérvári I, Görög D, Nemes B, Szabó J, Gerlei Z, Végső G, Kóbori L, Máthé Z. Examinations of Factors Influencing Survival of Liver Transplantation for Hepatocellular Carcinoma: A Single-Center Experience From Budapest. Transplant Proc 2015 Sep; 47(7): 2201–6. https://doi.org/10.1016/j.transproceed.2015.07.026 PMID: 26361680.
69. Nagy G, Gerlei Z, Haboub-Sandil A, Görög D, Szabó J, Kóbori L, Huszty G, Bihari L, Rózsa B, Pőcze B, Máthé Z, Piros L. Optimizing Survival for Hepatocellular Carcinoma After Liver Transplantation: A Single-Center Report and Current Perspectives. Transplant Proc 2022 Nov; 54(9): 2593–2597. https://doi.org/10.1016/j.transproceed.2022.10.048 Epub 2022 Nov 19. PMID: 36414513.
70. Lerut JP, Orlando G, Adam R, Schiavo M, Klempnauer J, Mirza D, et al. The place of liver transplantation in the treatment of hepatic epitheloid hemangioendothelioma: report of the European liver transplant registry. Ann Surg 2007; 246: 949–957. Discussion 57. https://doi.org/10.1097/SLA.0b013e31815c2a70
71. Bridgewater J, Galle PR, Khan SA, Llovet JM, Park JW, Patel T, et al. Guidelines for the diagnosis and management of intrahepatic cholangiocarcinoma. J Hepatol 2014; 60: 1268–1289.
72. Rosen CB, Heimbach JK, Gores GJ. Liver transplantation for cholangiocarcinoma. Transpl Int 2010; 23: 692–697. https://doi.org/10.1016/j.jhep.2014.01.021
73. Rana A, Hong JC. Orthotopic liver transplantation in combination with neoadjuvant therapy: a new paradigm in the treatment of unresectable intrahepatic cholangiocarcinoma. Curr Opin Gastroenterol 2012; 28: 258–265. https://doi.org/10.1097/MOG.0b013e32835168db
74. Darwish Murad S, Kim WR, Harnois DM, Douglas DD, Burton J, Kulik LM, et al. Efficacy of neoadjuvant chemoradiation, followed by liver transplantation, for perihilar cholangiocarcinoma at 12 US centers. Gastroenterology 2012; 143: 88–98., e3; quiz e14. https://doi.org/10.1053/j.gastro.2012.04.008
75. Hoti E, Adam R. Liver transplantation for primary and metastatic liver cancers. Transpl Int 2008; 21: 1107–1117. https://doi.org/10.1111/j.1432-2277.2008.00735.x
76. Hagness M, Foss A, Line PD, Scholz T, Jorgensen PF, Fosby B, et al. Liver transplantation for nonresectable liver metastases from colorectal cancer. Ann Surg 2013; 257: 800–806. https://doi.org/10.1097/SLA.0b013e3182823957
77. Dueland S, Syversveen T, Solheim JM, Solberg S, Grut H, Bjørnbeth BA, Hagness M, Line PD. Survival Following Liver Transplantation for Patients with Nonresectable Liver-only Colorectal Metastases. Ann Surg 2020; 271: 212–218. https://doi.org/10.1097/SLA.0000000000003404
78. Dueland S, Smedman TM, Røsok B, Grut H, Syversveen T, Jørgensen LH, Line P-D. Treatment of relapse and survival outcomes after liver transplantation in patients with colorectal liver metastases. Transpl Int 2021 Nov; 34(11): 2205–2213. https://doi.org/10.1111/tri.13995
79. Line PD, Hagness M, Berstad AE, Foss A, Dueland S. A Novel Concept for Partial Liver Transplantation in Nonresectable Colorectal Liver Metastases: The RAPID Concept. Ann Surg 2015; 262: e5–e9. https://doi.org/10.1097/SLA.0000000000001165
80. Rauchfuß F, Nadalin S, Königsrainer A, Settmacher U. Living donor liver transplantation with two-stage hepatectomy for patients with isolated, irresectable colorectal liver-the LIVER-T(W)O-HEAL study. World J Surg Oncol 2019 Jan 8; 17(1): 11. https://doi.org/10.1186/s12957-018-1549-5 PMID: 30621712; PMCID: PMC6325801.
81. Máthé Z, Kóbori L, Görög D, Fehérvári I, Nemes B, Gerlei Z, Doros A, Németh A, Mándli T, Fazakas J, Járay J. Az első sikeres élő donoros felnőttkori jobb lebenyes májtranszplantáció Magyarországon (The first successful adult right-lobe living donor liver transplantation in Hungary). Orv Hetil 2010 Jan 3; 151(1): 3–7. Hungarian. https://doi.org/10.1556/OH.2010.28782 PMID: 20031520.
