Reviews
The role of percutaneous transhepatic gallbladder drainage in the management of acute cholecystitis
Summary
Acute cholecystitis is the most common complication of cholecystolithiasis. Laparoscopic cholecystectomy in the acute phase is an accepted option of the modern therapeutic algorythm. However, severity of inflammation, onset of symptoms and general condition of the patient must be considered before surgical treatment. For high-risk patients with significant comorbidities, percutaneous gallbladder drainage is a safe and effective way to achieve rapid improvement in the patient’s condition. Although indications of the intervention have been declared in the Tokyo Guideline (2018 Edition), several aspects of the protocol still remain controversial. For example, the optimal timing of insertion and removal of the drain, considerations of subsequent cholecystecomy as well as the follow-up of patients are not well-established. Nowadays we are still lack of strong evidence and guideline regarding these aspects of gallbladder drainage. This review summarizes the available literature and provides the protocol of treatment utilized in our institution.
Összefoglalás
Az epehólyag-kövesség leggyakoribb szövődménye az akut calculosus cholecystitis. Korszerű ellátási algoritmusában az akut szakban elvégzett cholecystectomia térnyerése figyelhető meg. A műtéti indikáció felállításában azonban a gyulladás súlyosságán, illetve fennállásának idején túl a beteg általános állapota, műtéti teherbírása is kulcsfontosságú szempont. Azon betegek körében, akiknél az akut műtét túl magas rizikót jelent, széles körben elfogadott és alkalmazott alternatív eljárás az epehólyag perkután drenázsa, amely salvage-beavatkozásként a szeptikus állapot rapid javulásához vezethet. Indikációja a cholecystitis ellátásának hazánkban is alapját képező Tokyo Guideline legfrissebb, 2018-as kiadásában is rögzített. Azonban a drenált betegek további gondozása, a drén behelyezésének optimális időzítése, a dréneltávolítás, illetve a későbbi cholecystectomia feltételei nem kellően tisztázottak, egyértelmű ajánlás jelenleg még nem áll rendelkezésünkre. Jelen közleményünk célja az elérhető irodalmi adatok áttekintése mellett a klinikánkon is alkalmazott gyakorlat bemutatása, összefoglalása.
Az akut cholecystitis kezelésében a konzervatív (gyógyszeres), valamint a heveny (korai) szakban elvégzett laparoszkópos cholecystectomia mellett elfogadott, széles körben alkalmazott terápiás módozat az epehólyag ultrahang- vagy CT-vezérelt perkután drenázsa. Annak ellenére, hogy az első közlemény az eljárásról több, mint 40 évvel ezelőtt (1980) született (1), számos, azóta sem teljesen tisztázott kérdéssel állunk szemben a témával kapcsolatban. Jóllehet az indikációs kör ajánlásszinten rögzített a hazai ajánlás (Epeút- és epehólyag-gyulladás: diagnosztikus kritériumok és terápia. Egészségügyi Közlöny, 2023;73(8):898-936) alapját is képező Tokyo Guideline-ban, a beteg további kezelését illetően konkrét ajánlás – magas szintű evidenciák hiányában – még várat magára. Így a gyakorlatban számos kérdéssel találkozhat a klinikus ezen betegcsoport ellátásakor, gondozásakor, amelyekre a szakirodalomban rendkívül megosztó válaszokat találhat.
A korai szakban elvégzett cholecystectomia és perkután cholecystadrenázs
Az epehólyag-kövesség a teljes népesség mintegy 10-15%-ánál fordul elő, jóllehet az esetek nagy részében „néma” marad, szövődményt csak nagyjából 20%-ban okoz (2). Ennek egyik megjelenési formája a heveny epehólyag-gyulladás. A gyulladás súlyossági klasszifikációját illetően hazai ajánlásunkban is a Tokyo-irányelvek a mérvadóak. A diagnózis felállítása és a súlyosság osztályozása összetett szempontrendszer szerint történik (szisztémás jelek, lokális tünetek, valamint a radiológiai jelek figyelembevételével), amelyek alapján grade I (enyhe), grade II (középsúlyos), valamint grade III (súlyos) cholecystitist különböztetünk meg (3).
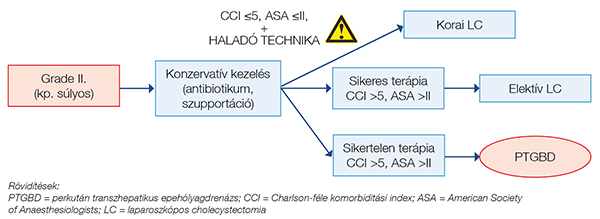
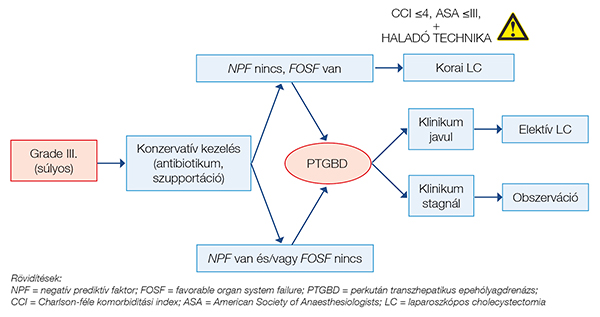
Grade III-as gyulladás esetén cholecystitis klinikoradiológiai jelei mellett a szisztémás gyulladás részjelenségeként szervi diszfunkció is fennáll, ennek megfelelően ezek a betegek gyakran intenzív osztályos kezelést igényelnek (4). Grade II-es cholecystitisről beszélünk abban az esetben, ha az epehólyag-gyulladás diagnózisa felállítható, nem áll fenn szervi diszfunkció, azonban a tünetek több mint 72 órája fennállnak, a képalkotókon kifejezett gyulladásos jelek vagy szövődményes cholecystitis képe (pl. gangrenosus cholecystitis, epehólyag körüli abscessus, májtályog, emphysematosus cholecystitis) ábrázolódik, a laborleletben leukocytosis (>18 000/mm3) vagy fizikálisan tapintható, megnagyobbodott, fájdalmas epehólyag észlelhető. Grade I-es, enyhe gyulladásról beszélünk igazolt cholecystitis mellett II-es és III-as kritériumok hiányában (4) (1. ábra).

Az akut cholecystitis korszerű kezelési protokolljában az akut szakban végzett epehólyag-eltávolítás – természetesen számos szempont mérlegelése után – prioritást élvez (5). A Tokyo Guideline legfrissebb, 2018-as ajánlása mellett a World Society of Emergency Surgery (WSES) 2020-as kiadása is határozottan amellett foglal állást, hogy az akut cholecystitis valamennyi stádiumában (grade I–III) kellő tapasztalattal és műtői infrastruktúrával a birtokunkban, a rizikó tényezők gondos mérlegelése után a laparoszkópos cholecystectomia elvégezhető (6). Egy 337 500 beteget magában foglaló metaanalízis a cholecystadrenázs kimenetelét vizsgálta az akutan elvégzett cholecystectomiával szemben. Azt kapták eredményül, hogy a perkután intervenció magasabb mortalitási rizikóval bír, hosszabb kórházi tartózkodással jár, és az epeúti szövődmények miatti ismételt kórházi felvétel is nagyobb arányban fordult elő a drenált betegek körében. Ugyanakkor a beavatkozás közbeni komplikációk, valamint a reintervenciók arányában a különbség nem bizonyult szignifikánsnak. Összességében tehát nem tűnt előnyösebbnek az epehólyag-gyulladás intervenciós kezelése a primer műtétnél, ezzel is alátámasztva az akut cholecystectomia létjogosultságát (7).
Egy holland munkacsoport által koordinált multicentrikus, randomizált (CHOCOLATE) tanulmány szintén a két terápiás modalitást hasonlította össze magas rizikójú, az Acute Physiology and Chronic Health Evaluation szerint 7 pontnál magasabbat elért (APACHE II >7) betegek esetében. A korábbi közleményeknek megfelelően magas sikerráta (>96%) és rapid klinikai javulás jellemezte az intervención átesett betegcsoportot, azonban a kórházban töltött napok száma, a súlyos szövődmények aránya (miokardiális infarktus, pulmonalis embólia, pneumónia, hasűri tályog), a kórházi visszavételt igénylő epével összefüggő panaszok gyakorisága szignifikánsan magasabbnak bizonyult, mint a cholecystectomián átesettek esetében. Érdemes megfigyelni, hogy mely betegek zárták ki a vizsgálatból: többek közt a 14-nél magasabb APACHE II pontszámú betegeket (25 pontnál 50%-os, 35 pontnál 80%-os mortalitással számolhatunk, a legmagasabb szerezhető pontszám 71), az egy hétnél hosszabb ideje panaszos, valamint intenzív osztályos felvételt igénylő pácienseket. Ezen betegcsoport tagjait magas műtéti rizikó miatt a randomizációba nem vonták be, ugyanakkor pont ezen betegek esetén merül fel leginkább a cholecystadrenázs indikációja és elsőbbsége (8).
Számos közlemény világít rá arra, hogy a korai cholecystectomia megkerülhetetlen feltétele a kellő sebészi tapasztalat mellett a beteg megfelelő műtéti teherbírása, általános állapota, amelyek eldöntésére, felmérésére különböző pontrendszerek állnak rendelkezésünkre, úgymint a Charlson-féle komorbiditási index (CCI), vagy az American Society Of Anesthesiologists Physical Score (ASA-score) (5).
Korai cholecystectomia javasolható tehát grade I-es (enyhe) és grade II-es (középsúlyos) cholecystitis esetén CCI ≤5, és ASA ≤II értékek mellett, míg grade III-as (súlyos) cholecystitis esetén CCI ≤3, valamint ASA ≤II pontszámokat elért betegek esetén megfelelő infrastruktúrával és gyakorlattal rendelkező centrumban (5).
A Tokyo Guideline kategóriáit követve az egyes súlyossági fokozatok ellátása a következők szerint tervezhető. Grade I-es, enyhe cholecystitis esetén ha a beteg a fent részletezett kritériumoknak megfelel, elsőként választható a műtéti megoldás. Ha a betegnél műtét nem végezhető el, a kisebb kockázatot jelentő konzervatív kezelés választandó (ennek részeként antibiotikum terápia, karentia, fájdalomcsillapítók, görcsoldók alkalmazása). Enyhe lefolyású cholecystitis során a konzervatív kezelés legtöbbször sikerre vezet, perkután drenázs indikációja nem áll fenn (5) (2. ábra).

Grade II-es (középsúlyos) gyulladás esetén a beteg kellő teherbírása mellett az akut műtét feltételeként a kellő sebészi gyakorlatot is kiemeli az ajánlás, ennek hiányában, valamint a konzervatív kezelés sikertelensége, progrediáló klinikum esetén javasolja a perkután intervenció elvégzését (5) (3. ábra).
Grade III-as (súlyos) cholecystitis mellett tapasztalható szervi diszfunkció (1. ábra) leggyakrabban a beteg intenzív osztályos kezelését indokolja, itt a gondos állapot- és teherbírás felmérése kritikus pont, ha negatív prediktív faktorok nem állnak fenn (icterus, légzési elégtelenség, neurológiai diszfunkció), akutan elvégzett cholecystectomia javasolható, azonban a Tokyo-Guideline hangsúlyozza, hogy ez haladó sebészeti centrumban történjék (5). Ha az ellátó ezzel nem rendelkezik, sürgős epehólyagdrenázs, ha ez sem elérhető, a beteg mielőbbi megfelelő centrumba szállítása javasolt (4. ábra).
Magas rizikójú betegek esetén az epehólyag perkután intervenciója mellett az endoszkópos beavatkozási lehetőségek is megemlítendők: az endoszkópos ultrahangvezérelt epehólyagdrenázs (EUS-GBD), valamint az ERCP során transzpapillárisan elvégzett epehólyagdrenázs (nasobiliaris, illetve endoszkópos epehólyagsztentelés) (5. ábra).
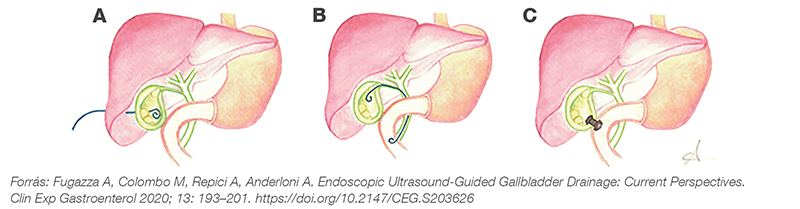
A: perkután transzhepatikus drenázs, B: endoszkópos transzpapilláris drenázs, C: EUS-vezérelt drenázs (LAMS)
A hazai ajánlás a legalább hasonló klinikai és technikai sikerrátára, valamint alacsonyabb szövődményszámra és reintervenciós arányra tekintettel több lehetőség rendelkezésre állásakor az EUS-vezérelt megoldást javasolja a perkután drenázzsal szemben, bár Magyarországon ez az eljárás egyelőre nem terjedt el (3). Ennek legfőbb magyarázata az, hogy a perkután behelyezett pigtail drén és az EUS során felhasznált lument összetartó fémsztent, vagy Lumen-Apposing Metal Stent (LAMS) ára közötti különbség több nagyságrendben mérhető. Másfelől számos közlemény az eljárást azon betegek esetén javasolja leginkább, akiknél társbetegségek, általános állapot, életkor miatt ez végleges megoldást jelent. Jóllehet sikeres laparoszkópos cholecystectomiáról számolnak be EUS-GBD-n átesett betegek kapcsán, mint áthidaló (bridge-to-surgery) technika létjogosultsága egyelőre nem nyilvánvaló. Tyberg és munkatársai perkután és EUS-vezérelt epehólyagdrenázson átesett betegeket vizsgáltak, a gyulladás lezajlása után mindkét csoport műtéten esett át. A műtéti időt és a kórházi tartózkodást is rövidebbnek találták az EUS-on átesett betegek körében, a konverziós arányt tekintve pedig a különbség nem volt szignifikáns. Az eredmények annak ismeretében értékelendők, hogy a műtét előtt valamennyi LAMS-t eltávolították, a nyílást pedig endoszkópos úton klippel (over-the-scope) zárták (9).
A transzpapilláris úton elvégzett epehólyagdrenázs technikai sikeressége a három beavatkozási módozat közül a legalacsonyabb (83%), ezt a ductus cysticus kanülálási nehézségével magyarázzák, ugyanakkor előnye, hogy antikoagulált beteg esetén is járható út, mivel sphincterotomia nélkül is kivitelezhető, de előnyös ascites, kövekkel teli vagy kontrahált epehólyag esetén is (3). Megjegyzendő, hogy irodalmi adatok alapján a transzpapilláris drenázs esetén kell a legkevesebb arányban számolni reintervencióval, ismételt kórházi felvétellel, illetve mortalitással (10).
A drenázs időzítése
A megfelelő indikációval elvégzett epehólyagdrenázs a szeptikus góc, gyulladásos tartalom lebocsátásával rapid állapotjavuláshoz vezethet. Egy, a 2000-es évek elején megjelent tanulmányban 145 részben calculosus, részben acalculosus emphysemás cholecystitis miatt hospitalizált beteget vizsgáltak. Valamennyiüknél sikeresen elvégezték az ultrahang- (UH-) vezérelt drenázst, amely a vizsgált betegek 93%-ánál 48 órán belül a szepszis javulásához vezetett (11).
A drenázs időzítése ugyanakkor még nem pontosan meghatározott az irodalomban, bár számos szerző szorgalmazza a beavatkozás mielőbbi elvégzését. Chou és munkacsoportja 209, epehólyagdrenázson átesett beteget vizsgált retrospektíven két kategóriában: egy korai (a tünetek megjelenése után 24 órán belül drenált), és egy késői (a tünetek megjelenésétől számított 24 órán túl interveniált) csoportban. Eredményeik szerint a korai csoportba kerülő betegek szignifikánsan rövidebb időt töltöttek kórházban, és a beavatkozás közben észlelt vérzéses szövődmény előfordulása is ritkább volt (12). Bickel és munkatársai 59 beteget két csoportban vizsgálva (I. csoport: panaszok kezdete után 2 napon belül, II. csoport: tünetek kezdetétől 3-6 nap között elvégzett drenázs) arra az eredményre jutottak, hogy a később elektíven elvégzett cholecystectomia során a konverziós arány szignifikánsan alacsonyabb volt az I. csoport betegei között (8,3% vs. 33%). Ezen eredmények alapján tehát feltételezhetjük, hogy a felvételkor műtétre alkalmatlan beteg és súlyos gyulladás jeleit mutató, megnagyobbodott, hydropsos epehólyagok esetén adekvát gyógyszeres kezelés beállítása mellett a beteg számára kedvezőbb a mihamarabbi intervenció (13).
A drenázst követő műtét időzítése
A műtét optimális idejét tekintve nem létezik széles körben elfogadott, erős evidencián alapuló ajánlás. A témával foglalkozó közlemények a korai műtét, valamint a későn elvégzett („delayed”) cholecystectomia között oszlanak meg. Egy munkacsoport (Lyu és munkatársai) 100 olyan beteget, akiknek kiindulási paraméterei között nem volt szignifikáns eltérés (nem, kor, gyulladásos markerek, társbetegségek, ASA, CCI), 3 csoportba osztott aszerint, hogy az epehólyagdrenázs után mikor távolították el a cholecystát. Az első csoport egy héten belül, a második csoport egy hét és egy hónap között, a harmadik csoport egy hónapon túl esett át laparoszkópos cholecystectomián. Közleményükben az első csoport betegei szignifikánsabban kevesebb időt töltöttek kórházban, és kisebb egészségügyi kiadást jelentettek anélkül, hogy ez jelentősen befolyásolta volna a perioperatív szövődmények számát (akár a műtéti időt, akár a konverziós rátát, akár a műtét alatti vérveszteséget vizsgálva). Megjegyezték ugyanakkor, hogy tovább bent hagyva a drént növekedett a drénnel összefüggő nemkívánatos események száma, úgymint a drén kicsúszása, eltömődése, illetve a bőr dréncső körüli irritációja (14). Woodward és munkacsoportja szintén a drenázst követő cholecystectomia időzítését vizsgálta, az előbbiektől eltérő eredménnyel. Azt találták, hogy a beavatkozás utáni első hónap fokozott rizikót jelent a perioperatív szövődmények tekintetében, ezt az időt tehát érdemes megvárni a műtéttel, ugyanakkor 8 héten túli drénviselet esetén szignifikánsan több gond volt a behelyezett csövekkel (26,9 vs. 69%). Ezen adatok alapján tehát egy és két hónap közötti műtéti időpont lehet az optimális, valamint felmerül a drenázs szükséges időtartamának kérdésköre is (15).
A drenázs mint definitív kezelés
Ha a betegnél a gyulladás lezajlása után sem reális műtétet tervezni (komorbiditásai, életkora okán), úgy az epehólyag drenázsát definitív megoldásnak is tarthatjuk. Hátránya természetesen, hogy a góc bent hagyásával számolnunk kell a kiújulás lehetőségével, ennek aránya igen széles skálán mozog a közleményekben (átlagosan 4 és 40% között), illetve a beteg életminősége szempontjából is kedvezőtlen.
Tuncer 102 olyan beteget vizsgált, akiknél az epehólyag-katéter végleges megoldást jelentett. A kiújulási arányt 36,3%-nak találta, érdekes emellett, hogy a legtöbb relapszus a drén eltávolítását követő első 3 hónapban jelentkezett (az összes rekurrencia 59,5%-a). A tanulmányok számos faktor jelenlétét hozták összefüggésbe a kiújulással, úgymint: a kövek mérete, száma, a beteg lázas állapota, a procalcitonin szintje, előző cholecystitisek az anamnézisben stb. (16).
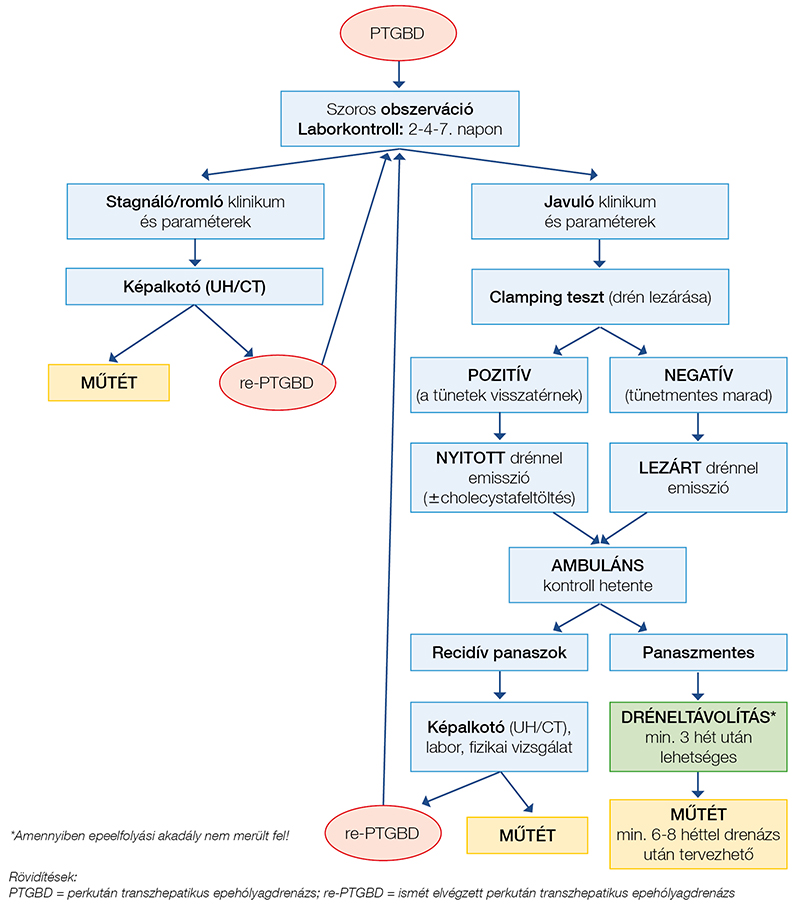
A dréneltávolítás
A dréneltávolítás és annak körülményei egyelőre nem kellően szabályozott folyamat, időzítését leginkább a kezelőorvos belátása és a helyi rutin alakítják. Beláthatjuk azonban, hogy a biztonságos drénhúzás feltétele az érett fistulajárat megléte, ez biztosítja, hogy a cső eltávolítása után a szabad hasüreg felé epecsorgás ne jöhessen létre. Ezen járat kialakulásához szükséges átlagos időt Wise és munkatársai 21 napban határozták meg, magyarázva ezt a sebgyógyulás fiziológiájával. Ismeretes, hogy a hegesedés folyamán 3 héttel a beavatkozást követően, a véralvadás és a gyulladásos szakaszok után (0-3 nap) lezárul a proliferáció stádiuma, amely során a gyulladásos sejtek helyét átveszik a fibroblastok, amelyek a fistulajárat képzéséhez szükséges granulációs szövet létrehozásáért felelősek (17). Kayaoglu eredményei szintén a 21 napos csőmegtartást igazolták, a vizsgált 163, cholecystadrenázson átesett beteg 5,5%-ánál (9/163) észleltek recidív cholecystitist az utánkövetési idő alatt, ennek kétharmad részét (6/9) azon betegeknél, akiknél 3 héten belül történt a drén eltávolítása. Ez a korreláció szignifikánsnak bizonyult (18).
A tervezetten műtétre kerülő betegek drénkihúzásának időzítésére sem ismeretes széles körben elfogadott, egységes ajánlás, több szerző a műtétig javasolja a drén benntartását, ugyanakkor számos publikáció foglal állást amellett, hogy a gyulladás lezajlása és a fistulajárat kialakulása után a drén több szempontból is eltávolítandó. Egyrészről feltételezik, hogy önmagában a hosszan bent hagyott drén az epehólyag-mucosa irritációja, illetve a cső bakteriális kolonizációja által provokáló tényezője lehet ismétlődő cholecystitises epizódoknak (19). Hsieh eredményei szerint a két hétnél hosszabb drénviselet a két hónapon belüli cholecystitis rekurrenciájának független rizikófaktora lehet (20). Másfelől a fent már említett Woodward-féle vizsgálat szerint is hosszas drenázs esetén növekszik a drénnel összefüggő szövődmények száma, mint például a drén kimozdulása, amely amellett, hogy szintén recidív epehólyag-gyulladás rizikófaktora lehet, akár hasfali vagy hasűri gócok, tályogok létrejöttét is okozhatja (21) (6. ábra).
Saját tapasztalatok
Klinikánkon az UH-vezérelt epehólyagdrenázs kivitelezését és a drén kezelését belső protokollunk szabályozza (7. ábra). A beavatkozás indikációját a Tokyo-elveknek megfelelően állítjuk fel, aneszteziológus kollégákkal konzultálva, magas műtéti rizikóval bíró betegek esetén. Ennek mérlegelése a beteg felvételekor történik, célunk a beavatkozás mielőbbi elvégzése, gyakran az osztályos felvétel előtt, a sürgősségi betegellátás keretében megtörténik a drén behelyezése, így a beteg már a beavatkozás után kerül a sebészeti osztályra. A drenázs történhet transzhepatikusan, illetve transzperitoneálisan is.
Gyakorlatunkban mi az előbbit alkalmazzuk, amelynek előnye, hogy a szabad hasüreget megkerülve a májparenchymán vezet át, ezáltal segítve a preformált fistulajárat gyorsabb kialakulását, csökkentve a szabad hasűri epéscsorgás és a drén kimozdulásának rizikóját. Helyi érzéstelenítésben
a 18 G méretű vezető trokár UH-vezérelt pozicionálása után Seldinger szerint 8 F-es pigtail pigtail draint vezetünk az epehólyag lumenébe, majd a szárát a hasfal bőréhez rögzítjük. A drenázs során nyert epeminta bakteriológiai vizsgálatát rutinszerűen elvégezzük, hogy később a beteg már célzott antimikrobiális kezelésben részesüljön.
A drén behelyezése után ha a klinikai kép javul, és a gyulladásos markerek is csökkenő tendenciát mutatnak, a beteg hazabocsátása tervezhető. A cső eltömődésének megelőzésére napi kétszer 5 ml fiziológiás sóval öblítjük a drént. Ha a betegnek záróköve nincs, kivizsgálása alapján epeúti obstrukció gyanúja nem merül fel, emisszió előtt 2 nappal ún. clamping tesztet végzünk, amelynek lényege, hogy lezárt drén mellett figyeljük a beteg panaszait. Ha panaszmentes marad, a lezárást jól tolerálja, otthonába bocsátható. Ha panaszai súlyosbodnak, belázasodik, felmerül az epehólyagból elfolyási akadály fennállása, egyéni mérlegelés alapján drénen keresztüli cholecystafeltöltéssel (kolecisztogrammal) ezt igazolhatjuk, illetve kizárhatjuk (8. ábra).
Igazolt ductus cysticus zárókő vagy egyéb epeelfolyási akadály esetén a drain lezárását nem javasoljuk, ha a későbbiekben cholecystectomiát tervezünk, a drént a műtétig benttartjuk (7. ábra). Park és munkacsoportja azt találta, hogy a rutinszerűen végzett cholecystogram nem, az előbbiekben említett clamping teszt azonban szignifikánsan csökkentette a rekurrenciák számát a drén eltávolítása után (22). Gyakorlatunkban – az érett fistulajárat kialakulására alapozva – a legalább 3 hetes drénviseletet követjük. Ha a beteg a drén lezárását jól tolerálta, panaszai ezalatt nem ismétlődtek, gyulladásos markerei normalizálódtak, akkor a drén eltávolítását javasoljuk. Természetesen a drénkihúzást betegre szabottan, körültekintően időzítjük, ha szükséges, a drént tovább benntartva (pl. elesett állapotú, alultáplált, hypoproteinaemiás, jelentősen komorbid betegek, lezárt cholecysta esetén). Ha a későbbiekben cholecystectomiát tervezünk (amelyre optimális esetben a drenázs után legalább 6-8 héttel kerítünk sort), az emissziót követően a műtéti előkészítést ambuláns keretek között végezzük, a műtétig a beteget rendszeresen kontrolláljuk. Ha a kontroll során a beteg panaszai ismétlődnek, labor- és képalkotó vizsgálatok után születik döntés a további terápiás lépésről (redrenázs, obszerváció vagy akut műtét).
Összefoglalás
Az epehólyag UH-vezérelt drenázsa több évtizedes múltja ellenére számos kérdésben bizonytalanságot hagy maga után, nagy esetszámú, randomizált kontrollált tanulmányok híján gyakran a helyi szokások és a kezelőorvos tapasztalata vezetik a döntéshozatalt mind a beavatkozás indikációját, mind a drenált betegek menedzsmentjét illetően. Klinikánkon az akut cholecystitis kezelése során a Tokyo Guideline-on alapuló hazai irányelvek az irányadóak, ennek megfelelően állítjuk fel a perkután cholecystadrenázs indikációját is. A drén bent hagyását és a cholecystectomia időzítését illetően célunk a megfelelő fistula kialakítása (a legalább 3 hétig bent hagyott drén által), és a gyulladásmentes környezetben történő műtét (drenázs után legalább 6-8 héttel). Ugyanakkor intézményünk progresszivitási szintjének megfelelően a haladó laparoszkópia kibontakozásával párhuzamosan érezhető a laparoszkópos cholecystectomiának mint az akut cholecystitis elsődleges kezelési módjának térnyerése.
Következtetés
A perkután cholecystadrenázs akut cholecystitis esetén megfelelő indikációval alkalmazva életmentő lehet, akár „bridging”-ként, akár definitív kezelésként. Ha a beteget később műteni kell, ennek optimális ideje jelenleg még nem meghatározott, egyértelmű ajánlással nem rendelkezünk. A laparoszkópia térnyerésével, fejlődésével, laparoszkópos centrumok létrejöttével, az endoszkópos lehetőségek bővülésével a beavatkozás indikációja a következő években klinikánkon is várhatóan átalakul. Mindezek fényében a cholecystadrenázs és az azt követő cholecystectomia pontos helyének és idejének, valamint a drenált betegek optimális gondozásának tisztázására a jövőben további vizsgálatok szükségesek.
Irodalom
PubMed PMID: 7215096
2. Ibrahim MM, Sarvepalli S, Morris-Stiff G, Rizk M, Bhatt A, Walsh M, et al. Gallstones: Watch and wait, or intervene? Cleveland Clinic Journal of Medicine 2018; 85(4): 323–331. https://doi.org/10.3949/ccjm.85a.17035
3. Yokoe M, Hata J, Takada T, Strasberg SM, Asbun HJ, Wakabayashi G, et al. Tokyo Guidelines 2018: diagnostic criteria and severity grading of acute cholecystitis (with videos). Journal of Hepato-Biliary-Pancreatic Sciences 2018; 25(1): 41–54. https://doi.org/10.1002/jhbp.515
4. Okamoto K, Suzuki K, Takada T, Strasberg SM, Asbun HJ, Endo I, et al. Tokyo Guidelines 2018: flowchart for the management of acute cholecystitis. J Hepatobiliary Pancreat Sci 2018; 25(1): 55–72. Epub 20171220.
https://doi.org/10.1002/jhbp.516 PubMed PMID: 29045062.
5. Pisano M, Allievi N, Gurusamy K, Borzellino G, Cimbanassi S, Boerna D, et al. 2020 World Society of Emergency Surgery updated guidelines for the diagnosis and treatment of acute calculus cholecystitis. World Journal of Emergency Surgery 2020; 15(1): 61.
https://doi.org/10.1186/s13017-020-00336-x
6. Ambe PC, Kaptanis S, Papadakis M, Weber SA, Jansen S, Zirngibl H. The Treatment of Critically Ill Patients With Acute Cholecystitis. Dtsch Arztebl International 2016; 113(33–34): 545–51.
https://doi.org/10.3238/arztebl.2016.0545
7. Loozen CS, Santvoort HCv, Duijvendijk Pv, Besselink MG, Gouma DJ, Nieuwenhuijzen GA, et al. Laparoscopic cholecystectomy versus percutaneous catheter drainage for acute cholecystitis in high risk patients (CHOCOLATE): multicentre randomised clinical trial. BMJ 2018; 363: k3965.
https://doi.org/10.1136/bmj.k3965
8. Tseng LJ, Tsai CC, Mo LR, Lin RC, Kuo JY, Chang KK, et al. Palliative percutaneous transhepatic gallbladder drainage of gallbladder empyema before laparoscopic cholecystectomy. Hepatogastroenterology 2000; 47(34): 932–6. PubMed PMID: 11020851.
9. Chou CK, Lee KC, Chan CC, Perng CL, Chen CK, Fang WL, et al. Early Percutaneous Cholecystostomy in Severe Acute Cholecystitis Reduces the Complication Rate and Duration of Hospital Stay. Medicine (Baltimore) 2015; 94(27): e1096.
https://doi.org/10.1097/md.0000000000001096
PubMed PMID: 26166097; PubMed Central PMCID: PMC4504525.
10. Bickel A, Hoffman RS, Loberant N, Weiss M, Eitan A. Timing of percutaneous cholecystostomy affects conversion rate of delayed laparoscopic cholecystectomy for severe acute cholecystitis. Surg Endosc 2016; 30(3): 1028–33. Epub 20150703. https://doi.org/10.1007/s00464-015-4290-y
PubMed PMID: 26139479.
11. Lyu Y, Li T, Wang B, Cheng Y. Early laparoscopic cholecystectomy after percutaneous transhepatic gallbladder drainage for acute cholecystitis. Sci Rep 2021; 11(1): 2516. Epub 20210128.
https://doi.org/10.1038/s41598-021-82089-4 PubMed
PMID: 33510242; PubMed Central PMCID: PMC7844221.
12. Woodward SG, Rios-Diaz AJ, Zheng R, McPartland C, Tholey R, Tatarian T, et al. Finding the Most Favorable Timing for Cholecystectomy after Percutaneous Cholecystostomy Tube Placement: An Analysis of Institutional and National Data. J Am Coll Surg 2021; 232(1): 55–64. Epub 20201021. https://doi.org/10.1016/j.jamcollsurg.2020.10.010
PubMed PMID: 33098966.
13. Tuncer K, Kilinc Tuncer G, Çalık B. Factors affecting the recurrence of acute cholecystitis after treatment with percutaneous cholecystostomy. BMC Surgery 2023; 23(1): 143.
https://doi.org/10.1186/s12893-023-02042-2
14. Wise JN, Gervais DA, Akman A, Harisinghani M, Hahn PF, Mueller PR. Percutaneous Cholecystostomy Catheter Removal and Incidence of Clinically Significant Bile Leaks: A Clinical Approach to Catheter Management. American Journal of Roentgenology 2005; 184(5): 1647–51.
https://doi.org/10.2214/ajr.184.5.01841647 PubMed PMID: 15855132.
15. Kayaoglu SA, Tilki M. When to remove the drainage catheter in patients with percutaneous cholecystostomy? Rev Assoc Med Bras (1992). 2022; 68(1): 77–81. https://doi.org/10.1590/1806-9282.20210787
PubMed PMID: 34909967.
16. Czakó L, Gyökeres T, Hritz I, Madácsy L, Illés D, Szepes Z, et al. Epeút- és epehólyag-gyulladás: diagnosztikus kritériumok és terápia. Orvosi Hetilap 2023; 164(20): 770–87.
https://doi.org/10.1556/650.2023.32770
17. Tyberg A, Duarte-Chavez R, Shahid HM, Sarkar A, Simon A, Shah-Khan SM, et al. Endoscopic Ultrasound-Guided Gallbladder Drainage Versus Percutaneous Drainage in Patients With Acute Cholecystitis Undergoing Elective Cholecystectomy. Clin Transl Gastroenterol 2023; 14(6): e00593. Epub 20230601. https://doi.org/10.14309/ctg.0000000000000593
PubMed PMID: 37141073; PubMed Central PMCID: PMC10299765.
18. Podboy A, Yuan J, Stave CD, Chan SM, Hwang JH, Teoh AYB. Comparison of EUS-guided endoscopic transpapillary and percutaneous gallbladder drainage for acute cholecystitis: a systematic review with network meta-analysis. Gastrointest Endosc 2021; 93(4): 797–804.e1.
Epub 20200925. https://doi.org/10.1016/j.gie.2020.09.040
PubMed PMID: 32987004.
19. Park JK, Yang JI, Wi JW, Park JK, Lee KH, Lee KT, et al. Long-term outcome and recurrence factors after percutaneous cholecystostomy as a definitive treatment for acute cholecystitis. J Gastroenterol Hepatol 2019; 34(4): 784–90. Epub 20190211. https://doi.org/10.1111/jgh.14611
PubMed PMID: 30674071.
