Reviews
Surgical treatment of early gastric cancer
Summary
The technological innovations in gastro-enterologic interventions make possible to perform more and more invasive procedures. The invasive gastro-enterology achieves in different stages of early gastric cancer the same long term oncologic results with lower risk and complication rate compared to surgical interventions. It means, that nowadays the treatment of early gastric cancer is on the borderline of invasive gastro-enterology and minimal invasive surgery. In our paper we were trying to find the answer for the question, in which stages of early gastric cancer should be chosen currently invasive gastro-enterological, surgical or hybrid intervention, applying the two methods at the same time.
Összefoglalás
A gasztroenterológiai eljárások technikai fejlődése egyre invazívabb beavatkozások elvégzésére nyújt lehetőséget, amelyek alkalmazásával a korai gyomorrák bizonyos stádiumaiban alacsonyabb szövődményráta és kisebb megterhelés mellett elérhetők a sebészi módszerek után tapasztalt hosszú távú onkológiai eredmények, ezért napjainkban a korai gyomorrák ellátása az invazív gasztroenterológia és minimál invazív sebészet határterületét képezi. Közleményünkben arra a kérdésre keressük a választ, hogy aktuálisan a korai gyomorrák mely eseteiben válasszunk első lépésként gasztroenterológiai, sebészeti vagy a két eljárást együttesen alkalmazó, hibrid megoldást.
Bevezetés
A gyomorrák gyógyítása napjainkban is komoly kihívást jelent, legtöbbször elkerülhetetlen a multidiszciplináris megközelítés, azaz a gasztroenterológia, a sebészet és az onkológia programozott együttműködése. Az egyes társszakmák bevetésének mértékét, az alkalmazott terápiás eljárásokat és ezek sorrendjét az adott betegség stádiuma és a beteg műtéti terhelhetősége határozza meg, természetesen az adott ellátó intézményben aktuálisan rendelkezésre álló lehetőségek mellett.
Az egyes eljárások után bizonyos százalékban szövődmények léphetnek fel, ezek száma természetesen az invazivitás mértékével arányosan növekszik, és értelemszerűen a legmagasabb a sebészeti beavatkozások után, ami egyébként a modern eszközök és a laparoszkópos technika alkalmazásával jelentősen csökken.
Ugyanakkor a technológiai fejlődés a gasztroenterológia területén is egyre invazívabb beavatkozások elvégzésére nyitott lehetőséget, és napjainkban a korai gyomorrák speciális gasztroszkópos instrumentárium segítségével a legtöbbször eltávolítható.
Továbbá jelenleg rendelkezésre állnak már nagy esetszámot feldolgozó és hosszú utánkövetést felmutató tanulmányok, amelyek meghatározták a korai gyomorrák azon altípusait, amikor az invazív gasztroenterológia onkológiai eredményei nem maradnak el a sebészi eredményektől (1, 2, 3).
Mindkét terület – az egyre invazívabbá váló gasztroenterológia és az egyre minimál invazívabbá váló sebészet – egyre dinamikusabb technikai fejlődése szinte napról napra írja át a szakmai irányelveket. Nem egyszerű eldönteni, hogy egy adott műtéti teherbírású beteg és egy adott stádiumú gyomorelváltozás esetén melyik a rövid és hosszú távú eredmények és az egyes beavatkozások szövődményaránya szempontjából a legoptimálisabb módszer. Elvi szinten a kérdést tovább bonyolítja a két eljárás egyre gyakoribb együttes alkalmazása. Ugyanakkor a mindennapi gyakorlatban nem – a sokszor még inkább futurisztikus – elvi lehetőségek, hanem az adott intézményben rendelkezésre álló személyi és tárgyi feltételek alapján dől el, hogy egy adott esetben invazív gasztroenterológiai vagy (minimál invazív) sebészeti, illetve valamely, a két eljárást ötvöző, hibrid megoldást alkalmazzák.
Mindezek alapján próbáltuk áttekinteni a korai gyomorrák sebészeti vonatkozásait kezdeti tapasztalataink és az aktuális irodalom alapján.
Definíció
Definíció szerint a korai gyomorrák (early gastric cancer, EGC) invazív karcinóma, amely a gyomor nyálkahártyájára (T1a) és a submucosára (T1b) lokalizálódik. A definícióban a nyirokcsomóstátusz mint kritérium nem szerepel (1).
Gyakoriság
A fenti definíciót alapul véve az EGC aránya a gyomorrákos esetek között az ázsiai országokban (Dél-Korea, Japán) a különböző szűrőprogramoknak köszönhetően 50% körül van, és a daganat többnyire intesztinális típusú, a nyugati országokban ez az arány 20%-ra tehető, és a daganatok többsége diffuse típusú (1, 4).
Klasszifikáció
A leggyakrabban alkalmazott onkológiai stádiumbeosztás, a TNM rendszer nem teszi lehetővé a korai gyomorrák olyan precizitású további alcsoportokra történő besorolását, amely alapján meghatározható lenne az invazív gasztroenterológiai kezelés kritériumrendszere.
A japán beosztás ugyan részletesebb, de ez is inkább csak a tumor makroszkópos megjelenésére alapoz (5). Sokkal precízebb differenciálásra ad lehetőséget a hisztológiai leleten alapuló Vienna klasszifikáció, amely az infiltráció alapján különbözteti meg a korai gyomorelváltozásokat. Az infiltratív elváltozásokat az infiltráció mélysége alapján sorolja további alcsoportokba, azaz megkülönböztet csak a nyálkahártyára lokalizálódó és a submucosát is érintő tumorokat. A csak a mucosára lokalizálódó, infiltráló elváltozások esetén az infiltráció mélysége alapján határoz meg további három alcsoportot, azaz a nyálkahártyának csak a hámrétegét (m1), a lamina propriát (m2) és a nyálkahártya izomrétegét (muscularis mucosae, m3) érintő tumorokat. A submucosát is elérő daganatok további két alcsoportba kerülnek, azaz fél mm-nél kisebb mértékű infiltráció esetén sm1, e felett sm2 koraigyomorrák-stádiumot különböztet meg (6) (1. táblázat).

Gasztroenterológiai kezelés: endoszkópos mucosareszekció (EMR), endoszkópos submucosadisszekció (ESD)
Invazív gasztroenterológiai megoldás akkor jön szóba, ha a gasztroszkópia kapcsán az en block reszekció kivitelezhetőnek tűnik, és a nyirokcsomó-metasztázis esélye csekély (24, 25). A beavatkozás az eltávolított specimen hisztológiai vizsgálata után tekinthető véglegesnek, ha a karcinóma jól differenciált, nem mutat lymphovascularis terjedést, csak a mucosát vagy a submucosát 0,5 mm-nél nem mélyebben érinti, és exulceráció vagy sm1 esetén a tumor átmérője nem haladja meg a 30 mm-t. Rosszul differenciált és nem kifekélyesedett elváltozások esetén 20 mm-es átmérő alatt az ESD mint definitív ellátás még megkísérelhető. Ha a szövettani vizsgálat nem en block reszekciót és/vagy tumorosan érintett horizontális reszekciós szélt jelez, akkor még szóba jöhet ismételt ESD szoros kontroll mellett. Az összes többi esetben sebészi reszekció és lymphadenectomia javasolt standard kezelésként, ha azt a beteg műtéti teherbírása lehetővé teszi (5).
Ennek megfelelően a korai gyomorrák négy paramétere – a Vienna klasszifikáció (mélységi kiterjedés), a tumorátmérő (horizontális kiterjedés), a differenciáltság foka és az exulceráció ténye – alapján lehet kiválasztani az egyes tumorstádiumokban javasolt optimális terápiás modalitást, azaz az endoszkópos mucosareszekciót (EMR), az endoszkópos submucosalis disszekciót (ESD), valamint a sebészi reszekciót és az ezzel együtt járó nyirokcsomó-disszekció kiterjesztését (2. táblázat). Az egyes stádiumokban javasolt terápiás opciók hosszú távú eredménye napjainkban már rendelkezésre áll, tulajdonképpen ez képezi a 2. táblázatban megfogalmazott szakmai ajánlás alapját (7).
Ugyanakkor fontos hangsúlyozni, hogy bár a gasztroenterológiai ellátásra javasolt stádiumokban a tumorspecifikus túlélés megegyezik a sebészi reszekció után tapasztaltakkal, a lokális recidívaarány EMR/ESD után magasabb. Emiatt fontos jelentőséggel bír a rendszeres endoszkópos kontrollvizsgálat (7). Másrészt gyakorlott kézben is 4-5% a beavatkozást követő perforáció, és 8% az utóvérzés aránya, amely gyakrabban fordul elő a gyomor felső harmadában végzett beavatkozások után. Emiatt EMR/ESD után elengedhetetlen a beteg megfelelő szintű obszervációja (vérkép, natív hasi röntgenvizsgálat) (8).
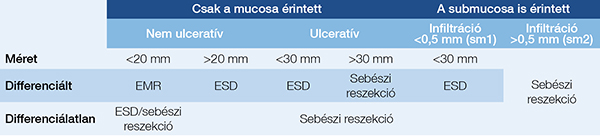
Hibrid eljárások, azaz gasztroenterológiai és sebészeti megoldás együtt alkalmazása
Ha a gyomor onkológiai okból megtartható, vagy a beteg általános állapota nem tesz lehetővé sebészi reszekciót, ugyanakkor az EMR/ESD technikai vagy akár személyi okból nem elvégezhető, akkor a laparoszkópos sebészet bevetésével érhető el a tumor teljes és biztonságos eltávolítása a műtéti megterhelés lényeges növelése nélkül. Saját tapasztalat alapján a tumor gasztroszkópos jelölése (spotting), majd későbbi sebészi laparoszkópos eltávolítása nem válik be annyira, mint a colon esetében. Ugyanis az ép reszekciós szél csak a tumor pontos vizualizálása esetén biztosítható. Ehhez
a gyomrot természetesen meg kell nyitni, festés nélkül a műtét során egyébként összeesett gyomron egy néhány cm-es nyálkahártya-elváltozás alig megtalálható, festés után pedig az elváltozás szélének és a reszekciós vonalnak a megítélése bizonytalan. Ez adja meg a különböző hibrid eljárások létjogosultságát.
Laparoscopic endoscopic cooperative surgery (LECS)
A beavatkozás során gasztroszkóppal jelölik ki a gyomornyálkahártyán a reszekció vonalát (precutting), majd a vonalnak megfelelően a gyomorfalat egy ponton perforálják. Ezen a ponton kezdi meg a has felől a laparoszkópos sebész a reszekciót, amelyet a jelölésnek megfelelően a gyomorfal teljes vastagságában elvégez. A gyomor zárása (varrógéppel vagy kézi varrással) is laparoszkóposan történik (8). Az eljárás előnye, hogy a reszekció horizontális síkját gasztroszkóp segítségével biztonságos vizualizáció mellett, felfújt gyomron jelölik ki, míg az épben vezetett mélységi reszekciós sík a sebészi, teljes falra kiterjedő excízió által biztosított. Inkább csak elvi hátrány a hasüreg szükségszerű kontaminációja, amely a klinikai gyakorlatban adekvát hasűri lavage és antibiotikus védelem mellett nem releváns probléma.
A LECS elsősorban 30 mm-nél nagyobb vagy kifekélyesedett lézió esetén javasolható, amikor az ESD kivitelezése technikai nehézségbe ütközik (9).
Endoszkóposan asszisztált laparoszkópos reszekció
Az előző eljáráshoz hasonlóan a laparoszkópia során történik gasztroszkópia, amely segítségével felfújt gyomron, direkt gasztroszkópos vizualizáció mellett, laparoszkóposan behelyezett öltések segítségével jelölik ki az elváltozás határait, lehetőleg legalább négy irányból. Ezután távolítják el az elváltozást sebészi vágó-varró gép felhelyezésével olyan módon, hogy a behelyezett öltések is az eltávolított gyomorrészen maradnak, így biztosítva az ép reszekciós határt. Cardia vagy pylorus közeli és kisgörbületi elváltozások esetén a módszer technikai kivitelezhetősége erősen kétséges, ha mégis, akkor az elváltozás határainak kijelölése után a gyomor megnyitásával végzett reszekció jöhet szóba az előző módszernél leírtaknak megfelelően, majd laparoszkóposan behelyezett öltésekkel kivitelezett gyomorfalzárás biztosíthatja a strictura elkerülését.
Laparoszkópos intragasztrikus sebészet
A beavatkozás során az elváltozás gasztroszkópos lokalizációja után a hasfalon keresztül bevezetett laparoszkópos optika és trokárok a gyomor lumenébe kerülnek, ahol a gyomor felfújása mellett a laparoszkópos eszközök segítségével történik meg az ESD. Az eljárás főként gastro-oesophagealis junctióhoz vagy a pylorushoz közel elhelyezkedő tumorok esetén jön szóba, amikor a sebészi, teljes gyomorfalra kiterjedő excízió strictura veszélyével fenyeget, és a gasztroszkóppal végzett ESD is technikai kihívást jelent a lokalizáció miatt (11).
Az ESD és laparoszkópos nyirokcsomó-disszekció
Mind a gasztroenterológiai, mind a hibrid eljárások kiváló kiegészítése lehet a sentinel nyirokcsomó laparoszkópos disszekciója, ilyen módon a nyirokcsomóáttétet nagyobb eséllyel okozó korai gyomorkarcinómák esetén is elkerülhető lenne a sebészi reszekció. Az eljárás során az elváltozásba a beavatkozás előtt gasztroszkóp segítségével a nyirokutak által transzportált speciális izotópot vagy fluoreszcens indocyanin green (ICG) festékanyagot és normál fény mellett látható festéket (kettős jelölés) injektálnak, amelyek, belépve a nyirokrendszerbe, kijelölik az adott gyomorelváltozáshoz tartozó legközelebbi nyirokcsomókat (sentinel technika). Ezek laparoszkópos eltávolításával az adott régióban elhelyezkedő korai gyomorrák excíziója mellett célzott lymphadenectomia is biztosítható (10). A sebészeti oldalról szükséges eszközök (a nyirokutakba került izotóp vagy ICG detektálásához szükséges, laparoszkóposan bevezethető kamera, a nyirokutakat megjelölő patent blue festék, valamint a finom manipulációt lehetővé tevő sebészi optika és műszerek) évek óta rendelkezésre állnak. Sajnos megoldatlan probléma, hogy az emlősebészetben már évtizedek óta kiváló eredményekkel alkalmazott sentinel technika a gyomorkarcinómák vonatkozásában nem megbízható. Kimutatott, hogy a tumor közeli és sentinel technikával eltávolítható negatív nyirokcsomók mellett mintegy 20% az ettől távolabbi (úgy nevezett jumping vagy skip) metasztázisok aránya, amelyek eltávolításának feltétele a sebészi reszekció. Az ok valószínűleg anatómiai, azaz a gyomor igen bőséges nyirokérhálózata és ezek kapcsolatrendszere nemcsak a hasüreg, hanem a retroperitoneum és a mediastinum nyirokútjai felé is (12).
Ezért a (korai) gyomorrák vonatkozásában a sentinel technika aktuálisan nem része a klinikai gyakorlatnak, jelenleg még csak experimentális jellegű, bár a SENORITA trial közelmúltban publikált, ötéves eredményei ilyen vonatkozásban biztatóak (13). Ennek megfelelően a hibrid technikák vonatkozásában az indikációs kör azonos az invazív gasztroenterológiai eljárásoknál leírtakkal, indikációjukat az EMR/ESD feltételeinek hiánya vagy a technikai kihívást jelentő tumorlokalizáció jelenti. Ugyanakkor hasznos kiegészítői az EMR/ESD-nek, amikor ezek elvégezhetősége technikai problémákba ütközik, mert biztonságossá teszik a sebészi reszekciót kiváltó beavatkozást, amikor erre onkológiai szempontból lehetőség adódik vagy a beteg általános állapota nem teszi lehetővé a nagyobb megterhelést jelentő total/subtotal gastrectomiát (14).
Sebészeti eljárások (total/subtotal gastrectomia, nyirokcsomó-disszekció, cholecystectomia)
Ha a korai gyomorrák exulcerált, és 30 mm-nél nagyobb átmérőjű vagy az előzetes biopszia lymphovascularis inváziót vagy rosszul differenciált elváltozást mutat, akkor sebészi reszekció és lymphadenectomia az onkológiai elveknek megfelelő, elsőként választandó terápiás opció. Ugyanez javasolt kiegészítő eljárásként, ha az EMR/ESD során eltávolított specimen szövettani vizsgálata az előzetes biopszia ellenére igazol rosszul differenciált tumort, lymphovascularis inváziót vagy a tumor által érintett mélységi reszekciós síkot. Az sm2 szintű mélységi infiltráció minden esetben, az sm1 pedig 3 cm tumorátmérő felett tesz indokolttá sebészi megoldást. Nem en block reszekció vagy érintett horizontális szél esetén is szóba jön sebészeti megoldás egyéb opciók (ismételt ESD, hibrid műtét, endoszkópos koaguláció vagy szoros endoszkópos obszerváció) mellett. Továbbá természetesen a korai gyomorrák bármely formája sebészi indikációt képez, ha az invazív gasztroenterológiai eljárások nem állnak rendelkezésre (5) (3. táblázat).

Gyomorreszekció
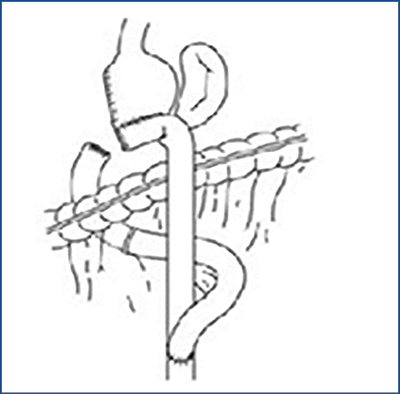
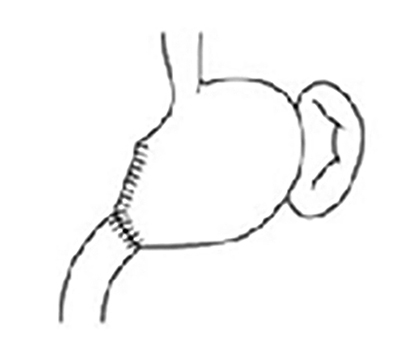
Ha a 3. táblázatban összefoglalt onkológiai elvek alapján sebészi megoldás a döntés, total gastrectomia (1. ábra), subtotal gastrectomia Billroth II. (B II.) szerint (2. ábra) vagy gyomorreszekció Billroth I. (B I.) szerint (3. ábra) a három lehetséges opció. Ha a sebészi megoldásra nem onkológiai okból, hanem az ESD/EMR lehetőségének hiánya miatt kerül sor, akkor jönnek szóba az előzőekben leírt hibrid műtétek. A gyomor csonkolását illetően kis gyomorcsonk megtartásával a subtotal gastrectomia B II. szerint az elsőként választandó opció. Ha ilyen módon diffúz típusú karcinómák esetén 8 cm, illetve intesztinális típusú tumorok esetén 5 cm-es biztonsági zóna (szabad szél) nem tartható, úgy total gastrectomia a választandó eljárás. Távol keleti országokban, ahol mind a korai, mind az intesztinális típusú elváltozások aránya lényegesen magasabb a nyugati országokban tapasztaltaknál, gyakran végeznek B I. szerint reszekciót, amely után nagyobb gyomorcsonk marad vissza, és megtartott a duodenum passage a B II. szerint végzett subtotal reszekcióhoz képest. A nyugati országokban a B I.-es reszekció nem hódított tért a diffuse típusú, gyakran multicentrikus tumorok magas aránya miatt (15).
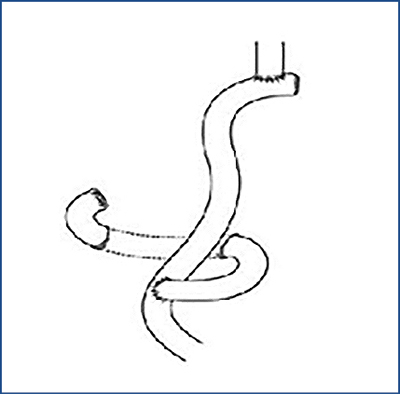
1. ábra: A total gastrectomia vázlatos rajza (rekonstrukció
Roux-kaccsal)
Lymphadenectomia
Fontos kérdés a lymphadenectomia és annak kiterjesztésének kérdése. Elvileg 3 szintű nyirokcsomó-disszekció jöhet szóba. Ezek egyike a sentinelnyirokcsomó-disszekció, amikor csak az elváltozáshoz legközelebbi nyirokcsomókat távolítjuk el, amelyek az elváltozásba adott és a nyirokrendszerbe belépő izotóp/ICG és festékanyag segítségével jeleníthetőek meg. A másik az 1-es szintű disszekció, amikor a gyomor melletti, 1-től 7-ig számozott nyirokrégiót távolítjuk el (D1). A harmadik a 2-es szintű, amikor a truncus coeliacus, a léphylus és részben a májkapu nyirokrégióit is eltávolítjuk, ami további öt régió disszekcióját foglalja magában (D2) (4. ábra, 4. táblázat).
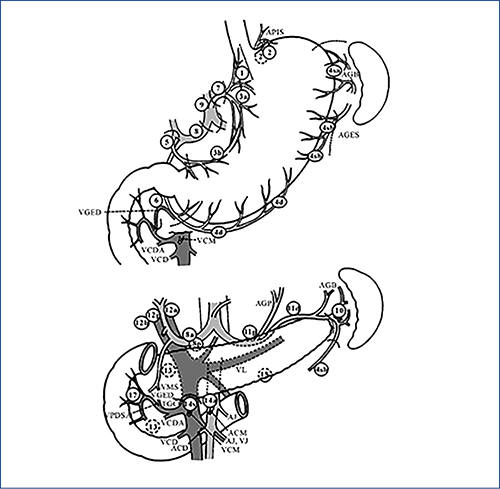

A gyomor és annak nyálkahártyarétege bőséges nyirokér-ellátással rendelkezik. A nyálkahártyaizom rétegében (muscularis mucosae), közvetlenül felette a lamina propriában, valamint alatta, a submucosában plexust képező nyirokérhálózat mutatható ki. Ez az anatómiai háttere annak, hogy T1a, azaz csak a nyálkahártyára lokalizálódó tumorok esetén is előfordulhat nyirokcsomó-metasztázis. Ha csak a muscularis mucosae érintett, ennek aránya 5%-ra tehető, míg submucosainfiltráció esetén ez irodalmi adatok szerint 20-60%-ot is elérhet (16). A nyirokcsomóáttét esélye magasabb, ha a tumor differenciálatlan, lymphovascularis terjedést mutat, makroszkóposan a felszíne a nyálkahártya szintje alá süllyed (depressed tumor), a gyomor proximális részén helyezkedik el, illetve ha kifekélyesedett (1, 14).
Japán szerzők is hasonló következtetésre jutottak, amikor több mint ötezer, korai gyomorrák miatt végzett sebészi reszekció és lymphadenectomia hisztológiai eredményeit elemezték. Differenciálatlan vagy 30 mm-nél nagyobb átmérőjű és exulcerált elváltozások esetén találtak szignifikánsan magasabb számú nyirokcsomóáttétet. Lymphovascularis érintettség esetén 36,6%, míg ennek hiányában 9,8% volt a metasztatikus nyirokcsomók aránya. Ilyen szempontból jelentős különbség mutatkozott az sm1/sm2 mélységi infiltráció vonatkozásában is (8,8 vs. 23,7%). Ugyancsak fontos, hogy 10%-ban találtak az elváltozástól távolabbi (D2) nyirokcsomókban áttétet, amikor a gyomor melletti (D1) nyirokcsomókban nem, ami tovább nyomatékosítja a sentinel technika bizonytalanságát és egyben a D2-es szintű lymphadenectomia fontosságát a sebészi reszekcióra ajánlott korai gyomortumorok esetén is (1). A jumping (skip) metasztázisok aránya a nyugati országok betegpopulációiban valószínűleg még magasabb a diffuse típusú gyomorkarcinómák nagyobb arányú előfordulása miatt.
A kiterjesztett nyirokcsomó-disszekció fontosságát támasztják alá a korai gyomorrák különböző stádiumaiban tapasztalt prognosztikai adatok is, amelyek szerint az összes korai gyomorrákos eset hosszú távú túlélését illetően 2-3%-os különbség mutatkozik a D2-es lymphadenectomia javára a D1-eshez képest. Ha külön vizsgálták a submucosát is érintő elváltozásokat, akkor ez a különbség már elérte a 10%-ot. Amikor pedig a korai gyomorrák miatt operált, nyirokcsomó-pozitív esetek 10 éves túlélését vizsgálták, akkor ezt D2-es lymphadenectomia után 87%-nak, míg D1-es szintű disszekció után 55%-nak találták (17).
Cholecystectomia
A total/subtotal gastrectomia és a D2-es lymphadenectomia az epehólyag működésében funkcionális károsodást okoz. Ennek egyik oka a duodenum gasztrointesztinális passage-ból történő kirekesztése miatt a cholecysta kiürülését fokozó hormonok alacsonyabb szintje, másrészt a lymphadenectomia hátrányosan érinti az epehólyag innervációját. Ezért az epehólyag-kövesség és ennek szövődményeinek aránya gastrectomia és D2-es lymphadenectomia után eléri a 15%-ot (18). Ugyanakkor a cholecystectomia a gastrectomia és D2-es lymphadenectomia által okozott műtéti megterhelést lényegesen nem befolyásolja. Mérlegelve továbbá, hogy esetleges epeútkövesség kialakulásakor a gyomor műtét után az ERCP/EST lehetősége erősen limitált, indokolt a total/subtotal gastrectomiával egy ülésben a profilaktikus cholecystectomia elvégzése, ami még megerősítésre váró irodalmi adatok szerint kiválthatónak tűnik a műtét után napi 300-600 mg urzodezoxikólsav alkalmazásával (19).
Konklúzió
Az invazív gasztroenterológiai és a minimál invazív sebészeti módszerek jelenleg tapasztalt rendkívül dinamikus fejlődése napról napra írja át a korai gyomorrák optimális ellátási stratégiáját. Ha az onkológiai elvek lehetővé teszik és a személyi és technikai feltételek rendelkezésre állnak, vagy onkológiai kompromisszumot vállalva magas rizikójú beteg esetén indokolt EMR/ESD-t végezni. Ennek feltételeinek hiánya vagy kihívást jelentő lokalizáció esetén jönnek szóba az ún. hibrid megoldások. Ha a gyomorreszekció indokolt, úgy a nyugati országokban aktuálisan is a total/subtotal gastrectomia és a D2-es lymphadenectomia a gold standard megoldás profilaktus cholecystectomiával kiegészítve. Mind irodalmi adatok, mind kezdeti tapasztalataink alapján a beteg műtéti megterhelése tovább csökkenthető, ha a sebészeti beavatkozást laparoszkóposan végezzük.
Irodalom
https://doi.org/10.3748/wjg.v28.i7.693
2. Espinel J, Pinedo E, Ojeda V, Del Rio MG. Treatment modalities for early gastric cancer. World J Gastrointest Endosc 2015 Sep 10; 7(12): 1062–1069. Published online 2015 Sep 10. https://doi.org/10.4253/wjge.v7.i12.1062
3. Mejía R, Sáez J, Norero E, Briones P, Ceroni P, Martínez C, Díaz A, Calvo A, Sharp A. Long-term Results of Endoscopic Submucosal Dissection (ESD) for the Treatment of Early Gastric Cancer (EGC) in a High-volume Latin American Center. Surg Laparosc Endosc Percutan Tech 2020 Sep 11; 31(2): 165–169. https://doi.org/10.1097/SLE.0000000000000857
4. Hamashima C. Update version of the Japanese Guidelines for Gastric Cancer Screening. Systematic Review Group and Guideline Development Group for Gastric Cancer Screening Guidelines. Jpn J Clin Oncol 2018 Jul 1; 48(7): 673–683. https://doi.org/10.1093/jjco/hyy077
5. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021 Jan; 24(1): 1–21.
https://doi.org/10.1007/s10120-020-01042-y Epub 2020 Feb 14.
6. Kuan J, Ratcliffe E, Hayes S, McGrath S, Ang Y. Accuracy of the revised Vienna Classification for predicting postendoscopic resection outcomes for gastric and oesophageal neoplasms: a retrospective cohort study of patients from a UK tertiary referral centre. J Clin Pathol 2020 Aug; 73(8): 493–501. https://doi.org/10.1136/jclinpath-2019-206285
Epub 2020 Jan 20.
7. Fan T, Sun Q, Cao S, Fan X, Huang Q, Zhang S, Lv Y, Zhang X, Ling T, Wang L, Zou X, Xu G. Clinical outcomes of early gastric cardiac cancer treated with endoscopic submucosal dissection in patients with different indications. BMC Gastroenterol 2021; 21: 119. Published online 2021 Mar 12. https://doi.org/10.1186/s12876-021-01700-0
8. Hiki N, Nunobe S. Laparoscopic endoscopic cooperative surgery (LECS) for the gastrointestinal tract: Updated indications. Ann Gastroenterol Surg 2019 May; 3(3): 239–246. Published online 2019 Feb 19.
https://doi.org/10.1002/ags3.12238
9. Nunobe S, Hiki N, Gotoda T, Murao T, Haruma K, Matsumoto H, Hirai T, Tanimura S, Sano T, Yamaguchi T. Successful application of laparoscopic and endoscopic cooperative surgery (LECS) for a lateral-spreading mucosal gastric cancer. Gastric Cancer 2012 Jul; 15(3): 338–42.
https://doi.org/10.1007/s10120-012-0146-5 Epub 2012 Feb 17.
10. Kinami S, Kosaka T. Laparoscopic sentinel node navigation surgery for early gastric cancer. Transl Gastroenterol Hepatol 2017; 2: 42.
https://doi.org/10.21037/tgh.2017.05.02 Published online 2017 May 09.
11. Varga Z, Sárkány P, Tóth D. Vissza a jövőbe: Gastro-oesophagealis junctio subepitheliális tumorának laparoszkópos transgastricus resectiója. Magy Seb 2021 Jun 16; 74(2): 43–48.
https://doi.org/10.1556/1046.74.2021.2.3
12. Zhao X, Cai A, Xi H, Chen L, Peng Z, Li P, Liu N, Cui J, Li H. Predictive Factors for Lymph Node Metastasis in Undifferentiated Early Gastric Cancer: a Systematic Review and Meta-analysis. J Gastrointest Surg 2017; 21: 700–711. https://doi.org/10.1007/s11605-017-3364-7 Epub 2017 Jan 24.
13. Hur H, Lee YJ, Kim YW, Min JS, Yoon HM, An JY, Eom BW, Cho GS, Park YK, Jung MR, Park JH, Hyung WJ, Jeong SH, Kook MC, Han M, Nam BH, Ryu KW. Clinical Efficacy of Laparoscopic Sentinel Node Navigation Surgery for Stomach Preservation in Patients With Early Gastric Cancer: 5-year Results of the SENORITA Trial. Ann Surg 2024 Jan 25. PMID: 38269605.
https://doi.org/10.1097/SLA.0000000000006219
14. Shin EJ, Gong CS, Kim BS, Kim SO, Ko CS, Kim HS. Early Surgical and Long-term Oncological Outcomes of Totally Laparoscopic Near-total Gastrectomy in >150 Cases. Surg Laparosc Endosc Percutan Tech 2020; 30: 529–33. https://doi.org/10.1097/SLE.0000000000000823
15. Bollschweiler B, Berlth F, Baltin C, Mönig S, Hölscher AH. Treatment of early gastric cancer in the Western World. World J Gastroenterol 2014 May 21; 20(19): 5672–5678. Published online 2014 May 21.
https://doi.org/10.3748/wjg.v20.i19.5672
16. Medeiros Milhomem L, Medeiros Milhomem-Cardoso D, Da Mota OM, Duarte Mota E, Kagan A, Benevides Santana Filho J. Risk of lymph node metastasis in early gastric cancer and indications for endoscopic resection: is it worth applying the east rules to the west? Surg Endosc 2021 Aug; 35(8): 4380–4388.
https://doi.org/10.1007/s00464-020-07932-7 Epub 2020 Sep 3.
17. An L, Gaowa S, Cheng H, Hou M. Long-Term Outcomes Comparison of Endoscopic Resection With Gastrectomy for Treatment of Early Gastric Cancer: A Systematic Review and Meta-Analysis. Front Oncol 2019; 9: 725. Published online 2019 Aug 7. https://doi.org/10.3389/fonc.2019.00725
18. Bencini L, Marchet A, Alfieri S, Rosa F, Verlato G, Marrelli D, Roviello F, Pacelli F, Cristadoro L, Taddei A, Farsi M. The Cholegas trial: long-term results of prophylactic cholecystectomy during gastrectomy for cancer-a randomized-controlled trial. Gastric Cancer 2019; 22: 632–639.
https://doi.org/10.1007/s10120-018-0879-x
19. Lee SH, Jang DK, Yoo MW, Hwang SH, Ryu SY, Kwon OK, Hur H, Man Yoon H, Eom BW, Ahn HS, Son T, Song KY, Lee HH, Choi MG, An JY, Lee SI, Lee KH, Ahn S, Park YS, Park DJ. Efficacy and Safety of DWJ1319 in the Prevention of Gallstone Formation after Gastrectomy in Patient with Gastric Cancer: A Multicenter, Randomized, Double-blind, Placebo-controlled Study (PEGASUS-D). JAMA Surgery 2020; 155(8): 703–711.
https://doi.org/10.1001/jamasurg.2020.1501
