Reviews
Management of diabetes with liver disease: current concepts of screening, diagnosis and treatment
Summary
Liver plays a crucial role in glucose homeostasis. Type 2 diabetes mellitus (T2DM) is often associated with cirrhosis. Both conditions are related in metabolic associated steatotic liver disease (MASLD), the leading cause of chronic liver disease. Having diabetes as comorbidity increase the risk of cirrhosis-related complications, such as hepatocellular karcinóma (HCC) and overall mortality. Patients with type 2 diabetes should be systematically screened for MASLD-related fibrosis with noninvasive tools using FIB-4 score and transient elastography. Early diagnosis of diabetes in patients with cirrhosis is crucial for finding the optimal management strategy. Using HbA1c for the diagnosis of diabetes in patients with cirrhosis can be misleading, especially in Child–Pugh B-C stage, while anemia may turn the test unreliable. In decompensated cirrhosis the only recommended treatment for diabetes is insulin, however clinicians must be aware of higher risk of hypoglycaemia. Patient care should be based on a multidisciplinary approach, including endocrinologists, hepatologists, nutritionists and physiotherapists, while the treatment should be personalized, based on risk-benefit evaluation. In the present review authors summarize the association between diabetes and liver disease, demonstrate the main pathomechanisms, draw attention to special diagnostic aspects and also muster the currently available antidiabetics in the chronic liver disease.
Összefoglalás
A máj központi szerepet játszik a glükózanyagcserében. A 2-es típusú diabetes mellitus (T2DM) gyakran társul májcirrózissal, illetve mindkét állapot szorosan összefügg a nem alkoholos zsírmáj betegség (MASLD), illetve a metabolikus diszfunkcióval társult zsírmáj betegség (MAFLD) jelenlétével, amely a krónikus májbetegség leggyakoribb oka. A diabetes mellitus egyidejű jelenléte esetén emelkedik a májcirrózissal összefüggő szövődmények kockázta, így a hepatocelluláris karcinóma (HCC) előfordulása és az összmortalitás is magasabb. A 2-es típusú diabetes mellitusos betegek szisztematikus szűrése javasolt MASLD-eredetű fibrózis irányában noninvazív módszerekkel, így a FIB-4 index, illetve a tranziens elasztográfia alkalmazásával. A diabétesz korai diagnózisa májcirrózisos betegekben elengedhetetlen a megfelelő kezelési stratégia kialakításához. Kizárólag a HbA1c alkalmazása a diagnosztikában félrevezető lehet májcirrózisos betegekben, különösen Child–Pugh B-C stádiumban, hiszen anémia esetén az értéke nem megbízható. Dekompenzált májcirrózisban az egyetlen kezelési lehetőség az inzulin, azonban számolnunk kell a hypoglykaemia fokozott kockázatával. A diabéteszes májcirrózisos betegek gondozása multidiszciplináris feladat (endokrinológus, hepatológus és táplálásterápiás szakember/dietetikus, gyógytornász közös feladata), a megfelelő kezelés kiválasztásának egyénre szabottan, a kockázat-haszon becslést mérlegelve kell megvalósulnia. A közlemény összefoglalja a diabétesz és a májbetegségek összefüggéseit, áttekinti a fő patomechanizmusokat, felhívja a figyelmet a diagnosztika speciális szempontjaira, valamint számba veszi a jelenleg elérhető kezelési lehetőségeket a diabétesz és a májbetegségek társulása esetén.
Bevezetés
A máj központi szerepet játszik a szénhidrát-anyagcsere homeosztázisának fenntartásában, számos kulcsfontosságú folyamat, a glikogenezis, a glikogenolízis, a glikolízis, illetve a glükoneogenezis révén (1). A májsejtek károsodása a szénhidrát-anyagcsere zavarát okozza, míg a szénhidrát-anyagcsere zavarai májkárosodáshoz vezethetnek. A 2-es típusú diabetes mellitus (T2DM) gyakran társul májcirrózissal, mindkét állapot szorosan összefügg a nem alkoholos zsírmáj betegség (MASLD), illetve a metabolikus diszfunkcióval társult zsírmáj betegség (MAFLD) jelenlétével, amely a krónikus májbetegség leggyakoribb oka (2). A diabétesz növekvő népegészségügyi problémát jelent, így mind az alapellátásban, mind a hepatológiai gyakorlatban gondolni kell a betegség szűrésre. 2017-ben a diabétesz előfordulását világszerte 451 millióra becsülték, 2045-re ez várhatóan 693 millióra fog növekedni. Egy összefoglaló közlemény 58 tanulmány 9705 májcirrózisos betegét vizsgálta, és azt találta, hogy a diabétesz prevalenciája összesen 30,7% volt (95% CI: 27,9–33,5) (3). A legmagasabb prevalenciát MASLD esetén találták, amely 56% volt, kriptogén cirrózis esetén 51%, HCV esetén 32%, alkoholos májcirrózisban 27% volt a diabétesz előfordulási gyakorisága. A diabétesz előfordulása összefüggött az életkorral, az elhízással, valamint a családban előforduló T2DM-mel. Egy, 248 MASLD-beteg bevonásával történt vizsgálatban azt találták, hogy a májcirrózis prevalenciája magasabb diabétesz esetén (28%), mint diabétesz nélkül (6%) (4). Hét vizsgálat metaanalízise kapcsán 439, diabéteszes és biopsziával igazolt MASLD esetén az előrehaladott fibrózis és cirrózis prevalenciája 17% volt (95% CI: 7,2–34,8) (2). A tanulmányok eredményei alapján az előrehaladott májfibrózis prevalenciája diabéteszes betegek esetén kb. 15-20%. A diabétesz egyidejű jelenléte májcirrózis esetén a kedvezőtlen kimenetel független prediktív tényezője, magasabb a szövődmények előfordulása, így a dekompenzáció kialakulása (pl. az ascites, az encephalopathia), valamint infekciók is gyakrabban megjelennek, továbbá az összmortalitás is magasabb (5). Egy prospektív kohorszvizsgálatban 63 275 beteget vizsgálva a diabétesz magasabb, cirrózissal összefüggő halálozással járt együtt (HR: 2,80; 95% CI: 2,04–3,83) (6). Egy másik vizsgálatban 299, biopsziával igazolt NASH és kompenzált cirrózisos beteg esetén ötéves követési idő alatt a diabétesz kétszer magasabb halálozással járt (HR: 4,23; 95% CI: 1,93–9,29), a májbetegséggel összefüggő kimenetel is rosszabb volt (HR: 2,03; 95% CI: 1,00–4,11), valamint a HCC előfordulása is magasabb volt (HR: 5,42; 95% CI: 1,74–16,80). A májcirrózis jelenléte diabétesz esetén szintén befolyásolja a kimenetelt, valamint a kezelési stratégiát, azonban a májcirrózist gyakran előrehaladott stádiumban, a szövődmények megjelenése esetén ismerik fel (7). MASLD esetén a halálozás fő oka kardiovaszkuláris megbetegedés (CVD), amelyet az extrahepatikus malignitás követ (kolorektális karcinóma, emlőkarcinóma). MASLD esetén gyakoribb a CVD, a hipertónia, a szívelégtelenség, a pitvarfibrilláció és egyéb szívritmuszavarok, valamint az aortabillentyű sclerosisa (8). Egy svéd tanulmány eredményei szerint MASLD esetén magasabb volt a nem halálos kardiovaszkuláris események száma, és alacsonyabb volt a várható élettartam, azonban a CVD halálozás nem különbözött (9).
Patofiziológia: a diabetes mellitus és a májcirrózis összefüggései
Májcirrózis esetén a diabétesz kialakulásában az inzulinhatás károsodása, a májban, az izomszövetben és a zsírszövetben kialakuló inzulinrezisztencia, valamint a béta-sejt-diszfunkció játszik központi szerepet. A diabétesz kialakulásában szerepet játszó mechanizmusokat az 1. ábrán foglaltuk össze.
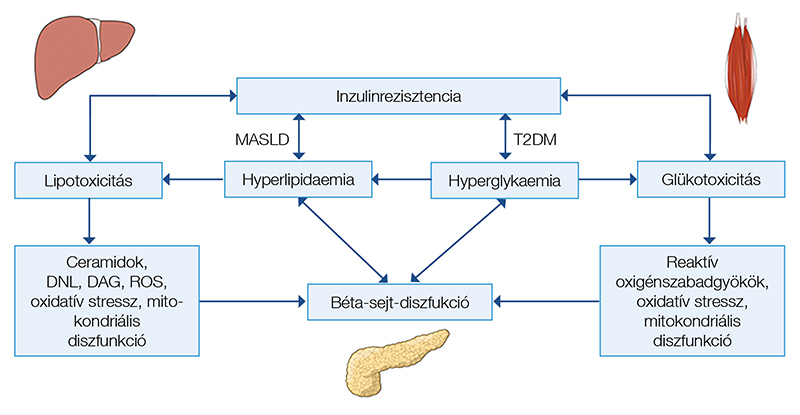
A májcirrózis hatása a glükóz- és lipidanyagcserére nem minden aspektusában ismert. Számos korábbi vizsgálat igazolta, hogy a májcirrózis súlyosságával párhuzamosan az inzulinrezisztencia is romlik (10). Prediabéteszben az izom-inzulinrezisztencia dominál, majd a máj-inzulinrezisztencia romlásával a fokozott hepatikus glükózprodukció, emelkedő éhgyomri és posztprandiális glükózszint már manifeszt diabétesz formájában jelentkezik. MASLD esetén az inzulinrezisztencia és a lipotoxicitás központi szerepet játszik a steatohepatitis és a fibrózis kialakulásában (11). Májcirrózis esetén károsodott glükózanyagcseréhez vezet a krónikus hyperinsulinaemia, a csökkent szöveti válasz az inzulinra, az emelkedett szabadzsírsav-szintek és a zsírszövet inzulinrezisztenciája, valamint a glükotoxicitás, következésképpen károsodik az inzulinszekréció és a perifériás glükózmetabolizmus. A pancreas béta-sejt-diszfunkciója következtében először posztprandiális hyperglykaemia, csökkent glükóztolerancia alakul ki. Az inzulinszekréció csökkenésével a glükóz-homeosztázis tovább romlik, és éhgyomri hyperglykaemia is kialakul. A krónikus májbetegség, mint a diabétesz oka, korábban külön entitásként, „hepatogén diabétesz” diagnózisként merült fel. A hyperinsulinaemia már a májcirrózis korai stádiumában megjelenik, a súlyos inzulinrezisztencia és a csökkent perifériás inzulinclearance következtében. Briel és munkatársai 190 májbeteget vizsgálva azt találták, hogy steatohepatitis és steatosis esetén a hepatikus inzulinclearance 30%-kal csökken (12). A hepatikus inzulinclearance csökkenése nem mutatott összefüggést a gyulladás súlyosságával vagy a fibrózis mértékével. Anyagcserezavarhoz társuló steatohepatitis (MASH) esetén súlyosabb a hyperinsulinaemia, mint egyszerű steatosis (MASLD) esetén az extrahepatikus inzulinclearance csökkenése és a súlyos zsírszöveti inzulinrezisztencia következtében. T2DM esetén az izom- és májszöveti inzulinrezisztencia, az inadekvát kompenzatorikus béta-sejt-inzulinszekréció miatt károsodik a normál glükóz-homeosztázis. Májbetegség esetén számos tényező vezet a diabétesz kialakulásához, amelyet befolyásolnak a genetikai tényezők, a metabolikus zavar, a társbetegségek és az alkalmazott gyógyszerek, amelyek rontják az inzulinszekréciót és az inzulinrezisztenciát. A májcirrózis felszínre hozza a pancreas genetikailag determinált, maszkírozott béta-sejt-diszfunkcióját, és kimeríti a kompenzatorikus kapacitást. Mindezek alapján az Amerikai Diabetes Társaság (ADA) nem tekinti külön entitásnak a hepatogén diabéteszt (13).
Az ektópiás zsírlerakódás az izomszövetben (myosteatosis) és a lipotoxicitás központi szerepet játszik az inzulinrezisztencia kialakulásában T2DM, obesitas és MASLD esetén (14). A sarcopenia, az izomtömeg csökkenése, amely az ülő életmód, szervelégtelenség (szív, tüdő, máj), malignitás, endokrin kórképek, malnutríció esetén alakul ki, és rosszabb kimenetellel társul egyidejűleg jelenlévő myosteatosis és MASLD esetén (15). A sarcopenia kedvezőtlen hatásai fokozottan érvényesülnek obesitas és T2DM esetén, hiszen az izomszövet központi szerepet játszik inzulinmediált glükózanyagcserében, és befolyásolja a hepatikus zsírsav-oxidációt. Az inzulinrezisztencia, a lipotoxicitás és az ektópiás zsírakkumuláció MASLD estén befolyásolja a máj- és az izomszövet funkcióját.
A máj fibrogenezisében központi szerepük van az aktivált csillagsejteknek és a portális myofibroblastoknak, amelyekre a fokozott proliferáció, migráció és kontraktilitás jellemző, és relatíve ellenállóak az apoptosissal szemben (16). Az aktivált cholangiocyták hasonlóak a fibrogén progenitor sejtekhez, és a hepatocyták lipoapoptosisa esetén fokozódik a számuk. Az extracelluláris mátrixkomponensek szintézise és lerakódása fokozódik, csökken a fibrolysis a mátrix fokozott metalloproteináz-szöveti inhibitor-1 (TIMP-1) szintézisének következtében, és csökken a mátrix-metalloproteázok (MMP) termelése a csillagsejtek/myofibroblastok és makrofágok által. A diabétesz a lipotoxicitás, glükotoxicitás és egyéb mechanizmusok következtében hozzájárul a fibrózis progressziójához, a csillagsejtek aktiválódása, a gyulladás, az apoptosis, az angiogenezis és a hepatikus sinusoidalis kapillarizáció révén. Az inzulinrezisztencia a májban a szabad zsírsavak fokozott képződéséhez és ektópiás zsírlerakódáshoz vezet, amely jelentős szerepet játszik a MASLD patofiziológiájában, és toxikus lipidek, mint diacilglicerol, ceramidok, hosszú láncú acil-Co-A képződéséhez vezet, amelyek különböző módon befolyásolják az inzulinszignalizációt és a gyulladásos folyamatokat. A szabad zsírsav fokozott képződése a májban, az izmokban és egyéb szövetekben mitokondriális diszfunkcióhoz vezet (17). A lipotoxicitás gyulladásos útvonalak és csillagsejtek aktiválódásához vezet, amely a MASH progresszióját okozza (18). Inzulinrezisztens állapotban a zsírszövetben fokozódik a proinflammatorikus citokinek (tumornekrózisfaktor-α, transzformáló növekedési faktor-β, interleukin-6) termelése, míg csökken az antiinflammatorikus adipokinek, mint az adiponektin termelése (19). A proinflammatorikus citokinek májkárosító hatásúak direkt és indirekt módon egyaránt, az oxidatív stressz, a hepatocellularis károsodás, a fibrózis fokozása révén.
Májfibrózis irányú szűrés diabétesz fennállása esetén
A májcirrózis prevalenciája világszerte emelkedik, akárcsak az obesitas és a T2DM prevalenciája. Mindkét állapot elősegíti a MASLD kialakulását, amely a májcirrózis leggyakoribb oka (2, 7). Az Európai Májkutató Társaság, az Európai Diabetes Társaság és az Európai Elhízástudományi Társaság (EASL, EASD, EASO) guideline-ja MASLD esetén szisztematikus szűrést javasol diabétesz fennállásának irányában (20). Az ADA ajánlása szerint pedig T2DM-betegek szisztematikus szűrése javasolt MASLD fennállásának irányában. Az ajánlások tehát az egyes esetek megtalálása helyett univerzális szűrési programok megvalósítását javasolják noninvazív eszközökkel, így a FIB-4 index és a tranziens elasztrográfia alkalmazásával. A FIB-4 index egy olcsó, könnyen hozzáférhető teszt, amelynek magas a negatív prediktív értéke az előrehaladott májfibrózis kizárásában (21). A FIB-4 index egyszerűen kiszámolható online kalkulátor segítségével az életkor, a GOT, a GPT, valamint a thrombocytaszám alapján. Ha az értéke 1,3 pont alatti, az előrehaladott májfibrózis nem valószínű. Ha a FIB-4 score 1,3–2,6 pont közötti, javasolt fibroscan elvégzése, illetve 2,6 pont felett javasolt a diabéteszes beteg hepatológiai szakellátásba irányítása.
A diabetes mellitus diagnózisa májbetegség esetén
Kompenzált májcirrózisos betegek esetén a diabétesz diagnózisa megegyezik a májbetegséggel nem rendelkező betegek esetén alkalmazott diagnosztikus módszerekkel. A diabétesz korai diagnózisának prognosztikus értéke van a májcirrózis vonatkozásában, és a diabétesz megfelelő kezelése lehetőséget teremt a diabéteszes szövődmények kialakulásának csökkentésére (22). Epidemiológiai adatok bizonyítják, hogy az obesitas és a diabétesz jelenléte cirrózisos betegekben a betegség gyorsabb progressziójához vezet, függetlenül a májcirrózis etiológiájától, illetve a májbetegséggel összefüggő szövődmények, így a dekompenzációs események (nyelőcsővarix-vérzés, encephalopathia és ascites), a hospitalizáció és a HCC gyakoribb előfordulásához (23, 24).
A diabétesz diagnózisának kritériumai: 1) az éhomi glükóz ≥7 mmol/l, 2) OGTT során a 2 órás vércukorérték ≥11,1 mmol/l, 3) a HbA1c ≥6,5% vagy 4) random vércukorérték ≥11,1 mmol/l a hyperglykaemia tüneteivel vagy hyperglykaemiás krízissel (13). A diabétesz diagnózisának felállítását nehezítheti az OGTT és a HbA1c eredményeinek ellentmondása, különösen, ha a hypersplenia, a krónikus veseelégtelenség vagy egyéb társbetegség okozta anémia is észlelhető. Az ADA ajanlása szerint a kérdéses teszt ismétlése javasolt. Dekompenzált májcirrózisban számolnunk kell mérsékelt vagy súlyos fokú anémia előfordulásával a hypersplenia és portális hipertenzió következtében, különösen beszűkült veseműködés, illetve hepatorenális szindróma esetén, amely esetekben a HbA1c értéke a valósnál alacsonyabb, „fals normál” értéket ad.
A májcirrózisban észlelhető hypersplenia következtében fokozott vörösvértest-turnover észlelhető. Az ADA ajánlása szerint fokozott vörösvértest-turnoverrel járó állapotokban, így hypersplenia, hemolitikus anémia, közelmúltban történt transzfúzió, glükóz-6-foszfát-dehidrogenáz-deficiencia, erythropoesist stimuláló gyógyszerek, illetve krónikus veseelégtelenség esetén a diabétesz diagnózisát a vércukorértékek (éhgyomri, posztprandiális vagy OGTT) alapján kell felállítani. Az elsőként javasolt
diagnosztikus módszer az OGTT (17). A diabétesz fennállása májcirrózis esetén rosszabb prognózist jelent, és a megfelelő kezelés bevezetése az életminőség javítása mellett a hosszú távú túlélés szempontjából is kedvező lehet. Egy nemrég megjelent, nagy betegszámú kohorszvizsgálatban a MASLD-ben és diabetes mellitusban szenvedő betegek esetén GLP-1-RA alkalmazása szignifikánsan csökkentette a májfibrózis cirrózisba való progressziójának rizikóját, a szövődmények előfordulási gyakoriságát, valamint a mortalitást is. A GLP-1-RA-kezelés mortalitásra gyakorolt kedvező hatása azonban már fennálló májcirrózis esetén nem volt megfigyelhető, ami hangsúlyozza a kezelés időben történő bevezetésének fontosságát (25).
Az OGTT elvégzése prediabétesz esetén is hasznos lehet, amikor a mikrovaszkuláris és makrovaszkuláris szövődmények rizikója már magasabb. A prediabétesz jóval a májcirrózis kialakulása előtt jelen lehet, és hozzájárul a kedvezőtlen kimenetelhez, de gyakran aluldiagnosztizált MASLD esetén (26). A diabétesz előfordulását illetően pontos adatok nem állnak rendelkezésre, sajnos az alapellátásban ritkán történik OGTT szűrő jelleggel. Becsült adatok alapján a diabétesz prevalenciája májcirrózisban 15-30%, az eredményeket befolyásolja a diagnózis felállításának eszköze, maga a betegpopuláció (kompenzált vs. dekompenzált májcirrózis) és az ellátórendszer is (szekunder vagy tercier progresszivitási szintű intézmény) (27). Nishida 12 vizsgálat eredményeit összesítve 1747 májcirrózisos beteg adatait összegyűjtve a diabétesz gyakoriságát 35%-nak találta, míg csökkent glükóztolerancia 28%-ban fordult elő (28). A csökkent glükóztolerancia esetén nemcsak a későbbi diabétesz előfordulásának rizikója magasabb, hanem a kardiovaszkuláris rizikó is két-háromszorosra nő (29), a kardiovaszkuláris betegségek pedig a halálozás fő okai májcirrózis esetén is (9). Az izom- és máj-inzulinérzékenység általában csökken MASLD esetén, ami patofiziológiai alapot biztosít a diabétesz magas rizikójához ezen betegcsoportban, és a májbetegség progressziójával az inzulinrezisztencia is súlyosbodik (30). Számos májcirrózisos betegnek normál vagy közel normál tartományban van az éhgyomri vércukra, valamint a HbA1c szintje, tehát csak ezen paramétereket vizsgálva elmulaszthatjuk a diabétesz diagnózisát. A javasolt módszer tehát az OGTT, különösen pozitív családi anamnézis, centrális obesitas, illetve egyéb társuló metabolikus zavar esetén (13). A diabétesz diagnosztikus és kezelési algoritmusát májcirrózis esetén a 2. ábrán foglaltuk össze.
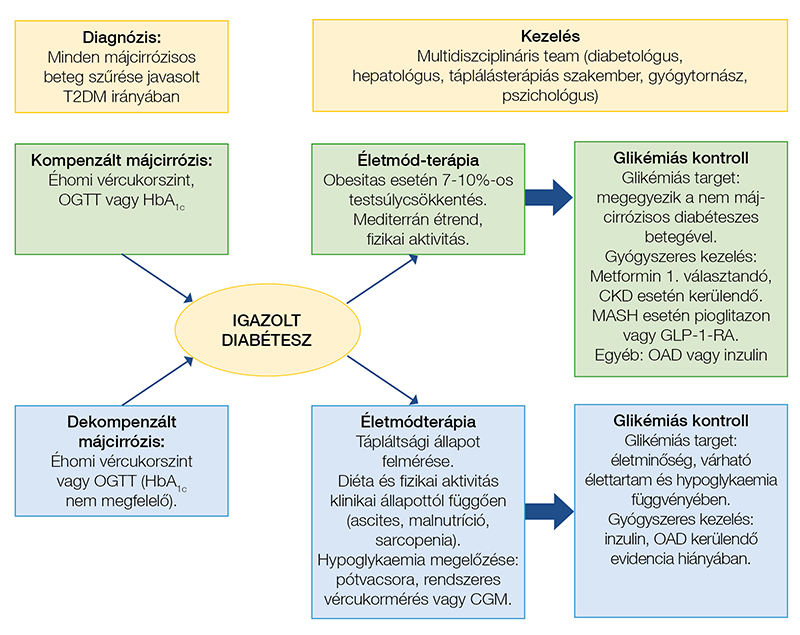
A diabetes mellitus kezelése májbetegség esetén
A glikémiás kontroll mértékét individuálisan kell meghatároznunk, figyelembe véve az életminőség, illetve a kezelés lehetséges mellékhatásainak szempontjait, a várható élettartamot, a diabétesz és a májbetegség szövődményeit. A diabéteszes májcirrózisos betegek gondozása multidiszciplináris szemléletet igényel, endokrinológus, hepatológus, táplálástudományi szakember közös feladata. Májcirrózis esetén gyakrabban kell számolnunk a hypoglykaemia előfordulásával, amelynek okait a 3. ábrán foglaltuk össze.
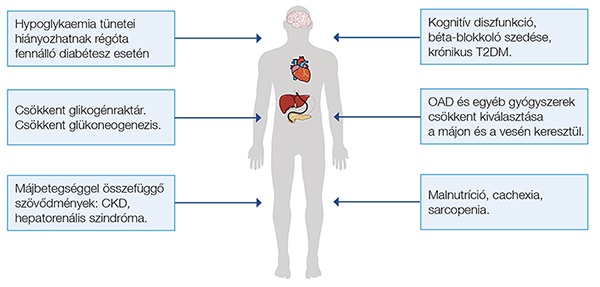
A hypoglykaemia kialakulásának rizikóját fokozza májbetegség esetén a gyakran előforduló malnutríció, a cachexia, a csökkent glikogénraktár, a sarcopenia és az egyéb társbetegségek (például szívelégtelenség vagy krónikus pancreatitis glükagondeficienciával). Beszűkült veseműködés esetén az inzulinclearance csökken, valamint az orális antidiabetikumok ürülése is elhúzódhat, kognitív diszfunkció esetén a hypoglykaemia korai tüneteit nem ismerik fel, egyes szedett gyógyszerek szintén fokozhatják a hypoglykaemia kockázatát (a béta-blokkolók csökkentik a hypoglykaemia okozta sympathicotoniát, így nehezítik a hypoglykaemia tüneteinek felismerését). A klinikusnak edukálnia kell a betegeket a hypoglykaemia fokozott rizikójáról, annak tüneteiről, a glükagon sürgősségi alkalmazhatóságáról, amely intramuszkuláris és nazális formában is elérhető. Kompenzált májcirrózis esetén az orális antidiabetikumok biztonságosan alkalmazhatóak. Korai stabil májcirrózis esetén, anémia és súlyos társbetegségek nélkül, a glikémiás targetek megegyeznek a májbetegség nélküli diabéteszes betegek célértékeivel. A 2023-as ADA-guideline szerint általánosságban a HbA1c <7% a célérték, ha ez szignifikáns hypoglykaemia nélkül elérhető. Limitált várható élettartam esetén kevésbé szigorú glikémiás kontroll szükséges, elegendő a HbA1c <8%. A HbA1c nem alkalmas a glükózanyagcsere variabilitásainak és a hypoglykaemiáknak a lekövetésére, amelyeknek különösen régóta fennálló T2DM, krónikus pancreatitis vagy súlyos inzulindeficiencia esetén van jelentőségük, ezekben az esetekben a folyamatos glükózmonitorozásnak (CGM) lehet szerepe a „time in range” (TIR), azaz a normoglikémiás állapotban eltöltött idő követésével. Dekompenzált májcirrózis, valamint középsúlyos, súlyos anémia esetén a HbA1c nem alkalmas a diabétesz követésére, a terápia monitorozására (hiszen tévesen „normál” értéket mutat). A fruktózamin meghatározása, amely az elmúlt 3 hét glükózanyagcseréjét jelzi, szintén korlátozott értékű, és fals normál értéket ad, ha a máj szintetizáló funkciója károsodott. Ezekben az esetekben az éhgyomri glükóz (4,4–7,2 mmol/l), a posztprandiális csúcsglükóz (<10,0 mmol/l) értéke, valamint a CGM alkalmas a terápia monitorozására (31). Hosszú távú követéses, kontrollált tanulmányok hiányában a glikémiás kontroll mértékének hatása nem ismert a májbetegség kimenetelére vagy az életminőségre, azonban jelentős szerepe lehet a diabéteszes mikrovaszkuláris szövődmények csökkentésében. A hyperglykaemia kedvezőtlenül befolyásolja a hepatocyták és a csillagsejtek működését, így a szoros glikémiás kontroll kedvező hatású lehet. A szoros glikémiás kontroll legfőbb limitáló tényezője a hypoglykaemia. A legtöbb új antidiabetikus készítmény biztonságosan alkalmazható kompenzált májcirrózisban, azonban dekompenzált cirrózisban nem vizsgálták ezen készítmények biztonságosságát (32). Inzulinkezeléssel összehasonlítva alacsonyabb a hypoglykaemia rizikója, így a jövőben biztonságos alkalmazhatóságuk bizonyítására további vizsgálatok szükségesek dekompenzált májcirrózisos betegek esetén.
Életmód-terápia
Kompenzált májcirrózis esetén az életmód-terápiát illető ajánlások megegyeznek a májbetegséggel nem rendelkező diabétesz esetén javasolt ajánlásokkal (33). Az életmódbeli változtatások alapja az egészséges étrend, a kalóriabevitel megszorítása és a fizikai aktivitás fokozása révén elért óvatos, 7-10%-os testsúlycsökkentés, amely a májenzimértékek és a szövettani eltérések javulását eredményezi. Az életmód-terápia célja a perifériás inzulinérzékenység fokozása, a hyperglykaemia okozta krónikus gyulladás és oxidatív stressz csökkentése, ezáltal a májbetegség progressziójának lassítása. Javasolt a mediterrán diéta, az alkoholfogyasztás kerülése, a kalóriabevitel megszorítása, a iatrogén hypoglykaemia elkerülése. A hypoglykaemia tüneteire a betegeket edukálni kell, valamint az éjszakai hypoglykaemia elkerülésére javasolt az esti snack fogyasztása. A megfelelő fehérjebevitel kiemelt fontosságú (legalább 1,2-1,5 g/kg/nap javasolt) a sarcopenia megelőzése céljából. A fizikai aktivitást illetően a heti 3-5 alkalommal végzett, összesen 150-200 perces közepes intenzitású aerob tréning javasolt. Dekompenzált májcirrózis esetén a betegek közel felében malnutríció, sarcopenia van jelen, amely a hipokalóriás étrend ellenjavallata (34). A terhelhetőség csökkenése, az ascites és az ödéma jelenléte szintén korlátozza a fizikai aktivitást ezen betegekben. Dekompenzált májcirrózisban javasolt a tápláltsági állapot felmérése, az izomerő vizsgálata, a száraz testtömegindex és testösszetétel meghatározása, amelyek figyelembe vételével individuálisan tervezendő az életmód-terápia táplálkozástudományi szakember és gyógytornász bevonásával. Malnutríció és sarcopenia esetén a táplálásterápia részeként szükséges orális vagy parenterális roborálás szintén multidiszciplináris megközelítést igényel (35).
Bariátriai sebészet
Az obesitas kezelésének egyik leghatékonyabb módszere a bariátriai sebészet, amely a diabétesz kontrolljára és a kardiovaszkuláris események rizikójára is kedvező hatást gyakorol (36). Bariátriai sebészet előtti és utáni biopsziás mintákban a szövettani eltérések, a steatohepatitis és fibrózis javulását írták le. A fibrózis regressziója a májbetegség szövődményeinek rizikóját csökkentheti, beleértve a HCC előfordulását és az összmortalitást is. Hosszú távú követéses vizsgálatok hiányában nem áll rendelkezésünkre pontos adat a testsúlycsökkentésnek a kimenetelre gyakorolt hatásairól. A bariátriai sebészeti beavatkozások biztonságosnak tekinthetőek, azonban a szövődmények előfordulásáról sem szabad megfeledkeznünk. A perioperatív mortalitás 0,03% és 0,2% között van (37). A kompenzált májcirrózisban elvégzett bariátriai műtét mortalitásának rizikója mérsékelten magasabb nem májcirrózisos betegekhez képest (0,9% vs. 0,3%), azonban szignifikánsan magasabb dekompenzált májcirrózisban (16,3%) (38). Számos tanulmány bizonyítja, hogy stabil, kompenzált májcirrózis esetén, megfelelően kiválasztott betegekben a bariátriai beavatkozás biztonságos, és a periprocedurális rizikó csekély emelkedésével kell számolnunk. A megfelelő bariátriai beavatkozás módját illetően azonban nincs konszenzus. Jól szelektált betegek esetén, kompenzált májcirrózisban, tapasztalt centrumban végzett bariátriai műtét kedvező hatású lehet megfontolt haszon-rizikó becslés után. Dekompenzált májcirrózisban nem javasolt bariátriai műtét elvégzése. További vizsgálatok szükségesek a bariátriai műtét típusának meghatározása, a testsúlycsökkentő beavatkozás klinikai hasznának bizonyítása és a megfelelő biztonságosság igazolása céljából.
Gyógyszeres kezelés
A gyógyszeres kezelést illetően az ajánlások alapvetően különböznek, attól függően, hogy kompenzált vagy dekompenzált májcirrózisról van-e szó. A májcirrózis korai stádiumaiban a kezelési lehetőségek hasonlóak a nem cirrózisos betegekéihez. Ezzel szemben dekompenzált májcirrózisban, különösen társbetegségek, szövődmények (mint pl. krónikus veseelégtelenség, hepatorenális szindróma, szívelégtelenség, ödéma, portális hipertenzió, ascites, hypersplenismus esetén kihívást jelent a diabétesz kezelése, továbbá nagy körültekintést és a szoros együttműködést igényel a diabetológussal. Az alábbiakban ismertetjük a különböző antidiabetikumok, illetve az inzulin alkalmazási lehetőségeit májbetegekben.
Metformin
Az életmód-terápia sikertelensége esetén elsőként választandó kezelési lehetőség a metformin kompenzált májcirrózis esetén. A metformin hatékonyan csökkenti az éhgyomri vércukorszintet a máj glükózkibocsátásának mérséklésével, valamint csökkenti az inzulinrezisztenciát is. A csökkent hepatikus laktátclearance és a gyakori kardiorenális komplikációk miatt azonban a metforminasszociált laktátacidózis fokozott rizikójával kell számolnunk. A biguanidok körültekintéssel alkalmazandóak májcirrózis esetén, Child B stádiumban és beszűkült veseműködés (GFR <60 ml/min/1,73 m2) esetén kerülendők, és dekompenzált májcirrózisban ellenjavalltak. Fontos tehát a májcirrózis súlyosságának (Child–Pugh-stádiumának) meghatározása és a veseműködés ellenőrzése metforminkezelés elkezdése előtt és a kezelés során. Számos randomizált, kontrollált vizsgálat bizonyította, hogy a metformin alkalmazása alacsonyabb HCC-rizikóval és alacsonyabb összmortalitással jár (39). Korábbi vizsgálatok bizonyították, hogy MASLD-betegekben a metforminkezelés a májban mérsékelte a steatosis mértékét és a gyulladás fokát, illetve a szérumtranszaminázok csökkentését idézte elő (40). Egy nemrég megjelent tanulmány eredményei szerint 212, T2DM- és Child–Pugh A stádiumú májcirrózisos beteg esetén a halálozás és a májtranszplantáció, az akut dekompenzáció és a HCC rizikója is alacsonyabb volt metforminkezelésben részesülő betegek esetén. A fentiek alapján továbbra is a metformin az elsőként választandó kezelés kompenzált májcirrózisos diabéteszes betegek esetén is.
Tiazolidindionok
A tiazolidindionok a peroxiszóma-proliferátor gamma-receptor-agonisták (PPAR-gamma) és inzulinszenzitizáló hatású gyógyszerek, amelyek közvetlenül nem fokozzák az inzulinszekréciót, így nem okoznak hypoglykaemiát. A tiazolidindionok kerülendők mérsékelt fokú és előrehaladott májcirrózisban, azonban korai májcirrózis esetén kedvező hatásúak lehetnek diabétesz esetén. A rosiglitazont és a troglitazont kivonták a forgalomból a potenciális májkárosító, valamint pangásos szívelégtelenséget és kardiovaszkuláris halálozást fokozó hatásuk miatt. A pioglitazont azonban beemelték az ajánlások közé a diabétesz kezelésére MASH esetén, májcirrózis nélkül (41). Májcirrózis esetén kevés adat áll rendelkezésünkre a pioglitazon alkalmazását illetően, és adása dekompenzált stádiumban ellenjavallt, tekintve, hogy a CYPC29, kisebb részben a CYP3A4 enzim által metabolizálódik. Egy, a közelmúltban megjelent tanulmányban, amely a májcirrózis incidenciáját vizsgálta 65 év feletti diabéteszes betegek esetén, a pioglitazont szedők között alacsonyabb volt a májcirrózis incidenciája a DPP4-gátló-, az SGLT2-gátló- és a GLP-1-RA-terápiában részesülőkhöz képest (42). További hosszú távú követéses vizsgálatok szükségesek a pioglitazon hatékonyságának és kimenetelre gyakorolt hatásának bizonyításához.
Szulfanilureák
A szulfanilureák különböző módon metabolizálódnak, részben a máj CYP450 enzimrendszerén (CYP450:2C9 izoenzimen), részben a vesén keresztül ürülnek. A hosszú hatású szulfanilureák (gliburid, glimepirid) féléletideje 9-10 óra, így a hypoglykaemia rizikója magasabb, különösen egyidejűleg fennálló veseelégtelenség esetén, tekintve hogy 50-60%-ban a vesén keresztül ürülnek. A rövidebb hatástartamú glipizid féléletideje 2-5 óra és elsősorban a májban metabolizálódik, mindössze kb. 10%-ban ürül a vesén, így biztonságosabb májbetegség esetén, különös beszűkült veseműködésnél (43). Kardiovaszkuláris események szempontjából a glimepirid alkalmazása nem növelte a rizikót, így ez a készítmény a legbiztonságosabb a szulfanilureák közül (44). A szulfanilureák a májban aktív és inaktív metabolitokká alakulnak a máj oxidatív enzimein (CYP450) keresztül, és fokozzák az inzulinszekréciót. A szulfanilureák erősen kötődnek plazmafehérjékhez, és túlnyomó részben a vesén keresztül ürülnek ki. A szulfanilureák inzulinelválasztást fokozó hatásuk miatt hypoglykaemiát okozhatnak, amely hatáshoz májbetegség esetén hozzájárul – az alacsony albuminszint következtében – a magasabb szabad gyógyszerszint, a károsodott glükoneogenezis, illetve súlyos májbetegség esetén a csökkent hepatikus inzulinclearance. Ha malnutríció is jelen van, a hypoglykaemizáló hatás még fokozottabb. A fentiek alapján a szulfanilureák ellenjavalltak májcirrózisos betegekben.
DPP4-gátlók
A DPP4-gátlók a GLP-1 lebontását végző dipeptidil-peptidáz-4 enzim gátlásával az inkretin hatást fokozzák, a vércukorszintet csökkentik, az inzulinelválasztást glükózdependens módon fokozzák, így nem hypoglykaemizálnak, és nem okoznak béta-sejt-depléciót. Per os alkalmazott készítmények, általában jól tolerálhatóak, azonban gyomor-bél rendszeri mellékhatások, hányinger, émelygés előfordulásával kell számolnunk, valamint hasnyálmirigy-daganat, illetve pancreatitis esetén kontraindikáltak. A sitagliptin és a vildagliptin a vesén keresztül választódik ki aktív tubuláris reszorpcióval. A linagliptin 80%-ban részt vesz az enterohepatikus körforgásban, így akár súlyos veseelégtelenség esetén is alkalmazható. A saxagliptin elsősorban a májban metabolizálódik a CYP3A4 és a CYP3A5 enzimeken keresztül, majd a vesén és a májon keresztül választódik ki. A DPP4-gátlók csökkentik a steatosis fokát a májban, amely elsősorban az anyagcsere-paraméterek kedvező változásának a következménye (45). A sitagliptin, a linagliptin és a saxagliptin dózismódosítás nélkül adható májbetegeknek. A vildagliptin kontraindikált, ha a normál érték felső határát háromszorosan meghaladó GPT-emelkedés észlelhető. A DPP4-gátlók Child–Pugh A és B stádiumban dózismódosítás nélkül adhatóak, azonban Child–Pugh C stádiumban kontraindikáltak.
GLP-1-RA-k
A GLP-1-receptor-analógok szubkután és már tabletta formájában is adható készítmények, jelentős testsúlycsökkentő és béta-sejt-protektív hatásúak, hypoglykaemiát nem okoznak. Alkalmazásukat limitálja a gyakran előforduló gasztrointesztinális mellékhatások, émelygés, hányinger jelentkezése. A GLP-1-RA-készítmények nem a májon keresztül metabolizálódnak, és az utóbbi években megjelent tanulmányok eredményei szerint csökkentik a májban a steatosis fokát, és a fibrózis progresszióját is lassítják T2DM-ben. A GLP-1-RA szerepét MASLD esetén számos kontrollált tanulmány igazolta, azonban májcirrózis esetén meglehetősen kevés adat áll rendelkezésünkre alkalmazhatóságukról. Egy 71, diabéteszes, NASH talaján kialakult májcirrózisos beteg bevonásával készült tanulmányban heti 2,4 mg semaglutid alkalmazása 48 hétig a testsúly szignifikáns csökkenését (−9 kg), a szérum-aminotranszferázok és a HbA1c szignifikáns csökkenését találták, azonban a steatohepatitis és a fibrózis mértéke nem változott a placebóhoz képest (46). Habár a kezelés biztonságos és jól tolerálható volt, alkalmazásukat limitálhatja az enyhe-középsúlyos gasztrointesztinális mellékhatások gyakori előfordulása. Májcirrózisos betegekben nem ritka a malnutríció, illetve a sarcopenia, amely esetekben a testsúlycsökkentés ellenjavallt, így a GLP-1-RA alkalmazása is kérdéses súlyos májbetegség esetén.
SGLT2-gátlók
Az SGLT2-gátlók az inzulinszekréciót nem befolyásolják, a vese proximális tubulusain elhelyezkedő nátrium-glükóz-kotranszporter-2 (SGLT2) reverzibilis gátlása révén fokozzák a glükózúriát. Az inzulinelválasztástól független hatásmechanizmusuknak köszönhetően a diabétesz korai és késői stádiumaiban is hatékonyak. Az SGLT2-gátlás révén fokozódik a glükózúria és a natriuresis, csökken a renin, angiotenzin II szekréció, ezáltal a só- és vízretenció, csökken az ödémakészség, és a vérnyomás is mérséklődik, ezenkívül a visceralis zsírszövet csökkentése révén testsúlycsökkentő hatással is bírnak. Az SGLT2-gátlók csökkentik az intraglomeruláris nyomást, az afferens arteriolák vazokonstrikcióját okozzák tubuloglomeruláris feedback mechanizmussal, és posztglomeruláris arteriola vazodilatációt eredményeznek, ezáltal renoprotektív hatásúak, továbbá a renális fibrózis mértékét is csökkentik. Kedvező kardiorenális hatásaik mellett számos tanulmány igazolta zsírmáj esetén a steatohepatitist mérséklő hatásukat, emellett a folyadéktúlterhelés mértéke is csökken, valamint előrehaladott májcirrózisban a kimenetel is javul. Az EFFECT-II-vizsgálatban a dapagliflozin és az omega-3 zsírsavak alkalmazása szignifikánsan csökkentette a máj zsírtartalmát, a dapagliflozin a gyulladásos markerekre és a májenzimértékekre is kedvező hatást gyakorolt (47). Az EMPA-REG OUTCOME-vizsgálat utólagos elemzése során a GPT-szint jelentősebb csökkenését figyelték meg a GOT-hoz képest, amely a MASLD javulására utalt (48). Habár a kedvező renális és hemodinamikai hatások miatt előnyös hatásúak a kimenetelre, májcirrózis esetén való alkalmazásuk további vizsgálatokat igényel. Egy tanulmányban 78, T2DM-es, döntően kompenzált májcirrózisos beteget vizsgálva az SGLT2-gátló 2 éves alkalmazása biztonságos volt, valamint az akut dekompenzáció és a mortalitás sem különbözött az epidemiológiai adatoktól. Egy követéses vizsgálatban 846 beteg esetén vizsgálták az SGLT2-gátlók és a DPP4-gátlók hatását (49). Az ascites előfordulása nem különbözött, azonban a halálozás alacsonyabb volt SGLT2-gátló-kezelés esetén (HR: 0,33; 95% Cl: 0,11–0,99; p<0,05). Hosszú távú követéses vizsgálatok szükségesek ahhoz, hogy az SGLT2-gátlók megtalálják helyüket májcirrózis esetén a diabétesz kezelésében.
Inzulin
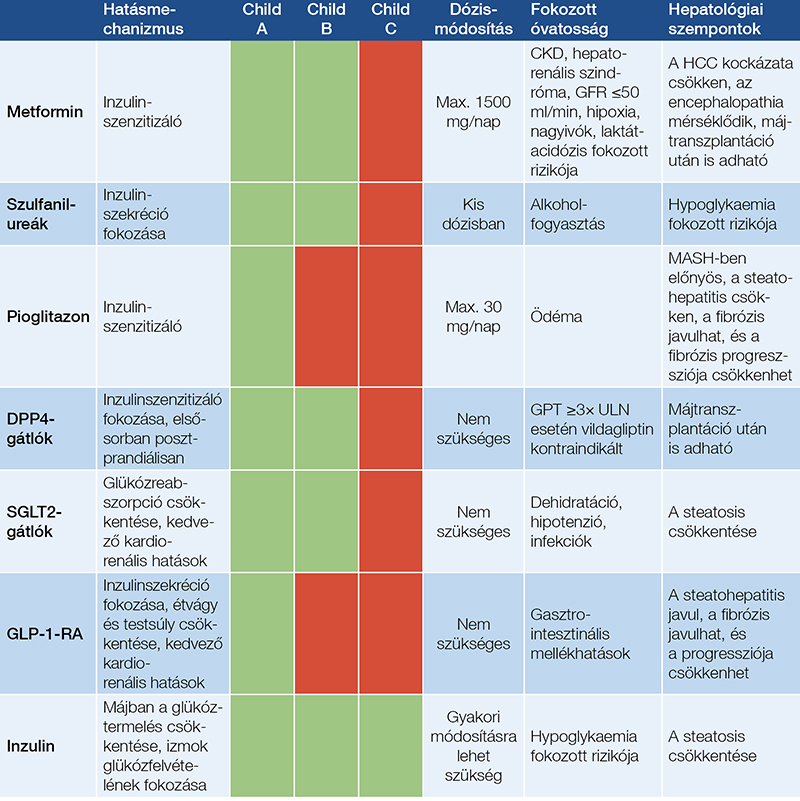
Az inzulin a legszélesebb körben alkalmazott kezelési mód májcirrózis és diabétesz együttes fennállása esetén, azonban alkalmazása körültekintést igényel a hypoglykaemia fokozott rizikója miatt. A perifériás inzulinrezisztencia és a hyperinsulinaemia gyakori szövődmény előrehaladott májfibrózis és cirrózis esetén. A hyperinsulinaemiáért a fokozott inzulinszekréciós ráta és a csökkent hepatikus clearance felelős. Ezenkívül dekompenzált májcirrózisban csökken a glükoneogenezis, csökken az inzulin lebontása, következésképpen fokozódik az inzulinrezisztencia, amely tényezők miatt az inzulinigény meghatározása nehézséget jelent exogén inzulinkezelés esetén. Kompenzált májcirrózis esetén az inzulinigény jelentős, hiszen a patomechanizmus szempontjából az inzulinrezisztencia a legmeghatározóbb. Dekompenzált májcirrózis esetén csökken az inzulinigény, mert az inzulin metabolizmusa lassul a májban. Az inzulinkezelés beállítása fekvőbeteg-ellátó intézményben javasolt, amely lehetővé teszi a vércukorszint szoros monitorozását és a hypoglykaemia rizikójának csökkentését. Figyelmet érdemel a nem szelektív béta-blokkolók széles körű alkalmazása májcirrózis esetén a portális hipertenzió csökkentésére és a nyelőcsővarix-vérzések megelőzésére. Nem szelektív béta-blokkoló-kezelés esetén a hypoglykaemia tünetszegény lehet, illetve súlyosabb tudatzavar alakulhat ki alarmtünetek nélkül. Egy tanulmányban nem szelektív béta-blokkoló-kezelésben részesülő és nem részesülő, diabéteszes májcirrózisos betegeket vizsgálva nem találtak szignifikáns különbséget a hypoglykaemia gyakorisága és súlyossága tekintetében. Ezek alapján a nem szelektív béta-blokkolók nem ellenjavalltak inzulinnal kezelt májcirrózisos betegekben sem. Hosszú távú követéses vizsgálatok, amelyek az inzulinkezelés kedvező hatását igazolnák a májbetegséggel összefüggő kimenetelre és a túlélésre vonatkozóan, máig hiányoznak. Egy tajvani munkacsoport kohorszvizsgálata az inzulin alkalmazásának kedvezőtlen hatását írta le, és megkérdőjelezte az inzulin alkalmazását májcirrózis esetén (50). T2DM-kompenzált májcirrózisos betegeket vizsgálva a halálozás, a májbetegséggel összefüggő szövődmények, a kardiovaszkuláris események, valamint a hypoglykaemia is gyakrabban fordult elő inzulinkezelésben nem részesülő betegekhez képest. Ezen provokatív eredmények szintén felhívják a figyelmet arra, hogy további vizsgálatok szükségesek kompenzált májcirrózis esetén a kimenetel becslésére inzulinkezelés esetén. Az ADA és az EASD közös ajánlása szerint májcirrózis esetén az elsőként választandó gyógyszer továbbra is az inzulin a diabétesz kezelésére. A hypoglykaemia fokozott rizikója miatt az ultragyors hatású inzulinok alkalmazása preferálandó. Az analóg gyors hatású inzulinkészítmények jobb glikémiás kontrollt biztosítanak a humán inzulinokhoz képest, valamint a hypoglykaemia kockázata is alacsonyabb. Az ajánlás szerint alacsony inzulindózisok alkalmazása, a vércukorszint szoros monitorozása és a gyakori dózismódosítás javasolt T2DM és májbetegség egyidejű fennállása esetén. A diabétesz kezelésében használt gyógyszerek fő hatástani csoportjainak jellemzőit az 1. táblázatban foglaltuk össze.
Összefoglalás
A diabétesz előfordulási gyakorisága májcirrózis esetén magas, és ez igaz fordítva is. A MASLD eredetű májcirrózis gyakori T2DM-betegekben. A májbetegség és diabétesz társulása azonban aluldiagnosztizált és alulkezelt világszerte. A diabéteszes betegek szisztematikus szűrése javasolt májfibrózis irányában noninvazív eszközökkel (FIB-4 index meghatározással és FIB-4 >1,3 érték esetén fibroscanvizsgálattal). A korai diagnózis és hepatológiai gondozásba vétel lehetőséget teremt a májcirrózissal összefüggő szövődmények kialakulásának megelőzésében. Effektív betegutak kidolgozása szükséges az alapellátás, az endokrinológiai és a hepatológiai szakellátás között. A megfelelő életmódbeli változtatások megvalósításához multidiszciplináris megközelítés szükséges. A diabetes mellitus kezelése krónikus májbetegségben komplex és kihívást jelentő feladat, részben a károsodott májfunkció, beszűkült veseműködés miatt, részben az antidiabetikumok potenciális májkárosító hatása miatt. A diabétesz esetén gyakoribbak a májbetegséggel összefüggő szövődmények, mind az akut dekompenzáció, mind a HCC és az összmortalitás is magasabb. Az EASL-EASD-EASO ajánlás szerint javasolt a MASLD, májcirrózisos betegek diabétesz irányú szűrése. Az antidiabetikus kezelés kiválasztása előtt fel kell mérni a májkárosodás súlyosságát, és meg kell határozni a Child–Pugh-stádiumot. A hospitalizációt igénylő májcirrózisos betegeknél a legbiztonságosabb és legegyszerűbb módszer az ingadozó vércukorértékek kezelésére az inzulinkezelés a vércukorszint szoros monitorozása mellett.
Rövidítések
- ADA = Amerikai Diabetes Társaság
- CLD = krónikus májbetegség
- CGM = folyamatos glükózmonitorozás (continuous glucose monitoring)
- CVD = kardiovaszkuláris betegség
- EASD = Európai Diabetes Társaság
- EASL = Európai Májkutató Társaság
- EASO = Európai Elhízástudományi Társaság
- HCC = hepatocelluláris karcinóma
- MASLD = metabolikus diszfunkcióval társult zsírmáj betegség
- MASH = metabolikus diszfunkcióval társult steatohepatitis
- IGT = csökkent glükóztolerancia (impaired glucose tolerance)
- IFG = emelkedett éhomi glükóz (impaired fasting glucose)
- OGTT = orális glükóztolerancia-teszt
- T2DM = 2-es típusú diabetes mellitus
- TIR = céltartományon belüli értékek aránya (time in range)
Irodalom
2. Younossi ZM, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol 2019; 71(4): 793–801.
https://doi.org/10.1016/j.jhep.2019.06.021
3. Cho NH, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045. Diabetes Res Clin Pract 2018; 138: 271–281. https://doi.org/10.1016/j.diabres.2018.02.023
4. Lee WG, Wells CI, McCall JL, Murphy R, Plank LD. Prevalence of diabetes in liver cirrhosis: A systematic review and meta-analysis. 2019; 35(6): e3157. John Wiley and Sons Ltd. https://doi.org/10.1002/dmrr.3157
5. Petit JM, et al. Impact of liver disease severity and etiology on the occurrence of diabetes mellitus in patients with liver cirrhosis. Acta Diabetol 2014; 51(3): 455–460.
https://doi.org/10.1007/s00592-013-0538-y
6. Goh GBB, Pan A, Chow WC, Yuan JM, Koh WP. Association between diabetes mellitus and cirrhosis mortality: the Singapore Chinese Health Study. Liver International 2017; 37(2): 251–258. https://doi.org/10.1111/liv.13241
7. Ginès P, et al. Population screening for liver fibrosis: Toward early diagnosis and intervention for chronic liver diseases. Hepatology 2022 Jan; 75(1): 219–228. https://doi.org/10.1002/hep.32163
8. Lee SB, et al. Association between non-alcoholic fatty liver disease and subclinical coronary atherosclerosis: An observational cohort study. J Hepatol 2018; 68(5): 1018–1024. https://doi.org/10.1016/j.jhep.2017.12.012
9. Shang Y, Nasr P, Widman L, Hagström H. Risk of cardiovascular disease and loss in life expectancy in NAFLD. Hepatology 2022; 76(5): 1495–1505.
https://doi.org/10.1002/hep.32519
10. Perseghin G, et al. Contribution of Reduced Insulin Sensitivity and Secretion to the Pathogenesis of Hepatogenous Diabetes: Effect of Liver Transplantation. Hepatology 2000 Mar; 31(3): 694–703.
https://doi.org/10.1002/hep.510310320
11. Gastaldelli A, Cusi K. From NASH to diabetes and from diabetes to NASH: Mechanisms and treatment options. JHEP Rep 2019 Jul 19; 1(4): 312–328. https://doi.org/10.1016/j.jhepr.2019.07.002
12. Bril F, et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology 2014; 59(6): 2178–2187. https://doi.org/10.1002/hep.26988
13. Elsayed NA, et al. 4. Comprehensive Medical Evaluation and Assessment of Comorbidities: Standards of Care in Diabetes – 2023. Diabetes Care 2023; 46: S49–S67. https://doi.org/10.2337/dc23-S004
14. Cusi K. The role of adipose tissue and lipotoxicity in the pathogenesis of type 2 diabetes. Curr Diab Rep 2010 Aug; 10(4): 306–15.
https://doi.org/10.1007/s11892-010-0122-6
15. Zambon Azevedo V, Silaghi CA, Maurel T, Silaghi H, Ratziu V, Pais R. Impact of Sarcopenia on the Severity of the Liver Damage in Patients With Non-alcoholic Fatty Liver Disease. Front Nutr 2022 Jan 17; 8: 774030.
https://doi.org/10.3389/fnut.2021.774030
16. Schuppan D, Surabattula R, Wang XY. Determinants of fibrosis progression and regression in NASH. J Hepatol 2018 Feb; 68(2): 238–250.
https://doi.org/10.1016/j.jhep.2017.11.012
17. Fromenty B, Roden M. Mitochondrial alterations in fatty liver diseases. J Hepatol 2023 Feb; 78(2): 415–429.
https://doi.org/10.1016/j.jhep.2022.09.020
18. Patterson RE, et al. Lipotoxicity in steatohepatitis occurs despite an increase in tricarboxylic acid cycle activity. Am J Physiol Endocrinol Metab 2016; 310: 484–494. https://doi.org/10.1152/ajpendo.00492.2015
19. Straub LG, Scherer PE. Metabolic Messengers: adiponectin. Nat Metab 2019; 1(3): 334–339. https://doi.org/10.1038/s42255-019-0041-z
20. Marchesini G, et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64(6): 1388–1402. https://doi.org/10.1016/j.jhep.2015.11.004
21. Elsayed NA, et al. 4. Comprehensive Medical Evaluation and Assessment of Comorbidities: Standards of Care in Diabetes – 2023. Diabetes Care 2023; 46: S49–S67. https://doi.org/10.2337/dc23-S004
22. Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet 2017 Jun 3; 389(10085): 2239–2251. https://doi.org/10.1016/S0140-6736(17)30058-2
23. Liu TL, Trogdon J, Weinberger M, Fried B, Barritt AS. Diabetes Is Associated with Clinical Decompensation Events in Patients with Cirrhosis. Dig Dis Sci 2016; 61(11): 3335–3345. https://doi.org/10.1007/s10620-016-4261-8
24. Chung W, Promrat K, Wands J. Clinical implications, diagnosis, and management of diabetes in patients with chronic liver diseases. World J Hepatol 2020; 12(9): 533–557.
https://doi.org/10.4254/WJH.V12.I9.533
25. Kanwal F, Kramer JR, Li L, et al. GLP-1 Receptor Agonists and Risk for Cirrhosis and Related Complications in Patients With Metabolic Dysfunction-Associated Steatotic Liver Disease. JAMA Intern Med 2024; 184(11): 1314–1323. https://doi.org/10.1001/jamainternmed.2024.4661
26. Ortiz-Lopez C, et al. Prevalence of prediabetes and diabetes and metabolic profile of patients with Nonalcoholic Fatty Liver Disease (NAFLD). Diabetes Care 2012; 35(4): 873–878. https://doi.org/10.2337/dc11-1849
27. Coman LI, Coman OA, Bădărău IA, Păunescu H, Ciocîrlan M. Association between liver cirrhosis and diabetes mellitus: A review on hepatic outcomes. J Clin Med 2021 Jan 12; 10(2): 262.
https://doi.org/10.3390/jcm10020262
28. Nishida T. Diagnosis and clinical implications of diabetes in liver cirrhosis: A focus on the oral glucose tolerance test. J Endocr Soc 2017; 1(7): 886–896. https://doi.org/10.1210/js.2017-00183
29. Gujral UP, et al. Association between varying cut-points of intermediate hyperglycemia and risk of mortality, cardiovascular events and chronic kidney disease: A systematic review and meta-analysis. BMJ Open Diabetes Res Care 2021; 9(1): e001776. https://doi.org/10.1136/bmjdrc-2020-001776
30. Park SK, Seo MH, Shin HC, Ryoo JH. Clinical availability of nonalcoholic fatty liver disease as an early predictor of type 2 diabetes mellitus in korean men: 5-year prospective cohort study. Hepatology 2013; 57(4): 1378–1383. https://doi.org/10.1002/hep.26183
31. Bergman M, et al. Review of methods for detecting glycemic disorders. Diabetes Res Clin Pract 2020 Jul; 165: 108233. https://doi.org/10.1016/j.diabres.2020.108233
32. Cusi K, et al. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocrine Practice 2022; 28(5): 528–562. https://doi.org/10.1016/j.eprac.2022.03.010
33. Rinella ME, et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology 2023; 77(5): 1797–1835. https://doi.org/10.1097/HEP.0000000000000323
34. Merli M, et al. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol 2019; 70(1): 172–193. https://doi.org/10.1016/j.jhep.2018.06.024
35. Garcia-Pagan JC, Francoz C, Montagnese S, Senzolo M, Mookerjee RP. Management of the major complications of cirrhosis: Beyond guidelines. J Hepatol 2021 Jul: 75(Suppl 1): S135–S146. https://doi.org/10.1016/j.jhep.2021.01.027
36. Aminian A, et al. Association of Bariatric Surgery with Major Adverse Liver and Cardiovascular Outcomes in Patients with Biopsy-Proven Nonalcoholic Steatohepatitis. JAMA 2021; 326(20): 2031–2042. https://doi.org/10.1001/jama.2021.19569
37. Arterburn DE, Telem DA, Kushner RF, Courcoulas AP. Benefits and Risks of Bariatric Surgery in Adults: A Review. JAMA 2020 Sep 1; 324(9): 879–887. https://doi.org/10.1001/jama.2020.12567
38. Patton H, Heimbach J, McCullough A. AGA Clinical Practice Update on Bariatric Surgery in Cirrhosis: Expert Review. Clinical Gastroenterology and Hepatology 2021; 19(3): 436–445. https://doi.org/10.1016/j.cgh.2020.10.034
39. Vilar-Gomez E, et al. Long-term metformin use may improve clinical outcomes in diabetic patients with non-alcoholic steatohepatitis and bridging fibrosis or compensated cirrhosis. Aliment Pharmacol Ther 2019; 50(3): 317–328. https://doi.org/10.1111/apt.15331
40. Haukeland JW, et al. Metformin in patients with non-alcoholic fatty liver disease: A randomized, controlled trial. Scand J Gastroenterol 2009; 44(7): 853–860. https://doi.org/10.1080/00365520902845268
41. Younossi ZM, Golabi P, Paik JM, Henry A, Van Dongen C, Henry L. The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology 2023; 77(4): 1335–1347. https://doi.org/10.1097/HEP.0000000000000004
42. Yang JY, et al. Newer second-line glucose-lowering drugs versus thiazolidinediones on cirrhosis risk among older US adult patients with type 2 diabetes. J Diabetes Complications 2020; 34(11): 107706. https://doi.org/10.1016/j.jdiacomp.2020.107706
43. Hahr AJ, Molitch ME. Management of Diabetes Mellitus in Patients With CKD: Core Curriculum 2022. Am J Kidney Dis 2022 May; 79(5): 728–736. https://doi.org/10.1053/j.ajkd.2021.05.023
44. Huang HK, Yeh JI. Comparison of mortality and cardiovascular event risk associated with various insulin secretagogues: A nationwide real-world analysis. Diabetes Res Clin Pract 2019; 152: 103–110. https://doi.org/10.1016/j.diabres.2019.04.032
45. Rosenstock J, et al. Effect of Linagliptin vs Glimepiride on Major Adverse Cardiovascular Outcomes in Patients with Type 2 Diabetes: The CAROLINA Randomized Clinical Trial. JAMA 2019; 322(12): 1155–1166. https://doi.org/10.1001/jama.2019.13772
46. Loomba R, et al. Semaglutide 2·4 mg once weekly in patients with non-alcoholic steatohepatitis-related cirrhosis: a randomised, placebo-controlled phase 2 trial. Lancet Gastroenterol Hepatol 2023; 8(6): 511–522. https://doi.org/10.1016/S2468-1253(23)00068-7
47. Eriksson JW, et al. Effects of dapagliflozin and n-3 carboxylic acids on non-alcoholic fatty liver disease in people with type 2 diabetes: a double-blind randomised placebo-controlled study. Diabetologia 2018; 61(9): 1923–1934. https://doi.org/10.1007/s00125-018-4675-2
48. Sattar N, Fitchett D, Hantel S, George JT, Zinman B. Empagliflozin is associated with improvements in liver enzymes potentially consistent with reductions in liver fat: results from randomised trials including the EMPA-REG OUTCOME® trial. Diabetologia 2018; 61(10): 2155–2163. https://doi.org/10.1007/s00125-018-4702-3
49. Saffo S, et al. Impact of SGLT2 inhibitors in comparison with DPP4 inhibitors on ascites and death in veterans with cirrhosis on metformin. Diabetes Obes Metab 2021; 23(10): 2402–2408. https://doi.org/10.1111/dom.14488
50. Yen FS, et al. Is insulin the preferred treatment in persons with type 2 diabetes and liver cirrhosis? BMC Gastroenterol 2021; 21(1): 263. https://doi.org/10.1186/s12876-021-01773-x
