Original publication
Effectiveness and safety of darvadstrocel treatment in perianal fistulizing Crohn’s disease
Summary
Background: Perianal fistulas of Crohn’s disease (CD) create a significant burden on patient lives. However, the efficacy and safety of adipose-derived mesenchymal stem cell treatment are contradicting, and real-world evidence is lacking. We aimed to examine the usability of darvadstrocel therapy in managing perianal CD.
Methods: In this retrospective multicenter study, CD patients with perianal fistulas were enrolled and followed. The primary outcome was perianal clinical remission (all treated fistulas have closed) at weeks 26 and 52, while the secondary outcomes were clinical response rates (≥1 fistulas have closed), perianal activity (PDAI), patient satisfaction, and adverse events. The data was recorded at the baseline and weeks 12, 26, and 52. Prediction of primary outcomes was performed by logistic regression.
Results: Overall, based on the data of 223 patients (male/female ratio: 0.48), perianal clinical remission was achieved in 78.2% and 62.3% until week 26 and 52, whereas baseline PDAI score (OR: 0.75), number of fistulas (OR: 0.28), and the number of weeks after preparation for surgery (OR: 0.98) were associated with treatment failure. The clinical response rates were 84.8% and 79.8% at week 26 and 52. Moreover, the improvement of subjective perianal symptoms was achieved in 77.8% and 78.4% of the patients, respectively. Adverse events occurred in 13.5% of the patients, with perianal abscesses and proctalgia reported the most.
Conclusion: Effectiveness data are higher than the clinical trials. The safety profile is reassuring, and patients’ satisfaction is high. Appropriate patient selection, fistula preparation, and expertise may help to achieve treatment success.
Összefoglaló
Bevezetés: A perianális, fisztulázó Crohn-betegség (PFCD) rendkívül nagy terhet jelent a betegek életében. A mesenchymalis őssejtkezelés hatékonysága és biztonságossága ellentmondásos, és hiányoznak a valós életből származó evidenciák. Vizsgálatunk célja a darvadstrocel terápia alkalmazhatóságának vizsgálata volt a PFCD kezelésében.
Módszerek: Retrospektív, multicentrikus vizsgálatunkba perianális fisztulával rendelkező, Crohn-betegségben szenvedő résztvevőket vontunk be; az utánkövetés minimum 6 és maximum 12 hónap volt. Elsődleges kimenetelként elemeztük a perianális klinikai remisszió (az összes kezelt fisztula záródása) arányát a 26. és az 52. héten, míg a másodlagos kimenetel a klinikai válasz aránya (≥1 záródott, kezelt fisztula), a perianális aktivitás (PDAI), a betegelégedettség és a nemkívánatos események megjelenése volt. Az adatokat bevonáskor, valamint a 26. és az 52. héten gyűjtöttük. A hatékonyságot jellemző kimenetelek predikciójához logisztikus regressziós analízist végeztünk.
Eredmények: Összesen 223 beteg adatai alapján (férfi/nő arány 0,48) a perianális klinikai remisszió aránya 78,2% és 62,3% volt a 26. és az 52. héten, míg a kiindulási PDAI pontszám (OR: 0,75), a fisztulák száma (OR: 0,28) és a műtétek között eltelt idő (OR: 0,98) a kezelés sikertelenségével volt összefüggésben. A klinikai válasz aránya 84,4% és 79,8% volt a 26. és az 52. héten. Továbbá a betegek 77,8%-a és 78,4%-a tapasztalta a szubjektív perianális tünetek javulását a 26. és az 52. héten mért adatok alapján. Nemkívánatos események a betegek 13,5%-ánál jelentkeztek: leggyakrabban perianális tályogot és proctalgiát rögzítettek.
Következtetés: A hatékonysági adatok vizsgálatunkban magasabbak, mint a klinikai vizsgálatok adatai. A biztonsági profil megnyugtató és a betegek elégedettsége magas. A megfelelő betegkiválasztás és a sebészi tapasztalat segíthet a sikeres kezelés elérésében.
Bevezetés
A Crohn-betegség (CD) a szervezet idült, immunmediált, ismeretlen etiológiájú megbetegedése, amelynek betegséglefolyása során az extraintestinalis tüneteken túl különböző méretű fekélyes léziók, penetráló, illetve szűkületet okozó szövődmények jelenhetnek meg az emésztőtraktusban, valamint a perianális fisztulák kialakulása tovább ronthatja a betegek életminőségét. Emiatt a betegség rendkívül nagy terhet ró az egészségügyi ellátórendszerre (1).
A Crohn-betegségben szenvedők 10–26%-ánál jelenik meg perianális fisztula a betegséglefolyás során (PFCD, perianal fistulizing Crohn’s disease) (2–4). A perianális fisztulák kapcsolatot teremtenek a perianális bőrfelszín és az anális csatorna vagy a rectum között, és gyakran tályogot drenálnak, így a fenotípus kezelése rendkívül nehéz (3, 5). Ennek hátterében az áll, hogy a CD gyulladásos mechanizmusai a citokineken keresztül a mátrix-metalloproteázok expanzióját és a hámsejtréteg gyengülését okozzák, amelyek így epithelialis-mesenchymalis tranzícióhoz és fisztulaképződéshez vezetnek (5).
A PFCD-ben szenvedő betegek életminősége a luminalis tünetek mellett jelenlévő, a perianális tünetekből fakadó korlátozottság miatt általánosságban rossz; kezelésük nehéz és költséges, a gyógyulás pedig időigényes és gyakran részleges, vagy csak átmeneti (5, 6).
A PFCD kezelése multidiszciplináris szemléletet igényel: szükséges kolorektális sebészt, gasztroenterológust és radiológust bevonni a döntéshozatalba. Az Európai Crohn és Colitis Társaság ajánlása alapján teljes fisztulazáródás anti-TNF alkalmazásával érhető el a legnagyobb eséllyel (infliximab vagy adalimumab), míg az antibiotikus monoterápia vagy a szisztémás immunszuppresszió mellett nem áll rendelkezésre elegendő evidencia (7).
A gyógyszeres kezelések sikertelensége esetén több sebészeti módszer alkalmazható. Válogatott esetekben a fisztulák zárhatók előretolt lebenyképzéssel, az intersphinctericus nyílás zárásával (LIFT), fibrinragasztóval vagy fisztuladugóval, míg a nem felszívódó, „seton” fonallal történő drenázs minden esetben javasolt (7, 8). A sebészeti eljárások sokszínűségének ellenére a refrakter betegség előfordulása, valamint a szövődményráta továbbra is magas (8).
Az ADMIRE-CD klinikai vizsgálat igazolta az MSC-kezelés hatékonyságát (darvadstrocel) és biztonságosságát PFCD-ben szenvedő betegeknél (9). A placebokontrollált, multicentrikus, randomizált, kettős vak vizsgálatban először 24 héten át, majd ezután újabb 104 héten át követték a pácienseket. A kezelt betegek 51,5%-a, míg a placebocsoport (tagjai csak sebészeti kezelést kaptak) 35,6%-a mutatott kombinált klinikai és radiológiai remissziót. A biztató eredmények mellett nagy arányban jelentek meg adverz eseményként anális tályogok és proctalgia (9–11). Habár a klinikai vizsgálatok metaanalízisének adatai az MSC-kezelés hatékonyságát és bizonságosságát mutatják, kevés a való életből származó eredmény (11–13). Továbbá egy közelmúltban záródott, globális, randomizált, kontrollált vizsgálat (ADMIRE-
CD-II) eredményei nem igazolták a darvadstrocelkezelés szuperioritását a placebóval kombinált sebészeti kezeléssel szemben, így felmerül az MSC-kezelés kérdéses szerepe a PFCD kezelésében (14). Továbbá a kezelés pozícionálásához szükséges, való életből származó adatok csaknem hiányoznak (15–17).
Összegezve: a jelenleg rendelkezésre álló evidenciák ellentmondásosak a darvadstrocelkezelés alkalmazhatóságával kapcsolatban. Emiatt vizsgálatunk célja volt a darvadstrocelkezelés hosszú távú hatékonyságának és biztonságosságának vizsgálata PFCD-ben, valós, klinikai multicentrikus környezetben.
Anyagok és módszerek
Elrendezés és résztvevők
Jelen retrospektív, multicentrikus kohorszvizsgálatot három ország (Izrael, Csehország és Magyarország) hat, tercier IBD-centrumában végeztük. Olyan, Crohn-betegségben szenvedő felnőtteket (≥18 éves) vontunk be konszekutív módon, akik 2019. január 1. és 2023. szeptember 30. között MSC-kezelésben (darvadstrocel) részesültek a hagyományos kezelésre refrakter (a fisztuladrenázs és a farmakoterápia hatástalansága, beleértve a betegbevonást megelőző 6 héten belül bármilyen biológiai kezelést) PFCD (≤2 belső és ≤3 külső nyílás) miatt. Alapvonalként definiáltuk az MSC-kezelés alkalmazásának napját, míg az utánkövetést legalább 6 és legfeljebb 12 hónapig végeztük. Kizárási kritériumot jelentett a mérsékelt vagy súlyos luminalis aktivitás (CDAI ≥220) (18), aktív CD a végbélben, >2 cm intraabdominalis tályog, egyidejűleg fennálló rectovaginalis fisztula vagy deviáló sztóma, rektális vagy anális szűkület és sebészi beavatkozás (kivéve a peri-
anális sipolyok tekintetében a sebészeti/setondrenázs).
A vizsgálat eredményeinek bemutatása a STROBE-ajánlás szerint történik (19). Valamennyi beteg írásbeli, tájékozott beleegyezését adta a rendszeres egészségügyi ellátáshoz és a darvadstrocelkezeléshez.
A darvadstrocel alkalmazása
A darvadstrocelt a fisztulajáratok alapos kürettjét követően és a seton revíziója után intralézionális injekció formában szükséges alkalmazni a gyártó ajánlásainak megfelelően. A beavatkozás során a belső nyílások öltéssel való zárása után 120 millió őssejtet (5 millió sejt/ml) injektáltunk a fisztulajáratok falába. A vizsgálatban részt vevő centrumok, valamint a betegeket ellátó sebészek részt vettek az ADMIRE-vizsgálatban, azonban a betegbeválasztásnak nem volt feltétele az ADMIRE-tanulmányban való részvétel.
Adatgyűjtés
A kórházi medikai rendszerekben elérhető ambuláns lapok, zárójelentések és leletek felhasználásával az adatokat egységes adatbázisba gyűjtöttük, majd anonim módon elemeztük. Az MSC-kezelést megelőzően a betegek egy preparációs műtéten estek át, amely során a sipolyjáratokat kürettálták és járatokat nem felszívódó „seton” fonalakkal zárták. A demográfiai adatokat (életkor, nem, születési dátum, életkor a diagnóziskor), a klinikai adatokat (a betegség lokalizációja a Montreal-osztályzás (20) alapján, a korábbi gyógyszerek, a jelenlegi gyógyszerek, a korábbi műtétek) és az MSC műtéti adatokat a betegbevonás időpontjában rögzítettük, míg a perianális betegség aktivitási adatait a bevonáskor, majd a 12., a 26. és az 52. héten (ha rendelkezésre állt) mértük. A vizsgálati elrendezés miatt az adatgyűjtés időpontja a referenciaidőpontot megelőző/követő egy héten volt lehetséges, a reguláris megjelenések alkalmával.
A perianális betegség leírására a Parks-féle sipolyosztályzást alkalmaztuk (21). A luminalis klinikai aktivitást a CDAI (≥150) pontszámmal, az endoszkópos aktivitást a SES-CD-vel (≥3) (22), míg a perianális panaszokat a PDAI-pontszámmal objektivizáltuk (23). A betegek CRP-szintjét, a módosított Van Assche-indexet (24) (ha MRI-felvétel rendelkezésre állt), valamint a betegek elégedettségét egy hárompontos Likert-skála segítségével (25) (javult, nem változott, romlott) mértük a 12., a 26. és az 52. héten. Szintén rögzítettük az időfüggő változókat, mint például a nemkívánatos eseményeket (AE), a kezelés után újból megnyíló fisztulákat, illetve a kezelés után fellépő anális szűkületet. Az adatgyűjtést 2024. február 1. és április 30. között végeztük.
Kimenetelek és definíciók
A vizsgálat elsődleges kimenetele a 26. és az 52. héten mért perianális klinikai remisszió volt, amelyet a gasztroenterológus és/vagy a kolorektális sebész határozott meg a kezelt fisztulák valamennyi külső nyílásának záródása esetén. Másodlagos kimenetelként elemeztük a 26. és az 52. héten mért klinikai válasz arányát, amennyiben a kezelt sipolyok legalább egy külső nyílása bezáródott az értékelő véleménye alapján. A kezelés sikertelenségét akkor határoztuk meg, ha egyetlen kezelt sipolyjárat sem záródott be a kezelés után. Harmadlagos kimenetelként határoztuk meg a 12., a 26. és az 52. héten a perianális klinikai aktivitási arányokat (a >4-es PDAI-pontszámmal definiálva [26]), a betegek elégedettségét, valamint a kórházi kezeléseket igénylő AE-k megjelenését (gyakoriság/100 betegév alapján). Alcsoportelemzést is végeztünk az elsődleges eredmények tekintetében a résztvevő centrum betegforgalmát figyelembe véve (>100 kezelt eset).
Statisztikai analízis
Statisztikai erő számításra nem volt mód, hiszen az összes alkalmas beteget bevontuk és elemeztük, míg kontrollcsoport nem állt rendelkezésre; így elemszámbecslés sem történt. A folytonos változókat átlag és szórás vagy medián és interkvartilis terjedelem (IQR), míg a kategorikus változókat gyakoriság (%) formájában közöltük. A normalitást vizuális eszközök (hisztogramok és Q-Q plot) segítségével vizsgáltuk. A hipotézisvizsgálatokat kategorikus változók esetén khi-négyzet-teszt vagy Fisher-féle egzakt teszt segítségével, míg a folytonos változókat független mintás t-tesztekkel hasonlítottuk össze. Az elsődleges és a másodlagos kimenetelekkel összefüggő potenciális kovariánsokat és zavaró tényezőket egyváltozós és többváltozós logisztikus regressziós modellek segítségével elemeztük. Az egyváltozós elemzésben szereplő, <0,15 p-értékkel rendelkező változókat vontuk be a többváltozós elemzésbe. A végleges többváltozós modelleket a valószínűségi arányok „forward” szelekciójával kaptuk. A regressziós analízisek illeszkedésének minőségét a Hosmer–Lemeshow-teszttel és a Nagelkerke R2-tel számoltuk, míg az adverz események időbeli jellemzőinek meghatározására a Kaplan–Meier-féle túlélési görbéket használtuk log-rank teszttel. Cox-féle regressziós modelleket is készítettünk az AE-kel összefüggő kovariánsok vizsgálatára. Az eredmények vizsgálatakor az elemzést az elérhető betegadatokkal végeztük el, míg a többszörös összehasonlítás torzításának csökkentésére Bonferroni-korrekciót alkalmaztuk. A kétoldalas <0,05 p-értéket tekintettük szignifikánsnak. A statisztikai elemzést az IBM SPSS szoftver (Windows. 29.0 verzió, IBM Corp., Armonk, NY) segítségével végeztük.
Etikai engedély
A tanulmányt a Nemzeti Népegészségügyi és Gyógyszerészeti Központ hagyta jóvá az Egészségügyi Tudományos Tanács Tudományos Kutatásetikai Bizottságának javaslata alapján (nyilvántartási szám: NNGYK/GYSZ/12796-4/2024). A vizsgálatot a Helsinki Nyilatkozat elvei szerint végeztük (Helsinki Nyilatkozat 1975, 6. felülvizsgálat, 2008). A résztvevő centrumok esetében a helyi etikai bizottságok hagyták jóvá a kutatást. Valamennyi beteg írásbeli beleegyezését adta az egészségügyi ellátáshoz és darvadstrocelkezeléshez.
Eredmények
Populációs jellemzők
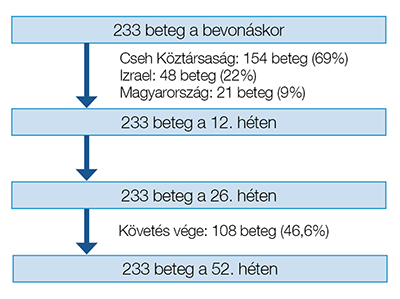
Összesen 223 fő, CD-ben szenvedő beteg adatait elemeztük (férfi/nő arány 0,48); az utánkövetési idő mediánja 51,9 hét (IQR: 48–53) volt. A betegek 69%-át (154/223), 22%-át (48/223) és 9%-át (21/223) a Cseh Köztársaság, Izrael és Magyarország centrumaiban kezelték. A bevonáskor a medián életkor 39 év (IQR: 33–49) és a betegségük medián időtartama 13 év (IQR: 7–21) volt. A betegek körülbelül háromnegyede (75,7%) nem dohányzott. Összesen a páciensek 69,1%-át nagy betegforgalmú tercier központban kezelték. A betegbevonás és utánkövetés folyamatábrája az 1. ábrán látható.
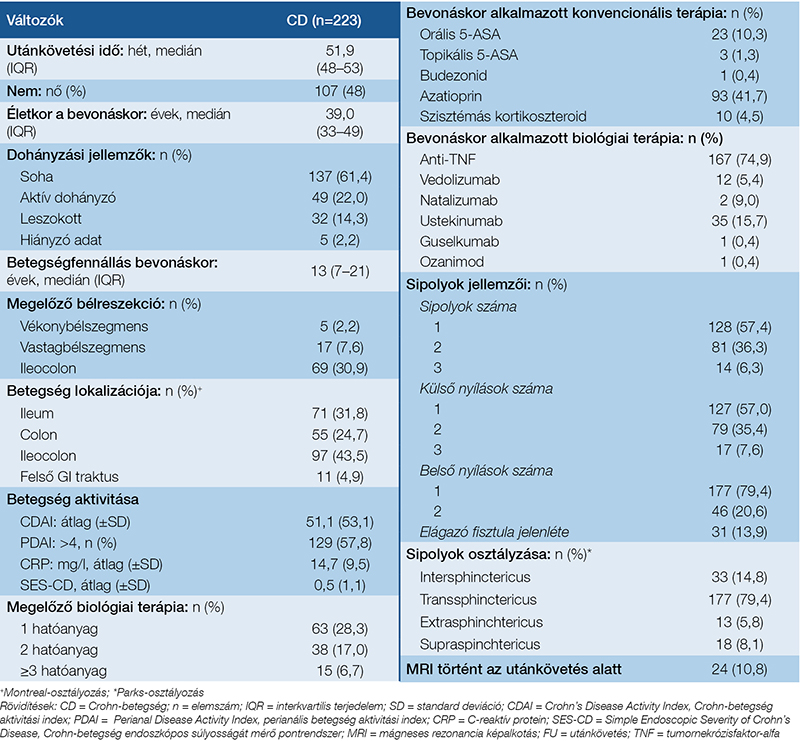
A leggyakoribb lokalizáció az ileocolon (43,5%) volt, és a betegek 40,7%-a korábban már átesett bélreszekción. A kohorsz többsége (91,5%) a kiindulási időpontban klinikai remisszióban volt. Emellett a betegek 41,7%-ánál alkalmaztak immunmodulátort, míg több mint háromnegyedük anti-TNF-kezelésben részesült. A betegek 57,4%-ának felvételkor egy sipolyjárata volt; a sipolyjáratok többsége transsphinctericus lokalizációjú volt. Elágazó sipolyjáratokat az esetek 13,9%-ában regisztráltak. A betegek több mint felénél a PDAI-pontszám <4 volt (57,8%). A klinikai és demográfiai alap adatokat az 1. táblázat tartalmazza.
Hatékonyság és predikció
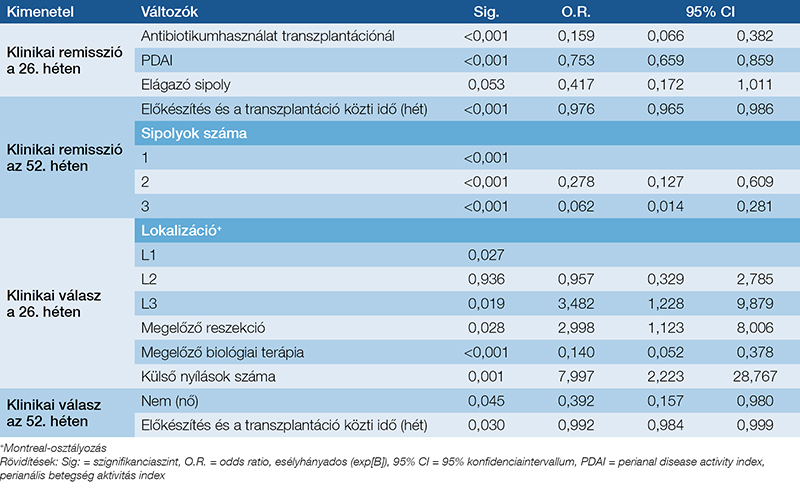
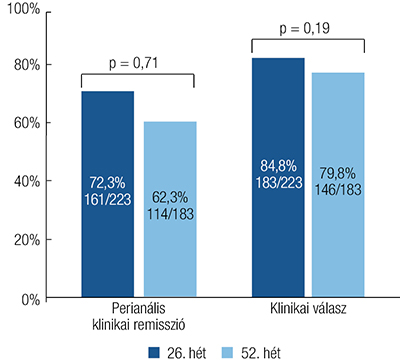
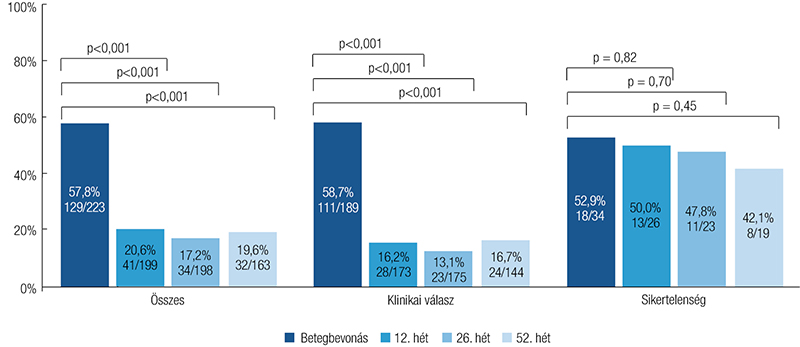
Összesen a betegek 100%-ának, illetve 82,1%-ának adatai álltak rendelkezésre a 26. és az 52. héten. A betegek 72,2%-a (161/223) és 62,3%-a (114/183) a 26., illetve az 52. hétre klinikai remisszióba került. Az 52. heti klinikai remisszió kapcsolatot mutatott a beavatkozás időszakában alkalmazott antibiotikumhasználattal (OR: 0,159; 95% CI: 0,066–0,382), a kiindulási PDAI-pontszámmal (OR: 0,753; 95% CI: 0,659–0,859) és az elágazó fisztulák jelenlétével (OR: 0,417; 95% CI: 0,172–1,011), míg a 26. heti remissziós kimenetel az előkészítés és a transzplantációs műtét között eltelt idővel (OR: 0,976; 95% CI: 0,965–0,986) és a kiindulási fisztulák alacsony számával (OR: 0,278; 95% CI: 0,127–0,609) párosult. Az elsődleges eredmények elérése gyakrabban volt megfigyelhető a nagy betegforgalmú központokban a 26. héten (82,5% vs. 49,3%; X2=26,153; p <0,001) és az 52. héten (72,0% vs. 41,4%; X2=15,815; p <0,001). A klinikai válasz aránya 84,8% (189/223) és 79,8% (146/183) volt a 26. és az 52. héten. A 26. héten a klinikai válaszarányok összefüggésbe hozhatók voltak a betegség ileocolicus lokalizációjával (OR: 3,482; 95% CI: 1,228–9,879), a bélreszekcióval (OR: 2,998; 95% CI: 1,123–8,006), a külső fisztulanyílások számával (OR: 7,997; 95% CI: 2,223–28,767) és az előzőleg alkalmazott biológiai terápiával (OR: 0,140; 95% CI: 0,052–0,378). A kezelés sikertelensége az 52. héten összefüggött a női nemmel (OR: 0,392; 95% CI: 0,157– 0,980) és a transzplantációs műtét elhúzódásával (OR: 0,992; 95% CI: 0,984–0,999). Sem a klinikai remissziós arányok (X2=0,143; p=0,71), sem a klinikai válaszok aránya (X2=1,722; p=0,19) nem változtak az 52. hétig. A 2. táblázat a modellszelekciót követő, többváltozós regressszió prediktív eredményeit mutatja be. A 2. ábra a 26. és az 52. héten mért perianális klinikai remissziót elérő betegek arányára vonatkozó adatokat mutatja be. A bevonáskor a betegek 57,8 %-ának (129/223) volt aktív perianális betegsége (PDAI >4). Ez az arány 20,6%-ra (41/199; X2=60,638; p<0,001), 17,2%-ra (34/198, X2=32,596; p<0,001), és 19,6%-ra (32/163; X2=56,566; p<0,001) csökkent a 12., a 26. és az 52. hétre.
A 26. hétre reagáló betegek körében hasonló csökkenés igazolódott. Az aktív perianális betegség aránya azonban nem csökkent a 26. héten a sikertelen kezelést tapasztalók körében. A 3. ábra az aktív perianális betegségben szenvedő betegek arányát mutatja a kiindulási időpontban, valamint a 12., a 26. és az 52. héten mért adatok szerint.
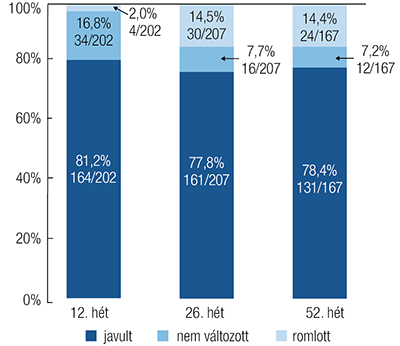
Fontos kiemelni, hogy a betegek 81,2%-a (164/202), 77,8% (161/207) és 78,4%-a (131/167) tapasztalt javulást a szubjektív tünetekben, míg 16,8%-a (34/202), 7,7%-a (16/207) és 7,2%-a (12/167) nem tapasztalt változást a 12., a 26. és az 52. hétig. A 4. ábra a betegek tapasztalatait mutatja be.
Biztonság
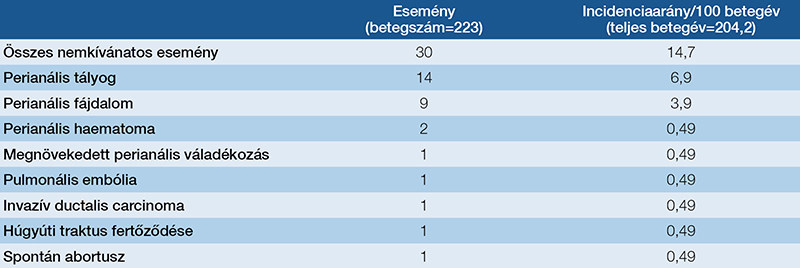
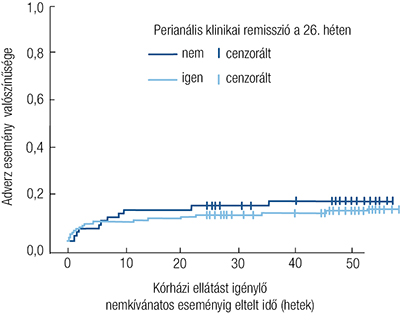
Összességében 204 betegévet regisztráltunk, míg 13,5%-ban (14,7/100 betegév) jelent meg kórházi kezelést igénylő AE a követés során. Az AE-k megjelenéséig eltelt idő mediánja 51,1 hét (IQR: 27,9–52,9) volt a kezelés után. Az AE-k előfordulása azonos volt a 26. héten elért perianális klinikai remisszió szerint rétegzett csoportok esetében (X2=0,522; p=0,47). Az AE-k előfordulása kapcsolatot mutatott a magasabb kiindulási PDAI-pontszámmal (HR: 1,148; 95% CI: 1,021–1,290), míg az aktív dohányzás (HR: 0,227; 95% CI: 0,054–0,957) csökkent kockázattal párosult. A 3. táblázat az AE-k további részleteit mutatja be, míg az 5. ábra az AE-k megjelenéséig eltelt idő görbéjét szemlélteti a 26. héten bekövetkezett perianális klinikai remisszió szerint.
Megbeszélés
Jelen multicentrikus kohorszvizsgálatban retrospektív módon elemeztük az MSC-kezelés hatékonyságát és biztonságosságát perianális, fisztulázó CD-ben egyéves utánkövetési idővel. Összesen 6 centrumból és 3 országból 223 beteget vontunk be a vizsgálatba konszekutív módon. A primer végpontként elemzett perianális klinikai remisszió aránya a 26. és az 52. héten 72,2%, illetve 62,3% volt, amely negatív összefüggést mutatott az antibiotikumhasználattal, a kiindulási emelkedett PDAI-pontszámmal, az előkészítés és a műtét között eltelt idővel, valamint az elágazó fisztulák jelenlétével. AE a betegek 13,5%-ánál fordult elő, leggyakrabban perianális tályogot és végbéltáji fájdalmat jelentettek a betegek. Az AE-k előfordulása a kiindulási emelkedett PDAI-pontszámmal állt összefüggésben.
Több klinikai vizsgálatot végeztek az MSC-kezelés hatékonyságának és biztonságosságának értékelésére a perianális fisztulával rendelkező, CD-ben szenvedő betegek körében. Az ADMIRE-CD placebokontrollált klinikai vizsgálatban 212 fő, CD-ben szenvedő beteg vett részt. A 24. héten a 107 fő, darvadstrocellel kezelt betegcsoportból a placebóval kezeltekhez (43%) képest nagyobb arányban (55%) értek el klinikai remissziót (az összes kezelt külső nyílás záródását) (9). Érdekes módon az ADMIRE-CD vizsgálat hosszú távú kiterjesztett vizsgálata 80%-os klinikai remissziós arányról számolt be az 52. héten az MSC-vel kezelt csoportban (11).
Egy II. fázisú klinikai vizsgálatban fibrinragasztót alkalmaztak az MSC-kezelés után a sipolyok lezárására. Bár a kutatás a fibrinragasztóval összefüggésben előnyről számolt be, a retrospektív, utánkövetéses értékelés azt mutatta, hogy a betegek nagy hányadánál nem sikerült a járatok tartós záródását elérni (11/21 vs. 10/13). Fontos kiemelni, hogy a vizsgálati populáció nem korlátozódott a CD-ben szenvedő betegekre (27, 28). Továbbá metaanalízisekkel és szisztematikus áttekintésekkel értékelték a darvadstrocelkezelés hatékonyságát, amely a placebóhoz képest előnyt mutatott a sipolyok gyógyulásában (29–31). Vizsgálatunkban a betegek 72,2%-a volt klinikai remisszióban a 26. héten, míg ez az arány az 52. hétre 62,3%-ra csökkent. Bár a klinikai válasz aránya a 26. héten 84,8% volt, ami magasabb volt, mint az ADMIRE-populációban (69% vs. 55%), fontos kiemelni, hogy a használt végpont szigorúbb volt a regisztrációs tanulmányban (a kezelt traktusok 50%-ának a záródása).
Ennek ellenére az ADMIRE-II globális, randomizált, kontrollált vizsgálat nem tudta igazolni az MSC-kezelés szuperioritását a placebóval összehasonlítva (kombinált remissziós arány a 24. héten: 48,8% vs. 46,3%). Bár ez megkérdőjelezi az eljárás létjogosultságát, a teljes publikáció még nem áll rendelkezésünkre. Bár az ADMIRE-II vizsgálatban a klinikai remissziós arányok alacsonyabbak voltak, a rendelkezésre álló néhány, valós klinikai környezetből származó adat a magasabb hatékonyság mellett szól. Ez összhangban van a forgalomba hozatalt követő INSPIRE-regiszter adataival és az ADMIRE-CD betegeinek retrospektív elemzésével (INSPECT), amely 76,6%-os és 67,4%- os klinikai remissziós arányt jelzett egy év elteltével (32). Mivel azonban az INSPIRE adatait még nem publikálták, a való életből származó adatok továbbra is korlátozottan érhetők el, hiszen csak néhány publikáció számol be valós tapasztalatokról, amelyekben átlagosan kevesebb mint 100 betegről közölnek adatokat.
Mindkét ADMIRE-vizsgálat a klinikai és radiológiai remisszió (<2 cm-es folyadékgyülemek hiánya) mint elsődleges végpontok kombinációjával értékelte a hatékonyságot, ami lehetetlenné tette a mi eredményeinkkel való megfelelő összehasonlítást. Ráadásul MRI vizsgálatot csak a betegek 10,8%-ánál (24/223) végeztünk az utánkövetés során, és a módosított Van Assche-pontszám csak a betegek 7,2%-ánál (16/223) állt rendelkezésünkre. Így radiológiai jellemzőket tartalmazó statisztikai elemzést nem végeztünk. A regisztrációs vizsgálatok hatékonysága és a valós klinikai adatok közötti ellentmondások feloldása érdekében tanulmányunkban több kovariánst is értékeltünk a kezelések sikerességének előrejelzése céljából. Először: a magasabb kiindulási PDAI-pontszám, a kezeléskor alkalmazott antibiotikumhasználat, a sipolyok magasabb száma és az elágazó fisztulák jelenléte, a kezelés elhúzódása, a női nem és a megelőzően alkalmazott biológiai terápia rosszabb klinikai kimenetelekkel járt együtt. Másodszor: bár úgy tűnt, hogy a külső nyílások magasabb száma előre jelzi a sikertelen kezelést a 26. héten, ez nem volt egyértelmű a változók ferde eloszlása miatt (három traktus a betegek mindössze 7,6%-ánál). Harmadszor: a biológiai terápiák korábbi alkalmazása potenciálisan szelektálhatja az agresszívabb betegséglefolyású betegeket. Nem szabad azonban figyelmen kívül hagyni az MSC-kezelést megelőző farmakológiai kezelések lehetséges hatását (34). Ezen eredmények alapján a kezdeti perianális klinikai aktivitás, valamint a sipolyok száma és az elágazódás figyelembevétele segíthet a potenciálisan jobb kezelési kimenetelű betegek kiválasztásában, míg a megfelelő antibiotikumhasználat megfontolandó. A kohorszunkban észlelt magasabb hatékonyság okainak vizsgálatakor megfontolható az ADMIRE-CD vizsgálatokhoz hasonló populációs jellemzők jelenléte. Mivel a betegek nagy hányada anti-TNF biológiai terápiában részesült, a klinikai és biokémiai aktivitási paraméterek alacsonyak voltak, és a fisztulák jellemzői is hasonlóak voltak. Mindazonáltal pontos összehasonlítás szükséges a teljes ADMIRE vizsgálati populációval. Jelen tanulmányban a populációnk 69,1%-át a magas szintű, tercier központban kezelt betegek tették ki (ahol >150 beteget kezeltek darvadstrocellel). Ezen csoportban a kohorsz többi eleméhez képest magasabb hatékonyságot mértünk. Bár egyértelmű statisztikai szignifikancia nem határozható meg, mégis felvetődik a kolorektális sebészek, gasztroenterológusok és radiológusok tapasztalata a kezelést végző központban, amely hatással lehet a kezelés kimenetelére.
A perianális fisztulák klinikai lefolyása és a tünetek közötti összefüggést korábbi tanulmányok vizsgálták, amelyekben a <4-es PDAI-pontszámot inaktív betegségnek tekintették. Az ADMIRE klinikai vizsgálatban a PDAI-pontszám a kezelés után csökkent. A placebóval végzett vizsgálatban azonban <1-es csökkenést figyeltek meg (ADMIRE-CD 24. hét: –2,4 vs. –1,2; 52. hét: –2,3 vs. –1,4). Vizsgálatunkban a <4-es PDAI pontszámmal rendelkező betegek aránya nőtt a kezelés után, és az 52. hétig perzisztált (57,8%–19,6%), míg a nem reagáló egyének tekintetében nem észleltünk jelentős javulást.
Mindkét ADMIRE-publikációban a betegek viszonylag magas aránya ért el klinikai remissziót a kontrollcsoportokban (<40%) darvadstrocelkezelés nélkül. Ez az eredmény a kezelés előtt elvégzett, szigorú sipolyjárat-kürettálás hatásával magyarázható. Ezért a kohorszunk magas eredményességi arányának hátterében álló potenciális okok között meg kell említeni a preparációs műtét fontosságát.
A szakirodalomban a betegek által jelzett tünetek és az életminőség értékelése korlátozott mértékben érhető el. Egy francia kísérleti vizsgálat során, amelyben 27 fő, perianális fisztulával rendelkező, CD-ben szenvedő beteg vett részt, a kezelés után jelentős javulást értek el a betegek életminőségében (CAF-QoL). Ez az adat összhangban van a mi vizsgálatunkkal, amelyben a betegek 77,8–81,2%-a tapasztalta a klinikai tünetek javulását, magas szintű elégedettség mellett (17). Az ADMIRE-CD vizsgálatok az IBD életminőségi (IBDQ) pontszámának javulását mutatták a kezelés után a 26. héten (átlagos különbség: 3,8). Ugyanakkor a placebóval végzett vizsgálatban is megfigyelhető volt a pontszám csökkenése (átlagos különbség: 4,0) (10).
Jelen kohorszunkban a biztonságossági profil megnyugtató volt, az AE-k összesített előfordulási aránya 14,7/100 betegév volt. Az esetek többségében tályogról és proctalgiáról számoltak be, ami összhangban van az ADMIRE-CD vizsgálat eredményeivel. Egy svájci kohorszban herekarcinómáról és citomegalovírus által okozott fertőzésről közöltek adatokat (15), míg a vizsgálatunkban az emlő invazív ductalis karcinómáját és a húgyutakban kialakuló fertőzést figyelték meg. Ezen mellékhatások darvadstrocelkezeléssel való összefüggése azonban valószínűtlen. Emellett egy esetben tüdőembóliát regisztráltak, ami összefüggésbe hozható lehet a műtéti eljárással és a kórházi felvétellel. Ezen eredmények arra utalnak, hogy az MSC-kezelés jól tolerálható.
Végezetül: jelen tanulmány számos erősséggel bír. Először is: ez volt a legnagyobb való életből származó vizsgálat a darvadstrocel hatékonyságáról és biztonságosságáról a fisztulázó CD-ben. Másodszor: regressziós elemzéseket végeztünk a lehetséges kovariánsok és zavaró tényezők kiküszöbölésére, a lehetséges prediktorok kiválasztására és az I. típusú hiba csökkentésére. Harmadszor: viszonylag hosszú követési időszakot és szigorú betegkiválasztást alkalmaztunk a torzító hatások csökkentése érdekében, míg a pragmatikusan választott végpontok segítettek a való életből származó következtetések levonásában.
Ennek ellenére meg kell jegyeznünk néhány korlátozó tényezőt. Először: a bevont betegek nagy száma ellenére a bevont központok száma viszonylag alacsony volt, és a kezelési volumen is eltérő volt. Másodszor: a retrospektív vizsgálat nem tette lehetővé, hogy pontos következtetéseket vonjunk le, hanem csak lehetséges magyarázatokat tudunk nyújtani. Harmadszor: nem volt lehetőség az egyes központok tapasztalatai közötti különbségek konkrét elemzésére, amelyek egyértelműen befolyásolták a kezelés hatékonyságát és a biztonságossági kérdéseket. Negyedszer: a vizsgálat „való élet” jellege miatt nem használtunk kontrollcsoportot a kezeléssel kapcsolatos kovariánsok, például a spontán sipolyzáródások vizsgálatára. Ezen korlátozások ellenére tanulmányunk szilárd, valós bizonyítékot szolgáltat a darvadstrocel perianális, fisztulázó CD-ben történő alkalmazására.
Fontos megjegyezni, hogy az ellentmondó klinikai vizsgálati eredményeket alapul véve a gyártó globálisan, önként, bizonytalan időre visszavonta a darvadstrocel-kezelésre vonatkozó forgalomba hozatali engedélyét. A kezelés létjogosultsága megkérdőjelezhető, a PFCD ellátása továbbra is kihívás marad. Kielégítetlen igény áll fenn továbbra is korszerű, hatékony és tartós kezelési modalitások kifejlesztésére, ezen keresztül a PFCD-vel élő betegek életminőségének javítására.
Következtetés
Eredményeink alapján a darvadstrocelkezelés hatékonyságára vonatkozó adatok magasabbak voltak, mint az ADMIRE-vizsgálatok adatai. A Crohn-betegségben szenvedők több mint 80%-a részesült a kezelés előnyeiből. Ugyanakkor a placebóval kezelt betegeknél a sipolyok spontán záródása továbbra is magas az irodalomban, feltehetően a sipolyok szigorú kürettálása miatt. Ezenkívül a biztonsági profil megnyugtató, míg a betegek elégedettsége magas volt. Bár a retrospektív vizsgálat miatt pontos következtetéseket nem lehet levonni, a kezelés sikerének előzetes értékelésében és a betegkiválasztásban több szempont szerepét is célszerű figyelembe venni. Azok a betegek, akiknek a perianális klinikai aktivitása a kiindulási időpontban alacsonyabb, és a sipolyok száma alacsonyabb, jobb eredményeket érhetnek el az MSC-kezelést követően. A transzplantációt közvetlenül megelőző preparációs műtét és az antibiotikumok megfelelő alkalmazásának jelentőségét mindenképpen hangsúlyozni kell. Összefoglalva: a perianális betegségben szenvedő CD-s betegek kezeléséhez multidiszciplináris orvosi és sebészeti megközelítésekre van szükség.
Köszönetnyilvánítás:
A szerzők hálásak Tóth-Káli Csillának, Csorba Brigittának és Ördög Krisztinának a tanulmány során nyújtott támogatásért (Szent-Györgyi Albert Orvostudományi Kar, Belgyógyászati Klinika Szegedi Tudományegyetem, Szeged, Magyarország).
Adatmegosztás:
Az MT a cikk garanciavállalója. Minden szerző elolvasta és elfogadta a kézirat benyújtott változatát. Az adatok nem oszthatók meg nyilvánosan a vizsgálatban részt vevő személyek magánéletének védelme érdekében. A cikk alapjául szolgáló adatok a megfelelő szerzőhöz intézett észszerű kérésre megosztásra kerülnek.
Támogatás:
Jelen tanulmányt a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (támogatási azonosítók: 125377 és 143549 MT-nek, 129266 BA-nak, 134863 FK-nak), az Emberi Erőforrások Minisztériumának Új Nemzeti Kiválósági Program (UNKP- 23-3 -SZTE-268 és EKÖP-368 BP-nek, UNKP-22-4 -SZTE-293 BR-nak, UNKP-23-3-SZTE-317 RT-nak, UNKP-22-4-SZTE-296 FA-nak), valamint a Szegedi Tudományegyetem Szent-Györgyi Albert Orvostudományi Karának Bolyai János Kutatási Ösztöndíj (BO/00598/19/5) és Hetényi Géza Kutatási Ösztöndíj (FK, RM és BA részére) támogatásaival végeztük. A projekt az EU Horizont 2020 kutatási és innovációs program által a 739593 számú támogatási megállapodás keretében kapott támogatást.
Érdekeltségek:
MT, FK, NM előadói tiszteletdíjat kapott a Takeda cégtől. NM pályázati támogatást kapott a Takeda cégtől. BP, CSS, DS, ZS, RT, FB, SP, MP, MZ, AS, BA, FA, BR, BZS, IE, SZZ, GYL, KV, AT, PZ, SZÁ nem rendelkezik érdekeltséggel.
Irodalom
https://doi.org/10.1016/j.mayocp.2017.04.010
2. Burisch J, Kiudelis G, Kupcinskas L, et al. Natural disease course of Crohn’s disease during the first 5 years after diagnosis in a European population-based inception cohort: an Epi-IBD study. Gut. 2019; 68(3): 423–433. https://doi.org/10.1136/gutjnl-2017-315568
3. Hellers G, Bergstrand O, Ewerth S, Holmström B. Occurrence and outcome after primary treatment of anal fistulae in Crohn’s disease. Gut 1980; 21(6): 525–527. https://doi.org/10.1136/gut.21.6.525
4. Solomon MJ. Fistulae and abscesses in symptomatic perianal Crohn’s disease. Int J Colorectal Dis 1996; 11(5): 222–226.
https://doi.org/10.1007/s003840050051
5. Panés J, Rimola J. Perianal fistulizing Crohn’s disease: pathogenesis, diagnosis and therapy. Nat Rev Gastroenterol Hepatol 2017; 14(11): 652–664. https://doi.org/10.1038/nrgastro.2017.104
6. American Gastroenterological Association Clinical Practice Committee. American Gastroenterological Association medical position statement: perianal Crohn’s disease. Gastroenterology 2003; 125(5): 1503–1507.
https://doi.org/10.1016/j.gastro.2003.08.024
7. Torres J, Bonovas S, Doherty G, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J Crohns Colitis 2020; 14(1): 4–22. https://doi.org/10.1093/ecco-jcc/jjz180
8. Adamina M, Bonovas S, Raine T, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Surgical Treatment. J Crohns Colitis 2020; 14(2): 155–168. https://doi.org/10.1093/ecco-jcc/jjz187
9. Panés J, García-Olmo D, Van Assche G, et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016; 388(10051): 1281–1290.
https://doi.org/10.1016/S0140-6736(16)31203-X
10. Panés J, García-Olmo D, Van Assche G, et al. Long-term Efficacy and Safety of Stem Cell Therapy (Cx601) for Complex Perianal Fistulas in Patients With Crohn’s Disease. Gastroenterology 2018; 154(5): 1334–1342.e4. https://doi.org/10.1053/j.gastro.2017.12.020
11. Garcia-Olmo D, Gilaberte I, Binek M, et al. Follow-up Study to Evaluate the Long-term Safety and Efficacy of Darvadstrocel (Mesenchymal Stem Cell Treatment) in Patients With Perianal Fistulizing Crohn’s Disease: ADMIRE-CD Phase 3 Randomized Controlled Trial. Dis Colon Rectum 2022; 65(5): 713–720. https://doi.org/10.1097/DCR.0000000000002325
12. Wang H, Jiang HY, Zhang YX, Jin HY, Fei BY, Jiang JL. Mesenchymal stem cells transplantation for perianal fistulas: a systematic review and meta-analysis of clinical trials. Stem Cell Res Ther 2023; 14(1): 103. (Published 2023 Apr 26.) https://doi.org/10.1186/s13287-023-03331-6
13. Lightner AL, Wang Z, Zubair AC, Dozois EJ. A Systematic Review and Meta-analysis of Mesenchymal Stem Cell Injections for the Treatment of Perianal Crohn’s Disease: Progress Made and Future Directions. Dis Colon Rectum 2018; 61(5): 629–640.
https://doi.org/10.1097/DCR.0000000000001093
14. Serclova Z, Garcia-Olmo D, Chen ST, et al. OP18 Efficacy and safety of darvadstrocel treatment in patients with complex perianal fistulas and Crohn’s Disease: results from the global ADMIRE-CD II phase 3 study. Journal of Crohn’s and Colitis 2024; 18, Supplement_1: i34–i35.
15. Cabalzar-Wondberg D, Turina M, Biedermann L, Rogler G, Schreiner P. Allogeneic expanded adipose-derived mesenchymal stem cell therapy for perianal fistulas in Crohn’s disease: A case series. Colorectal Dis 2021; 23(6): 1444–1450. https://doi.org/10.1111/codi.15587
16. Schwandner O. Stem cell injection for complex anal fistula in Crohn’s disease: A single-center experience. World J Gastroenterol. 2021; 27(24): 3643–3653. https://doi.org/10.3748/wjg.v27.i24.3643
17. Fathallah N, Akaffou M, Haouari MA, et al. Deep remission improves the quality of life of patients with Crohn’s disease and anoperineal fistula treated with darvadstrocel: results of a French pilot study. Tech Coloproctol 2023; 27(12): 1201–1210. https://doi.org/10.1007/s10151-023-02765-7
18. Best WR, Becktel JM, Singleton JW, Kern F Jr. Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study. Gastroenterology 1976; 70(3): 439–444.
19. von Elm E, Altman DG, Egger M, et al. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. J Clin Epidemiol 2008; 61(4): 344–349. https://doi.org/10.1016/j.jclinepi.2007.11.008
20. Silverberg MS, Satsangi J, Ahmad T, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19 Suppl A: 5A-36A.
https://doi.org/10.1155/2005/269076
21. Parks AG, Gordon PH, Hardcastle JD. A classification of fistula- in-ano. Br J Surg 1976; 63: 1–12. https://doi.org/10.1002/bjs.1800630102
22. Koutroumpakis E, Katsanos KH. Implementation of the simple endoscopic activity score in crohn’s disease. Saudi J Gastroenterol 2016; 22(3): 183–191.
23. Irvine EJ. Usual therapy improves perianal Crohn’s disease as measured by a new disease activity index. McMaster IBD Study Group. J Clin Gastroenterol 1995; 20(1): 27–32.
24. van Rijn KL, Lansdorp CA, Tielbeek JAW, et al. Evaluation of the modified Van Assche index for assessing response to anti-TNF therapy with MRI in perianal fistulizing Crohn’s disease. Clin Imaging 2020; 59(2): 179–187. https://doi.org/10.1016/j.clinimag.2019.10.007
25. Jebb AT, Ng V, Tay L. A Review of Key Likert Scale Development Advances: 1995-2019. Front Psychol 2021; 12: 637547. (Published 2021 May 4.) https://doi.org/10.3389/fpsyg.2021.637547
26. Losco A, Viganò C, Conte D, et al. Assessing the activity of perianal Crohn’s disease: comparison of clinical indices and computer-assisted anal ultrasound. Inflamm Bowel Dis 2009; 15(5): 742–749.
https://doi.org/10.1002/ibd.20826
27. Garcia-Olmo D, Herreros D, Pascual I, et al. Expanded adipose-derived stem cells for the treatment of complex perianal fistula: a phase II clinical trial. Dis Colon Rectum 2009; 52(1): 79–86.
https://doi.org/10.1007/DCR.0b013e3181973487
28. Guadalajara H, Herreros D, De-La-Quintana P, Trebol J, Garcia-Arranz M, Garcia-Olmo D. Long-term follow-up of patients undergoing adipose-derived adult stem cell administration to treat complex perianal fistulas. Int J Colorectal Dis 2012; 27(5): 595–600.
https://doi.org/10.1007/s00384-011-1350-1
29. Wang H, Jiang HY, Zhang YX, Jin HY, Fei BY, Jiang JL. Mesenchymal stem cells transplantation for perianal fistulas: a systematic review and meta-analysis of clinical trials [published correction appears in Stem Cell Res Ther. 2024 Feb 16;15(1):45]. Stem Cell Res Ther 2023; 14(1): 103. (Published 2023 Apr 26.) https://doi.org/10.1186/s13287-023-03331-6
30. Cao Y, Su Q, Zhang B, Shen F, Li S. Efficacy of stem cells therapy for Crohn’s fistula: a meta-analysis and systematic review. Stem Cell Res Ther 2021; 12(1): 32. (Published 2021 Jan 7.)
https://doi.org/10.1186/s13287-020-02095-7
31. Fousekis FS, Mpakogiannis K, Lianos GD, et al. Effectiveness and safety of darvadstrocel in patients with complex perianal fistulizing Crohn’s disease: a systematic review. Ann Gastroenterol 2024; 37(1): 46–53.
https://doi.org/10.20524/aog.2023.0850
32. Fathallah N, Zmora O, Baumgart DC, et al. INSPIRE: Preliminary data from an observational post-marketing registry on the effectiveness and safety of darvadstrocel in patients with Crohn’s Disease and complex perianal fistulas. Journal of Crohn’s and Colitis 2024; Supplement_1: i191–i193.
33. Panés J, Bouma G, Ferrante M, et al. INSPECT: A Retrospective Study to Evaluate Long-term Effectiveness and Safety of Darvadstrocel in Patients With Perianal Fistulizing Crohn’s Disease Treated in the ADMIRE-CD Trial. Inflamm Bowel Dis 2022; 28(11): 1737–1745.
https://doi.org/10.1093/ibd/izab361
34. Johnson V, Webb T, Norman A, et al. Activated Mesenchymal Stem Cells Interact with Antibiotics and Host Innate Immune Responses to Control Chronic Bacterial Infections. Sci Rep 2017; 7(1): 9575. (Published 2017 Aug 29.) https://doi.org/10.1038/s41598-017-08311-4
