Original publication
Endoscopic ultrasound-guided radiofrequency ablation (EUS-RFA): a novel treatment modality for pancreatic neuroendocrine tumors
Summary
Introduction: Neuroendocrine tumors of the pancreas account for 2–5% of all pancreatic neoplasms. Histopathologically, they can be well-differentiated or poorly differentiated, and are graded into three categories based on mitotic index and Ki-67 proliferation rate. These grades significantly influence the prognosis and future therapeutic decisions. Endoscopic ultrasound (EUS) with fine-needle aspiration biopsy has long been pivotal in the diagnosis of pancreatic neuroendocrine tumors. More recently, EUS-guided radiofrequency ablation (EUS-RFA) has emerged as a new therapeutic modality in this patient population.
Methods: This study presents data from patients undergoing EUS-guided radiofrequency ablation at the National Institute of Oncology in the year of 2024. We discuss the indications of the procedure and highlight criteria for patient selection. All ablations were performed using a 19-gauge, 10 mm cooled tip RFA needle applying 50 W of energy for 15 seconds per ablation through 1–3 needle passes, utilizing a Taewoong Viva Combo RF generator.
Results: During the study period, a total of 17 patients were diagnosed with pan-NET in our unit, of whom 5 were deemed suitable for EUS-RFA treatment. Key selection criteria included tumor location and size (mean diameter: 14.25 mm; range 9–17 mm), biological behavior (G1), absence of contraindications, and patient-specific factors (mean age: 63.5 years; range 55–74 years). No early complications were observed post-procedure. One patient presented with abdominal pain 120 hours after ablation, which resolved rapidly with intravenous antibiotics and was attributed to needle tract irritation. Oncological follow-up imaging (abdominal CT; 3, 6, and 12 months post-ablation) showed complete or partial (>50%) tumor regression in three patients.
Conclusions: Preliminary experience suggests that EUS-RFA is a safe and effective therapeutic option for pan-NETs. It can be applied with curative intent in well-differentiated tumors smaller than 20 mm, and palliatively in patients with high surgical risk, offering a minimally invasive treatment alternative with a low complication rate.
Összefoglaló
Bevezetés: A neuroendokrin tumorok az összes hasnyálmirigy-daganat 2–5%-át teszik ki. Szövettani szempontból jól vagy rosszul differenciált formákat, valamint a mitotikus index és a Ki-67 proliferációs ráta alapján három grádust különböztetünk meg, amelyek jelentősen befolyásolják a prognózist és a terápiás döntéseket. A hasnyálmirigy neuroendokrin tumorainak (pan-NET) diagnosztikájában az endoszkópos ultrahang (EUH) a finomtű-biopsziás mintavétellel eddig is kulcsszerepet játszott, azonban mára onkoterápiás modalitásként lépett elő ebben a betegcsoportban.
Módszerek: Tanulmányunkban bemutatjuk a 2024-ben, az Országos Onkológiai Intézet EUH-ERCP-laborjában, endoszkópos ultrahang által vezérelt, radiofrekvenciás ablációs terápiában részesülő betegek adatait, taglalva a módszer indikációs köreit és a betegkiválasztás szempontjait. Az ablációs beavatkozást minden esetben 19 G átmérőjű, 10 mm-es, hűtött RFA-tűvel, 1–3 szúrásból, 50W/15 sec energia leadásával (Taewoong Viva Combo RF generátor) végeztük.
Eredmények: A vizsgált időszakban összesen 17 betegnél diagnosztizáltunk pan-NET-et, amelyek közül 5 eset bizonyult EUH-RFA-val végzett terápiára alkalmasnak. A legfontosabb szelekciós kritériumok a következők voltak: a tumor elhelyezkedése és mérete (átlagosan 14,25 mm; 9–17 mm), biológiai viselkedése (G1), a kontraindikációk hiánya, valamint a betegspecifikus tényezők (átlagos kor: 63,5 év; 55–74 év). A beavatkozáson átesetteknél nem észleltünk korai szövődményt; egy alkalommal került sor a beavatkozás után 120 órával hasi fájdalom miatti betegfelvételre, amely iv. antibiotikumterápia mellett gyorsan szűnő szúrcsatorna-irritációnak bizonyult. Az onkológiai utánkövetés során készült képalkotó vizsgálatokon három páciensnél (hasi CT 3, 6 és 12 hónapnál) a tumor méretében teljes vagy részleges (>50%) regresszió mutatkozott.
Konklúziók: Korai tapasztalataink alapján az EUH-RFA biztonságosan és hatékonyan alkalmazható terápia a pan-NET kezelésében. Kuratív céllal a 20 mm-nél kisebb, jól differenciált tumorok esetében, illetve palliatív céllal a magas műtéti kockázatú betegeknél alkalmazható, alacsony szövődményrátával rendelkező, hatékony terápiás lehetőség.
Bevezetés
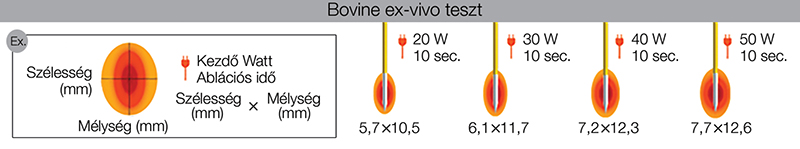
A hasnyálmirigy neuroendokrin tumorainak incidenciája az elmúlt évtizedekben ugrásszerűen megnőtt. A hasnyálmirigy összes daganatainak 2–5%-át teszik ki; előfordulásuk minden korcsoportban és mindkét nemben hasonló, de középkorú és idősebb felnőttekben gyakoribb (1). Szövettani szempontból jól (pan-NET) vagy rosszul differenciált (pan-NEC) formákba sorolhatók. A funkcionáló tumorok közül az insulinomák a leggyakoribbak, míg a nem funkcionáló változatokat gyakran véletlen leletként, úgynevezett incidentalomaként fedezik fel (2). A mitotikus index és a Ki-67 proliferációs ráta alapján három grádust különböztetünk meg: a G1-es tumoroknál a Ki-67-index ≤3%, a G2-es tumoroknál 4% és 20% közötti, míg a G3 besorolásúaknál 20% feletti értéket mutat (3); ennek megállapítása jelentősen befolyásolja a prognózist és a terápiás döntéseket. A hasnyálmirigy neuroendokrin tumorainak diagnosztikájában az endoszkópos ultrahang (EUH) a finomtű-biopsziás mintavétellel (FNB) eddig is kulcsszerepet játszott, azonban mára bizonyos esetekben onkoterápiás modalitásként is előrelépett. A sebészeti megoldások mindenesetre továbbra is alappillérét képezik mind a funkcionáló, mind a nem funkcionáló pan-NET-ek kezelésének, elsősorban nem metasztatikus betegségben, jelentős túlélési előnyt biztosítva a betegek számára (4). Ugyanakkor a hasnyálmirigy-sebészetben a szövődmények nem ritkák: a beavatkozás következtében jelentős rövid és hosszú távú mellékhatások fordulhatnak elő. Egy 62 tanulmányt összegző irodalmi áttekintés szerint a leggyakoribb posztoperatív szövődmények közé tartoznak az alábbiak: a hasnyálmirigy-fisztula (enucleatio után 45%, distalis pancreatectomia és pancreatoduodenectomia után 14%, centrális pancreatectomia után 58%), a megnyúlt gyomorürülés (enucleatio és distalis pancreatectomia után 5%, pancreatoduodenectomia után 18%, centrális pancreatectomia után 15%), a műtét utáni vérzéses szövődmények (distalis pancreatectomia után 1%, pancreatoduodenectomia után 7%, centrális pancreatectomia után 4%), vagy akár a korai halálos kimenetel is (distalis pancreatectomia 4%, pancreatoduodenectomia 6%, centrális pancreatectomia 4%) (5). Ezért kiemelt fontosságú a személyre szabott döntéshozatal: bizonyos esetekben a képalkotó vizsgálatokkal történő követés vagy kisebb invazivitással járó, alternatív terápiás beavatkozás szükséges a mellékhatások elkerülése érdekében. Egy metaanalízisben összesen 183 fő endoszkópos ultrahang által vezérelt radiofrekvenciás ablációval kezelt beteget vizsgáltak: a sikerességi arányt a mellékhatásprofil súlyosságával összevetve kimutatták, hogy jó terápiás válasz mellett (93,4%) a súlyos mellékhatások minimális arányban jelentkeztek (0,007%); az enyhe mellékhatások jellemzően hasi fájdalom vagy hasnyálmirigy-gyulladás formájában jelentkeztek a nem funkcionáló pan-NET csoportban (14,7%) (6). Fenti eredmények alapján elmondható, hogy a hasnyálmirigy neuroendokrin tumorainak kezelésében az endoszkópos ultrahang által vezérelt radiofrekvenciás abláció (EUH-RFA) jól kiválasztott betegcsoportban a sebészeti beavatkozások megfelelő alternatívája lehet. Kiemelendő azonban, hogy egyes irányelvek lehetővé teszik a jól differenciált, kisméretű (elsősorban <1 cm), nem funkcionáló pan-NET esetében az aktív utánkövetést is (7). A radiofrekvenciás abláció technikája és klinikai felhasználása A radiofrekvenciás ablációt (RFA-t) évtizedek óta alkalmazzák szolid malignitások kezelésére, mind intraoperatív, mind perkután technikával (8, 9). A „radiofrekvencia” kifejezés az alkalmazott elektromos áram frekvenciájából ered, amely megegyezik a rádióhullámok frekvenciájával. A beavatkozás monopoláris vagy bipoláris elektródákkal valósítható meg. A korábban kifejlesztett és nagyobb szöveti penetrációra képes monopoláris elektróda szigetelt tűelektródából áll, amelynek aktív végződését a beteg testén elhelyezett földelő elektródával kapcsolják össze. A bipoláris elektródák két, egymással szomszédos aktív elektródából állnak, amelyek a tű csúcsa közelében helyezkednek el; ezáltal ugyan kisebb a szöveti penetráció, de a hatásterület pontosabban meghatározható. Mindkét esetben a radiofrekvenciás áram kiváltotta ionáramlás súrlódás útján hőt termel, amely koagulációs nekrózis révén sejtpusztulást idéz elő a célszövetben (>60°C) (1. ábra) (6).
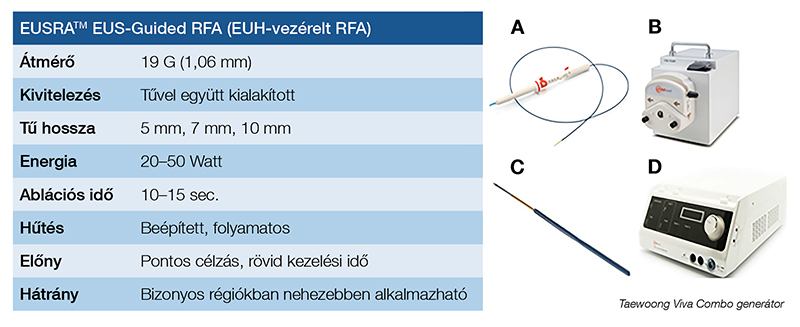
Az RFA ezenkívül a tumorantigének felszabadításával T-sejtek által mediált immunválaszt vált ki, ami apoptózis révén potenciálisan daganatellenes immunitáshoz vezet (10, 11). A technika klinikumban való alkalmazása perkután megközelítésből az 1990-es évek óta folyamatosan bővül; időközben a hepatocellularis karcinóma kezelésének egyik alappillérévé vált, ezt nemzetközi irányelvek is megállapították (12). Továbbá régóta alkalmazzák tüdő-, csont-, prosztata- és vesedaganatok esetében is. Endoszkópos alkalmazását előbb az ERCP-technikával kombinálták; legfőbb indikációi közé tartoznak a rosszindulatú epeúti vezetékszűkületek, valamint az elzáródott palliatív fémstentek rekanalizációja a stent eltávolítása nélkül (13, 14). Az intraductalisan alkalmazott technika a klinikai kihívást jelentő májkapui szűkületeknél behelyezett (nem cserélhető) bilaterális stentelzáródás esetén mutatott kifejezett előnyt (15). EUH-vezérelt alkalmazás tekintetében 1999-ben Brugge és munkatársai publikálták az első kísérletes, endoszkópos ultrahang által vezérelt RFA-t sertésmodellben (16). A kísérletes modellek után évekig tartott a hatékony ultrahangos endoszkópok és RFA-eszközök fejlesztése. 2015-ben került kereskedelmi forgalomba az első EUSRA-rendszer, amely az echoendoszkóp munkacsatornáján bevezethető, vízhűtéses, különböző aktív véghosszúságú, monopoláris, 18 G (később 19 G) rádiófrekvenciás tűből; egy dedikált radiofrekvenciás VIVA RF-generátorból; valamint egy, a tű belsejében hűtő sóoldatot keringető pumpából áll (2. ábra).

Az Országos Onkológiai Intézet EUH/ERCP laborjában 2024-ben összesen 17 betegnél diagnosztizáltunk hasnyálmirigy eredetű neuroendokrin tumort; a daganatok minden esetben hormonálisan inaktívak voltak. A szövettani mintához EUH által vezérelt vékonytű-biopsziával (FNB) jutottunk. A betegágy melletti citológiai véleményezés után sejtblokkfeldolgozással állítottuk fel a végleges diagnózist. Az esetek adatai alapján a további terápiás terv megállapítását egy multidiszciplináris onkológiai team véleménye alapján végeztük, figyelembe véve a beteg egyéni preferenciáját is (1. táblázat):
- Képalkotóval való követési stratégiát egy idős, multimorbid, alacsony grádusú, 7 mm nagyságú eltéréssel diagnosztizált nőbeteg esetében alkalmaztunk.
- 5 eset mutatkozott EUH-RFA általi kezelésre alkalmasnak; ezek kiválasztásánál a tumor mérete (10–20 mm) és biológiai sajátossága (G1) volt mérvadó.
- 5 betegnél döntöttünk sebészeti beavatkozás elvégzése mellett. Ezekben az esetekben a tumor mérete (>20 mm), elhelyezkedése (a pancreasvezetékhez való közelség; a transzducertől való távolság), szövettani típusa (pl. agresszívabb gastrinoma; Ki-67-ráta) volt a fő szelekciós szempont.
- Kemoterápiában 6 beteg részesült; itt az eltérések mindegyike magas osztódási potenciálúnak mutatkozott (G2, G3).
-
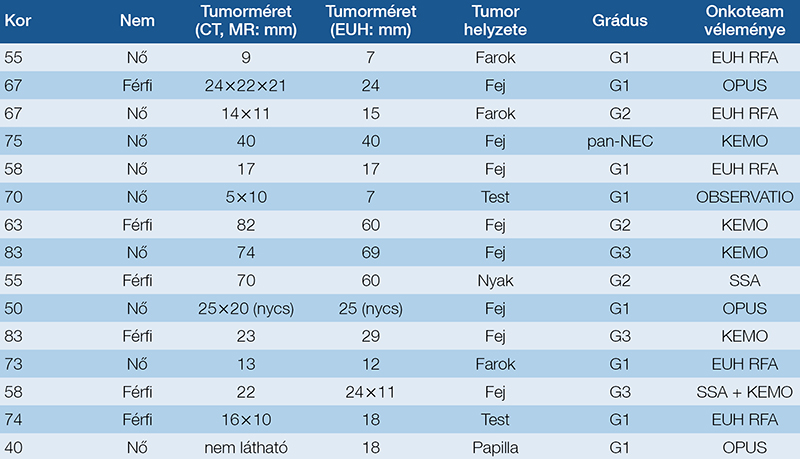
1. táblázat: 2024-ben az OOI EUH/ERCP-laborjában diagnosztizált pan-NET esetek
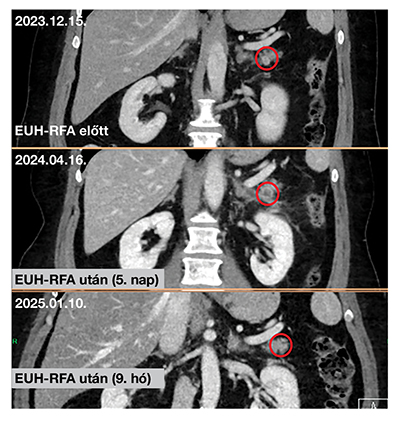
Az RFA-t mind az 5 esetben sikeresen elvégeztük. A beavatkozással közvetlen összefüggésben álló korai szövődményt egy alkalommal sem észleltünk. Egy betegünk a beavatkozást követő ötödik napon hasi fájdalom miatt hospitalizációra szorult; a sürgősséggel elvégzett vizsgálatok perforációt vagy hasnyálmirigy-gyulladást nem igazoltak (amiláz-lipáz normál; CRP: 13,6 mg/dl). Az esetet szúrcsatorna-irritációnak véleményeztük, amely rövid antibiotikumkúra és fájdalomcsillapítás mellett hamar oldódott. Az ablációs kezelés hatására már jól látható volt a tumorban a centrális elhalás a panasz miatt végzett korai CT-felvételeken is. A többi betegünk esetében sem korai, sem késői szövődményt nem regisztráltunk. Az onkológiai utánkövetést klinikai állapotfelmérés mellett kontrasztanyagos, hasi CT-vizsgálatokkal (3, 6 és 12 hónap) és ismételt laborvizsgálatokkal végeztük. Három betegnél az egyéves kontroll képalkotó vizsgálat során az elváltozás teljes vagy részleges (>50%) regressziót mutatott (4. ábra). Egy páciensnél a regresszió mértéke 40%-nak mutatkozott, és a chromogranin A értéke is emelkedett, így itt ismételt RFA-t végeztünk a korábbival megegyező beállításokkal; a további utánkövetéses adatok még nem állnak rendelkezésre. Az utolsó beteg esetében a harmadik hónapnál ismételt CT-vizsgálat során az elváltozás még változatlan méretűnek mutatkozott. Az EUH-RFA-kezelésen átesett betegeink utánkövetését és az új betegek bevonását jelenleg is folytatjuk.
Következtetések
Jelen tanulmányunk az endoszkópos ultrahang által vezérelt, radiofrekvenciás abláció első hazai tapasztalatait mutatja be a hasnyálmirigy neuroendokrin tumorainak kezelésében. Az eddig kezelt betegeknél rendre sikeresen elvégzett beavatkozás, a minimális szövődményráta, és a korai utánkövetés alapján három betegnél elért teljes vagy jelentős regresszió ígéretes eredményeket jelent. Az EUH-RFA technikájának nemzetközi fejlődése is azt mutatja, hogy ez a minimálisan invazív eljárás biztonságos és hatékony alternatívát jelenthet a hagyományos sebészeti megoldásokkal szemben, különösen jól kiválasztott betegcsoportban. A nemzetközi irodalom alapján a teljes radiológiai válaszadás aránya 85–95% közötti, amely összhangban van saját eredményeinkkel. Kiemelhető, hogy a betegkiválasztás és a megfelelő technika a sikeres kezelés kulcsfontosságú elemei. Az optimális jelöltek a 20 mm alatti, jól differenciált (G1) neuroendokrin tumorral rendelkező betegek. A terápia jó alternatívát jelent a magas műtéti kockázatú vagy a műtétet elutasító betegek számára is.
A jövőbeli kutatási irányok között szerepel a hosszú távú onkológiai eredmények értékelése, a nagyobb multicentrikus prospektív vizsgálatok elvégzése, valamint az optimális ablációs paraméterek standardizálása.
Összegzés
Elmondható, hogy az endoszkópos ultrahang által vezérelt radiofrekvenciás abláció ígéretes, minimálisan invazív terápiás lehetőségként jelenik meg a hasnyálmirigy kisebb neuroendokrin tumorainak kezelésében. Megfelelő betegkiválasztással kuratív célzattal alkalmazható, alacsony szövődményráta mellett. További nagyobb esetszámú, hosszú távú követéses vizsgálatok szükségesek ahhoz, hogy a klinikai gyakorlatban szélesebb körben alkalmazhassák ezt a technikát, és bekerüljön a nemzetközi kezelési irányelvekbe.
Irodalom
https://doi.org/10.1093/annonc/mdn351; Epub 2008 May 30.
2. Herrera MF, Åkerström G, et al. AACE/ACE disease state clinical review: pancreatic neuroendocrine incidentalomas. Endocr Pract 2015; 21(5): 546–53. https://doi.org/10.4158/EP14465.DSC
3. Claudio L, Aldo S, et al. Neoplastic progression in neuroendocrine neoplasms of the pancreas. Arch Pathol Lab Med 2024; 148(9): 975–9.
https://doi.org/10.5858/arpa.2022-0417-RA
4. Hill JS, McPhee JT, McDade TP, et al. Pancreatic neuroendocrine tumors: the impact of surgical resection on survival. Cancer 2009; 115(4):
741–51. https://doi.org/10.1002/cncr.24065
5. Jilesen AP, van Eijck CH, in’t Hof KH, et al. Postoperative complications, in-hospital mortality and 5 year survival after surgical resection for patients with a pancreatic neuroendocrine tumor: a systematic review. World J Surg 2016; 40(3): 729–48. https://doi.org/10.1007/s00268-015-3328-6
6. Armellini E, Facciorusso A, Crinò SF. Efficacy and safety of endoscopic ultrasound-guided radiofrequency ablation for pancreatic neuroendocrine tumors: a systematic review and meta-analysis. Medicina (Kaunas) 2023; 59(2): 359. https://doi.org/10.3390/medicina59020359
7. National Comprehensive Cancer Network (NCCN). Neuroendocrine and adrenal tumors. NCCN guidelines. Version 2.2025.
8. Goldberg SN. Radiofrequency tumor ablation: principles and techniques. Eur J Ultrasound 2001; 13(2): 129–47.
https://doi.org/10.1016/s0929-8266(01)00126-4
9. Livraghi T. Radiofrequency ablation of hepatocellular carcinoma. Surg Oncol Clin N Am 2011; 20(2): 281–99.
https://doi.org/10.1016/j.soc.2010.11.010
10. Ito F, Vardam TD, Appenheimer MM, et al. In situ thermal ablation augments antitumor efficacy of adoptive T cell therapy. Int J Hyperthermia 2019; 36(sup1): 22–36. https://doi.org/10.1080/02656736.2019.1653500
11. Löffler MW, Nussbaum B, et al. A non-interventional clinical trial assessing immune responses after radiofrequency ablation of liver metastases from colorectal cancer. Front Immunol 2019; 10: 2526.
https://doi.org/10.3389/fimmu.2019.02526
12. Reig M, Forner A, Rimola J, et al. BCLC strategy for prognosis prediction and treatment recommendation: the 2022 update. J Hepatol 2022; 76(3): 681–93. https://doi.org/10.1016/j.jhep.2021.11.018
13. Auriemma F, De Luca L, et al. Radiofrequency and malignant biliary strictures: an update. World J Gastrointest Endosc 2019; 11(2): 95–102.
https://doi.org/10.4253/wjge.v11.i2.95
14. Canakis A, Sharaiha RZ. Radiofrequency ablation for pancreatobiliary disease: an updated review. Ann Gastroenterol 2023; 36(5): 497–503.
https://doi.org/10.20524/aog.2023.0828
15. Pereira P, Santos AL, Morais R, et al. Endoscopic radiofrequency ablation for palliative treatment of hilar cholangiocarcinoma. VideoGIE 2021; 6(4): 195–198.
https://doi.org/10.1016/j.vgie.2020.12.009; eCollection 2021 Apr.
16. Goldberg SN, Mallery S, et al. EUS-guided radiofrequency ablation in the pancreas: results in a porcine model. Gastrointest Endosc 1999; 50(3): 392–401. https://doi.org/10.1053/ge.1999.v50.98847
17. Waung JA, Pereira SP, et al. Successful management of a sporadic pancreatic insulinoma by endoscopic ultrasound-guided radiofrequency ablation. Endoscopy 2016; 48(Suppl1): E144–5.
https://doi.org/10.1055/s-0042-104650
18. Bas-Cutrina F, Bargalló D, Gornals JB. Small pancreatic insulinoma: successful endoscopic ultrasound-guided radiofrequency ablation in a single session using a 22-G fine needle. Dig Endosc 2017; 29(5): 636–8.
https://doi.org/10.1111/den.12866
19. Choi JH, Kim MH, et al. Endoscopic ultrasound-guided radiofrequency ablation for management of benign solid pancreatic tumors. Endoscopy 2018; 50(11): 1099–104.
https://doi.org/10.1055/a-0583-8387. Epub 2018 May 4.
20. Oleinikov K, Goldin E, et al. Endoscopic ultrasound-guided radiofrequency ablation: a new therapeutic approach for pancreatic neuroendocrine tumors. J Clin Endocrinol Metab 2019; 104(7): 2637–47.
https://doi.org/10.1210/jc.2019-00282
21. Barthet M, Gonzalez JM, et al. Endoscopic ultrasound-guided radiofrequency ablation for pancreatic neuroendocrine tumors and pancreatic cystic neoplasms: a prospective multicenter study. Endoscopy. 2019; 51(9): 836–42.
https://doi.org/10.1055/a-0824-7067 Epub 2019 Jan 22.
22. Barthet M, Giovannini M, et al. Long-term outcome after EUS-guided radiofrequency ablation: prospective results in pancreatic neuroendocrine tumors and pancreatic cystic neoplasms. Endosc Int Open 2021; 9(8): E1178–85.
https://doi.org/10.1055/a-1479-2199 Epub 2021 Jul 16.
23. Figueiredo Ferreira M, Garces-Duran R, et al. EUS-guided radiofrequency ablation of pancreatic/peripancreatic tumors and oligometastatic disease: an observational prospective multicenter study. Endosc Int Open 2022;10(10): E1380–5.
https://doi.org/10.1055/a-1922-4536 eCollection 2022 Oct.
24. de Nucci G, Imperatore N, et al. Endoscopic ultrasound-guided radiofrequency ablation of pancreatic neuroendocrine tumors: a case series. Endosc Int Open 2020; 8(12): E1754–8.
https://doi.org/10.1055/a-1261-9359 Epub 2020 Nov 17.
25. Napoléon B, Lisotti A, et al. Risk factors for EUS-guided radiofrequency ablation adverse events in patients with pancreatic neoplasms: a large national French study (RAFPAN study). Gastrointest Endosc 2023; 98(3): 392–99.e1 https://doi.org/10.1016/j.gie.2023.04.003
Epub 2023 Apr 12.
