Reviews
Significance of intestinal barrier damage in inflammatory bowel diseases
Summary
The pathogenesis of inflammatory bowel diseases (IBD) is critically influenced by the intestinal barrier integrity disruption, characterized by widened intercellular junctions, microerosions, and increased permeability, which impacts disease course, relapse risk, and regeneration. Gut microbiota, dietary habits, and the gut–brain axis modulate barrier function and extraintestinal manifestations. Novel biomarkers and technologies (confocal laser endomicroscopy, 3D imaging, and artificial intelligence) enable in vivo cellular-level assessment, paving the way for precision medicine and targeted biological interventions. Further studies are required to elucidate causal mechanisms and validate new therapeutic strategies.
Összefoglaló
A gyulladásos bélbetegségek (IBD) patogenezisében kulcsszerepet játszik a bélbarrier integritásának zavara, amely az intercelluláris rések kiszélesedésével, mikroeróziókkal és fokozott permeabilitással jár, befolyásolva a betegség lefolyását, a relapszus kockázatát és a regenerációt. A bélflóra, a táplálkozás és a bél–agy tengely modulálja a barrierfunkciót, valamint az extraintestinalis manifesztációkat. Az új biomarkerek és technológiák (a konfokális lézer-endomikroszkópia, a 3D-képalkotás és a mesterséges intelligencia) lehetővé teszik az in vivo sejtszintű értékelést, elősegítve a precíziós orvoslást és a célzott biológiai terápiákat. További kutatások szükségesek az ok-okozati mechanizmusok feltárására és az új stratégiák validálására.
Bevezetés
A bélbarrier egy összetett és dinamikus rendszer, amely alapvető szerepet játszik az emberi szervezet homeosztázisának fenntartásában. Fizikai akadályként elválasztja a bél lumenének tartalmát a szervezet belső környezetétől, miközben immunológiai védelmi vonalként szabályozza a luminalis antigénekkel és mikroorganizmusokkal való interakciót. Ugyanakkor szelektív áteresztőképessége révén lehetővé teszi a létfontosságú tápanyagok és a víz felszívódását. Ezen védelmi és felszívódási funkciók egyensúlya kulcsfontosságú a bél homeosztázisának, így az egész szervezet egészségének a fenntartásában. Ezért a barrier működésének megértése elengedhetetlen az IBD patogenezisének tisztázásához (1).
Az IBD – amely magába foglalja a Crohn-betegséget (CD) és a colitis ulcerosát (UC) – egy krónikus, fellángolásokkal komplikált betegség, amelynek pontos patomechanizmusa még nem teljesen tisztázott. Napjainkban azonban egyre több bizonyíték támasztja alá, hogy a bélbarrier integritásának csökkenése nemcsak tüneti kísérőjelenség, hanem kiemelkedő szerepet játszhat ezen kórfolyamat kialakulásában és progressziójában (2, 3).
A „szivárgó bél” (leaky gut), azaz a fokozott bélpermeabilitás azt jelenti, hogy a bélfal képtelen hatékonyan elválasztani a luminalis mikrobiomot a nyálkahártya immunrendszerétől, amelynek következtében a baktériumok, a mikroorganizmusok és az antigének bejutnak a bélfalba, és proinflammatorikus immunválaszt indítanak el (2, 3). A fokozott permeabilitás a CD klinikai tüneteinek megjelenése előtt akár három évvel is kimutatható, amely alátámasztja a jelenség kulcsfontosságú szerepét az IBD patogenezisében (1).
Jelen áttekintés célja, hogy bemutassa a bélbarrier fő szerkezeti elemeit és azok működését, feltárja a barrier-diszfunkció IBD-ben betöltött patogenetikai szerepét, továbbá összefoglalja a bélpermeabilitás mérésére szolgáló hagyományos és új biomarkereket, valamint az integritás helyreállítását célzó legígéretesebb terápiás megközelítéseket.
A bélbarrier szerkezete és funkciója
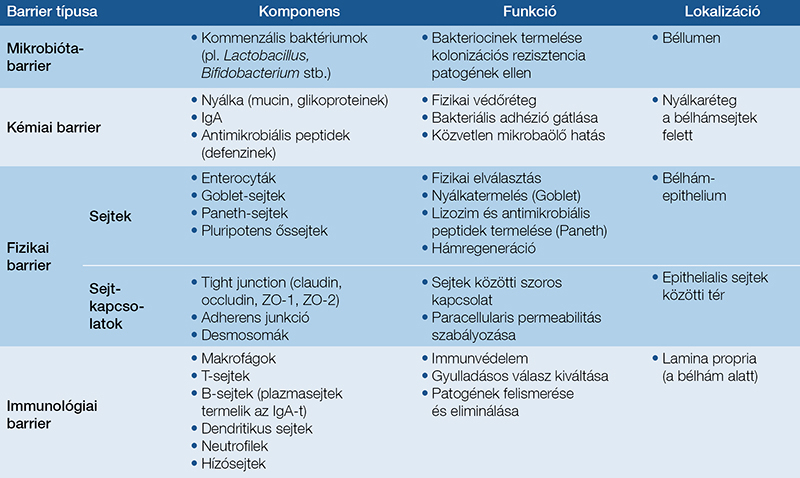
A bélbarrier egy többrétegű, funkcionálisan külső fizikai és belső immunológiai védelmi vonalra tagolódó rendszer, amely biztosítja a tápanyagok felszívódását és megóvja a szervezetet a lumennel érintkező óriási mikrobatömeggel szemben (4). A barrier fő vonalát a polarizált enterocyták egysejtes rétege alkotja, amelyek integritását és szelektív áteresztőképességét a specializált sejt közötti kapcsolatok szabályozzák. Ezeket szoros (tight junction, TJ) és adherens kapcsolatok (adherens junction, AJ), valamint desmosomák alkotják (5). A „tight junction” kapcsolatok a legapikálisabb komplexek, amelyek a paracellularis teret lezárva szabályozzák az ionok és a kis molekulák áthaladását. Fő komponenseik a klaudinok, az occludin és a zonula occludens (ZO) fehérjék (2, 6). A klaudinok (mint a pórusképző klaudin-2 és a barrierzáró klaudin-1) különböző mintázatban expresszálódnak a bél különböző szakaszaiban, alkalmazkodva a mikrobiális terheléshez (2). Az AJ elsősorban E-cadherinből áll, amely főként a sejt-sejt adhézióért felelős, valamint a nyálkahártya stabilitását garantálja (5).
A bélhám felszínét egy mucinokból álló nyákréteg borítja, amely fizikai és kémiai gátat képez a káros anyagok és mikrobák ellen (7). A vastagbélben ez két rétegből áll: egy belső, sűrű, steril és egy külső, lazább komponensre oszlik (2, 8). Ezt a réteget, amely kritikus szerepet tölt be a vastagbél védelmében, elsősorban a kehelysejtek által termelt mucinok (különösen a MUC2 mucin) építik fel, továbbá tartalmaz foszfatidil-kolint és antimikrobiális peptideket (AMP-ket) is, amelyek együttesen alkotják a fizikai és a kémiai barriert a baktériumok kolonizációjával szemben (2, 9).
Az AMP-k (mint az α-defenzinek, β-defenzinek, lizozim és a kathelicidin) elsősorban a vékonybélben található Paneth-sejtek által termelt molekulák, amelyek a nyákban koncentrálódva közvetlenül akadályozzák a patogén mikroorganizmusok epithelhez való tapadását és proliferációját (2, 3). Az antitestek közül a szekretoros immunglobulin A (sIgA) kulcsszerepet játszik a nyálkahártya védelmében, semlegesítve a mikroorganizmusokat és a toxinokat, ezáltal megakadályozva azok kolonizációját és az epithelialis károsodást. A lamina propria makrofágjai, dendritikus sejtjei és lymphocytái szintén hozzájárulnak az immunhomeosztázis fenntartásához (3).
A bélbarrier működését befolyásolják a bélmikrobióta anyagcseretermékei. Az egészséges egyensúly során a mikrobióta a toll-like receptorok (TLR-ek) és NOD-szerű receptorok (NLR-ek) aktiválásán keresztül szabályozza a hám barrierfunkcióit, irányítva a nyák és az antimikrobiális faktorok expresszióját (3). A mikrobák által előállított rövid szénláncú zsírsavak (SCFA), mint az acetát, a propionát és a butirát, létfontosságúak a bélbarrier megfelelő működéséhez (2). A butirát különösen fokozza a transepithelialis rezisztenciát és javítja a „tight junction” kapcsolatok működését az AMP-aktivált protein-kináz aktiválásán keresztül. Egyes jótékony törzsek, mint az Akkermansia muciniphila és a Lactobacillusok, hozzájárulnak a barrier integritásának fenntartásához a mucinszekréció és a TJ-gének expressziójának modulálásával. Ezen összetevők komplex kölcsönhatásának felborulása szerepet játszik az IBD kialakulásában (2, 9, 10).
A bélbarrier főbb alkotóelemeit az 1. táblázat foglalja össze.
A bélbarrier diszfunkciója és patogenezise gyulladásos bélbetegségekben
A gyulladásos bélbetegségek egyik központi patomechanizmusát a bélbarrier integritásának sérülése képezi, amely a luminalis antigének és mikroorganizmusok transzlokációját eredményezi a nyálkahártya alatti szövetekbe (2, 3). Ezzel párhuzamosan a proinflammatorikus citokinek (mint pl. az IFNγ, a TNFα, az IL-1β és az IL-17) képződnek, amelyek a TJ-fehérjék, pl.: a ZO-1 és a különböző klaudinok expressziójának módosításán keresztül tovább fokozzák a permeabilitást (11). A TNFα az NF-kB jelátviteli útvonal aktiválásán keresztül, a ZO-1 expressziójának csökkentésével szuppresszálja a TJ-funkciót, így végső soron a barrierfunkciót. Az IL-13-függő klaudin-2 expressziójának felszabályozása a pórusok számát növeli (12). Emellett fokozódik a myosin light chain kinase (MLCK) aktivitása, ami a cytoskeleton átrendeződésén keresztül gyengíti a sejtek közötti kapcsolatokat (13). A bélbarrier mechanikai szilárdságát tovább gyengíti a fokozott epithelialis apoptózis és hámsejtleválás, amelynek következtében fluoreszceinalapú vizsgálatokkal és konfokális lézer-endomikroszkópiával is kimutatható mikrosérülések alakulnak ki (2, 14). Jelentős genetikai hajlamot hordoznak a betegség kialakulására az ATG16L1 és a NOD2 gének polimorfizmusai, amelyek az autofágia és az antimikrobiális peptidek termelésének csökkenéséhez vezetnek, emiatt pedig romlik a baktériumokat elimináló képesség is (2, 3, 15). Fontos megfigyelés, hogy a megnövekedett bélpermeabilitás akár 3 évvel megelőzheti a CD klinikai megjelenését, ami felvetheti a korai kockázatfelismerés és a prevenciós stratégiák lehetőségét (2, 16). A környezeti tényezők (például a stressz) a kortikotropin-felszabadító faktor– (CRF–) mastocyta tengely aktiválásán keresztül ronthatják a bélbarrier működését (15). A nyugati típusú étrend és az ipari élelmiszer-adalékanyagok használata hozzájárulhat a bélbarrier károsodásához, valamint az immunrendszerrel összefüggő rendellenességek gyakori előfordulásához (17). Továbbá a bél hipoperfúziója, a fertőzések, valamint a toxikus anyagok is ronthatják a bél védekezőfunkcióját (1).
Az egészséges mikrobióta fontos szerepet tölt be a bélhám barrierfunkciójának fenntartásában, részben a SCFA-k termelése révén. Az IBD-ben megfigyelhető dysbiosis, vagyis a mikrobióta összetételének és diverzitásának megváltozása, fokozza a permeabilitást (2, 18). Gyakran megfigyelhető a butiráttermelő baktériumok számának csökkenése, ami hátrányosan befolyásolja a barrier integritását. Emellett a mikrobióta a TLR-ek és NLR-ek aktiválásán keresztül is befolyásolja a barrierfunkciót (3, 18). A NOD2-mutációk csökkentik a baktériumok eliminációjának képességét és fokozzák a proinflammatorikus citokinek termelődését, tovább kompromittálva a barrier védelmi mechanizmusait (2, 18).
A bél–agy tengely és az extraintestinalis manifesztációk
A bélbarrier diszfunkciója messze túlmutat a lokális bélbetegségeken, és jelentős mértékben hozzájárul számos extraintestinalis gyulladásos és degeneratív kórkép kialakulásához, illetve súlyosbodásához. A bél–agy tengely egy kifinomult kétirányú kommunikációs hálózatot alkot, amely több összekapcsolódó útvonalon keresztül működik, valamint gyulladásos, hormonális, idegi és mikrobiális mechanizmusokat foglal magában (3). A pszichológiai stressz és a depresszió ronthatja a bél barrierfunkcióját a CRF–mastocyta tengely aktiválásán keresztül, amely összefüggést mutat az IBD relapszusaival (3). A bél barrierfunkciójának romlása és az immunválaszok diszregulációja jelentős szerepet játszik a nyálkahártyagyulladás kialakulásában és a fokozott afferens szenzoros jelátviteli aktivitásban, amely hasi panaszok megjelenéséhez vezethet. A bakteriális transzlokáció és a gyulladásos mediátorok átjutása a szisztémás keringésbe neuroinflammációt indukálhat (3).
Továbbá a bélbarrier károsodása szorosan összefügg a kognitív zavarokkal, különösen az Alzheimer-kórral (2). Az Alzheimer-kór egérmodelljében a barrier integritásának romlását, csökkent occludin- és ZO-1-szinteket, valamint bélgyulladást figyeltek meg (2). Probiotikumos kezelések, mint például az Akkermansia muciniphila és a Lactobacillus törzsek alkalmazása javította a kognitív funkciót és az amyloid patológiát ezekben a modellekben (2, 12). Parkinson-kórban szenvedő betegek esetében is gyakori a bél dysbiosisa és a barrier diszfunkciója, amely már a neurológiai elváltozások előtt is megfigyelhető (2). A bélmikrobióta által termelt metabolitok, különösen a butirát, létfontosságúak a bélpermeabilitás szabályozásában. A butirát képes átjutni a vér–agy gáton és a központi idegrendszer kannabinoid receptorain indított jelátviteli úton keresztül javítja a bélbarrier működését. Az SCFA-k védik a TJ-fehérjéket és fenntartják a vér–agy gát és a vér–liquor gát integritását. Az SCFA-k pótlása így hozzájárulhat a barrier integritásának helyreállításához és a neuropszichiátriai tünetek csökkentéséhez (3, 17). Az IBD-ben megfigyelhető neuropszichiátriai tünetek és neurodegeneratív betegségek kialakulásában tehát a bélbarrier diszfunkciója – a mikrobiális metabolitok és a TJ-fehérjék komplex kölcsönhatásán keresztül – központi szerepet játszik (2, 3).
A bélbarrier diszfunkciójának értékelése és a biomarkerek
Az IBD diagnosztikájában, monitorozásában és terápiájában a bélbarrier integritásának és permeabilitásának értékelése egy viszonylag új, viszont rendkívül ígéretes terület. A rendelkezésre álló lehetőségek száma és spektruma egyre bővül, az invazív eljárásoktól a nem invazív biomarkereken át a legújabb technológiákig. A klinikumban való rutinszerű alkalmazás azonban csak kevés módszer esetében valósul meg.
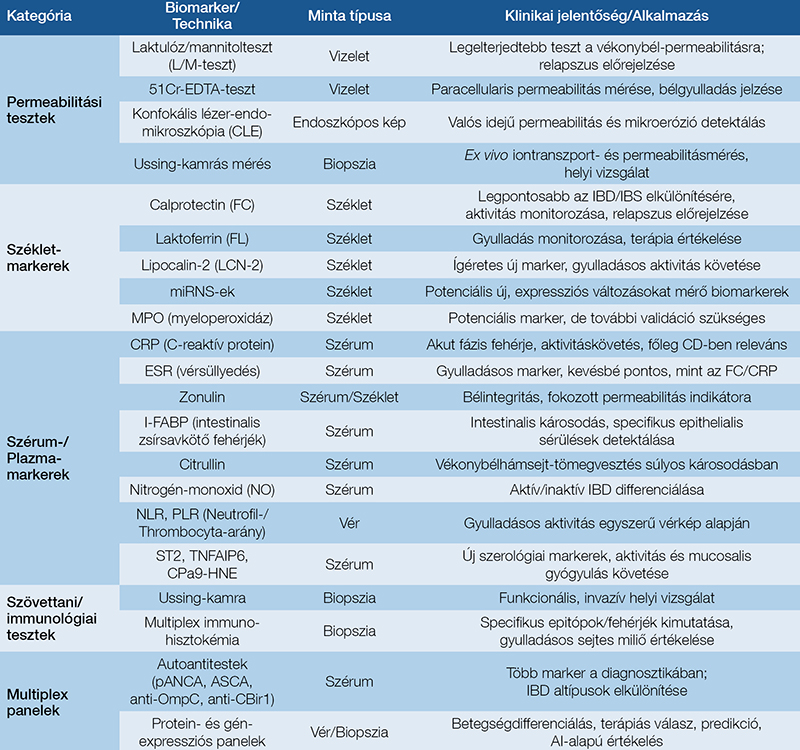
Permeabilitásmérés alkalmával in vitro körülmények között a transepithelialis elektromos rezisztencia (TER) a legérzékenyebb mutató a mucosalis barrier paracellularis rezisztenciájának vizsgálata céljából. A TER csökkenése barrierdiszfunkciót jelez, amely jól korrelál a bélgyulladás súlyosságával (6). A cukortesztek közül a laktulóz/mannitolteszt a legelterjedtebb a vékonybél permeabilitásának meghatározására, amely a két cukor vizeletben történő kiválasztását méri (19). A laktulóz főként paracellularisan, míg a mannitol mind transzcelluláris, mind paracellularis úton képes felszívódni, így a szervezetbe bejutó laktulóz arányának növekedése barrierkárosodást jelezhet (2, 16). A radioaktívan jelölt 51Cr-EDTA molekula paracellularis átjutása a bélnyálkahártyán, majd fokozott kiválasztódása a vizeletbe is bélgyulladásra utal (16, 19). Az Ussing-kamrák ex vivo módon lehetővé teszik az iontranszport és a permeabilitás pontos mérését megőrzött morfológiai szerkezetű és funkcionális ioncsatornákat tartalmazó biopsziás mintákban (1).
Az endoszkópos képalkotó technikák forradalmasíthatják a barrierfunkció valós idejű értékelését. A konfokális lézer-endomikroszkópia (CLE) és a szondaalapú konfokális lézer-endomikroszkópia (pCLE) modern endoszkópos módszerek, amelyek akár 1000-szeres nagyításban teszik lehetővé a bélhám vizualizálását (17). Intravénás fluoreszcein kontrasztanyaggal kombinálva direkt módon kimutatják a fluoreszcein paracellularis szivárgását a lumenbe, vizualizálva a helyi barrier diszfunkcióját (4). A Watson Score egy specifikus pontozási rendszer (I–III. fokozat), amely a hámsejtleválás és a fluoreszcein luminalis szivárgását értékeli, valamint jól korrelál a hisztopatológiás eltérésekkel, és prognosztikai értékkel bír az IBD-relapszus tekintetében (17).
A különböző biomarkerek egyre nagyobb jelentőséggel bírnak, mivel nem invazív módon nyújtanak értékes információkat az IBD diagnosztikájában és követésében. Lehetőséget nyújtanak a betegség korai felismerésére, aktivitásának objektív megítélésére, valamint a terápiás válasz monitorozására. A székletalapú biomarkerek közül a székletcalprotectin (FC) egy neutrofil eredetű fehérje, amelynek magas koncentrációja szoros korrelációt mutat a bélgyulladás mértékével, ezáltal kiválóan alkalmas az IBD aktivitásának nem invazív meghatározására (20). Az FC szintje szignifikáns összefüggést mutat az endoszkópos aktivitással, ezáltal értékes eszközt nyújt a terápiás hatékonyság követésére és a relapszus kockázatának előrejelzésére; továbbá különösen hasznos a gyulladásos és a funkcionális bélbetegségek differenciáldiagnosztikájában, mivel az irritábilis bél szindróma esetén nem mutat kóros emelkedést (20). Szintén ígéretes székletbiomarker a laktoferrin és a lipocalin-2 (LCN-2) (20). A szérum biomarkerei között a C-reaktív protein (CRP) egy pentamerikus, akut fázisú fehérje, amelyet elsősorban a máj hepatocytái szintetizálnak a különböző proinflammatorikus citokinek hatására. Bár a CRP emelkedése nem specifikus az IBD-re, jelentős korrelációt mutat a betegség aktivitásával (20). A zonulin a vékonybél barrierfunkciójának szabályozásában játszik szerepet, és a sejtek közötti TJ-kapcsolatok irányított szétesésén keresztül befolyásolja a bél permeabilitását (16, 20). Az intestinalis zsírsavkötő fehérjék (I-FABP-k) a vékonybél károsodásának markerei, míg a citrullin a vékonybél hámsejttömegének elvesztését jelzi. Az IBD aktív és inaktív fázisában a szérumnitrogén-monoxid (NO) eltérő szintje jelezheti a gyulladásos folyamatokat (16, 20).
A hagyományos endoszkópos módszerek mellett kifejlesztett ultranagy felbontású képalkotó technológiák, mint a pCLE és az endocitoszkópia valós idejű, sejtszintű betekintést nyújtanak a bélhám szerkezetébe és funkciójába. A multispektrális képalkotás, a felkonverziós nanorészecskék és a tömegcitometria olyan térbeli képalkotó platformok, amelyek a barrier heterogén molekuláris és ultrastrukturális aspektusainak részletes feltárását teszik lehetővé (17). Az AI és a számítógépes képanalízis integrációja forradalmasíthatja a barrierkárosodás és -gyógyulás értékelését, valamint jelezheti a gyulladásos aktivitás fokozódását és a relapszus kockázatát (17). Ezek az AI-alapú analízisek nagy előrelépést jelenthetnek és hozzájárulhatnak a pontos, valós idejű és standardizált barrierfunkció értékeléshez (17). A könnyebb áttekinthetőség érdekében a bélbarrier károsodásának biomarkereit 2. táblázatban rendszereztük.
Terápiás megközelítések a bélbarrier-funkció modulálására
A bélbarrier integritásának helyreállítása és modulációja kritikus célponttá vált az IBD terápiás kutatásában, amely megköveteli a multidiszciplináris megközelítés alkalmazását.
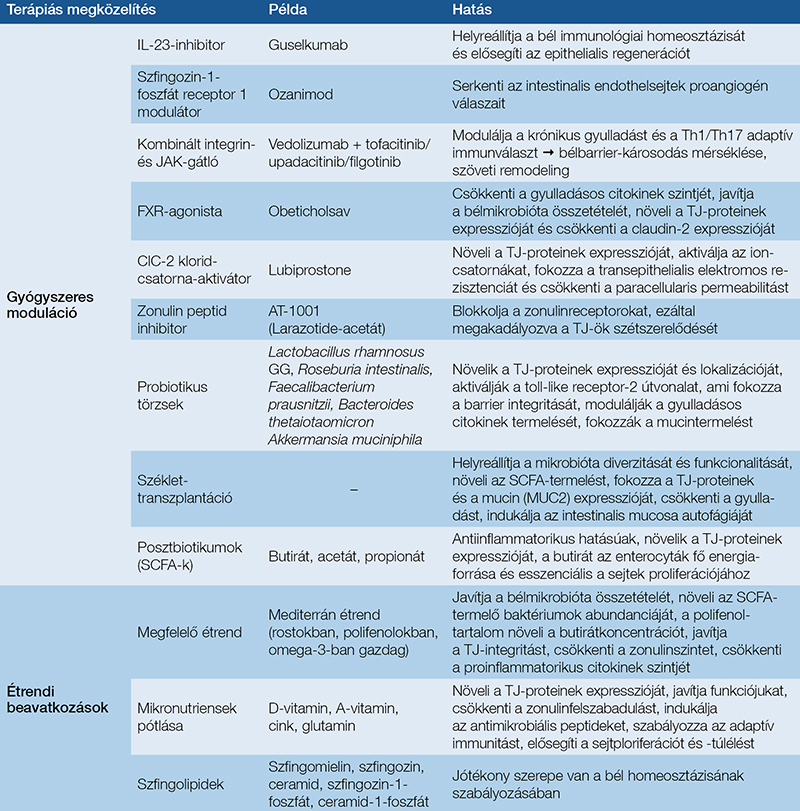
A bél barrierfunkciójának gyógyszeres modulációja során számos mechanizmust célzó ágens bizonyult hatékonynak. Az IL-23 inhibitorok (pl. a guselkumab) az epithelialis sejtek proliferációjának fokozásával erősítik meg a bél barrierfunkcióját (17). A szfingozin-1-foszfát-receptor-1-modulátorok (pl. ozanimod) az endothelsejtek proangiogén válaszainak (migráció, proliferáció, csőképzés) elősegítésében játszanak szerepet (17). A kombinált terápiás megközelítés jelentős előrelépést mutat, pl. az integrin- és JAK-gátlók együttes alkalmazása ígéretes eredményeket hozott CD esetén, a barrierdiszfunkció kezelésében (17). Az FXR-agonisták (pl. obeticholsav) szintén hozzájárulnak a barriervédelem fenntartásához. A ClC-2-kloridcsatorna-aktivátor (lubiprostone) javítja a barriertulajdonságokat, emellett a zonulin peptid inhibitorok (pl. AT-1001) is csökkenthetik a permeabilitást, és enyhíthetik a colitises tüneteket (17, 21).
A mikrobiom modulációja alapvető fontosságú a bél barrierfunkciójának helyreállításában, ahol a probiotikumok és posztbiotikumok, különös tekintettel az SCFA-ra, elősegítik a mucinszekréciót, a TJ-fehérjék expresszióját és a hámréteg regenerálódását (17). A specifikus probiotikus törzsek közül kiemelkedő hatékonyságot mutatnak a Lactobacillus rhamnosus GG, a Roseburia intestinalis, a Faecalibacterium prausnitzii és a Bacteroides thetaiotaomicron. Az Akkermansia muciniphila különleges figyelmet érdemel, hiszen bizonyítottan colitist enyhítő hatású és barrierjavító tulajdonságokkal rendelkezik (1, 2, 18). A széklettranszplantáció újszerű terápiás megközelítésként ígéretes lehet a barrier defektusainak kezelésében, bár hosszú távú hatékonysága további vizsgálatokat igényel (17, 18).
Az étrendi beavatkozások kiemelt jelentőségűek a bélbarrier-homeosztázis fenntartásában. A mediterrán étrend (amely rostokban, polifenolokban és omega-3 zsírsavakban gazdag, ezáltal modulálja a TJ-fehérjék expresszióját, és elősegíti a mikrobióta jótékony összetételének kialakulását) bizonyítottan javítja a barrier integritását. Ezzel szemben a nyugati típusú táplálkozás (amely magas zsír- és alacsony rosttartalmú) rontja a barrierfunkciót (22). A mikronutriensek pótlása tehát alapvető követelménye a barrierintegritás fenntartásának. Az étrendi szfingolipidek szerepe külön kiemelendő a bél homeosztázis szabályozásában betöltött jótékony szerepük miatt (17). A D-vitamin, az A-vitamin, a cink és a glutamin szupplementációja elengedhetetlen, mivel ezen anyagok deficienciája súlyos barriersérülést okozhat. A bél barrierfunkciójának hatékony támogatása megköveteli ezen terápiás modalitások koordinált alkalmazását, figyelembe véve a beteg egyéni igényeit és a betegség stádiumát (17). A 3. táblázatban rendszereztük össze a könnyebb áttekinthetőség érdekében a lehetséges terápiás megközelítéseket.
Következtetések és jövőbeli irányok
A bélhám integritásának zavara központi szerepet játszik az IBD kialakulásában és lefolyásában (14). A fokozott permeabilitás, a hámhézagok és mikroeróziók megjelenése nemcsak a betegség aktivitását tükrözik, hanem bizonyítottan jelzik a relapszusok kockázatát és a súlyosabb betegségkimenetelt is (2, 14). A bélmikrobióta összetétele és anyagcseretermékei (különösen az SCFA-k), valamint az étrendi tényezők (mint például a mediterrán étrend) alapvetően befolyásolják a barrier funkcionális állapotát (3). A bélbarrier diszfunkciója az egész szervezet homeosztázisára kiterjedő következményekkel jár, és a bél–agy tengelyen keresztül extraintestinalis, akár szisztémás tünetekhez vezethet (17). Az olyan innovatív technológiai fejlesztések, mint a CLE és a fejlett térbeli képalkotó rendszerek, forradalmasíthatják a barrier integritásának valós idejű, sejtszintű/molekuláris értékelését (17). Az AI-alapú képelemzés objektív és kvantitatív felmérést tesz lehetővé, megalapozva az IBD precíziós kezelését (17). A jövőbeli terápiás stratégiák közé tartoznak a barrier helyreállítását célzó gyógyszeres beavatkozások, amelyek közvetlenül kívánják helyreállítani a barrierfunkciót (17). Emellett a mikrobiommoduláció (mint a specifikus probiotikumok, posztbiotikumok és a széklettranszplantáció) kulcsfontosságú szerepet játszik a hám helyreállításában, valamint a barrier erősítésében (10). Az étrendi beavatkozások szintén ígéretes megközelítések a bél homeosztázisának helyreállítására (17). Azonban az ok-okozati összefüggések mélyebb tisztázása, valamint az új terápiás megközelítések hosszú távú hatékonyságának és biztonságosságának prospektív klinikai vizsgálatokkal történő igazolása elengedhetetlen a széleskörű klinikai alkalmazás előtt (5, 18).
Támogatás
„A kulturális és innovációs minisztérium EKÖP-24-3-I-DE-427 kódszámú egyetemi kutatói ösztöndíj programjának a nemzeti kutatási, fejlesztési és innovációs alapból finanszírozott szakmai támogatásával készült.”
Rövidítések: IBD = gyulladásos bélbetegség; CLE = konfokális lézer-endomikroszkópia; AI = mesterséges intelligencia; CD = Crohn-betegség; UC = colitis ulcerosa; TJ = tight junction; AJ = adherens junction; ZO = zonula occludens; AMP = antimikrobiális peptidek; sIgA = szekretoros IgA; TLR = toll-like receptor; NLR = NOD-szerű receptor; SCFA = rövid szénláncú zsírsav; ZO = zonula occludens-1; MLCK = miozin könnyűlánc-kináz; CRF = kortikotropin-felszabadító faktor; TER = transepithelialis elektromos rezisztencia; pCLE = szondaalapú konfokális lézer-endomikroszkópia; FC = székletcalprotectin; LCN-2 = lipocalin-2; CRP = C-reaktív protein; I-FABP = intestinalis zsírsavkötő fehérje; NO = nitrogén-monoxid
Irodalom
https://doi.org/10.1186/s12876-014-0189-7
2. Neurath MF, Artis D, Becker C. The intestinal barrier: a pivotal role in health, inflammation, and cancer. Gastroenterol Hepatol 2025; 10(6): 573–92. https://doi.org/10.1016/S2468-1253(24)00390-X
3. Wells JM, Brummer RJ, Derrien M, MacDonald TT, et al. Homeostasis of the gut barrier and potential biomarkers. Am J Physiol Gastrointest Liver Physiol 2016; 312(3): G171–93. https://doi.org/10.1152/ajpgi.00048.2015
4. Scaldaferri F, Pizzoferrato M, Gerardi V, Lopetuso L, Gasbarrini A. The gut barrier: new acquisitions and therapeutic approaches. J Clin Gastroenterol 2012; 46 Suppl: S12–7. https://doi.org/10.1097/MCG.0b013e31826ae849
5. Odenwald MA, Turner JR. The intestinal epithelial barrier: a therapeutic target? Nat Rev Gastroenterol Hepatol 2016; 14(1): 9–21.
https://doi.org/10.1038/nrgastro.2016.169
6. Blikslager AT, Moeser AJ, Gookin JL, Jones SL, Odle J. Restoration of barrier function in injured intestinal mucosa. Physiol Rev. 2007; 87(2):
545–64. https://doi.org/10.1152/physrev.00012.2006
7. Suzuki T. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Anim Sci J 2020; 91(1): e13357.
https://doi.org/10.1111/asj.13357
8. Antoni L, Nuding S, Wehkamp J, Stange EF. Intestinal barrier in inflammatory bowel disease. World J Gastroenterol 2014; 20(5): 1165–79.
https://doi.org/10.3748/wjg.v20.i5.1165
9. Suzuki T. Regulation of intestinal epithelial permeability by tight junctions. Cell Mol Life Sci 2012; 70(4): 631–59.
https://doi.org/10.1007/s00018-012-1070-x
10. Qiao Y, He C, Xia Y, Ocansey DKW, Mao F. Intestinal mucus barrier: A potential therapeutic target for IBD. Autoimmun Rev 2024; 24(2): 103717. https://doi.org/10.1016/j.autrev.2024.103717
11. Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol 2009; 9(11): 799–809. https://doi.org/10.1038/nri2653
12. Lee B, Moon KM, Kim CY. Tight Junction in the Intestinal Epithelium: Its Association with Diseases and Regulation by Phytochemicals. J Immunol Res 2018; 2018: 2645465. https://doi.org/10.1155/2018/2645465
13. Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol 2006; 169(6): 1901–9. https://doi.org/10.2353/ajpath.2006.060681
14. Merga Y, Campbell BJ, Rhodes JM. Mucosal barrier, bacteria and inflammatory bowel disease: possibilities for therapy. Dig Dis 2014; 32(4): 475–83. https://doi.org/10.1159/000358156
15. Michielan A, D’Incà R. Intestinal Permeability in Inflammatory Bowel Disease: Pathogenesis, Clinical Evaluation, and Therapy of Leaky Gut. Mediators Inflamm 2015; 2015: 628157. https://doi.org/10.1155/2015/628157
16. Caviglia GP, Ribaldone DG, Fagoonee S. Novelties on non-invasive biomarkers for the assessment of intestinal permeability and gut barrier integrity in patients with inflammatory bowel diseases. Minerva Gastroenterology 2023; 69(1): 1–3. https://doi.org/10.23736/S2724-5985.22.03215-6
17. Iacucci M, Santacroce G, Majumder S, Morael, et al. Opening the doors of precision medicine: novel tools to assess intestinal barrier in inflammatory bowel disease and colitis-associated neoplasia. Gut 2024; 73(10): 1749–62. https://doi.org/10.1136/gutjnl-2023-331579
18. Schoultz I, Keita ÅV. Cellular and Molecular Therapeutic Targets in Inflammatory Bowel Disease-Focusing on Intestinal Barrier Function. Cells 2019; 8(2): 193. https://doi.org/10.3390/cells8020193
19. Sun Z, Wang X, Andersson R. Role of intestinal permeability in monitoring mucosal barrier function. History, methodology, and significance of pathophysiology. Dig Surg 1998; 15(5): 386–97. https://doi.org/10.1159/000018651
20. Lamb CA, Mansfield JC. Measurement of faecal calprotectin and lactoferrin in inflammatory bowel disease. Frontline Gastroenterol 2010;
2(1): 13–8. https://doi.org/10.1136/fg.2010.001362
21. Nakai D, Miyake M. Intestinal Membrane Function in Inflammatory Bowel Disease. Pharmaceutics 2023; 16(1): 29.
https://doi.org/10.3390/pharmaceutics16010029
22. Dunleavy KA, Raffals LE, Camilleri M. Intestinal Barrier Dysfunction in Inflammatory Bowel Disease: Underpinning Pathogenesis and Therapeutics. Dig Dis Sci 2023; 68(12): 4306–20.
https://doi.org/10.1007/s10620-023-08122-w
