Present-day diagnosis of GERD (What changed during more than a decade between Porto and Lyon consensus reports)
Summary
This review summarizes the update investigation and modern approach to assessing findings in patients with GERD. Over more than a decade since the Porto Consensus, a number of changes have taken place in the diagnostic work up of GERD, which are published now in the Lyon Consensus. The Lyon Consensus defines parameters on oesophageal testing that conclusively establish the presence of GERD and characteristics that rule out GERD. Clinical history and response to antisecretory therapy are insufficient to make a clear diagnosis of GERD, but are indispensible to determine the need for further investigation. Conclusive diagnosis can be made in cases where LA-C, LA-D oesophagitis or complicated GERD has been demonstrated at endoscopy. A normal endoscopic finding with histology does not exclude GERD. In patient with PPI refractory GERD pH and impedance monitoring plays a central role. In most cases, the study should be performed at least one week after the PPI treatment is discontinued, and if the acid exposure time (AET) in the distal oesophagus is >6%, GERD is established, or it can paracticaly be excluded if the AET<4% and the number of reflux episodes is <40. The reflux-symptom relationship on pH and impedance monitorig is indicated by the symptom index (SI) and the symptom association probability (SAP). In cases with normal AET (50%, SAP>95%). In patients with borderline pH-impedance monitoring values (AET 4-6%, the number of reflux episodes 40-80), or in other inconclusive cases the impaired cardia or oesophagus body function detected by high resolution manometry (HRM) can be of value to make further therapeutic decisions. Concerning the future GERD management the Lyon Consensus report proposes an individual patient phenotype-based strategy.
A közlemény összefoglalja a refluxbetegség kivizsgálásának menetét és a leletek értékelésének korszerű szemléletét. A refluxbetegség diagnosztikájában a Portói Konszenzus óta eltelt több mint egy évtizedben számos változás következett be, ami most a Lyoni Konszenzusban jelent meg. A Lyoni Konszenzus azokat a nyelőcső-vizsgálati paramétereket határozta meg, amelyek a refluxbetegség fennállását igazolják, illetve azokat a jellegzetességeket, amelyek ezt a diagnózist kizárják. A refluxbetegség diagnózisa egyedül az anamnézisre és a szekréció-gátló kezelésre alapozva egyértelműen nem állítható fel, viszont ezek révén határozható meg a további kivizsgálás igénye. Egyértelmű a diagnózis azokban az esetekben, amelyekben LA-C, LA-D oesophagitist, vagy szövődményes refluxbetegséget (strictura, Barrett-metaplasia) mutatott az endoszkópia. A szövettani mintavétellel is megerősített negatív endoszkópos lelet nem zárja ki a refluxbetegséget. A PPI-refrakter betegek további kivizsgálásában a központi szerepet a pH-metria impedanciavizsgálat játssza. A vizsgálatot az esetek döntő többségében legalább egy héttel a PPI-kezelés elhagyása után javasolt elvégezni. Amennyiben a nyelőcsőben a savexpozíció ideje (AET) >6% a refluxbetegség megállapítható, ha viszont a AET<4% és a vizsgálat során detektált reflux-epizódok száma <40 a refluxbetegség gyakorlatilag kizárható. A reflux-epizódok és a reflux-tünetek közötti kapcsolatot mutatja a tünetindex (SI) és a tünet asszociáció valószínűsége (SAP). Normál AET (<4%) mellet a pozitív tünetreflux kapcsolat (SI>50%, SAP>95%) alapján reflux hiperszenzitivitás, negatív tünet-reflux kapcsolat esetén funkcionális gyomorégés állapítható meg (1. táblázat). A határérték-eredmények (AET 4-6%, refluxepizódok száma 40-80), vagy egyéb inkonkluzív esetekben a nagyfelbontású nyelőcső-manometria (HRM) során kimutatott cardia és nyelőcsőtest-funkció eltérések segíthetnek a refluxbetegséggel kapcsolatos további terápiás döntésekben. A refluxbetegség Lyoni Konszenzus a betegre individuálisan jellemző reflux fenotípusok meghatározását javasolja a betegség menedzselésének jövőbeni stratégiájaként.
Bevezetés
A refluxbetegség diagnózisa a beteg tüneteinek értékelésén alapul és eszközös kivizsgálás akkor válik szükségessé, amikor a gyógyszeres kezelés sikertelennek bizonyul, illetve ha a diagnózis bizonytalan, vagy sebészeti kezelés igénye merül fel. A refluxbetegség eszközös kivizsgálásának módszertana és az eredmények értékelése a Portóban 2002-ben (1), illetve Magyarországon 2004-ben a Madách színházban (2) megrendezett konszenzus konferencia óta eltelt mintegy 15 évben jelentősen változott. A betegség diagnosztikájának áttekintését különösen aktuálissá teszi a 2017 novemberében Lyonban lezajlott konszenzus konferencia; az ott született szakmai javaslatok összefoglalásai a közelmúltban jelentek meg (3, 4). A refluxbetegség diagnosztikájának fejlődése nagyrészt az időközben széleskörben elérhetővé vált a pH-metria és impedanciavizsgálatra és a nagyfelbontású manometriára alapul. A reflux osesophagitis endoszkópos tüneteinek Los Angeles osztályozása 1999-ben jelent meg (5), de ennek szerepét a Portoi Konszenzus még nem taglalta (1).
A reflux fiziológiás jelenség, és betegségként akkor lép fel, amikor a beteg számára zavaró tünetek vagy szövődményeket okoz. Ezt fogalmazta meg 2006-ban a GERD Montreáli definíciója (6). A 24 órás pH-metria és impedanciamonitorozás, mint a reflux minden formájának elfogadott szenzitív módszere, 2017-re aranystandarddá vált. A betegek kivizsgálásának elsődleges célja az, hogy különbséget tegyünk a kóros reflux, a nyelőcsőben megjelenő valamilyen típusú refluxra jelentkező túlérzékenység és a nyelőcső eredetű funkcionális kórképek között (7). A Portói Konszenzus óta váltak ismertté számunkra a sav expozíciós idő (AET), a reflux-epizódok számának normál értékei, illetve ezek jelentősége a diagnosztikában, valamint a PPI-kezelés mellett, vagy annak kihagyásával végzett vizsgálatok szerepe. A Portói Konszenzus a duodeno-gastro-oesophagealis reflux vizsgálatára az epe fotokémiai detektálására kifejlesztett Bilitec diagnosztikus szerepét még diszkutálja, de szerepe azóta nem nyert megerősítést, így a Lyoni Konszenzus csak, mint nem kellően megbízható módszert említi (4). A nagyfelbontású manometriának (HRM) a GERD diagnosztikájában nincs közvetlen szerepe, de hasznos járulékos információt biztosít a nyelőcsőtest motoros funkciójáról, a nyelőcső kontraktilis válaszkészségéről, valamint a nyelőcső kimeneti obstrukciójáról.
A refluxbetegség eszközös kivizsgálásában a különböző tesztek saját normál és kóros értékekkel rendelkeznek, és ez határozza meg, hogy a GERD diagnózisát megerősítik vagy nem. A Lyoni Konszenzus erőssége és újdonsága éppen abban áll, hogy az egyes diagnosztikus modalitásokat a pozitív vagy negatív prediktív értékük, avagy éppen inkonkluzív voltuk alapján értékeli.
A refluxbetegség diagnózisa
A refluxbetegség klasszikus tünetei: a gyomorégés a regurgitáció és a mellkasi fájdalom. A gyomorégés az epigastriumban jelentkező és retrosternális irányba terjedő égő fájdalmat jelent, leggyakrabban étkezést követően. A regurgitáció során savanyú vagy keserű ízű gyomortartalom jön fel a garatba vagy a szájba. A refluxbetegség a legtöbb beteg esetében heti 2-3 alkalommal előforduló típusos tünetet jelent; a betegek kis részének van naponta tünete. A tünetek általában akkor válnak betegek számára zavaróvá, ha az életminőséget befolyásolja; a heti 4 alkalommal jelentkező reflux, mérhető életminőség-romlást okoz (8). Egyéb atípusos refluxtünet, a globus érzés, ritkán hányinger, illetve az extraoesophagealis tünetek: köhögés, rekedtség, asztma.
Az anamnézis továbbra is alapvető jelentőségű a refluxbetegség kórisméjében, viszont az endoszkópos és pH-metriás leletekkel összevetve, még a specialisták esetében is csak 70% a szenzitivitása és 67% a specificitása (9). A PPI-teszt diagnosztikus értéke sem egyértelmű, hiszen a kedvező PPI terápiás teszt válasz az erozív oesophagitis esetek 69%-ában, a NERD 49%-ában, és az endoszkóposan negatív, de pH-metriával fiziológiás viszonyokat mutató betegek 35%-ában is megfigyelhető (10). Ez alapján a PPI-teszt jelentős placebo hatása feltételezhető, amit a közlemények metaanalízise is igazolt (11). Az irodalom és a diagnosztikus irányelvek többsége megemlíti az empirikus PPI-teszt költségek tekintetében kedvező voltát, ugyanakkor nem vizsgálták az ebből eredő túldiagnosztizálás és túlzott PPI-használat költségvonzatát.
Mikor szükséges endoszkópos vizsgálat?
Amikor az empirikus PPI-kezelésre a tünetek nem megfelelően reagálnak, endoszkópos vizsgálat elvégzése szükséges. A perzisztáló, vagy visszatérő panaszok hátterében az anatómiai eltérés (hiatus hernia), esetleg peptikus strictura igazolására az endoszkópia haszna nyilvánvaló. Egyéb esetekben azonban, az endoszkópos vizsgálat várható diagnosztikus haszna csekély, mert a gyomorégésre panaszkodó kezeletlen betegek egyharmadában, és a savszekréció-gátló kezeltekben csupán 10%-ban látható oesophagitis (12). A funkcionális kórformákkal való jelentős tüneti átfedés következtében a Róma IV konszenzus alapján az endoszkópia és biopszia elvégzése javasolt – különösen dysphagia esetén – az eozinofil oesophagitis kizárása céljából is (13).
Mikor szükséges pH-metria refluxbetegség diagnosztikájában és milyen módszer használata javasolt?
Nyelőcső funkciós vizsgálatot végzünk, ha a GERD egyértelmű diagnózisának igénye merül fel, tehát ha az adekvát terápiára nem megfelelő a tüneti válasz, vagy antireflux műtét kapcsán, illetve atípusos reflux-tünetek esetén. Erozív elváltozások hiánya esetén a 24 órás pH-metria és impedanciavizsgálat lehet alkalmas a refluxbetegség megállapítására. A pH-metria a reflux-jelenségek aciditását, az impedancia pedig a folyadék és gáz reflux-eseményeket, illetve azok mozgási irányát mutatja meg. A pH-metria szenzitivitása 77-100%, specificitása 85-100% (14, 15).
A tranziens alsó nyelőcső sphincter relaxációk (TLESR) alkalmával óránként 2-3 alkalommal reflux élettanilag is előfordulhat, ezért fontos kérdés, hogy mennyi a kórosnak tartható epizódok száma. A Lyoni Konszenzus a 24 óra alatt <40 reflux-epizódot fiziológiásnak, és kórosnak a 80-nál magasabb értéket tartja (3). A nyelőcső savexpozíciójának időtartama (AET) a 24 órás nyelőcső pH-metria során meghatározott elsődleges jelentőségű paraméter. Ezt a mérési időtartam százalékában adják meg és korábban a 4%-ot meghaladó értéket tekintettük kórosnak. Jelenleg a 6%-ot meghaladó értéket tekintjük egyértelműen kórosnak, a 4-6% közötti értékek pedig nem diagnosztikusak (3). A 4-6% közötti AET eseteiben a 80 feletti reflux-epizód és az ezekhez köthető tünet lehet a döntő szempont a reflux kórosként történő értékelésében.
A reflux-esemény és a beteg által észlelt tünet közötti kapcsolatot különböző paraméterek mutatják. A tünet index (SI) a beteg által jelzett panaszt 2 perccel megelőzően előforduló reflux-eseményt veszi tekintetbe, és gyomorégésre vonatkozóan ennek 50%-nál magasabb arányban kell bekövetkeznie (16). A tünet asszociációs valószínűség (SAP) összetett statisztikai számítással állapítja meg a reflux-esemény és a jelzett tünet közötti kapcsolatot, és akkor tekintjük pozitívnak, ha jelenségek véletlenszerűen bekövetkező egybeesésének valószínűségénél kisebb értéket kapunk (p<0,05), vagyis, ha a SAP >95% (17). A két mérőszám együttes használata adja a legjobb eredményt a tünet és a reflux-esemény közötti kapcsolatra (18). Fontos megjegyezni, hogy a SI és SAP relatíve nagyobb számú, PPI-kezelésre rosszul reagáló betegen végzett megfigyelések szerint legfeljebb a betegek egyharmadában volt pozitív a savas és nem savas reflux-epizódokra vonatkozóan. Ezekben a betegekben a reflux mértéke nem nagy, viszont jelentős nap-napi variabilitást mutat, ezért a SI- és SAP-pozitivitás véletlenszerű bekövetkezésének esélye viszonylag nagy. Ezért a szerzők a kizárólagosan SI- és SAP-pozitivitásra alapuló terápiás döntéseket (pl. antireflux műtét) nem javasolják (19). Annál is inkább, mivel eddigi tanulmányok csak a kóros savexpozíció (AET) és a gyógyszeres vagy sebészeti kezelés kimenete közötti korrelációt bizonyították. A SAP meghatározása által biztosított diagnosztikus többlet elsősorban a savas (pH<4) és gyengén savas (4<pH<7) epizódokhoz kötődő panaszok igazolhatósága tekintetében látszik hasznosnak, de ennek a jelentősége még nem tisztázott (20).
A kóros savexpozíció fennállásának igazolhatóságát és a teszteredmények reprodukálhatóságát a mérési időtartamot 48 vagy 96 órára kiterjesztése javítja (21, 22), viszont az ezt lehetővé tévő vezetéknélküli rendszerek költségessége miatt az ebből származó diagnosztikus haszon jelentősége jelenleg korlátozott.
A pH-metria a PPI-kezelés fenntartásával (on-PPI) és felfüggesztésével (off-PPI) végezhető. A PPI-kezelés mellett, a fiziológiás mértékű savexpozíció érték a kezelés hatékonyságát, valamint a savas és gyengén savas reflux-epizódok tünetképző szerepének a meghatározását szolgálhatja. A Lyoni Konszenzus a vizsgálat elvégzését emelt dózisú PPI-kezelés mellett javasolja akkor, ha a GERD korábban egyértelműen igazolt (korábbi endoszkópia által leírt LA-C vagy LA-D-oesophagitis, hosszú szegmens Barrett-oesophagus, vagy korábbi kóros pH-metria) (3). Ebben az esetben a vizsgálat célja a reflux-epizódok és a tünetek közötti korreláció meghatározása a kezelés hatékonyságának, egyéb ok által fenntartott tünetek, rossz compliance igazolása érdekében. Ebben az esetben mindig pH-impedancia vizsgálat javasolt, mivel a PPI-kezelés mellett a reflux-epizódok többsége gyengén savas. A Lyoni Konszenzus minden egyéb esetben a PPI-kezelés elhagyása után javasolja a pH-metria elvégzését (3). Tehát ha az endoszkópos vizsgálat nem, vagy csak enyhe (LA-A, LA-B) oesophagitist mutatott, korábbi pH-metria nem igazolt refluxbetegséget, akkor a PPI legalább 7 nap kihagyása után javasolt a pH-metria elvégzése. Ugyancsak off-PPI történjen az antireflux műtét előtt is a pH-metria. Saját gyakorlatunkban javasoljuk, hogy a PPI elhagyása már 2 héttel a pH-metria impedancia vizsgálat előtt történjen.
A légúti tünetek (köhögés, rekedtség, asztma) és a proximális reflux, illetve laryngealis reflux ok-okozati összefüggésének vizsgálatára a Lyoni Konszenzus nem tesz javaslatot, mivel a módszertan nincs standardizálva, az eredmények értékelése nem egyöntetű és a betegség kimenetele tekintetében vizsgálatok jelenleg nem állnak rendelkezésre (23–25).
Kell-e nyelőcső manometriát végezni refluxbetegség esetén?
Refluxbetegségben az eltérés nélküli manometriás lelet a legvalószínűbb. A PPI-kezelésre nem megfelelően reagáló GERD esetén, ha antireflux műtét merül fel, a nyelőcső-perisztaltika vizsgálatára, illetve más motoros nyelőcsőbetegség tisztázására a nyelőcső-manometria (HRM) elvégzése indokolt. A GERD esetén végzett HRM-vizsgálatokkal gyakran látjuk az gastro-oesophagealis junkció és/vagy a nyelőcsőtest károsodását. A refluxbetegségben a cardia inkompetencia alapvető kórélettani jelenség, és ez annak a barrier funkciónak a károsodását jelenti, amely megakadályozza a gyomortartalom nyelőcsőbe jutását. A HRM viszgálat eredményének kórélettani jelentősége alapvető ugyan, de a gyakorlati szerepe a betegek ellátása szempontjából kevéssé ismert, hiszen az erre alapuló klasszifikáció csak az elmúlt évben jelent meg (26). Ugyanakkor a Lyoni Konszenzus elfogadta és javasolja a GERD-ben a HRM-vizsgálatot, aminek a cardia a nyelőcsőtest vizsgálatára és a kontrakciós rezerv kapacitás meghatározására kell irányulnia. A cardiában a barrierfunkció károsodását az alsó nyelőcső sphincter (LES) és a rekeszszárak közötti szeparáció mértéke, valamint a gastro-oesophagealis junkció kontraktilis integrálja alapján ítélhető meg. Azonban az erre irányuló tanulmányok eredményei, részben az eltérő metodológia miatt, nem egységesek.
A későbbiekben a 3 dimenziós HRM hozhat új eredményeket a cardia-diszfunkció vizsgálatában. A nyelőcsőtest funkciókárosodását a fragmentált hiányzó perisztaltika jelzi. A perisztaltikus károsodás mértéke progresszíve fokozódik a NERD, erozív esophagitis és Barrett-nyelőcső irányába (27, 28). A perisztaltika károsodása általában kóros AET-értékekkel jár, és a legsúlyosabb a hiányzó kontraktilitás esetén (29). A kontrakciós rezerv meghatározására provokációs teszteket (repetitív gyors folyadék vagy száraz nyelések) alkalmazunk. A Lyoni Konszenzus javasolja ezek elvégzését. A repetitív folyadék-nyeletés az oesophago-gastricus junkció obstrukciója és az achalasia differenciálását segíti (30). Ezeket az eltéréseket a Chicago klasszifikációval összhangban célszerű értékelni.
Megbeszélés
A kóros reflux és a GERD összetett klinika megnyilvánulási formái közötti összefüggés nem egyértelmű, mivel a patogenezis heterogén, a terápiás tesztek eredményei változók, és a hiperszenzitivitás által erősen befolyásolt. A PPI-kezelésre jól reagáló betegekben további kivizsgálás csak akkor jön szóba, ha antireflux műtét igénye merül fel. Kezelésre nem megfelelően reagáló betegekben a GERD vonatkozásában a pH-metria impedanciavizsgálat eredménye központi jelentőségű (1. táblázat).
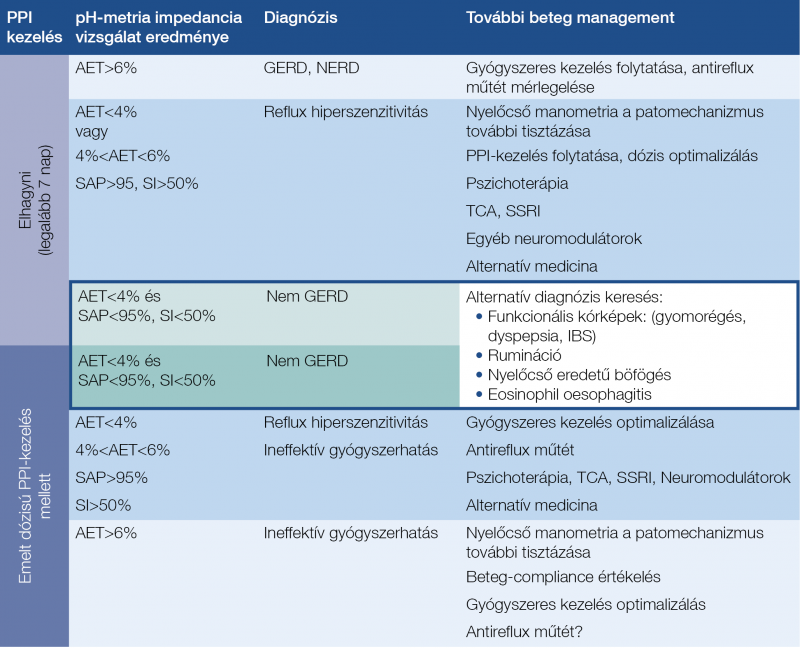
A tünetek tekintetében a klasszikus reflux-tünetek esetén számíthatunk kóros refluxra, a mellkasi fájdalomnál közepes, a köhögés és laryngealis tünetek esetén pedig kicsi a GERD valószínűsége. Az endoszkópia GERD vonatkozásában akkor konkluzív, ha LA-C, LA-D oesophagitist, peptikus strikturát, vagy Barrett-nyelőcsövet látunk. A negatív endoszkópos lelet nem zárja ki a GERD diagnózisát, de ha a pH-metria és impedanciavizsgálat során az AET<4% és a reflux-epizódok száma <40, akkor a GERD valószínűsége PPI-kezelésben nem részesülő betegben csekély. A PPI-kezeltekben az LA-stádium megítélése nehezebb, de a negatív endoszkópos lelet esetén a GERD valószínűsége legfeljebb közepes. A klasszikus tünetek és negatív endoszkópos lelet esetén a pH-metria impedanciavizsgálat eredménye (AET >6%) alapján a tünetasszociációtól függetlenül a NERD állapítható meg. Azokban a betegekben merül fel a reflux hiperszenzitivitás, akikben az AET<4% és a savas, gyengén savas, vagy nem savas reflux epizódokra vonatkozó pozitív tünetasszociáció megállapítható . Ez a funkcionális gasztrointesztinális betegségek Roma IV klasszifikációjában definiált, korábban hiperszenzitív nyelőcsőnek nevezett kórformának felel meg (13). Ebben az esetben a pozitív tünetasszociációt tételezik diagnosztikus kritériumként, függetlenül attól, hogy a pH-metriát PPI-kezelés mellett vagy annak elhagyásával végezzük. Viszont megkövetelt a major nyelőcső-motilitás zavarok kizárása nyelőcső-manometriával. Ha a savexpozíció normális, a reflux-epizódokhoz kötődő tüneti asszociáció és nyelőcső-motilitás eltérés sincs, akkor a PPI-refrakter betegekben funkcionális gyomorégés állapítható meg. A határérték (borderline), vagy inkonkluzív esetekben (LA-A, LA-B-oesophagitis; AET 4-6%, reflux-epizódok száma 40-80) jönnek szóba az egyéb támogató vizsgálatok eredményei: pH-metria impedanciavizsgálattal a reflux tünetasszociáció (SAP), HRM-vizsgálattal a cardia funkció, nyelőcső hipomotilitás (rossz nyelőcső clearence); a szövettani vizsgálat nekrózis eróziót intraepitheliális gyulladásos sejtes infiltrációt, a bazális sejtréteg hiperpláziáját, a sejtközötti rések kiszélesedettségét mutatja. Egyedül ezen kiegészítő jelenségek alapján, különösen a szövettan, és a manometria leletei esetében, a GERD diagnózisa nem állítható fel. Az emelt dózisú PPI mellett is típusos refluxos-tünetekről panaszkodó betegek több mint 90%-ában reflux hiperszenzitivitás – a funkcionális nyelőcső-rendellenességek Roma IV kritériumrendszerében definiált új entitás –, vagy funkcionális gyomorégés diagnosztizálható.
Következtetések
A Lyoni Konszenzus a pH-metria eredményét döntő jelentőségűnek tételezi a refluxbetegségre utaló tünetek esetén, amelyet az endoszkópos lelettel együtt értékelve a kezelés szempontjából a refluxbetegség eltérő fenotípusai határozhatók meg. Szintén új megállapítás az, hogy a GERD diagnózisa egyértelmű akkor, ha endoszkópos vizsgálattal LA-C, LA-D-oseophagitist, peptikus stricturát vagy Barrett-oesophagust mutattak ki, illetve 24 órás pH-monitorozással az AET >6%. Szintén új szempont a diagnosztikus bizonytalanság bevezetése azokban az esetekben, amikor endoszkópos vizsgálattal LA-A vagy LA-B-oesophagitist, illetve 24 órás pH-monitorozással az AET 4-6% közötti értéket találunk.
A Porto Konszenzus óta eltelt 15 év során összegyűlt tapasztalatok alapján kimondható, hogy a refluxbetegség diagnosztikája továbbra is komoly kihívást jelent. A szakértői panel GERD kivizsgálásra vonatkozó javaslatainak minőségére vonatkozó evidenciák 10%-a sem éri el azt a szintet, ahol további vizsgálatok ne hoznának változást a jövőben. A javaslatok egyharmada közepes minőségű és egyharmada pedig rossz minőségű evidenciákra alapul (3), ami azt jelenti, hogy a refluxbetegség területén a jól tervezett perspektíva vizsgálatoktól jelentős változások várhatók.
Bár a GERD kivizsgálásának technikai lehetőségei jelentősen javultak, a gyakorlati diagnosztika továbbra is a PPI-kezelésre jelentkező válaszra alapul. Ha viszont a gyógyszernek nincs számottevő klinikai kedvező hatása, akkor szedése nem indokolt. További kutatások, nagy volumenű prospektív klinikai tanulmányok szükségesek annak eldöntésére, hogy a betegek különböző reflux fenotípusokba sorolása, és az erre alapuló személyre szabott management hogyan javítja a refluxbetegek ellátását.
A közlemény megjelenését az Egis Gyógyszergyár Zrt. támogatta. Az összefoglalóban szereplő információk a szerző(k) nézeteit tükrözik. Bármely említett termék alkalmazásakor az érvényes alkalmazási előírás az irányadó.
1. Sifrim D, Castell D, Dent J, et al. Gastro-oesophageal reflux monitoring: review and consensus report on detection and definitions of acid, non-acid, and gas reflux. Gut 2004; 53: 1024–1031.
2. Simon L, Lonovics J. Tulassay Zs, Wittmann T. A gastrooesophagealis reflux betegség (GERD) emésztőszervi és más szervrendszeri megjelenési formái. Astra-Zeneca Könyvtár, Kiadó: Magyar Gasztroenterológiai Társaság; 2003.
3. Roman S, Gyawali CP, Savarino E, et al. Ambulatory reflux monitoring for diagnosis of gastro-esophageal reflux disease: update of the Porto consensus and recommendations from an international consensus group. Neurogastroenterol Motil 2017; 29: 1–15.
4. Gyawali CP, Savarino E, et al. Modern diagnosis of GERD: the Lyon Consensus. Gut 2018; Feb 3. pii: gutjnl-2017-314722 (Epub ahead of print)
5. Lundell LR, Dent J, Bennett JR, et al. Endoscopic Assessment of Oesophagitis: Clinical and Functional Correlates and Further Validation of the Los Angeles Classification. Gut 1999; 45: 172–180.
6. Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, Global Consensus Group. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006; 101: 1900–1920
7. Galmiche JP, Zerbib F, des Varannes SB. Treatment of GORD: three decades of progress and disappointments. United European Gastroenterol J 2013; 1: 140–150.
8. Kahrilas PJ. Regurgitation in Patients with Gastroesophageal Reflux Disease Gastroenterol Hepatol (NY) 2013; 9: 37–39.
9. Dent J, Vakil N, Jones R, et al. Accuracy of the diagnosis of GORD by questionnaire, physicians and a trial of proton pump inhibitor treatment: the Diamond Study. Gut 2010; 59: 714–721.
10. Bytzer P, Jones R, Vakil N, et al. Limited ability of the proton-pump inhibitor test to identify patients with gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2012; 10: 1360–1366.
11. Numans ME, Lau J, de Wit NJ, et al. Short-term treatment with proton-pump inhibitors as a test for gastroesophageal reflux disease: a meta-analysis of diagnostic test characteristics. Ann Intern Med 2004; 140: 518–527.
12. Poh CH, Gasiorowska A, Navarro-Rodriguez T, et al. Upper GI tract findings in patients with heartburn in whom proton pump inhibitor treatment failed versus those not receiving antireflux treatment. Gastrointest Endosc 2010; 71: 28–34.
13. Aziz Q, Fass R, Gyawali CP, et al. Functional esophageal disorders. Gastroenterology 2016; 150: 1368–1379.
14. Pandolfino JE, Richter JE, Ours T, et al. Ambulatory esophageal pH monitoring using a wireless system. Am J Gastroenterol 2003; 98: 740–749.
15. Becker V, Bajbouj M, Waller K, et al. Clinical trial: persistent gastro-oesophageal reflux symptoms despite standard therapy with proton pump inhibitors – a follow-up study of intraluminal-impedance guided therapy. Aliment Pharmacol Ther 2007; 26: 1355–1360.
16. Singh S, Richter JE, Bradley LA, et al. The symptom index. Differential usefulness in suspected acid-related complaints of heartburn and chest pain. Dig Dis Sci 1993; 38: 1402–1408.
17. Weusten BL, Roelofs JM, Akkermans LM, et al. The symptom-association probability: an improved method for symptom analysis of 24-hour esophageal pH data. Gastroenterology 1994; 107: 1741–1745.
18. Taghavi SA, Ghasedi M, Saberi-Firoozi M, et al. Symptom association probability and symptom sensitivity index: preferable but still suboptimal predictors of response to high dose omeprazole. Gut 2005; 54: 1067–1071.
19. Slaughter JC, Goutte M, Rymer JA, et al. Caution about overinterpretation of symptom indexes in reflux monitoring for refractory gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2011; 9: 868–874.
20. Patel A, Sayuk GS, Gyawali CP. Parameters on esophageal pH-impedance monitoring that predict outcomes of patients with gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2015; 13: 884–891.
21. Scarpulla G, Camilleri S, Galante P, et al. The impact of prolonged pH measurements on the diagnosis of gastroesophageal reflux disease: 4-day wireless pH studies. Am J Gastroenterol 2007; 102: 2642–2647.
22. Sweis R, Fox M, Anggiansah A, et al. Prolonged, wireless pH-studies have a high diagnostic yield in patients with reflux symptoms and negative 24-h catheter-based pH-studies. Neurogastroenterol Motil 2011; 23: 419–26.
23. Vaezi MF, Schroeder PL, Richter JE. Reproducibility of proximal probe pH parameters in 24-hour ambulatory esophageal pH monitoring. Am J Gastroenterol 1997; 92: 825–859.
24. McCollough M, Jabbar A, Cacchione R, et al. Proximal sensor data from routine dual-sensor esophageal pH monitoring is often inaccurate. Dig Dis Sci 2004; 49: 1607–1611.
25. Zerbib F, Roman S, Bruley Des Varannes S, et al. Normal values of pharyngeal and esophageal 24-hour pH impedance in individuals on and off therapy and interobserver reproducibility. Clin Gastroenterol Hepatol 2013; 11: 366–372.
26. Gyawali CP, Roman S, Bredenoord AJ, et al. Classification of esophageal motor findings in gastro-esophageal reflux disease: conclusions from an international consensus group. Neurogastroenterol Motil 2017; 29: e13104.
27. Rosztóczy A, Izbéki F, Róka R, et al. The evaluation of oesophageal function in patients with different types of oesophageal metaplasia. Digestion 2011; 84: 273–280.
28. Savarino E, Gemignani L, Pohl D, et al. Oesophageal motility and bolus transit abnormalities increase in parallel with the severity of gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2011; 34: 476–86.
29. Rengarajan A, Bolkhir A, Gor P, et al. Esophagogastric junction and esophageal body contraction metrics on high-resolution manometry predict esophageal acid burden. Neurogastroenterol Motil 2017. doi: 10.1111/nmo.13267.
30. Ang D, Hollenstein M, Misselwitz B, et al. Rapid Drink Challenge in high-resolution manometry: an adjunctive test for detection of esophageal motility disorders. Neurogastroenterol Motil 2017; 29: e12902.
