Original publication
The EUS and ERCP connection: unity is the future
Summary
EUS and ERCP developed independently for some years, but in today’s practice they started to converge with each other. For instance, in the case of jaundice due to a pancreatic head tumor we can provide diagnostic (histology sampling, loco-regional staging) and therapeutic (biliary duct stenting, celiac neurolysis) help to the patient with the integrated approach. EUS is a very attractive technique, even among ERCP professionals, due to the advanced need for accurate and real-time imaging information before any therapeutic manoeuvres in the management of bilio-pancreatic pathologies. EUS, which was first developed as an exlusively diagnostic technique, has acquired therapeutic roles, and interventional ERCP recently returned to its original intraductal diagnostic purpose in recent years. The combination of their diagnostic and therapeutic potential is powerful in many clinical situations, such as indeterminate biliary stenosis, biliary stones, chronic pancreatitis and bilio-pancreatic malignancies. The integration between EUS and ERCP can be expressed in different clinical scenarios highlighted in the publication, showing the clinical applicability of performing the two procedures in one endoscopic session, with its positive implications for the patient, the endoscopist and the health care system.
Összefoglalás
A pancreatobiliaris betegségek endoszkópos kezelése során a mindennapokban szembesülhetünk azzal, hogy az EUH és az ERCP ugyan elméletileg két különböző vizsgálóeljárás, de a gyakorlatban mégis egymástól elválaszthatatlanok. Egy pancreasfeji térfoglalást alapul véve gyakran a betegnek egyszerre van szüksége diagnosztikus (stádiumbeosztás és mintavétel) és terápiás (epeelfolyás megoldása és fájdalomcsillapítás) segítségre. Az ERCP-t végző szakemberben nem alaptalan a vágy, hogy teljes körű diagnosztika (EUH) után végezze a beavatkozást, így a beteg számára a legoptimálisabb kezelési stratégiát választva. A cél a módszerek együttműködésével érhető el: a diagnosztikában az EUH kap főszerepet (bár az intraductalis diagnosztikában az ERCP jelentősége egyre bővül), a terápiát pedig hagyományosan az ERCP végzi (bár egyre gyakrabban végzünk terápiás EUH-t is). A két módszer közös fejlődése és együttműködése látványos indeterminált epeúti szűkületekben, epeúti kövességben, krónikus pancreatitisben és pancreatobiliaris malignitás esetén. A cikkünkben az EUH-ERCP együttműködés lehetőségeire gyakorlati példákkal is rávilágítunk, bemutatva a kombinált (akár egy ülésben végzett) vizsgálatok előnyeit a beteg, a személyzet és az egészségügyi finanszírozó számára. Az új tendencia magával hozza az oktatási és betegirányítási rendszer jövőbe mutató szervezési kérdéseit is.
Bevezetés
Az endoszkópos retrográd kolangiopankreatográfiát (ERCP) a 60-as évek végén, az endoszkópos ultrahangot (EUH) a 80-as évek végén fejlesztették ki azzal a céllal, hogy a pancreatobiliaris régió anatómiai viszonyairól pontosabb képet nyerhessünk. Annak ellenére, hogy az ERCP-t diagnosztikus célra alkották, a 2010-es évektől a hangsúly szigorúan a terápiás indikációs kör felé tolódott, mivel olyan nem invazív, de hasonló diagnosztikus pontosságú képalkotó eljárások terjedtek el, mint az MRCP vagy az EUH. Az elmúlt évtized szemtanúja volt az ún. kiegészítő technikai eszközök bevezetésének, mint az intraductalis ultrahang (IDUH), kolangioszkópia és a konfokális lézer-endomikroszkópia (pCLE). A kolangioszkópia és a pankreatoszkópia elősegítették azt, hogy az ERCP ismét fontos diagnosztikus eszközzé válhatott az indeterminált epeúti és pancreasszűkületek diagnosztikájában (1). A diagnosztikus céllal kifejlesztett EUH-t alapvetően biopszia elvégzése céljából használták, de mára számos EUH-vezérelt terápiás beavatkozás vált ismertté (pl. peripancreaticus folyadékok drenázsa, necrosectomia, epeúti drenázs és gasztroenterális anastomosisok létesítése).
Ezek az újdonságok az EUH-t igen vonzóvá tették, még az ERCP-t végző endoszkópos szakemberek körében is, hiszen a biliopancreaticus régió heterogén betegségeinek pontos diagnosztikája és terápiája ma már nem lehetséges EUH nélkül. Emiatt érthető, hogy bár korábban az EUH és az ERCP külön fejlődési utakon jártak, de az ERCP diagnosztikus és az EUH terápiás potenciáljának fejlődésével a két technika mára már nem elválasztható egymástól. A célok közösek (pl. mintavétel: FNB vagy intraductalis, epeúti drenázs: transpapillaris vagy transmuralis), így a technikák is közösen fejlődhetnek tovább, számtalan kombinációs lehetőséget eredményezve, és nagymértékben javítva a betegellátás színvonalát. Már nem lepődünk meg, amikor a beutalón nem „EUH-vizsgálat” vagy „ERCP-vizsgálat” mérlegelését kérik, hanem „EUH-ERCP konzíliumba” küldik a beteget, felismerve a kombinációs lehetőségek széles tárházát, a problémaorientált (nem eszközorientált) látásmódot és a terület specializálódását az endoszkópián belül is. Az EUH-ERCP konvergáló útját olasz szerzők előszeretettel hívják „EURCP”-nek, azaz endoszkópos ultrahang – retrográd kolangiopankreatográfiának is (2).
Az EUH és az ERCP együttműködésének lehetőségei és szükségessége
Az EUH-ERCP kollaboráció igen sokoldalú lehet, bizonyos esetekben az EUH indikálja (epeúti kövesség), más esetekben kiegészíti (hasnyálmirigytumor és krónikus gyulladás) az ERCP-vizsgálatot.
Az EURCP elgondolás egyik indikációs területe a choledocholithiasis. Az epeúti kövesség „alacsony vagy intermedier” valószínűsége esetében EUH-elővizsgálat szükséges, amely igazolhatja a kő jelenlétét, ezzel indikálva az ERCP-vizsgálatot. Diagnosztikus ERCP-t végezve a betegek 12%-ánál széles súlyossági skálán mozgó szövődmények alakulhatnak ki, például epeúti gyulladás, vérzés, perforáció és akut hasnyálmirigy-gyulladás. Az EUH elfogadható pozitív prediktív érték mellett nagy negatív prediktív értékkel rendelkezik, így nagy pontossággal (szenzitivitás 89%, specificitás 94%) és kis rizikóval azonosíthatja az epeúti kövességet (3). Pausawasdi és munkatársai 131 betegen végeztek vizsgálatot, akiknek korábbi képalkotók alapján ismeretlen etiológiájú epeúttágulatuk volt. Az EUH a betegek 67%-ában mutatta ki az epeúttágulat okát (31% malignus, 18,3% kőbetegség) (4). Az EUH-nak a pancreatobiliaris eltérések diagnosztikájában az MRCP a kihívója: egy metaanalízis azt találta, hogy az EUH nagyobb szenzitivitással rendelkezett az MRCP-vel szemben choledocholithiasist vizsgálva (95% vs. 87%), különösen a 6 mm-nél kisebb kövek esetében, a specificitásban viszont szignifikáns különbség nem volt (90% vs. 92%) (5). Továbbá több vizsgálat is azt mutatta, hogy ha a költséghatékonyságot és a kockázat-haszon elemzést is figyelembe vesszük, akkor az EUH megfelelőbb extrahepatikus epeúti betegségek gyanúja esetén, mint az ERCP vagy az MRCP (6, 7). Az ERCP kiváló diagnosztikus pontossága csak jóval magasabb szövődményrátával érhető el, de az EUH-val a felesleges ERCP, illetve kapcsolódó komplikációk elkerülhetőek. Az ASGE (American Society of Gastrointestinal Endoscopy) és ESGE (European Society of Gastrointestinal Endoscopy) a betegeket choledocholithiasis rizikója szempontjából alacsony (<10%), közepes (10–50%) és magas (>50%) rizikócsoportba sorolja, a kategóriák a klinikai rutint befolyásolják. 2019-es irányelvek alapján a magas rizikójú betegeket az alábbi kritériumok alapján definiálták a diagnosztikus ERCP-k és szövődményeik limitálására: képalkotó alapján kő jelenléte bizonyítható a közös epevezetékben, tág közös epevezeték (6 mm-nél nagyobb – epehólyag jelenlétében, 8 mm-nél nagyobb – cholecystectomia után), totál bilirubin >68,4 µmol/l vagy epeútgyulladás klinikuma. Azon betegeknél, akik a magas rizikócsoportba sorolhatóak, ERCP javasolt elsődleges vizsgálatként diagnosztikus és terápiás céllal. Ellenben a közepes rizikóval rendelkezők esetén (totál bilirubin 27,4–68,4 µmol/l, 55 év felettiek, tágult epevezeték) EUH vagy MRCP javasolt az ERCP tényleges szükségességének megítélésére (8, 9). Kimutatható, hogy ebben a betegcsoportban az EUH bevetésével 67%-ban kerülhető el az ERCP-vizsgálat (10). Az elmúlt években a kőre magas rizikójú betegek esetében is terjed az EUH használata, hiszen a kövek számát, méretét és pontos elhelyezkedését is leírhatjuk, segítve a terápia tervezését (11). Az EUH után az ERCP azonnali (egy ülésben) elvégzésének több klinikai előnye van: az ERCP-hez teljesen friss („real-time”) diagnosztika áll rendelkezésre (spontán kőmigráció nem történik közben), illetve az ERCP-re való várakozás rövidülésével csökken a cholangitis vagy biliaris pancreatitis rizikója is (12).
A második alcsoportba sorolható a pancreatobiliaris daganatok okozta sárgaság, ahol az EUH és az ERCP kiegészítik egymást. Az EUH a szövettani verifikáció mellett segíti a stádium pontosítását, és a finomtűvel végzett plexus coeliacus neurolízis fájdalommentességet eredményezhet, illetve az ERCP során epeúti stentelést végezhetünk. A transabdominalis UH és CT szélesebb körben elérhető elsővonalbeli technikák, de fontos tudnunk, hogy az EUH hasnyálmirigy-terime esetén a legpontosabb kiegészítő technika. Egy 3 cm-nél kisebb tumor esetén az EUH 93%-os szenzitivitása messze meghaladja az MR (67%) vagy a CT (53%), de még az FDG-PET/CT (80,1%) szenzitivitását is (13, 14). Hasnyálmirigy-adenocarcinomára magas rizikójú betegben az EUH által leírt léziókat a CT és az MR 19/92 (22,3%) esetben nem ismerte fel, ezek az eltérések mind releváns szolidumok voltak (15). Az EUH-nak „köztudottan” magas a negatív prediktív értéke pancreasrákra (közel 100%), de ez csak nagy esetszámoknál igaz, hiszen az EUH vizsgálófüggő eljárás (16, 17). Az EUH szerepe lokoregionális stagingben kiemelt, különösen jól bevethető a vénás confluence megítélésére (a CT-nél is jobb), a T-stádiumot 90% feletti szenzitivitással határozza meg (jobb, mint a CT, MR, PET-CT) (18). Az EUH-val végzett stádiummeghatározás a betegutat 14%-ban módosította új, inoperabilitást jelentő eltérések felfedezésével (19). A harmadik generációs FNB-tűk megjelenésével pedig nemcsak kiváló citológiai, de az esetek több mint 95%-ában core biopsziás mintához is jutunk (20). A fentiek alapján az EUH szerepe megalapozott a pancreasrák diagnosztikai algoritmusában, és az ERCP-vizsgálat sem nélkülözheti a fenti diagnosztikus információkat (1. ábra).
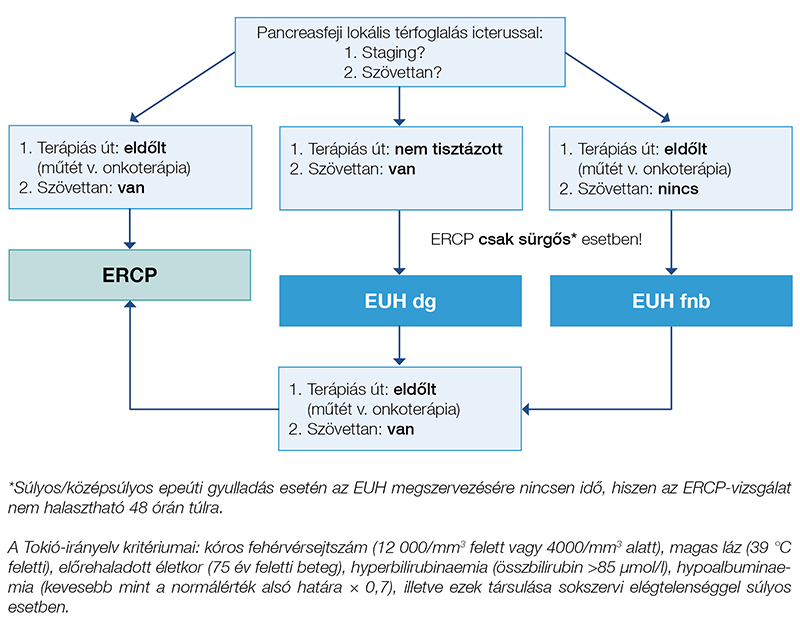
Az EUH-nak fontos szerepe van krónikus pancreatitisben is, hiszen a legpontosabb információt nyújtja a krónikus pancreatitis jelenlétéről (parenchyma és ductalis jelek), súlyosságáról, és fájdalom esetén plexus coeliacus blokád is végezhető, míg az ERCP-vel a pancreasvezetéken terápiás beavatkozást tudunk végezi. Krónikus hasnyálmirigy-gyulladás okozta folyadékgyülemek ellátásánál is tetten érhető az EUH-ERCP együttműködés, különösen akkor, amikor a vezetékszűkület stentelése (ERCP) is szükséges a pseudocystogastrostomia (EUH) hosszú távú sikeréhez (21).
Az EUH- és az ERCP-vizsgálatok sorrendjének meghatározásánál általános szabályként megfogalmazható, hogy a diagnosztikus vizsgálat (EUH) előnyben részesítendő a terápiás beavatkozással (ERCP) szemben (1. ábra). A kívánatos sorrend sajnos a mindennapi rutinban gyakran megfordul, pedig az ERCP előtt már jó tudnunk, hogy mi okozza a sárgaságot (pl. daganat esetében fémstent választandó), hogy tényleg van-e epeúti kövesség (negatív EUH esetén az ERCP szükségtelen), illetve hogy operábilis-e a daganat (operábilis esetben a direkt sebészi megoldás előnyben részesítendő az ERCP-vel szemben). Az „első az EUH” stratégia a fenti okok mellett azért is fontos, mert az EUH diagnosztikus hatásfoka ERCP nélkül (stentműtermékek) lényegesen jobb (22), így fájdalmatlan icterus esetén az EUH előtt elvégzett ERCP kifejezetten megnehezítheti az EUH-t végző szakemberek dolgát. Az EUH olykor háttérbe szorulhat akut cholangitis (fájdalmatlan icterus mellett ritkaság) vagy májbiopsziával igazolt, metasztatikus pancreasdaganat (sem staging, sem mintavétel nem szükséges már) esetében.
Az EUH fentiekben részletezett indikáló és kiegészítő szerepe mellett az epeúti terápiás EUH megjelenésével az endoszkópos ultrahang az ERCP-vizsgálatok fontos kiegészítője („rendezvous” technikák) vagy akár helyettese (sikertelen ERCP) is lehet, erről a következőkben szólunk bővebben.
Epeúti intervenciók, avagy az EUH mint az ERCP lehetséges alternatívája
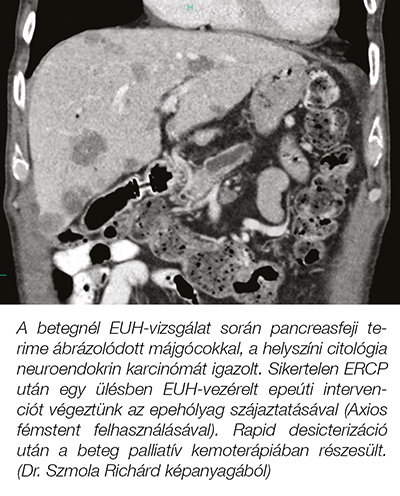
Az EUH-hoz kapcsolódó terápiás paletta mára nagyon széles lett, az ERCP-hez hasonló eredményességgel, sokszor még túljutva az ERCP során felmerülő technikai határokon is. Epeúti obstrukcióban szenvedő betegek esetén az ERCP-re gondolunk mint első terápiás lépésre, hiszen az eredményessége 90-97% közé tehető, ugyanakkor tudjuk, hogy bizonyos szituációkban az ERCP kivitelezhetetlen vagy ineffektív (23). Utóbbi esetekben az EUH-vezérelt epeúti drenázs (EUH-BD) egy jól járható út, amely a Vater-papilla érintése nélküli, sikeres epeúti drenázst biztosít. Az EUH-vezérelt transmuralis biliodigestiv anastomosis külföldön az emelt szintű EUH-ERCP központokban már a mindennapok részét képezi. Elmondhatjuk, hogy hazánkban is, az Országos Onkológiai Intézet EUH-ERCP laborjában, sikeresen beállításra került és elérhető az EUH-BD módszertana. Az EUH-BD főbb technikái mechanicus icterus esetén a hepaticogastrostomia (2. ábra) és a choledochoduodenostomia (3. ábra), illetve válogatott esetekben cholecystoduodenostomia is végezhető (4. ábra) (24).
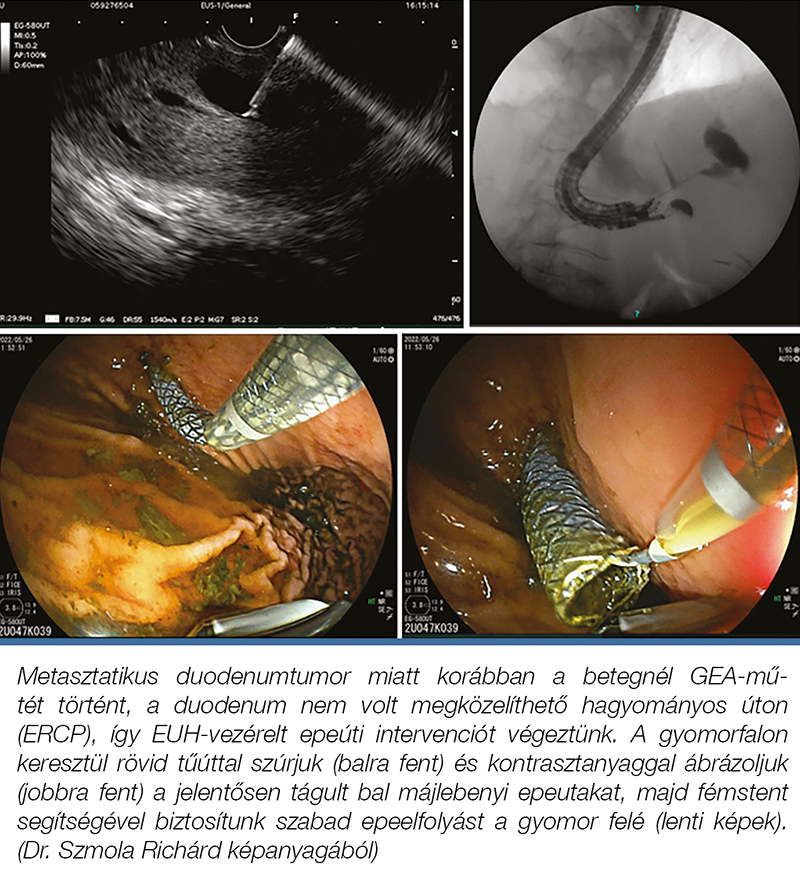
és az intrahepaticus epeutak között (hepaticogastrostomia „Giobor” stenttel)
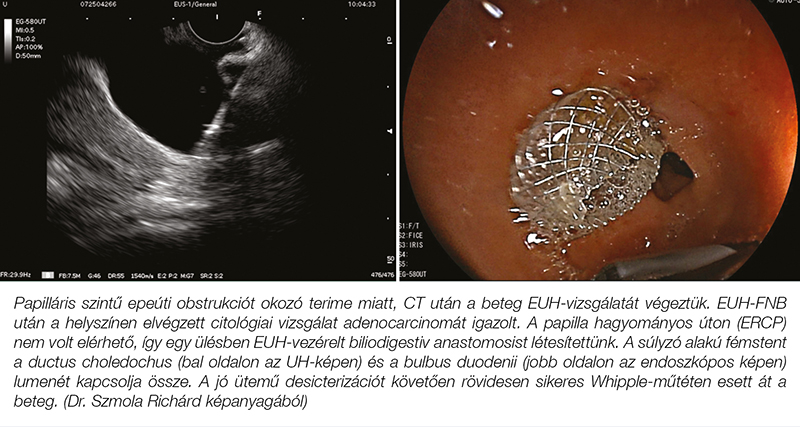
A technikák lényege, hogy a szélesebb körben elérhető endoszkópos pseudocystogastrostomiához hasonlóan EUH-vezérelten célozzuk, és FNA-tű segítségével érjük el, a tápcsatorna lumenéhez közel elhelyezkedő folyadéktartalmú képleteket, majd anastomosist hozunk létre a pangó epeút és a tápcsatorna között transmuralis stentelés útján. EUH-BD esetében az intrahepaticus (2. ábra) és extrahepaticus (3. ábra) epeutak drenázsa is megoldható a béllumen irányába. Fontos megjegyezni, hogy az EUH-BD vetekszik a PTD hatékonyságával, így a jelenlegi ESGE-ajánlás alapján malignus epeúti obstrukció esetén, ha az ERCP sikertelen volt, az EUH-vezérelt eljárás előnyben részesítendő a PTD-vel szemben, így elkerülhetőek a külső drainnel járó problémák (diszkomfort, infekció, vérzés, diszlokáció, epecsorgás) (24). A nemzetközi esetszámok látványos növekedésével a tanulmányok manapság már azt a kérdést is felteszik, hogy az EUH-BD lehet-e esetleg alternatívája az ERCP-nek malignus distalis epeúti obstrukció esetén. Három randomizált kontrollált vizsgálat hasonlította össze az EUH-BD-t az ERCP-vel ebben az indikációban (25, 26, 27). Két vizsgálat nem talált szignifikáns különbséget az EUH-BD és az ERCP között a sikerrátában vagy a szövődmények számát tekintve (25, 27), ugyanakkor Paik és munkatársai az EUH-BD-t még jobbnak is találták az ERCP-nél a stentdiszfunkció, a stent átjárhatósági ideje, a szövődmények száma és a reintervenciós szükség szempontjából (26). Ezt a tendenciát két metaanalízis is megerősítette (28, 29). A fenti eredmények alapján inoperábilis malignus distalis epeúti obstrukcióban az ESGE-irányelv az EUH-BD-t elsődleges technikaként is javasolja az ERCP alternatívájaként (24).
Malignus hilaris epeúti szűkületek (Bismuth Corlette III/IV) ellátásában az ERCP és az EUH-BD kiegészíthetik egymást, egy májlebeny epeúti drenázsát ERCP útján, a másikét pedig EUH-BD útján lehet megoldani (mindkét esetben fémstentek beültetésével), így a rekurráló obstrukciók száma csökkenthető. A fenti eljárásnak a kombinált endoszkópos retrográd és endoszkópos ultrahang vezérelte kolangiográfia (CERES) nevet adták, ami jó példa a két technika terápiás együttműködésére a gyakorlatban (30).
Az EUH segítheti az ERCP-t transpapillaris vezetődrót pozicionálásával (bélfalon keresztül, anterográd módon), amelyen a korábban kanülációs gondok miatt sikertelen ERCP mégis befejezhető. Az úgynevezett „rendezvous” technika eddig csak perkután transhepaticus (PTD) úton volt lehetséges, de mostanában az EUH térnyerésével a lehetőségek tárháza bővült. Nemcsak az epeúti intervenciókban hasznos a terápiás EUH, hiszen EUH-vezérelt anterográd technikával a pancreasvezeték is elérhető sikertelen ERCP után. A Wirsung-vezeték fibrotikus szűkülete, passzálhatatlan kő vagy műtét után megváltozott anatómiai szituációkban az epeutakra leírt „rendezvous” vagy „transmuralis” technikák hasnyálmirigy-vezetékben is 70-90% közötti sikerrátával alkalmazhatók, de még gyakorlott kézben is magasabb a szövődmények előfordulása, mint a hagyományos ERCP során („rendezvous” esetén közel 20%), így a technika széles körben még nem terjedt el (31).
Az EUH-BD-beavatkozások egy friss metaanalízis alapján expert kézben 95%-os sikerrátával és 13,7%-os szövődményaránnyal járnak. Korai szövődmény az epecsorgás (2,2%) és cholangitis (1%), késői szövődmény a stentmigráció (1,7%) és a stentelzáródás (11%), amelyek 16,2%-os reintervenciós szükséghez vezetnek (32). Fontos hangsúlyozni, hogy ha szövődmény lép fel, annak kezelése kiemelten komplex, így ezen beavatkozások elvégzése magasan képzett endoszkópos szakembereket és – a szövődmények miatt – jól megalapozott intervenciós radiológiai és sebészeti hátteret igényelnek. A pancreatobiliaris vezetékeket célzó terápiás EUH-beavatkozások a legkomplexebbek, magasabb a szövődményrátájuk, és kisebb betegpopulációt érintenek, ezért széles körű elterjedésük nem várható, de egy-két „emelt szintű EUH-ERCP” központ el tudja majd látni a hazai igényeket. A közlemény 3. és 4. ábrája egy ülésben végzett EUH-diagnosztikát, ERCP-kísérletet és sikeres EUH-terápiát mutat be.
Az „egy ülésben” végzett EUH + ERCP előnyeiről
Az EUH és az ERCP gyakran két ülésben, külön szobában, külön orvossal, külön napon történik, a beteg duplázott terhelését, szedációját eredményezve. Ezek alapján felmerülhet a kérdés: szükségszerű-e a vizsgálatok elkülönítése a mindennapi gyakorlatban?
A két vizsgálat nemcsak két lépésben, hanem akár egy ülésben is megvalósulhat, ha a vizsgálószobában röntgenberendezés és EUH is rendelkezésre áll. Az utóbbi stratégiának előnye, hogy a beadott bódítószerek mennyisége lényegesen csökken, a beavatkozás utáni obszerváció egyszeri, illetve egy endoszkópos helyiséget foglalunk csak le, és ideális esetben csak egy szakorvost. A fenti strukturális szempontok mellett az ERCP-t megelőző diagnosztikai adat „valós idejű”, így megbizonyosodhatunk az epeúti kő jelenlétéről, illetve egy epeúti szűkület pontos helyéről és az egyéb anatómiai viszonyokról, helyszíni citológia a diagnózis pontosításában is segítségünkre lehet. Az elérhető tanulmányok szerint a szövődmények száma az egy ülésben végzett vizsgálatok során nem emelkedik, illetve a diagnosztikus pontosság (EUH) és a kanülációs sikerráta (ERCP) is azonos a két lépésben elvégzett vizsgálatokkal összevetve. A betegek komfortérzete jobb, lerövidül a hospitalizáció, illetve az onkológiai kezelésig eltelt idő is (12, 33, 34). Megemlítendő, hogy a felsorolt mutatók nagy esetszámú nemzetközi központokból származnak, a két vizsgálat kombinálása komoly felkészültséget kíván a pancreatobiliaris endoszkópos szakembertől (35).
Ezeket a gyakorlati előnyöket felismerve már nem meglepő, hogy az EUH és az ERCP eszköztárát nemzetközileg elismert centrumokban, egy szobában és egy orvos kezében igyekeznek összehozni. Ráadásul indulhattak olyan hibrideszköz-fejlesztések is, amelyek egyetlen endoszkópban ötvöznék az echoendoszkóp (EUH) és a duodenoszkóp (ERCP) tudását (2). Optimális, ha a vizsgálatok egy ülésben és megfelelő kombinációban történhetnek meg, így biztosítva a beavatkozás pillanatában az összes diagnosztikus és terápiás lehetőséget a beteg számára.
Konklúziók
Az EUH és az ERCP külön-külön is fontos diagnosztikai és terápiás beavatkozást tesznek lehetővé, de igazán az együttműködésük hatékony, együtt fedik le a pancreatobiliaris endoszkópia lehetőségeinek tárházát. A leggyakrabban az EUH-diagnosztika segít az ERCP-indikáció pontos felállításában és a terápia tervezésben, de az ERCP epeúti terápiás segítséget is kérhet az EUH-tól, illetve az ERCP is nyújthat intraductalis diagnosztikus segítséget az EUH-nak. Az epeúti kövességben, krónikus pancreatitisben és pancreatobiliaris malignitás esetén egyesíteni lehet a két eljárás előnyeit. Az EUH hasznos információkat nyújt a pancreatobiliaris régió anatómiai viszonyairól, illetve lehetőséget ad diagnózisra, stádiumbesorolásra, és nem utolsósorban segíthet az ERCP megfelelő indikációjának felállításában (1. ábra). Az együttműködés még látványosabb, ha a két vizsgálat egy ülésben megvalósulhat, hiszen egy szobában, egyszeri altatással, lehetőleg ugyanaz a szakember elvégezheti a komplex endoszkópos diagnosztikát és terápiát. Az EUH látványos fejlődésével egyes esetekben (inoperábilis pancreasfeji daganat) mint önálló módszer is képes az endoszkópos feladatok ellátására (FNB + lokoregionális staging + fájdalomcsillapítás + transmuralis stentelés).
Az EUH-ERCP együttműködés a klinikai implikációkon túl fontos oktatási és betegszervezési szempontokat is felvet. Mint láthatjuk, az EUH- és az ERCP-technikák közötti kollaboráció olyan magas fokot ért el, hogy bár az „alapszintű ERCP” képzésben nem feltétlenül, de az „emelt szintű ERCP” képzés részeként már kívánatos az EUH-tudás elsajátítása is. Ha az EUH- és ERCP-szakértelem egy kézben összpontosul, garantált, hogy a vizsgálatok optimális kombinációban, sorrendben és akár egy ülésben valósulhatnak meg. Az egészségügyi ellátórendszer szemszögéből ez rövidebb hospitalizációs időt, az onkológiai kezelésig eltelt idő látványos rövidülését és költséghatékonyabb működést eredményezhet. Az EUH hazai térnyerésével a vármegyei, alapszintű ERCP-központok mellett 2-3 vármegyét ellátó, emelt szintű EUH-ERCP-központok (intervenciós endoszkópiák) jöhetnek létre, ahol a pancreatobiliaris betegek komplexebb és hatékonyabb endoszkópos ellátása biztosított, valamint a jövő szakembereinek integrált képzése is megoldódhat. A dedikált központok kialakításáig is segíthetjük a betegek hatékony ellátását, ha a komplex beavatkozásokat (pl. fájdalmatlan icterus, pancreasintervenció) olyan specializált endoszkópos munkahelyre irányítjuk, ahol az EUH és az ERCP együttműködése megvalósul a mindennapokban. Hiszen, talán nem túlzás állítani, hogy a pancreatobiliaris endoszkópia jövője az EUH- és az ERCP-vizsgálatok egységében rejlik.
Köszönetnyilvánítás
Az Országos Onkológiai Intézetben működő EUH-ERCP labor minden kedves dolgozójának köszönjük az áldozatos munkáját!
Irodalom
2. De Angelis CG, Dall`Amico E, Staiano MT, et al. The Endoscopic Retrograde Cholangiopancreatography and Endoscopic Ultrasound Connection: Unity Is Strength, or the Endoscopic Ultrasonography Retrograde Cholangiopancreatography Concept. Diagnostics (Basel) 2023; 13(20): 3265.
https://doi.org/10.3390/diagnostics13203265
3. Garrow D, Miller S, Sinha D, Conway J, Hoffmann BJ, Hawes RH, Romagnuolo J. Endoscopic Ultrasound: A meta-analysis of test performance in suspected biliary obstruction. Clin Gastroenterol Hepatol 2007; 5(5): 616–623. https://doi.org/10.1016/j.cgh.2007.02.027
4. Pausawasdi N, Hongsrisuwan P, Kamani L, et al. Diagnostic Value of Endoscopic Ultrasonography for Common Bile Duct Dilatation without Identifiable Etiology Detected from Cross-Sectional Imaging. Clin Endosc 2022; 55: 122–127. https://doi.org/10.5946/ce.2021.122
5. Meeralam Y, Al-Shammari K, Yaghoobi M. Diagnostic accuracy of EUS compared with MRCP in detecting choledocholithiasis: A meta-analysis of diagnostic test accuracy in head-to-head studies. Gastrointest Endosc 2017; 86: 986–993. https://doi.org/10.1016/j.gie.2017.06.009
6. Scheiman JM, Carlos RC, Barnett JL, Elta GH, Nostrant TT, Chey WD, et al. Can endoscopic ultrasound or magnetic resonance cholangiopancreatography replace ERCP in patients with suspected biliary disease? A prospective trial and cost analysis. Am J Gastroenterol 2001; 96(10): 2900–4. https://doi.org/10.1111/j.1572-0241.2001.04245.x
7. Karakan T, Cindoruk M, Alagozlu H, Ergun M, Dumlu S, Unal S. EUS versus endoscopic retrograde cholangiography for patients with intermediate probability of bile duct stones: a prospective randomized trial. Gastrointest Endosc 2009; 2: 244–52. https://doi.org/10.1016/j.gie.2008.05.023
8. ASGE Standards of Practice Committee, Buxbaum J, Abbas Fehmi S, Sultan S, Fishmann D, Qumseya B, et al. ASGE guideline on the role of endoscopy in the evaluation and management of choledocholithiasis. Gastrointest Endosc 2019; 89: 1075–1105. https://doi.org/10.1016/j.gie.2018.10.001
9. Manes G, Paspatis G, Aabakken L, Anderloni A, Arvanitakis M, Ah-Soune P, et al. Endoscopic management of common bile duct stones: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2019; 51(5): 472–491. https://doi.org/10.1055/a-0862-0346
10. Petrov M, Savides T. Systematic review of endoscopic ultrasonography versus endoscopic retrograde cholangiopancreatography for suspected choledocholithiasis. BJS 2009; 97: 967–974. https://doi.org/10.1002/bjs.6667
11. Fusaroli P, Lisotti A, Syguda A, D’ercole M, Maimone A, Fabbri C, et al. Reliability of endoscopic ultrasound in predicting the number and size of common bile duct stones before endoscopic retrograde cholangiopancreatography. Dig Liver Dis 2016; 48: 277–282. https://doi.org/10.1016/j.dld.2015.10.007
12. Fusaroli P, Lisotti A. EUS and ERCP in the Same Session for Biliary Stones: From Risk Stratification to Treatment Strategy in Different Clinical Conditions. Medicina (Kaunas) 2021; 57(10): 1019. https://doi.org/10.3390/medicina57101019
13. Fusaroli P, Kypraios D, Caletti G, Eloubeidi M. Pancreatico-biliary endoscopic ultrasound: a systematic review of the levels of evidence, performance and outcomes. WJG 2012; 18(32): 4243–56. https://doi.org/10.3748/wjg.v18.i32.4243
14. Tang S, Huang G, Liu J, Liu T, Treven L, Song S, et al. Usefulness of 18F-FDG PET, combined FDG-PET/CT and EUS in diagnosing primary pancreatic carcinoma: a meta-analysis. Eur J Radiol 2011; 78(1): 142–50. https://doi.org/10.1016/j.ejrad.2009.09.026
15. Canto M, Hruban R, Fishman E, Kamel I, Schulik R, Zhang Z, et al. Frequent detection of pancreatic lesions in asymptomatic high-risk individuals. Gastroenterology 2012; 142(4): 796–804. https://doi.org/10.1053/j.gastro.2012.01.005
16. Catanzaro A, Richardson S, Veloso H, Isenberg G, Wong R, Sivak M, Chak A. Long-term follow-up of patients with clinically indeterminate suspicion of pancreatic cancer and normal EUS. GI Endoscopy 2003; 58(6): 836–40. https://doi.org/10.1016/s0016-5107(03)02301-0
17. Ho S, Bonasera R, Pollack B, Grendell J, Feuerman M, Gress F. A Single-Center Experience of Endoscopic Ultrasonography for Enlarged Pancreas on Computed Tomography. Clin Gastroenterol Hepatol 2006; 4(1): 98–103. https://doi.org/10.1016/s1542-3565(05)00859-1
18. Glazer E, Rashid O, Klapman J, Harris C, Hodul P, Pimiento J, Malafa M. Endoscopic ultrasonography complements computed tomography in predicting portal or superior mesenteric vein resection in patients with borderline resectable pancreatic carcinoma. Pancreatology 2017; 17(1): 130–134. https://doi.org/10.1016/j.pan.2016.12.001
19. James P, Meng Z, Zhang M, Belletrutti P, Mohamed R, Ghali W, et al. The incremental benefit of EUS for identifying unresectable disease among adults with pancreatic adenocarcinoma: A meta-analysis. PLoS One 2017; 12(3): e0173687. https://doi.org/10.1371/journal.pone.0173687
20. Bang J, Kirtane S, Krall K, Navaneethan U, Hasan M, Hawes R, Varadarajulu S. In memoriam: Fine-needle aspiration, birth: Fine-needle biopsy: The changing trend in endoscopic ultrasound-guided tissue acquisition. Dig Endosc 2019; 31(2): 197–202. https://doi.org/10.1111/den.13280
21. Vila JJ, Fernández-Urién I, Carrascosa J. EUS and ERCP: A rationale categorization of a productive partnership. Endosc Ultrasound 2021; 10(1): 25–32. https://doi.org/10.4103/eus.eus_58_20
22. Fusaroli P, Manta R, Fedeli P, Maltoni S, Grillo E, Giovanni E, et al. The influence of endoscopic biliary stents on the accuracy of endoscopic ultrasound for pancreatic head cancer staging. Endoscopy 2007; 39(9): 813–7.
23. Karagyozov PI, Tishkov I, Boeva I, Draganov K. Endoscopic ultrasound-guided biliary drainage-current status and future perspectives. World J Gastrointest Endosc 2021; 13(12): 607–618. https://doi.org/10.4253/wjge.v13.i12.607
24. Van der Merwe SW, Van Wanrooij RLJ, Bronswijk M, Everett S, Lakhtakia S, Rimbas M, et al. Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2022; 54(2): 185–205. https://doi.org/10.1055/a-1717-1391
25. Bang JY, Kirtane S, Krall K, Navaneethan U, Hasan M, Hawes R, Varadarajulu S. Stent placement by EUS or ERCP for primary biliary decompression in pancreatic cancer: a randomized trial (with videos). Gastrointest Endosc 2018; 88(1): 9–17. https://doi.org/10.1016/j.gie.2018.03.012
26. Paik WH, Lee TH, Park DH, Choi JH, Kim SO, Jang S, et al. EUS-Guided Biliary Drainage Versus ERCP for the Primary Palliation of Malignant Biliary Obstruction: A Multicenter Randomized Clinical Trial. Am J Gastroenterol 2018; 113(7): 987–997. https://doi.org/10.1038/s41395-018-0122-8
27. Park JK, Woo YS, Noh DH, Yang JI, Bae SY, Yun HS, et al. Efficacy of EUS-guided and ERCP-guided biliary drainage for malignant biliary obstruction: prospective randomized controlled study. Gastrointest Endosc 2018; 88(2): 277–282. https://doi.org/10.1016/j.gie.2018.03.015
28. Lou X, Yu D, Li J, Feng S, Sun JJ. Efficacy of endoscopic ultrasound-guided and endoscopic retrograde cholangiopancreatography-guided biliary drainage for malignant biliary obstruction: a systematic review and meta-analysis. Minerva Med 2019; 110(6): 564–574. https://doi.org/10.23736/S0026-4806.19.05981-0
29. Kakked G, Salameh H, Cheesman AR, Kumta NA, Nagula S, DiMaio CJ. Primary EUS-guided biliary drainage versus ERCP drainage for the management of malignant biliary obstruction A systematic review and meta-analysis. Endosc Ultrasound 2020; 9(5): 298–307. https://doi.org/10.4103/eus.eus_10_20
30. Kongkam P, Tasneem AA, Rerknimitr R. Combination of endoscopic retrograde cholangiopancreatography and endoscopic ultrasonography-guided biliary drainage in malignant hilar biliary obstruction. Dig Endosc 2019; 31(Suppl. 1): 50–51. https://doi.org/10.1111/den.13371
31. Khan Z, Hayat U, Moraveji S, Adler DG, Siddiqui AA. EUS-guided pancreatic ductal intervention: A comprehensive literature review. Endosc Ultrasound 2021; 10(2): 98–102. https://doi.org/10.4103/eus.eus_67_20
32. Giri S, Mohan BP, Jearth V, Kale A, Angadi S, Afzalpurkar S, Harindranath S, Sundaram S. Adverse events with EUS-guided biliary drainage: a systematic review and meta-analysis. Gastrointest Endosc 2023; 98(4): 515–523.e18. https://doi.org/10.1016/j.gie.2023.06.055.
33. Gornals JB, Moreno R, Castellote J, Loras C, Barranco R, Catala I, et al. Single-session endosonography and endoscopic retrograde cholangiopancreatography for biliopancreatic diseases is feasible, effective and cost beneficial. Liver Dis 2013; 45(7): 578–83. https://doi.org/10.1016/j.dld.2013.01.023
34. Kawakubo K, Kawakami H, Kuwatani H, Haba S, Kudo T, Abe Y, et al. Safety and utility of single-session endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography for the evaluation of pancreatobiliary diseases. Gut Liver 2014; 8(3): 329–32. https://doi.org/10.5009/gnl.2014.8.3.329
35. Vila JJ, Kutz M, Goñi S, Ostiz M, Amorena E, Prieto C, et al. Endoscopic and anesthetic feasibility of EUS and ERCP combined in a single session versus two different sessions. World J Gastrointest Endosc 2011; 3: 57–61. https://doi.org/10.4253/wjge.v3.i3.57
