Reviews
Advanced salvage cannulation techniques during ERCP in patients with difficult biliary cannulation
Summary
This review about advanced biliary cannulation, provides a comprehensive overview of endoscopic retrograde cholangiopancreatography (ERCP) salvage cannulation techniques, focusing on strategies for managing difficult biliary cannulation. In this review we integrated the theoretical knowledge with practical applications, supported by numerous research and evidence based clinical studies and guidelines to present the current optimal approach of salvage ERCP techniques in patients with difficult biliary cannulation.
Összefoglalás
Ez az endoszkópos retrográd kolangiopankreatográfia (ERCP) során végzett haladó epeúti kanülálási technikákról szóló összefoglaló közlemény átfogó áttekintést nyújt a nehéz epeúti kanülálás megoldására szolgáló haladó endoszkópos technikákról és stratégiákról, kiemelve a bizonyítékokon alapuló orvoslás gyakorlatának alkalmazását és a poszt-ERCP-s pancreatitis (PEP) szövődmény minimalizálásának fontosságát. Közleményünkben az ERCP minőségi indikátorainak leírásától és a nehéz epeúti kanülálás definíciójától kezdve részletezzük a különféle haladó epeúti kanülálási technikákat, és emellett összehasonlítjuk a hatékonyságukat az evidencián alapuló orvoslás eredményei alapján, végül pedig javaslatot teszünk az optimális mentési ERCP-stratégiákra.
Bevezetés
William McCune és sebészeti csapata a George Washington Egyetemen érte el az első sikeres epevezeték-kanülálást egy Eder száloptikai duodenoszkóp segítségével, amely előre- és oldalnézetet biztosított (1). Akkoriban az epeutak kanülálásának sikeressége azonban még csak 50%-os volt. McCune-nak a közleményben idézett mondatai kiemelik a sikeres epeúti kanüláláshoz szükséges alapvető tulajdonságokat a vizsgáló részéről, mint az állhatatosságot, az elszántságot és a kitartást, amelyre a komplikált endoszkópos eljárás kezdeti szakaszában szükségük volt az ERCP-s orvosoknak, de napjainkban is elmondható, hogy ezekre a tulajdonságokra minden operatív endoszkópos orvosnak szüksége van. Egy évvel később Oi I. és munkatársai Japánban egy olyan, oldalnézetet biztosító száloptikai duodenoszkópot fejlesztettek ki, amelynek már emelője is volt, és ez lehetővé tette, illetve megkönnyítette a töltő kanül behatolási szögének manipulálását a Vater-papilla tengelyéhez képest (2). Ez a technológiai előrelépés drasztikusan javította az ERCP-kanülálás sikerességi arányát 77%-ra, csökkentve a szövődményeket is. Öt évvel később Classen és Demling Erlangenben (Németország) és Kawai (Japánban) egymástól függetlenül dolgoztak az ERCP terápiás alkalmazásainak kifejlesztésén, az epevezeték irányú sphincterotomia (papillotomia, EST) első eseteit dokumentálva (3, 4). Kawai egy, a mai tűkéses sphincterotomhoz hasonló eszközt és technikát is kidolgozott (3). A Demling–Classen papillotom megkönnyítette ezt az eljárást, lehetővé téve a kontrasztanyag injekcióját a katéter helyben tartása közben, valamint az endoszkópos epeúti kőextrakciót (4). Évtizedekkel később Peter Cotton egy editorialban foglalta össze az ERCP-vel kapcsolatos életművét és tapasztalatait, amelynek bevezetőjében Hippokratésztől idézve az ERCP-ről azt írta, hogy „az élet rövid, a művészet hosszú, az alkalom elrepül, a kísérletezés veszedelmes, az ítéletalkotás pedig nehéz”, amely idézetre néhai dr. Szepes Attila barátom, tanítványom és munkatársam hívta fel először a figyelmemet (5). Ez a mondat véleményünk szerint teljes egészében igaz a nehéz epeúti kanülálás eseteiben a haladó ERCP-kanülálási technikák alkalmazására, mivel ennek során a beavatkozások láncolatát egy adott rövid időperiódusban kell precízen végrehajtani, és helyes sorrendben kell alkalmazni a technikailag meglehetősen kihívást jelentő, minimálinvazív mikrosebészeti endoszkópos eljárásokat, mert ha bármelyik lépés során sokáig eredménytelenül kísérletezünk vagy tévedünk, az veszedelmes, elsősorban az ERCP-vel kapcsolatos szövődmények (poszt-ERCP-s pancreatitis) kapcsán. Másrészt közleményében Peter Cotton azt is hangsúlyozza, hogy az ERCP ezen területe egy olyan, az orvosoknak is nagy sikerélménnyel kecsegtető, minimálinvazív, endoszkópos operatív beavatkozás, amelyet általában nem sebészek, hanem a belgyógyászok és a gasztroenterológusok végezhetnek, amivel, ha megfelelő időzítéssel és indikációval történik, akár a beteg életét is meg lehet menteni, például egy szeptikus cholangitises, biliaris pancreatitises vagy epeúti köves betegnél. Viszont az ERCP-nek van egy sötét oldala is, és ez elsősorban a szövődményekkel kapcsolatos. Általánosságban az ERCP után 5-7%-ban alakulhat ki valamilyen szövődmény, amely kb. 1%-ban súlyos, és egy ezrelékben akár halálos kimenetelű is lehet, ami általában a poszt-ERCP-s pancreatitis (PEP), vérzés vagy a perforáció következménye (5). Ezek a szövődmények sokszor a beavatkozás technikai sikerétől vagy színvonalától függetlenek, mivel aktuálisan a betegtől függő rizikófaktorok, azaz a műtét tökéletesen sikerül, és a beteg mégis belehal a poszt-ERCP-s pancreatitis szövődményeibe. Az USA-ban a legtöbb endoszkópiával kapcsolatos műhibaper is ilyen esetekből származik, amelynek esélyét az indikáció helyes megválasztása mellett a megfelelő áthidaló (salvage) technika alkalmazásával lehet minimalizálni. Az indikáció helyes megválasztása különösen fontos, általános elvként kijelenthetjük, hogy az ERCP-vizsgálatot néhány speciális kivételtől eltekintve (például kolangioszkópos szövettani mintavétel) diagnosztikus céllal nem végzünk, ERCP kizárólag akkor indokolt, ha egyértelmű az operatív ERCP beavatkozás igénye, akár egy ülésben endoszkópos ultrahangvizsgálattal is igazolva. Szintén a szerzőtől származik a megfelelő indikáció fontosságát hangsúlyozó idézet: „az ERCP azokban a betegekben a legveszélyesebb, akikben annak elvégzése a legkevésbé indokolt” (5).
I. A minőség meghatározása az ERCP során
Aksel Kruse szerint az endoszkópiában – és különösen az ERCP során – a minőség bár a külső megfigyelő (szakértő) által jól érezhető, de viszonylag nehezen számszerűsíthető és mérhető (6). Napjainkban az ERCP minőségét az Európai Gasztrointesztinális Endoszkópos Társaság (ESGE) által meghatározott kvantitatív mutatókkal definiálhatjuk. Ez az irányelv többek között magában foglalja a magas epevezeték-kanülálási arány elérését (legalább 90%-os arány normál anatómiájú esetekben), és emellett a poszt-ERCP-s pancreatitis arányának 10% alatt tartását. Az ESGE is elismeri az ERCP során az endoszkópos minőség számszerűsítésének nehézségét, de hangsúlyozza az irányelvek betartásának fontosságát (7).
Nehéz epeúti kanülálás
A nehéz epeúti kanülálást az ESGE irányelvei alapján határozhatjuk meg, olyan tényezőket figyelembe véve, mint a Vater-papillával történő érintkezéseknek a száma, a kanülálási idő hossza és a hasnyálmirigy-vezeték nem szándékolt kanülálása és/vagy töltése (8).
Még tapasztalt endoszkóposok kezében is akár 20%-ban kudarcot vallhat a szelektív epevezeték-kanülálás (selective biliary cannulation, SBC) első körben. Az SBC többszöri kísérlete növeli a bódításban vagy mély szedációban töltött időt, növeli a sugárterhelést, fokozza a poszt-ERCP-s pancreatitis (PEP) kockázatát, és késlelteti a terápiás lehetőségeket. Nehéz SBC esetén az endoszkóposnak időben meg kell hoznia azt a döntést, hogy a standard kanülálási technikák további erőltetése helyett időben áttérjen olyan haladó kanülálási áthidaló (salvage) technikákra, mint a hasnyálmirigy-vezeték vezetődrótos kanülálása és stentelése vagy az elővágás (precutting), vagy pedig időlegesen felfüggeszti az ERCP-s beavatkozást. A beteg biztonsága, az eljárás sürgőssége, a kanülálással töltött idő és az eszközök költségei mind fontos tényezők ebben a döntésben. Vizsgálatok kimutatták, hogy a kanülálással töltött idő növekedése és a több kanülálási kísérlet nagyobb PEP-arányhoz vezet, és a haladó eszközök (különféle tűkések, extrahidrofil vezetődrótok, pancreasstentek) használata nagyobb költségeket jelent mind a beteg, mind az endoszkópos vizsgálóhely számára (9, 10).
A poszt-ERCP-s pancreatitis (PEP) az ERCP egyik leggyakoribb és potenciálisan akár halálos szövődménye. A PEP-et, azaz az ERCP utáni pancreatitist (a pankreatogén fájdalom és a klinikai tünetek, a szérumamiláz- és -lipázszint háromszorosan meghaladják a vizsgálat utáni 24 órában a normál felső határértéket, vagy a pozitív pancreatitisre utaló képalkotó leletek [CT vagy MRI]) a felsoroltak közül legalább kettő tünet jelenlétével definiálják, leginkább olyan esetekben, amelyek legalább 1 napra, nem tervezetten kórházi felvételt igényelnek, és jelentős extra kórházi költségeket okoznak az ERCP során. A 21 prospektív vizsgálatot magában foglaló, 16 885 beteget átfogó szisztematikus áttekintés kimutatta, hogy az ERCP után kialakuló PEP általános gyakorisági aránya 3,5%, a mortalitási arány pedig 0,8% volt. A PEP betegtől függő kockázati tényezői közé tartozik a feltételezett Oddi-sphincter-diszfunkció, a női nem, az epeúti tágulat vagy az epeúti obstrukcióra utaló laboreltérések hiánya és az azt megelőzőleg a korábbi ERCP után kialakult PEP is (11).
A betegtől független, az ERCP technikai kivitelezésével összefüggő legfontosabb kockázati tényező a PEP kialakulására a nehéz (problémás vagy elhúzódó) epeúti kanülálás. Emellett a PEP kockázata általánosságban megnövekedik precut sphincterotomiával (RR: 2,71; 95% CI: 2,02–3,63; p<0,001) és kontrasztanyag hasnyálmirigybe történő injekciójával (RR: 2,2; 95% CI: 1,6–3,01; p<0,001) is. A technikai faktorokkal kapcsolatos PEP-kockázat szintén megnövekszik az alacsonyabb ERCP-volumenű (<200 ERCP/év) és alacsonyabb ERCP-gyakoriságú endoszkópossal (<40/év) rendelkező központokban, és ezek a rizikónövekedések összeadódnak más, a beteghez kapcsolódó kockázati tényezőkkel, mint például a fiatalabb kor vagy a női nem (12).
A nehéz epevezeték-kanülálás fogalmát az alábbiak szerint definiálhatjuk.
A nehéz kanülálás korai definíciójához korábban az alábbiakban felsorolt három kritérium közül legalább két tényező kombinációját használták:
- Kísérletek száma: Minimális számú kanülálási kísérlet (általában 5-15) szolgált küszöbértékül.
- Eltelt idő: A standard kanülálási technikákkal töltött időt is figyelembe vették, jellemzően 5-20 percnél hosszabb idő szolgált küszöbértékül.
- Nem szándékolt MPD-kanülálás: Néhány definíció a fő hasnyálmirigy-vezeték (MPD) nem szándékolt kanülálásainak számát is figyelembe vette, egyes vizsgálatok több mint 4 MPD-kanülálást jeleztek nehéz kanülálásként.
Az ESGE jelenleg is érvényes irányelvei alapján a nehéz epevezeték-kanülálás fogalmát az alábbiak szerint definiálják (8):
Intakt papillájú betegekben végzett ERCP beavatkozások esetén az ESGE definíciója szerint nehéz a kanülálási kísérlet, ha a következők bármelyike igaz:
- Túllépés az időben: a kanülálási kísérlet 5 percnél tovább tartott.
- Túllépés a kísérletek számában: több mint 5 kanülálási kísérletet tettek.
- Nem szándékolt MPD-kanülálás: több mint egy nem szándékolt MPD-kanülálás vagy kontrasztanyaggal történő feltöltés (opacifikáció) esetleg túltöltés (acinalizáció) történt.
Az ERCP-kanülálási folyamat során a poszt-ERCP-s pancreatitisre hajlamosító legfontosabb szempont azonban a kanülálás teljes időtartama, számos nagy beteganyagot magában foglaló prospektív tanulmányban igazolták, hogy a 15 percnél hosszabb kanülálási időtartam szignifikánsan emeli a PEP gyakoriságát (10). Nem teljesen meglepő, de viszonylag új adat, hogy a Vater-papilla makroszkópos megjelenése (type I: normális küllemű, type II: kicsi [mamilláris], type III: előemelkedő [protrudáló, muscularis], type IV: taréjos, lebernyeges) és a nehéz epeúti kanülálás között összefüggés mutatható ki, miszerint a különböző típusokban a nehéz epeúti kanülálás aránya: 36%, 52%, 48% és 43%, sorrendben, átlagosan (13).
II. Haladó ERCP-kanülálási technikák
A kanülálási arány javítása érdekében az elmúlt években számos haladó ECRP-kanülálási technikát és eszközt terveztek meg és javasoltak az ERCP-s szakemberek, amelyek nemcsak megkönnyítik az epevezeték kanülálását, hanem csökkentik a kanülálási időt, és ezáltal a PEP kockázatát is. Ezen módszerek kivitelezését, előnyeit és nehézségeit az alábbiakban részletezzük. Ez a rész az ERCP-ben alkalmazott haladó technikákat ismerteti részletesen, amelyeket akkor vethetünk be, ha a standard szelektív epevezeték-kanülálás (SBC) sikertelen.
1. Vezetődrót-asszisztált kanülálás
A vezetődróttal asszisztált epeúti kanülálás (wire-guided selective biliary cannulation, WG-SBC) napjainkban egy alapvető elsőként választandó technika, amelynek alkalmazásával (háromlumenű kanülotomon felvezetett, hidrofil 0,35” vezetődróttal) megkönnyíthető a szelektív epeúti kanülálás, és elkerülhető, hogy a hasnyálmirigy-vezetékbe ismét kontrasztanyagot adjunk. Az eljárás nagy előnye, hogy ha sikerül a vezetővel szelektíven az epeútba jutni, akkor a dróton a kanülotom (három lumenű papillotom) könnyen az epevezetékbe juttatható, és kontraszttöltés után, kifelé jövet ugyanazon eszközzel indokolt esteben a sphincterotomia (epe irányú papillotomia) is elvégezhető. A kanülálás közben a vezetődrót megfelelő helyzetét a fluoroszkópia során is (RTG képerősítőn) ellenőrizve csak akkor töltünk kontrasztanyagot, ha meggyőződtünk róla, hogy a vezetődrót magasan a choledochusba jutott, ez a gyakorlat csökkenti a felesleges pancreasvezeték-töltés esélyét, és ezáltal a PEP szövődmény gyakoriságát is. A vezetődrót behatolási irányát a Vater-papilla tengelyéhez képest nemcsak a
duodenoszkóp emelőjével, hanem a kanülotom vágóélének feszítésével és oldalirányú forgatásával is változtathatjuk, miközben a hidrofil 25-25”-es vezetődrótot finoman néhány milliméternyit előre-hátra mozgatva megtalálhatjuk a helyes irányt. A drót Vater-papillán belüli helyzetét közben az RTG-képerősítőn is figyelhetjük, így váltva a pancreasvezetékről az epevezetékre. Tovább javíthatja a hatékonyságot, ha a vezetődrótot és a kanülotomot is maga az endoszkópos orvos kezeli, mert így jobban érezzük az ellenállást a vezetődróton, ami a nem megfelelő behatolási szöget jelenti. Ha 5-10 perc próbálkozás ellenére sem sikerül kivitelezni a fenti (WG-SVC) eljárást, akkor az alábbi lehetőségek vagy azok kombinációja közül választhatunk (14, 15).
Hasnyálmirigyvezeték-vezetődrót vagy dupla vezetős technika (double guide-wire technique: DGWT)
Egy másik hatékony kanülálási mentőeljárás a kétvezetős technika, amely a pozícióban hagyott hasnyálmirigyvezeték-drót használata mellett egy második vezetődróttal történő kanülálást jelent az SBC megkönnyítésére, amely eljárást először Gyökeres Tibor és Pap Ákos közölték az endoszkópos szakirodalomban (16). Ilyenkor a fő hasnyálmirigy-vezetékben (MPD) lévő vezetődrót kiegyenesíti az epevezeték intramurális szakaszát, ezzel irányítva a második vezetőt vagy a papillotomot az epevezetékbe, és csökkentve a további véletlen MPD-kanülálás kockázatát. Az első vezetődrót stabilizálja is a papillát, valamint megmutatja a pancreasvezeték kanülálási irányát a térben, amely helyzettől az epevezeték tangenciálisabban és az óramutató járásával ellentétesen 2 órával balra helyezkedik el. Retrospektív és prospektív vizsgálatok (n=363 és n=274) az egyvezetős (SGWT) és a korai kétvezetős (DGWT) technika összehasonlításával nem mutattak szignifikáns különbséget a kanülálási sikerességben vagy a PEP-arányokban. Egy 7 RCT-t (n=577) magában foglaló metaanalízis azonban kimutatta, hogy a DGWT növelte a PEP kockázatát a standard WG-SBC és a korai elővágásos technikákhoz képest (RR: 1,98; 95% CI: 1,14–3,42) (17–19).
Vezetékvezérelt kanülálás hasnyálmirigystent felett (wire-guided cannulation over pancreatic stent, WGC-PS)
Ezen eljárás lényege, hogy az ismételt véletlen hasnyálmirigy-vezeték kanülálás után a vezetődrót helyben hagyása mellett egy ideiglenes, kis kaliberű (3-5 F) profilaktikus hasnyálmirigystentet helyeznek be, majd a stent felett/mellett végzik el a WG-SBC-t (20, 21). Ez kizárja a további véletlen MPD-kanülálást, és ráadásul a profilaktikus kis kaliberű hasnyálmirigystentet 2-5 napig a beavatkozás után a hasnyálmirigy-vezetékben hagyva jelentősen csökkenthetjük a súlyos PEP-szövődmények arányát is. Tanulmányok kimutatták, hogy a WGC-PS szignifikánsan csökkenti a PEP arányát (akár 23%-ról kevesebb mint 3%-ra). Egy retrospektív vizsgálat, amely a WGC-PS-t és a DGT-t hasonlította össze, hasonló kanülálási sikert, de alacsonyabb PEP-arányt mutatott a WGC-PS-csoportban (bár ez nem érte el a statisztikai szignifikanciát). Lényeges hangsúlyozni, hogy a DGT kudarcának mintegy fele sikeresen menthető volt WGC-PS segítségével. A WGC-PS költséghatékonyabbnak tekinthető az alacsonyabb PEP-arányok miatt, ráadásul kombinálható más technikákkal is, például tűkéses sphincterotomiával mint további mentő eljárással, ha a WGC nem sikerül 5-10 percen beül. Az ESGE profilaktikus, kis kaliberű hasnyálmirigyvezeték-stentelést javasol mind a vezetékvezérelt kanülálási módszerek, mind az elővágási technikák előtt, a szövődmények minimalizálása miatt. Fontos tudni azonban, hogy a már behelyezett, kis kaliberű pancreasstentnek a papillából kilógó része – az anatómiától függően – technikailag nehezítheti vagy lehetetlenné teheti a tűkéses elővágást, különösen, ha külső malacfarok (pigtail) jellegű pancreasstentről van szó.
2. Elővágási technikák (precutting)
Az alábbiakban a különböző tűkéses elővágási módszereket mutatjuk be, elsősorban a longitudinális tűpapillotomiára és a fistulotomiára koncentrálva (22–28). Amikor a standard epevezeték-kanülálási technikák nem járnak sikerrel, sok endoszkópos tűkéses elővágást (precut papillotomiát) végezhetünk a közös hepatopancreaticus ampulla endoszkópos microsebészeti feltárásához és az epevezeték kezdeti szakaszának az eléréséhez. Ez magában foglalhatja az ampulláris szakaszt (top-to-tip vagy tip-to-top tűkéses elővágás), vagy a közös sphincterzóna felett is elvégezhető (fistulotomia). Ezeket a technikákat összefoglalóan elővágási technikáknak nevezik, és megkönnyítik a hozzáférést az epeúthoz, illetve az Oddi-sphincter biliáris propria területén keresztül. Biztonságos és hatékony kivitelezéséhez azonban a Vater-papilla anatómiájának alapos ismerete szükséges. Az elővágási technikákban leggyakrabban használt eszköz a tűkés precut papillotom, egy olyan, a hagyományos kanülhöz hasonlító precíziós vágóeszköz, amelynek belsejéből egy vékony, tűszerű szabad drótvég áll ki, amelyet áram hatására monopolárisan aktiválnak (Endocut I, E1). Az eszköz használata nyugodt beteget és milliméterre precíz endoszkópos kontrollt igényel; valamint fontos tudni, hogy a tűkés hegyének a katéternél 2-3 mm-nél nagyobb kinyúlása jelentősen megnöveli a perforáció kockázatát (akár a duodenum mediális falán keresztül, akár retroduodenális perforációt okozva, ami potenciálisan műtétet is igénylő, akár halálos komplikáció veszélyét rejti). Hangsúlyozni kell továbbá, hogy a tűkéses elővágásnak nem célja a komplett sphincterotomia elérése, az elővágást csak addig kell meghosszabbítani, amíg az epevezeték distalis pontja a sphincterizomzaton belül megnyílik (epecsepp jelenik meg a műtéti területen) és ezután hagyományos papillotomra és vezetődrótra cserélve könnyen kivitelezhetővé válik a WG-SBC, majd ennek nyomán komplettálhatjuk a papillotomiát a harántredőig a hagyományos sphincterotommal. Léteznek már olyan, újabb hibrid eszközök, amelyek a tűkést közvetlenül a hagyományos sphincterotom (ST) belsejébe integrálják, ami potenciálisan komplexebb, egy ülésben eszközcsere nélküli lehetőséget biztosít, mint a különálló tűkéses eszközök használata esetén. Az ESGE azt javasolja, hogy ha lehetséges, profilaktikus, kis kaliberű hasnyálmirigyvezeték-stentet is helyezzenek el az elővágás előtt vagy azután a fő hasnyálmirigy-vezetékbe (MPD). Ez védi a hasnyálmirigy kivezető szájadékát, kiegyenesíti az epevezeték intramurális szakaszát, és javítja a hozzáférést a sphincterotom számára a metszés után.
Precut papillotomia (PP)
Az eljárás leírása részletesen: egy tűkés segítségével bemetszik a Vater-papilla duodenumban elhelyezkedő, közös szakaszát, megnyitva a közös epevezetéket (CBD). A bemetszés általában a papilláris nyílástól (orificium) felfelé az epeút irányában 11-12 órai pozíciójában kezdődik, és az intraduodenalis CBD-szegmens középvonala mentén felfelé halad (tip-to-top) (1. ábra). A beavatkozást tiszta vágóárammal vagy Endocut I E1-el végezzük, helyesen rétegről rétegre haladva (nyálkahártya, submucosa) egészen addig, amíg el nem érjük az epeúti záróizmot, amelyet jellegzetes fehéres, hagymahéjszerű megjelenéséről lehet azonosítani. A sphincter felszíni izomrostjainak feltárása után a papilla gyakran vörös pontként vagy mellbimbószerű struktúraként jelenik meg, amelyen keresztül a sárga színű epefolyás láthatóvá válhat. Ezután a papillán át az epevezeték közvetlenül vagy vezetődrót segítségével szelektíven és mélyen kanülálható, majd a sphincterotomia a kanülálás után hagyományos papillotommal tovább bővíthető.
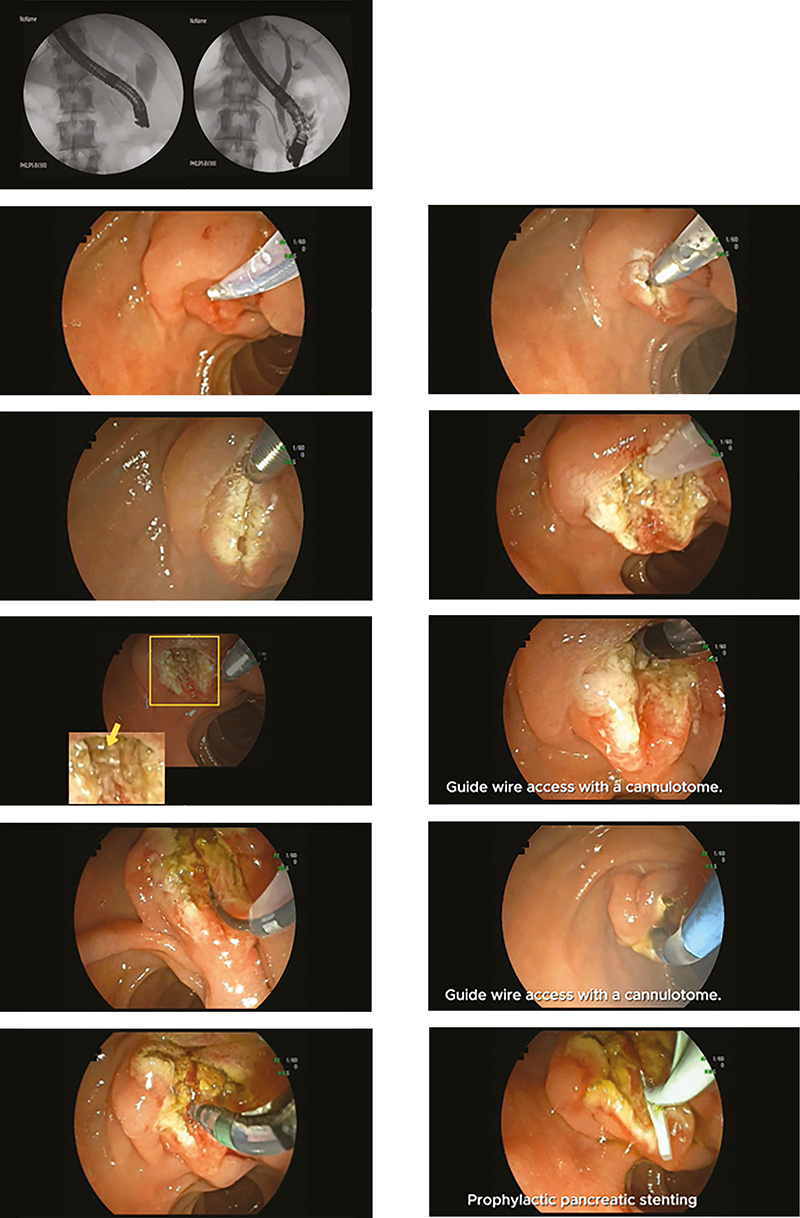
Precut fistulotomia (PFT)
A precut fistulotomia során a tűkéses elővágást a papilla egy olyan speciális területén, a papilláris nyílás felett végezzük, amely a distalis choledochus (CBD) intraduodenalis szegmensét (vagy a hepatopancreaticus ampulla epevezeték-beszájadzását) fedi (2. és 3. ábra). Itt az előzőekben részletezett módszerhez hasonlóan, rétegről rétegre haladva tűkéssel bemetszést ejtünk, és ezáltal egy fisztulát hozhatunk létre a duodenalis lumen és a CBD lumen között. A bemetszés a kezdeti metszés helyétől függően kissé lefelé, a papilláris nyílás felé, vagy felfelé is meghosszabbítható, utóbbi esetben vigyázva arra, hogy a harántredőt és az ampulláris szakasz szélét ne érje el. Az elővágott fistulotomia technika érintetlenül hagyja a záróizom közös szakaszát és a papilláris nyílást (bár a fistulotomia szükség esetén a záróizmon keresztül lefelé egészen az orificiumig meghosszabbítható, de erre általában nincs szükség), és olyan fisztulát hoz létre, amely lehetővé teszi az endoszkópos orvos számára, hogy közvetlenül a CBD-t kanülálja a pancreasvezeték vagy annak intraampulláris szakaszának érintése nélkül. Legalábbis elméletben és esetkontrollált vizsgálatok alapján ez a módszer csökkenti a hasnyálmirigynyílás termikus sérülésének kockázatát és ezáltal a súlyos PEP kockázatát, különösen magas rizikójú betegek esetében. Ennek a technikának egy változata, a szuprapapilláris punkció, közvetlen duodenocholedochalis hozzáférést hoz létre egy endoszkópos ultrahangos biopsziás tűbe helyezett vezetődrót segítségével, amely fluoroszkópos irányítás mellett, kauterizálás nélkül közvetlenül az epevezetéket pungálja meg. Az utóbbi eljárást EUH-val kombinálva a módszer bizonyítottan csökkenti a PEP arányát, miközben elfogadhatónak tűnő, alacsony perforációs arányt mutat (29).
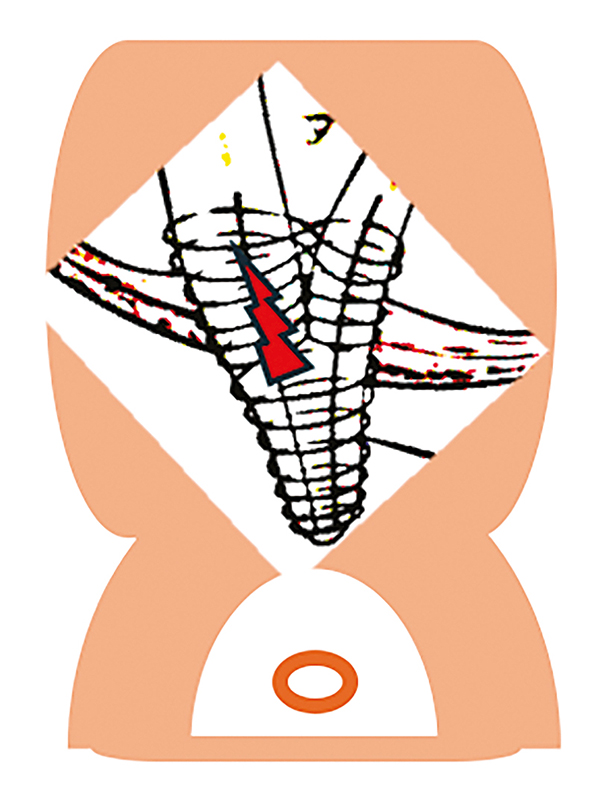
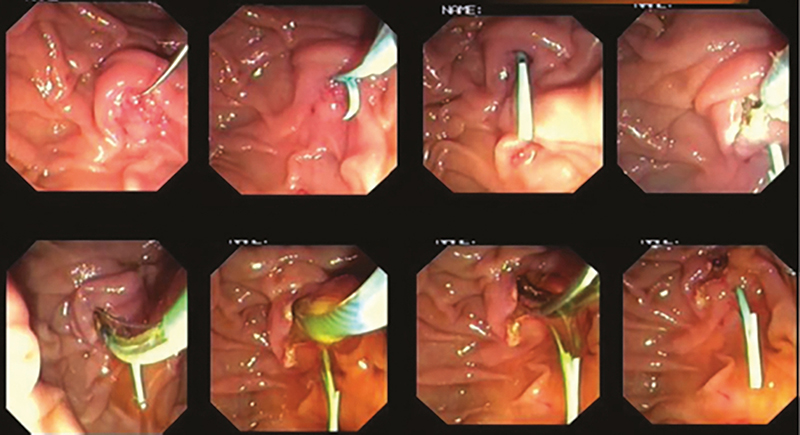
behelyezése, majd ezután elvégzett sikeres fistulotomia tűkéses papillotommal, majd a sphincterotomia komplettálása vezetődróttal és hagyományos háromlumenű papillotommal
Transpancreaticus precut sphincterotomia (TPS)
A megfelelő precut papillotomia vagy fistulotomia elérése tűkéssel nehéz lehet kevésbé gyakorlott operatív endo-
szkópos orvosok számára, vagy olyan betegeknél, akiknek kicsi vagy nehezen lokalizálható papillájuk van. Az ilyen betegek esetében a TPS egy életképes alternatív módszer lehet. A TPS technikájáról először 2007-ben Kapetanos Dimitris számolt be, amely közleményben egy standard, rövid végű (precut) sphincterotomot használt, amelyet a CBD felé tájolt, körülbelül 11 óránál, és amelyet felületesen vezetnek be az ampullába vagy az MPD-be, és ilyen módon epe irányú septotomiát végezve segítette elő az epeúti kanülálást (30). A későbbi közleményekben már a standard sphincterotomot használják a TPS-re olyan módon, hogy miután a pancreasvezetékbe jutott vezetődróton át annak hegyét és a vágóél kezdetét az ampulláris szakaszba juttatták, egy elővágást készítenek 11 óra irányában felfelé, az epevezeték irányában történő bemetszésre a precut papillotomia elvégzéséhez. A TPS előnyei közé tartozik, hogy nem kell a sphincterotomot a tűkéses eszközre cserélni, és a tűkéses eszközhöz képest jobban kontrollálható a metszés mélysége. Bár a TPS önmagában 9%-os PEP-kockázatot hordoz (valószínűleg az MPD-t érintő irritáció és ödéma miatt), a PD-stent elhelyezése a TPS után bizonyítottan 4%-ra csökkenti a PEP előfordulását (31).
Összefoglalva, ebben a részben az elővágási technikákat olyan átfogó stratégiaként mutattuk be, amelyekkel hozzáférhetünk az epevezetékhez nehéz epeúti kanülálás eseteiben is, amikor a standard módszerek kudarcot vallanak. Ki kell emelni azonban, hogy ezen haladó kanülálási technikák alkalmazása nem helyettesíti a hagyományos kanülálási technikák megfelelő szintű elsajátítását és azok precíz kivitelezését, és semmiképen nem javasoltak kezdő endoszkópos orvosok számára, hiszen a megfelelő gyakorlat, az anatómiai ismeretek, a pontos műszerhasználat és a profilaktikus hasnyálmirigy-stentelés biztonságos kivitelezése nélkül önmagukban veszélyesek, és szakavatatlan kezekben halálos komplikációknak tehetik ki a beteget.
A különböző elővágási technikák hatékonysága
Az elővágási technikákkal kapcsolatos korai tanulmányok szerint a PEP aránya elérte a 15-20%-ot, ami riasztóan magas szám volt, és 2-3-szorosa a szövődménymentes SBC PEP-arányának. Nem volt azonban világos, hogy ezek az arányok a tűkéses elővágási technikák használatának vagy a már ez előtt hosszasan kivitelezett többszöri SBC-kísérleteknek tulajdoníthatók-e. Akkoriban általános nézet volt, hogy az elővágási tűkéses precut papillotomia beavatkozások előtt a hagyományos kanülálási technikákat kell előnyben részesíteni, lehetőség szerint hosszan kitartani emellett a stratégia mellett (perzisztens hagyományos kanülálás), és a tűkéses technikát csak végső esetben volt javasolt bevetni. Saját akkori gyakorlatunkban mi is ezt alkalmaztuk, azonban megfigyeltük, hogy ha a sikertelen hagyományos kanülálási próbálkozások után mégis elővágunk a tűkéspapillotommal, akkor még ha az ödéma és a vérzés miatt a szelektív epeúti kanülálás azonnal nem is sikerült, pár nap múlva az ödéma elmúltával a korábban nehéznek bizonyuló epeúti kanülálás pár perc alatt könnyedén ment WG-SBC technikával a korábbi elővágás miatt annak felső végénél. Ezért hamar áttértünk a korai tűkéses elővágás stratégiájára, és már 20 évvel ezelőtt is a korai elővágási technikák mellett érveltünk, amikor a nehéz kanülálás előre látható vagy korán felismerhető a PEP kockázatának csökkentése érdekében. A világirodalomban először hasonlítottuk össze a korai elővágási technikák kanülálási sikerességét és a PEP arányát a tartós standard kanülálási kísérletekkel szemben, amely eredményeinket azóta nagy randomizált tanulmányok is igazolták (32–35). Sundaralingam és munkatársai az összes randomizált tanulmány eredményeit értékelő metaanalízisükben is azt igazolták, hogy nagyobb SBC-sikerességet lehet elérni a korai elővágás csoportjában (RR: 1,32; 95% CI: 1,04–1,68), és az elővágási csoportban alacsonyabb PEP-arányt állapítottak meg (36). Egy 2016-os RCT, amelyben 50 korai tűkéses precut papillotomiás beteg és 50 olyan beteg vett részt, akiknél nehéz kanülálás után, precut technika nélkül végeztek MPD-stentelést, hasonló, körülbelül 4%-os PEP-arányt talált, igazolva azt, hogy a korai precut tűkéspapillotomia biztonságos és alacsony PEP-szövődményekkel járó eljárás (37).
Saját betegeinkben a magas PEP-rizikójú betegcsoportban, amikor nehéz epeúti kanülálás mellett a vezetődrót ismét a pancreasvezetékbe jutott, a világirodalomban először kombináltuk a profilaktikus, kis kaliberű pancreasvezeték-stentelést és a tűkéses fistulotomiát. Eredményeink alapján magas technikai sikerráta mellett a PEP-szövődmények elkerülhetők voltak. Sundaralingam és munkatársai a metaanalízisük során azt is megállapították, hogy csak azok a tanulmányok, amelyekben szakértő endoszkóposok, és nem gyakornokok vettek részt, mutatták ki a pancreatitis kockázatának szignifikáns csökkenését a precutcsoportban a standard technikához képest. Ezek a tanulmányok együttesen azt sugallják, hogy tapasztalt endoszkópos szakemberek kezében a korai elővágásos technika megkönnyítheti az SBC-t, alacsonyabb PEP-aránnyal, összehasonlítva a standard kanülálás ismételt kísérleteivel (37–41).
A TPS technika további tárgyalást igényel, mivel ezt a technikát nem értékelték külön a fent említett metaanalízisekbe bevont tanulmányokban. Öt tanulmányon keresztül a TPS technikával végzett epeúti kanülálás sikerességi aránya 85% és 100% között mozgott, a nemkívánatos események aránya 3,5% és 20,5% között, a PEP aránya pedig az esetek 3,5 és 22,4%-a között volt. Nemrégiben a TPS-t a tűkéses PP-vel összehasonlító metaanalízis szignifikánsan alacsonyabb sikerességi arányt (OR: 0,5; p=0,046; RR: 0,92; p=0,03) és magasabb vérzéses szövődményarányt (OR: 2,24; p=0,02; RR: 2,18; p=0,02) talált a tűkéses csoportban, de a PEP, a perforáció vagy az összes szövődmény arányában nem volt különbség a TPS-hez képest (42–45). Mindezek a metaanalízisből származó pozitív eredmények a TPS javára azonban megfelelő elővigyázatossággal értékelhetők, mivel nincsenek közvetlen, nagy betegszámú, randomizált vizsgálati eredmények, amelyek direktben a primer PP vagy a PFT és a TPS technikákat hasonlítanák össze. Ráadásul az esetenként 20,5% közeli PEP-arányok a TPS mellett arra utalnak, hogy ezt az eljárást is érdemes profilaktikus pancreasstenteléssel kiegészíteni.
2021-ben Maharshi és munkatársai egy olyan randomizált prospektív tanulmányt közöltek, amelyben a korai tűkéses precut papillotomiát a primer (azonnali) tűkéses precut papillotomiával hasonlították össze, amely hasonló kanülálási siker mellett a primer PP eseteiben a PE-rizikó további csökkenését igazolta (46). Mint a korai tűpapillotomia egyik hazai úttörője – bár a III. típusú muscularis papilla esetén logikus megközelítésnek vélem, ezzel együtt egyetértve Martin L. Freemannek a közleményhez írt editorialjában megjelentekkel –, nem gondolom, hogy ilyen gyorsan egy mentő eljáráshoz kellene nyúlni a mindennapi gyakorlatban (47).
Összefoglalás és következtetések
Nehéz epeúti kanülálás esetén a szakirodalmi adatok és az ESGE-ajánlások alapján az alábbi ERCP-gyakorlat javasolt (4. ábra) (48):
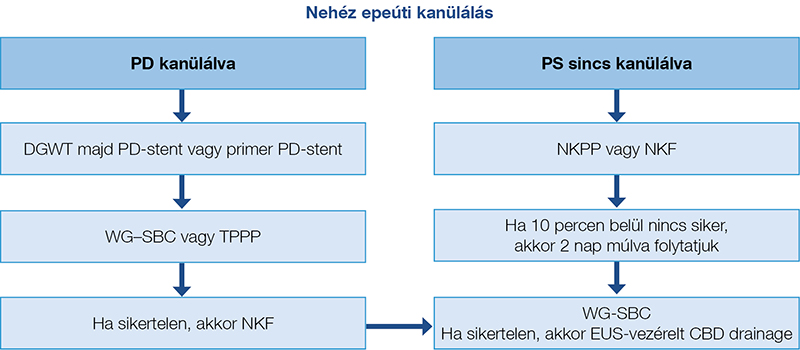
- Előnyben részesítsük a vezetődrót-asszisztált technikákat és a korai elővágást (különösen a fistulotomiát) nehéz epeúti kanülálás esetén.
- Alkalmazzunk kis kaliberű, profilaktikus hasnyálmirigy-stentelést, különösen ismételt, nem szándékolt hasnyálmirigyvezeték-kanülálás esetén, vagy ha transpancreaticus sphincterotomiát fontolgatunk.
- Ismerjük fel a korai mentési technikák fontos helyét és szerepét, és kerüljük el a hosszan tartó sikertelen hagyományos kanülálási próbálkozásokat.
- Mindenekelőtt magas PEP-rizikójú betegek vagy sikertelen epeúti kanülálás esetén a beteget tercier centrumokba, tapasztalt endoszkópos szakemberekhez célszerű mielőbb irányítani, és a szakértői konzultáció igénybevételének lehetőségét kell biztosítani az indikációk és az alternatív (EUH-vezérelt) epeúti drainage lehetséges megoldásainak átgondolására.
Irodalom
https://doi.org/10.1097/00000658-196805000-00013
2. Oi I. Fiberduodenoscopy and endoscopic pancreatocholangiography. Gastrointest Endosc 1970; 17: 59–62. PMID: 5488440
3. Kawai K. Preliminary report on endoscopical papillotomy. J Kyoto Pref Univ Med 1973; 82: 353–355.
4. Classen M, Demling L. Endoskopische Sphinkterotomie der Papilla Vateri und Steinextraktion aus dem Ductus choledochus Endoscopic sphincterotomy of the papilla of vater and extraction of stones from the choledochal duct (author’s transl). Dtsch Med Wochenschr 1974 Mar 15; 99(11): 496–7. German.
https://doi.org/10.1055/s-0028-1107790 PMID: 4835515.
5. Cotton PB. Fifty years of ERCP: a personal review. Gastrointest Endosc 2018 Aug; 88(2): 393–396. Epub 2018 Apr 12. PMID: 29654739.
https://doi.org/10.1016/j.gie.2018.04.013
6. Kruse A, Mathiasen MS. Endoskopisk retrograd kolangio-pankreatografi (ERCP). En endoskopisk-radiologisk undersøgelse Endoscopic retrograde cholangio-pancreatography (ERCP). An endoscopic-radiological study. Ugeskr Laeger 1976 Apr 12; 138(16): 965–70. Danish. PMID: 1265875.
7. Domagk D, Oppong KW, Aabakken L, et al. Performance measures for ERCP and endoscopic ultrasound: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2018 Nov; 50(11): 1116–1127.
https://doi.org/10.1055/a-0749-8767 Epub 2018 Oct 19. PMID: 30340220.
8. Testoni PA, Mariani A, Aabakken L, et al. Papillary cannulation and sphincterotomy techniques at ERCP: European Society of Gastrointestinal Endoscopy (ESGE) clinical guideline. Endoscopy 2016; 48: 657–683. https://doi.org/10.1055/s-0042-108641
9. Freeman ML, DiSario JA, Nelson DB, et al. Risk factors for post-ERCP pancreatitis: a prospective, multicenter study. Gastrointest Endosc 2001; 54: 425–434. PMID: 11577302 https://doi.org/10.1067/mge.2001.117550
10. Dumonceau JM, Andriulli A, Elmunzer BJ, et al. European Society of Gastrointestinal Endoscopy. Prophylaxis of post-ERCP pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – updated June 2014. Endoscopy 2014; 46: 799–815. PMID: 25148137
https://doi.org/10.1055/s-0034-1377875
11. Haraldsson E, Kylänpää L, Grönroos J, et al. Macroscopic appearance of the major duodenal papilla influences bile duct cannulation: a prospective multicenter study by the Scandinavian Association for Digestive Endoscopy Study Group for ERCP. Gastrointest Endosc 2019 Dec; 90(6): 957–963. https://doi.org/10.1016/j.gie.2019.07.014 Epub 2019 Jul 18. PMID: 31326385.
12. Lou L, Wang X, Zhang Y, Luo H, Ren G, Zhang L, Liang S, Kang X, Shi X, Chen L, Lv Y, Wang X, Pan Y. Prolonged cannulation time is an independent risk factor for moderate-to-severe post-endoscopic retrograde cholangiopancreatography (ERCP) pancreatitis: a large cohort study. Ann Transl Med 2023 Mar 15; 11(5): 188. https://doi.org/10.21037/atm-22-4697 Epub 2023 Mar 6. PMID: 37007573; PMCID: PMC10061457.
13. Dubravcsik Z, Gyökeres T, Novák P, Budai A, Mohácsi S, Velkei T, Madácsy L. Az endoszkópos retrográd cholangiopancreatographia szövődményei. (Complications of endoscopic retrograde cholangiopancreatography.) Orv Hetil 2022 Jun 5; 163(23): 911–919. Hungarian. https://doi.org/10.1556/650.2022.32433 PMID: 35895605.
14. Cennamo V, Fuccio L, Zagari RM, Eusebi LH, Ceroni L, Laterza L, Fabbri C, Bazzoli F. Can a wire-guided cannulation technique increase bile duct cannulation rate and prevent post-ERCP pancreatitis?: A meta-analysis of randomized controlled trials. Am J Gastroenterol 2009 Sep; 104(9): 2343–50. https://doi.org/10.1038/ajg.2009.269 Epub 2009 Jun 16. PMID: 19532133.
15. Sasahira N, Kawakami H, Isayama H, Uchino R, Nakai Y, Ito Y, Matsubara S, Ishiwatari H, Uebayashi M, Yagioka H, Togawa O, Toda N, Sakamoto N, Kato J, Koike K. Early use of double-guidewire technique to facilitate selective bile duct cannulation: the multicenter randomized controlled EDUCATION trial. Endoscopy 2015 May; 47(5): 421–9. https://doi.org/10.1055/s-0034-1391228 Epub 2015 Jan 15. PMID: 25590186.
16. Gyökeres T, Duhl J, Varsányi M, Schwab R, Burai M, Pap A. Double guide wire placement for endoscopic pancreaticobiliary procedures. Endoscopy 2003 Jan; 35(1): 95–6. https://doi.org/10.1055/s-2003-36403 PMID: 12510238.
17. Sasahira N, Kawakami H, Isayama H, Uchino R, Nakai Y, Ito Y, Matsubara S, Ishiwatari H, Uebayashi M, Yagioka H, Togawa O, Toda N, Sakamoto N, Kato J, Koike K. Early use of double- guidewire technique to facilitate selective bile duct cannulation: the multicenter randomized controlled EDUCATION trial. Endoscopy 2015; 47: 421–429. PMID: 25590186 https://doi.org/10.1055/s-0034-1391228
18. Tanaka R, Itoi T, Sofuni A, Itokawa F, Kurihara T, Tsuchiya T, Tsuji S, Ishii K, Ikeuchi N, Umeda J, Tonozuka R, Honjo M, Mukai S, Moriyasu F. Is the double-guidewire technique superior to the pancreatic duct guidewire technique in cases of pancreatic duct opacification? J Gastroenterol Hepatol 2013; 28: 1787–1793. PMID: 23800118 https://doi.org/10.1111/jgh.12303
19. Tse F, Yuan Y, Moayyedi P, Leontiadis GI, Barkun AN. Double-guidewire technique in difficult biliary cannulation for the prevention of post-ERCP pancreatitis: a systematic review and meta-analysis. Endoscopy 2017; 49: 15–26. PMID: 27997966 https://doi.org/10.1055/s-0042-119035
20. Ito K, Fujita N, Noda Y, Kobayashi G, Obana T, Horaguchi J, Takasawa O, Koshita S, Kanno Y, Ogawa T. Can pancreatic duct stenting prevent post-ERCP pancreatitis in patients who undergo pancreatic duct guidewire placement for achieving selective biliary cannulation? A prospective randomized controlled trial. J Gastroenterol 2010; 45: 1183–1191. PMID: 20607310 https://doi.org/10.1007/s00535-010-0268-7
21. Singh P, Das A, Isenberg G, Wong RC, Sivak MV Jr, Agrawal D, Chak A. Does prophylactic pancreatic stent placement reduce the risk of post-ERCP acute pancreatitis? A meta-analysis of controlled trials. Gastrointest Endosc 2004; 60: 544–550. PMID: 15472676 https://doi.org/10.1016/S0016-5107(04)02013-9
22. Székely A, Kurucsai G, Biró E, Joó I, Fejes R, Madácsy L. Needle knife precut access papillotomy versus persistence for standard techniques for diffucult bile duct cannulation and sphincterotomy. Endoscopy 2006; 38: Suppl II, A25, OP-E: 104.
23. Madácsy L, Kurucsai G, Fejes R, Székely A, Székely I. Prophylactic pancreas stenting followed by needle-knife fistulotomy in patients with sphincter of Oddi dysfunction and difficult cannulation: new method to prevent post-ERCP pancreatitis. Dig Endosc 2009 Jan; 21(1): 8–13. https://doi.org/10.1111/j.1443-1661.2008.00819.x PMID: 19691794.
24. Furuya CK, Sakai P, Marinho FRT, Otoch JP, Cheng S, Prudencio LL, de Moura EGH, Artifon ELA. Papillary fistulotomy vs. conventional cannulation for endoscopic biliary access: A prospective randomized trial. World J Gastroenterol 2018 Apr 28; 24(16): 1803–1811. https://doi.org/10.3748/wjg.v24.i16.1803 PMID: 29713133; PMCID: PMC5922998.
25. Testoni PA, Giussani A, Vailati C, Testoni S, Di Leo M, Mariani A. Precut sphincterotomy, repeated cannulation and post-ERCP pancreatitis in patients with bile duct stone disease. Dig Liver Dis 2011; 43: 792–796. PMID: 21733768 https://doi.org/10.1016/j.dld.2011.05.010
26. Manes G, Di Giorgio P, Repici A, Macarri G, Ardizzone S, Porro GB. An analysis of the factors associated with the development of complications in patients undergoing precut sphincterotomy: a prospective, controlled, randomized, multicenter study. Am J Gastroenterol 2009; 104: 2412–2417. PMID: 19550413 https://doi.org/10.1038/ajg.2009.345
27. Davee T, Garcia JA, Baron TH. Precut sphincterotomy for selective biliary duct cannulation during endoscopic retrograde cholangiopancreatography. Ann Gastroenterol 2012; 25: 291–302. PMID: 24714256
28. Testoni PA, Testoni S, Giussani A. Difficult biliary cannulation during ERCP: how to facilitate biliary access and minimize the risk of post-ERCP pancreatitis. Dig Liver Dis 2011; 43: 596–603. PMID: 21377432 https://doi.org/10.1016/j.dld.2011.01.019
29. Matsushita M, Uchida K, Okazaki K. EUS-guided suprapapillary puncture for safe selective biliary access. Gastrointest Endosc 2007; 66: 865–6.; author reply 866–7. PMID: 17905034 https://doi.org/10.1016/j.gie.2007.04.010
30. Kapetanos D, Kokozidis G, Christodoulou D, Mistakidis K, Dimakopoulos K, Katodritou E, Kitis G, Tsianos EV. Case series of transpancreatic septotomy as precutting technique for difficult bile duct cannulation. Endoscopy 2007; 39: 802–806. PMID: 17703389 https://doi.org/10.1055/s-2007-966724
31. Sakai Y, Tsuyuguchi T, Sugiyama H, Kurosawa J, Saito M, Tawada K, Mikata R, Tada M, Ishihara T, Yokosuka O. Transpancreatic precut papillotomy in patients with difficulty in selective biliary cannulation. Hepatogastroenterology 2011; 58: 1853–1858. PMID: 22024055 https://doi.org/10.5754/hge11201
32. Cennamo V, Fuccio L, Zagari RM, Eusebi LH, Ceroni L, Laterza L, Fabbri C, Bazzoli F. Can early precut implementation reduce endoscopic retrograde cholangiopancreatography-related complication risk? Meta-analysis of randomized controlled trials. Endoscopy 2010; 42: 381–388. PMID: 20306386 https://doi.org/10.1055/s-0029-1243992
33. Gong B, Hao L, Bie L, Sun B, Wang M. Does precut technique improve selective bile duct cannulation or increase post-ERCP pancreatitis rate? A meta-analysis of randomized controlled trials. Surg Endosc 2010; 24: 2670–2680. PMID: 20414680 https://doi.org/10.1007/s00464-010-1033-y
34. Navaneethan U, Konjeti R, Venkatesh PG, Sanaka MR, Parsi MA. Early precut sphincterotomy and the risk of endoscopic retrograde cholangiopancreatography related complications: An updated meta-analysis. World J Gastrointest Endosc 2014; 6: 200–208. PMID: 24891933 https://doi.org/10.4253/wjge.v6.i5.200
35. Choudhary A, Winn J, Siddique S, Arif M, Arif Z, Hammoud GM, Puli SR, Ibdah JA, Bechtold ML. Effect of precut sphincterotomy on post-endoscopic retrograde cholangiopancreatography pancreatitis: a systematic review and meta-analysis. World J Gastroenterol 2014; 20: 4093–4101. PMID: 24744601 https://doi.org/10.3748/wjg.v20.i14.4093
36. Sundaralingam P, Masson P, Bourke MJ. Early Precut Sphincterotomy Does Not Increase Risk During Endoscopic Retrograde Cholangiopancreatography in Patients With Difficult Biliary Access: A Meta-analysis of Randomized Controlled Trials. Clin Gastroenterol Hepatol 2015; 13: 1722–1729.e2 PMID: 26144018 https://doi.org/10.1016/j.cgh.2015.06.035
37. Zagalsky D, Guidi MA, Curvale C, Lasa J, de Maria J, Ianniccillo H, Hwang HJ, Matano R. Early precut is as efficient as pancreatic stent in preventing post-ERCP pancreatitis in high-risk subjects – A randomized study. Rev Esp Enferm Dig 2016; 108: 258–562. PMID: 27604474 https://doi.org/10.17235/reed.2016.4348/2016
38. Harewood GC, Baron TH. An assessment of the learning curve for precut biliary sphincterotomy. Am J Gastroenterol 2002; 97: 1708–1712. PMID: 12135022 https://doi.org/10.1111/j.1572-0241.2002.05829.x
39. Fukatsu H, Kawamoto H, Harada R, Tsutsumi K, Fujii M, Kato H, Hirao K, Nakanishi T, Mizuno O, Ogawa T, Ishida E, Okada H, Sakaguchi K. Quantitative assessment of technical proficiency in performing needle-knife precut papillotomy. Surg Endosc 2009; 23: 2066–2072. PMID: 18528622 https://doi.org/10.1007/s00464-008-9969-x
40. Robison LS, Varadarajulu S, Wilcox CM. Safety and success of precut biliary sphincterotomy: Is it linked to experience or expertise? World J Gastroenterol 2007; 13: 2183–2186. PMID: 17465498 https://doi.org/10.3748/wjg.v13.i15.2183
41. Figueiredo FA, Pelosi AD, Machado L, Francioni E, Freitas G, Hatum PB, de Mello Perez R. Precut papillotomy: a risky technique not only for experts but also for average endoscopists skilled in ERCP. Dig Dis Sci 2010; 55: 1485–1489. PMID: 19533355 https://doi.org/10.1007/s10620-009-0860-y
42. Catalano MF, Linder JD, Geenen JE. Endoscopic transpancreatic papillary septotomy for inaccessible obstructed bile ducts: Comparison with standard pre-cut papillotomy. Gastrointest Endosc 2004; 60: 557–561. PMID: 15472678 https://doi.org/10.1016/S0016-5107(04)01877-2
43. Zang J, Zhang C, Gao J. Guidewire-assisted transpancreatic sphincterotomy for difficult biliary cannulation: a prospective randomized controlled trial. Surg Laparosc Endosc Percutan Tech 2014; 24: 429–433. PMID: 24910935 https://doi.org/10.1097/SLE.0000000000000062
44. Pécsi D, Farkas N, Hegyi P, Balaskó M, et aĺ. Transpancreatic sphincterotomy has a higher cannulation success rate than needle-knife precut papillotomy – a meta-analysis. Endoscopy 2017; 49: 874–887. PMID: 28609791 https://doi.org/10.1055/s-0043-111717
45. Cha SW, Kim SH, Kim A, Park ET. 447 DGT vs. TPS in Patients With Initial PD Cannulation by Chance; Prospective Randomized Multi-Center Study. Gastrointest Endosc 2012; 75: AB141. https://doi.org/10.1016/j.gie.2012.04.064
46. Maharshi S, Sharma SS. Early precut versus primary precut sphincterotomy to reduce post-ERCP pancreatitis: randomized controlled trial (with videos). Gastrointest Endosc 2021 Mar; 93(3): 586–593. https://doi.org/10.1016/j.gie.2020.06.064 Epub 2020 Jun 29. PMID: 32615179.
47. Krafft MR, Freeman ML. Precut biliary sphincterotomy in ERCP: Don’t reach for the needle-knife quite so fast! Gastrointest Endosc 2021 Mar; 93(3): 594–596. https://doi.org/10.1016/j.gie.2020.08.005 PMID: 33583518.
48. Maruta S, Sugiyama H, Ogasawara S, Sugihara C, Ouchi M, Kan M, Yamada T, Miura Y, Nagashima H, Takahashi K, Kusakabe Y, Ohyama H, Okitsu K, Ohno I, Mikata R, Sakai Y, Tsuyuguchi T, Kato J, Kato N. “Salvage techniques” are the key to overcome difficult biliary cannulation in endoscopic retrograde cholangiopancreatography. Sci Rep 2022 Aug 10; 12(1): 13627. https://doi.org/10.1038/s41598-022-17809-5 PMID: 35948566; PMCID: PMC9365799.
