Reviews
Diagnosis and treatment of Crohn’s disease in the upper gastrointestinal tract
Summary
Crohn's disease occurs in the upper gastrointestinal tract in 0.5-4% of symptomatic adult patients. Involvement of the esophagus, stomach, or duodenum usually occurs simultaneously with involvement of the lower tract. The diagnosis is based on endoscopic, histological and radiological evaluation. Aphthoid or longitudinal ulcers, strictures and fistulas all raise the suspicion of Crohn's disease. Histologically, the presence of a chronic inflammatory process, mainly the predominance of lymphoplasmacytic cells, as well as active focal gastritis indicate Crohn's disease, epithelioid granuloma is rarely detected. During treatment, in addition to proton pump inhibitors, corticosteroids, immunomodulators and biological therapy are used, depending on the severity of the disease.
Összefoglaló
A Crohn-betegség felső tápcsatornai megjelenése 0,5-4%-ra tehető tünetekkel rendelkező felnőtt betegeknél. A nyelőcső, a gyomor vagy a duodenum érintettsége általában az alsó tápcsatorna érintettségével egyidejűleg fordul elő. A diagnózis alapját endoszkópos, szövettani és radiológiai értékelés képezi. Aftoid vagy hosszanti fekélyek, szűkületek és fisztulák egyaránt felvetik a Crohn-betegség gyanúját. Szövettanilag a krónikus gyulladásos folyamat jelenléte, elsősorban a lymphoplasmocytás sejtek túlsúlya, valamint az aktív fokális gastritis utalnak Crohn-betegségre, epitheloid granuloma ritkán mutatható ki. A kezelés során protonpumpagátló mellett kortikoszteroidokat, immunmodulátorokat és biológiai terápiát alkalmazunk a betegség súlyosságától függően.
Bevezetés
A Crohn-betegség egy heterogén, multifaktoriális etiológiájú kórkép, amely jellegzetesen krónikus, szegmentális és transzmurális gyulladást okoz a gasztrointesztinális traktus bármely szakaszán, a szájüregtől egészen az ánuszig. Először 1932-ben írta le Crohn, Ginzburg és Oppenheimer a terminális ileumot érintő betegségként, de két évvel később már beszámoltak más szegmentumok érintettségéről is (1, 2). A felső gasztrointesztinális traktusban (GIT) előforduló megjelenésről az első leírás 1937-ből származik (3). Az endoszkópos képalkotás fejlődésével lehetővé vált a nyelőcső-, a gyomor- és a nyombélléziók kimutatása.
A bécsi klasszifikáció szerint a felső GIT manifesztáció alatt a terminális ileumtól proximálisan elhelyezkedő szakaszok betegségét értjük (4). A montreali beosztás – amely a bécsi beosztás átdolgozása – a felső szakaszok érintettségét (L4) a betegség módosító tényezőjének tekinti, másik bélszakaszt érintő Crohn-betegséghez társul (pl. gyakran L1+L4 vagy L2+L4), vagy akár izoláltan is megjelenhet (5). A felső GIT lokalizációjú Crohn-betegség rosszabb prognózisú betegségtípust jelent, gyakran rekurrens, progresszív betegséget takar, valamint komplikációkhoz és sebészeti beavatkozáshoz vezet (6–9). A proximális CD gyakrabban fordul elő fiatalabb életkorban, nem dohányzóknál, szűkületes formájú terminális ileumérintettség esetén. Ha összevetjük az L4-jejunális és az L4-oesophagogastroduodenalis megjelenési formákat, az L4-jejunális megjelenés gyakoribb ileum és stenotizáló formák esetén, a betegek idősebbek, és gyakrabban szorulnak bélreszekcióra. A különbségek miatt a montreali beosztás revízióját javasolják, ahol a gyermekpopulációhoz hasonlóan elkülönítik az L4a (a Treitz-szalagtól proximális) és az L4b (a Treitz-szalagtól distalis) betegséget felnőttekben is (9).
Felső gasztrointesztinális tünetekkel bíró betegeknél a Crohn-betegség prevalenciája 0,5-5% között változik. Az újabb obszervációs vizsgálatok magasabb előfordulási arányról számolnak be tünetmentes Crohn-betegnél. Protokollszerűen elvégzett felső panendoszkópia és/vagy kapszulaendoszkópia esetén akár 11-16% is lehet. Gyermekkori gyulladásos bélbetegség (IBD) esetén a szakmai ajánlások rutinszerűen javasolják az oesophagogastrobulboscopia és biopszia elvégzését frissen diagnosztizált betegségben (10). Gyermekpopulációban a felső GIT érintettsége éppen ezért 11% körüli. A legtöbb talált makroszkópos és mikroszkópos eltérés azonban nem specifikus, sokszor kérdéses relevanciájú a klinikai gyakorlat számára. Az Európai Crohn és Colitis Társaság (ECCO) frissen diagnosztizált felnőtt Crohn-betegnél javasolja a vékonybél-manifesztáció keresését és a kiterjedés meghatározását, ugyanakkor tünetmentes betegnél rutinszerűen a gasztroszkópia nem indokolt (11). Nem klasszifikálható IBD esetén a gasztroszkópia segítheti a Crohn-betegség és a colitis ulcerosa elkülönítését.
Egy 2021-ben készült metaanalízis feldolgozása alapján felső GIT lokalizáció esetén leggyakrabban a gyomor (56%) és a duodenum (55%) érintett, a jejunum 36%-ban, a proximális ileum 32%-ban, a nyelőcső csak 11%-ban. Az esetek felében ileocoecalis lokalizációhoz társultan jelenik meg, csak 10%-ban fordul elő izolált formában. Döntően gyulladásos fenotípusú (B1) betegséggel találkozhatunk, B2 stenotizáló variáns 26%-ban, B3 penetráló forma 16%-ban fordul elő. Nagyobb valószínűséggel fordul elő felső GIT-CD fiatal, férfi, stenotizáló viselkedésű betegeknél, akiknél erythema nodosum is ismert. Náluk gyakrabban válik indokolttá a kórházi bennfekvés és műtéti reszekció. A legtöbb műtéti megoldást a jejunális érintettségű betegség igényli, amely sokszor agresszívabb viselkedésű, és előfordul, hogy ezek a betegek már a diagnózis megszületése pillanatában műtétre szorulnak (12).
Tekintettel arra, hogy a jejunális megjelenésű Crohn-betegséggel kapcsolatos irodalmi ismereteink szegényesek, az összefoglaló a nyelőcső, a gyomor és a duodenum érintettségre szorítkozik (13).
A nyelőcső Crohn-betegsége
A nyelőcső Crohn-betegsége ritka, prevalenciája 7,6-17,6% a gyermekgyógyászatban vizsgált betegeknél, és 3,3-6,8% között mozog a felnőtt populációban – utóbbi adatok alábecsülnek a tünetmentes felnőtteknél elmulasztott diagnosztika miatt (14). A legtöbb retrospektív obszervációs vizsgálatban a nyelőcső érintettség fiatal életkorban jelentkezett, jellegzetesen 1-3 évvel a más lokalizációban diagnosztizált betegség után.
A nyelőcső-CD tünettanát tekintve jelentkezhet refluxra emlékeztető gyomorégés, regurgitáció vagy mellkasi fájdalom, előrehaladottabb állapotban dysphagia, odynophagia, hányás és fogyás is. Szövődményként szűkület, fisztulák és ritkán perforáció előfordulhat. A fisztulák akár a környező szervekbe is penetrálhatnak (pl. hörgő, mediastinum), ahol tályogképződéshez vezethet. Nyelés-röntgenvizsgálat során azonosíthatók a nyálkahártya-egyenetlenségek, a polipok, a szűkületek és a fisztulák. Nehéz diagnosztikus helyzetben az endoszkópos ultrahangvizsgálat is segíthet, mivel képes kimutatni a gyulladásos folyamat transzmurális jellegét.
A nyelőcső-CD endoszkópos megjelenése nem specifikus; sérülékenység, afták, felületes vagy mély fekélyek, granuláltság, utcakőrajzolat és merev nyálkahártya egyaránt megjelenhet (15). Egyes szerzők szerint nyelőcső érintettségű CD-ben jellegzetes az ún. „lyukasztóvas” lézió, amely nagyobb és mélyebb fekélyeket jelent, és hasonlít a herpeszvírusok és cytomegalovirus okozta fekélyekre (16) (1. ábra). További elkülönítendő kórképek a HIV oesophagitis, a sarcoidosis, a tuberkulózis, az eosinophil oesophagitis, a Behcet-betegség, a karcinóma, a szifilisz, a disszeminált nyelőcsőmycosis és a lymphoma. Szűkület az esetek kb. 20%-ában, fisztula és pszeudopolipok 5-5%-ban fordulnak elő (16). A leggyakrabban érintett szakaszok a nyelőcső középső (80%) és distalis (15%) harmada, a proximális nyelőcső (5%) csak ritkán érintett. A diagnózishoz és a differenciáldiagnosztikához szövettani mintavétel szükséges a felületes és a mély léziókból.
Randomizált, kontrollált vizsgálatok hiányában a nyelőcső-CD kezelésére vonatkozó irányelvek hiányosak. Általánosságban elmondható, hogy a Crohn-betegség kezelése során használt valamennyi szer alkalmazható (szteroidok, immunmoduláns és biológiai terápiák). Dysphagiát okozó fibrotikus szűkület esetén ballonos nyelőcsőtágítás javasolható, illetve stent behelyezése is szóba jön (17). Az oesophagectomia szintén egy lehetőség azokban az esetekben, ahol fisztulákkal, kiterjedt szűkületekkel vagy tályogokkal szövődött, konzervatív kezelésre refrakter betegség van jelen. Protonpumpagátlók (PPI) használata tüneti javulást válthat ki, azonban ezek a gyógyszerek nem idéznek elő nyálkahártya-gyógyulást, monoterápiaként történő alkalmazásuk éppen ezért nem javasolt, akárcsak az aminoszalicilátoké sem.
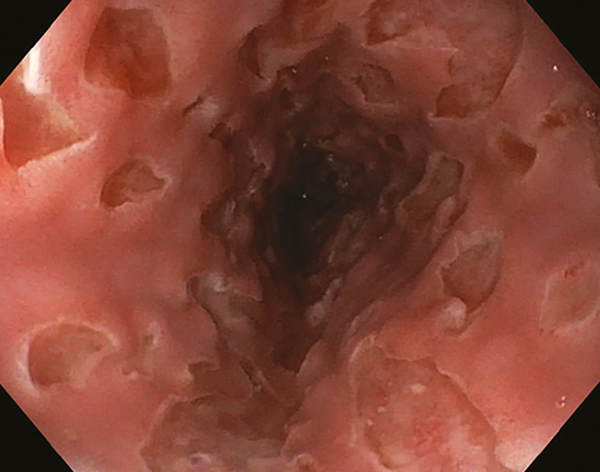
Típusos „lyukasztóvas-léziók” a nyelőcső teljes hosszában egy 24 éves, újonnan diagnosztizált nőbetegnél. A klinikai képet a véres hasmenés mellett a súlyosbodó dysphagia jellemezte
(dr. Sarlós Patrícia felvétele)
Gastroduodenalis Crohn-betegség
A gastroduodenalis Crohn-betegség prevalenciája 0,5-4%-ra tehető, ugyanakkor izolált gyomor- és nyombélérintettség csak 0,07%-ban fordul elő.
A legtöbb esetben a betegek tünetmentesek, a tünetes betegség általában a béltünetekkel párhuzamosan jelentkezik. Jellemző lehet az epigastrialis hasi fájdalom, a hányinger és a hányás, a posztprandiális teltségérzés, az étvágytalanság és a láz. Hasi feszülés, étkezést követő hányás és a fogyás súlyosabb érintettség, szűkület esetén fordul elő. Ritkán vérhányás, megkésett pubertás és vashiányos anémia is megjelenhet. Gastroduodenalis fisztula kialakulása szintén ritka szövődmény, a környező colon transversum, esetleg az ileocoecalis anasztomózis szakaszaival jön létre abnormális kapcsolat. A Vater-papilla régióját érintő gyulladásos folyamat és fibrózis akut vagy krónikus pancreatitist provokálhat.
Radiológiai vizsgálat során a redők megvastagodását, pylorusdeformitást, stenosist, fissurákat és pseudodiverticulumokat tudunk kimutatni. Az antrum jellegzetesen merev, csökkent perisztaltikájú, radiológiai megjelenése „kosszarv”-ra emlékeztet. A progresszív pylorusszűkülettel járó gastroduodenalis érintettség esetén azonosítható a csőszerű antrum, pylorus és duodenum, az ún. „pszeudo-Billroth I” képet eredményezve. A duodenum szűkülete zsinórra emlékeztető képet ad (18). A gyomor- és a duodenumfisztulák gyakran másodlagosan alakulnak ki a colon transversum és az ileocoecalis anasztomózis területi gyulladás következményeképpen. A primer gastroduodenalis fisztula ritka, legtöbbször enterokután fisztulák fordulnak elő. Esettanulmányokban a leggyakrabban a proximális antrum és a duodenum folytonosan kiterjedő gyulladásával találkozhatunk, amelyet gyakoriságban a leszálló duodenum izolált megbetegedése, majd a distalis duodenum érintettsége követ (19). A proximális gyomor területe gyakran megkímélt.
A gastroduodenalis CD endoszkópos képe hasonlít más szegmentumok gyulladására; jellemző az ödéma, a szabálytalan alakú, serpiginosus vagy longitudinális, felszínes és mély eróziók, fekélyek, macskakőrajzolat, granularitás. A gyulladás fokális eloszlása miatt többszörös mintavétel indokolt az endoszkóposan érintett és az épnek tűnő területekről egyaránt. További diagnosztikai kihívást jelent, hogy a gastroduodenalis elváltozások jelenléte nem mindig tükrözik a betegség aktivitását. Gastroduodenalis CD esetén elkülönítendő betegségek az alábbiak: fekélybetegség, Ménétrier-betegség, Zollinger–Ellison-szindróma, gastrinoma, tuberkulózis, lymphoma, sarcoidosis, szifilisz, collagenosis és amyloidosis.
Egy esetkontrollos vizsgálat kimutatta, hogy a Helicobacter pylori negatív fokális gastritis gyakrabban fordult elő CD-ben, mint colitis ulcerosás betegeknél és egészséges kontrolloknál, különösen fiatalabb korosztályban (OR: 40,8; 95% CI: 15,5–114,9) (20). Újabban felmerült az is, hogy a Helicobacter pylori infekció potenciálisan „védő” hatású lenne az IBD kialakulását tekintve (RR: 0,64; 95% CI: 0,54–0,75). Valószínűleg nem valódi „védő” hatásról van szó, hanem a magasabb higiéniai körülmények között ritkábban előforduló Helicobacter pylori fertőzésről, és a gyakoribb IBD-megjelenés befolyásolja a kapott eredményt. Ugyanakkor a gazdaszervezet immunológiai mechanizmusai is fontosak lehetnek, hiszen a H. pylori fertőzés hatására megváltozik a gyulladásos T-sejtes válasz, amely a proinflammatorikus citokinek és a Th1/Th17 kaszkád downregulációjához vezet (21).
A gastroduodenalis CD kezelése elsősorban a distalis betegséglokalizáció kezelésén és a klinikai tapasztalaton alapszik. A PPI képes a tünetek csökkentésére, de a krónikus gyulladásos aktivitást nem befolyásolja, éppen ezért monoterápiában nem ajánlott alkalmazni. Indukciós terápia céljából szisztémás szteroid és PPI együttes adása javasolt. Az aminoszaliciliátoknak nincs előnyük, sőt a tünetek rosszabbodását is előidézhetik. Fenntartó célzattal immunmodulátor azatioprin alkalmazható, illetve az infliximab- és adalimumabkezelés nyálkahártya-gyógyulást képes előidézni (22, 23). Rövid pylorus vagy duodenumszűkület esetében ballontágítás javasolt, a perforációs szövődmény ritka (1-2%). A gyakori rekurrencia miatt ismételt tágításokra van szükség, hogy elkerüljük a műtéti beavatkozást. Ha sebészeti beavatkozásra kerül sor, strikturoplasztika vagy bypass megoldás (gastrojejunostomia, gastroduodenostomia vagy duodenojejunostomia) jön szóba. A vagotomia csökkenti az anasztomózisfekélyek előfordulását, de hasmenést okozhat. A műtét fő indikációja a tágításra refrakter szűkület mellett a fisztula kialakulása, a gyógyszeres kezelésre nem reagáló fekélyek jelenléte és a tartós vérzés.
Szövettani eltérések felső tápcsatornai Crohn-betegségben
A leggyakoribb szövettani eltérés a felső tápcsatornai Crohn-betegségben is, akárcsak más lokalizációjú betegségben, a lamina propriában jelen lévő krónikus gyulladásos infiltrátum jelenléte lymphocytatúlsúllyal (2. ábra).
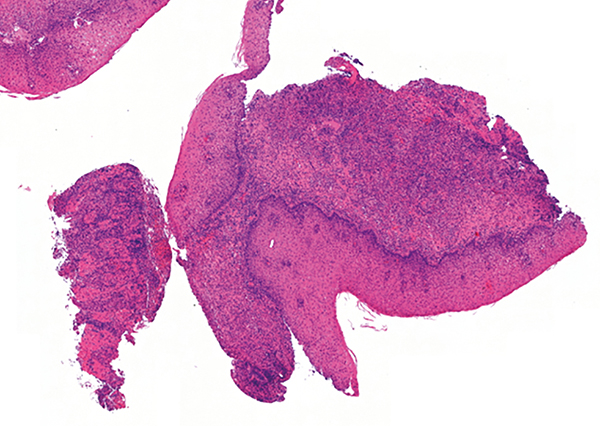
Ulcerált regeneratorikus laphám lobos sarjszövettel és pörkkel. A szöveti kép nem specifikus, de a jellegzetes endoszkópos képpel és a gyomor elváltozásával együttesen értékelve megfelel a Crohn-betegség manifesztációjának (dr. Hegedűs Ivett felvétele, ugyanazon betegből származó minta)
El nem sajtosodó granuloma a szövettani minták kevesebb mint 25%-ában figyelhető meg, hiszen ezek a mélyebb fali rétegekben, a submucosában és az izomrétegben találhatóak (3. ábra). A granuloma jelenléte a szövettani mintában egyes vizsgálatokban rossz prognosztikai jelnek minősült (24, 25). Az epitheloid granulomák és a makrofágokból álló mikroaggregátumok csak Crohn-betegségből származó szövettani gyomormintákban kimutathatóak, colitis ulcerosában nem, amely segítheti a két betegség közti elkülönítést. Megjegyzendő ugyanakkor, hogy ritkán, elsősorban colectomia után, colitis ulcerosában is találhatunk diffúz duodenitisre utaló eltéréseket (26). Fontos hangsúlyozni, hogy a szövettani eredmény a legtöbb esetben csak nem specifikus gyulladást jelez, a granulomák sokszor csak a későbbi műtéti reszekátumban mutathatók ki.
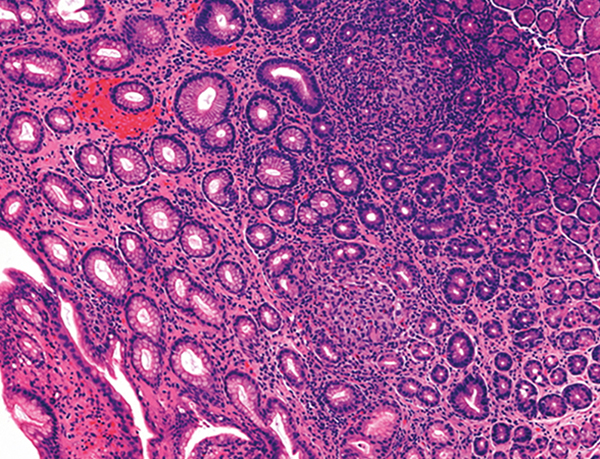
Regeneratorikus gyomornyálkahártya epitheloid sejtes granulomákkal és kevert, krónikus aktív gyulladásos infiltrációval (dr. Hegedűs Ivett felvétele, ugyanazon betegből származó minta)
Megbeszélés
Összességében láthatjuk, hogy a nyelőcső-, a gyomor- és a duodenumérintettségű Crohn-betegséggel kapcsolatos terápiás és prognosztikai ismeretek még nem kellő mélységben feltérképezettek, elsősorban ezen lokalizáció ritka előfordulása miatt. Máig nem rendelkezünk nagy esetszámú összehasonlító vizsgálatokkal, amelyek a mindennapi döntéseinket megkönnyítenék. Annak ellenére, hogy a felső traktus érintettsége mint betegségmódosító szempont a montreali osztályozásban megjelenik, a felső gyomor-bél rendszeri rutinendoszkópia nem javasolt a betegség mértékének felmérése céljából felső GIT tünetek nélküli felnőtt betegeknél, mivel az eredmény klinikai kimenetelre gyakorolt hatása bizonytalan. Ugyanakkor tünetekkel rendelkező betegeknél az endoszkópia és a többszörös szövettani mintanvétel indokolt, nem elfelejtve a Crohn-betegséget utánzó kórképek elkülönítését.
Irodalom
https://doi.org/10.1016/0002-9343(52)90025-9
2. Davis KG. Crohn’s Disease of the Foregut. Surg Clin North Am 2015; 95: 1183–1193. https://doi.org/10.1016/j.suc.2015.07.004
3. Laube R, Liu K, Schifter M, Yang JL, Suen MK, Leong RW. Oral and upper gastrointestinal Crohn’s disease. J Gastroenterol Hepatol 2018; 33: 355–364. https://doi.org/10.1111/jgh.13866
4. Gasche C, Scholmerich J, Brynskov J, D’Haens G, Hanauer SB, Irvine EJ, Jewell DP, Rachmilewitz D, Sachar DB, Sandborn WJ, Sutherland LR. A simple classification of Crohn’s disease: Report of the Working Party for the World Congresses of Gastroenterology, Vienna 1998. Inflamm Bowel Dis 2000; 6: 8–15. https://doi.org/10.1097/MIB.0b013e31828132b4
5. Satsangi J, Silverberg MS, Vermeire S, Colombel JF. The Montreal classification of inflammatory bowel disease: Controversies, consensus, and implications. Gut 2006; 55: 749–753.
https://doi.org/10.1136/gut.2005.082909
6. Lazarev M, Huang C, Bitton A, Cho JH, Duerr RH, McGovern DP, Proctor DD, Regueiro M, Rioux JD, Schumm PP, Taylor KD, Silverberg MS, Steinhart AH, Hutfless S, Brant SR. Relationship between proximal Crohn’s disease location and disease behavior and surgery: A cross-sectional study of the IBD Genetics Consortium. Am J Gastroenterol 2013; 108: 106–112.
https://doi.org/10.1038/ajg.2012.389
7. Henriksen M, Jahnsen J, Lygren I, Aadland E, Schulz T, Vatn MH, Moum B; Ibsen Study Group. Clinical course in Crohn’s disease: Results of a five-year population-based follow-up study (the IBSEN study). Scand J Gastroenterol 2007; 42: 602–610. https://doi.org/10.1080/00365520601076124
8. Gomollón F, Dignass A, Annese V, Tilg H, Van Assche G, Lindsay JO, Peyrin-Biroulet L, Cullen GJ, Daperno M, Kucharzik T, Rieder F, Almer S, Armuzzi A, Harbord M, Langhorst J, Sans M, Chowers Y, Fiorino G, Juillerat P, Mantzaris GJ, Rizzello F, Vavricka S, Gionchetti P; ECCO. 3rd European Evidence based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis 2017; 11: 3–25.
https://doi.org/10.1093/ecco-jcc/jjw168
9. Levine A, Griffiths A, Markowitz J, Wilson DC, Turner D, Russell RK, Fell J, Ruemmele FM, Walters T, Sherlock M, Dubinsky M, Hyams JS. Pediatric modification of the Montreal classification for inflammatory bowel disease: The Paris classification. Inflamm Bowel Dis 2011; 17: 1314–1321.
https://doi.org/10.1002/ibd.21493
10. Abdullah BA, Gupta SK, Croffie JM, Pfefferkorn MD, Molleston JP, Corkins MR, Fitzgerald JF. The role of esophagogastroduodenoscopy in the initial evaluation of childhood inflammatory bowel disease: A 7-year study. J Pediatr Gastroenterol Nutr 2002; 35: 636–640.
https://doi.org/10.1097/00005176-200211000-00009
11. Feakins RM. Ulcerative colitis or Crohn’s disease? Pitfalls and problems. Histopathology 2014; 64: 317–335.
https://doi.org/10.1111/his.12263
12. Yip HC, Cheng H Ng, Snow Y, et al. Systematic review with meta-analysis: The prevalence, risk factors and outcomes of upper gastrointestinal tract Crohn’s disease. Dig Liver Dis 2021; 53(12): 1548–1558.
https://doi.org/10.1016/j.dld.2021.07.037
13. Pimentel AM, Rocha R, Santana GO. Crohn’s disease of esophagus, stomach and duodenum. World J Gastrointest Pharmacol Ther 2019; 7(10): 35–49. https://doi.org/10.4292/wjgpt.v10.i2.35
14. De Felice KM, Katzka DA, Raffals LE. Crohn’s Disease of the Esophagus: Clinical Features and Treatment Outcomes in the Biologic Era. Inflamm Bowel Dis 2015; 21: 2106–2113.
https://doi.org/10.1097/MIB.0000000000000469
15. Feagans J, Victor D, Joshi V. Crohn disease of the esophagus: A review of the literature. South Med J 2008; 101: 927–930. https://doi.org/10.1097/SMJ.0b013e31818047be
16. D’Haens G, Rutgeerts P, Geboes K, Vantrappen G. The natural history of esophageal Crohn’s disease: Three patterns of evolution. Gastrointest Endosc 1994; 40: 296–300. https://doi.org/10.1016/S0016-5107(94)70059-1
17. Goldstein NS, Amin M. Upper Gastrointestinal Tract in Inflammatory Bowel Disease. Surg Pathol Clin 2010; 3: 349–359. https://doi.org/10.1016/j.path.2010.05.004
18. van Hogezand RA, Witte AM, Veenendaal RA, Wagtmans MJ, Lamers CB. Proximal Crohn’s disease: Review of the clinicopathologic features and therapy. Inflamm Bowel Dis 2001; 7: 328–337. https://doi.org/10.1097/00054725-200111000-00010
19. Nugent FW, Richmond M, Park SK. Crohn’s disease of the duodenum. Gut 1977; 18: 115–120. https://doi.org/10.1136/gut.18.2.115
20. Sonnenberg A, Melton SD, Genta RM. Frequent occurrence of gastritis and duodenitis in patients with inflammatory bowel disease. Inflamm Bowel Dis 2011; 17: 39–44. https://doi.org/10.1002/ibd.21356
21. Papamichael K, Konstantopoulos P, Mantzaris GJ. Helicobacter pylori infection and inflammatory bowel disease: Is there a link? World J Gastroenterol 2014; 20: 6374–6385. https://doi.org/10.3748/wjg.v20.i21.6374
22. Mottet C, Juillerat P, Gonvers JJ, Michetti P, Burnand B, Vader JP, Felley C, Froehlich F. Treatment of gastroduodenal Crohn’s disease. Digestion 2005; 71: 37–40. https://doi.org/10.1159/000083871
23. Rodríguez-Grau Mdel C, Chaparro M, Díaz R, Gisbert JP. Infliximab in the treatment of refractory gastroduodenal Crohn’s disease. Gastroenterol Hepatol 2014; 37: 21–22. https://doi.org/10.1016/j.gastrohep.2013.06.008
24. Molnár T, Tiszlavicz L, Gyulai Cs, Nagy F, Lonovics J. Clinical significance of granuloma in Crohn’s disease. World J Gastroenterol 2005; 11(20): 3118–21. https://doi.org/10.3748/wjg.v11.i20.3118
25. Simillis C, Jacovides M, Reese GE, Yamamoto T, Tekkis PP. Meta-analysis of the role of granulomas in the recurrence of Crohn disease. Dis Colon Rectum 2010; 53: 177–185. https://doi.org/10.1007/DCR.0b013e3181b7bfb0
26. Cauchi S, Van Venetien F, Sciberras M, Ellul P. Colitis Trouble up High: A Case of Gastroduodenal Ulcerative Colitis and Literature Review. J Gastrointestin Liver Dis 2025; 34(1): 128–132. https://doi.org/10.15403/jgld-5903
