Original publication
The role of home parenteral nutrition in maintaining nutritional status and survival in patients with malignant intestinal failure: a retrospective study
Summary
Home parenteral nutrition (HPN) is a crucial therapeutic option for patients with intestinal failure; however, its effectiveness in the context of malignant underlying disease remains less well understood. In our study, we analyzed data from 17 patients with chronic intestinal failure caused by malignancy. During HPN, body weight, BMI, and muscle mass remained stable, and the median overall survival was 9 months. Complications occurred on four occasions in total. Our findings support the conclusion that HPN is a safe and effective method for maintaining nutritional status and potentially prolonging survival.
Az otthoni parenterális táplálás (OPT) kulcsfontosságú terápiás lehetőséget jelent a bélelégtelenségben szenvedő betegek számára, azonban malignus alapbetegség esetén hatékonysága kevésbé ismert. Vizsgálatunkban 17, malignus eredetű krónikus bélelégtelenségben szenvedő beteg adatait elemeztük. Az OPT során a testtömeg, a testtömegindex (BMI) és az izomtömeg lényegében stabil maradt, míg a medián túlélés 9 hónap volt. Szövődmények összesen négy alkalommal fordultak elő. Eredményeink alátámasztják, hogy az OPT biztonságos és hatékony módszer a tápláltsági állapot fenntartására, valamint a túlélés meghosszabbítására.
Bevezetés
A bélelégtelenség olyan állapot, amelyben a bél elégtelen felszívóképessége következtében a táplálás nem biztosít elegendő tápanyagot és folyadékot a szervezet számára (1). Ez a kórkép számos állapot következtében kialakulhat, többek között rövidbél-szindróma, krónikus motilitászavar vagy malignus eredetű bélelzáródás esetén (2). Onkológiai betegeknél gyakran fordul elő, hogy a daganat progressziója, a sebészeti beavatkozások vagy a kemoterápia által kiváltott bélműködési zavarok miatt enterális úton nem biztosítható az adekvát tápanyagbevitel (3).
Az otthoni parenterális táplálás (OPT) egy olyan terápiás lehetőség, amely idült bélelégtelenségben szenvedő betegek számára lehetővé teszi a megfelelő tápanyagellátást, miközben otthoni környezetben folytathatják életvitelüket (4). Az OPT indikált azon járóbeteg-ellátás keretében biztonságosan gondozható betegeknél, akik képtelenek szájon keresztül vagy szondán történő táplálással elérni az optimális tápláltsági állapotot (5). A sikeres OPT megvalósításának feltétele a beteg megfelelő funkcionális állapota, a várhatóan legalább két hónapos túlélési idő, valamint egy biztosított centrális vénás hozzáférés (6). Emellett elengedhetetlen a megfelelő otthoni környezet és gondozási háttér, amely biztosítja a kezelési protokoll betartását és a szövődmények megelőzését (7).
Az OPT folyamata több fázisból áll. Az első szakaszban a betegek kiválasztása és az állapotuk felmérése történik, amely magában foglalja a tápláltsági állapot objektív vizsgálatát, az antropometriai paraméterek (pl. testtömeg, testtömegindex [basal metabolic rate, BMI], vázizomtömeg) és a biokémiai markerek (pl. szérumalbuminszint, lymphocytaszám, C-reaktív protein [CRP]) mérését (8). Ezútán a beteg egy kórházi felkészítő szakaszon esik át, amely során megtanulja a parenterális táplálás otthoni kivitelezését és az esetleges szövődmények felismerését. A terápia beállítása egyénre szabottan történik, figyelembe véve a beteg aktuális klinikai állapotát, energiaszükségletét és metabolikus egyensúlyát.
Az OPT során a beteg rendszeres orvosi ellenőrzés alatt áll, amelynek célja a tápláltsági állapot fenntartása, a szövődmények megelőzése és az életminőség javítása. Az OPT hosszú távú hatékonyságát és biztonságosságát befolyásoló tényezők közé tartozik a testösszetétel alakulása, a tápláltsági kockázati mutatók (nutritional risk index [NRI], geriatric nutritional risk index [GNRI], prognostic nutritional index [PNI], global leadership initial on malnutrition [GLIM]) változása, a szövődmények előfordulása, valamint a betegek túlélési esélyeinek értékelése (9).
Jelen retrospektív vizsgálat célja, hogy átfogóan elemezze az onkológiai eredetű, idült bélelégtelenségben szenvedő betegek körében alkalmazott OPT hatékonyságát, biztonságosságát és a túlélésre gyakorolt hatását, mivel ezen indikációs körben az OPT alkalmazása nem egyértelmű hazánkban. A kutatás során különös figyelmet fordítottunk az OPT indikációira, a tápláltsági állapot változására, a szövődmények előfordulására és az antropometriai paraméterek alakulására, amelyek fontos prognosztikai tényezőként szolgálhatnak az OPT sikerességének értékelésében.
Metodika
A vizsgált populáció
Retrospektív, obszervációs vizsgálatunkba 2015. január elseje és 2025. január elseje között kezelt betegeket vontunk be. Minden beteg malignus tumor által okozott idült bélelégtelenségben szenvedett. A beválogatásnál a következő szempontokat vettük figyelembe:
- tartós bélelégtelenség, vagyis enterálisan nem biztosítható a kellő tápanyagszükséglet, malabszorpció áll fenn (10);
- legalább 2 hónapos várható túlélés;
- megfelelő funkcionális állapot;
- megfelelő tüneti kontroll, vagyis a beteg fájdalma és egyéb súlyos tünetei (például hányás, dyspnoe) megfelelően kontrolláltak, így az OPT kivitelezhető;
- megfelelő centrális vénás hozzáférés;
- otthoni környezet és ápolási háttér, vagyis a betegnek rendelkeznie kell megfelelő otthoni környezettel és egy gondozóval, aki segíteni tudja az OPT kivitelezését.
Kizárási kritériumot jelentett, ha a betegek:
- nem feleltek meg minden beválogatási kritériumnak;
- nem töltötték be a 18. évet;
- nem malignus betegségben szenvedtek (például az obstrukciót pseudomyxoma peritonei, desmoid tumor okozza);
- rendkívül rossz általános állapotban voltak, és tüneteik nem voltak kontrollálhatók.
A vizsgálatot a Szegedi Tudományegyetem Regionális Humán Biológiai Kutatásetikai Bizottsága hagyta jóvá (114/2023-SZTE RKEB).
Adatgyűjtés
A vizsgálathoz szükséges adatokat (a betegek nemét, életkorát, pontos diagnózisát, az otthoni parenterális táplálás [OPT] indikációját, a túlélési időt és a fellépő szövődményeket) a kórházi Medsol-adatbázisból gyűjtöttük össze. Emellett rögzítettük a testtömeget, a testmagasságot, a BMI-t, valamint az egyéb antropometriai paramétereket, beleértve a vázizomtömeget (SMM), a testzsírszázalékot (PBF) és az extracelluláris víz arányát (ECW ratio). Az antropometriai paraméterek rögzítése InBody 770-es készülékkel történt a programba való felvételkor (11), illetve a kontrollidőpontok alkalmával. A laboratóriumi paraméterek közül az albuminszint, a lymphocytaszám és a CRP-szint változását követtük nyomon. A BMI kategóriáit a Centers for Disease Control and Prevention (CDC) ajánlásai szerint határoztuk meg, amely alapján az alultápláltság határértéke 18,5 kg/m² alatt volt, míg a normál testsúly tartománya 18,5 és 24,9 kg/m² közé esett. A 25 kg/m² vagy annál magasabb BMI túlsúlyos állapotra utal (12).
A tápláltsági állapot komplex értékelése érdekében több validált mutatót alkalmaztunk, köztük az NRI-, PNI- és a GLIM-kritériumrendszert (13). A WHO ajánlásainak megfelelően a 70 év feletti betegek esetében az NRI helyett a GNRI-t számítottuk ki (14), amelyet az alábbi képlettel határoztunk meg:
GNRI = (1,489 × szérumalbumin [g/l]) + (41,7 × [ideális testtömeg {kg} / jelenlegi testtömeg {kg}])
NRI = (1,519 × szérumalbumin [g/l]) + (41,7 × [ideális testtömeg {kg} / jelenlegi testtömeg {kg}])
PNI = (10 × albumin [g/dl]) + (0,005 × teljes lymphocytaszám [sejt/mm³])
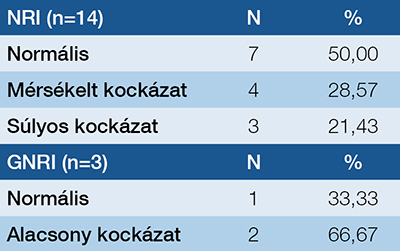
A GNRI értékei alapján a betegek táplálkozási kockázata különböző kategóriákba sorolható. Azok, akiknél a GNRI értéke meghaladja a 98-at, nincsenek kitéve táplálkozási kockázatnak, míg a 92 és 98 közötti tartomány alacsony, a 82 és 92 közötti érték mérsékelt, a 82 alatti pedig jelentős táplálkozási kockázatot jelent. A PNI esetében a 38 feletti érték normál tápláltsági állapotra utal, míg a 35 és 38 közötti tartomány mérsékelt, a 35 alatti pedig súlyos táplálkozási kockázatra utal. Az NRI szerinti besorolás alapján a 100 feletti érték a táplálkozási kockázat hiányát, a 97,5 és 100 közötti tartomány enyhe, a 83,5 és 97,5 közötti mérsékelt, míg a 83,5 alatti érték súlyos táplálkozási kockázatot jelent. A vázizomtömeg pontosabb értékelése érdekében annak indexelt formáját, az SMI-t (skeletal muscle index) számítottuk ki, amely a testtömegre normalizált izomtömeget mutatja:
SMI = (vázizomtömeg [kg] / testtömeg [kg]) × 100
Az ideális testtömeg (ideal body weight, IBW) meghatározására a Devine-képletet alkalmaztuk, és nemtől függően eltérő módon számítottuk ki:
- Férfiak esetében: IBW (kg) = 50 + 0,9 × (testmagasság [cm] – 152,4)
- Nők esetében: IBW (kg) = 45,5 + 0,9 × (testmagasság [cm] – 152,4)
Továbbá vizsgáltuk a Glasgow prognostic score-t (GPS-t), amely egy széles körben alkalmazott prognosztikai biomarker, különösen daganatos betegek esetében. A GPS kiszámítása során a betegek 1-1 pontot kaphatnak a magas CRP-szintre (>10 mg/l) és az alacsony albuminszintre (<35 g/dl). OPT során különösen fontos a várható élettartam becslése, mivel a magasabb GPS-érték kedvezőtlenebb prognózist jelez. Korábbi vizsgálatok szerint GPS=2 esetén a medián túlélés gyakran csupán 2–3 hónap (15).
Statisztika
A populáció alapvető jellemzőinek bemutatására és az adatok eloszlásának szemléltetésére leíró statisztikai módszereket alkalmaztunk: átlag, szórás (SD), medián, interkvartilis tartomány, minimum- és maximumérték, illetve variációs együttható. A különböző kategóriák (pl. diagnózisok megoszlása) relatív gyakoriságát százalékban fejeztük ki. A túlélés elemzése során Kaplan–Meier- görbét és univariáns, Cox-arányos hazard regressziós modellt alkalmaztunk. A Kaplan–Meier-görbe a betegek túlélési valószínűségét (16) az idő függvényében ábrázolja. Az univariáns, Cox-arányos hazard regresszió (17) azt vizsgálja, hogy a különböző tápláltsági mutatók milyen mértékben befolyásolják a túlélést. A kiindulási és a végállapot közötti változások elemzéséhez páros összehasonlító teszteket alkalmaztunk. Azokban az esetekben, ahol az adatok eloszlása normál eloszlású volt, páros t-próbát végeztünk, ellenkező esetben Wilcoxon-próbát. Az adatok normál eloszlásáról Shapiro–Wilk-teszttel győződtünk meg. A korrelációs vizsgálatokat Spearman-féle rangkorrelációval és Pearson-féle korrelációval elemeztük. Többváltozós, lineáris regressziós analízist alkalmaztunk annak meghatározására, hogy a végső testösszetételi paramétereket milyen tényezők befolyásolták. A reziduális szórások homogenitását (homoszkedaszticitás) Breusch–Pagan-teszttel vizsgáltuk.
Eredmények
A betegek általános jellemzése
Vizsgálatunkban 17 beteg adatait elemeztük, akiknek átlagéletkora 59 ± 11,9 év volt. A vizsgált populáció túlnyomó többsége nő volt (n=14; 82,35%), míg a férfiak aránya 17,65%-ot tett ki (n=3). A parenterális táplálás indikációja az esetek 29,4%-ában (n=5) 1-es típusú rövidbél-szindróma, 11,8%-ában (n=2) 2-es típusú rövidbél-szindróma, míg 58,8%-ában (n=10) tumor okozta mechanikus bélobstrukció volt. A táplálásterápia indikációjául szolgáló alapbetegségek között gyomorkarcinóma 2 esetben (11,8%), kolonkarcinóma 7 betegnél (41,2%), míg különböző nőgyógyászati malignitások szintén 7 betegnél (41,2%) fordultak elő. Ezenkívül egy beteg esetében (5,9%) világossejtes veserák állt fenn. A betegek számára a parenterális táplálást eltérő vaszkuláris hozzáférési lehetőségekkel biztosítottuk: 10 esetben (58,8%) centrális vénás port implantációjára került sor, míg 7 betegnél (41,2%) perifériásan behelyezett centrális katéter (peripherally inserted central catheter, PICC line) segítségével valósult meg a táplálás. A kezelés során 4 betegnél (23,5%) jelentkeztek szövődmények. Egy esetben portelzáródás lépett fel, amely alkoholos átmosás után rendeződött. Egy másik betegnél kritikus fokú bőrelvékonyodás alakult ki a port felett, amelynek következtében annak eltávolítása és az ellenoldalra történő áthelyezése vált szükségessé. Két beteg esetében infekció alakult ki, amelyek antibiotikus kezelés hatására megszűntek. Az egyik páciensnél azonban a gyakori reinfekciók miatt a port eltávolítására volt szükség, amelyet centrális vénás katéter (CVC) implantációja követett.
A betegek tápláltsági jellemzői
A betegek testtömege átlagosan 53,92 ± 14,43 kg volt, amelyhez 166,4 ± 12,6 cm-es magasság tartozott. Mindezek alapján a BMI átlagosan 19,37 ± 3,62 kg/m² értéknek adódott. Az átlagos ECW-arány 0,396 ± 0,0125 volt. Alacsony ECW-arány egyetlen betegnél sem volt megfigyelhető, négy esetben az arány a normál tartomány felett volt (>0,40), míg a többi beteg esetében az értékek a fiziológiás határokon belül maradtak (0,36–0,39).
A testzsírszázalék vizsgálata során öt betegnél (29,4%) emelkedett értékeket észleltünk (nőknél >30%, férfiaknál >25%), míg hét páciensnél (41,2%) a testzsírszázalék a normál tartomány alatt volt (nőknél <18%, férfiaknál <10%).
A tápláltsági és az immunállapot pontosabb jellemzésére több validált mutatót is alkalmaztunk; ilyen mutató például a GLIM-kritériumrendszer, az NRI (nutritional risk index), a GNRI (geriatric nutritional risk index) és a PNI (prognostic nutritional index). A GLIM alapján a betegek 64,7%-a (n=11) alultápláltnak bizonyult, ami megerősíti az alacsony izomtömeg és testzsírszázalék gyakoriságát a vizsgált populációban. A GNRI számítását kizárólag a 70 év feletti betegek esetében végeztük el; ez alapján két beteg alacsony kockázatúnak, egy beteg pedig kockázatmentesnek minősült. Az NRI alapján hét beteg (50%) nem mutatott tápláltsági kockázatot, négy beteg (28,57%) mérsékelt kockázatúnak, míg három beteg (21,43%) súlyos kockázatúnak bizonyult. A PNI szerint minden beteg tápláltsági állapota normális volt (1. táblázat).
A biokémiai paraméterek közül az albuminszint 38,1 ± 5,6 g/l volt, a lymphocytaszám 3256 ± 3259 sejt/µl, a CRP pedig 33,11 ± 45,3.
A tápláltsági adatok alakulása
A vizsgálat során minden beteg esetében összehasonlítottuk az antropometriai paraméterek (testtömeg, BMI, vázizomtömeg, testzsírszázalék és ECW-arány) kezdeti és végső értékeit. Célunk az volt, hogy meghatározzuk, mennyire sikerült fenntartani az optimális testösszetételt, illetve milyen mértékben tudtuk lassítani a testösszetétel romlását az OPT során (2. táblázat).
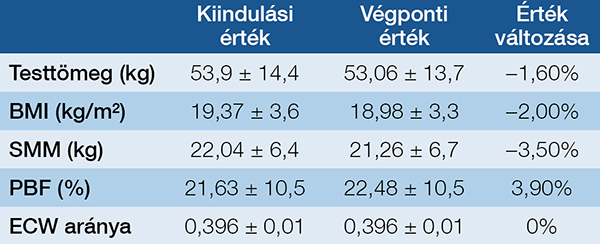
Eredményeink azt mutatták, hogy egyik vizsgált paraméter (testtömeg, BMI, vázizomtömeg, testzsírszázalék, illetve az ECW-arány) esetében sem volt statisztikailag szignifikáns eltérés a kezdeti és a végső értékek között. Ez arra utal, hogy a betegek képesek voltak megőrizni testtömegüket és izomtömegüket, valamint a testfolyadékok eloszlása is stabil maradt.
Összességében az eredmények arra engednek következtetni, hogy az alkalmazott táplálási és szupportív terápiás stratégiák segíthettek a testösszetétel fenntartásában, hozzájárulva a betegek stabil tápláltsági állapotának megőrzéséhez az OPT során (1. ábra és 2. ábra).
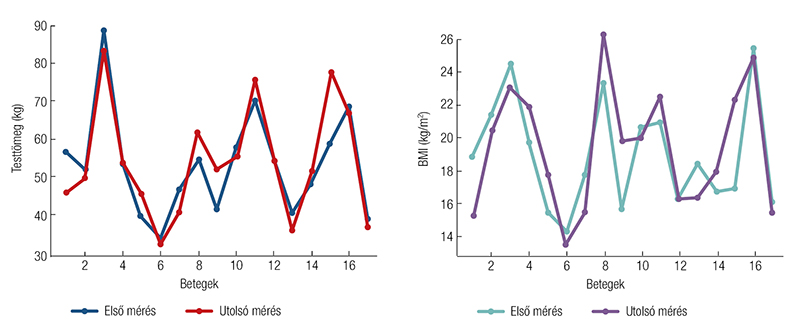
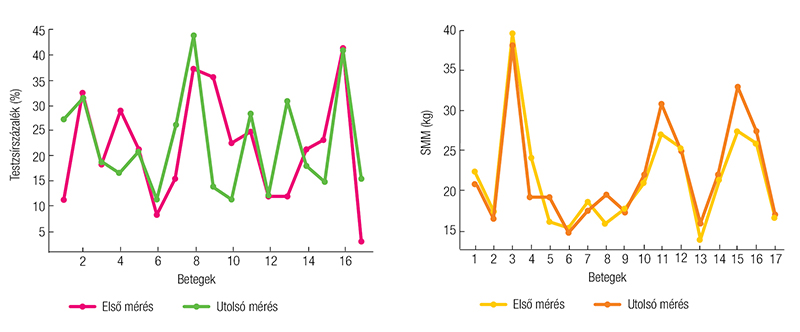
személyekre lebontva
A betegek túlélése
A vizsgálatban szereplő betegek átlagos túlélési ideje 15,16 ± 14,99 hónap, a medián túlélés pedig 9 hónap volt. A Kaplan–Meier-görbe segítségével szemléltettük a populáció túlélési valószínűségének időbeli alakulását (3. ábra) (3. táblázat).
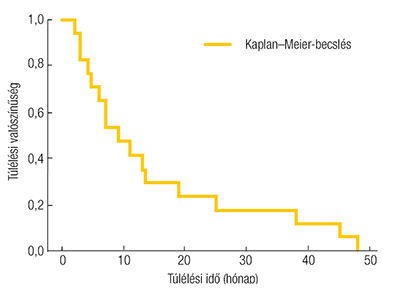
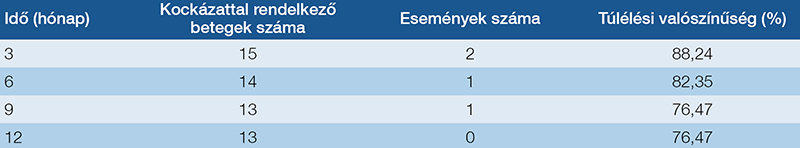
Az univariáns, Cox-féle regressziós analízis eredményei alapján az NRI-értékek nem mutattak szignifikáns összefüggést a halálozással (HR=1,0155; p=0,6825; 95% CI: 0,9434–1,0931). A GNRI értéke sem volt statisztikailag szignifikáns (HR=0,9638; p=0,1616; 95% CI: 0,9152–1,0149). A Cox-féle arányos hazard modell alkalmazásával megvizsgáltuk, hogy az antropometriai paraméterek közül melyek befolyásolják szignifikáns mértékben a túlélést, azonban egyetlen változó esetében sem találtunk egyértelmű és statisztikailag szignifikáns hatást.
A GPS elemzése során jelen vizsgálatban 6 beteg (35,3%) tartozott a GPS szerinti „0” csoportba, 8 beteg (47,1%) az 1-es csoportba, míg 3 beteg (17,6%) a 2-es kategóriába.
Korrelációs számítások
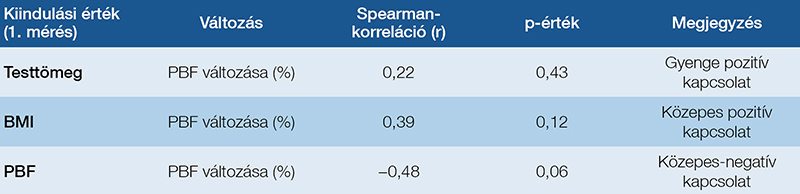
A kiindulási értékek és az OPT során bekövetkező testösszetétel-változások közötti összefüggések feltárása érdekében Spearman-féle és Pearson-féle korrelációs analízist végeztünk. Célunk az volt, hogy megértsük: a kezdeti antropometriai paraméterek milyen mértékben befolyásolják a kezelés során tapasztalt változásokat.
Elemzésünk során egyik esetben sem találtunk statisztikailag szignifikáns kapcsolatot, azonban néhány közepes erősségű összefüggést megfigyeltünk. A kezdeti BMI és a testzsírszázalék (PBF) változása között közepes pozitív kapcsolatot észleltünk, ami arra utal, hogy magasabb kiindulási BMI esetén a PBF nagyobb mértékű változása figyelhető meg. Emellett a kezdeti testzsírszázalék és a PBF változása között közepes negatív kapcsolat mutatkozott, vagyis a kezdetben magasabb testzsírszázalékot mutató betegek kisebb mértékű változáson mentek keresztül (4. táblázat).
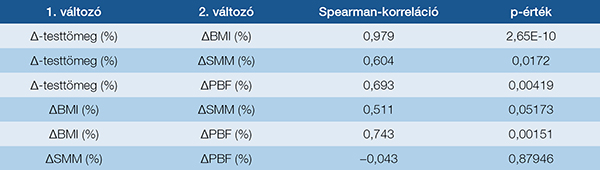
Vizsgáltuk továbbá a különböző testösszetételi paraméterek közötti összefüggéseket, és erős korrelációt találtunk a testtömeg és a BMI, a PBF, valamint az SMM változása között. A BMI szoros kapcsolatot mutatott a PBF és az SMM változásával, ugyanakkor a BMI és az izomtömeg változása között nem volt jelentős összefüggés. Ez arra utalhat, hogy a BMI változása elsősorban a zsírtömeg változását tükrözi, és nem feltétlenül jár együtt az izomtömeg csökkenésével (5. táblázat).
Az OPT végső értékei, illetve az azokban bekövetkező változások közötti összefüggéseket is elemeztük, hogy feltárjuk, mely tényezők befolyásolták leginkább a testösszetétel alakulását. Az OPT végső testtömegértéke szignifikánsan pozitív korrelációt mutatott a testzsírszázalék változásával, míg a végső BMI szignifikánsan pozitív kapcsolatban állt a testtömeg változásával. Ugyanakkor a végső testtömeg és a BMI változása közötti kapcsolat közepes erősségű volt, de nem érte el a statisztikai szignifikancia küszöbét (6. táblázat).
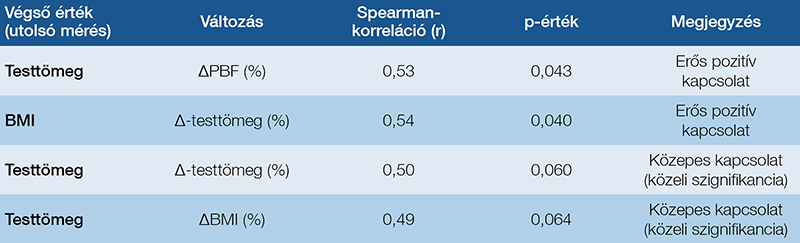
és p-értékekkel
A végső testösszetételi paraméterek alakulásának hátterében álló legfontosabb tényezők azonosítása érdekében többváltozós, lineáris regressziós analízist végeztünk. Az eredmények azt mutatták, hogy a vizsgált végső paraméterek mindegyikét leginkább a kiindulási értéke határozta meg, és egyedül ez volt statisztikailag szignifikáns befolyásoló tényező. Ez arra utal, hogy a betegek testösszetételének végső állapotát alapvetően a kezdeti állapot determinálta (7. táblázat).
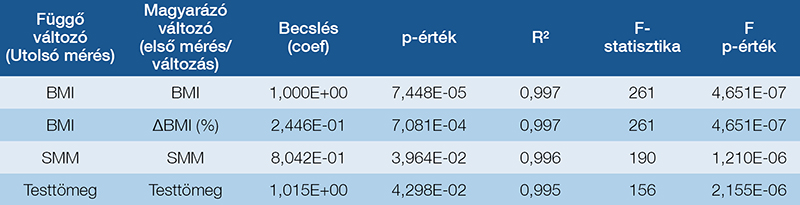
Diszkusszió
Az OPT alkalmazása malignus eredetű krónikus bélelégtelenségben szenvedő betegek esetében egyre fontosabb szerepet tölt be a tüneti kezelésben, az életminőség fenntartásában és a túlélés meghosszabbításában (18). Vizsgálatunk retrospektív módon elemezte az OPT hatékonyságát és a betegek túlélésére gyakorolt hatását, különös tekintettel az antropometriai változásokra, a tápláltsági állapotra és a prognosztikai biomarkerekre.
Eredményeink azt mutatták, hogy az OPT során a betegek testtömege és izomtömege megközelítőleg stabil maradt, ami arra utal, hogy a megfelelő tápanyagbevitel biztosítása révén sikerült elkerülni a testösszetétel jelentős romlását (19). Azonban az egyéni változások figyelembevételével megfigyelhető volt, hogy a magasabb kezdeti BMI-vel rendelkezők nagyobb testzsírszázalék-változást mutattak, míg az alacsonyabb kezdeti testzsírszázalékkal rendelkezők kevésbé reagáltak a táplálási intervencióra.
Jelen vizsgálatunk eredményei összhangban állnak a nemzetközi irodalomban közölt adatokkal, miszerint a malignus eredetű, krónikus bélelégtelenségben szenvedő betegek számára az OPT a tápláltsági állapot fenntartásának fontos terápiás eszköze (20). Eredményeink arra engednek következtetni, hogy az OPT során a testtömeg, a BMI, a vázizomtömeg és az extracelluláris víz aránya (ECW ratio) lényegében stabil maradt, míg a testzsírszázalék kismértékben emelkedett. Ez a tendencia megfelel a várakozásainknak, tekintettel arra, hogy az onkológiai betegek táplálásterápiájának elsődleges célja nem feltétlenül a tápláltsági paraméterek javítása, hanem azok romlásának megakadályozása (21).
A Kaplan–Meier túlélési analízis alapján a vizsgált betegcsoport medián túlélési ideje 9 hónap volt, amely megfelel a korábbi szakirodalmi adatoknak az előrehaladott daganatos betegségben szenvedő betegek körében alkalmazott OPT esetén (22). Az univariáns Cox-féle regresszió nem mutatott szignifikáns összefüggést az NRI és a GNRI értékei, valamint a túlélés között, azonban a GNRI alacsonyabb hazard rátája arra utalhat, hogy a jobb tápláltsági állapotú betegek túlélési esélyei kedvezőbb tendenciát mutathatnak. A GPS-értékek megoszlása szintén igazolta a korábbi megfigyeléseket, miszerint a magasabb GPS-értékkel rendelkező betegek prognózisa kedvezőtlenebb (23).
A többváltozós regressziós analízis alapján megállapítható, hogy a végső antropometriai paramétereket leginkább a kezdeti értékek határozták meg. Ez arra utal, hogy a betegek testösszetételének alakulása nagymértékben függ a kiindulási állapottól, és az OPT célja inkább a fenntartás, semmint a jelentős pozitív változások elérése.
Az irodalom további releváns adatait figyelembe véve érdemes kiemelni, hogy az albuminszint és a testsúlycsökkenés szintén fontos prediktív tényezők az onkológiai betegek túlélésében (24). A mi adataink esetében az albuminszint (bár az OPT során kismértékben csökkent) nem bizonyult önálló prediktornak a Cox-féle regressziós analízisben. Ez felveti annak a lehetőségét, hogy a kizárólag albuminon alapuló indexek (pl. NRI, GNRI) érzékenysége limitált lehet azokban a populációkban, ahol a gyulladásos háttér és a tumorprogresszió meghatározó tényezők.
Ezzel szemben a GPS egyszerűsége és erőteljes prediktív ereje az onkológiai betegek körében kiemelendő. A gyulladás és a tápláltság kettős integrálása révén ez a mutató érzékenyebb lehet az életkilátások előrejelzésében, mint a kizárólag tápláltsági paramétereken alapuló indexek (25).
Konklúzió
Vizsgálatunk alátámasztotta, hogy az otthoni parenterális táplálás hatékony terápia lehet a malignus eredetű krónikus bélelégtelenségben szenvedő betegek számára, különösen azok esetében, akik várhatóan legalább néhány hónapos túléléssel rendelkeznek. Az OPT lehetővé tette a testtömeg és izomtömeg megőrzését, csökkentve a cachexia és az alultápláltság súlyos következményeit.
További nagy elemszámú vizsgálatok szükségesek annak meghatározására, hogy mely klinikai és biokémiai paraméterek szolgálhatnak a legjobb prediktorként az OPT sikerességének előrejelzésére, illetve hogyan lehet optimalizálni a terápiás beavatkozásokat a betegek életminőségének javítása érdekében.
Irodalom
3. Pironi L, Cuerda C, Jeppesen PB, et al. ESPEN guideline on chronic intestinal failure in adults – Update 2023. Clinical Nutrition 2023; 42(10): 1940–2021. https://doi.org/10.1016/j.clnu.2023.07.019
4. Brandt CF, Hvistendahl M, Naimi RM, et al. Home Parenteral Nutrition in Adult Patients With Chronic Intestinal Failure: The Evolution Over 4 Decades in a Tertiary Referral Center. JPEN J Parenter Enteral Nutr 2017; 41(7): 1178–1187. https://doi.org/10.1177/0148607116655449
5. Tappenden KA, Quatrara B, Parkhurst ML, Malone AM, Fanjiang G, Ziegler TR. Critical role of nutrition in improving quality of care: An interdisciplinary call to action to address adult hospital malnutrition. JPEN J Parenter Enteral Nutr 2013; 37(4): 482–497. https://doi.org/10.1177/0148607113484066
6. Singer P, Reintam Blaser A, Berger MM, et al. ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit. Clin Nutr 2023; 42(9): 1671–1689. https://doi.org/10.1016/j.clnu.2023.07.011
7. Van Gossum A, Cabre E, Hébuterne X, et al. ESPEN Guidelines on Parenteral Nutrition: Gastroenterology. Clin Nutr 2009; 28(4): 415–427. https://doi.org/10.1016/j.clnu.2009.04.022
8. Weimann A, Braga M, Carli F, Higashiguchi T, Hübner M, Klek S, et al. ESPEN guideline: Clinical nutrition in surgery. Clin Nutr 2017; 36(3): 623–650. https://doi.org/10.1016/j.clnu.2017.02.013
9. Chen W, Lu C, Zhou T, Jiang F, Zhou J, Yuan X, et al. Prognostic nutritional index as a predictor of mortality in critically ill patients. Journal of Parenteral and Enteral Nutrition 2021; 45(4): 614–622.
https://doi.org/10.2147/IJGM.S318896
10. Segal JB, Griswold M, Achy-Brou A, et al. Using Propensity Scores Subclassification to Estimate Effects of Longitudinal Treatments: An Example Using a New Diabetes Medication. Med Care 2007; 45(10 Supl 2):S 149–157. https://doi.org/10.1097/MLR.0b013e31804ffd6d
11. Kyle UG, Bosaeus I, De Lorenzo AD, et al. Bioelectrical impedance analysis — part I: review of principles and methods. Clin Nutr 2004; 23(5): 1226–1243. https://doi.org/10.1016/j.clnu.2004.06.004
12. Flegal KM, Kit BK, Orpana H, Graubard BI. Association of all-cause mortality with overweight and obesity using standard body mass index categories: a systematic review and meta-analysis. JAMA 2013; 309(1): 71–82. https://doi.org/10.1001/jama.2012.113905
13. Cederholm T, Jensen GL, Correia MITD, et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin Nutr 2019; 38(1): 1–9.
https://doi.org/10.1016/j.clnu.2018.08.002
14. Bouillanne O, Morineau G, Dupont C, et al. Geriatric Nutritional Risk Index: A new index for evaluating at-risk elderly medical patients. Am J Clin Nutr 2005; 82(4): 777–783. https://doi.org/10.1093/ajcn/82.4.777
15. Proctor MJ, Morrison DS, Talwar D, et al. An inflammation-based prognostic score (mGPS) predicts cancer survival independent of tumour site: A Glasgow Inflammation Outcome Study. Br J Cancer 2011; 104k(4): 726–734. https://doi.org/10.1038/sj.bjc.6606087
16. Love SB, Altman DG. Survival analysis part I: basic concepts and first analyses. Br J Cancer 2003; 89(2): 232–238.
https://doi.org/10.1038/sj.bjc.6601118
17. Miguel AH. The hazards of hazard ratios. Epidemiology 2010; 21(1): 13–5. https://doi.org/10.1097/EDE.0b013e3181c1ea43
18. Pironi L, Arends J, Baxter J, et al. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clin Nutr 2015; 34(2): 171–180. https://doi.org/10.1016/j.clnu.2014.08.017
19. Vashi PG, Dahlk S, Popiel B, et al. A longitudinal study investigating quality of life and nutritional outcomes in advanced cancer patients receiving home parenteral nutrition. BMC Cancer 2014; 15:14:593.
https://doi.org/10.1186/1471-2407-14-593
20. Cotogni P, Pedrazzoli P, De Waele E, et al. Nutritional therapy in cancer patients receiving chemoradiotherapy: Should we need stronger recommendations to act for improving outcomes? J Cancer 2019; 10(18): 4318–4325. https://doi.org/10.7150/jca.31611
21. Arends J, Baracos V, Bertz H, et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin Nut 2017; 36(1): 11–48. https://doi.org/10.1016/j.clnu.2017.06.017
22. Bozzetti F, Arends J, Lundholm K, et al. ESPEN guidelines on parenteral nutrition: non-surgical oncology. Clin Nutr 2009; 28(4): 445–454. https://doi.org/10.1016/j.clnu.2009.04.011
24. Gupta D, Lis CG. Pretreatment serum albumin as a predictor of cancer survival: A systematic review of the epidemiological literature. Nutr J 2010; 22:9:69. https://doi.org/10.1186/1475-2891-9-69
25. Proctor MJ, Morrison DS, Talwar D, et al. A comparison of inflammation-based prognostic scores in patients with cancer: A Glasgow inflammation outcome study. Eur J Cancer 2011; 47(17): 2633–41.
https://doi.org/10.1016/j.ejca.2011.03.028
