Reviews
Endoscopic ultrasound-guided biliary drainage: indications and outcomes
Summary
Ultrasound-guided endoscopic biliary drainage (EUS-BD) has become an increasingly common method for treating biliary obstruction, with many advantages over surgical, percutaneous, and even conventional endoscopic retrograde cholangiopancreatography (ERCP) techniques if utilized in proper indications. EUS-BD has a lower incidence of complications (e.g. bile leakage, drain obstruction, or infections) due to its direct, short route to the bile duct. The procedure achieves a higher rate of long-term decompression of the bile ducts, thus improving patient outcomes in cases of malignant biliary obstruction. As EUS-BD continues to evolve, it presents a compelling case for its incorporation into standard practice for managing challenging biliary conditions, ultimately improving care and outcomes for gastroenterology patients.
Az ultrahanggal irányított endoszkópos epedrenázs (EUS-BD) az epeúti elzáródások kezelésének egyre elterjedtebb módszerévé vált, amely számos előnyt mutat a sebészeti, a perkután és – megfelelő indikációban alkalmazva – akár a hagyományos endoszkópos retrográd kolangiopankreatográfia (ERCP) technikákkal szemben. Az EUS-BD a komplikációk tekintetében (pl. az epeváladék szivárgása, drén elzáródása vagy a fertőzések), az epevezetékhez való közvetlen, rövid úton történő hozzáférése miatt azok alacsonyabb előfordulási gyakoriságát mutatja. Az eljárással nagyobb arányban sikerül az epeutak hosszú távú dekompresszióját elérni, így javítja a betegek eredményeit rosszindulatú epeúti elzáródás esetén. Az EUS-BD folyamatos fejlődésével meggyőző érveket mutat be a kihívást jelentő epeúti állapotok kezelésének standard gyakorlatába való beépítése mellett, végső soron javítva a gasztroenterológiai betegek ellátását és eredményeit.
Bevezetés
Az ultrahanggal irányított endoszkópos epeúti drenázs (EUS-BD) egy minimálisan invazív beavatkozási technika az epeelzáródás megszüntetésére, amelyet rossz- vagy jóindulatú állapotok okozhatnak, ideértve a hasnyálmirigyrákot, az epekövességet és az egyéb epeúti eltéréseket. Az EUS-BD terápiás hozzáférést biztosít az epeutakhoz anélkül, hogy külső dréneket kellene alkalmazni, ami elősegíti a betegek jobb életminőségét. Az endoszkópos ultrahanggal vezérelt epeúti drenázs számos előnyt kínál a korábbi módszerekkel szemben, beleértve a kisebb szövődményarányt, az epeelzáródás hatékony kezelését és a rövidebb felépülési időt. Az EUS-BD fő célja az epevezeték és a gyomor vagy duodenum/jejunum közötti fisztula létrehozása, amelyen keresztül stentet helyezhetünk be az epe elfolyásának biztosítására. Ez a technika különösen fontos azoknál a betegeknél, akiknél nem kivitelezhető, vagy sikertelen a hagyományos endoszkópos retrográd kolangiopankreatográfia (ERCP). Egyes tanulmányok szerint az EUH-vezérelt choledochoduodenostomia a hagyományos ERCP-hez hasonló biztonsági profillal rendelkezik, és a poszt-ERCP-s pancreatitist tekintve jelentősen jobb annál (1).
Az EUS-BD kialakításának számos kivitelezése lehetséges (1. táblázat). A legtöbb módszer alapja, hogy ultrahang segítségével vizualizáljuk a drenálni kívánt epeutat, és direkt fistulotomia (pl. EUH-epehólyagdrenázs, EUS-CDS) vagy 19G-s tű segítségével bevezetett vezetődrót mentén (EUS-HGS, antegrád stentelés) alakítjuk ki az összeköttetést a bél- és eperendszer között stentek segítségével.

Történeti áttekintés
Történetileg az endoszkópos ultrahangvezérelt epeúti drenázs lehetőségét Wiersema és munkatársai publikációja után indították el 1996-ban. Ekkor még csak diagnosztikus kolangiográfiát (n=10) és pankreatográfiát (n=1) végeztek (2). 2001-ben Giovannini és munkatársai számoltak be arról, hogy terápiás céllal EUH-vezérelt choledochoduodenostomiát végeztek plasztikstenttel. Ez még hibrid technikával történt. Az epeutak vezetődróttal történő ellátása után duodenoszkóppal fejezték be a beavatkozást (3). Az első egylépéses megközelítést Burmester és munkatársai publikálták 2002-ben (4). 2004-ben Mallery és munkatársai számoltak be több sikeres EUH-vezérelt randevútechnika kivitelezéséről. Ezután számos nem randomizált tanulmány számolt be igen magas technikai és klinikai sikerességi arányról (70–100%) (5). A fő indikációs kör kezdetben a malignus distalis daganatok voltak sikertelen ERCP után, illetve sebészetileg megváltozott anatómia esetén (Billroth II, Roux-Y stb.). Ezután léptek előtérbe a benignus eltérések megoldására az EUH-intervenciók. Alkalmazták juxtapapillaris diverticulum, krónikus hasnyálmirigy-gyulladás, benignus epeúti szűkületek és egyéb elváltozások terén is. A malignus betegségekben a klinikai sikeresség magasabbnak mutatkozott, mint a benignus eltérések során (6). 2016-ban nemzetközi ajánlás fogadta el az eljárás elsőbbrendűségét distalis epeúti elzáródások esetén a PTD-vel és sebészeti eljárásokkal szemben sikertelen ERCP után (7).
Anyag és módszer
A PUBMED-en az „endoscopic ultrasound, ERCP, percutan transhepatic drainage, hepaticogastrostomy, choledochoduodenostomy, hepatico-enterostomy, choledocho-enterostomy” kifejezésekre keresve a 2014–2024-ig megjelent publikációkat (502 találat), az EUS-BD-vel kapcsolatos főbb releváns klinikai vizsgálatokat, RCT-ket, szisztematikus áttekintéseket, metaanalíziseket, valamint az ESGE EUH-intervenciókra vonatkozó 2022-es guideline-ját tekintettük át.
Eredmények
Az EUS-BD az utóbbi évtizedek során elfogadott és biztonságos beavatkozássá nőtte ki magát epeúti obstrukciók minimál invazív ellátásaként. A főbb vizsgálatok eredményeit az eljárással kapcsolatban a 2. táblázatban részletezzük.
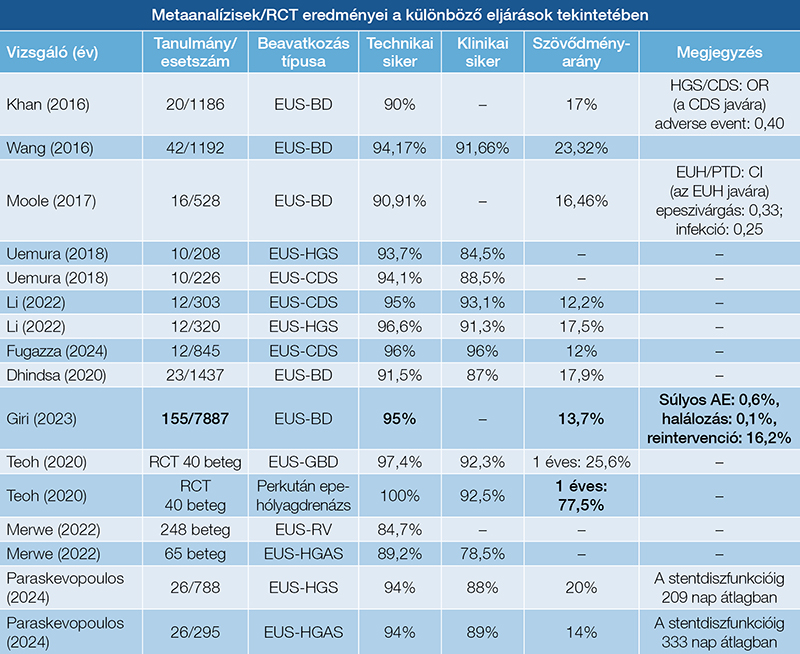
A beavatkozás indikációi lehetnek benignus és malignus eltérések is. A benignus eltérések indikációs köre továbbra is limitált a malignus elváltozásokhoz képest. A leggyakoribb benignus epeúti betegségek, amelyek során EUH-intervenció merül fel, a cholecystitis, az epeúti szűkületek és az epeúti epekövek. A cikk terjedelmi limitációi miatt a benignus kórképeket a ritkább indikáció miatt csak részlegesen tárgyaljuk.
Az EUS-BD módszereinek ismertetése (1. ábra)
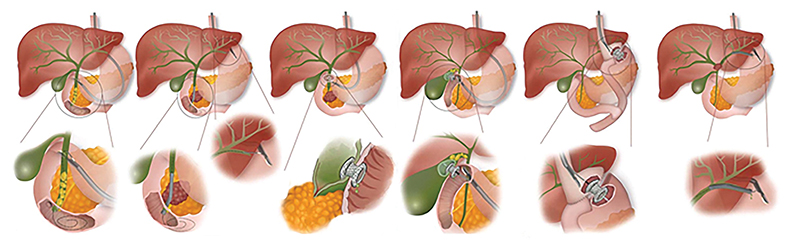
B: EUH-vezérelt antegrád stentelés, C: EUS-CDS, D: EUH-vezérelt cholecystadrenázs, E: EDGE, F: EUS-HGS (forrás: ESGE 2022 guideline) (34)
EUH-vezérelt epehólyagdrenázs (EUS-GBD)
Az epehólyag endoszkópos stentelése a benignus indikációk példájaként került előtérbe a műtétre alkalmatlan betegek cholecystitise esetén, rescue kezelésként malignus obstrukció esetén is alkalmazható egyebekben. Ez a szituáció súlyos társbetegségek vagy egyéb akut betegség társulása (pl. pancreatitis) esetén javasolt alternatíva a sebészeti eltávolítás helyett. Több országban, köztük Magyarországon is, ezen betegek perkután drenázson esnek át, vagy ritkábban transpapillarisan plasztikstentet helyeznek be az epehólyagba. Az eljárás jelenleg elfogadott kivitelezése direkt cystotomia után behelyezett LAMS-sal történik a gyomorból vagy a duodenumból (a hosszabb stentfunkció miatt a duodenumból javasolja inkább az ESGE).
Luk és munkatársai 2019-es metaanalízisében az EUS-GBD-t (206 beteg) és a perkután epehólyagdrenázst (289 beteg) hasonlították össze 5 tanulmány során. A technikai és klinikai sikerben nem volt szignifikáns különbség. Ellenben az EUS-GBD-csoportban szignifikánsan rövidebb volt a kórházi tartózkodás, a reintervenciós igény (OR: 0,16) és a nemkívánatos esemény (OR: 0,43) (8). Egy 2023-as, 1136 beteget vizsgáló metaanalízisben az EUS-GBD-t szignifikánsan jobbnak találták a perkután drenázzsal szemben a technikai siker (OR: 0,40), a nemkívánatos esemény (OR: 0,35) és alacsonyabb reintervenciós arányt tekintve (OR: 0,18) (9). Az ESGE ajánlása alapján az EUS-GBD választandó aktuálisan műtétre nem alkalmas beteg cholecystitise esetén a perkután drenázzsal szemben. A behelyezett LAMS legtöbbször definitív megoldás marad, de a beteg állapotában bekövetkező javulás esetén később plasztikstentre cserélhető a kövek eltávolítása után, illetve az operáció is elvégezhető. Az ideális időzítésről nincsenek egyértelmű ajánlások jelenleg. Hosszú távú stent fenntartásakor vérzést, cholecystitist és stentmigrációt is leírtak (10). Az EUS-GBD-t követő cholecystectomiáról kevés irodalmi adat áll még rendelkezésre, de sebészeti szempontból biztonságosnak tűnik a cholecystectomia elvégzése az EUH-drenázs után. A gyomorból kialakított EUS-GBD könnyebb technikai megoldást jelent a műtét során (11).
Egyes tanulmányok a malignus epeúti elzáródások alkalmazása esetén is vizsgálták ezen beavatkozást. 136 beteget vizsgálva a klinikai siker 85% volt, a nemkívánatos események pedig 13%-ban jelentkeztek. Jelenleg ezen indikációban egyéb megközelítést javasolnak a dezikterizáció kivitelezésére (12).
EUH-vezérelt randevútechnika (EUS-RV) és antegrád stentelés (EUS-HGAS)
Sikertelen ERCP után, könnyen elérhető papilla esetén választható opció az EUH-vezérelt randevútechnika. A sikertelen kanülálást ezen esetben egy, a szűkület feletti proximalisabb epeút pungálásával, majd distalis irányban a papillán átvezetett vezetődrót segítségével hidalhatjuk át. Ezután ERCP során fejezzük be az eljárást (pl. EST és kőeltávolítás, szűkületek stentelése stb.). Ez perkután bevezetett vezetődróttal is megoldható, az EUH-vezérelt megoldás választása a lokális ellátóhely tapasztalatától is függ.
Az antegrád stentelési eljárások megváltozott anatómia (pl. Roux-Y, Billroth II) vagy nyombélszűkület miatt nem elérhető papilla esetén jönnek szóba. Ilyenkor a gyomor felől egy bal lebenyi epeszegmensen keresztül juttatjuk a vezetődrótot a duodenumba, majd ezt követő tágítás után fém- vagy plasztikstentet helyezünk a distalis epeutak irányába. 2024-es metaanalízisben az EUS-HGAS 94%-os technikai és 89%-os klinikai sikerről számoltak be antegrád stentelés esetén 295 betegnél (13).
EUS-HGS (EUH-vezérelt hepaticogastrostomia)
Az eljárás során a gyomor felől a máj bal lebenyének S2 (könnyebb manipuláció, de súlyosabb szövődmények) vagy S3 epeútjait (nehezebb manipuláció, de biztonságosabb) (14) drenáljuk speciális öntáguló fémstenttel (SEMS) (2. ábra), vagy ritkábban plasztikstenttel (3. ábra), amelynek a májban levő része fedetlen, míg a máj és a gyomor között fedett. Az eljárás során a kiválasztott epeutat egy 19G-s EUS-tűvel pungáljuk, majd epeaspirációt végzünk, az eperendszer kontrasztos feltöltése során 0,035-es vagy 0,025-es vezetődrótot helyezünk be. Ezután fistulaképzést végzünk (6 Fr cystotom ± ballon), és végül a speciális fémstenttel kialakítjuk a drenázst (15). Az eljárás technikai sikeraránya 96,6–97,7%, míg a klinikai sikeressége 88,1–91,1%, de a nemkívánatos események aránya magasabb (12–17,5%), mint az EUS-CDS-nél tapasztalt 12,2% (16, 17). Ezen sikerességi arány eléréséhez hosszú tanulási görbe vezet (>4 év) (17). Az ESGE ajánlása szerint EUS-HGS csak inoperábilis malignus hilaris epeúti szűkületben javasolt tág bal eperendszer esetén, nagy volumenű centrumokban (18).
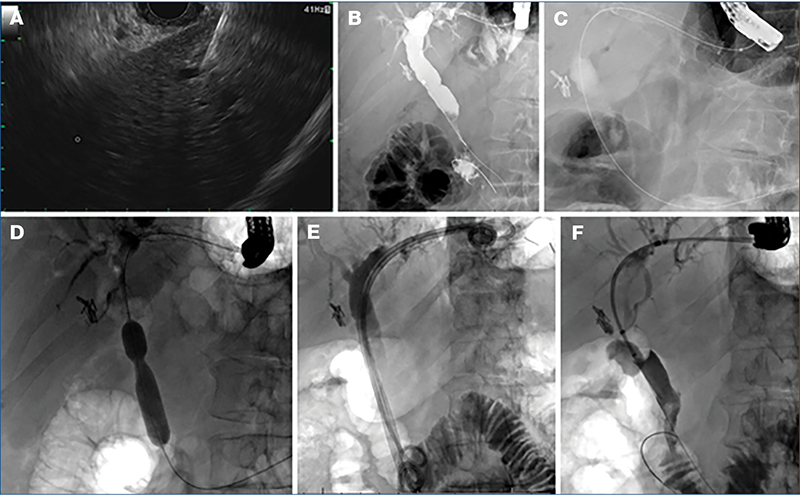
18 cm hosszú, 7 Fr-es double pigtaillel. Roux-Y-műtét után kialakult benignus distalis epeúti elzáródás kezelésére (1)
EUS-CDS (EUH-vezérelt choledochoduodenostomia)
Az eljárás olyan esetekben alkalmazható, amelyeknél a bulbus az eszköz számára biztonságosan elérhető, és az epe elvezetése megoldott a vékonybél distalis irányába (GEA, átjárható duodenum). Ezen eljárás alkalmával a bulbusból „hosszú úton” pungáljuk a közös epevezetéket a lézió felett és a hilus alatt ideálisan 3-4 cm-rel. Itt alkalmazhatunk lumenösszetartó fémstentet (LAMS), illetve vezetődrót mentén 6 Fr-es cystotommal átégetve a nyombél és az epeút falát 6 cm-es fedett SEMS-et (4. ábra). Alkalmazható randevútechnika ezen pozícióból is, de ekkor „rövid úton” a papilla irányába állunk az eszközzel. Az EUS-CDS-t vizsgáló 2024-es metaanalízis (845 beteg) a technikai és klinikai sikerességet 96%-osnak találta. A nemkívánatos események aránya 12% volt. Itt a 8×8 mm-es LAMS jobb volt a nemkívánatos események terén, mint a 6×8 mm-es (19).
Malignus distalis epeúti elzáródás esetén sikertelen ERCP után az ESGE ajánlása az EUS-CDS kivitelezése a PTD-vel szemben (18).
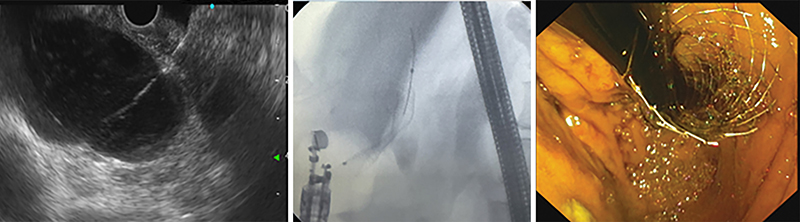
EUH-vezérelt transgastricus ERCP (EDGE)
Tekintve, hogy ezen eljárás során nem direkt az epeutakat drenáljuk, csak érintőleges leírást adunk az eljárás lehetőségéről. Gyomorbypass után első lépésben LAMS segítségével a kirekesztett gyomorrészt szájaztatjuk a megmaradt proximalis gyomorcsonkhoz, majd duodenoszkópra váltva, az eredeti anatómiát követve hajtjuk végre a hagyományos ERCP-t. Alternatívája lehet malignus eltérés esetén az antegrád stentelés (1. ábra).
169 beteget vizsgálva a technikai sikeresség 99% a gastrogastrostomia kialakításnál, és 98% az azt követő ERCP során. Nemkívánatos esemény 18%-ban fordult elő, gravis szövődményként 1 betegnél műtétre volt szükség perforáció miatt (20).
Különböző eljárások összehasonlítása (2. táblázat)
PTD versus EUS-BD
A korábban sikertelen ERCP után alkalmazott PTD-t összevetve az EUS-BD-vel a technikai sikeresség azonos (90,3% vs. 90,8%), míg a klinikai sikerességben az EUS-BD jobbnak bizonyult (73% és 89,1%). Ezen túlmenően a PTD-nél szignifikánsan magasabb nemkívánatos esemény és reintervenciós igény mutatkozott 545 beteget vizsgálva (retro- és prospektív vizsgálatok alapján) (21).
Sharaiha és munkatársai 2017-es metaanalízisében (9 vizsgálat, 483 beteg) az EUS-BD és a PTD között a technikai sikerességet tekintve nem volt különbség (OR: 1,78), de a klinikai sikerességben az EUS-BD jobb volt (OR: 0,45), kevesebb nemkívánatos eseménnyel (OR: 0,23), valamint kisebb reintervenciós igénnyel (OR: 0,13) (22).
Hassan és munkatársai 2022-ben a PTD (151 beteg) vs. EUS-BD (161 beteg) során a reintervenciók számában szignifikáns különbséget találtak (4,9 vs. 1,3). Késői nemkívánatos események során is jelentős különbség volt (53,8% vs. 6,6%), de a korai szövődményekben nem volt különbség (3,3% vs. 3,8%) (23).
ERCP versus EUS-BD
Az ERCP-vel összevetve az EUS-BD-t több publikációban (304 beteg) vizsgálták 2016–2018 között. A technikai sikeresség 95,6% vs. 93,4%, míg a klinikai sikeresség 92,8% vs. 95,7% volt. Szignifikáns különbséget nem találtak ezen a téren a két eljárás között, ellenben a pancreatitis tekintetében lényegi különbség adódott az EUS-BD javára (19,7–35,7% vs. 0%) (21).
Chen és munkatársai egy 2023-as RCT-ben (ELEMENT trial) az EUS-CDS-t és az ERCP-t vizsgálták elsődleges ellátásként distalis rosszindulatú epeúti elzáródásoknál (142 beteg). Az eredményeket tekintve a beavatkozási idő 14 vs. 23,1 perc (p<0,01), a technikai siker 90,4% vs. 83,1%, a stentdiszfunkció 9,6% vs. 9,9%, az onkológiai kimenetelben és az életminőségben nem volt szignifikáns különbség (24).
Egy 2024-es metaanalízisben (519 beteg) a posztprocedurális AP 7,2% az ERCP-csoportban, és 0% EUS-BD során. Az átlagos beavatkozási idő ERCP esetén 21,06 perc, míg EUS esetén 13,43 perc volt. Az átlagos stentfunkció ERCP esetén 187 nap, míg EUS esetén 194,11 nap volt (25).
McCullers metaanalízisében az EUS-BD nem volt ennyivel jobb kimenetelű az ERCP-hez képest. A technikai siker (RR: 1,04) és a szövődmények (RR: 1,39) terén nem találtak szignifikáns különbséget, de a cholangitis (RR: 3,01) és a stentmigráció (RR: 5,06) magasabb arányban szerepelt az EUS-BD-csoportban (26).
Ezek alapján a későbbiekben primer beavatkozásként is felmerülhet az EUS-CDS lehetősége malignus distalis epeúti szűkületek esetén, nagy tapasztalattal bíró centrumokban.
EUS-CDS versus EUS-HGS
Uemura és munkatársai 2018-as metaanalízisében (10 vizsgálat, 434 beteg, 208 EUS-HGS, 226 EUS-CDS) az EUS-CDS és az EUS-HGS tekintetében a technikai siker 94,1% vs. 93,7%, a klinikai siker 88,5% vs. 84,5% volt, a nemkívánatos eseményben nem tapasztaltak különbséget (OR: 0,97) (27).
A későbbiekben 2023-ban Li és munkatársai is hasonló vizsgálatot végeztek (12 vizsgálat, 623 beteg, 320 EUS-HGS, 303 EUS-CDS). Összevetve az EUS-CDS-t az EUS-HGS-sel, a technikai siker 95% vs. 96,6%, a klinikai siker 93,1% vs. 91,3% volt. A nemkívánatos események terén egyebekben szignifikáns különbséget mutattak 12,2% vs. 17,5% (16).
A magasabb szövődményarány miatt az ESGE ajánlása szerint is distalis epeúti szűkületekben az EUS-CDS élvez elsőbbséget az EUS-HGS-sel szemben, ha a duodenum elérhető az endoszkóp számára (18).
Megbeszélés
A fentebb ismertetett eredmények alapján az EUS-BD procedúrák a világon egyre inkább alkalmazott eljárásokká fognak válni a betegek jobb életminősége, a beavatkozás minimálinvazivitása és kis szövődményaránya miatt.
Egy 2020-as metaanalízisben 23 tanulmányt (1437 beteget) vizsgálva a technikai sikeresség 91,5%, a klinikai siker 87%, míg a nemkívánatos események aránya 17,9% (epecsorgás: 4,1%, stentvándorlás és infekció: 3,8%) volt (28).
Egy másik, 2023-as metaanalízis is vizsgálta az EUS-BD-vizsgálatok sikerességi arányát (95%) és a nemkívánatos szövődmények gyakoriságát (13,7%), (n=7887 beteg, 155 tanulmány). A leggyakoribb nemkívánt események ez alapján az epecsorgás (2,2%), a cholecystitis (1%), a stentmigráció (1,7%) és a stentelzáródás (11%) voltak. A súlyos szövődmények aránya 0,6%, míg a beavatkozással összefüggésbe hozható halálozás 0,1% volt. Reintervencióra 16,2%-nál volt szükség (29). A metaanalízisek során is látható, hogy az idővel fejlettebb akcesszorok és a gyakorlat előrehaladtával a vizsgált paraméterek az utóbbi évek során javulást mutattak.
Az EUS-BD gyors elterjedésének a legfőbb akadálya a hosszú tanulási idő és a korábbi alternatívák (PTD, sebészeti megoldás) szélesebb körű elterjedése a kevésbé fejlett régiókban. A kisebb esetszámú centrumokban a kezdeti szövődményarány magasabb lehet a nagyobb betegforgalmú centrumokhoz képest, ami a vállalkozókedv csökkenését vonhatja maga után. Ez a metaanalíziseket részletesebben tanulmányozva is látható (22, 28–32). Az eljárás során tapasztalt lehetséges gyakoribb szövődmények a vérzés, az epecsorgás, a pneumoperitoneum, a stentmigráció, a cholangitis, egyéb infekciók, a hasi fájdalom, a peritonitis és az ezekből adódó esetleges halálozás lehetnek, amelyek még mindig kisebb arányban tapasztalhatók, mint a korábban alkalmazott PTD vagy sebészeti biliodigesztív anastomosisok során (32).
Következtetések
A kezdeti nehézségeket legyőzve az egyre nagyobb számban megjelenő nemzetközi eredmények alapján, ha a lokális szakmai tapasztalat megfelelő, az EUS-BD tekinthető jelenleg a legjobb alternatívának sikertelen ERCP után malignus, illetve egyes benignus epeúti szűkületek esetén.
Rövidítések
- EUS-BD = EUH-vezérelt biliodigesztív anasztomózis
- EUS-HGS = EUH-vezérelt hepaticogastrostomia
- EUS-HDS = EUH-vezérelt hepaticoduodenostomia
- EUS-CDS = EUH-vezérelt choledochoduodenostomia
- EUS-GBD = EUH-vezérelt epehólyagdrenázs
- EUS-RV = EUH-vezérelt randevútechnikák
- EUS-HGAS = EUH-vezérelt hepaticogastrostomián keresztüli antegrád stentelés
- ERCP = endoszkópos retrográd kolangio-pankreatográfia
- EDGE = endoszkópos ultrahangvezérelt transgastricus ERCP (endoscopic ultrasound directed transgastric ERCP)
- PTD = perkután transhepaticus drenázs
- RCT = randomizált kontrollált vizsgálat
- SEMS = öntáguló fémstent (self expandable metal stent)
- LAMS = lumenösszetartó fémstent (lumen apposing metal stent)
- ESGE = European Society of Gastrointestinal Endoscopy
- CI = konfidenciaintervallum
- OR = esélyhányados (odds ratio)
Irodalom
2. Wiersema MJ, et al. Endosonography-guided cholangiopancreatography. Gastrointestinal Endoscopy 1996; 43: 102–106.
https://doi.org/10.1016/s0016-5107(06)80108-2
3. Giovannini M, et al. Endoscopic Ultrasound-Guided Bilioduodenal Anastomosis: A New Technique for Biliary Drainage. Endoscopy 2001; 33(10): 898–900. https://doi.org/10.1055/s-2001-17324
4. Burmester E, et al. EUS-cholangio-drainage of the bile duct: report of 4 cases. Gastrointestinal Endoscopy 2002; 57(2): 246–251. https://doi.org/10.1067/mge.2003.85
5. Fabbri C, et al. Endoscopic ultrasound-guided treatments: Are we getting evidence based – a systematic review. World journal of Gastroenterology 2014; 20(26): 8424–8448. https://doi.org/10.3748/wjg.v20.i26.8424
6. Dietrich CF, et al. Controversies in Endoscopic Ultrasound-Guided Biliary Drainage. Cancers 2024; 1616: 16.
https://doi.org/10.3390/cancers16091616
7. Fusaroli P, et al. EFSUMB Guidelines on Interventional Ultrasound (INVUS), Part V – EUS-Guided Therapeutic Interventions. Ultraschall Med 2016; 37: 412–420. https://doi.org/10.1055/s-0035-1553742
8. Luk SWJ, et al. Endoscopic ultrasound-guided gallbladder drainage versus percutaneous cholecystostomy for high risk surgical patients with acute cholecystitis: a systematic review and meta-analysis. Endoscopy 2019; 51: 722–732. https://doi.org/10.1055/a-0929-6603
9. Boregowda U, et al. Endoscopic Ultrasound-Guided Gallbladder Drainage versus Percutaneous Gallbladder Drainage for Acute Cholecystitis: A Systematic Review and Meta-Analysis. Diagnostics (Basel) 2023; 13(4): 657. https://doi.org/10.3390/diagnostics13040657
10. Merwe SW, et al. Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2022; 54(02): 185–205. https://doi.org/10.1055/a-1717-1391
11. Saumoy M, et al. Long-term outcomes after EUS-guided gallbladder drainage. Endoscopic Ultrasound 2018; 7(2): 97–101. https://doi.org/10.4103/eus.eus_9_18
12. McDonagh P, et al. Endoscopic Ultrasound-Guided Gallbladder Drainage for Malignant Biliary Obstruction: A Systematic Review. Cancers 2023; 15(11): 2988. https://doi.org/10.3390/cancers15112988
13. Paraskevopoulos P, et al. Hepaticogastrostomy versus hepaticogastrostomy with antegrade stenting for malignant biliary obstruction: a systematic review and meta-analysis. Therap Adv Gastroenterol 2024; 17: 17562848241273085. https://doi.org/10.1177/17562848241273085
14. Ogura T, et al. Endoscopic Ultrasound-Guided Hepaticogastrostomy: Technical Review and Tips to Prevent Adverse Events. Gut and Liver 2021; 15(2): 196–205. https://doi.org/10.5009/gnl20096
15. Ogura T, et al. Endoscopic Ultrasound-Guided Hepaticogastrostomy: Technical Review and Tips to Prevent Adverse Events. Gut and Liver 2020; 15(2): 196–205. https://doi.org/10.5009/gnl20096
16. Li J, et al. Comparison of Choledochoduodenostomy and Hepaticogastrostomy for EUS-Guided Biliary Drainage: A Meta-Analysis. Front Surg 2022; 9: 811005. https://doi.org/10.3389/fsurg.2022.811005
17. Binda C, et al. Efficacy and safety of endoscopic ultrasound-guided hepaticogastrostomy: a meta-regression analysis. Endoscopy 2024; 56(09): 694–705. https://doi.org/10.1055/a-2282-3350
18. Merwe, S.W., Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy, 2022; 54(2): 185-205. https://doi.org/10.1055/a-1717-1391
19. Fugazza A, et al. Outcomes predictors in endoscopic ultrasoundguided choledochoduodenostomy with lumen-apposing metal stent: Systematic review and meta-analysis. Endosc Int Open 2024. Mar; 12(03): 456-462.
https://doi.org/10.1055/a-2271-2145
20. Prakash S, et al. Endoscopic ultrasound-directed transgastric ERCP (EDGE): a systematic review describing the outcomes, adverse events, and knowledge gaps. Endoscopy 2022. Jan; 54(01): 52–61. https://doi.org/10.1055/a-1376-2394
21. Hindryckx P, et al. Endoscopic ultrasound-guided drainage of the biliary system: Techniques, indications and future perspectives. World Journal of Gastrointestinal Endoscopy 2019; 11(2): 103–114. https://doi.org/10.4253/wjge.v11.i2.103
22. Sharaiha RZ, et al. Efficacy and safety of EUS-guided biliary drainage in comparison with percutaneous biliary drainage when ERCP fails: a systematic review and meta-analysis. Gastrointestinal Endoscopy 2017. May; 85(5): 904–914. https://doi.org/10.1016/j.gie.2016.12.023
23. Hassan Z, et al. Percutaneous transhepatic cholangiography vs endoscopic ultrasound-guided biliary drainage: A systematic review. World J Gastroenterol 2022. Jul; 28(27): 3514–3523. https://doi.org/10.3748/wjg.v28.i27.3514
24. Chen YI, et al. Endoscopic Ultrasound-Guided Biliary Drainage of First Intent With a Lumen-Apposing Metal Stent vs Endoscopic Retrograde Cholangiopancreatography in Malignant Distal Biliary Obstruction: A Multicenter Randomized Controlled Study (ELEMENT Trial). Gastroenterology 2023; 165: 1249–1261. https://doi.org/10.1053/j.gastro.2023.07.024
25. Gopakumar H, et al. Endoscopic Ultrasound-Guided vs. Endoscopic Retrograde Cholangiopancreatography-Guided Biliary Drainage as Primary Approach to Malignant Distal Biliary Obstruction: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Gastroenterol 2024. Aug; 119(8): 1607–1615. https://doi.org/10.14309/ajg.0000000000002736
26. McCullers MR, et al. Comparison between transpapillary versus transmural endoscopic ultrasound-guided decompression for biliary obstruction: a meta-analysis. HPB (Oxford) 2023. Aug; 25(8): 855–862. https://doi.org/10.1016/j.hpb.2023.03.005
27. Uemura RS, et al. EUS-guided Choledochoduodenostomy Versus Hepaticogastrostomy: A Systematic Review and Meta-analysis. J Clin Gastroenterol 2018; 52(2): 123–130. https://doi.org/10.1097/mcg.0000000000000948
28. Dhindsa BS, et al. EUS-guided biliary drainage: A systematic review and meta-analysis. Endoscopic Ultrasound 2020; 9(2): 101–109. https://doi.org/10.4103/eus.eus_80_19
29. Giri S, et al. Adverse events with EUS-guided biliary drainage: a systematic review and meta-analysis. Gastrointestinal Endoscopy 2023; 98: 515–523. https://doi.org/10.1016/j.gie.2023.06.055
30. Khan MA, et al. Endoscopic Ultrasound-Guided Biliary Drainage: A Systematic Review and Meta-Analysis. Dig Dis Sci 2016. Mar; 61: 684–703. https://doi.org/10.1007/s10620-015-3933-0
31. Moole H, et al. A meta-analysis and systematic review: Success of endoscopic ultrasound guided biliary stenting in patients with inoperable malignant biliary strictures and a failed ERCP. Medicine (Baltimore) 2017. Jan; 96(3): 5154. https://doi.org/10.1097/md.0000000000005154
32. Wang K, et al. Assessment of efficacy and safety of EUS-guided biliary drainage: a systematic review. Gastrointest Endosc 2016; 83(6): 1218–1227. https://doi.org/10.1016/j.gie.2015.10.033
33. Teoh AYB, et al. Endosonography-guided gallbladder drainage versus percutaneous cholecystostomy in very high-risk surgical patients with acute cholecystitis: an international randomised multicentre controlled superiority trial (DRAC 1). Gut 2020. June; 69: 1085–1091. https://doi.org/10.1136/gutjnl-2019-319996
34. Wanrooij RL, et al. Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Technical Review. Endoscopy 2022; 54: 310–332. https://doi.org/10.1055/a-1738-6780
