Reviews
Treatment options of gastroenteropancreatic neuroendocrine neoplasm
Summary
Thanks to sophisticated modern diagnostic tools and a comprehensive pathologic diagnostic arsenal, the number of the diagnosed gastroenteropancreatic neuroendocrine neoplasms (GEP-NENs) has been steadily increasing. In recent years, more detailed therapeutic algorithms have been developed, and additional clinical trial data have become available. The aim of our review is to summarize the current therapeutic options based on the available guidelines.
Összefoglaló
Az otthoni parenterális táplálás (OPT) kulcsfontosságú terápiás lehetőséget jelent a bélelégtelenségben szenvedő betegek számára, azonban malignus alapbetegség esetén hatékonysága kevésbé ismert. Vizsgálatunkban 17, malignus eredetű krónikus bélelégtelenségben szenvedő beteg adatait elemeztük. Az OPT során a testtömeg, a testtömegindex (BMI) és az izomtömeg lényegében stabil maradt, míg a medián túlélés 9 hónap volt. Szövődmények összesen négy alkalommal fordultak elő. Eredményeink alátámasztják, hogy az OPT biztonságos és hatékony módszer a tápláltsági állapot fenntartására, valamint a túlélés meghosszabbítására.
Bevezetés
A diffúz neuroendokrin sejtrendszerből eredő térfoglaló folyamatokat neuroendokrin neoplasiának (NEN) nevezzük. Ez egy gyűjtőnév, amely magában foglalja a jól differenciált (G1: Ki-67-index ≤2%, G2: Ki-67-index 3–20% között, G3: Ki-67-index >20%) neuroendokrin tumorokat (NET) és a rosszul differenciált (nagysejtes vagy kissejtes, magas proliferációjú, Ki-67-index: 50–90%) neuroendokrin karcinómákat (NEC). Fontos megjegyezni, hogy a G3-as NET jól differenciált, és a G1–G2-es daganatoknál gyorsabban proliferál, azonban szükséges elkülöníteni a neuroendokrin karcinómától. A NEN-ek jellegzetessége, hogy képesek biogén aminokat és hormonokat termelni, és ezáltal jellegzetes tüneteket okoznak. Jelen közleményünk fókuszában a gastroenteropancreaticus neuroendokrin neoplasiák (GEP-NEN-ek) állnak.
A SEER-adatbázis alapján közölt, folyamatosan emelkedő esetszámok (1), az újonnan megjelenő terápiás stratégiák és a frissített irányelvek indokolják, hogy új áttekintést nyújtsunk a hazai szakemberek számára. Áttekintő közleményünkben az előző, magyar nyelven megjelenő összefoglaló tanulmányokra is építettünk (2–7). A GEP-NEN-ek ellátásában kiemelten fontos a multidiszciplináris együttműködés, amely magában foglalja a gasztroenterológus, az endokrinológus, a sebész, az onkológus és a nukleáris medicinával foglalkozó szakemberek munkáját.
A neuroendokrin daganatok kezelési lehetőségei és a terápiás döntést befolyásoló tényezők
Jelenleg a neuroendokrin daganatok terápiája három alappilléren nyugszik. Az elsőt a lokális módszerek (köztük a sebészi és a definitív ablatív kezelések) jelentik.
A második pillér az endoradioterápia/PRRT (peptidreceptor-radionuklidterápia). A harmadik fő pillért a szisztémás kezelések képezik. A kezelési lehetőségeket a rendelkezésre álló klinikai vizsgálati eredményekkel együtt egy ábrában foglaltuk össze (1. ábra).
A választandó kezelést a NEN típusa, a kiindulási helye (hasnyálmirigy, gasztrointesztinális, egyéb NET/NEC), a reszekálhatósága, a beteg teljesítménystátusza (Eastern Cooperative Oncology Group [ECOG], Karnofsky-index) és kísérőbetegségei, a daganat TNM-státusza és grádusa, a NEN funkcionáló vagy nem funkcionáló jellege, a különböző terápiás modalitások elérhetősége és a beteg preferenciája határozza meg.
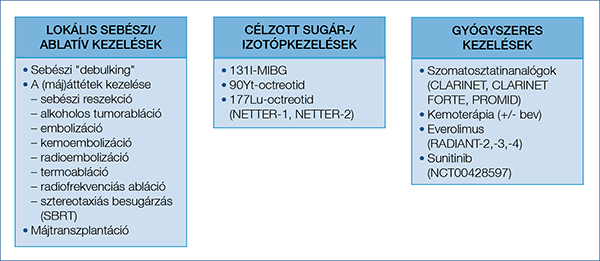
A hasnyálmirigy neuroendokrin tumorai
A hasnyálmirigy nem funkcionáló neuroendokrin tumorai (NF-pan-NET-ek)
Tünetmentes, 1 cm-es vagy az alatti átmérőjű NF-pan-NET esetén, illetve akkor, ha a Wirsung-vezeték tágulata nem áll fenn, a betegek aktív követése javasolható. Amennyiben az NF-pan-NET átmérője meghaladja az 1 cm-et, de maximum 2 cm-es, és nem áll fenn a Wirsung-vezeték tágulata, a műtét típusát egyedileg szükséges elbírálni a beteg állapota és társbetegségei alapján. Amennyiben az NF-pan-NET átmérője meghaladja a 2 cm-t, és/vagy a Wirsung-vezeték tágult, a műtét erősen ajánlott. Amennyiben a műtét szükséges és kivitelezhető, akkor a minimálisan invazív műtéti technikát kell előnyben részesíteni (8).
A szomatosztatinreceptor- (SSTR-) pozitív, előrehaladott G1–G2-es, aszimptomatikus, lassan növekvő tumorok esetén az ajánlott algoritmus a következő: első vonalban szomatosztatinanalóg (SSA) (ha a Ki-67-index <10%) (9); másodvonalban sunitinib (10), everolimus (11, 12), vagy PRRT (13) és a cytoreductio céljából végzett lokálisan ablatív eljárások; harmadvonalban alkiláló bázisú kemoterápia (pl. kapecitabin-temozolomid, CAPTEM). Az SSTR-pozitív szimptomatikus és/vagy gyorsan növekvő tumorok esetén első vonalban kiváló hatás várható az alkiláló bázisú (pl. CAPTEM) kemoterápiától (14), másodvonalban pedig sunitinib, everolimus, vagy PRRT és a cytoreductio céljából végzett lokális ablatív eljárások javasolhatók. Az SSTR-negatív, aszimptomatikus, lassan növekvő tumoroknál az irányelvek alapján everolimus vagy sunitinib lehet az elsővonalbeli kezelés; ezek a készítmények egyedi méltányossági kérelemmel (EMK) igényelhetők. Az SSTR-negatív és/vagy a gyorsan növekvő (G3) tumorok esetén fordított algoritmust alkalmazunk: első vonalban alkiláló bázisú kemoterápiával (CAPTEM) indítunk, másodvonalban pedig everolimust vagy sunitinibet alkalmazhatunk (15).
A III. fázisú CABINET (NCT03375320) a cabozantinib hatékonyságát vizsgálta áttétes vagy lokálisan előrehaladott, legalább egy vonalon túl progrediáló NET-es betegek körében. Extrapancreaticus NET esetén napi 60 mg cabozantinib hatására a medián PFS 8,4 hónapra nőtt a placebo-csoportban tapaszalt 3,9 hónappal szemben (HR 0,38; p<0,001). Pancreaticus NET esetén a medián PFS 13,8 hónapról 4,4 hónapra javult (HR 0,23; p<0,001). Ezen vizsgálat alapján az Amerikai Gyógyszerügyi Hatóság (FDA) 2025 márciusában engedélyezte a cabozantinib alkalmazását a progressziót mutató, jól differenciált pan-NET és az extrapancreaticus NET-es betegek körében; ez a kezelés potenciálisan meghosszabbíthatja a betegek várható élettartamát (16).
A hasnyálmirigy funkcionáló neuroendokrin tumorai (pan-NET-ek)
Funkcionáló pan-NET esetén a tumor méretétől függetlenül minden esetben kötelező a műtét. 2 cm feletti tumor esetén a standard ellátás a duodenopancreatectomia, vagy a distalis pancreatectomia regionális lymphadenectomiával, válogatott esetekben alternatív metódusként enucleatióval. 2 cm-es vagy annál kisebb funkcionáló pan-NET esetén enucleatio javasolt. A lokális insulinomák esetén a parenchymát kímélő hasnyálmirigy-reszekció, enucleatio és centrális hasnyálmirigy-reszekció a standard ellátás. Ha technikailag kivitelezhető, akkor minden esetben a minimálisan invazív sebészeti beavatkozást részesítjük előnyben. A terápiás lehetőségek közé újdonságként kerültek be az invazív radiológiai eljárások. Kis méretű (≤2 cm) és lokális insulinomával rendelkező, műtétre alkalmatlan betegeknél az endoszkópos ultrahanggal végzett radiofrekvenciás abláció (EUS-RFA) is javasolható terápiás lehetőség (17).
A lokális sporadikus gastrinomák sebészi ellátása a primer reszekció, szisztémás lymphadenectomiával. A duodenumban elhelyezkedő, MEN-1-asszociált vagy sporadikus gastrinoma által okozott Zollinger–Ellison-szindróma (ZES) műtéti ellátásának tartalmaznia kell a duodenotomiát, vagy a duodenumreszekciót szisztémás lymphadenectomiával a hypergastrinaemia ellátása, illetve az áttétes betegség rizikójának csökkentése céljából. A MEN-1-szindrómához társuló ZES sebészi ellátásakor a magasabb gyógyulási esély miatt javasolt a pancreaticoduodenectomiát a beteggel egyeztetni (az előny/kockázat mérlegelését figyelembe véve).
Minden előrehaladott, funkcionáló pan-NET kezelése multimodális gondolkodásmódot igényel a szupportív, a sebészi, az intervenciós, a szekréciógátló és az antiproliferatív terápiák felhasználásával. A tumortömeg csökkentését célzó terápiák szignifikánsan csökkentik a betegek hormonális tüneteit. Cytoreductióban akkor érdemes gondolkodni, amikor a látható, funkcionáló daganat 70–90%-a eltávolítható. Alternatívaként szolgál a lokoregionális terápia: radiofrekvenciás abláció (RFA), transarterialis, hatóanyag nélküli embolizáció (TABE [TAE]), transarterialis kemoembolizáció (TACE), transarterialis radioembolizáció (TARE). Adott pan-NET-hez dedikált, első vonalbeli szupportív terápia mellett azonnal javasolt a palliatív SSA indítása. A PRRT, a kemoterápia, az everolimus vagy a sunitinib általánosságban véve az SSA-refrakter esetekben javasolt. PRRT és TKI után további lehetőségként cabozantinib javasolt (16).
A pan-NET-ek hormonális tüneteinek és daganatellenes kezelésének algoritmusai előrehaladott betegségben (18)
Fontos kiemelni, hogy a funkcionáló tumorral rendelkező, szindrómás betegek ellátása multimodális megközelítést igényel. Az elsővonalbeli kezelést minden, tüneteket mutató és előrehaladott stádiumú betegnél el kell kezdeni; akár monoterápiában, akár kombinált kezelés formájában. Refrakter tünetek esetén további terápiás lehetőségeket kell mérlegelni a klinikai előny eléréséig, figyelembe véve a daganat növekedési ütemét és a daganat tömegét; különös tekintettel az antiproliferatív kontroll vagy a cytoreductio szükségességére.
- Gastrinoma: első vonalban emelt dózisú PPI; másodvonalban SSA; harmadvonalban PRRT; negyedvonalban kemoterápia, sunitinib, everolimus, cytoreductio: lokoregionális ellátás, sebészet
- Insulinoma: első vonalban diéta, diazoxid; másodvonalban SSA; harmadvonalban PRRT, everolimus; negyedvonalban sunitinib, kemoterápia
- VIPoma: első vonalban hidrálás, SSA, szteroid; másodvonalban PRRT; harmadvonalban kemoterápia, everolimus, sunitinib
- Glukagonoma: első vonalban táplálkozási szupportáció, SSA; másodvonalban PRRT; harmadvonalban kemoterápia, sunitinib
- Parathormonoma: első vonalban hidrálás, denoszumab, zoledronsav; másodvonalban kalcitonin, kacsdiuretikum, SSA; harmadvonalban PRRT; negyedvonalban kemoterápia, everolimus, sunitinib
- GHRHoma: első vonalban SSA; másodvonalban pegvisomant
- ACTHoma: első vonalban szteroidogén enzim gátló; másodvonalban SSA, dopaminantagonista; harmadvonalban kétoldali adrenalectomia
A gastroduodenalis, azaz gyomor-bél rendszer eredetű neuroendokrin tumorok (G1–G3)
Endoszkópos reszekció javasolt 1 cm feletti, 1-es típusú, a gyomorban található NET (gNET) esetén. A submucosa endoszkópos reszekciója (ESD) és a teljes falvastagságban végzett endoszkópos reszekció (EFTR) hatékonyabb az „R0” reszekció szempontjából, mint az endoszkópos nyálkahártya-reszekció (EMR). Az 1 cm feletti gNET-ek inkomplett reszekciójakor (R1) a következő lépcsőzetes megközelítés javasolt: EMR > ESD > EFTR > műtét. Amennyiben a tumor reszekciója javallott, de sem endoszkóposan, sem pedig műtéti úton nem kivitelezhető, akkor az SSA-kezelés indokolt lehet. Sebészi reszekció ajánlott 20 mm feletti tumor esetén, valamint akkor, ha felmerül a muscularis propria inváziójának gyanúja. Szintén sebészi eltávolítás javasolt a biopsziás mintában magas rizikójú jellegeket (magas Ki-67-index, lymphovascularis invázió) mutató esetekben. A preferált műtéttechnikai stratégia a limitált reszekció, helyi nyirokcsomó-mintavétellel kiegészítve. Nyirokcsomó-metasztázis esetén a javasolt eljárás a gastrectomia, D2-lymphadenectomiával. A 2-es típusú gNET nagyon ritka entitás, ezért külön nem részletezzük.
Az endoszkópos reszekció megfontolható a 3-as típusú, lokális, G1-es, 10 mm-es vagy az alatti gNET-ek esetén, valamint a 15 mm alatti gNET-eknél akkor, ha a Ki-67-index <10% és a sebészi reszekció rizikója magas. Az ékreszekció (regionális nyirokcsomó-biopsziával) mérlegelhető lokális ellátáskor, G1–G2-es gNET-ek esetén lymphadenopathia nélkül. Radikális sebészi reszekció (lymphadenectomiával) ajánlott a preoperatív staging során igazolt nyirokcsomóáttét esetén, illetve a nyirokcsomóáttét gyanúja esetén akkor, ha a Ki-67-index >20%, vagy ha a tumor átmérője meghaladja a 20 mm-t.
A pars superior duodeni területén levő, nagyon kis méretű, nem funkcionáló duodenalis NET (dNET) eltávolítása EMR-el történhet. Az 5–10 mm-es (néhány centrumban 15 mm-es) léziókat endoszkópos technikával távolítják el. Sebészi eltávolítás javasolt a 10–15 mm-es nagyságot meghaladó tumorok esetén, a submucosán túl terjedő, G2–G3 tumorok esetén és/vagy lymphovascularis invázó jelenlétekor.
Irreszekábilis vagy áttétes, G1–G2-es, alacsony Ki-67-indexű (<10%) és szomatosztatinreceptor-pozitív esetekben SSA-terápia indikált. Lassan növekvő és lassú progressziót mutató tumorok esetén magasabb Ki-67-index mellett is alkalmazható az SSA. A PRRT a szomatosztatinreceptor-státusztól függően reális lehetőségként szolgál. Az everolimus ebben az indikációban EMA törzskönyvvel rendelkező terápiás lehetőség. A G3-as gastroduodenalis NET-ek esetén kemoterápia javasolt (19). A CABINET-vizsgálat eredménye alapján a cabozantinib új lehetőségként ebben az indikációban is javasolható (16).
A vékonybél neuroendokrin tumorai (si-NET)
Minden lokális, reszekábilis si-NET műtéti ellátását szervmegtartó technikával, magas esetszámú centrumban javasolt végezni. A lokális si-NET makroszkópos radikális reszekciója csökkenti a bélelzáródás és az iszkémia kialakulásának esélyét. A radikális reszekciót a mesenterialis nyirokcsomók szisztémás eltávolításával együtt javasolt elvégezni. A műtéti aranystandard a nyitott technikával, a teljes vékonybél bimanuális tapintásával, valamint érkímélő nyirokcsomó-eltávolítással (legalább >8 nyirokcsomó) végzett operáció, azzal a céllal, hogy az eltávolított vékonybélszakasz hosszát limitáljuk (20). Adjuváns kezelés a kuratív reszekciót követően nem javasolt. Általánosságban a lokálisan előrehaladott si-NET eltávolítása is javasolt az akut/krónikus bélelzáródás, vagy a lokális/diffúz intestinalis iszkémia elkerülése érdekében. Mesenterialis fibrózis (MF) esetén a sebészi reszekció onkológiai előnye kérdéses, ezért minden esetben egyedi elbírálás szükséges.
Irreszekábilis/metasztatikus G1, vagy G2 (Ki-67-index <10%), SSTR-pozitív, vagy lassú növekedésű si-NET esetén hosszú hatású SSA (lanreotid vagy octreotid) az első vonalbeli kezelés a CLARINET (9) és PROMID (21) randomizált-kontrollált vizsgálatok alapján. Szelektált G1-es, tünetmentes, kis tumorterheléssel vagy stabil si-NET-el rendelkező betegeknél a „watch and wait” stratégia is választható opció. Előrehaladott, szomatosztatinreceptor-negatív esetben a lokoregionális ellátás az elsődleges; ha ez nem kivitelezhető, akkor everolimus (vagy esetleg INF-alfa) alkalmazható az első vonalban. Szelektált, előrehaladott esetben (G2, Ki-67-index >10%) első vonalban everolimus és PRRT-opciók állnak rendelkezésre. A kemoterápiának kis szerepe van ebben a betegcsoportban, leginkább a G3-as és/vagy rapid tumorprogressziót mutató esetekben, illetve a korábbi kezelések utáni progresszió esetén jön szóba.
A javasolt másodvonalbeli kezelés szomatosztatinreceptor-pozitív esetben a PRRT, majd az everolimus (22). PRRT-rechallenge (23) és magas dózisú SSA (24) szelektált esetekben javasolható. A tirozin-kináz-gátlóknak (TKI) az elfogadott másodvonalbeli kezelések kudarca után van létjogosultsága SSTR-negatív esetekben, illetve későbbi vonalban SSTR-pozitív esetekben is.
A cabozantinib új TKI-terápiaként si-NET esetén is szóba jön (16).
Kemoterápia G2-es NET (Ki-67-index 15%–20% között) vagy rapid progressziójú G3-as NET kezelésekor javasolt.
Csak májáttétel rendelkező, negyedik stádiumú, G1/G2-es si-NET esetén, ha az „R0” reszekció kivitelezhető, akkor sebészeti műtét indikált. Májdomináns irreszekábilis esetben lokoregionális invazív radiológiai módszerek javasolhatók a tumornövekedés, a carcinoid szindróma és az oligometasztatikus progresszió gátlása céljából (25–27). Csak peritonealis carcinomatosis fennállásakor peritonealis műtét javasolt (cytoreductio céljából) (28). Tünetmentes betegekben, alapvetően irreszekábilis, negyedik stádiumú betegségben a primer tumor reszekcióját alaposan meg kell fontolni a haszon-kockázat mérlegelésével.
Carcinoid szindróma (CS) esetén multidiszciplináris gondolkodásmód szükséges. Refrakter CS és predomináns hasmenés észlelésekor javasolható az SSA kiegészítése teloristat-ethyl készítménnyel (29, 30). SSA-dóziseszkaláció és IFN-alfa együttes alkalmazása SSA-val javasolható refrakter CS esetén. Refrakter CS esetén gondolni kell a korai lokoregionális ablatív ellátásra és a „debulking” jellegű műtétre is. Progresszív, áttétes betegség és CS együttes fennállásakor a PRRT is választható terápia. Az egyéb terápiás lehetőségek kimerülésekor szignifikáns tumornövekedés esetén az everolimus kombinálható az SSA-val (31).
Az appendix neuroendokrin tumorai (aNET-ek)
10 mm vagy az alatti aNET esetén appendectomia javasolt. Komplettáló, jobb oldali hemicolectomia 2 cm feletti tumorméret és inkomplett appendectomia (R1/R2) esetén javasolt. Általánosságban azt mondhatjuk, hogy kompletten eltávolított, 2 cm-es (vagy annál kisebb) tumor esetén a komplettáló, jobb oldali hemicolectomia nem szükséges. 1–2 cm-es, reszekált aNET esetében a magas grádusú aNET, illetve a beteg egyéni preferenciája indikálhatja a komplettáló, jobb oldali hemicolectomia elvégzést. A serosa perforációjának fennállásakor kevés evidencia áll rendelkezésünkre a komplettáló, jobb oldali hemicolectomia terápiás előnyével kapcsolatban. Komplettáló műtétnek a jobb oldali hemicolectomiát tekintjük, azonban fiatal vagy gyermekkorú betegeknél az ileocoecalis reszekció is alkalmazható (32). Mindkét metódusnak alacsony a morbiditása és az életminőségre gyakorolt hatása. Jelenleg a műtét után adjuváns kezelés nem javasolt, mivel az aNET esetek jelentős része alacsony grádusú tumor.
A féregnyúlvány metasztatikus NET-jének ellátása nem különbözik az egyéb GEP-NET-ek ellátásától, viszont általában az ileum NET-jével társulva fordul elő (33).
A kolorektális NET-ek
A vastagbél neuroendokrin tumorjainak standard sebészi ellátása (az adenocarcinomák ellátásával megegyezően) a sebészi reszekció és a regionális lymphadenectomia. Szelektált, korai, G1-es, 10 mm alatti vastagbél-neoplasiáknál megfontolható az endoszkópos reszekció.
A végbél neuroendokrin tumorjainak műtéti ellátásakor lényegesen szélesebb endoszkópos, illetve sebészi repertoár áll rendelkezésünkre. A 10 mm-es vagy kisebb NET-ek esetében endoszkópos eltávolítás (EMR, ESD, EFTR) javasolt (34–36). A 20 mm-es vagy annál nagyobb lézióknál sebészi reszekció javasolt mély anterior reszekcióval vagy abdominoperinealis reszekcióval.
A 10–20 mm-es lézióknál multidiszciplináris team egyedi elbírálása után endoszkópos vagy sebészi eltávolítás is javasolható.
Irreszekábilis, metasztatikus, G1–G2, SSTR-pozitív tünetmentes, alacsony grádusú, alacsony tumorterhelésű, lassan növekvő, 10% alatti Ki-67-indexű esetben első vonalbeli kezelésként SSA, másodvonalban everolimus, PRRT és májdomináns esetben lokoregionális ellátás, harmadvonalban pedig TKI javasolt (37).
Irreszekábilis, metasztatikus, G1–G2, SSTR-pozitív tünetes, magas grádusú, magas tumorterhelésű, gyorsan növekvő, 10% feletti Ki-67-indexű esetben első vonalbeli kezelésként everolimus, kemoterápia vagy PRRT alkalmazható, másodvonalban pedig TKI, májdomináns esetben lokoregionális ellátás jön szóba (37).
Irreszekábilis, metasztatikus, G1–G2, SSTR-negatív esetben első vonalbeli kezelésként everolimus, másodvonalban májdomináns esetben lokoregionális ellátás, egyéb esetekben kemoterápia és TKI javasolt (37).
Irreszekábilis, metasztatikus, G3, SSTR-pozitív esetben első vonalbeli kezelésként a CAPTEM-kombináció javasolt, majd az algoritmus tünetmentes, alacsony tumorterhelésű és tünetes, magas tumorterhelésű csoportra oszlik. Tünetmentes esetben másodvonalban everolimus, TKI és PRRT alkalmazható. Tünetes csoportban másodvonalban oxaliplatinbázisú kemoterápia, harmadvonalban pedig PRRT javasolható (37).
Irreszekábilis, metasztatikus, G3, SSTR-negatív esetben első vonalbeli kezelésként a CAPTEM-kombináció javasolt, másodvonalban az oxaliplatin bázisú kemoterápia vagy az everolimus, harmadvonalban pedig a PRRT. (37) A kolorektális NET ellátása hasonló a si-NET kezeléséhez, de összességében nagyobb szerepet kap a kemoterápia.
Az emésztőrendszeri neuroendokrin karcinómák (NEC-ek)
Fitt betegek lokális és reszekábilis emésztőrendszeri neuroendokrin karcinómája esetén a sebészi eltávolítás ajánlott, ha az „R0” reszekció kivitelezhető (38). A sebészi beavatkozás eldöntése előtt 18F-FDG PET/CT elvégzése szükséges, mivel ezekben az esetekben jelentősen lecsökken a szomatosztatinreceptor kimutathatósága és növekszik a proliferáció. A nyelőcső és a végbél lokális neuroendokrin karcinómái esetén neoadjuváns kemoirradiáció javasolt, hasonlóan a nem neuroendokrin tumorok kezeléséhez (39). A rektális NEC-ek ellátásakor az evidenciák alapján a kemoirradiáció előnye nem egyértelmű (40). A lokális emésztőrendszeri NEC-ek radikális műtéti eltávolítása után 4–6 ciklus platina/etoposid adjuváns kemoterápia javasolható.
Az első vonalbeli kezelési standard NEC esetén a carboplatin/etoposid kombináció, azonban első vonalban az irinotecan/cisplatin is alternatív terápiás lehetőség (41, 42). Más rezsimek is javasolhatók a beteg általános állapotának, a primer tumor lokalizációjának és a Ki-67-indexének megfelelően. Az SSA nem része a NEC antiproliferatív ellátásának. Az első vonalbeli platinabázisú kezelés kudarca után nincs egyértelmű ajánlás. A javasolt terápiás lehetőségek a FOLFOX (5FU-leucovorin-oxaliplatin), a FOLFIRI (5FU-leucovorin-irinotecan), illetve a CAPTEM. A legerősebb evidencia az irinotecan készítményen alapuló kezelés mellett van. Áttétes betegségben általánosságban a primer folyamat műtéti eltávolítása vagy PRRT nem javasolt.
Tumoragnosztikus terápiás lehetőségek is rendelkezésünkre állnak. MSI és/vagy magas TMB esetén az első vonalbeli kemoterápia progresszióját követően kettős immunellenőrzőpont-gátló (ICI) megfontolható. Sajnos a megfelelő terápiás válasz még kétséges, mivel a NEC-ek jelentős része nem reagál az ICI-ra, és az e készítménnyel kapcsolatban rendelkezésre álló klinikai vizsgálati adatok is elégtelenek. A BRAF gén V600E jelű mutációja esetén szóba jöhet a BRAF-MEK-gátló kombináció. Mivel egyéb tumoragnosztikus markerek is rendelkezésünkre állnak, így korai molekuláris profilozás javasolható (43).
Összefoglalás
Közleményünkben a GEP-NEN-ek lokális és szisztémás ellátásának alappilléreit és ajánlásait foglaltuk össze. Az ESMO és az ENETS hatályos irányelvei alapján összefoglaló ábrát készítettünk a GEP-NEN-ek szisztémás kezelési algoritmusairól (2. ábra).
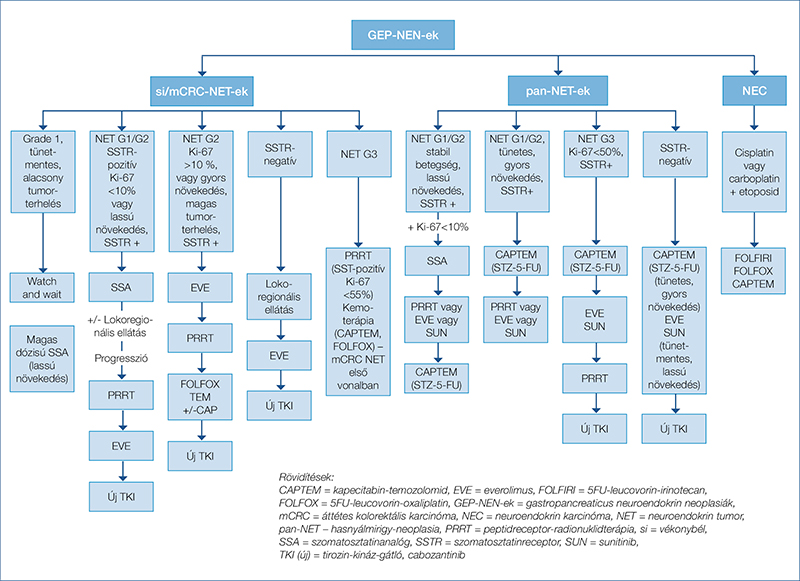
Továbbra is kiemelendő, hogy betegeink számára a leginkább kuratív ellátás csak sebészi beavatkozással biztosítható. Azonban a szisztémás kezelési lehetőségek bővülésének, a célzott izotópkezelések könnyebb elérhetőségének, valamint az áttétes betegség esetén alkalmazott ablatív eljárások megfelelő időzítésének köszönhetően a betegségperspektíva és a betegek életminősége javuló tendenciát mutat. A molekuláris célzott kezelések és az immunterápia még nem hoztak jelentős áttörést ebben a daganattípusban, de megfelelő indikációban alkalmazva kiegészítik az ellátási algoritmust. A PRRT egyre ígéretesebb terápiás lehetőségnek tekinthető (másodvonalban a NETTER-1-, első vonalban a NETTER-2-vizsgálat alapján). A tervezett NETTER-3 a PRRT effektivitását a G1–2-es GEP-NET-ek első vonalbeli terápiájában fogja vizsgálni. A tendenciákat figyelembe véve a PRRT technikai metodikája finomodni fog, és a terápiás algoritmusban várhatóan előbbre fog kerülni. Új lehetőségként jelenik meg a kezelési szekvenciában a cabozantinib, amely tovább javítja a betegek túlélését. A NEN ellátásában is egyre fontosabbá válik az a személet, hogy e betegek lehetőség szerint minél több terápiás lehetőséget megkapjanak szekvenciálisan, és ezáltal életkilátásaik is jelentősen javulhatnak.
Irodalom
1. Dasari A, Shen C, Halperin D, et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol 2017; 3(10): 1335–1342.
https://doi.org/10.1001/jamaoncol.2017.0589
2. Petrányi Á, Bodoky Gy. Neuroendokrin daganatok gyógyszeres kezelése. Orv Hetil 2011; 152(10): 379–391.
3. Uhlyarik A, Pápai Zs. A neuroendokrin daganatok kórisméje és kezelésének irányelvei. Orv Hetil 2013; 154(39): 1549–1555.
4. Tóth M. A neuroendokrin tumorok gyógyszeres kezelése. Orv Hetil 2013; 154(39): 1556–1564.
5. Tóth M. A neuroendokrin daganatok kezelésének lehetőségei. LAM 2013; 23(10–11): 503–513.
6. Tóth M. A neuroendokrin daganatok kezelésének lehetőségei. A 2013-as kézirat átdolgozott változata (különkiadás). LAM; 2015.
7. Tóth M. A gasztroenteropankreatikus neuroendokrin daganatok kezelése. Magy Onkol 2018; 62(2): 99–106.
8. Partelli S, Andreasi V, Rancoita PMV, et al. Outcomes after distal pancreatectomy for neuroendocrine neoplasms: a retrospective comparison between minimally invasive and open approach using propensity score weighting. Surg Endosc 2021; 35(1): 165–173.
https://doi.org/10.1007/s00464-020-07375-0
9. Caplin ME, Pavel M, Ćwikła JB, et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014; 371(3): 224–233. https://doi.org/10.1056/NEJMoa1316158
10. Raymond E, Dahan L, Raoul JL, et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med 2011; 364(6): 501–513. https://doi.org/0.1056/NEJMoa1003825
11. Yao JC, Shah MH, Ito T, et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011; 364(6): 514–523.
https://doi.org/10.1056/NEJMoa1009290
12. Yao JC, Fazio N, Singh S, et al. Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4). Lancet 2016; 387(10022): 968–977.
https://doi.org/10.1016/S0140-6736(15)00817-X
13. Brabander T, van der Zwan WA, Teunissen JJM, et al. Long-Term Efficacy, Survival, and Safety of [177Lu-DOTA0,Tyr3]octreotate in Patients with Gastroenteropancreatic and Bronchial Neuroendocrine Tumors. Clin Cancer Res 2017; 23(16): 4617–4624.
https://doi.org/10.1158/1078-0432.CCR-16-2743
14. de Mestier L, Walter T, Evrard C, et al. Temozolomide Alone or Combined with Capecitabine for the Treatment of Advanced Pancreatic Neuroendocrine Tumor. Neuroendocrinology 2020; 110(1–2): 83–91.
https://doi.org/10.1159/000500862
15. Kos-Kudła B, Castaño JP, Denecke T, et al. European Neuroendocrine Tumour Society (ENETS) 2023 guidance paper for nonfunctioning pancreatic neuroendocrine tumours. J Neuroendocrinol 2023; 35(12): e13343. https://doi.org/10.1111/jne.13343
16. Chan JA, Geyer S, Zemla T, et al. Phase 3 Trial of Cabozantinib to Treat Advanced Neuroendocrine Tumors. N Engl J Med 2025; 392(7): 653–665. https://doi.org/10.1056/NEJMoa2403991
17. de Carbonnières A, Challine A, Cottereau AS, et al. Surgical management of insulinoma over three decades. HPB (Oxford) 2021; 23(12): 1799–1806. https://doi.org/10.1016/j.hpb.2021.04.013
18. Hofland J, Falconi M, Christ E, et al. European Neuroendocrine Tumor Society 2023 guidance paper for functioning pancreatic neuroendocrine tumour syndromes. J Neuroendocrinol 2023; 35(8): e13318.
https://doi.org/10.1111/jne.13318
19. Panzuto F, Ramage J, Pritchard DM, et al. ENETS 2023 guidance paper for gastroduodenal neuroendocrine tumours (NETs) G1-G3. J Neuroendocrinol 2023; 35(8): e13306. https://doi.org/10.1111/jne.13306
20. Kaçmaz E, Chen JW, Tanis PJ, Nieveen van Dijkum EJM, Engelsman AF. Postoperative morbidity and mortality after surgical resection of small bowel neuroendocrine neoplasms: a systematic review and meta-analysis. J Neuroendocrinol 2021; 33(8): e13008. https://doi.org/10.1111/jne.13008
21. Rinke A, Müller HH, Schade-Brittinger C, et al. PROMID study: octreotide LAR for metastatic neuroendocrine midgut tumors. J Clin Oncol 2009; 27(28): 4656–4663. https://doi.org/10.1200/JCO.2009.22.8510
22. Strosberg JR, Caplin ME, Kunz PL, et al. NETTER-1 trial: 177Lu-Dotatate in midgut NETs. Lancet Oncol 2021; 22(12): 1752–1763.
https://doi.org/10.1016/S1470-2045(21)00572-6
23. Strosberg J, Leeuwenkamp O, Siddiqui MK. PRRT re-treatment in progressive NETs: a meta-analysis. Cancer Treat Rev 2021; 93: 102141.
https://doi.org/10.1016/j.ctrv.2020.102141
24. Pavel M, Ćwikła JB, Lombard-Bohas C, et al. CLARINET FORTE: high-dose lanreotide in progressive NETs. Eur J Cancer 2021; 157: 403–414. https://doi.org/10.1016/j.ejca.2021.06.056
25. Yang TX, Chua TC, Morris DL. Radioembolization and chemoembolization for unresectable NET liver metastases. Surg Oncol 2012; 21(4): 299–308. https://doi.org/10.1016/j.suronc.2012.07.001
26. Kanabar R, Barriuso J, McNamara MG, et al. Liver Embolisation for NETs: Systematic Review. Neuroendocrinology 2021; 111(4): 354–369. https://doi.org/10.1159/000507194
27. de Mestier L, Zappa M, Hentic O, et al. Liver transarterial embolizations in metastatic NETs. Rev Endocr Metab Disord 2017; 18(4): 459–471.
https://doi.org/10.1007/s11154-017-9431-2
28. Wonn SM, Limbach KE, Pommier SJ, et al. Cytoreductive surgery in peritoneal carcinomatosis from small bowel NETs. Surgery 2021; 169(1): 168–174. https://doi.org/10.1016/j.surg.2020.03.030
29. Kulke MH, Hörsch D, Caplin ME, et al. Telotristat Ethyl for Carcinoid Syndrome. J Clin Oncol 2017; 35(1): 14–23.
https://doi.org/10.1200/JCO.2016.69.2780
30. Pavel M, Gross DJ, Benavent M, et al. TELECAST trial: Telotristat ethyl in carcinoid syndrome. Endocr Relat Cancer 2018; 25(3): 309–322.
https://doi.org/10.1530/ERC-17-0455
31. Lamarca A, Bartsch DK, Caplin M, et al. ENETS 2024 guidance: small intestine NETs. J Neuroendocrinol 2024; 36(9): e13423.
https://doi.org/10.1111/jne.13423
32. Kaltsas G, Walter T, Knigge U, et al. ENETS 2023 guidance: appendiceal NETs. J Neuroendocrinol 2023; 35(10): e13332.
https://doi.org/10.1111/jne.13332
33. Nesti C, Bräutigam K, Benavent M, et al. Hemicolectomy vs. appendectomy in 1–2 cm aNETs. Lancet Oncol 2023; 24(2): 187–194.
https://doi.org/10.1016/S1470-2045(22)00750-1
34. Zhang HP, Wu W, Yang S, Lin J. Endoscopic treatments for rectal NETs <16 mm: meta-analysis. Scand J Gastroenterol 2016; 51(11): 1345–1353. https://doi.org/10.1080/00365521.2016.1200140
35. Pan J, Zhang X, Shi Y, Pei Q. EMR vs. ESD in small rectal NETs: meta-analysis. Scand J Gastroenterol 2018; 53(9): 1139–1145.
https://doi.org/10.1080/00365521.2018.1498120
36. Meier B, Albrecht H, Wiedbrauck T, et al. Full-thickness resection of rectal NETs. Endoscopy 2020; 52(1): 68–72. https://doi.org/10.1055/a-1008-9077
37. Rinke A, Ambrosini V, Dromain C, et al. ENETS 2023 guidance paper for colorectal NETs. J Neuroendocrinol 2023; 35(6): e13309.
https://doi.org/10.1111/jne.13309
38. Pommergaard HC, Nielsen K, Sorbye H, et al. Surgery of primary tumour in high-grade GEP-NEN and MiNEN. J Neuroendocrinol 2021; 33(5): e12967. https://doi.org/10.1111/jne.12967
39. Honma Y, Nagashima K, Hirano H, et al. Esophageal NEC treated with chemoradiotherapy. Cancer Med 2020; 9(2): 595–604.
https://doi.org/10.1002/cam4.2708
40. Voong KR, Rashid A, Crane CH, et al. Chemoradiation for high-grade NEC of rectum and anal canal. Am J Clin Oncol 2017; 40(6): 555–560. https://doi.org/10.1097/COC.0000000000000211
41. Sorbye H, Welin S, Langer SW, et al. NORDIC NEC study: prognostic factors in G3 GEP-NEC. Ann Oncol 2013; 24(1): 152–160.
https://doi.org/10.1093/annonc/mds276
42. Morizane C, Machida N, Honma Y, et al. TOPIC-NEC: Etoposide+Cisplatin vs. Irinotecan+Cisplatin. JAMA Oncol 2022; 8(10): 1447–1455.
https://doi.org/10.1001/jamaoncol.2022.3395
43. Sorbye H, Grande E, Pavel M, et al. ENETS 2023 guidance for digestive neuroendocrine carcinoma. J Neuroendocrinol 2023; 35(3): e13249.
https://doi.org/10.1111/jne.13249
