Összefoglaló közlemények / Reviews
Forty years old is the oesophageal hydrostatic balloon catheter; Technique and application of dilation in organic, benign oesophageal stenosis
Summary
Forty years old is the oesophageal hydrostatic balloon catheter; Technique and application of dilation in organic, benign oesophageal stenosis The authors detail the introduction of balloon catheter dilation 40 years ago, the direction and steps of technical development, after historical review of the instruments of esophageal stenosis dilatation. They show different ways and control of balloon catheter dilation. Compared to bougie, they explain the benefits of balloon catheter dilation. It also discusses some important experiences and proposals depending on etiology.
A szerzők a nyelőcsőszűkület-tágítás eszközeinek történeti áttekintése után részletezik a ballonkatéteres tágítás 40 éve történt bevezetését, a technikai fejlődés irányát és lépéseit. Bemutatják a ballonkatéteres tágítás kivitelének és ellenőrzésének különböző módjait. Bougieval összevetve ismertetik a ballonkatéteres tágítás előnyeit. A fontosabb tapasztalatokat, javaslatokat kóroki bontásban tárgyalják.
A nyelőcső terápiás endoszkópia, sebészet fejlődése sok szempontból változást hozott a benignus-, malignus nyelőcső és cardiaszűkületek kezelésében. A látszólagos rivalizálás ellenére a sebészet, az endoszkópia és más társszakmák szoros együttműködése biztosíthatja csak a betegek optimális ellátását.
Bevezetés
A nyelőcsőszűkületeket funkcionális és organikus sztenózisokra, az utóbbit benignus és malignus szűkületekre oszthatjuk, amelyek kóroki szempontból tovább csoportosíthatóak. A felosztás azért is fontos, mert a szűkület természete nemcsak a sebészeti, hanem a tágító kezelés módját is meghatározza. Ezen belül is a szűkület etiológiájának ismerete tovább módosíthatja a tágítás kivitelét és egyben prognosztikai jelentőséggel is bír.
A nyelőcsőszűkületek:
- Funkcionális szűkület: cricopharyngealis diszfunkcióval és achalasiaval eltérő kezelési módja miatt és terjedelmi okokból most nem foglalkozunk.
- Organikus szűkület
- Benignus sztenózis;
- Peptikus sztenózis;
- Korrozív sztenózis;
- Posztoperatív anasztomózis sztenózis;
- Eosinophil oesophagitis okozta sztenózis;
- Posztirradiációs, posztszkleroterápiás, posztligációs sztenózis;
- Endoszkópos posztreszekciós: EMR/ESD;
- Posztablációs: RFA/PDT sztenózis;
- Bőrbetegségek: scleroderma, epidermolysis bullosa dystrophica, pemphigus és pemphigoid, lichen planus okozta szűkület.
- Malignus sztenózis:
- nyelőcső-, cardia-, extraluminális eredetű tumor;
- oesophago-respiratorikus fisztulák;
- Benignus sztenózis;
A nyelőcső-, cardia obstrukciós szindróma két formáját különböztetjük meg: striktúraszindróma és achalasiaszindróma. A szűkületen átáramló folyadék mennyiségét és azt befolyásoló tényezők súlyát a Hagen–Poiseuille-egyenletből láthatjuk:

A szűkületen átáramló folyadék mennyisége a folyadéknyomással, a szűkület sugarának 4. hatványával egyenesen, míg a szűkület hosszával és a viszkozitással fordítottan arányos. A szűkületen átáramló folyadék mennyisége legjobban a szűkület átmérőjétől függ. Tágításkor azonban nemcsak a szűkület sugarát növeljük, hanem a szűkület hossza is csökken. A beteg az étel jó megrágásával nemcsak a viszkozitást csökkenti, hanem folyadékivással a nyelőcsőben a nyomást is növeli.
A fentiekből nyilvánvaló, hogy a nyelőcső-, cardiaszűkület nem sebészi, leghatékonyabb kezelése a tágítás, amelynek történeti áttekintéséből is nyilvánvaló, hogy a fejlesztés célja a tágítás hatékonyságának és biztonságának növelése, miközben csökkentjük a beavatkozás invazivitását, a beteg megterhelését.
Az előzményekből megismerhetjük azokat a fontos mérföldköveket, amelyek megváltoztatták szemléletünket és azt is láthatjuk, hogy a saját tevékenységünk hogyan illeszkedik az elmúlt 40 év fejlődésébe.
Történeti és technikai áttekintés
Az 1980-as évekig a nyelőcsőtágítás hazánkban fül-orr-gégész és sebészeti privilégium volt. A tágításhoz tompa, Hurst (1915) és hegyes, Maloney-bougie-kat „vakon” vezették a nyelőcsőbe. Ez a perforáció fokozott veszélyével járt. Az Eder-Puestow flexibilis, olivás, fém dilatátor (1), majd a lépcsős kiképzésű Celestin-bougie (2) már vezetődrót számára centrális csatornával készült. Fiberoszkóp bougie-vá való alakítása (3), vagy átlátszó kúpos előtét használata endoszkópos kontrollt is biztosít. A Savary–Miller-bougie (4) sorozat (átmérő 4 mm-től 20 mm) hosszú kúpos, hajlékony, vezetődróthoz centrális csatornája van. Széles körben elterjedtté vált, de ennél is – mint minden bougie-nál – tágításkor a szűkületben tágító és nyíró erő egyaránt hat. Az 1979-ben bevezetett ballonkatéteres tágításnál csak tágító erő lép fel.
A fentiekhez hasonló folyamat játszódott le korábban a vaszkuláris intervenciós radiológiában, ahol kezdetben Dotter koaxiális katéterrel és vezetődróttal végezte az értágítást (5). Grüntzig 1974-ben elsőként készített egy-, (6) majd kettős lumenű értágító ballonkatétert (7). Utóbbival 1976-ban alsó végtag artéria – 1978-ben koronária (8) –, majd arteria renalis szűkületet tágított (9). Az első tágítással Dotterhez hasonlóan egy gangrénás beteg lábát mentette meg az amputációtól. A terápiás endoszkópia számos ötletet, módszert az intervenciós radiológiából vett át. A határterületek művelése kölcsönösen gazdagítják egymást.
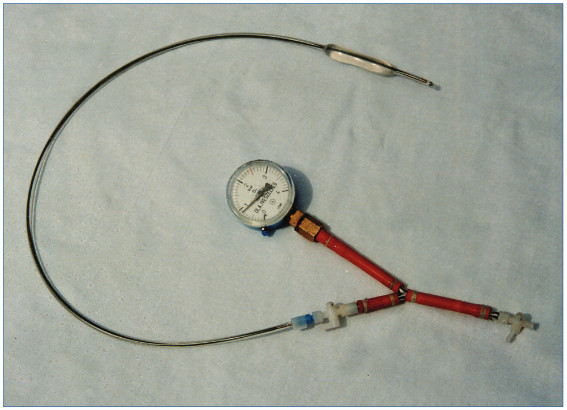
Először 1979 májusában kettős lumenű, Grüntzig-értágító ballonkatéterrel, majd – javaslatomra Cook Europe ApS (Arne Mølgaard Nielsen) által készített – egylumenű (1. ábra, PVD I., 1979. okt.), majd kettős lumenű, nagy átmérőjű, nyelőcsőtágító ballonkatéterrel (PVD 14, 1982) végeztem nyelőcsőtágítást. Az új eszközről, módszerről 1980-ban gasztroenterológiai, radiológiai kongresszuson számoltunk be és 1981. januárban, az Orvosi Hetilapban (10), az Extracta Gastroenterologica-ban közöltük (11). London és munkatársai 1981-ben két komplex nyelőcsősztenózis Grüntzig-ballonkatéterrel végzett tágításáról számoltak be (12). A kettős lumenű nyelőcsőtágító ballonkatéter vezetődrótos irányítása megkönnyítette nemcsak a nyelőcső-, hanem a gyomorkimeneti anastomosis-, és pylorus sztenózisok, majd a vastagbélszűkületek ballonkatéteres tágítását is (13, 14, 15). Ehhez még nagyobb átmérőjű, kettős lumenű ballonkatétereket (PVD II.) fejlesztettünk ki. A ballonok polivinilkloridból (PVC) készültek, amelyek nyomástűrő képessége korlátozott volt.
Évek múlva Boston Scientific, Microvasive technológiai fejlesztés után gasztroenterológiai célra kettős lumenű – 2 mm-enként növekvő átmérőjű – ballonkatéter-sorozatot (6-20 mm átmérő) készített. A további fejlesztések a ballonok nyomástűrő-képességének fokozására, másrészt a ballonkatéter alapátmérő csökkentésére irányultak. Az utóbbi törekvés célja az volt, hogy a ballonkatétert az endoszkóp csatornáján át lehessen vezetni. A through the scope (TTS), egylumenű ballonkatéterek 1986-ban kerültek használatba (16). A következő fejlesztés arra irányult, hogy ezek a TTS ballonkatéterek is kettős lumennel készüljenek, és vezetődrót alkalmazásával javítsák a tágítás biztonságát. A ballonok fix átmérőjűek (low-compliance) voltak, a nyomás növelésével a ballon átmérője csak a megadott átmérőig nőtt, határérték feletti nyomásnál megrepedtek vagy kilyukadtak. Ezek a ballonkatéterek – bizonyos átmérő felett – nehézkesen vezethetőek át és – tágítás után – nehezen húzhatók vissza az endoszkópcsatornán. Újabb fejlesztések arra irányultak, hogy a ballon átmérője a nyomás – megadott nyomáshatárok között (3-5-7 atm) – emelésével fokozatosan (3 mm-rel) tovább nőjön. Ezeket kontrolláltan táguló (CRE, controlled radial expansion, progresszív) ballonkatéreknek hívják, amelyek bevezetése megkönnyítette a ballonok TTS alkalmazását. A használatuknak azonban hátrányai is vannak. A fejlesztési irányokat a szaporodó konkurens cégek (Wilson Cook, Bard, Endo-Flex, Micro-tech…) is követték és a bővülő kínálat mellett az optimális eszközválasztáshoz a fentiek és a ballonok jellemzőinek az ismerete szükséges.
1. ábra: Első nyelőcsőtágító ballonkatéter (egylumenű), saját készítésű manométerrel
A tágítások előfeltételei
Tágítás előtt tisztázni kell a szűkület okát. Ebben a biopszia – malignitás kizárása, eosinophil oesophagitis igazolása és minden kétes esetben – alapvető fontosságú. Malignitás gyanújakor negatív szövettan esetén is rebiopszia, képalkotó vizsgálat (CT, endoszonográfia) javasolt. A korrozív sérülés-, radioterápia után, komplex sztenózis lokalizációjának, hosszának, mértékének tisztázására-, fisztula gyanújakor nyelési vizsgálat javasolt (17). A bougie és ballonkatéteres tágítás ott végezhető, ahol ennek személyi, tárgyi feltételei biztosítottak. Terápiás endoszkópiában jártas szakorvos és endoszkópos asszisztens mellett szoros radiológiai együttműködés és nyelőcsősebészeti háttér szükséges. A tágítás nem csak technikai kérdés. Gyakorlott és ez irányban elkötelezett orvosnak nemcsak a tágítás indikációjával, kontraindikációjával (nem gyógyult perforáció, varratelégtelenség, 3 héten belüli korrozív sérülés, korai posztoperatív szak, vérzékenység…), komplikációk, perforáció felismerésével és annak luminalis ellátásával, hanem a különböző tágítási technikákkal és az alternatív és kiegészítő kezelésekkel is tisztában kell lennie (17). Jól felszerelt endoszkópos laborban nemcsak Savary-bougie sorozat, hanem a szükséges méretekben rendelkezésre álló ballonkatéterek, vezetődrótok, manométerek, diagnosztikus és terápiás endoszkópok és egyidejű röntgenkontroll lehetősége valamint a szövődmények ellátásához szükséges eszközök (teljesen bevont fémstent, clip, ovesco clip…) alapkövetelmény. A szűkület okának, jellegzetességeinek ismeretében a beteg státuszától függően a terápiás alternatívákról, a kezelés módjáról, várható eredményről és a kockázatokról informált beteg előzetes írásbeli beleegyezése szükséges. Közöljük a beteggel azt is, hogy ismételt tágításra is szükség lehet és perforáció esetén endoszkópos vagy műtéti beavatkozás szükséges. A kezelés előtt odakészítjük a várhatóan szükséges eszközöket.
A tágítások kivitele röntgenkontroll, röntgen- és endoszkópos ellenőrzés alatt
A tágítást 6-10 órás koplalás után végezzük. Nyelőcső, gyomor tisztaságát leszívással, öblítéssel is elősegítjük. A premedikáció intézet-, orvos- és betegfüggően változhat. Mi rendszerint pethidin (Dolargan) premedikációt, mások Dormicum, Fentanyl kombinációt, esetleg Propofol szedációt vagy intratrachealis narkózist alkalmaznak. A beteget kezelés közben monitorozzuk és panaszait, fájdalmát is figyeljük. A terápiás terv szerint választunk endoszkópot és tágító eszközt.
A kezelés előtt endoszkópiát sz.e. korábban már nyelési vizsgálatot végeztünk (2–3. ábra). Röntgenátvilágítás során a sztenózis felső szélére vagy más fontos helyre sugárelnyelő bőrjelzést tehetünk. Atraumatikus vezetődrótot juttatunk a sztenózis alá, lehetőleg a gyomorba (3–4. ábra), majd azt visszahagyva többnyire csak röntgenellenőrzés alatt, kettős lumenű ballonkatétert vezetünk a sztenózis alá. Felére higított vízoldékony kontrasztanyaggal részlegesen töltve a ballont visszahúzzuk a szűkületbe úgy, hogy a sztenózis a ballon közepére essen (retrográd tágítás). Ekkor végezzük a ballonkatéteres tágítást (5–6. ábra). A fecskendővel kifejtett nyomást manométerrel mérjük. A ballonkatéter hosszának és átmérőjének kiválasztása igen fontos. A ballon 2 cm-rel legyen hosszabb, mint a szűkület várható hossza.
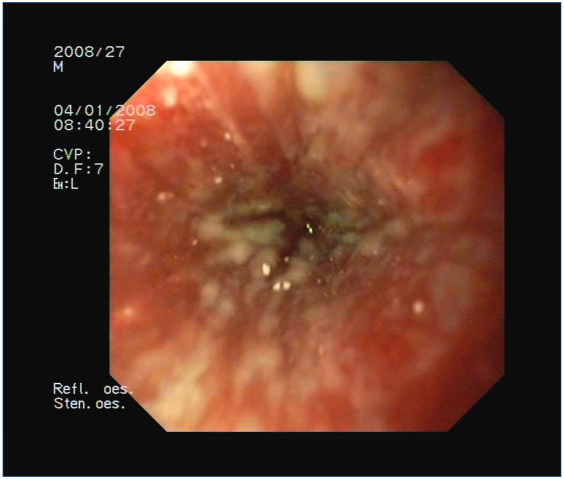
2. ábra: 43 éves férfi, reflux oesophagitis okozta teljes nyelőcső-elzáródás endoszkópos képe
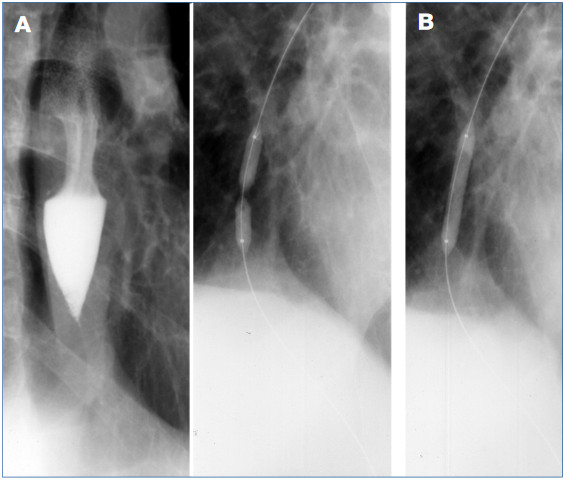
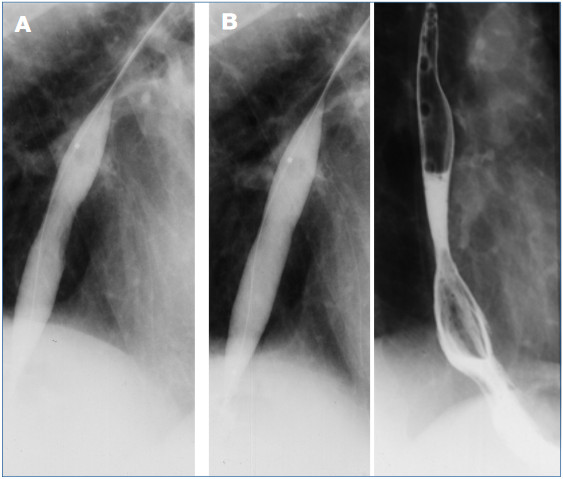
3. ábra: A: Nyelési vizsgálat: reflux oesophagitis okozta teljes nyelőcsőobstrukció.
B: Tágítás 8 mm átmérőjű ballonkatéterrel
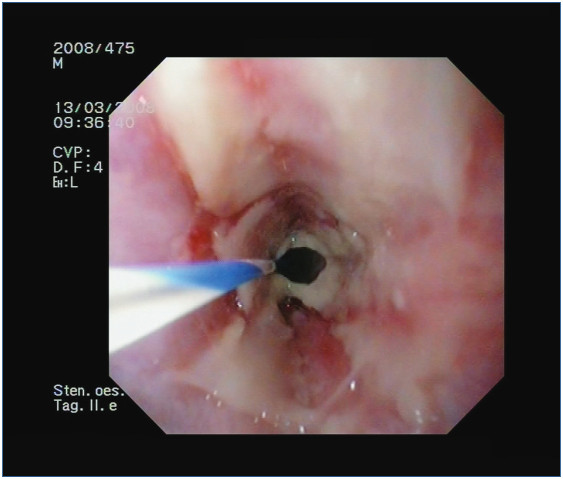
4. ábra: Második tágítás előtt még súlyos reflux oesophagitis, vastag fibrines lepedék, vezetődrót és szűk lumen látszik
5. ábra: A: második ballonkatéteres tágítás.
B: utána javuló nyelőcsőürülés
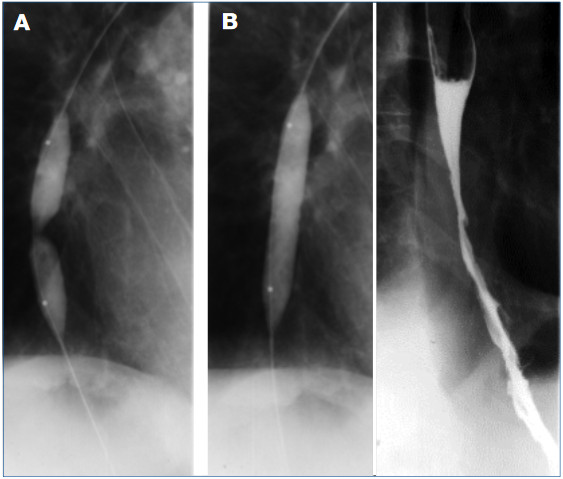
6. ábra: A: Egy évvel később, az utolsó tágítás előtt már csak enyhe befűződés látszik a ballonon. B: Nyelési vizsgálat során normális nyelőcsőürülés, hiatus hernia
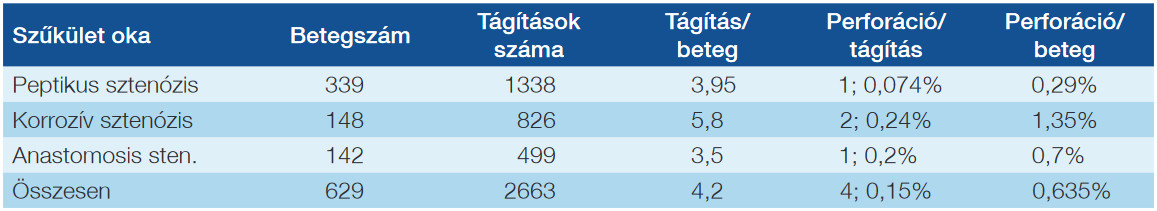
1. táblázat: Organikus benignus nyelőcsőszűkületes betegeink ballonkatéteres tágításának perforációs szövődményei etiológiai bontásban (1979. május – 2008. július)
Választhatunk fix átmérőjű, nem táguló ballont, amelynek átmérője 2-3 mm-rel legyen nagyobb, mint a sztenózis átmérője. A nyomás fokozatos emelésével a ballonon kirajzolódik a szűkület, majd a benyomat, befűződés a nyomás további emelésével fokozatosan csökken, majd megszűnik (5–6. ábra). Az ehhez szükséges nyomás tájékoztat a sztenózis tágulékonyságáról, hegesedés mértékéről. Az alkalmazott nyomás többnyire 1,5-3 atm. Hegesebb sztenózis esetén a szükséges nyomás 3-5 atm és magasabb is lehet. Ha a befűződés nem csökken 3 atm-nál és továbbra is jelentős, akkor a biztonság kedvéért inkább kisebb ballonátmérőt és nagyobb nyomást alkalmazzunk. Amennyiben CRE-ballont alkalmazunk, ahol a jelzett tágítási intervallum pl. 12-15 mm átmérő, akkor olyan ballonátmérőt válasszunk, ahol az alsó érték megfelel vagy kicsit kisebb a szűkület átmérőjénél. Ilyenkor kis nyomásnál még látszik a szűkület okozta befűződés, amely 3 atm-nál többnyire megszűnik. Ilyenkor a nyomás fokozásakor az átmérő további növekedését röntgenkontroll alatt alig látjuk, csak a nyomásból tudjuk megítélni a valószínű ballonátmérőt. Amennyiben a szűkület igen heges, nehezen tágul, akkor viszont azt észleljük, hogy a ballonátmérő a nyomással nő, ezáltal a sztenózis okozta befűződés a ballonon kifejezettebbé válik, amely szövődmény veszélyét fokozza. Ilyenkor kisebb átmérőjű kontrolláltan táguló ballonkatétert választunk, ahol a limitáltabb ballonátmérő mellett nagyobb nyomással tágíthatjuk a sztenózist. Röntgenátvilágítás során is a sugárterhelés minimalizálására törekszünk (sugáridő, blende).
Ennek az egyik további módja, hogy endoszkópos kontrollt és TTS-ballonkatétert alkalmazunk, amely történhet egy, vagy kétlumenű-, fix átmérőjű, vagy CRE-ballonkatéterrel. A tágítást proximálisan kezdjük és többes szűkület esetén lépésenként distal felé haladunk (anterográd tágítás). A ballon leszívása után látjuk a tágítás hatását, szűkületátmérő növekedését, mucosasérülést, berepedést. Amennyiben ez jelentős a tágítást később folytatjuk. Ha a tágulás mértéke elégtelen, akkor célszerű a tágítás során rövid ideig röntgenátvilágítást is végezni, hogy a ballon és a szűkület tágulását lássuk. Ez befolyásolhatja az alkalmazott nyomást, vagy balloncserét tehet szükségessé. Amennyiben nincs röntgenkontrollra lehetőségünk az endoszkópcsatornán át – a fentiek szerint – kettős lumenű TTS-ballonkatétert alkalmazhatunk vezetődróttal. Egylumenű ballonkatétert csak egyszerű, nem komplex szűkületeknél (nem súlyos ≥9 mm, nem kanyargós, rövid, nem többszörös) alkalmazzunk.
Komplex sztenózis esetén (átmérő ≤9 mm, kanyargós, hosszú, többszörös) és nagy kockázatú sztenózisban (korrozív-, posztirradiációs) mindig vezetődrótot és kettős lumenű ballonkatétert alkalmazunk lehetőleg röntgenkontroll mellett.
Tágítás a ballon mellett visszavezetett endoszkóp kontroll alatt
Endoszkópos kontroll mellett alkalmazhatunk vastagabb, kettős lumenű, nem TTS-ballonkatétert is. Ilyenkor endoszkópos kontroll mellett a vezetődrótot a szűkület alá, lehetőleg a gyomorba juttatjuk. Ezután a kettős lumenű ballonkatétert a nyelőcsőbe, a szűkület fölé vezetjük. Az endoszkópot a ballonkatéter mellett a nyelőcsőbe visszavezetjük. Ettől kezdve a TTS-technikához hasonlóan – de az endoszkóp mellett – végezhetjük a szűkülettágítást. Az asszisztencia szempontjából fontos, hogy vagy a ballonkatétert, vagy csak az endoszkópot mozgatjuk. Felfújt ballont ne mozgassunk, mert sérülést okozhatunk. A ballon igyekszik le vagy felfelé kicsúszni a sztenózisból, ezért a sztenózis a ballon közepén legyen. A distalis elmozdulást a katéter szájnál való megfogásával gátolhatjuk. A szűkület tágulását, esetleges mucosarepedést, szövődményt a ballon leszívásakor látjuk. Ilyenkor a ballont ki is húzhatjuk a sztenózisból vagy az alá tolhatjuk, miközben a vezetődrót a helyén marad. A tágítás végén a leszívott ballont az endoszkóp mellett kihúzhatjuk, akár úgy is, hogy a vezetődrót a helyén marad. A tágítás végén mindig célszerű még egyszer megtekinteni a tágított területet az esetleges szövődmények kizárása céljából. Ez fontos a tágítás utáni teendők, obszerváció szempontjából is. Perforáció gyanúja esetén azonnal gasztrografinos nyelési vizsgálatot végzünk. A kezelés eredményességéről az endoszkópos kép, a dysphagia alakulása, testsúlyváltozás tájékoztatnak, amelyet sz.e. időszakosan BaSO4-gyel végzett nyelési vizsgálattal kontrollálunk (5–6. ábra).
Mint látjuk a tágítás történhet csak röntgen-, röntgen és endoszkópos és csak endoszkópos kontroll mellett. A választást többnyire a technikai lehetőségek és a sztenózis sajátságai szabják meg. Fontos a kezelés hatékonysága, biztonsága, beteg-, idő- és költségkímélő módja.
Tágítás Savary-bougie-val
A bougie-k közül ezt használják leggyakrabban, mert alkalmazása vezetődróttal egyszerű – sorozattal – fokozatos tágítás biztosított és az újrahasználhatóság következtében költséghatékony. Hármas szabály szerint egy ülésben – szövődmény veszélye miatt – ne használjuk három, egymást követő, 1 mm-rel növekvő átmérőjű bougie-nál többet. Tágításnál általában – mint említettem – egy ülésben 3 mm-nél nagyobb átmérőnövekedést kerüljük. Inkább több ülésben tágítsunk, csökkentve a szövődmények veszélyét. Fontos tudni, hogy az egy ülésben végezhető tágítás mértékét még nagyban befolyásolja a szűkület oka, súlyossága, tágulékonyság és egyéb jellemzők. Ismételt tágításnál vegyük figyelembe az utolsó tágításnál elért átmérőt, alkalmazott nyomást és egyéb tapasztaltakat.
Savary-bougie használata ballonnál olcsóbb, alkalmazása egyszerűbb. Bougie-val végzett tágítás után a szűkületen endoszkóppal való átjutás valószínűsége, vagy hagyományos nyelőcsőprotézisek implantáció sikeressége nagyobb, mint ugyanilyen átmérőjű ballonkatéterrel végzett tágítás után. Vezetődrót nélküli bougie-val „vakon – biztonsági okokból – tágítást ne végezzünk.
Minden tágító kezelést nálunk 3 órás szoros obszerváció követi. Láz és panaszmentesség esetén a per os táplálást vízitatással kezdjük és tünetmentesség esetén folyékony-pépessel folytatjuk. Tágítás után rutinszerűen nyelési vizsgálatot nem végzünk. A tágítás ismétlése – egyedi mérlegelés után – 3 naptól két hét között jön szóba, míg az átmérő eléri a 15 mm-t, vagy legalább a diagnosztikus endoszkóp átjut rajta. Megfigyelés szempontjából az első 24 óra még fontos. Kapcsolattartást biztosítani kell.
Perforáció gyanúja esetén (tartós, fokozódó mellkasi fájdalom, dyspnoe, láz, tachycardia, subcutan emphysema) a szövődmény kizárására gasztrografinos nyelésvizsgálatot, szükség esetén CT-t végzünk. Tünetek esetén reendoszkópia, endoszkópos kezelés, stentimplantáció is szóba jön. A szövődmények vizsgálati eredményektől függő komplex (endoszkópos, nyelőcsősebész, intenzív terapeuta) ellátása késedelmet nem szenvedhet.
Benignus nyelőcsőszűkületek bougie és ballonkatéteres tágítása között tüneti javulás, kiújulási ráta, vérzés és perforáció vonatkozásában különbség nincs, a ballonos tágítást azonban kisebb fájdalom követi (18). A témában kevés a randomizált vizsgálat, a betegszám kicsi.
A fenti állítás valószínűleg igaz, de a közlemények a szövődményeket a szűkületek etiológiai bontásában többnyire nem tárgyalják. Az alábbi nagy beteganyagunk is bizonyítja, hogy etiológiai bontásban a tágításokra és betegszámra vonatkozó perforációs ráta jelentős eltérést mutat (1. táblázat).
Szövődmények összehasonlításában szignifikáns különbség – igen alacsony szövődményráta mellett – csak nagy beteganyag esetén igazolható. A szerzők vagy bougie-, vagy ballonkatéteres tágítást végeznek nagyobb, vagy mindkettőt külön-külön kisebb beteganyagon. Ezen kívül a szövődményráta nemcsak eszköz és etiológia-, hanem módszer és személyfüggő is (19). Ezért a kérdés eldöntésében a metaanalízisek is alig segítenek (18).
Bár a szövődmények tekintetében a guideline-ok bougie és ballonkatéter között különbséget nem tesznek (17, 19, 20), a ballonos tágításnál tapasztalt alacsony szövődményrátáink és az alábbi előnyei miatt egyértelműen a ballonkatétert preferáljuk.
A ballonkatéteres tágítást támogató érvek
- Tágításakor csak radiális tágító erő hat, bougie-nál nyíróerő is érvényesül.
- A levezetése és tágítás a beteg számára kíméletesebb, különösen nagyobb átmérőjű esetén. A tágítás utáni fájdalmak is kevésbé súlyosak (18).
- Többszörös szűkületek egymástól független átmérővel tágíthatók.
- Olyan lokalizációban is használható, ahol a bougie nem (pl. távol a természetes nyílásoktól).
- A ballon részletes információt ad a szűkület hosszáról, alakjáról és a nyomás ismeretében a tágulékonyságáról (nyelőcső-topográfia). Néha reálisabb, mint a nyelési vizsgálat.
- Tapasztalatom alapján – gyakorlott kézben – kevesebb szövődménnyel jár.
Szövődmények közül legsúlyosabb a perforáció, amely endoszkópos, nyelőcsősebész és intenzív terapeuta együttműködését igényli. Legfontosabb a korai diagnózis és a korai ellátás. Perforáció endoszkópos vagy sebészi kezelése egyedi mérlegelést igényel. Endoszkópos terápiás lehetőség a defektus zárása (clip, ovesco) (21), vagy bevont stent (22), esetleg endosponge-behelyezés vákuumkezeléssel (20). Késedelem a morbiditást és a mortalitást is nagyban növeli (23).
Megbeszélés
A tágítás eredményessége és a resztenózis a szűkület okától, annak sajátosságaitól, resztenózis-hajlamtól, a kezelést végző orvos gyakorlatától és a kiegészítő kezeléstől is függ. A tágítás hatékonyságát elsősorban a szűkület tágulékonysága szabja meg, amely legjobban azzal a nyomástartománnyal jellemezhető, amely a sztenózis tágulásával kezdődik, és a benyomat megszűnéséig tart. Ez az érték vagy intervallum a sztenózis korai szakában vagy rövid szűkület esetén alacsony, míg régi, heges, hosszabb szakaszt érintő sztenózisnál magasabb. A resztenózishajlam a szűkület átmérőjétől, hosszától, a szűkült szakasz szöveteinek gyulladásos folyamatától, annak mélyre terjedésétől és a sztenózis okától függ. A tágítás során a mucosa és mélyebb sérülés, berepedés gyógyulása, hegesedése maga is resztenózist válthat ki. Másrészt a szűkületet kiváltó gyulladás fennállása és annak tartama döntő a resztenózis kialakulásában.
A reflux oesophagitis, peptikus sztenózis korai, erélyes és tartós PPI-kezelése, vagy eosinophil oesophagitis helyi-, tartós, kis dózisú szteroidterápiája csökkenti a gyulladást, a recidívát, ezáltal a tágítás és redilatáció számát (17). Régi-, krónikus, közel transmuralis gyulladás esetén a folyamat lassabban nyugszik meg és a resztenózishajlam lecsengése hosszabb időt vesz igénybe. Ugyanez a helyzet korrozív-, posztirradiációs szűkület esetén, ahol jelenleg ezt a gyulladást, tartós hegesedési folyamatot nem tudjuk érdemben befolyásolni. Ezért csak idővel, fokozatosan csökken a resztenózishajlam.
Schatzki-gyűrű kialakulása reflux oesophagitis következménye, amely maga is véd a magasabb refluxtól. Ezért PPI-vel kezeljük, és csak akkor tágítjuk, ha tünetet, dysphagiát okoz, vagy az endoszkóp nem jut át rajta. Rugalmassága miatt nem mindig reagál kellően a ballonos tágításra. Ilyenkor a septum több irányú, nem mély elektromos bemetszése-, esetleg kombinálása óvatos ballonkatéteres tágítással igen hatékony módszer.
Eosinophil oesophagitisnél az endoszkópos kép fontos, de nem elég megbízható, ezért klinikai gyanú (fiatal, dysphagia, ételelakadás…), bizarr panaszok esetén is a nyelőcső mindhárom harmadából biopszia szükséges. A lokális szteroidkezelés előzze meg és kövesse is a tágítást preventív és a resztenózis késleltetése céljából. PPI adását (40 mg) társuló reflux esetén savcsökkentő és egyéb pl. gyulladáscsökkentő hatása is indokolhatja (24). Akut tüneteket, gyakori dysphagiát okozó, kezelésre nem reagáló szűk stricturában a tágítást várakozás nélkül el kell végezni. A tágítás kockázata kissé fokozott, a perforációs ráta hasonló más stricturákhoz, de egy éven belül újabb tágításra lehet szükség (17).
Korrozív sérülésnél – amennyiben kontraindikácio nincs – CO2-befuvással korai (12-48 óra), óvatos diagnosztikus endoszkópia végzendő a prognózis megítélésére. Korai szűkülettágítást lehetőleg 3 hét után, óvatosan végezzük, amelynek ismétlése két héten belül célszerű. Ismételt tágításokra – növekvő időintervallumok mellett – több mint egy évig szükség lehet.
A guideline (17) >15 mm átmérő elérését tűzi ki célként, tudva, hogy ezt nem mindig kell elérni, mert prioritást a beteg tünetei jelentik. A szűkület okát és egyéb jellemzőit is figyelembe kell venni. A célértékhez – egyszerű szűkületnél – általában 1-3, maximum 5 tágítás elég (25). A következő, esedékes kezelés időpontját a tágítást végző orvos határozza meg (26).
Refrakter sztenózisról akkor beszélünk, ha fibrózis dominál és nyilvánvaló gyulladásos jelek nélküli sztenózis 5, két héten belüli tágítással sem tágítható 14 mm fölé vagy az elért átmérő nem tartható fenn 1 hónapig (27, 28). Terápiás lehetőség refrakter vagy rekurrens sztenózis esetén antireflux terápia és tágítás eredménytelensége mellett a gyulladásos folyamat csökkentésére intralézionális szteroidinjekció jön szóba (19). Incíziós kezelést Schatzki-gyűrű, anastomosis sztenózis esetén végezhetünk. Amennyiben az előző kezelések eredménytelenek bevont fémstent átmeneti (4-8 hét) alkalmazását mérlegelhetjük. Szelektált beteganyagon biodegradable stent csökkentheti a tágítások gyakoriságát. Öntágítás (bougie) szelektált, motivált betegnél rövid, proximális sztenózisnál alkalmazható. Amennyiben nem javul, vagy nem tolerálja a kezelést műtéti megoldás javasolt (29).
Következtetések
A ballonkatéteres tágítás 40 év alatt az eseti alkalmazástól indulva óriási karriert futott be. Évtizedek alatt a centrumokban rutin módszerré vált. A módszer perspektíváját, bővülő alkalmazási lehetőségeket már a kezdetben láttuk, amelyek gasztroenterológiai bevezetésére – anyagi és egyéb korlátaink ellenére – korán sor került (14, 15). Nyitottunk a határterületek és más szakmák felé is (30, 31). Ma már a ballonkatéteres tágítás nemcsak vaszkuláris, gasztroenterológiai-, hanem bronchológiai-, fül-orr-gégészeti-, urológiai, szemészeti és állatorvosi alkalmazására is sor került (32). A technikai fejlődés minden korábbi elképzelésünket meghaladta és az útnak még nincs vége. Költséghatékonyság szempontjából – bár kedvező a változás – további javulást várunk.
2. Celestin LR, Cambell WB. A new and safe system for oesophageal dilatation. Lancet 1981; I: 74–75. PMID 6109122
3. Bue3 G, Kometz B, Hindebrand E, Schelong H. Bougierung von Stenosen im Bereich des Magenganausganges. Akt Chir 1984; 19: 206–210. PMID 6197297
4. Vantrappen G, Hellemans J. Etiology and nonsurgical treatment of organic esophageal stenosis. In: Diseases of the esophagus. Handbuch der inneren Medizin Bd. 3, T.1. ed. Vantrappen G, Hellemans J. Berlin – Heidelberg – New York: Spinger Verlag; 1974. p. 795–354.
5. Dotter CT, Judskins MP. Percutaneous transluminal treatment of arterioscletotic obstruction. Radiology 1965; 84: 631–43. PMID: 14275329, DOI: https://doi.org/10.1148/84.4.631
6. Grüntzig A, Hopff H. Percutaneous recanalization after chronic arterial occlusion with a new dilator-catheter (modification of the Dotter technique). Dtsch Med Wochenschr 1974; 99 (49): 2502–10. 2511.
7. Grüntzig A. Die perkutane Rekanalisation chronischer arterieller Verschlüsse (Dotter-Prinzip) mit einem neuen doppellumigen Dilatationskatheter. Röfo 1976; 124 (1): 80–86.
8. Grüntzig A. Transluminal dilatation of coronary-artery stenosis. Lancet 1978; I: 263. PMID: 74678, DOI: https://doi.org/10.1016/s0140-6736(78)90500-7
9. Grüntzig A, Kuhlmann U, Vetter W, Lutolf U, Meier, B. Sigenthaler W. Treatment of renovascular hypertension with percutaneous transluminal dilatation of a renal–artery stenosis. (coronary artery stenosis.) Lancet 1978; I: 801–802. PMID 85817. DOI: https://doi.org/10.1016/s0140-6736(78)93000-3
10. Solt J, Horváth L, Rauth J. A nyelőcső benignus szűkületeinek ballon katéteres célzott tágítása. Orv Hetil 1981 Jan 18; 122 (3): 157–9. PMID: 7220048
11. Solt J, Rauth J, Horváth L. Gezielte Dilatation benigner Oesophagusstenosen mit einem Ballonkatheter. Extracta Gastroenterol 1981; 10: 313–323.
12. London RL, Trotman BW, Dimaranino AJ, Oleaga JA, Freiman DB, Ring EJ, Rosato EF. Dilation of severe esophageal strictures by an inflatable ballooncatheter. Gastroenterology 1981 jan; 80: 173–5. PMID: 7450405
13. OwmannT, Lunderquist A. Ballooncatheter dilation of esophageal strictures: a preliminary report. Gastrointest Radiol 1982; 7: 301–5. PMID: 7141182
14. Solt J, Rauth J, Papp Z, Bohenszky G. Balloon catheter dilation of postoperative gastric outlet stenosis. Gastrointest Endosc 1984 Dec; 30(6): 359–61. PMID: 6510646
15. Solt J, Papp Zs. Dilatation of recto-sigmoid stenoses with the balloon-catheter. Journal of Interventional Radiology 1988; 2: 85–88.
16. Graham DY, Tabibian N, Schwartz JT, Smith JL. Evaluation of the effectiveness of through-the-scope balloons as dilators of benign and malignant gastrointestinal strictures. Gastrointest Endosc 1987; 33 (6): 432–5. PMID: 3443261, DOI: https://doi.org/10.1016/s0016-5107(87)71681-2
17. Sarmed S Sami, Haboubi HN, Ang Y, Boger P, Bhandari P, de Caestecker J, Griffiths H, Haidry R, Laasch HU, Patel P, Paterson S, Ragunath K, Watson P, Siersema PD, Attwood SE. UK guidelines on oesophageal dilatation in clinical practice. Gut 2018 Jun; 67(6): 1000–1023. Published online 2018 Feb 24. doi: https://doi.org/10.1136/gutjnl-2017-315414 PMCID: PMC5969363
18. Josino IR, Madruga-Neto AC, Ribeiro IB, et al. Endoscopic dilation with bougies versus balloon dilation in esophageal benign strictures: systematic review and meta-analysis. Gastroenterol Res Pract 2018; 2018: 1–9. https://doi.org/10.1155/2018/5874870
19. Egan JV, Baron TH, Adler DG, et al. Esophageal dilation. Gastrointest Endosc 2006; 63: 755–60. DOI: https://doi.org/10.1016/j.gie.2006.02.031
20. Siddiqui UD, Banerjee S, Barth B, Chauhan, SC, Gottlieb KTG, Konda V, Maple JT, Murad FM, Pfau PR, Pleskow DK, Tokar JL, Wang A, Rodriguez SA. Tools for endoscopic stricture dilation. Gastrointest Endosc 2013; 78: 391–404. DOI: https://doi.org/10.1016/j.gie.2013.04.170
21. Lázár G, Paszt A, Mán E. Role of endoscopic clipping in the treatment of oesophageal perforations. World J Gastrointest Endosc 2016; 8(1): 13–22 DOI: https://dx.doi.org/10.4253/wjge.v8.i1.13
22. Solt J, Sarlós G, Tabár B, Bertalan A. [Treatment of large, esophageal perforations and mediastinitis with a covered, removable metallic endoprosthesis and mediastinal drainage]. Orv Hetil 2007 Aug 26; 148(34): 1601–7. Hungarian PMID: 17702689
23. Möschler O, Nies C, Mueller MK. Endoscopic vacuum therapy for esophageal perforations and leakages. Endosc Int Open2015; 3: E554–8. DOI: https://doi.org/10.1055/s-0034-1393160
24. Lipka S, Kumar A, Miladinovic B, et al. Systematic review with network meta-analysis: comparative effectiveness of topical steroids vs. PPIs for the treatment of the spectrum of eosinophilic oesophagitis. Aliment Pharmacol Ther 2016; 43: 663–73. https://doi.org/10.1111/apt.13537
25. Pereira-Lima JC, Ramires RP, Zamin I, et al. Endoscopic dilation of benign esophageal strictures: report on 1043 procedures. Am J Gastroenterol 1999; 94: 1497–501. PMID: 10364013 DOI: https://doi.org/10.1111/j.1572-0241.1999.01061.x
26. Burr NE, Everett SM. Management of benign oesophageal strictures. Frontline Gastroenterol 2019 Apr; 10(2): 177–181. doi: https://doi.org/10.1136/flgastro-2018-101075. Epub 2019 Jan 7
27. Kochman ML, McClave SA, Boyce HW. The refractory and the recurrent esophageal stricture: a definition. Gastrointest Endosc 2005; 62D3: 474–5. https://doi.org/10.1016/j.gie.2005.04.050
28. van Boeckel PG, Siersema PD. Refractory esophageal strictures: what to do when dilation fails. Curr Treat Options Gastroenterol 2015; 13: 47–58. https://doi.org/10.1007/s11938-014-0043-6
29. Siersema PD, de Wijkerslooth LR. Dilation of refractory benign esophageal strictures. Gastrointest Endosc 2009; 70(5): 1000–12. DOI: https://doi.org/10.1016/j.gie.2009.07.004
30. Hübler J, Solt J. Húgycsőtágítás ballonkatéterrel. Orv Hetil 1991; 132: 925–27. PMID: 2027663
31. Móricz P, Solt J, Ráth G, Szanyi I, Pytel J. Hangprotézis alkalmazása total laryngectomia és partialis pharyngectomia után kialakult algarat-nyelőcső átmenet szűkület esetén. Fül-Orr-Gégegyógyászat 2004; 50 (4): 340–344.
32. Prutton JSW, Marks SL and Aleman M. Endoscopic balloon dilation of esophageal strictures in 9 horses. J Vet Intern Med 2015; 29(4): 1105–1111. doi: https://doi.org/10.1111/jvim.13572 PMID: 26118925
